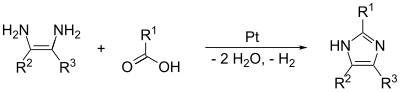Imidazol
| |||
| |||
 | |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido 1 H -Imidazol [1] | |||
| Otros nombres 1,3-Diazol Glioxalina (arcaica) | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| 103853 | |||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Banco de medicamentos |
| ||
| Tarjeta informativa de la ECHA | 100.005.473 | ||
| Número CE |
| ||
| 1417 | |||
| BARRIL | |||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
| Número de la ONU | 3263 | ||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| C3H4N2 | |||
| Masa molar | 68,077 g/mol | ||
| Apariencia | Sólido blanco o amarillo pálido. | ||
| Densidad | 1,23 g/cm3 , sólido | ||
| Punto de fusión | 89 a 91 °C (192 a 196 °F; 362 a 364 K) | ||
| Punto de ebullición | 256 °C (493 °F; 529 K) | ||
| 633 g/L | |||
| Acidez (p K a ) | 6,95 (para el ácido conjugado ) [2] | ||
| UV-vis (λmáx . ) | 206 nm | ||
| Estructura | |||
| Monoclínico | |||
| Anillo plano de 5 miembros | |||
| 3,61 D | |||
| Peligros | |||
| Seguridad y salud en el trabajo (SST/OHS): | |||
Principales peligros | Corrosivo | ||
| Etiquetado SGA : [4] | |||
   | |||
| Peligro | |||
| H302 , H314 y H360D | |||
| P263 , P270 , P280 , P301+P310 , P305+P351+P338 , P308+P313 [3] | |||
| punto de inflamabilidad | 146 °C (295 °F; 419 K) | ||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
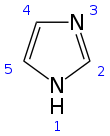
El imidazol (ImH) es un compuesto orgánico con la fórmula C 3 N 2 H 4 . Es un sólido blanco o incoloro que es soluble en agua, produciendo una solución ligeramente alcalina . En química, es un heterociclo aromático , clasificado como un diazol , y tiene átomos de nitrógeno no adyacentes en meta-sustitución .
Muchos productos naturales, especialmente los alcaloides , contienen el anillo imidazol. Estos imidazoles comparten el anillo 1,3-C 3 N 2 pero presentan sustituyentes variados. Este sistema de anillo está presente en importantes bloques de construcción biológicos, como la histidina y la hormona relacionada histamina . Muchos fármacos contienen un anillo imidazol, como ciertos fármacos antimicóticos , la serie de antibióticos nitroimidazólicos y el sedante midazolam . [5] [6] [7] [8] [9]
Cuando se fusiona con un anillo de pirimidina , forma una purina , que es el heterociclo que contiene nitrógeno más común en la naturaleza. [10]
El nombre "imidazol" fue acuñado en 1887 por el químico alemán Arthur Rudolf Hantzsch (1857-1935). [11]
Estructura y propiedades
El imidazol es un anillo plano de 5 miembros que existe en dos formas tautoméricas equivalentes porque el hidrógeno puede estar unido a uno u otro átomo de nitrógeno . El imidazol es un compuesto altamente polar, como lo demuestra su momento dipolar eléctrico de 3,67 D [12] y es altamente soluble en agua. El compuesto se clasifica como aromático debido a la presencia de un anillo plano que contiene 6 electrones π (un par de electrones del átomo de nitrógeno protonado y uno de cada uno de los cuatro átomos restantes del anillo). A continuación se muestran algunas estructuras de resonancia del imidazol:
Anfoterismo
El imidazol es anfótero , es decir, puede funcionar tanto como ácido como base. Como ácido, el p K a del imidazol es 14,5, lo que lo hace menos ácido que los ácidos carboxílicos, fenoles e imidas, pero ligeramente más ácido que los alcoholes. El protón ácido es el que está unido al nitrógeno. La desprotonación da el anión imidazolida, que es simétrico. Como base, el p K a del ácido conjugado (citado como p K BH + para evitar la confusión entre los dos) es aproximadamente 7, lo que hace que el imidazol sea aproximadamente sesenta veces más básico que la piridina . El sitio básico es el nitrógeno con el par solitario (y no unido al hidrógeno). La protonación da el catión imidazolio, que es simétrico.
Preparación
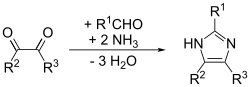
El químico alemán Heinrich Debus informó por primera vez sobre el imidazol en 1858 , aunque varios derivados del imidazol se habían descubierto ya en la década de 1840. Se demostró que el glioxal , el formaldehído y el amoníaco se condensan para formar imidazol (glioxalina, como se lo denominó originalmente). [13] Esta síntesis, si bien produce rendimientos relativamente bajos, todavía se utiliza para generar imidazoles C -sustituidos.
En una modificación de microondas , los reactivos son bencilo , benzaldehído y amoníaco en ácido acético glacial , formando 2,4,5-trifenilimidazol (" lofina "). [14]
El imidazol se puede sintetizar mediante numerosos métodos además del método de Debus . Muchas de estas síntesis también se pueden aplicar a diferentes imidazoles sustituidos y derivados de imidazol variando los grupos funcionales de los reactivos. Estos métodos se clasifican comúnmente según qué enlaces se forman para formar los anillos de imidazol y cuántos. Por ejemplo, el método de Debus forma los enlaces (1,2), (3,4) y (1,5) en el imidazol, utilizando cada reactivo como un fragmento del anillo, y por lo tanto este método sería una síntesis formadora de tres enlaces. A continuación se presenta una pequeña muestra de estos métodos.
Formación de un enlace
El enlace (1,5) o (3,4) se puede formar mediante la reacción de un imidato y un α-amino aldehído o α-amino acetal . El ejemplo siguiente se aplica al imidazol cuando R 1 = R 2 = hidrógeno.

Formación de dos enlaces
Los enlaces (1,2) y (2,3) se pueden formar mediante el tratamiento de un 1,2-diaminoalcano , a altas temperaturas, con un alcohol , un aldehído o un ácido carboxílico . Se requiere un catalizador deshidrogenante, como platino sobre alúmina .
Los enlaces (1,2) y (3,4) también pueden formarse a partir de α-aminocetonas N -sustituidas y formamida con calor. El producto será un imidazol 1,4-disustituido, pero en este caso, dado que R 1 = R 2 = hidrógeno, el imidazol en sí es el producto. El rendimiento de esta reacción es moderado, pero parece ser el método más eficaz para realizar la sustitución 1,4.
Formación de cuatro enlaces
Este es un método general que puede dar buenos rendimientos para imidazoles sustituidos. En esencia, es una adaptación del método de Debus llamado síntesis de imidazol de Debus-Radziszewski . Los materiales de partida son glioxal sustituido, aldehído, amina y amoníaco o una sal de amonio. [15]
Formación a partir de otros heterociclos
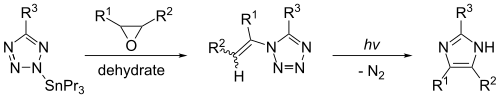
El imidazol se puede sintetizar mediante la fotólisis del 1-viniltetrazol . Esta reacción dará rendimientos sustanciales solo si el 1-viniltetrazol se produce de manera eficiente a partir de un compuesto organoestánnico , como el 2-tributilestanniltetrazol. La reacción, que se muestra a continuación, produce imidazol cuando R 1 = R 2 = R 3 = hidrógeno.
El imidazol también se puede formar en una reacción en fase de vapor. La reacción se produce con formamida , etilendiamina e hidrógeno sobre platino sobre alúmina y debe tener lugar entre 340 y 480 °C. Esto forma un producto de imidazol muy puro.
- Reacción de Van Leusen [16]
La reacción de Van Leusen también se puede emplear para formar imidazoles a partir de TosMIC y una aldimina . La síntesis de imidazol de Van Leusen permite la preparación de imidazoles a partir de aldiminas mediante la reacción con tosilmetil isocianuro (TosMIC). La reacción se ha ampliado posteriormente a una síntesis de dos pasos en la que la aldimina se genera in situ: la reacción de tres componentes de Van Leusen (vL-3CR).
Importancia biológica y aplicaciones
El imidazol se incorpora a muchos compuestos biológicos importantes. El más extendido es el aminoácido histidina , que tiene una cadena lateral de imidazol . La histidina está presente en muchas proteínas y enzimas , por ejemplo, uniéndose a cofactores metálicos, como se observa en la hemoglobina .
Los compuestos de histidina basados en imidazol desempeñan un papel muy importante en el tampón intracelular. [17] La histidina puede descarboxilarse a histamina . La histamina puede causar urticaria (ronchas) cuando se produce durante una reacción alérgica .
Los sustituyentes de imidazol se encuentran en muchos productos farmacéuticos. Los imidazoles sintéticos están presentes en muchos fungicidas y medicamentos antifúngicos , antiprotozoarios y antihipertensivos . El imidazol es parte de la molécula de teofilina , que se encuentra en las hojas de té y los granos de café, que estimula el sistema nervioso central . Está presente en el medicamento contra el cáncer mercaptopurina , que combate la leucemia al interferir con las actividades del ADN .
Varios imidazoles sustituidos, incluido el clotrimazol , son inhibidores selectivos de la óxido nítrico sintasa , lo que los convierte en objetivos farmacológicos interesantes en la inflamación , las enfermedades neurodegenerativas y los tumores del sistema nervioso. [18] [19] Otras actividades biológicas del farmacóforo imidazol se relacionan con la regulación negativa de los flujos intracelulares de Ca 2+ y K + y la interferencia con el inicio de la traducción. [20]
Derivados farmacéuticos
Los derivados de imidazol sustituidos son valiosos en el tratamiento de muchas infecciones fúngicas sistémicas . [21] Los imidazoles pertenecen a la clase de antifúngicos azólicos , que incluye ketoconazol , miconazol y clotrimazol .
A modo de comparación, otro grupo de azoles son los triazoles, que incluyen fluconazol , itraconazol y voriconazol . La diferencia entre los imidazoles y los triazoles implica el mecanismo de inhibición de la enzima citocromo P450 . El N3 del compuesto imidazol se une al átomo de hierro hemo del citocromo P450 férrico, mientras que el N4 de los triazoles se une al grupo hemo. Se ha demostrado que los triazoles tienen una mayor especificidad para el citocromo P450 que los imidazoles, lo que los hace más potentes que los imidazoles. [22]
Algunos derivados de imidazol muestran efectos sobre los insectos, por ejemplo, el nitrato de sulconazol exhibe un fuerte efecto antialimentario sobre las larvas del escarabajo de alfombra australiano Anthrenocerus australis que digiere queratina , al igual que el nitrato de econazol con la polilla de la ropa común Tineola bisselliella . [23]
Aplicaciones industriales
El imidazol en sí tiene pocas aplicaciones directas. Es más bien un precursor de una variedad de agroquímicos, entre ellos el enilconazol , el climbingazol , el clotrimazol , el procloraz y el bifonazol . [24]

Química de coordinación
El imidazol y sus derivados tienen una alta afinidad por los cationes metálicos. Una de las aplicaciones del imidazol es la purificación de proteínas marcadas con His en la cromatografía de afinidad por metales inmovilizados (IMAC). El imidazol se utiliza para eluir las proteínas marcadas unidas a iones de níquel adheridos a la superficie de las perlas en la columna de cromatografía . Se hace pasar un exceso de imidazol a través de la columna, lo que desplaza la etiqueta de His de la coordinación de níquel, liberando las proteínas marcadas con His.
Uso en investigación biológica
El imidazol es un tampón adecuado para pH de 6,2 a 7,8. [25] El imidazol puro no tiene prácticamente ninguna absorbancia en longitudes de onda relevantes para las proteínas (280 nm), [26] [27] sin embargo, purezas inferiores de imidazol pueden dar una absorbancia notable a 280 nm. El imidazol puede interferir con el ensayo de proteínas de Lowry . [28]
El imidazol se utiliza a menudo en la purificación de proteínas, donde las proteínas recombinantes con etiquetas de polihistidina se inmovilizan en resinas de níquel y se eluyen con una alta concentración de imidazol.
Sales de imidazol

Las sales de imidazol donde el anillo de imidazol es el catión se conocen como sales de imidazolio (por ejemplo, cloruro o nitrato de imidazolio ). [29] Estas sales se forman a partir de la protonación o sustitución en el nitrógeno del imidazol. Estas sales se han utilizado como líquidos iónicos y precursores de carbenos estables . Las sales donde un imidazol desprotonado es un anión también son bien conocidas; estas sales se conocen como imidazolatos (por ejemplo, imidazolato de sodio, NaC 3 H 3 N 2 ).
Heterociclos relacionados
- Benzimidazol , un análogo con un anillo de benceno fusionado
- Dihidroimidazol o imidazolina, un análogo donde el doble enlace 4,5 está saturado
- Pirrol , un análogo con solo un átomo de nitrógeno en la posición 1
- Oxazol , un análogo con el átomo de nitrógeno en la posición 1 reemplazado por oxígeno.
- Tiazol , un análogo con el átomo de nitrógeno en la posición 1 reemplazado por azufre.
- Pirazol , un análogo con dos átomos de nitrógeno adyacentes
- Triazoles , análogos con tres átomos de nitrógeno
Seguridad
El imidazol tiene una toxicidad aguda baja , como lo indica la DL50 de 970 mg/kg (rata, oral). [24]
Véase también
- 1-Metilimidazol
- 4-Metilimidazol
- Imidazolina (dihidroimidazol)
Referencias
- ^ "Presentación preliminar". Nomenclatura de la química orgánica: recomendaciones de la IUPAC y nombres preferidos 2013 (Libro azul) . Cambridge: The Royal Society of Chemistry . 2014. pág. 140. doi :10.1039/9781849733069-FP001. ISBN . 978-0-85404-182-4.
- ^ Walba, H.; Isensee, RW (1961). "Constantes de acidez de algunos arilimidazoles y sus cationes". J. Org. Chem . 26 (8): 2789–2791. doi :10.1021/jo01066a039.
- ^ "Imidazol". molekula.com . Molekula Group. Archivado desde el original el 19 de octubre de 2018 . Consultado el 19 de octubre de 2018 .
- ^ "Imidazol". pubchem.ncbi.nlm.nih.gov . Archivado desde el original el 10 de mayo de 2023 . Consultado el 17 de febrero de 2024 .
- ^ Karitzky, AR ; Rees, CWR; Scriven, EFV (1984). Química heterocíclica integral . Vol. 5. págs. 469–498. ISBN. 978-0-08-042072-1.
- ^ Grimmett, M. Ross (1997). Síntesis de imidazol y benzimidazol . Academic Press. ISBN 978-0-08-053445-9.
- ^ Brown, EG (1998). Nitrógeno en anillo y biomoléculas clave . Kluwer Academic Press. ISBN 978-94-011-4906-8.
- ^ Pozharskii, AF; et al. (1997). Heterociclos en la vida y la sociedad . John Wiley e hijos. ISBN 978-0-471-96033-1.
- ^ Gilchrist, TL (1985). Química heterocíclica . Bath Press. ISBN 978-0-582-01421-3.
- ^ Rosemeyer, H. (2004). "La quimiodiversidad de la purina como constituyente de productos naturales". Química y biodiversidad . 1 (3): 361–401. doi :10.1002/cbdv.200490033. PMID 17191854. S2CID 12416667.
- ^ Hantzsch, A. y Weber, JH (1887) "Ueber Verbindungen des Thiazols (Pyridins der Thiophenreihe)" Archivado el 30 de mayo de 2020 en Wayback Machine (Sobre compuestos de tiazol (piridinas de la serie de tiofeno), Berichte der deutschen chemischen Gesellschaft , 20 : 3118–3132, véase p. 3119. Véase también: Hantzsch, A. (1888) "Allegemeine Bemerkungen über Azole" Archivado el 30 de mayo de 2020 en Wayback Machine (Observaciones generales sobre los azoles), Annalen der Chemie , 249 : 1–6 propuso una reforma de la nomenclatura de los compuestos de azol, incluida una propuesta para llamar al anillo heterocíclico C 3 H 3. (NH)N "imidazol"; véanse las págs. 2 y 4.
- ^ Christen, Dines; Griffiths, John H.; Sheridan, John (1981). "El espectro de microondas del imidazol; estructura completa y distribución electrónica a partir de tensores de acoplamiento cuadrupolo nuclear y orientación del momento dipolar". Zeitschrift für Naturforschung A . 36 (12): 1378–1385. Bibcode :1981ZNatA..36.1378C. doi : 10.1515/zna-1981-1220 . S2CID 3522351.
- ^ Debus, Heinrich (1858). "Ueber die Einwirkung des Ammoniaks auf Glyoxal" [Sobre la reacción del amoníaco sobre el glioxal]. Annalen der Chemie und Pharmacie . 107 (2): 199–208. doi :10.1002/jlac.18581070209. Archivado desde el original el 30 de mayo de 2020 . Consultado el 1 de octubre de 2016 .De la pág. 205: "Die gereinigte Substanz stellt das oxalsaure Salz einer Basis dar, die ich mit Glyoxalin bezeichenen werde". (La sustancia purificada constituye la sal oxálica de una base, que denominaré "glioxalina".)
- ^ Crouch, R. David; Howard, Jessica L.; Zile, Jennifer L.; Barker, Kathryn H. (2006). "Síntesis de lofina mediada por microondas: desarrollo de un mecanismo para explicar un producto". J. Chem. Educ . 83 (11): 1658. Bibcode :2006JChEd..83.1658C. doi :10.1021/ed083p1658.
- ^ Patente estadounidense 6.177.575, Arduengo, AJ , "Proceso para la fabricación de imidazoles", expedida el 23 de enero de 2001
- ^ Van Leusen, Albert M.; Wildeman, Jurjen; Oldenziel, Otto H. (1977). "Química de los isocianuros de sulfonilmetilo. 12. Cicloadición inducida por base de isocianuros de sulfonilmetilo a enlaces dobles de carbono y nitrógeno. Síntesis de imidazoles 1,5-disustituidos y 1,4,5-trisustituidos a partir de aldiminas y cloruros de imidoilo". Journal of Organic Chemistry . 42 (7): 1153–1159. Bibcode :1977JOrgC..42.1153A. doi :10.1021/jo00427a012.
- ^ Hochachka, PW; Somero, GN (2002). Adaptación bioquímica: mecanismos y procesos en la evolución fisiológica . Nueva York: Oxford University Press.
- ^ Castaño, T.; Encinas, A.; Pérez, C.; Castro, A.; Campillo, NE; Gil, C. (2008). "Design, synthesis, and evaluation of potential inhibitors of nitric oxide synthase" (PDF) . Bioorg. Med. Chem. (Manuscrito enviado). 16 (11): 6193–6206. doi :10.1016/j.bmc.2008.04.036. hdl :10261/87090. PMID 18477512. Archivado (PDF) desde el original el 2023-03-06 . Consultado el 2018-07-24 .
- ^ Bogle, RG; Whitley, GS; Soo, SC; Johnstone, AP; Vallance, P. (1994). "Efecto de los imidazoles antifúngicos en los niveles de ARNm y la actividad enzimática de la óxido nítrico sintasa inducible". Br. J. Pharmacol . 111 (4): 1257–1261. doi :10.1111/j.1476-5381.1994.tb14881.x. PMC 1910171. PMID 7518297 .
- ^ Khalid, MH; Tokunaga, Y.; Caputy, AJ; Walters, E. (2005). "Inhibición del crecimiento tumoral y supervivencia prolongada de ratas con gliomas intracraneales tras la administración de clotrimazol". J. Neurosurg . 103 (1): 79–86. doi :10.3171/jns.2005.103.1.0079. PMID 16121977.
- ^ Leon Shargel (2007). Revista completa de farmacia (6.ª ed.). Lippincott Williams & Wilkins. pág. 930. ISBN 9780781765619.
- ^ Davis, Jennifer L.; Papich, Mark G.; Heit, Mark C. (2009). "Capítulo 39: Medicamentos antimicóticos y antivirales". En Riviere, Jim E.; Papich, Mark G. (eds.). Farmacología y terapéutica veterinaria (novena edición). Wiley-Blackwell. págs. 1019–1020. ISBN 978-0-8138-2061-3.
- ^ Sunderland, MR; Cruickshank, RH; Leighs, SJ (2014). "La eficacia de los compuestos antifúngicos azólicos y antiprotozoarios en la protección de la lana contra las larvas de insectos que digieren queratina". Textile Res. J . 84 (9): 924–931. doi :10.1177/0040517513515312. S2CID 135799368.
- ^ ab Ebel, K., Koehler, H., Gamer, AO y Jäckh, R. (2002). "Imidazol y Derivados". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a13_661. ISBN 978-3527306732.
{{cite encyclopedia}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Dawson, RMC (1986). Datos para la investigación bioquímica . Oxford: Clarendon Press. p. 325. ISBN. 978-0-19-855299-4.OCLC 11865673 .
- ^ "1H-imidazol". Archivado desde el original el 25 de abril de 2021. Consultado el 13 de mayo de 2021 .
- ^ "Optimización de la purificación de proteínas marcadas con histidina". Archivado desde el original el 13 de mayo de 2021 . Consultado el 13 de mayo de 2021 .
- ^ Molina, F; Rueda, A; Bosque-Sendra, JM; Megias, L (1996). "Determinación de proteínas en presencia de tampones de imidazol". Journal of Pharmaceutical and Biomedical Analysis . 14 (3). Elsevier BV: 273–280. doi :10.1016/0731-7085(95)01615-5. ISSN 0731-7085. PMID 8851751.
- ^ Zolfigol, Mohammad A.; Khazaei, Ardeshir; Moosavi-Zare, Ahmad R.; Zare, Abdolkarim; Kruger, Hendrik G.; Asgari, Zhila; Khakyzadeh, Vahid; Kazem-Rostami, Masoud (6 de abril de 2012). "Diseño de nitrato de imidazolio de ácido 3-metil-1-sulfónico líquido iónico como reactivo para la nitración de compuestos aromáticos mediante la generación in situ de NO2 en medios ácidos". Revista de química orgánica . 77 (7): 3640–3645. doi :10.1021/jo300137w. ISSN 0022-3263. PMID 22409592.