Bencilo
 | |
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido Difeniletanodiona | |
| Nombre sistemático de la IUPAC 1,2-Difeniletano-1,2-diona | |
| Otros nombres Difeniletano-1,2-diona Benzil Dibenzoil Bibenzoil Difenilglioxal | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| 608047 | |
| EBICh | |
| Química biológica | |
| Araña química | |
| Tarjeta informativa de la ECHA | 100.004.689 |
| Número CE |
|
Identificador de centro de PubChem |
|
| Número RTECS |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C14H10O2 | |
| Masa molar | 210,232 g·mol −1 |
| Apariencia | polvo cristalino amarillo |
| Densidad | 1,23 g/cm 3 , sólido (1,255 g/cm 3 , rayos X) |
| Punto de fusión | 94,0 a 96,0 °C; 201,2 a 204,8 °F; 367,1 a 369,2 K |
| Punto de ebullición | 346,0 a 348,0 °C; 654,8 a 658,4 °F; 619,1 a 621,1 K |
| insoluble | |
| Solubilidad en etanol | soluble |
| Solubilidad en éter dietílico | soluble |
| Solubilidad en benceno | soluble |
| -118,6·10 −6 cm3 / mol | |
| Estructura | |
| P3 1,2 21 [1] | |
| 3.8 D [2] | |
| Peligros | |
| Seguridad y salud en el trabajo (SST/OHS): | |
Principales peligros | Irritante |
| Etiquetado SGA : | |
 | |
| Advertencia | |
| H315 , H319 , H335 | |
| P261 , P264 , P271 , P280 , P302+P352 , P304+P340 , P305+P351+P338 , P312 , P321 , P332+P313 , P337+P313 , P362 , P403+P233 , P405 , P501 | |
| NFPA 704 (rombo cortafuegos) | |
| Dosis o concentración letal (LD, LC): | |
LD 50 ( dosis media ) | >3 g/kg (ratón, oral) [3] |
| Compuestos relacionados | |
Dicetonas relacionadas | diacetilo |
Compuestos relacionados | benzofenona glioxal bibencilo |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
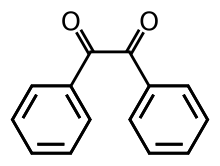
El bencilo (es decir, Bz 2 , conocido sistemáticamente como 1,2-difeniletano-1,2-diona) es el compuesto orgánico con la fórmula ( C 6 H 5 CO ) 2 , generalmente abreviado ( Ph CO) 2 . Este sólido amarillo es una de las dicetonas más comunes . Su principal uso es como fotoiniciador en la química de polímeros . [4]
Estructura
La característica estructural más notable del compuesto es el largo enlace carbono-carbono de 1,54 Å , que indica la ausencia de enlaces pi entre los dos centros carbonílicos. Los centros PhCO son planos, pero el par de grupos benzoilo están torcidos con respecto al otro con un ángulo diedro de 117°. [5] En análogos menos impedidos ( glioxal , biacetilo , derivados del ácido oxálico ), el grupo (RCO) 2 adopta una conformación plana, anti.
Aplicaciones
La mayor parte del bencilo se puede utilizar como fotoiniciador en el curado por radicales libres de redes de polímeros . Absorbe la radiación ultravioleta a una longitud de onda de 260 nm, lo que provoca la descomposición con la formación de especies de radicales libres y la formación de enlaces cruzados dentro del material. Sin embargo, es un fotoiniciador relativamente pobre y rara vez se utiliza. Sufre fotoblanqueo , lo que permite que la luz de curado alcance capas más profundas del material en una exposición más prolongada. [6] Los derivados de acetal , como la 2,2-dimetoxi-2-fenilacetofenona , tienen mejores propiedades para esta aplicación. [6]
El bencilo es un potente inhibidor de las carboxilesterasas humanas , enzimas implicadas en la hidrólisis de los carboxilesteres y de muchos fármacos de uso clínico. [7]
Reacciones
El bencilo es un componente básico en la síntesis orgánica . Se condensa con aminas para dar ligandos de dicetimina . Una reacción orgánica clásica del bencilo es la transposición del ácido bencílico , en la que una base cataliza la conversión del bencilo en ácido bencílico . Esta reactividad se aprovecha en la preparación del fármaco fenitoína . El bencilo también reacciona con 1,3-difenilacetona en una condensación aldólica para dar tetrafenilciclopentadienona .
Preparación
El bencilo se prepara a partir de benjuí , por ejemplo con acetato de cobre (II) : [8]
- PhC(O)CH(OH)Ph + 2 Cu 2+ → PhC(O)C(O)Ph + 2 H + + 2 Cu +
Se utilizan rutinariamente otros agentes oxidantes adecuados como el ácido nítrico (HNO3 ) .
El cloruro de hierro (III) (FeCl 3 ) se puede utilizar como un catalizador económico para esta conversión química. [9]
Referencias
- ^ Acta Crystallogr. B43 398 (1987)
- ^ Espectrómetro. Acta A60 (8-9) 1805 (2004)
- ^ "Bencil".
- ^ Hardo Siegel, Manfred Eggersdorfer "Cetonas" en la Enciclopedia de Química Industrial de Ullmann Wiley-VCH, 2002 por Wiley-VCH, Weinheim. doi :10.1002/14356007.a15_077
- ^ Quang. Shen, Kolbjoern. Hagen "Estructura molecular y conformación en fase gaseosa del bencilo determinada por difracción de electrones" J. Phys. Chem., 1987, 91 (6), págs. 1357-1360. doi :10.1021/j100290a017.
- ^ ab Green, W. Arthur (22 de abril de 2010). Fotoiniciadores industriales: una guía técnica. pág. 31. ISBN 9781439827468. Recuperado el 21 de mayo de 2022 .
- ^ Wadkins. RM et al "Identificación y caracterización de nuevos análogos de bencil (difeniletano-1,2-diona) como inhibidores de carboxilesterasas de mamíferos". J. Med. Chem., 2005 48 pp 2906–15.
- ^ Depreux, P.; Bethegnies, G.; Marcincal-Lefebvre, A. (1988). "Síntesis de bencilo a partir de benzoína con acetato de cobre(II)". Journal of Chemical Education . 65 (6): 553. Bibcode :1988JChEd..65..553D. doi :10.1021/ed065p553.
- ^ Bi, Xiaoxin; Wu, Lintao; Yan, Chaoguo; Jing, Xiaobi; Zhu, Hongxiang (2011). "Síntesis de bencilos en un solo recipiente a partir de aldehídos mediante dimerización de benzoína catalizada por Nhc en condiciones libres de metales en agua". Revista de la Sociedad Química de Chile . 56 (2): 663. doi : 10.4067/S0717-97072011000200008 .



