Benceno
 Modelo que llena el espacio | |||
| |||
 Benceno a temperatura ambiente | |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido Benceno [1] | |||
| Otros nombres Benzol (histórico/alemán) Ciclohexa-1,3,5-trieno; 1,3,5-ciclohexatrieno (isómeros de resonancia teóricos) [6] Anuleno (no recomendado [1] ) Fen (histórico) | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.000.685 | ||
| Número CE |
| ||
| BARRIL | |||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
Panel de control CompTox ( EPA ) |
| ||
| |||
| Propiedades | |||
| C6H6 | |||
| Masa molar | 78,114 g·mol −1 | ||
| Apariencia | Líquido incoloro | ||
| Olor | dulce aromático | ||
| Densidad | 0,8765(20) g/cm3 [ 2] | ||
| Punto de fusión | 5,53 °C (41,95 °F; 278,68 K) | ||
| Punto de ebullición | 80,1 °C (176,2 °F; 353,2 K) | ||
| 1,53 g/l (0 °C) 1,81 g/l (9 °C) 1,79 g/l (15 °C) [3] [4] [5] 1,84 g/l (30 °C) 2,26 g/l (61 °C) 3,94 g/l (100 °C) 21,7 g/kg (200 °C, 6,5 MPa) 17,8 g/kg (200 °C, 40 MPa) [6] | |||
| Solubilidad | Soluble en alcohol , CHCl3 , CCl4 , éter dietílico , acetona , ácido acético [ 6 ] | ||
| Solubilidad en etanodiol | 5,83 g/100 g (20 °C) 6,61 g/100 g (40 °C) 7,61 g/100 g (60 °C) [6] | ||
| Solubilidad en etanol | 20 °C, solución en etanol: 1,2 mL/L (20% v/v) [7] | ||
| Solubilidad en acetona | 20 °C, solución en acetona: 7,69 mL/L (38,46% v/v) 49,4 mL/L (62,5% v/v) [7] | ||
| Solubilidad en dietilenglicol | 52 g/100 g (20 °C) [6] | ||
| registro P | 2.13 | ||
| Presión de vapor | 12,7 kPa (25 °C) 24,4 kPa (40 °C) 181 kPa (100 °C) [8] | ||
| Ácido conjugado | Benceno [9] | ||
| Base conjugada | Benzenuro [10] | ||
| UV-vis (λmáx . ) | 255 nm | ||
| −54,8·10 −6 cm3 / mol | |||
Índice de refracción ( n D ) | 1,5011 (20 °C) 1,4948 (30 °C) [6] | ||
| Viscosidad | 0,7528 cP (10 °C) 0,6076 cP (25 °C) 0,4965 cP (40 °C) 0,3075 cP (80 °C) | ||
| Estructura | |||
| Trigonal plana | |||
| 0 D | |||
| Termoquímica | |||
Capacidad calorífica ( C ) | 134,8 J/mol·K | ||
Entropía molar estándar ( S ⦵ 298 ) | 173,26 J/mol·K [8] | ||
Entalpía estándar de formación (Δ f H ⦵ 298 ) | 48,7 kJ/mol | ||
Entalpía estándar de combustión (Δ c H ⦵ 298 ) | -3267,6 kJ/mol [8] | ||
| Peligros | |||
| Seguridad y salud en el trabajo (SST/OHS): | |||
Principales peligros | carcinógeno ocupacional potencial, inflamable | ||
| Etiquetado SGA : | |||
     [11] [11] | |||
| Peligro | |||
| H225 , H302 , H304 , H305 , H315 , H319 , H340 , H350 , H372 , H410 [11] | |||
| P201 , P210 , P301+P310 , P305+P351+P338 , P308+P313 , P331 [11] | |||
| NFPA 704 (rombo cortafuegos) | |||
| punto de inflamabilidad | -11,63 °C (11,07 °F; 261,52 K) | ||
| 497,78 °C (928,00 °F; 770,93 K) | |||
| Límites de explosividad | 1,2–7,8% | ||
| Dosis o concentración letal (LD, LC): | |||
LD 50 ( dosis media ) | 930 mg/kg (rata, oral) [13] | ||
LC Lo ( valor más bajo publicado ) | 44.000 ppm (conejo, 30 min) 44.923 ppm (perro) 52.308 ppm (gato) 20.000 ppm (humano, 5 min) [14] | ||
| NIOSH (límites de exposición a la salud en EE. UU.): | |||
PEL (Permisible) | TWA 1 ppm, TWA 5 ppm [12] | ||
REL (recomendado) | Ca TWA 0,1 ppm ST 1 ppm [12] | ||
IDLH (Peligro inmediato) | 500 ppm [12] | ||
| Ficha de datos de seguridad (FDS) | Base de datos de datos móviles | ||
| Compuestos relacionados | |||
Compuestos relacionados | Tolueno Borazina | ||
| Página de datos complementarios | |||
| Benceno (página de datos) | |||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El benceno es un compuesto químico orgánico con la fórmula molecular C 6 H 6 . La molécula de benceno está compuesta por seis átomos de carbono unidos en un anillo hexagonal plano con un átomo de hidrógeno unido a cada uno. Debido a que contiene solo átomos de carbono e hidrógeno, el benceno se clasifica como un hidrocarburo .
El benceno es un componente natural del petróleo y es uno de los petroquímicos elementales . Debido a los enlaces pi cíclicos continuos entre los átomos de carbono, el benceno se clasifica como un hidrocarburo aromático . El benceno es un líquido incoloro y altamente inflamable con un olor dulce, y es parcialmente responsable del aroma de la gasolina . Se utiliza principalmente como precursor para la fabricación de productos químicos con estructuras más complejas, como el etilbenceno y el cumeno , de los cuales se producen miles de millones de kilogramos anualmente. Aunque el benceno es un producto químico industrial importante , encuentra un uso limitado en artículos de consumo debido a su toxicidad. El benceno es un compuesto orgánico volátil . [15]
El benceno está clasificado como carcinógeno . Organizaciones de noticias como The New York Times han informado sobre sus efectos particulares en la salud humana , como los resultados a largo plazo de la exposición accidental. Por ejemplo, un artículo de 2022 afirmó que la contaminación por benceno en el área metropolitana de Boston causó condiciones peligrosas en varios lugares, y la publicación señaló que el compuesto podría eventualmente causar leucemia en algunas personas. [16]
Historia
Descubrimiento
La palabra " benceno " deriva de " goma de benjuí " ( resina de benjuí ), una resina aromática conocida desde la antigüedad en el sudeste asiático, y más tarde por los farmacéuticos y perfumistas europeos en el siglo XVI a través de las rutas comerciales. [17] Un material ácido se derivó del benjuí por sublimación , y se denominó "flores de benjuí" o ácido benzoico. El hidrocarburo derivado del ácido benzoico adquirió así el nombre de bencina, benzol o benceno. [18] Michael Faraday aisló e identificó por primera vez el benceno en 1825 a partir del residuo oleoso derivado de la producción de gas de iluminación, dándole el nombre de bicarburo de hidrógeno . [19] [20] En 1833, Eilhard Mitscherlich lo produjo destilando ácido benzoico (de goma de benjuí ) y cal . Le dio al compuesto el nombre de bencina . [21] En 1836, el químico francés Auguste Laurent denominó la sustancia «phène»; [22] esta palabra se ha convertido en la raíz de la palabra inglesa « phenol », que es benceno hidroxilado , y « fenil », el radical formado por la abstracción de un átomo de hidrógeno del benceno.
En 1845, Charles Blachford Mansfield , trabajando bajo la dirección de August Wilhelm von Hofmann , aisló el benceno del alquitrán de hulla . [23] Cuatro años después, Mansfield comenzó la primera producción a escala industrial de benceno, basada en el método del alquitrán de hulla. [24] [25] Poco a poco, entre los químicos se desarrolló la sensación de que varias sustancias estaban relacionadas químicamente con el benceno, comprendiendo una familia química diversa. En 1855, Hofmann fue el primero en aplicar la palabra « aromático » para designar esta relación familiar, en honor a una propiedad característica de muchos de sus miembros. [26] En 1997, se detectó benceno en el espacio profundo . [27]
Fórmula del anillo
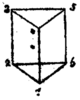
| Propuestas históricas de estructuras del benceno | |||||
|---|---|---|---|---|---|
 |  |  | |||
| Por Adolf Karl Ludwig Claus (1867) [28] | Por James Dewar (1869) [29] | Por Albert Ladenburg (1869) [30] | |||
 | |||||
| Por agosto Kekulé (1865/1872) [31] [32] | |||||
 |  |  | |||
| Por Henry Edward Armstrong (1887) [33] [34] | Por Adolf von Baeyer (1888) [35] | Por Friedrich Karl Johannes Thiele (1899) [36] | |||
La fórmula empírica del benceno se conocía desde hacía mucho tiempo, pero su estructura altamente poliinsaturada , con sólo un átomo de hidrógeno por cada átomo de carbono , era difícil de determinar. Archibald Scott Couper en 1858 y Johann Josef Loschmidt en 1861 [37] sugirieron posibles estructuras que contenían múltiples enlaces dobles o múltiples anillos, pero en esos años se sabía muy poco sobre la química aromática, por lo que los químicos no podían aportar evidencia adecuada para favorecer ninguna fórmula en particular.
Pero muchos químicos habían comenzado a trabajar con sustancias aromáticas, especialmente en Alemania, y los datos relevantes se estaban obteniendo rápidamente. En 1865, el químico alemán Friedrich August Kekulé publicó un artículo en francés (porque entonces enseñaba en la Bélgica francófona) sugiriendo que la estructura contenía un anillo de seis átomos de carbono con enlaces simples y dobles alternados. El año siguiente publicó un artículo mucho más largo en alemán sobre el mismo tema. [31] [38] Kekulé utilizó evidencia que se había acumulado en los años intermedios (a saber, que siempre parecía haber un solo isómero de cualquier monoderivado del benceno, y que siempre parecía haber exactamente tres isómeros de cada derivado disustituido, que ahora se entendía que correspondían a los patrones orto, meta y para de la sustitución del areno ) para argumentar en apoyo de su estructura propuesta. [39] El anillo simétrico de Kekulé podría explicar estos curiosos hechos, así como la relación carbono-hidrógeno de 1:1 del benceno.
- Modificación de Kekulé de su teoría de 1865 en 1872, que ilustra la alternancia rápida de enlaces dobles [nota 1]
La nueva comprensión del benceno, y por lo tanto de todos los compuestos aromáticos, resultó ser tan importante tanto para la química pura como para la química aplicada que en 1890 la Sociedad Química Alemana organizó un elaborado reconocimiento en honor de Kekulé, celebrando el vigésimo quinto aniversario de su primer artículo sobre el benceno. En este artículo, Kekulé habló de la creación de la teoría. Dijo que había descubierto la forma de anillo de la molécula de benceno después de haber tenido una ensoñación o sueño de una serpiente que se mordía la cola (un símbolo en las culturas antiguas conocido como el uróboros ). [40] Esta visión, dijo, le llegó después de años de estudiar la naturaleza de los enlaces carbono-carbono. Esto fue siete años después de haber resuelto el problema de cómo los átomos de carbono podían unirse a hasta otros cuatro átomos al mismo tiempo. Curiosamente, una representación similar y humorística del benceno había aparecido en 1886 en un panfleto titulado Berichte der Durstigen Chemischen Gesellschaft (Revista de la Sociedad Química Sedienta), una parodia de la Berichte der Deutschen Chemischen Gesellschaft , solo que la parodia tenía monos agarrándose unos a otros en un círculo, en lugar de serpientes como en la anécdota de Kekulé. [41] Algunos historiadores han sugerido que la parodia era una sátira de la anécdota de la serpiente, posiblemente ya bien conocida a través de la transmisión oral, incluso si aún no había aparecido impresa. [18] El discurso de Kekulé de 1890 [42] en el que apareció esta anécdota ha sido traducido al inglés. [43] Si la anécdota es el recuerdo de un evento real, las circunstancias mencionadas en la historia sugieren que debe haber sucedido a principios de 1862. [44]
En 1929, la naturaleza cíclica del benceno fue finalmente confirmada por la cristalógrafa Kathleen Lonsdale utilizando métodos de difracción de rayos X. [45] [46] Utilizando grandes cristales de hexametilbenceno , un derivado del benceno con el mismo núcleo de seis átomos de carbono, Lonsdale obtuvo patrones de difracción. A través del cálculo de más de treinta parámetros, Lonsdale demostró que el anillo de benceno no podía ser otra cosa que un hexágono plano, y proporcionó distancias precisas para todos los enlaces carbono-carbono en la molécula. [47]
Nomenclatura
El químico alemán Wilhelm Körner sugirió los prefijos orto-, meta-, para- para distinguir los derivados del benceno disustituidos en 1867; sin embargo, no utilizó los prefijos para distinguir las posiciones relativas de los sustituyentes en un anillo de benceno. [48] [49] Fue el químico alemán Carl Gräbe quien, en 1869, utilizó por primera vez los prefijos orto-, meta-, para- para denotar ubicaciones relativas específicas de los sustituyentes en un anillo aromático disustituido (a saber, naftaleno). [50] En 1870, el químico alemán Viktor Meyer aplicó por primera vez la nomenclatura de Gräbe al benceno. [51]
Aplicaciones tempranas
En 1903, Ludwig Roselius popularizó el uso de benceno para descafeinar el café . Este descubrimiento condujo a la producción de Sanka . Este proceso se interrumpió más tarde. El benceno se utilizó históricamente como un componente importante en muchos productos de consumo, como Liquid Wrench , varios decapantes de pintura , cementos de caucho , quitamanchas y otros productos. La fabricación de algunas de estas formulaciones que contenían benceno cesó alrededor de 1950, aunque Liquid Wrench continuó conteniendo cantidades significativas de benceno hasta fines de la década de 1970. [52]
Aparición
En el petróleo y el carbón se encuentran trazas de benceno. Es un subproducto de la combustión incompleta de muchos materiales. Para uso comercial, hasta la Segunda Guerra Mundial , gran parte del benceno se obtenía como subproducto de la producción de coque (o "aceite ligero de horno de coque") para la industria del acero . Sin embargo, en la década de 1950, el aumento de la demanda de benceno, especialmente de la creciente industria de polímeros , hizo necesaria la producción de benceno a partir del petróleo. Hoy en día, la mayor parte del benceno proviene de la industria petroquímica , y solo una pequeña fracción se produce a partir del carbón. [53] Se ha detectado benceno en Marte . [54] [55] [56]
Estructura
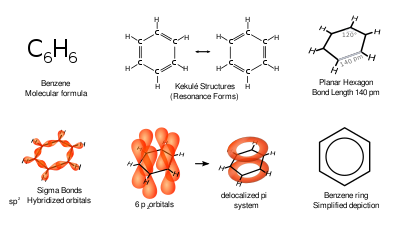
La difracción de rayos X muestra que los seis enlaces carbono-carbono en el benceno tienen la misma longitud, 140 picómetros (pm). [57] Las longitudes de enlace C–C son mayores que las de un enlace doble (135 pm) pero más cortas que las de un enlace simple (147 pm). Esta distancia intermedia es causada por la deslocalización electrónica : los electrones para el enlace C=C se distribuyen equitativamente entre cada uno de los seis átomos de carbono. El benceno tiene 6 átomos de hidrógeno, menos que el alcano parental correspondiente , el hexano , que tiene 14. El benceno y el ciclohexano tienen una estructura similar, solo el anillo de electrones deslocalizados y la pérdida de un hidrógeno por carbono lo distinguen del ciclohexano. La molécula es plana. [58] La descripción orbital molecular implica la formación de tres orbitales π deslocalizados que abarcan los seis átomos de carbono, mientras que la descripción del enlace de valencia implica una superposición de estructuras de resonancia . [59] [60] [61] [62] Es probable que esta estabilidad contribuya a las peculiares propiedades moleculares y químicas conocidas como aromaticidad . Para reflejar la naturaleza deslocalizada del enlace, el benceno se representa a menudo con un círculo dentro de una disposición hexagonal de átomos de carbono.
Los derivados del benceno se presentan con bastante frecuencia como componente de moléculas orgánicas, tanto que el Consorcio Unicode ha asignado un símbolo en el bloque Técnico Misceláneo con el código U+232C (⌬) para representarlo con tres dobles enlaces, [63] y U+23E3 (⏣) para una versión deslocalizada. [64]
Derivados del benceno
Muchos compuestos químicos importantes se derivan del benceno mediante la sustitución de uno o más de sus átomos de hidrógeno por otro grupo funcional . Ejemplos de derivados simples del benceno son el fenol , el tolueno y la anilina , abreviados PhOH, PhMe y PhNH 2 , respectivamente. La unión de anillos de benceno da bifenilo , C 6 H 5 –C 6 H 5 . Una mayor pérdida de hidrógeno da lugar a hidrocarburos aromáticos "fusionados", como el naftaleno , el antraceno , el fenantreno y el pireno . El límite del proceso de fusión es el alótropo libre de hidrógeno del carbono, el grafito .
En los heterociclos , los átomos de carbono en el anillo de benceno se reemplazan por otros elementos. Las variaciones más importantes contienen nitrógeno . Reemplazar un CH por N da el compuesto piridina , C 5 H 5 N. Aunque el benceno y la piridina están estructuralmente relacionados, el benceno no se puede convertir en piridina. El reemplazo de un segundo enlace CH por N da, dependiendo de la ubicación del segundo N, piridazina , pirimidina o pirazina . [65]
Producción
Cuatro procesos químicos contribuyen a la producción industrial de benceno: reformado catalítico , hidrodesalquilación de tolueno , desproporción de tolueno y craqueo a vapor , etc. Según el Perfil Toxicológico de la ATSDR para benceno, entre 1978 y 1981, los reformados catalíticos representaron aproximadamente el 44-50% de la producción total de benceno en Estados Unidos. [53]
Reformado catalítico
En el reformado catalítico, una mezcla de hidrocarburos con puntos de ebullición entre 60 y 200 °C se mezcla con gas hidrógeno y luego se expone a un catalizador bifuncional de cloruro de platino o cloruro de renio a 500–525 °C y presiones que varían de 8–50 atm. Bajo estas condiciones, los hidrocarburos alifáticos forman anillos y pierden hidrógeno para convertirse en hidrocarburos aromáticos. Los productos aromáticos de la reacción se separan luego de la mezcla de reacción (o reformado) por extracción con cualquiera de varios solventes , incluyendo dietilenglicol o sulfolano , y luego el benceno se separa de los otros aromáticos por destilación. El paso de extracción de aromáticos del reformado está diseñado para producir aromáticos con la menor cantidad de componentes no aromáticos. La recuperación de los aromáticos, comúnmente conocidos como BTX (isómeros de benceno, tolueno y xileno), involucra dichos pasos de extracción y destilación.
De manera similar a este reformado catalítico, UOP y BP comercializaron un método a partir de GLP (principalmente propano y butano) a aromáticos.
Hidrodesalquilación de tolueno
La hidrodesalquilación del tolueno convierte el tolueno en benceno. En este proceso que requiere mucho hidrógeno, el tolueno se mezcla con hidrógeno y luego se pasa sobre un catalizador de óxido de cromo , molibdeno o platino a 500–650 °C y 20–60 atm de presión. A veces, se utilizan temperaturas más altas en lugar de un catalizador (en condiciones de reacción similares). En estas condiciones, el tolueno sufre una desalquilación para dar lugar a benceno y metano :
Esta reacción irreversible va acompañada de una reacción secundaria de equilibrio que produce bifenilo (también conocido como difenilo) a mayor temperatura:
- 2 C
6yo
6⇌ A
2+ C
6yo
5-DO
6yo
5
Si la corriente de materia prima contiene muchos componentes no aromáticos (parafinas o naftenos), es probable que estos se descompongan en hidrocarburos inferiores como el metano, lo que aumenta el consumo de hidrógeno.
El rendimiento típico de una reacción supera el 95 %. En ocasiones, se utilizan xilenos y aromáticos más pesados en lugar de tolueno, con una eficiencia similar.
A esto se le suele llamar metodología "intencionada" para producir benceno, en comparación con los procesos convencionales de extracción BTX (benceno-tolueno-xileno).
Desproporción de tolueno
La desproporción de tolueno ( TDP ) es la conversión de tolueno en benceno y xileno . [66]
Dado que la demanda de para -xileno ( p -xileno ) supera considerablemente la demanda de otros isómeros de xileno, se puede utilizar un refinamiento del proceso TDP llamado TDP selectivo (STDP). En este proceso, la corriente de xileno que sale de la unidad TDP es aproximadamente 90% p -xileno. En algunos sistemas, incluso la relación benceno-xilenos se modifica para favorecer a los xilenos.
Craqueo por vapor
El craqueo a vapor es el proceso de producción de etileno y otros alquenos a partir de hidrocarburos alifáticos . Según la materia prima utilizada para producir las olefinas, el craqueo a vapor puede generar un subproducto líquido rico en benceno llamado gasolina de pirólisis . La gasolina de pirólisis se puede mezclar con otros hidrocarburos como aditivo de la gasolina o pasar por un proceso de extracción para recuperar los aromáticos BTX (benceno, tolueno y xilenos).
Otros métodos
Aunque no tienen importancia comercial, existen muchas otras rutas para obtener benceno. El fenol y los halobencenos se pueden reducir con metales. El ácido benzoico y sus sales sufren descarboxilación para formar benceno. La reacción del compuesto de diazonio derivado de la anilina con ácido hipofosforoso produce benceno. La trimerización del acetileno con alquinos produce benceno. La descarboxilación completa del ácido melítico produce benceno.
Usos
El benceno se utiliza principalmente como intermediario para fabricar otros productos químicos, sobre todo etilbenceno (y otros alquilbencenos ), cumeno , ciclohexano y nitrobenceno . En 1988 se informó que dos tercios de todos los productos químicos en las listas de la American Chemical Society contenían al menos un anillo de benceno. [67] Más de la mitad de toda la producción de benceno se procesa en etilbenceno, un precursor del estireno , que se utiliza para fabricar polímeros y plásticos como el poliestireno . Alrededor del 20% de la producción de benceno se utiliza para fabricar cumeno, que es necesario para producir fenol y acetona para resinas y adhesivos. El ciclohexano consume alrededor del 10% de la producción mundial de benceno; se utiliza principalmente en la fabricación de fibras de nailon, que se procesan en textiles y plásticos de ingeniería. Se utilizan cantidades más pequeñas de benceno para fabricar algunos tipos de cauchos , lubricantes , tintes , detergentes , medicamentos , explosivos y pesticidas . En 2013, el mayor país consumidor de benceno fue China, seguido de los EE. UU. La producción de benceno se está expandiendo actualmente en Oriente Medio y en África, mientras que las capacidades de producción en Europa Occidental y América del Norte están estancadas. [68]
En la actualidad, el tolueno se utiliza a menudo como sustituto del benceno, por ejemplo como aditivo para combustibles. Las propiedades disolventes de ambos son similares, pero el tolueno es menos tóxico y tiene un espectro de líquidos más amplio. El tolueno también se procesa para obtener benceno. [69]
Componente de la gasolina
Como aditivo de la gasolina, el benceno aumenta el octanaje y reduce el golpeteo . Como consecuencia, la gasolina solía contener varios porcentajes de benceno antes de la década de 1950, cuando el plomo tetraetílico lo reemplazó como el aditivo antidetonante más utilizado. Con la eliminación global de la gasolina con plomo, el benceno ha vuelto a ser un aditivo de la gasolina en algunas naciones. En los Estados Unidos , la preocupación por sus efectos negativos para la salud y la posibilidad de que el benceno entre en las aguas subterráneas ha llevado a una estricta regulación del contenido de benceno de la gasolina, con límites típicamente alrededor del 1%. [70] Las especificaciones europeas de la gasolina ahora contienen el mismo límite del 1% en el contenido de benceno. La Agencia de Protección Ambiental de los Estados Unidos introdujo nuevas regulaciones en 2011 que redujeron el contenido de benceno en la gasolina al 0,62%. [71]
En algunos idiomas europeos, la palabra petróleo o gasolina es un cognado exacto de "benceno". Por ejemplo, en catalán , la palabra "benzina" se puede utilizar para la gasolina, aunque ahora es relativamente poco frecuente.
Reacciones
Las reacciones más comunes del benceno implican la sustitución de un protón por otros grupos. [72] La sustitución aromática electrofílica es un método general de derivatización del benceno. El benceno es lo suficientemente nucleófilo como para sufrir una sustitución por iones acilio y carbocationes de alquilo para dar derivados sustituidos.
El ejemplo más ampliamente practicado de esta reacción es la etilación del benceno.
En 1999 se produjeron aproximadamente 24.700.000 toneladas. [73] Muy instructiva pero de mucha menos importancia industrial es la alquilación de Friedel-Crafts del benceno (y muchos otros anillos aromáticos) utilizando un haluro de alquilo en presencia de un fuerte catalizador de ácido de Lewis. De manera similar, la acilación de Friedel-Crafts es un ejemplo relacionado de sustitución aromática electrofílica . La reacción implica la acilación del benceno (o muchos otros anillos aromáticos) con un cloruro de acilo utilizando un fuerte catalizador de ácido de Lewis como el cloruro de aluminio o el cloruro de hierro (III) .
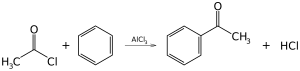
Sulfonación, cloración, nitración
Mediante la sustitución aromática electrofílica, se introducen muchos grupos funcionales en la estructura del benceno. La sulfonación del benceno implica el uso de óleum , una mezcla de ácido sulfúrico con trióxido de azufre . Los derivados sulfonados del benceno son detergentes útiles . En la nitración , el benceno reacciona con iones de nitronio (NO 2 + ), que es un electrófilo fuerte producido al combinar ácidos sulfúrico y nítrico. El nitrobenceno es el precursor de la anilina . La cloración se logra con cloro para dar clorobenceno en presencia de un catalizador de ácido de Lewis como el tricloruro de aluminio.
Hidrogenación
Mediante la hidrogenación , el benceno y sus derivados se convierten en ciclohexano y derivados. Esta reacción se logra mediante el uso de altas presiones de hidrógeno en presencia de catalizadores heterogéneos , como níquel finamente dividido . Mientras que los alquenos se pueden hidrogenar cerca de temperaturas ambiente, el benceno y los compuestos relacionados son sustratos más reacios, requiriendo temperaturas >100 °C. Esta reacción se practica a gran escala industrialmente. En ausencia del catalizador, el benceno es impermeable al hidrógeno. La hidrogenación no se puede detener para dar ciclohexeno o ciclohexadienos ya que estos son sustratos superiores. Sin embargo, la reducción de Birch , un proceso no catalítico, hidrogena selectivamente el benceno al dieno.
Complejos metálicos
El benceno es un excelente ligando en la química organometálica de metales de baja valencia. Entre los ejemplos importantes se incluyen los complejos sándwich y semisándwich, respectivamente, Cr(C 6 H 6 ) 2 y [RuCl 2 (C 6 H 6 )] 2 .
Efectos sobre la salud

El benceno está clasificado como carcinógeno , lo que aumenta el riesgo de cáncer y otras enfermedades, y también es una causa notoria de insuficiencia de la médula ósea . Una cantidad sustancial de datos epidemiológicos, clínicos y de laboratorio vinculan el benceno con la anemia aplásica, la leucemia aguda , las anomalías de la médula ósea y la enfermedad cardiovascular. [74] [75] [76] Las neoplasias hematológicas específicas con las que se asocia el benceno incluyen: leucemia mieloide aguda (LMA), anemia aplásica, síndrome mielodisplásico (SMD), leucemia linfoblástica aguda (LLA) y leucemia mieloide crónica (LMC). [77]
El Instituto Americano del Petróleo (API) afirmó ya en 1948 que "se considera generalmente que la única concentración absolutamente segura de benceno es cero". [78] No existe un nivel de exposición seguro; incluso cantidades minúsculas pueden causar daños. [79] El Departamento de Salud y Servicios Humanos de los Estados Unidos (DHHS) clasifica el benceno como carcinógeno humano. La exposición prolongada a niveles excesivos de benceno en el aire causa leucemia, un cáncer potencialmente mortal de los órganos hematopoyéticos. En particular, la leucemia mieloide aguda o leucemia no linfocítica aguda (AML y ANLL) es causada por el benceno. [80] La IARC clasificó al benceno como "conocido por ser carcinógeno para los humanos" ( Grupo 1 ).
Como el benceno está presente en la gasolina y los combustibles de hidrocarburos que se utilizan en todas partes, la exposición humana al benceno es un problema de salud mundial. El benceno ataca el hígado, los riñones, los pulmones, el corazón y el cerebro y puede provocar roturas de cadenas de ADN y daños cromosómicos , por lo que es teratogénico y mutagénico . El benceno causa cáncer en animales, incluidos los humanos. Se ha demostrado que el benceno causa cáncer en ambos sexos de múltiples especies de animales de laboratorio expuestos a través de diversas vías. [81] [82]
Exposición al benceno
Según la Agencia para Sustancias Tóxicas y Registro de Enfermedades (ATSDR) (2007), el benceno es una sustancia química sintética y natural que se produce a partir de procesos que incluyen: erupciones volcánicas, incendios forestales, síntesis de sustancias químicas como el fenol , producción de fibras sintéticas y fabricación de cauchos , lubricantes , pesticidas , medicamentos y colorantes . Las principales fuentes de exposición al benceno son el humo del tabaco , las estaciones de servicio de automóviles, los gases de escape de los vehículos de motor y las emisiones industriales; sin embargo, la ingestión y la absorción dérmica del benceno también pueden ocurrir a través del contacto con agua contaminada. El benceno se metaboliza hepáticamente y se excreta en la orina . La medición de los niveles de benceno en el aire y el agua se logra mediante la recolección a través de tubos de carbón activado , que luego se analizan con un cromatógrafo de gases . La medición del benceno en humanos se puede lograr a través de pruebas de orina , sangre y aliento ; sin embargo, todas ellas tienen sus limitaciones porque el benceno se metaboliza rápidamente en el cuerpo humano. [83]
La exposición al benceno puede conducir progresivamente a anemia aplásica , leucemia y mieloma múltiple . [84]
La OSHA regula los niveles de benceno en el lugar de trabajo. [85] La cantidad máxima permitida de benceno en el aire del lugar de trabajo durante una jornada laboral de 8 horas, una semana laboral de 40 horas es de 1 ppm. Como el benceno puede causar cáncer , el NIOSH recomienda que todos los trabajadores usen equipos de respiración especiales cuando sea probable que estén expuestos al benceno en niveles que excedan el límite de exposición recomendado (8 horas) de 0,1 ppm. [86]
Límites de exposición al benceno
La Agencia de Protección Ambiental de los Estados Unidos ha establecido un nivel máximo de contaminante para el benceno en el agua potable en 0,005 mg/L (5 ppb), según lo promulgado a través de las Regulaciones Nacionales Primarias de Agua Potable de los Estados Unidos. [87] Esta regulación se basa en la prevención de la leucemogénesis por benceno . El objetivo del nivel máximo de contaminante (MCLG), un objetivo de salud no exigible que permitiría un margen de seguridad adecuado para la prevención de efectos adversos, es una concentración cero de benceno en el agua potable. La EPA exige que se informe de los derrames o liberaciones accidentales al medio ambiente de 10 libras (4,5 kg) o más de benceno.
La Administración de Seguridad y Salud Ocupacional de los Estados Unidos (OSHA) ha establecido un límite de exposición permisible de 1 parte de benceno por millón de partes de aire (1 ppm) en el lugar de trabajo durante una jornada laboral de 8 horas, una semana laboral de 40 horas. El límite de exposición a corto plazo para el benceno en el aire es de 5 ppm durante 15 minutos. [88] Estos límites legales se basaron en estudios que demostraban evidencia convincente de riesgo para la salud de los trabajadores expuestos al benceno. El riesgo de exposición a 1 ppm durante toda la vida laboral se ha estimado en 5 muertes adicionales por leucemia por cada 1.000 empleados expuestos. (Esta estimación no supone ningún umbral para los efectos cancerígenos del benceno.) La OSHA también ha establecido un nivel de acción de 0,5 ppm para fomentar exposiciones aún más bajas en el lugar de trabajo. [89]
El Instituto Nacional de Seguridad y Salud Ocupacional de los Estados Unidos (NIOSH) revisó la concentración de benceno inmediatamente peligrosa para la vida y la salud (IDLH) a 500 ppm. La definición actual del NIOSH para una condición IDLH, como se da en la lógica de selección de respiradores del NIOSH, es aquella que plantea una amenaza de exposición a contaminantes transportados por el aire cuando es probable que esa exposición cause la muerte o efectos adversos permanentes inmediatos o retardados para la salud o impida el escape de dicho entorno. [90] El propósito de establecer un valor IDLH es (1) asegurar que el trabajador pueda escapar de un entorno contaminado dado en caso de falla del equipo de protección respiratoria y (2) se considera un nivel máximo por encima del cual solo se permite un aparato de respiración altamente confiable que brinde máxima protección al trabajador. [90] [91] En septiembre de 1995, NIOSH emitió una nueva política para desarrollar límites de exposición recomendados (REL) para sustancias, incluidos los carcinógenos. Como el benceno puede causar cáncer, NIOSH recomienda que todos los trabajadores usen equipos de respiración especiales cuando sea probable que estén expuestos al benceno en niveles que excedan el REL (10 horas) de 0,1 ppm. [92] El límite de exposición a corto plazo (STEL – 15 min) de NIOSH es 1 ppm.
La Conferencia Americana de Higienistas Industriales Gubernamentales (ACGIH) adoptó valores límite umbral (TLV) para benceno en 0,5 ppm TWA y 2,5 ppm STEL. [88]
Toxicología
Biomarcadores de exposición
Existen varias pruebas que pueden determinar la exposición al benceno. El benceno en sí puede medirse en el aliento, la sangre o la orina, pero estas pruebas suelen limitarse a las primeras 24 horas posteriores a la exposición debido a la eliminación relativamente rápida de la sustancia química por exhalación o biotransformación. La mayoría de las personas en los países desarrollados tienen niveles basales mensurables de benceno y otros hidrocarburos aromáticos del petróleo en la sangre. En el cuerpo, el benceno se convierte enzimáticamente en una serie de productos de oxidación, entre ellos el ácido mucónico , el ácido fenilmercaptúrico, el fenol , el catecol , la hidroquinona y el 1,2,4-trihidroxibenceno . La mayoría de estos metabolitos tienen algún valor como biomarcadores de la exposición humana, ya que se acumulan en la orina en proporción a la extensión y la duración de la exposición, y pueden seguir presentes durante algunos días después de que haya cesado la exposición. Los límites actuales de exposición biológica de la ACGIH para la exposición ocupacional son 500 μg/g de creatinina para el ácido mucónico y 25 μg/g de creatinina para el ácido fenilmercaptúrico en una muestra de orina de final de turno. [93] [94] [95] [96]
Biotransformaciones
Aunque no es un sustrato común para el metabolismo, el benceno puede ser oxidado tanto por bacterias como por eucariotas . En las bacterias, la enzima dioxigenasa puede añadir un oxígeno al anillo, y el producto inestable se reduce inmediatamente (por NADH ) a un diol cíclico con dos dobles enlaces, rompiendo la aromaticidad. A continuación, el diol se reduce nuevamente por NADH a catecol . El catecol se metaboliza entonces a acetil CoA y succinil CoA , utilizados por los organismos principalmente en el ciclo del ácido cítrico para la producción de energía.
La vía metabólica del benceno es compleja y comienza en el hígado. En ella intervienen varias enzimas, entre ellas la citocromo P450 2E1 (CYP2E1), la quinina oxidorreductasa (NQ01 o DT-diaforasa o NAD(P)H deshidrogenasa (quinona 1) ), el GSH y la mieloperoxidasa (MPO). La CYP2E1 interviene en varios pasos: convierte el benceno en oxepina (óxido de benceno), el fenol en hidroquinona y la hidroquinona en bencenotriol y catecol . La hidroquinona, el bencenotriol y el catecol se convierten en polifenoles. En la médula ósea, la MPO convierte estos polifenoles en benzoquinonas. Estos intermediarios y metabolitos inducen genotoxicidad por múltiples mecanismos, incluyendo la inhibición de la topoisomerasa II (que mantiene la estructura cromosómica), la interrupción de los microtúbulos (que mantiene la estructura y organización celular), la generación de radicales libres de oxígeno (especies inestables) que pueden conducir a mutaciones puntuales, el aumento del estrés oxidativo, la inducción de roturas de la cadena de ADN y la alteración de la metilación del ADN (que puede afectar la expresión génica). NQ01 y GSH alejan el metabolismo de la toxicidad. NQ01 metaboliza la benzoquinona hacia polifenoles (contrarrestando el efecto de la MPO). GSH está involucrado en la formación de ácido fenilmercaptúrico. [77] [97]
Los polimorfismos genéticos en estas enzimas pueden inducir pérdida de función o ganancia de función. Por ejemplo, las mutaciones en CYP2E1 aumentan la actividad y dan como resultado una mayor generación de metabolitos tóxicos. Las mutaciones de NQ01 dan como resultado una pérdida de función y pueden dar como resultado una disminución de la desintoxicación. Las mutaciones de mieloperoxidasa dan como resultado una pérdida de función y pueden dar como resultado una disminución de la generación de metabolitos tóxicos. Las mutaciones o deleciones de GSH dan como resultado una pérdida de función y dan como resultado una disminución de la desintoxicación. Estos genes pueden ser objetivos para la detección genética de la susceptibilidad a la toxicidad del benceno. [98]
Toxicología molecular
El paradigma de la evaluación toxicológica del benceno está cambiando hacia el dominio de la toxicología molecular, ya que permite comprender mejor los mecanismos biológicos fundamentales. El glutatión parece desempeñar un papel importante al proteger contra las roturas del ADN inducidas por el benceno y se lo está identificando como un nuevo biomarcador de exposición y efecto. [99] El benceno causa aberraciones cromosómicas en los leucocitos de sangre periférica y la médula ósea, lo que explica la mayor incidencia de leucemia y mieloma múltiple causados por la exposición crónica. Estas aberraciones se pueden monitorear utilizando hibridación in situ fluorescente (FISH) con sondas de ADN para evaluar los efectos del benceno junto con las pruebas hematológicas como marcadores de hematotoxicidad. [100] El metabolismo del benceno involucra enzimas codificadas por genes polimórficos. Los estudios han demostrado que el genotipo en estos loci puede influir en la susceptibilidad a los efectos tóxicos de la exposición al benceno. Los individuos portadores de la variante de NAD(P)H:quinona oxidorreductasa 1 (NQO1), epóxido hidrolasa microsomal (EPHX) y deleción de la glutatión S-transferasa T1 (GSTT1) mostraron una mayor frecuencia de roturas de cadena sencilla del ADN. [101]
Oxidación biológica y actividad cancerígena
Una forma de entender los efectos cancerígenos del benceno es examinar los productos de la oxidación biológica. El benceno puro, por ejemplo, se oxida en el cuerpo para producir un epóxido, el óxido de benceno , que no se excreta fácilmente y puede interactuar con el ADN para producir mutaciones dañinas.
Vías de exposición
Inhalación
El aire exterior puede contener niveles bajos de benceno proveniente de las estaciones de servicio de automóviles, el humo de la madera, el humo del tabaco, el transporte de gasolina, los gases de escape de los vehículos de motor y las emisiones industriales. [102] Aproximadamente el 50% de la exposición total al benceno en todo el país (Estados Unidos) se debe a fumar tabaco o a la exposición al humo del tabaco. [103] Después de fumar 32 cigarrillos por día, el fumador ingeriría aproximadamente 1,8 miligramos (mg) de benceno. Esta cantidad es aproximadamente diez veces la ingesta diaria promedio de benceno de los no fumadores. [104]
El benceno inhalado se expulsa principalmente sin cambios a través de la exhalación. En un estudio realizado en seres humanos, entre el 16,4 y el 41,6 % del benceno retenido se eliminó a través de los pulmones en un plazo de cinco a siete horas después de una exposición de dos a tres horas a entre 47 y 110 ppm, y solo entre el 0,07 y el 0,2 % del benceno restante se excretó sin cambios en la orina. Después de una exposición a entre 63 y 405 mg/m3 de benceno durante 1 a 5 horas, entre el 51 y el 87 % se excretó en la orina en forma de fenol durante un período de 23 a 50 horas. En otro estudio realizado en seres humanos, el 30 % del benceno absorbido aplicado por vía dérmica, que se metaboliza principalmente en el hígado, se excretó en forma de fenol en la orina. [105]
Exposición a los refrescos
En determinadas condiciones y en presencia de otras sustancias químicas, el ácido benzoico (un conservante) y el ácido ascórbico (vitamina C) pueden interactuar para producir benceno. En marzo de 2006, la Agencia de Normas Alimentarias oficial del Reino Unido realizó un estudio de 150 marcas de refrescos y descubrió que cuatro de ellas contenían niveles de benceno superiores a los límites establecidos por la Organización Mundial de la Salud . Los lotes afectados fueron retirados de la venta. La FDA de los Estados Unidos informó de problemas similares. [106]
Contaminación del suministro de agua
En 2005, el suministro de agua a la ciudad de Harbin en China, con una población de casi nueve millones de personas, se cortó debido a una importante exposición al benceno. [107] El benceno se filtró en el río Songhua , que suministra agua potable a la ciudad, después de una explosión en una fábrica de la Corporación Nacional de Petróleo de China (CNPC) en la ciudad de Jilin el 13 de noviembre de 2005.
Cuando las tuberías de agua de plástico se exponen a altas temperaturas, el agua puede contaminarse con benceno. [108]
Genocidio
El gobierno nazi alemán utilizó benceno administrado mediante inyección como uno de sus muchos métodos para matar . [109] [110]
Véase también
- BTEX
- 1,2,3-ciclohexatrieno
- Departamento de Sindicatos Industriales contra el Instituto Americano del Petróleo
- Anillos aromáticos de seis miembros con un carbono reemplazado por otro elemento: borabinceno , silabenceno , germabenceno , estannabenceno , piridina , fosforina , arsabenceno , bismabenceno , pirilio , tiopirilio , selenopirilio , teluropirilio
Notas explicativas
- ^ Los críticos señalaron un problema con la estructura original de Kekulé (1865) para el benceno: siempre que el benceno sufriera una sustitución en la posición orto, deberían haber resultado dos isómeros distinguibles, dependiendo de si existía un enlace doble o un enlace simple entre los átomos de carbono a los que estaban unidos los sustituyentes; sin embargo, no se observaron tales isómeros. En 1872, Kekulé sugirió que el benceno tenía dos estructuras complementarias y que estas formas se interconvertían rápidamente, de modo que si había un enlace doble entre cualquier par de átomos de carbono en un instante, ese enlace doble se convertiría en un enlace simple en el siguiente instante (y viceversa). Para proporcionar un mecanismo para el proceso de conversión, Kekulé propuso que la valencia de un átomo está determinada por la frecuencia con la que colisiona con sus vecinos en una molécula. A medida que los átomos de carbono en el anillo de benceno colisionaban entre sí, cada átomo de carbono colisionaría dos veces con un vecino durante un intervalo dado y luego dos veces con su otro vecino durante el siguiente intervalo. Por lo tanto, existiría un doble enlace con un vecino durante el primer intervalo y con el otro vecino durante el siguiente intervalo. Por lo tanto, entre los átomos de carbono del benceno no habría enlaces simples o dobles fijos (es decir, constantes) y distintos; en cambio, los enlaces entre los átomos de carbono eran idénticos. Véanse las páginas 86–89 Archivado el 20 de marzo de 2020 en Wayback Machine de Auguste Kekulé (1872) "Ueber einige Condensationsprodukte des Aldehyds" (Sobre algunos productos de condensación de los aldehídos), Liebig's Annalen der Chemie und Pharmacie , 162 (1): 77–124, 309–320. De la pág. 89: "Das einfachste Mittel aller Stöße eines Kohlenstoffatoms ergiebt sich aus der Summe der Stöße der beiden ersten Zeiteinheiten, die sich dann periodisch wiederholen. … man sieht daher, daß jedes Kohlenstoffatom mit den beiden anderen, … daß diese Verschiedenheit nur eine scheinbare, aber keine wirkliche ist." (El promedio más simple de todas las colisiones de un átomo de carbono [en el benceno] proviene de la suma de las colisiones durante las primeras dos unidades de tiempo, que luego se repiten periódicamente. … así se ve que cada átomo de carbono choca con la misma frecuencia con los otros dos contra los que choca, [y] por lo tanto se encuentra exactamente en la misma relación con sus dos vecinos. La fórmula estructural usual para el benceno expresa, por supuesto, solo las colisiones que ocurren durante una unidad de tiempo, por lo tanto durante una fase, y así uno es llevado a la opinión [de que] los derivados doblemente sustituidos [del benceno] deben ser diferentes en las posiciones 1,2 y 1,6 [del anillo de benceno]. Si la idea [que se] acaba de presentar —o una similar— puede considerarse correcta, entonces [se] sigue de ello que esta diferencia [entre los enlaces en las posiciones 1,2 y 1,6] es solo aparente, no real.)
Referencias
- ^ ab Favre, Henri A.; Powell, Warren H. (2014). Nomenclatura de la química orgánica: recomendaciones de la IUPAC y nombres preferidos 2013 (Libro azul) . Cambridge: The Royal Society of Chemistry . págs. 10, 22, 204, 494, 577. doi :10.1039/9781849733069. ISBN . 978-0-85404-182-4.
- ^ Lide, DR, ed. (2005). Manual de química y física del CRC (86.ª edición). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Arnold, D.; Plank, C.; Erickson, E.; Pike, F. (1958). "Solubilidad del benceno en agua". Química industrial e ingeniería Chemical & Engineering Data Series . 3 (2): 253–256. doi :10.1021/i460004a016.
- ^ Breslow, R.; Guo, T. (1990). "Las mediciones de tensión superficial muestran que los desnaturalizantes caotrópicos que se incorporan por vía salada no son simplemente rompedores de la estructura del agua". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 87 (1): 167–9. Bibcode :1990PNAS...87..167B. doi : 10.1073/pnas.87.1.167 . PMC 53221 . PMID 2153285.
- ^ Coker, A. Kayode; Ludwig, Ernest E. (2007). Diseño de procesos aplicados de Ludwig para plantas químicas y petroquímicas. Vol. 1. Elsevier. p. 114. ISBN 978-0-7506-7766-0Archivado desde el original el 12 de marzo de 2016. Consultado el 31 de mayo de 2012 .
- ^ abcde "Benzol". Archivado desde el original el 29 de mayo de 2014. Consultado el 29 de mayo de 2014 .
- ^ ab Atherton Seidell; William F. Linke (1952). Solubilidades de compuestos inorgánicos y orgánicos: una recopilación de datos de solubilidad de la literatura periódica. Suplemento. Van Nostrand. Archivado desde el original el 2020-03-11 . Consultado el 2015-06-27 .
- ^ abc Benzene en Linstrom, Peter J.; Mallard, William G. (eds.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69 , Instituto Nacional de Estándares y Tecnología, Gaithersburg (MD) (consultado el 29 de mayo de 2014)
- ^ "Bencenio (CID 12533897". PubChem . 8 de febrero de 2007 . Consultado el 18 de septiembre de 2022 .
- ^ "Benceno (CID 5150480)". PubChem . 24 de junio de 2005 . Consultado el 18 de septiembre de 2022 .
- ^ abc Sigma-Aldrich Co., Benzene Archivado el 1 de diciembre de 2016 en Wayback Machine . Consultado el 29 de mayo de 2014.
- ^ abc Guía de bolsillo del NIOSH sobre peligros químicos. "#0049". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ Hoja de datos de seguridad del material
- ^ "Benceno". Concentraciones inmediatamente peligrosas para la vida o la salud (IDLH) . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ "Hoja informativa sobre el benceno". CDC . 2 de septiembre de 2021 . Consultado el 16 de agosto de 2023 .
- ^ Shao, Elena (28 de junio de 2022). "El gas que se introduce en los hogares por tuberías contiene benceno y otras sustancias químicas peligrosas, según un estudio". The New York Times .
- ^ La palabra "benzoína" se deriva de la expresión árabe " luban jawi ", o " incienso de Java ". Morris, Edwin T. (1984). Fragancia: La historia del perfume desde Cleopatra hasta Chanel . Charles Scribner's Sons. pág. 101. ISBN 978-0684181950.
- ^ ab Rocke, AJ (1985). "Hipótesis y experimento en el desarrollo temprano de la teoría del benceno de Kekulé". Anales de la ciencia . 42 (4): 355–81. doi :10.1080/00033798500200411.
- ^ Faraday, M. (1825). «Sobre nuevos compuestos de carbono e hidrógeno, y sobre ciertos otros productos obtenidos durante la descomposición del petróleo por calor». Philosophical Transactions of the Royal Society . 115 : 440–466. doi : 10.1098/rstl.1825.0022 . JSTOR 107752. Archivado desde el original el 21 de noviembre de 2020. Consultado el 15 de enero de 2012 . En las páginas 443-450, Faraday analiza el "bicarburo de hidrógeno" (benceno). En las páginas 449-450, muestra que la fórmula empírica del benceno es C 6 H 6 , aunque no se da cuenta de ello porque (como la mayoría de los químicos de la época) utilizó la masa atómica incorrecta para el carbono (6 en lugar de 12).
- ^ Kaiser, R. (1968). "Bicarburo de hidrógeno. Reevaluación del descubrimiento del benceno en 1825 con los métodos analíticos de 1968". Angewandte Chemie International Edition en inglés . 7 (5): 345–350. doi :10.1002/anie.196803451.
- ^ Mitscherlich, E. (1834). "Über das Benzol und die Säuren der Oel- und Talgarten" [Sobre el benzol y los ácidos grasos y oleosos]. Annalen der Pharmacie . 9 (1): 39–48. doi :10.1002/jlac.18340090103. Archivado desde el original el 23 de noviembre de 2015 . Consultado el 27 de junio de 2015 . En una nota al pie de la página 43, Liebig, el editor de la revista, sugirió cambiar el nombre original de Mitscherlich para el benceno (es decir, "benzin") a "benzol", porque el sufijo "-in" sugería que era un alcaloide (por ejemplo, Chinin (quinina)), lo que el benceno no es, mientras que el sufijo "-ol" sugería que era aceitoso, lo que el benceno sí es. Así, en la página 44, Mitscherlich afirma: "Da diese Flüssigkeit aus der Benzoësäure gewonnen wird, und wahrscheinlich mit den Benzoylverbindungen im Zusammenhang steht, so gibt man ihr am besten den Namen Benzol, da der Name Benzoïn schon für die mit dem Bittermandelöl isomerische Verbindung von Liebig. und Wöhler gewählt worden ist." (Dado que este líquido [benceno] se obtiene del ácido benzoico y probablemente esté relacionado con compuestos de benzoilo, el mejor nombre para él es "benzol", ya que Liebig y Wöhler ya eligieron el nombre "benzoína" para el compuesto que es isómero con el aceite de almendras amargas [benzaldehído].)
- ^ Laurent, (1836) "Sur la chlorophénise et les acides chlorophénisique et chlorphénèsique", Annales de Chemie et de Physique , vol. 63, págs. 27–45, véase pág. 44 Archivado el 20 de marzo de 2015 en Wayback Machine : "Je donne le nom de phène au radical fondamental des acides précédens (φαινω, j'éclaire), puisque la benzine se trouve dans le gaz de l'éclairage". (Le doy el nombre de "phène" (φαινω, ilumino) al radical fundamental de los ácidos anteriores, porque el benceno se encuentra en el gas iluminador.)
- ^ Hofmann, AW (1845). "Ueber eine sichere Reaction auf Benzol" [Sobre una prueba fiable de benceno]. Annalen der Chemie und Pharmacie (en alemán). 55 (2): 200–205, especialmente 204–205. doi :10.1002/jlac.18450550205. Archivado desde el original el 22 de noviembre de 2015.
- ^ Mansfield Charles Blachford (1849). "Untersuchung des Steinkohlentheers". Annalen der Chemie und Pharmacie . 69 (2): 162–180. doi :10.1002/jlac.18490690203. Archivado desde el original el 27 de octubre de 2015 . Consultado el 27 de junio de 2015 .
- ^ Charles Mansfield solicitó (el 11 de noviembre de 1847) y recibió (mayo de 1848) una patente (n.º 11.960) para la destilación fraccionada de alquitrán de hulla.
- ^ Hoffman, Augustus W. (1856). "Sobre el ácido insólico". Actas de la Royal Society . 8 : 1–3. doi :10.1098/rspl.1856.0002. S2CID 97105342.
La existencia y el modo de formación del ácido insólico prueban que para la serie de ácidos aromáticos monobásicos, C
n2
H
n2-8
O
4
, cuyo término más bajo conocido es el ácido benzoico, … .
[Nota: Las fórmulas empíricas de los compuestos orgánicos que aparecen en el artículo de Hofmann (p. 3) se basan en una masa atómica de carbono de 6 (en lugar de 12) y una masa atómica de oxígeno de 8 (en lugar de 16).]
- ^ Cernicharo, José; et al. (2001), "Descubrimiento de C 4 H 2 , C 6 H 2 y benceno en CRL 618 por parte del Observatorio Espacial Infrarrojo", Astrophysical Journal Letters , 546 (2): L123–L126, Bibcode :2001ApJ...546L.123C, doi : 10.1086/318871
- ^ Claus, Adolph KL (1867) "Theoretische Betrachtungen und deren Anwendungen zur Systematik der organischen Chemie" (Consideraciones teóricas y sus aplicaciones al esquema de clasificación de la química orgánica), Berichte über die Verhandlungen der Naturforschenden Gesellschaft zu Freiburg im Breisgau (Informes del Actas de la Sociedad Científica de Friburgo en Breisgau), 4 : 116–381. En la sección Aromatischen Verbindungen (compuestos aromáticos), págs. 315-347, Claus presenta la estructura hipotética de Kekulé para el benceno (p. 317), presenta objeciones a ella, presenta una geometría alternativa (p. 320) y concluye que su alternativa es correcto (pág. 326). Véanse también las figuras de la pág. 354 o pág. 379.
- ^ Dewar James (1869). «Sobre la oxidación del alcohol fenílico y un arreglo mecánico adaptado para ilustrar la estructura en los hidrocarburos no saturados». Actas de la Royal Society of Edinburgh . 6 : 82–86. doi :10.1017/S0370164600045387. Archivado desde el original el 24 de noviembre de 2015. Consultado el 27 de junio de 2015 .
- ^ Ladenburg Alberto (1869). "Bemerkungen zur aromatischen Theorie" [Observaciones sobre la teoría aromática]. Berichte der Deutschen Chemischen Gesellschaft . 2 : 140–142. doi :10.1002/cber.18690020171. Archivado desde el original el 22 de noviembre de 2015 . Consultado el 27 de junio de 2015 .
- ^ ab Kekulé, FA (1865). "Sur la constitución de sustancias aromáticas". Boletín de la Société Chimique de París . 3 : 98–110. Archivado desde el original el 14 de noviembre de 2015 . Consultado el 27 de junio de 2015 .En la página 100, Kekulé sugiere que los átomos de carbono del benceno podrían formar una "cadena fermée" (cadena cerrada).
- ^ Aug. Kekulé (1872), "Ueber einige Condensationsproducte des Aldehyds" (PDF) , Annalen der Chemie und Pharmacie (en alemán), vol. 162, núm. 1, págs. 77–124, doi :10.1002/jlac.18721620110
- ^ Armstrong Henry E (1887). "Una explicación de las leyes que gobiernan la sustitución en el caso de compuestos bencenoides". Journal of the Chemical Society . 51 : 258–268 [264]. doi :10.1039/ct8875100258. Archivado desde el original el 22 de octubre de 2015 . Consultado el 27 de junio de 2015 .
- ^ En su artículo de 1890, Armstrong representó los núcleos de benceno dentro de los bencenoides policíclicos colocando dentro de los núcleos de benceno una letra "C", una abreviatura de la palabra "céntrico". Las afinidades céntricas (es decir, los enlaces) actuaban dentro de un ciclo designado de átomos de carbono. De la p. 102: "... el benceno, según este punto de vista, puede estar representado por un anillo doble, de hecho". Véase:
- Armstrong, HE (1890). «La estructura de los hidrocarburos cicloides». Actas de la Chemical Society . 6 : 101–105. Archivado desde el original el 2021-11-16 . Consultado el 2018-02-17 .
- Armit, James Wilson; Robinson, Robert (1925). "Tipos aromáticos heterocíclicos polinucleares. Parte II. Algunas bases de anhidronio". Journal of the Chemical Society, Transactions . 127 : 1604–1618. doi :10.1039/ct9252701604.
- ^ Adolf Baeyer (1888), "Über die Constitution des Benzols", Justus Liebigs Annalen der Chemie (en alemán), vol. 245, núm. 1–2, págs. 103–190, doi :10.1002/jlac.18882450110
- ^ Thiele, Johannes (1899) "Zur Kenntnis der ungesättigten Verbindungen" (Sobre nuestro conocimiento de los compuestos insaturados), Annalen der Chemie de Justus Liebig 306 : 87-142; ver: "VIII. Die aromatischen Verbindungen. Das Benzol". (VIII. Los compuestos aromáticos. Benceno.), págs. 125-129. Archivado el 10 de marzo de 2020 en Wayback Machine. Ver más: Thiele (1901) "Zur Kenntnis der ungesättigen Verbindungen", archivado el 26 de diciembre de 2021 en Wayback Machine Annalen der Chemie de Justus Liebig , 319 : 129-143.
- ^ Loschmidt, J. (1861). Chemische Studien (en alemán). Viena, Austria-Hungría: Carl Gerold's Sohn. pp. 30, 65. Archivado desde el original el 7 de mayo de 2016. Consultado el 27 de junio de 2015 .
- ^ Kekulé, FA (1866). "Untersuchungen über aromatische Verbindungen (Investigaciones de compuestos aromáticos)". Liebigs Annalen der Chemie und Pharmacie . 137 (2): 129–36. doi :10.1002/jlac.18661370202. Archivado desde el original el 26 de diciembre de 2021 . Consultado el 25 de diciembre de 2021 .
- ^ Rocke, AJ (2010). Imagen y realidad: Kekule, Kopp y la imaginación científica. University of Chicago Press. pp. 186–227. ISBN 978-0226723358Archivado desde el original el 27 de julio de 2020. Consultado el 15 de mayo de 2020 .
- ^ Read, John (1995). De la alquimia a la química . Nueva York: Dover Publications. pp. 179–180. ISBN 9780486286907.
- ^ Traducción al inglés Wilcox, David H.; Greenbaum, Frederick R. (1965). "La teoría del anillo de benceno de Kekulé: un tema para bromas desenfadadas". Revista de educación química . 42 (5): 266–67. Código Bibliográfico :1965JChEd..42..266W. doi :10.1021/ed042p266.
- ^ Kekulé, FA (1890). "Benzolfest: Rede". Berichte der Deutschen Chemischen Gesellschaft . 23 : 1302–11. doi :10.1002/cber.189002301204. Archivado desde el original el 16 de mayo de 2007 . Consultado el 12 de marzo de 2007 .
- ^ Benfey OT (1958). "August Kekulé y el nacimiento de la teoría estructural de la química orgánica en 1858". Revista de educación química . 35 (1): 21–23. Bibcode :1958JChEd..35...21B. doi :10.1021/ed035p21.
- ^ Gillis Jean (1966). "Auguste Kekulé et son oeuvre, réalisée à Gand de 1858 à 1867". Mémoires de la Classe des Sciences - Académie Royale des Sciences, des Lettres et des Beaux-arts de Belgique . 37 (1): 1–40.
- ^ Lonsdale, K. (1929). "La estructura del anillo de benceno en el hexametilbenceno". Actas de la Royal Society . 123A (792): 494–515. Bibcode :1929RSPSA.123..494L. doi : 10.1098/rspa.1929.0081 .
- ^ Lonsdale, K. (1931). "An X-Ray Analysis of the Structure of Hexachlorobenzene, Using the Fourier Method". Actas de la Royal Society . 133A (822): 536–553. Código Bibliográfico :1931RSPSA.133..536L. doi : 10.1098/rspa.1931.0166 . Archivado desde el original el 2021-03-19 . Consultado el 2007-03-12 .
- ^ Ramos-Figueroa, Josseline (21 de mayo de 2021). «Conoce a Kathleen Lonsdale, la física y reformadora de prisiones que descifró el código del benceno». Massive Science . Consultado el 1 de marzo de 2022 .
- ^ Wilhelm Körner (1867) "Faits pour servir à la détermination du lieu chimique dans la série aromatique" Archivado el 7 de julio de 2017 en Wayback Machine (Datos que se utilizarán para determinar la ubicación química en la serie aromática), Bulletins de l' Académie royale des sciences, des lettres et des beaux-arts de Belgique , segunda serie, 24 : 166–185; ver especialmente p. 169. De la pág. 169: "On distingue facilement ces trois séries, dans lesquelles les dérivés bihidroxiliques ont leurs Terms correspondientes, par les préfixes ortho-, para- et mêta-". (Se distinguen fácilmente estas tres series – en las que los derivados dihidroxi tienen sus términos correspondientes – por los prefijos orto-, para- y meta-.)
- ^ Hermann von Fehling, ed., Neues Handwörterbuch der Chemie [Nuevo diccionario conciso de química] (Braunschweig, Alemania: Friedrich Vieweg und Sohn, 1874), vol. 1, pág. 1142.
- ^ Graebe (1869) "Ueber die Constitution des Naphthalins" Archivado el 28 de noviembre de 2015 en archive.today (Sobre la estructura de la naftaleno), Annalen der Chemie und Pharmacie , 149 : 20-28; ver especialmente p. 26.
- ^ Victor Meyer (1870) "Untersuchungen über die Constitution der zweifach-substituirten Benzole" Archivado el 23 de octubre de 2015 en archive.today (Investigaciones sobre la estructura de los bencenos disustituidos), Annalen der Chemie und Pharmacie , 156 : 265–301 ; véanse especialmente las págs. 299-300.
- ^ Williams, PRD; Knutsen, JS; Atkinson, C.; Madl, AK; Paustenbach, DJ (2007). "Concentraciones de benceno en el aire asociadas con el uso histórico de algunas formulaciones de líquido Wrench". Revista de higiene ocupacional y ambiental . 4 (8): 547–561. doi :10.1080/15459620701446642. PMID 17558801. S2CID 32311057.
- ^ ab Hillis O. Folkins (2005). "Benceno". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a03_475. ISBN 978-3527306732.
- ^ Chang, Kenneth (7 de junio de 2018). "¿Vida en Marte? El último descubrimiento del rover la pone 'sobre la mesa'". The New York Times . Archivado desde el original el 28 de mayo de 2019. Consultado el 8 de junio de 2018.
La identificación de moléculas orgánicas en rocas del planeta rojo no necesariamente apunta a la existencia de vida allí, pasada o presente, pero sí indica que algunos de los componentes básicos estaban presentes.
- ^ ten Kate, Inge Loes (8 de junio de 2018). "Moléculas orgánicas en Marte". Science . 360 (6393): 1068–1069. Bibcode :2018Sci...360.1068T. doi :10.1126/science.aat2662. hdl : 1874/366378 . PMID 29880670. S2CID 46952468.
- ^ Eigenbrode, Jennifer L.; et al. (8 de junio de 2018). «Materia orgánica preservada en lutitas de 3 mil millones de años en el cráter Gale, Marte» (PDF) . Science . 360 (6393): 1096–1101. Bibcode :2018Sci...360.1096E. doi : 10.1126/science.aas9185 . PMID 29880683. S2CID 46983230. Archivado (PDF) del original el 25 de agosto de 2021 . Consultado el 4 de enero de 2021 .
- ^ Bacon, GE; Curry, N.; Wilson, S. (12 de mayo de 1964). "Un estudio cristalográfico del benceno sólido por difracción de neutrones". Actas de la Royal Society de Londres, Serie A . 279 (1376): 98–110. Bibcode :1964RSPSA.279...98B. doi :10.1098/rspa.1964.0092. ISSN 2053-9169. JSTOR 2414835. S2CID 94432897.
- ^ Moran D, Simmonett AC, Leach FE, Allen WD, Schleyer PV, Schaefer HF (2006). "Métodos teóricos populares predicen que el benceno y los arenos no son planos". Revista de la Sociedad Química Estadounidense . 128 (29): 9342–3. doi :10.1021/ja0630285. PMID 16848464.
- ^ Cooper, David L.; Gerratt, Joseph; Raimondi, Mario (1986). "La estructura electrónica de la molécula de benceno". Nature . 323 (6090): 699–701. Código Bibliográfico :1986Natur.323..699C. doi :10.1038/323699a0. S2CID 24349360.
- ^ Pauling, Linus (1987). "Estructura electrónica de la molécula de benceno". Nature . 325 (6103): 396. Bibcode :1987Natur.325..396P. doi : 10.1038/325396d0 . S2CID 4261220.
- ^ Messmer, Richard P.; Schultz, Peter A. (1987). "La estructura electrónica de la molécula de benceno". Nature . 329 (6139): 492. Bibcode :1987Natur.329..492M. doi : 10.1038/329492a0 . S2CID 45218186.
- ^ Harcourt, Richard D. (1987). "La estructura electrónica de la molécula de benceno". Nature . 329 (6139): 491–492. Código Bibliográfico :1987Natur.329..491H. doi :10.1038/329491b0. S2CID 4268597.
- ^ "Carácter Unicode 'ANILLO DE BENCENO' (U+232C)". fileformat.info . Archivado desde el original el 19 de febrero de 2009 . Consultado el 16 de enero de 2009 .
- ^ "Carácter Unicode 'ANILLO DE BENCENO CON CÍRCULO' (U+23E3)". fileformat.info . Archivado desde el original el 2009-07-03 . Consultado el 2009-01-16 .
- ^ "Química heterocíclica: compuestos heterocíclicos". Universidad Estatal de Michigan , Departamento de Química. Archivado desde el original el 6 de abril de 2016. Consultado el 8 de julio de 2016 .
- ^ Ali, MA; Haji, Shaker; Al-Khayyat, Mohammed; Abutaleb, Ahmed; Ahmed, Shakeel (1 de diciembre de 2022). "Modelado cinético y análisis termodinámico de la reacción de desproporción de tolueno sobre catalizadores basados en ZSM-5". Catalysis Communications . 172 : 106541. doi : 10.1016/j.catcom.2022.106541 . ISSN 1566-7367.
- ^ Browne, Malcolm W. (16 de agosto de 1988), "Una molécula omnipresente es capturada en una fotografía", The New York Times , archivado del original el 12 de agosto de 2021 , consultado el 13 de agosto de 2021
- ^ "Estudio de mercado: benceno (2.ª edición), Ceresana, agosto de 2014". ceresana.com. Archivado desde el original el 2017-12-21 . Consultado el 2015-02-10 .
- ^ "Estudio de mercado: Tolueno, Ceresana, enero de 2015". ceresana.com. Archivado desde el original el 2017-04-29 . Consultado el 2015-02-10 .
- ^ Kolmetz, Gentry, Pautas para la modernización de BTX, Conferencia de primavera de AIChE 2007
- ^ "Control de contaminantes atmosféricos peligrosos procedentes de fuentes móviles". Agencia de Protección Ambiental de Estados Unidos. 29 de marzo de 2006. pág. 15853. Archivado desde el original el 5 de diciembre de 2008. Consultado el 27 de junio de 2008 .
- ^ Stranks, DR; ML Heffernan; KC Lee Dow; PT McTigue; GRA Withers (1970). Química: una visión estructural . Carlton, Victoria : Melbourne University Press. p. 347. ISBN 978-0-522-83988-3.
- ^ Welch, Vincent A.; Fallon, Kevin J.; Gelbke, Heinz-Peter (2005). "Etilbenceno". Enciclopedia de química industrial de Ullmann . doi :10.1002/14356007.a10_035.pub2. ISBN 3527306730.
- ^ Kasper, Dennis L. et al. (2004) Principios de medicina interna de Harrison , 16.ª ed., McGraw-Hill Professional, pág. 618, ISBN 0071402357 .
- ^ Manual Merck, Home Edition Archivado el 29 de septiembre de 2011 en Wayback Machine , "Descripción general de la leucemia".
- ^ Bard, D (2014). "Contaminación del aire relacionada con el tráfico y aparición de infarto de miocardio: ¿se descubre que el benceno es un desencadenante? Un estudio de casos cruzados en áreas pequeñas". PLOS ONE . 9 (6): 6. Bibcode :2014PLoSO...9j0307B. doi : 10.1371/journal.pone.0100307 . PMC 4059738 . PMID 24932584.
- ^ ab Smith, Martyn T. (2010). "Avances en la comprensión de los efectos del benceno sobre la salud y la susceptibilidad". Annu Rev Public Health . 31 : 133–48. doi :10.1146/annurev.publhealth.012809.103646. PMC 4360999 . PMID 20070208.
- ^ Instituto Americano del Petróleo, Revisión toxicológica API, Benceno, septiembre de 1948, Agencia para Sustancias Tóxicas y Registro de Enfermedades, Departamento de Salud y Servicios Humanos
- ^ Smith, Martyn T. (1 de enero de 2010). "Avances en la comprensión de los efectos del benceno sobre la salud y la susceptibilidad". Revista anual de salud pública . 31 (1): 133–148. doi : 10.1146/annurev.publhealth.012809.103646 . PMC 4360999 . PMID 20070208.
- ^ OMS. Agencia Internacional para la Investigación sobre el Cáncer , Monografías del IARC sobre la evaluación de los riesgos carcinógenos para los seres humanos, Evaluaciones generales de carcinogenicidad: una actualización de las monografías del IARC Archivado el 6 de marzo de 2008 en Wayback Machine , Volúmenes 1 a 42, Suplemento 7
- ^ Huff J (2007). "Cánceres inducidos por benceno: historia abreviada e impacto en la salud ocupacional". Int J Occup Environ Health . 13 (2): 213–21. doi :10.1179/oeh.2007.13.2.213. PMC 3363002 . PMID 17718179.
- ^ Rana SV; Verma Y (2005). "Toxicidad bioquímica del benceno". J Environ Biol . 26 (2): 157–68. PMID 16161967.
- ^ Agencia para Sustancias Tóxicas y Registro de Enfermedades. (2007) Benceno: Hoja de información para el paciente. Archivado el 15 de diciembre de 2014 en Wayback Machine.
- ^ Yardley-Jones, A.; Anderson, D.; Parke, D.V. (1991). "La toxicidad del benceno y su metabolismo y patología molecular en la evaluación del riesgo humano". British Journal of Industrial Medicine . 48 (7): 437–44. doi :10.1136/oem.48.7.437. PMC 1035396 . PMID 1854646.
- ^ Normas de seguridad y salud ocupacional, Sustancias tóxicas y peligrosas, 1910.1028 Archivado el 29 de junio de 2015 en Wayback Machine . Osha.gov. Consultado el 23 de noviembre de 2011.
- ^ Declaración de salud pública sobre el benceno, Agencia para Sustancias Tóxicas y Registro de Enfermedades. (Agosto de 2007). Benceno: hoja de información para pacientes Archivado el 28 de mayo de 2010 en Wayback Machine . Atsdr.cdc.gov (3 de marzo de 2011). Consultado el 23 de noviembre de 2011.
- ^ "Contaminantes del agua potable | Sustancias químicas orgánicas | Benceno". Agencia de Protección Ambiental de los Estados Unidos (EPA). Archivado desde el original el 2 de febrero de 2015. Consultado el 17 de abril de 2014 .
- ^ ab "Información sobre muestreo químico del benceno". Administración de Seguridad y Salud Ocupacional (OSHA). Archivado desde el original el 29 de junio de 2015. Consultado el 23 de noviembre de 2011 .
- ^ "Toxicidad del benceno: normas y reglamentaciones". Agencia para el Registro de Sustancias Tóxicas y Enfermedades (ATSDR); Medicina ambiental y educación en salud ambiental – CSEM. 30 de junio de 2000. Archivado desde el original el 10 de junio de 2010. Consultado el 9 de octubre de 2010 .
- ^ ab "Lógica de selección de respiradores de NIOSH" (PDF) . Cincinnati, Ohio: Departamento de Salud y Servicios Humanos de los Estados Unidos (DHHS), Servicio de Salud Pública, Centros para el Control de Enfermedades (CDC), Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH). Octubre de 2004. Archivado desde el original (PDF) el 29 de agosto de 2017.publicación No. 2005-100.
- ^ "Documentación sobre concentraciones inmediatamente peligrosas para la vida o la salud (IDLH): Introducción". Centros para el Control y la Prevención de Enfermedades (CDC). Archivado desde el original el 22 de julio de 2012. Consultado el 23 de noviembre de 2011 .
- ^ "Declaración de salud pública sobre el benceno". Agencia para Sustancias Tóxicas y Registro de Enfermedades . Departamento de Salud y Servicios Humanos de los Estados Unidos, Servicio de Salud Pública, Centros para el Control de Enfermedades, Instituto Nacional de Seguridad y Salud Ocupacional. Agosto de 2007. Archivado desde el original el 20 de enero de 2012. Consultado el 23 de noviembre de 2011 , a través de Atsdr.cdc.gov.
- ^ Ashley, DL; Bonin, MA; Cardinali, FL; McCraw, JM; Wooten, JV (1994). "Concentraciones sanguíneas de compuestos orgánicos volátiles en una población estadounidense expuesta no ocupacionalmente y en grupos con exposición sospechada" (PDF) . Química clínica . 40 (7 Pt 2): 1401–4. doi :10.1093/clinchem/40.7.1401. PMID 8013127. Archivado (PDF) desde el original el 22 de noviembre de 2011 . Consultado el 25 de agosto de 2010 .
- ^ Fustinoni S, Buratti M, Campo L, Colombi A, Consonni D, Pesatori AC, Bonzini M, Farmer P, Garte S, Valerio F, Merlo DF, Bertazzi PA (2005). "Ácido t,t-mucónico urinario, ácido S-fenilmercaptúrico y benceno como biomarcadores de baja exposición al benceno". Interacciones químico-biológicas . 153–154: 253–6. Bibcode :2005CBI...153..253F. doi :10.1016/j.cbi.2005.03.031. PMID 15935823.
- ^ ACGIH (2009). TLV y BEI de 2009. Conferencia Americana de Higienistas Industriales Gubernamentales, Cincinnati, Ohio.
- ^ Baselt, R. (2008) Disposición de fármacos y productos químicos tóxicos en el hombre , 8.ª edición, Biomedical Publications, Foster City, CA, págs. 144-148, ISBN 0962652377 .
- ^ Snyder, R; Hedli, CC (1996). "Una visión general del metabolismo del benceno". Environ Health Perspect . 104 (Supl 6): 1165–1171. doi :10.1289/ehp.96104s61165. PMC 1469747 . PMID 9118888.
- ^ Dougherty, D; Garte, S; Barchowsky, A; Zmuda, J; Taioli, E (2008). "Polimorfismos de NQO1, MPO, CYP2E1, GSTT1 y STM1 y efectos biológicos de la exposición al benceno: una revisión de la literatura". Toxicology Letters . 182 (1–3): 7–17. doi :10.1016/j.toxlet.2008.09.008. PMID 18848868.
- ^ Fracasso ME, Doria D, Bartolucci GB, Carrieri M, Lovreglio P, Ballini A, Soleo L, Tranfo G, Manno M (2010). "Niveles bajos de benceno en el aire: correlación entre biomarcadores de exposición y efectos genotóxicos". Toxicol Lett . 192 (1): 22–8. doi :10.1016/j.toxlet.2009.04.028. PMID 19427373.
- ^ Eastmond, DA; Rupa, DS; Hasegawa, LS (2000). "Detección de hiperdiploidía y rotura cromosómica en linfocitos humanos en interfase tras la exposición al metabolito del benceno hidroquinona mediante hibridación in situ con fluorescencia multicolor con sondas de ADN". Mutat Res . 322 (1): 9–20. doi :10.1016/0165-1218(94)90028-0. PMID 7517507.
- ^ Garte, S; Taioli, E; Popov, T; Bolognesi, C; Farmer, P; Merlo, F (2000). "Susceptibilidad genética a la toxicidad del benceno en humanos". J Toxicol Environ Health A . 71 (22): 1482–1489. doi :10.1080/15287390802349974. PMID 18836923. S2CID 36885673.
- ^ Preguntas frecuentes sobre toxicidad del benceno, Agencia para Sustancias Tóxicas y el Registro de Enfermedades, Departamento de Salud y Servicios Humanos
- ^ ToxGuide for Benzene Archivado el 28 de mayo de 2010 en Wayback Machine , Agencia para Sustancias Tóxicas y Registro de Enfermedades, Departamento de Salud y Servicios Humanos
- ^ Declaración de salud pública. Benceno Archivado el 27 de mayo de 2010 en Wayback Machine , División de Toxicología y Medicina Ambiental, agosto de 2007
- ^ Benceno, CASRN: 71-43-2 Archivado el 22 de octubre de 2011 en Wayback Machine . Banco de datos de sustancias peligrosas, Biblioteca Nacional de Medicina de EE. UU., Institutos Nacionales de Salud.
- ^ "FDA: Demasiado benceno en algunas bebidas", CBS News , 19 de mayo de 2006. Consultado el 11 de julio de 2006.
- ^ "100 toneladas de contaminantes derramadas en un río chino". The Guardian . 25 de noviembre de 2005. Archivado desde el original el 10 de marzo de 2020 . Consultado el 7 de enero de 2020 .
- ^ Isaacson, Kristofer P.; Proctor, Caitlin R.; Wang, Q. Erica; Edwards, Ethan Y.; Noh, Yoorae; Shah, Amisha D.; Whelton, Andrew J. (2021). "Contaminación del agua potable por la degradación térmica de los plásticos: implicaciones para la respuesta a incendios forestales y estructurales". Ciencias ambientales: investigación y tecnología del agua . 7 (2): 274–284. doi : 10.1039/D0EW00836B .
- ^ "Selecciones e inyecciones letales". Museo Estatal de Auschwitz-Birkenau . Archivado desde el original el 9 de mayo de 2020. Consultado el 15 de mayo de 2020 .
- ^ "Un antiguo campo de trabajo nazi en Austria, ahora considerado un sitio turístico". Haaretz . 3 de mayo de 2019. Archivado desde el original el 11 de mayo de 2019 . Consultado el 11 de mayo de 2019 .
Enlaces externos
Benceno (categoría)
- Benceno en la Tabla Periódica de Vídeos (Universidad de Nottingham)
- Ficha internacional de seguridad química 0015
- Resumen de la EPA de los Estados Unidos sobre toxicidad del benceno
- Guía de bolsillo del NIOSH sobre peligros químicos
- Benceno de PubChem
- Departamento de Salud y Servicios Humanos: TR-289: Estudios de toxicología y carcinogénesis del benceno
- Podcast de vídeo de Sir John Cadogan dando una conferencia sobre el benceno desde Faraday, en 1991
- Perfil de la sustancia
- Banco de datos de sustancias peligrosas de la NLM: benceno






![Modificación de Kekulé de su teoría de 1865 en 1872, que ilustra la alternancia rápida de enlaces dobles[nota 1]](http://upload.wikimedia.org/wikipedia/commons/thumb/f/f8/Historic_Benzene_Formulae_Kekul%C3%A9_%28original%29.png/519px-Historic_Benzene_Formulae_Kekul%C3%A9_%28original%29.png)