Tiazol
| |||
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido 1,3-tiazol | |||
| Otros nombres Tiazol | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.005.475 | ||
Identificador de centro de PubChem |
| ||
| UNIVERSIDAD | |||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| C3H3NS | |||
| Masa molar | 85,12 g·mol −1 | ||
| Punto de ebullición | 116 a 118 °C (241 a 244 °F; 389 a 391 K) | ||
| Acidez (p K a ) | 2,5 (de ácido conjugado) [1] | ||
| -50,55·10 −6 cm3 / mol | |||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
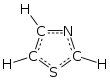
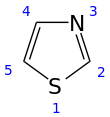
El tiazol ( /ˈθaɪ.əzoʊl/ ) , o 1,3-tiazol , es un compuesto heterocíclico de 5 miembros que contiene azufre y nitrógeno. El término "tiazol" también se refiere a una gran familia de derivados. El tiazol en sí es un líquido amarillo pálido con un olor similar a la piridina y la fórmula molecular C3H3NS . [ 2] El anillo de tiazol es notable como un componente de la vitamina tiamina ( B1 ) .
Estructura molecular y electrónica
Los tiazoles son miembros de los azoles , heterociclos que incluyen imidazoles y oxazoles . El tiazol también puede considerarse un grupo funcional cuando forma parte de una molécula más grande.
Los tiazoles, al ser planos, se caracterizan por una deslocalización significativa de los electrones pi y tienen cierto grado de aromaticidad , más que los oxazoles correspondientes . Esta aromaticidad se evidencia por el desplazamiento químico de los protones del anillo en el espectro de RMN de 1 H , que absorben entre 7,27 y 8,77 ppm, lo que indica una fuerte corriente de anillo diamagnética . La densidad de electrones pi calculada marca a C5 como el sitio primario para la sustitución electrofílica y a C2-H como susceptible a la desprotonación.
Presencia de tiazoles y sales de tiazolio

Los tiazoles se encuentran en una variedad de productos especializados, a menudo fusionados con derivados del benceno, los llamados benzotiazoles. Además de la vitamina B 1 , el anillo de tiazol se encuentra en el epotilona . Otros derivados importantes del tiazol son los benzotiazoles , por ejemplo, la sustancia química de la luciérnaga luciferina . Mientras que los tiazoles están bien representados en biomoléculas , los oxazoles no lo están. Se encuentra en péptidos naturales y se utiliza en el desarrollo de peptidomiméticos (es decir, moléculas que imitan la función y la estructura de los péptidos). [3]
Los tiazoles de importancia comercial incluyen principalmente colorantes y fungicidas . La tifluzamida, el triciclazol y el tiabendazol se comercializan para el control de diversas plagas agrícolas. Otro derivado de tiazol ampliamente utilizado es el fármaco antiinflamatorio no esteroide meloxicam . Los siguientes colorantes de antroquinona contienen subunidades de benzotiazol: amarillo de algol 8 (CAS# [6451-12-3]), amarillo de algol GC (CAS# [129-09-9]), indanthren rubina B (CAS# [6371-49-9]), azul de indanthren CLG (CAS# [6371-50-2] y azul de indanthren CLB (CAS# [6492-78-0]). Estos colorantes de tiazol se utilizan para teñir algodón .
Síntesis
Existen varios métodos de laboratorio para la síntesis orgánica de tiazoles. Destaca la síntesis de tiazol de Hantzsch, que es una reacción entre halocetonas y tioamidas . Por ejemplo, el 2,4-dimetiltiazol se sintetiza a partir de tioacetamida y cloroacetona . [4] En la síntesis de Cook-Heilbron , los tiazoles surgen por la condensación de α-aminonitrilo con disulfuro de carbono . Se puede acceder a los tiazoles por acilación de 2-aminotiolatos, a menudo disponibles mediante la reacción de Herz .
Biosíntesis
Los tiazoles se forman generalmente a través de reacciones de cisteína , que proporciona la estructura NCCS del anillo. Sin embargo, la tiamina no se ajusta a este patrón. Varias rutas de biosíntesis conducen al anillo de tiazol, tal como se requiere para la formación de tiamina. [5] El azufre del tiazol se deriva de la cisteína. En las bacterias anaeróbicas, el grupo CN se deriva de la deshidroglicina.
Reacciones
Con un pKa de 2,5 para el ácido conjugado, los tiazoles son mucho menos básicos que el imidazol (pKa = 7). [6]
La desprotonación con bases fuertes ocurre en C2-H. La carga negativa en esta posición se estabiliza como un iluro . Las bases de Hauser y los compuestos de organolitio reaccionan en este sitio, reemplazando el protón. Los 2-litiotiazoles también se generan por intercambio de metal-halógeno a partir del 2-bromotiazol. [7]
Sustitución aromática electrofílica en C5 pero requiere grupos activadores como un grupo metilo , como se ilustra en la bromación :
La oxidación en nitrógeno produce el N -óxido de tiazol aromático ; existen muchos agentes oxidantes, como el mCPBA ; uno nuevo es el ácido hipofluoroso preparado a partir de flúor y agua en acetonitrilo ; parte de la oxidación tiene lugar en azufre, lo que produce sulfóxido / sulfona no aromáticos : [8] Los N -óxidos de tiazol son útiles en las arilaciones de CH catalizadas por paladio, donde el N -óxido puede cambiar la reactividad para favorecer de manera confiable la posición 2, y permite que estas reacciones se lleven a cabo en condiciones mucho más suaves. [9]
- Los tiazoles son sintones formilados ; la conversión de R-tia al aldehído R-CHO se lleva a cabo, [7] respectivamente, con yoduro de metilo ( N -metilación), reducción orgánica con borohidruro de sodio e hidrólisis con cloruro de mercurio (II) en agua.
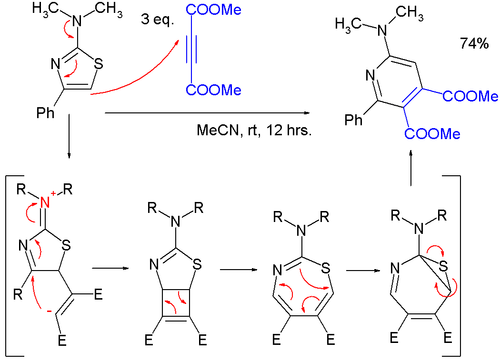
- Los tiazoles pueden reaccionar en cicloadiciones , pero en general a altas temperaturas debido a la estabilización aromática favorable del reactivo; las reacciones de Diels-Alder con alquinos son seguidas por la extrusión de azufre, y el producto final es una piridina ; en un estudio, [10] se encontró que una reacción muy suave de un 2-(dimetilamino)tiazol con dimetil acetilendicarboxilato (DMAD) a una piridina procedía a través de un intermedio zwitteriónico en una [2+2]cicloadición formal a un ciclobuteno, luego a una 1,3-tiazepina en una apertura de anillo electrocíclico de 4 electrones y luego a un 7-tia-2-azanorcaradieno en un anillo electrocíclico de 6 electrones, cerrando antes de extruir el átomo de azufre.
Sales de tiazolio
La alquilación de tiazoles en nitrógeno forma un catión tiazolio . Las sales de tiazolio son catalizadores en la reacción de Stetter y la condensación de benzoína . La desprotonación de las sales de N -alquil tiazolio produce carbenos libres [11] y complejos de carbenos de metales de transición .
Alagebrium es un fármaco a base de tiazolio.
Referencias
- ^ Zoltewicz, JA; Deady, LW (1978). "Cuaternización de compuestos heteroaromáticos: aspectos cuantitativos". Avances en química heterocíclica , volumen 22. Vol. 22. págs. 71–121. doi :10.1016/S0065-2725(08)60103-8. ISBN 9780120206223.
- ^ Eicher, T.; Hauptmann, S. (2003). La química de los heterociclos: estructura, reacciones, síntesis y aplicaciones . Wiley. ISBN 978-3-527-30720-3.
- ^ Mak, Jeffrey YW; Xu, Weijun; Fairlie, David P. (1 de enero de 2015). Peptidomiméticos I (PDF) . Temas de química heterocíclica. Vol. 48. Springer Berlin Heidelberg. págs. 235–266. doi :10.1007/7081_2015_176. ISBN. 978-3-319-49117-2.
- ^ George Schwarz (1945). "2,4-Dimetiltiazol". Síntesis orgánicas . 25 : 35. doi :10.15227/orgsyn.025.0035.
- ^ Kriek, M.; Martins, F.; Leonardi, R.; Fairhurst, SA; Lowe, DJ; Roach, PL (2007). "Tiazol sintetasa de Escherichia coli: una investigación de los sustratos y proteínas purificadas necesarias para la actividad in vitro" (PDF) . J. Biol. Chem . 282 (24): 17413–17423. doi : 10.1074/jbc.M700782200 . PMID 17403671.
- ^ Thomas L. Gilchrist (1997). Química heterocíclica (3.ª ed.). Essex, Inglaterra: Addison Wesley. pág. 414. ISBN 0-582-27843-0.
- ^ ab Dondoni, A.; Merino, P. (1995). "Homologación diastereoselectiva de acetónido de D-(R)-gliceraldehído utilizando 2-(trimetilsilil)tiazol". 72 : 21. doi :10.15227/orgsyn.072.0021.
{{cite journal}}: Requiere citar revista|journal=( ayuda ) - ^ Amir, E.; Rozen, S. (2006). "Acceso fácil a la familia de N -óxidos de tiazol utilizando HOF·CH 3 CN". Chemical Communications . 2006 (21): 2262–2264. doi :10.1039/b602594c. PMID 16718323.
- ^ Campeau, Louis-Charles; Bertrand-Laperle, Mégan; Leclerc, Jean-Philippe; Villemure, Elisia; Gorelsky, Serge; Fagnou, Keith (1 de marzo de 2008). "Arilación directa de N-óxidos de azol C2, C5 y C4, incluidas las reacciones a temperatura ambiente". Journal of the American Chemical Society . 130 (11): 3276–3277. doi :10.1021/ja7107068. ISSN 0002-7863. PMID 18302383.
- ^ Alajarín, M.; Cabrera, J.; Pastor, A.; Sánchez-Andrada, P.; Bautista, D. (2006). "Sobre la cicloadición [2+2] de 2-aminotiazoles y dimetil acetilendicarboxilato. Evidencia experimental y computacional de una apertura térmica disrotatoria del anillo de ciclobutenos fusionados". J. Org. Chem. 71 (14): 5328–5339. doi :10.1021/jo060664c. PMID 16808523.
- ^ Arduengo, AJ; Goerlich, JR; Marshall, WJ (1997). "Un tiazol-2-ilideno estable y su dímero". Liebigs Annalen . 1997 (2): 365–374. doi :10.1002/jlac.199719970213.