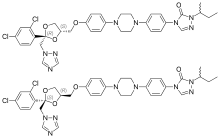
Itraconazol
 | |
| Datos clínicos | |
|---|---|
| Nombres comerciales | Sporanox, Sporaz, Orungal, otros |
| Otros nombres | ZIT |
| AHFS / Drogas.com | Monografía |
| MedlinePlus | a692049 |
| Datos de licencia |
|
Categoría de embarazo |
|
| Vías de administración | Por vía oral , solución ), óvulo vaginal , intravenoso. |
| Código ATC |
|
| Estatus legal | |
| Estatus legal |
|
| Datos farmacocinéticos | |
| Biodisponibilidad | ~55%, máximo si se toma con una comida completa |
| Unión de proteínas | 99,8% |
| Metabolismo | Amplio en el hígado ( CYP3A4 ) |
| Metabolitos | Hidroxi-itraconazol, ceto-itraconazol, N -desalquil-itraconazol [4] |
| Vida media de eliminación | 21 horas |
| Excreción | Riñón (35%), heces (54%) [5] |
| Identificadores | |
| |
| Número CAS | |
| Identificador de centro de PubChem |
|
| Banco de medicamentos | |
| Araña química | |
| UNIVERSIDAD |
|
| BARRIL | |
| EBICh | |
| Química biológica | |
| Panel de control CompTox ( EPA ) |
|
| Tarjeta informativa de la ECHA | 100.123.596 |
| Datos químicos y físicos | |
| Fórmula | C35H38Cl2N8O4 |
| Masa molar | 705,64 g·mol −1 |
| Modelo 3D ( JSmol ) |
|
| Quiralidad | Mezcla racémica |
| Punto de fusión | 165 [6] °C (329 °F) |
| Solubilidad en agua | 7,8 ± 0,4 × 10 −6 mol/L (pH 1,6) [6] mg/mL (20 °C) |
| |
| (verificar) | |
El itraconazol , a veces abreviado como ITZ , es un medicamento antimicótico que se utiliza para tratar una serie de infecciones fúngicas . [7] Esto incluye aspergilosis , blastomicosis , coccidioidomicosis , histoplasmosis y paracoccidioidomicosis . [7] Puede administrarse por vía oral o intravenosa . [7]
Los efectos secundarios comunes incluyen náuseas, diarrea, dolor abdominal, sarpullido y dolor de cabeza. [7] Los efectos secundarios graves pueden incluir problemas hepáticos , insuficiencia cardíaca , síndrome de Stevens-Johnson y reacciones alérgicas , incluida la anafilaxia . [7] No está claro si el uso durante el embarazo o la lactancia es seguro. [1] Pertenece a la familia de medicamentos de los triazoles . [7] Detiene el crecimiento de los hongos al afectar la membrana celular o afectar su metabolismo . [7]
El itraconazol fue patentado en 1978 y aprobado para uso médico en los Estados Unidos en 1992. [7] [8] Está en la Lista de Medicamentos Esenciales de la Organización Mundial de la Salud . [9]
Trabajos de investigación recientes sugieren que el itraconazol (ITZ) también podría usarse en el tratamiento del cáncer al inhibir la vía hedgehog [10] de manera similar al sonidegib .
Usos médicos
El itraconazol tiene un espectro de actividad más amplio que el fluconazol (pero no tan amplio como el voriconazol o el posaconazol ). En particular, es activo contra Aspergillus , a diferencia del fluconazol. También está autorizado para su uso en blastomicosis , esporotricosis , histoplasmosis y onicomicosis . El itraconazol se une a las proteínas en más del 99% y prácticamente no penetra en el líquido cefalorraquídeo . Por lo tanto, no debe utilizarse para tratar la meningitis u otras infecciones del sistema nervioso central . [11] Según la Guía de Abx de Johns Hopkins, tiene una "penetración insignificante en el LCR, sin embargo el tratamiento ha sido exitoso para la meningitis criptocócica y coccidioidal". [12]
También se prescribe para infecciones sistémicas, como aspergilosis , candidiasis y criptococosis , donde otros medicamentos antimicóticos son inadecuados o ineficaces. [ cita requerida ]
El itraconazol se ha explorado como un agente anticancerígeno para pacientes con carcinoma de células basales , cáncer de pulmón de células no pequeñas y cáncer de próstata . [13] Por ejemplo, en un estudio de fase II que involucraba a hombres con cáncer de próstata avanzado, el itraconazol en dosis altas (600 mg/día) se asoció con respuestas significativas del PSA y un retraso en la progresión del tumor. El itraconazol también mostró actividad en un ensayo de fase II en hombres con cáncer de pulmón de células no pequeñas cuando se combinó con el agente de quimioterapia, pemetrexed. [14] [15] [16] Una revisión reciente también destaca su uso tópico y oral junto con otros agentes quimioterapéuticos para carcinomas de células basales avanzados y metastásicos que no se pueden tratar quirúrgicamente. [17]
Formularios disponibles
El itraconazol se produce en cápsulas azules de 22 mm (0,87 pulgadas) con diminutos gránulos azules de 1,5 mm (0,059 pulgadas) en su interior. Cada cápsula contiene 100 mg y normalmente se toma dos veces al día en intervalos de doce horas. La marca Sporanox de itraconazol ha sido desarrollada y comercializada por Janssen Pharmaceutica , una subsidiaria de Johnson & Johnson . [ cita requerida ] La estructura de tres capas de estas cápsulas azules es compleja porque el itraconazol es insoluble y es sensible al pH. El complicado procedimiento no solo requiere una máquina especializada para crearlo, sino que también el método utilizado tiene problemas de fabricación. Además, la píldora es bastante grande, lo que dificulta que muchos pacientes la traguen. Partes de los procesos de creación de Sporanox fueron descubiertos por la patente coreana abierta al público No. 10-2001-2590. [18] Los diminutos gránulos azules contenidos en la cápsula se fabrican en Beerse, Bélgica . [18] [19]
La solución oral se absorbe mejor. La ciclodextrina contenida en la solución oral puede causar diarrea osmótica y, si esto es un problema, se puede administrar la mitad de la dosis como solución oral y la otra mitad como cápsula para reducir la cantidad de ciclodextrina administrada. [ cita requerida ] Las cápsulas de itraconazol "Sporanox" siempre deben tomarse con alimentos, ya que esto mejora la absorción, sin embargo, los fabricantes de "Lozanoc" afirman que se puede tomar "sin tener en cuenta las comidas". [20] La solución oral de itraconazol debe tomarse una hora antes de la comida o dos horas después de la comida (y lo mismo si se utiliza una combinación de cápsulas y solución oral). El itraconazol se puede tomar con jugo de naranja o cola , ya que la absorción también mejora con el ácido. La absorción de itraconazol se altera cuando se toma con un antiácido, un bloqueador H2 o un inhibidor de la bomba de protones . [ cita requerida ]
Efectos secundarios
El itraconazol es un fármaco relativamente bien tolerado (aunque no tan bien como el fluconazol o el voriconazol ) y la gama de efectos adversos que produce es similar a la de otros antimicóticos azólicos: [21]
- Se encuentran niveles elevados de alanina aminotransferasa en el 4% de las personas que toman itraconazol.
- “riesgo pequeño pero real” de desarrollar insuficiencia cardíaca congestiva [21]
- Insuficiencia hepática, a veces mortal
La ciclodextrina que se utiliza para elaborar el jarabe puede causar diarrea. Los efectos secundarios que pueden indicar un problema mayor incluyen: [ cita requerida ]
Interacciones
Los siguientes medicamentos no deben tomarse con itraconazol: [22]
Farmacología
Farmacodinamia
El mecanismo de acción del itraconazol es el mismo que el de otros antimicóticos azólicos : inhibe la síntesis de ergosterol mediada por hongos , a través de la inhibición de la lanosterol 14α-desmetilasa . Debido a su capacidad para inhibir el citocromo P450 3A4 CC-3, se debe tener precaución al considerar interacciones con otros medicamentos. [24]
El itraconazol es farmacológicamente distinto de otros agentes antimicóticos azólicos en que es el único inhibidor de esta clase que ha demostrado inhibir tanto la vía de señalización hedgehog [25] [26] como la angiogénesis . [27] [28] Estas actividades distintas no están relacionadas con la inhibición de la lanosterol 14 alfa-desmetilasa del citocromo P450 y los objetivos moleculares exactos responsables siguen sin identificarse. Funcionalmente, se ha demostrado que la actividad antiangiogénica del itraconazol está relacionada con la inhibición de la glucosilación, la fosforilación de VEGFR 2, [28] el tráfico [29] y las vías de biosíntesis del colesterol. [27] La evidencia sugiere que los determinantes estructurales para la inhibición de la señalización hedgehog por itraconazol son reconociblemente diferentes de los asociados con la actividad antiangiogénica. [30]
Farmacocinética
El itraconazol, al igual que la ciclosporina , la quinidina y la claritromicina , puede inhibir la glucoproteína P , lo que provoca interacciones farmacológicas al reducir la eliminación y aumentar la absorción de fármacos de cationes orgánicos. Con las preparaciones convencionales de itraconazol, los niveles séricos pueden variar mucho entre pacientes, lo que a menudo da como resultado concentraciones séricas inferiores al índice terapéutico. [31] Por lo tanto, se ha recomendado convencionalmente que los pacientes tomen itraconazol después de una comida rica en grasas en lugar de antes de comer. [32] [33]
Un producto (Lozanoc) autorizado a través del procedimiento descentralizado de la Unión Europea [34] tiene una mayor biodisponibilidad , una menor sensibilidad a la ingestión concomitante de alimentos y, por lo tanto, una menor variabilidad de los niveles séricos.
Química

La molécula de itraconazol tiene tres carbonos quirales . Los dos centros quirales en el anillo de dioxolano están fijos entre sí, y los sustituyentes del anillo de dioxolano triazolometileno y ariloximetileno siempre están en cis entre sí. La formulación clínica es una mezcla 1:1:1:1 de cuatro estereoisómeros (dos pares enantioméricos). [35] [36]

Historia
El itraconazol fue aprobado para uso médico en los Estados Unidos en 1992. [37]
Fue designado medicamento huérfano tanto por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) como por la Agencia Europea de Medicamentos (EMA). [38] [39] [40] [41] [42]
Referencias
- ^ ab "Uso de itraconazol durante el embarazo". Drugs.com . 20 de marzo de 2019 . Consultado el 15 de mayo de 2020 .
- ^ "Lista de todos los medicamentos con advertencias de recuadro negro obtenida por la FDA (use los enlaces Descargar resultados completos y Ver consulta)". nctr-crs.fda.gov . FDA . Consultado el 22 de octubre de 2023 .
- ^ "Sporanox 10 mg/mL Solución oral - Resumen de las características del producto (RCP)". (emc) . 1 de febrero de 2018 . Consultado el 15 de mayo de 2020 .
- ^ Isoherranen N, Kunze KL, Allen KE, Nelson WL, Thummel KE (octubre de 2004). "Papel de los metabolitos de itraconazol en la inhibición de CYP3A4". Metabolismo y disposición de fármacos . 32 (10): 1121–1131. doi :10.1124/dmd.104.000315. PMID 15242978. S2CID 6941636.
- ^ "Cápsulas de Sporanox (itraconazol). Información completa sobre prescripción" (PDF) . Janssen Pharmaceuticals, Inc. Archivado desde el original (PDF) el 17 de mayo de 2018 . Consultado el 28 de agosto de 2016 .
- ^ ab Vasilev NA, Surov AO, Voronin AP, Drozd KV, Perlovich GL (abril de 2021). "Nuevos cocristales de itraconazol: perspectivas a partir de diagramas de fases, termodinámica de formación y solubilidad". Revista internacional de farmacia . 599 : 120441. doi :10.1016/j.ijpharm.2021.120441. PMID 33675927. S2CID 232135660.
- ^ abcdefgh "Itraconazol". Sociedad Estadounidense de Farmacéuticos de Sistemas de Salud . Consultado el 8 de diciembre de 2017 .
- ^ Fischer J, Ganellin CR (2006). Descubrimiento de fármacos basado en análogos. John Wiley & Sons. pág. 503. ISBN 9783527607495.
- ^ Organización Mundial de la Salud (2019). Lista modelo de medicamentos esenciales de la Organización Mundial de la Salud: 21.ª lista , 2019. Ginebra: Organización Mundial de la Salud. hdl : 10665/325771 . OMS/MVP/EMP/IAU/2019.06. Licencia: CC BY-NC-SA 3.0 IGO.
- ^ Li K, Fang D, Xiong Z, Luo R (2019). "Inhibición de la vía hedgehog para el tratamiento del cáncer con itraconazol". OncoTargets and Therapy . 12 : 6875–6886. doi : 10.2147/OTT.S223119 . PMC 6711563 . PMID 31692536.
- ^ Gilbert DN, Moellering, RC, Eliopoulos GM, Sande MA (2006). Guía de Sanford para la terapia antimicrobiana . Antimicrobial Therapy, Incorporated. ISBN 978-1-930808-30-0.[ página necesaria ]
- ^ Pham P, Bartlett JG (24 de julio de 2007). "Itraconazol". Johns Hopkins. Archivado desde el original el 28 de noviembre de 2007.
- ^ "Resultados de la búsqueda de itraconazol". ClinicalTrials.gov . Institutos Nacionales de Salud de EE. UU . .
- ^ Aftab BT, Dobromilskaya I, Liu JO, Rudin CM (2011). "El itraconazol inhibe la angiogénesis y el crecimiento tumoral en el cáncer de pulmón de células no pequeñas". Cancer Research . 71 (21): 6764–6772. doi :10.1158/0008-5472.CAN-11-0691. PMC 3206167 . PMID 21896639.
- ^ Antonarakis ES, Heath EI, Smith DC, Rathkopf D, Blackford AL, Danila DC, King S, Frost A, Ajiboye AS, Zhao M, Mendonca J, Kachhap SK, Rudek MA, Carducci MA (2013). "Reutilización del itraconazol como tratamiento para el cáncer de próstata avanzado: un ensayo de fase II aleatorizado no comparativo en hombres con cáncer de próstata metastásico resistente a la castración". The Oncologist . 18 (2): 163–173. doi :10.1634/theoncologist.2012-314. PMC 3579600 . PMID 23340005.
- ^ Rudin CM, Brahmer JR, Juergens RA, Hann CL, Ettinger DS, Sebree R, Smith R, Aftab BT, Huang P, Liu JO (mayo de 2013). "Estudio de fase 2 de pemetrexed e itraconazol como terapia de segunda línea para el cáncer de pulmón no microcítico no escamoso metastásico". Journal of Thoracic Oncology . 8 (5): 619–623. doi :10.1097/JTO.0b013e31828c3950. PMC 3636564 . PMID 23546045.
- ^ Ip KH, McKerrow K (2021). "Itraconazol en el tratamiento del carcinoma basocelular: una revisión de casos de la literatura". Revista Australasiana de Dermatología . 62 (3): 394–397. doi :10.1111/ajd.13655. PMID 34160824. S2CID 235608763.
- ^ ab US 20050226924, Lee KH, Park ES, Chi SC, "Composición que comprende itraconazol para administración oral", publicada el 13 de octubre de 2005, asignada a FDL Inc.
- ^ "Sporanox (cápsulas de itraconazol)" (PDF) . Janssen . Junio de 2006. Archivado desde el original (PDF) el 5 de julio de 2008.
- ^ "Tecnología de biodisponibilidad SUBA". Mayne Pharma Group.
- ^ ab "Seguridad de las cápsulas de Sporanox y los comprimidos de Lamisil para el tratamiento de la onicomicosis". Aviso de salud pública de la FDA. 9 de mayo de 2001. Archivado desde el original el 28 de mayo de 2009. Consultado el 10 de agosto de 2006 .
- ^ "Cápsulas de Sporanox (itraconazol)". Cambios en el etiquetado de seguridad aprobados por el Centro de Evaluación e Investigación de Medicamentos de la FDA . Administración de Alimentos y Medicamentos de los Estados Unidos (FDA). Archivado desde el original el 26 de octubre de 2016. Consultado el 16 de diciembre de 2019 .
- ^ Tsimogianni AM, Andrianakis I, Betrosian A, Douzinas E (julio de 2011). "Paro cardíaco provocado por la interacción entre itraconazol y amiodarona: informe de un caso". Journal of Medical Case Reports . 5 : 333. doi : 10.1186/1752-1947-5-333 . PMC 3161953 . PMID 21801420.
- ^ Trevor AJ, Katzung BG, Kruidering-Hall M (2015). Farmacología de Katzung y Trevor: examen y revisión por parte de la junta (undécima edición). Nueva York: McGraw Hill Medical. pág. 397. ISBN 978-0-07-182635-8.
- ^ Kim J, Tang JY, Gong R, Kim J, Lee JJ, Clemons KV, Chong CR, Chang KS, Fereshteh M, Gardner D, Reya T, Liu JO, Epstein EH, Stevens DA, Beachy PA (2010). "Itraconazol, un antimicótico de uso común que inhibe la actividad de la vía Hedgehog y el crecimiento del cáncer". Cancer Cell . 17 (4): 388–99. doi :10.1016/j.ccr.2010.02.027. PMC 4039177 . PMID 20385363.
- ^ Kim J, Aftab BT, Tang JY, Kim D, Lee AH, Rezaee M, Kim J, Chen B, King EM, Borodovsky A, Riggins GJ, Epstein EH, Beachy PA, Rudin CM (2013). "El itraconazol y el trióxido de arsénico inhiben la activación de la vía hedgehog y el crecimiento tumoral asociado con la resistencia adquirida a los antagonistas smoothened". Cancer Cell . 23 (1): 23–34. doi :10.1016/j.ccr.2012.11.017. PMC 3548977 . PMID 23291299.
- ^ ab Chong CR, Xu J, Lu J, Bhat S, Sullivan DJ, Liu JO (2007). "Inhibición de la angiogénesis por el fármaco antimicótico itraconazol". ACS Chemical Biology . 2 (4): 263–70. doi :10.1021/cb600362d. PMID 17432820.
- ^ ab Aftab BT, Dobromilskaya I, Liu JO, Rudin CM (2011). "El itraconazol inhibe la angiogénesis y el crecimiento tumoral en el cáncer de pulmón de células no pequeñas". Cancer Research . 71 (21): 6764–72. doi :10.1158/0008-5472.CAN-11-0691. PMC 3206167 . PMID 21896639.
- ^ Xu J, Dang Y, Ren YR, Liu JO (2010). "El tráfico de colesterol es necesario para la activación de mTOR en las células endoteliales". Actas de la Academia Nacional de Ciencias . 107 (10): 4764–9. Bibcode :2010PNAS..107.4764X. doi : 10.1073/pnas.0910872107 . PMC 2842052 . PMID 20176935.
- ^ Shi W, Nacev BA, Aftab BT, Head S, Rudin CM, Liu JO (2011). "Análogos de la cadena lateral de itraconazol: estudios de la relación estructura-actividad para la inhibición de la proliferación de células endoteliales, la glicosilación del receptor 2 del factor de crecimiento endotelial vascular (VEGFR2) y la señalización Hedgehog". Journal of Medicinal Chemistry . 54 (20): 7363–74. doi :10.1021/jm200944b. PMC 3307530 . PMID 21936514.
- ^ Patterson TF, Peters J, Levine SM, Anzueto A, Bryan CL, Sako EY, Miller OL, Calhoon JH, Rinaldi MG (1996). "Disponibilidad sistémica de itraconazol en el trasplante de pulmón". Antimicrob. Agentes Chemother . 40 (9): 2217–20. doi : 10.1128/AAC.40.9.2217. PMC 163504. PMID 8878612.
- ^ Fraga Fuentes MD, García Díaz B, de Juana Velasco P, Bermejo Vicedo MT (1997). "[Influencia de los alimentos en la absorción de agentes antimicrobianos]". Nutr Hosp (en español). 12 (6): 277–88. PMID 9477653.
- ^ Barone JA, Koh JG, Bierman RH, Colaizzi JL, Swanson KA, Gaffar MC, Moskovitz BL, Mechlinski W, Van de Velde V (1993). "Interacción con alimentos y farmacocinética en estado estacionario de cápsulas de itraconazol en voluntarios varones sanos". Antimicrob. Agentes Chemother . 37 (4): 778–84. doi :10.1128/aac.37.4.778. PMC 187759. PMID 8388198 .
- ^ "Cápsulas duras de Lozanoc 50 mg (itraconazol)" (PDF) . Informe de evaluación pública Procedimiento descentralizado . Agencia Reguladora de Medicamentos y Productos Sanitarios del Reino Unido.
- ^ Kunze KL, Nelson WL, Kharasch ED, Thummel KE, Isoherranen N (abril de 2006). "Aspectos estereoquímicos del metabolismo del itraconazol in vitro e in vivo". Metabolismo y disposición de fármacos . 34 (4): 583–590. doi :10.1124/dmd.105.008508. PMID 16415110. S2CID 189994.
- ^ "Itraconazol en Drugs.com". Drugs.com . Consultado el 28 de agosto de 2016 .
- ^ "Itraconazol: medicamentos aprobados por la FDA". Administración de Alimentos y Medicamentos de Estados Unidos (FDA) . Consultado el 15 de mayo de 2020 .
- ^ "Designación de medicamento huérfano de itraconazol". Administración de Alimentos y Medicamentos de Estados Unidos (FDA) . 19 de mayo de 2016. Consultado el 15 de mayo de 2020 .
- ^ "Designación de medicamento huérfano de itraconazol". Administración de Alimentos y Medicamentos de Estados Unidos (FDA) . 16 de agosto de 2016. Consultado el 15 de mayo de 2020 .
- ^ "Designación de medicamento huérfano de itraconazol". Administración de Alimentos y Medicamentos de Estados Unidos (FDA) . 30 de octubre de 2008. Consultado el 15 de mayo de 2020 .
- ^ «EU/3/17/1901». Agencia Europea de Medicamentos (EMA) . 23 de agosto de 2017. Consultado el 15 de mayo de 2020 .
- ^ «UE/3/18/2024». Agencia Europea de Medicamentos (EMA) . 25 de mayo de 2018. Consultado el 15 de mayo de 2020 .


