Ácido sulfónico

En química orgánica , el ácido sulfónico (o ácido sulfónico ) se refiere a un miembro de la clase de compuestos organosulfurados con la fórmula general R−S(=O) 2 −OH , donde R es un grupo alquilo o arilo orgánico y el grupo S(=O) 2 (OH) un hidróxido de sulfonilo . [1] Como sustituyente, se le conoce como grupo sulfo . Un ácido sulfónico puede considerarse como ácido sulfúrico con un grupo hidroxilo reemplazado por un sustituyente orgánico . El compuesto original (con el sustituyente orgánico reemplazado por hidrógeno) es el ácido sulfónico original, HS(=O) 2 (OH) , un tautómero del ácido sulfuroso , S(=O)(OH) 2 . [a] Las sales o ésteres de ácidos sulfónicos se denominan sulfonatos .
Preparación

Los ácidos arilsulfónicos se producen mediante el proceso de sulfonación . Normalmente, el agente sulfonante es el trióxido de azufre . Una aplicación a gran escala de este método es la producción de ácidos alquilbencenosulfónicos :
En esta reacción, el trióxido de azufre es un electrófilo y el areno es el nucleófilo. La reacción es un ejemplo de sustitución aromática electrófila . [1]
Los ácidos alquilsulfónicos se pueden preparar mediante muchos métodos. En la sulfoxidación , los alcanos se irradian con una mezcla de dióxido de azufre y oxígeno . Esta reacción se emplea industrialmente para producir ácidos alquilsulfónicos, que se utilizan como surfactantes . [2]
La reacción directa de los alcanos con trióxido de azufre generalmente no es útil, excepto para la conversión del ácido metanosulfónico en ácido metanodisulfónico .
Muchos ácidos alcanosulfónicos pueden obtenerse mediante la adición de bisulfito a los alquenos terminales. El bisulfito también puede ser alquilado por haluros de alquilo : [2]
Los ácidos sulfónicos se pueden preparar por oxidación de tioles :
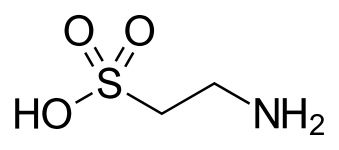
Esta vía es la base de la biosíntesis de la taurina .
Rutas de hidrólisis
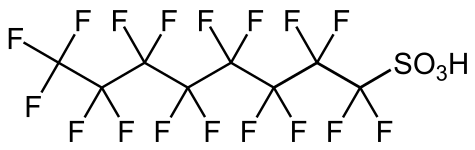
Muchos ácidos sulfónicos se preparan por hidrólisis de haluros de sulfonilo y precursores relacionados. Así, el ácido perfluorooctanosulfónico se prepara por hidrólisis del fluoruro de sulfonilo, que a su vez se genera por electrofluoración del ácido octanosulfónico. De manera similar, el cloruro de sulfonilo derivado del polietileno se hidroliza al ácido sulfónico. Estos cloruros de sulfonilo se producen por reacciones de radicales libres de cloro, dióxido de azufre y los hidrocarburos utilizando la reacción de Reed .
El ácido vinilsulfónico se deriva de la hidrólisis del sulfato de carbilo , ( C 2 H 4 (SO 3 ) 2 ), que a su vez se obtiene mediante la adición de trióxido de azufre al etileno .
Propiedades
Los ácidos sulfónicos son ácidos fuertes. Se citan comúnmente como alrededor de un millón de veces más fuertes que el ácido carboxílico correspondiente . Por ejemplo, el ácido p -toluenosulfónico y el ácido metanosulfónico tienen valores de p K a de −2,8 y −1,9, respectivamente, mientras que los del ácido benzoico y el ácido acético son 4,20 y 4,76, respectivamente. Sin embargo, como consecuencia de su fuerte acidez, sus valores de p K a no se pueden medir directamente, y los valores citados comúnmente deben considerarse como estimaciones indirectas con incertidumbres significativas. Por ejemplo, varias fuentes han informado que el p K a del ácido metanosulfónico es tan alto como −0,6 [3] o tan bajo como −6,5 [4] . Se sabe que los ácidos sulfónicos reaccionan con cloruro de sodio sólido ( sal ) para formar el sulfonato de sodio y cloruro de hidrógeno. [5] Esta propiedad implica una acidez de dos o tres órdenes de magnitud de la del HCl (g) , cuyo p K a fue determinado recientemente con precisión (p K aq = −5,9). [ cita requerida ]
Debido a su polaridad, los ácidos sulfónicos tienden a ser sólidos cristalinos o líquidos viscosos de alto punto de ebullición. Por lo general, también son incoloros y no oxidantes, [6] lo que los hace adecuados para su uso como catalizadores ácidos en reacciones orgánicas. Su polaridad, junto con su alta acidez, hace que los ácidos sulfónicos de cadena corta sean solubles en agua, mientras que los de cadena más larga exhiben propiedades similares a las de los detergentes.
La estructura de los ácidos sulfónicos se ilustra con el prototipo, el ácido metanosulfónico . El grupo del ácido sulfónico, RSO 2 OH, presenta un centro de azufre tetraédrico, lo que significa que el azufre está en el centro de cuatro átomos: tres oxígenos y un carbono. La geometría general del centro de azufre recuerda a la forma del ácido sulfúrico .
- Ácidos sulfónicos y sulfonatos representativos
- Taurina , un ácido biliar y uno de los pocos ácidos sulfónicos que se encuentran en la naturaleza (se muestra en un tautómero poco común ).
- PFOS , un surfactante y un contaminante controvertido.
- Ácido p -toluenosulfónico , un reactivo ampliamente utilizado en síntesis orgánica.
- Nafion , un ácido sulfónico polimérico útil en pilas de combustible .
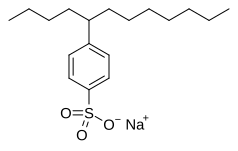
- Dodecilbencenosulfonato de sodio , un tensioactivo de alquilbencenosulfonato utilizado en detergentes para ropa .
- La coenzima M es un cofactor necesario para la biosíntesis del metano , que se encuentra en el gas natural .
Aplicaciones
Se conocen tanto los ácidos alquilsulfónicos como los arilsulfónicos, y la mayoría de las aplicaciones a gran escala están asociadas con los derivados aromáticos.
Detergentes y tensioactivos
Los detergentes y surfactantes son moléculas que combinan grupos altamente no polares y altamente polares. Tradicionalmente, los jabones son los surfactantes más populares, ya que se derivan de ácidos grasos . Desde mediados del siglo XX, el uso de ácidos sulfónicos ha superado al del jabón en las sociedades avanzadas. Por ejemplo, se estima que anualmente se producen 2 mil millones de kilogramos de alquilbencenosulfonatos para diversos fines. Los sulfonatos de lignina, producidos por sulfonación de lignina, son componentes de fluidos de perforación y aditivos en ciertos tipos de hormigón . [7]
Tintes
Muchos, si no la mayoría, de los colorantes antraquinónicos se producen o procesan mediante sulfonación. [8] Los ácidos sulfónicos tienden a unirse fuertemente a las proteínas y los carbohidratos . La mayoría de los colorantes "lavables" son ácidos sulfónicos (o tienen el grupo sulfonilo funcional en ellos) por esta razón. El ácido p-cresidinasulfónico se utiliza para fabricar colorantes alimentarios.
Catalizadores ácidos
Al ser ácidos fuertes, los ácidos sulfónicos también se utilizan como catalizadores . Los ejemplos más simples son el ácido metanosulfónico , CH3SO2OH y el ácido p - toluenosulfónico , que se utilizan regularmente en química orgánica como ácidos que son lipofílicos (solubles en disolventes orgánicos). Los ácidos sulfónicos poliméricos también son útiles. La resina Dowex son derivados del ácido sulfónico del poliestireno y se utilizan como catalizadores y para el intercambio iónico ( ablandamiento del agua ). Nafion , un ácido sulfónico polimérico fluorado, es un componente de las membranas de intercambio de protones en las pilas de combustible . [9]
Drogas

Los medicamentos a base de sulfamidas , una clase de antibacterianos, se producen a partir de ácidos sulfónicos.

Lignosulfonatos
En el proceso de sulfito para la fabricación de papel, la lignina se elimina de la lignocelulosa mediante el tratamiento de virutas de madera con soluciones de iones de sulfito y bisulfito. Estos reactivos rompen los enlaces entre los componentes de celulosa y lignina y, especialmente, dentro de la propia lignina. La lignina se convierte en lignosulfonatos , ionómeros útiles , que son solubles y se pueden separar de las fibras de celulosa.

Reacciones
La reactividad del grupo del ácido sulfónico es tan extensa que es difícil resumirla. [10]
Hidrólisis a fenoles
Cuando se tratan con una base fuerte, los derivados del ácido bencenosulfónico se convierten en fenoles. [11]
- C6H5SO3H + 2NaOH → C6H5OH + Na2SO3 + H2O
En este caso el sulfonato se comporta como un grupo saliente pseudohaluro.
Desulfonación hidrolítica
Los ácidos arilsulfónicos son susceptibles a la hidrólisis, la reacción inversa de la sulfonación:
- R − C6H4SO3H + H2O → R − C6H5 + H2SO4
Mientras que el ácido bencenosulfónico se hidroliza por encima de los 200 °C, muchos derivados son más fáciles de hidrolizar. Por lo tanto, el calentamiento de ácidos arilsulfónicos en ácido acuoso produce el areno original. Esta reacción se emplea en varios escenarios. En algunos casos, el ácido sulfónico sirve como un grupo protector solubilizante en agua, como lo ilustra la purificación del para-xileno a través de su derivado de ácido sulfónico. En la síntesis de 2,6-diclorofenol , el fenol se convierte en su derivado de ácido 4-sulfónico, que luego clora selectivamente en las posiciones que flanquean al fenol. La hidrólisis libera el grupo de ácido sulfónico. [12]
Esterificación
Los ácidos sulfónicos se pueden convertir en ésteres . Esta clase de compuestos orgánicos tiene la fórmula general R−SO 2 −OR. Los ésteres sulfónicos, como el triflato de metilo, se consideran buenos agentes alquilantes en la síntesis orgánica . Dichos ésteres sulfónicos se preparan a menudo mediante alcoholisis de los cloruros de sulfonilo:
- RSO2Cl + R′OH → RSO2OR ′ + HCl
Halogenación
Los grupos de haluro de sulfonilo (R−SO 2 −X) se producen mediante la cloración de ácidos sulfónicos utilizando cloruro de tionilo . Los fluoruros de sulfonilo se pueden producir mediante el tratamiento de ácidos sulfónicos con tetrafluoruro de azufre : [13]
- SF4 + RSO3H → SOF2 + RSO2F + HF
Desplazamiento por hidróxido
Aunque fuerte, el enlace (aril)C−SO 3 − puede romperse mediante reactivos nucleofílicos. De importancia histórica y continua es la α-sulfonación de la antroquinona seguida del desplazamiento del grupo sulfonato por otros nucleófilos, que no pueden instalarse directamente. [8] Un método temprano para producir fenol implicaba la hidrólisis básica del bencenosulfonato de sodio , que puede generarse fácilmente a partir del benceno. [14]
- C 6 H 5 SO 3 Na + NaOH → C 6 H 5 OH + Na 2 SO 3
Las condiciones para esta reacción son duras, sin embargo, requiriendo 'álcali fundido' o hidróxido de sodio fundido a 350 °C para el ácido bencenosulfónico en sí. [15] A diferencia del mecanismo para la hidrólisis alcalina fundida del clorobenceno, que procede a través de eliminación-adición ( mecanismo de bencina ), el ácido bencenosulfónico experimenta la conversión análoga por un mecanismo S N Ar, como lo revela un etiquetado de 14 C, a pesar de la falta de sustituyentes estabilizadores. [16] Los ácidos sulfónicos con grupos atractores de electrones (por ejemplo, con sustituyentes NO 2 o CN) experimentan esta transformación mucho más fácilmente.
o-Litiación
Los ácidos arilsulfónicos reaccionan con dos equivalentes de butil litio para dar lugar a los derivados de orto-litio, es decir, orto-litiación . Estos compuestos de dilitio están preparados para reaccionar con muchos electrófilos. [10]
Notas
- ^ Ni el ácido sulfónico ni el ácido sulfuroso originales han sido aislados o incluso observados, aunque el monoanión de estas especies hipotéticas existe en solución como una mezcla de equilibrio de tautómeros: HS(=O) 2 (O − ) ⇌ S(=O)(OH)(O − ) .
Referencias
- ^ ab March, Jerry (1992), Química orgánica avanzada: reacciones, mecanismos y estructura (4.ª ed.), Nueva York: Wiley, ISBN 0-471-60180-2
- ^ ab Kosswig, Kurt (2000). "Ácidos sulfónicos alifáticos". Ullmann's Encyclopedia of Industrial Chemistry . Weinheim: Wiley-VCH. doi :10.1002/14356007.a25_503. ISBN 3-527-30673-0.
- ^ Bordwell, Frederick G. (1988). "Acidez de equilibrio en solución de dimetilsulfóxido". Accounts of Chemical Research . 21 (12): 456–463. doi :10.1021/ar00156a004. ISSN 0001-4842.
- ^ Smith, Michael; March, Jerry (2007). Química orgánica avanzada de March: reacciones, mecanismos y estructura (6.ª ed.). Hoboken, NJ: Wiley-Interscience. ISBN 978-1-61583-842-4.OCLC 708034394 .
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart G. (enero de 2012). Química orgánica (2.ª ed.). Oxford: Oxford University Press. ISBN 978-0-19-166621-6.OCLC 867050415 .
- ^ Gernon, Michael D.; Wu, Min; Buszta, Thomas; Janney, Patrick (1999). "Beneficios ambientales del ácido metanosulfónico". Química verde . 1 (3): 127–140. doi :10.1039/A900157C. ISSN 1463-9262.
- ^ Kosswig, K. "Surfactantes" en Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. doi :10.1002/14356007.a25_747.
- ^ ab Bien, Hans-Samuel; Stawitz, Josef; Wunderlich, Klaus (2002). "Tintes e intermedios de antraquinona". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a02_355. ISBN 978-3527306732.
- ^ Busca, Guido (2007). "Catalizadores ácidos en la química industrial de hidrocarburos". Chem. Rev. 107 ( 11): 5366–5410. doi :10.1021/cr068042e. PMID 17973436.
- ^ ab Tanaka, Kazuhiko (1991). "Ácidos sulfónicos, ésteres, amidas y haluros como sintones". En Saul Patai (ed.). Ácidos sulfónicos, ésteres y sus derivados (1991) . PATAI'S Chemistry of Functional Groups. págs. 401–452. doi :10.1002/0470034394.ch11. ISBN 978-0-470-03439-2.
- ^ WW Hartman (1923). " p -Cresol". Síntesis orgánicas . 3 : 37. doi :10.15227/orgsyn.003.0037.
- ^ Otto Lindner; Lars Rodefeld (2005). "Ácidos bencenosulfónicos y sus derivados". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a03_507. ISBN . 978-3527306732.
- ^ Boswell, GA; Ripka, WC; Scribner, RM; Tullock, CW (2011). "Fluoración por tetrafluoruro de azufre". Reacciones orgánicas . págs. 1–124. doi :10.1002/0471264180.or021.01. ISBN 978-0-471-26418-7.
- ^ Manfred Weber, Markus Weber, Michael Kleine-Boymann "Fenol" en Ullmann's Encyclopedia of Industrial Chemistry 2004, Wiley-VCH. doi :10.1002/14356007.a19_299.pub2.
- ^ Bunnett, Joseph F.; Zahler, Roland E. (1 de octubre de 1951). "Reacciones de sustitución nucleofílica aromática". Chemical Reviews . 49 (2): 273–412. doi :10.1021/cr60153a002. ISSN 0009-2665.
- ^ Oae, Shigeru; Furukawa, Naomichi; Kise, Masahiro; Kawanishi, Mitsuyoshi (1966). "El mecanismo de la fusión alcalina del ácido bencenosulfónico". Boletín de la Sociedad Química de Japón . 39 (6): 1212–1216. doi : 10.1246/bcsj.39.1212 .