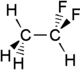
1,1-Difluoroetano
| |||
 | |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido 1,1-Difluoroetano | |||
Otros nombres
| |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| Química biológica | |||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.000.788 | ||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| C2H4F2 | |||
| Masa molar | 66,05 g/mol | ||
| Densidad | 900 g/L a 25 °C | ||
| Punto de fusión | -117 °C (-179 °F; 156 K) | ||
| Punto de ebullición | -24,7 °C (-12,5 °F; 248,5 K) | ||
| Punto crítico ( T , P ) | 113,45 °C | ||
| 0,54 % a 0 °C | |||
| Presión de vapor |
| ||
| Viscosidad | 8,87 μPa·s (0,00887 cP) a 25 °C | ||
| Peligros | |||
| Seguridad y salud en el trabajo (SST/OHS): | |||
Principales peligros | Extremadamente inflamable | ||
| Etiquetado SGA : | |||
  | |||
| Peligro | |||
| NFPA 704 (rombo cortafuegos) | |||
| Ficha de datos de seguridad (FDS) | SDS para 1,1-difluoroetano | ||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El 1,1 -difluoroetano , o DFE , es un compuesto organofluorado con la fórmula química C2H4F2 . Este gas incoloro se utiliza como refrigerante , donde a menudo se lo menciona como R-152a (refrigerante-152a) o HFC-152a ( hidrofluorocarbono - 152a ) . También se utiliza como propulsor para aerosoles y en productos para espolvorear con gas . Como alternativa a los clorofluorocarbonos , tiene un potencial de agotamiento de la capa de ozono de cero, un potencial de calentamiento global menor (124) y una vida atmosférica más corta (1,4 años). [2] [3]
Producción
El 1,1-difluoroetano es una sustancia sintética que se produce mediante la adición catalizada por mercurio de fluoruro de hidrógeno al acetileno : [4]
- HCCH + 2HF → CH3CHF2
El intermedio en este proceso es el fluoruro de vinilo ( C2H3F ) , el precursor monomérico del fluoruro de polivinilo .
Usos
Con un índice de potencial de calentamiento global (GWP) relativamente bajo de 124 y propiedades termofísicas favorables, el 1,1-difluoroetano se ha propuesto como una alternativa ecológica al R134a . A pesar de su inflamabilidad, el R152a también presenta presiones de operación y capacidad de enfriamiento volumétrico (VCC) similares al R134a, por lo que se puede utilizar en enfriadores de gran tamaño [5] o en aplicaciones más particulares como intercambiadores de calor con aletas de tubos de calor . [6]
Además, el 1,1-difluoroetano también se utiliza habitualmente en espolvoreadores de gas y otros numerosos productos en aerosol para venta minorista, en particular aquellos sujetos a estrictos requisitos de compuestos orgánicos volátiles (COV).
El peso molecular del difluoroetano es 66, lo que lo convierte en una herramienta útil y conveniente para detectar fugas de vacío en sistemas de cromatografía de gases-espectrometría de masas (GC-MS). Este gas, barato y de libre acceso, tiene un peso molecular y un patrón de fragmentación (pico base de 51 m/z en EI-MS típico, [7] pico principal a 65 m/z) distintos de cualquier otro en el aire. Si se observan picos de masa correspondientes al 1,1-difluoroetano inmediatamente después de rociar un punto de fuga sospechoso, se pueden identificar las fugas.
Seguridad
El difluoroetano es un gas extremadamente inflamable, que se descompone rápidamente al calentarse o quemarse, produciendo humos tóxicos e irritantes, incluidos fluoruro de hidrógeno y monóxido de carbono . [8]
En un estudio de DuPont , se expuso a ratas a niveles de hasta 25.000 ppm (67.485 mg/m3 ) durante seis horas diarias, cinco días a la semana, durante dos años. Este nivel se ha convertido en el nivel sin efectos adversos observados para esta sustancia. La exposición prolongada al 1,1-difluoroetano se ha relacionado en humanos con el desarrollo de enfermedades coronarias y angina de pecho . [9] La exposición repetida o a niveles suficientemente altos, en particular la inhalación intencionada, puede precipitar una arritmia cardíaca mortal . [10]
Abuso
El difluoroetano es un intoxicante con potencial de abuso. [10] [11] [12] [13] Parece actuar principalmente a través de los receptores GABA A y glutamato . [14] [15] Las muertes relacionadas con el abuso de difluoroetano incluyen a la actriz Skye McCole Bartusiak , el cantante Aaron Carter y el luchador Mike Bell . [16] Los amargantes , agregados voluntariamente a algunas marcas para disuadir la inhalación intencionada, a menudo no son requeridos legalmente; no niegan ni contrarrestan los efectos intoxicantes del difluoroetano.
Abundancia ambiental


La mayor parte de la producción, uso y emisiones de HFC-152a se han producido en el hemisferio norte de la Tierra, más industrializado y poblado, tras la introducción de la sustancia en la década de 1990. Su concentración en la troposfera norte alcanzó un promedio anual de aproximadamente 10 partes por billón en el año 2011. [17] La concentración de HFC-152a en la troposfera sur es aproximadamente un 50% menor debido a que su tasa de eliminación (es decir, su vida útil ) de aproximadamente 1,5 años es similar en magnitud al tiempo de mezcla atmosférica global de uno a dos años. [18]
Véase también
Referencias
- ^ 1,1-Difluoroetano en Sigma-Aldrich
- ^ "Cambios en los constituyentes atmosféricos y en el forzamiento radiativo" (PDF) . Cambridge University Press. 2007. p. 212 . Consultado el 11 de mayo de 2017 .18 de febrero de 2019
- ^ "Potencial de calentamiento global de los sustitutos de las SAO". Agencia de Protección Ambiental de Estados Unidos . 2010. Archivado desde el original el 16 de octubre de 2010. Consultado el 20 de septiembre de 2010 .
- ^ Siegemund, Günter; Schwertfeger, Werner; Feiring, Andrés; Inteligente, Bruce; Behr, Fred; Vogel, Herward; McKusick, Blaine (2010). "Compuestos de flúor orgánicos". En Bohnet, Matías; Bellussi, Giuseppe; Autobús, James; et al. (eds.). Enciclopedia de química industrial de Ullmann . John Wiley e hijos. doi :10.1002/14356007.a11_349. ISBN 978-3527306732.
- ^ Longo, Giovanni A.; Zilio, Claudio; Righetti, Giulia (2015). "Condensación del refrigerante de bajo GWP HFC152a dentro de un intercambiador de calor de placas soldadas". Experimental Thermal and Fluid Science . 68 : 509–515. doi :10.1016/j.expthermflusci.2015.06.010.
- ^ Righetti, Giulia; Zilio, Claudio; Mancin, Simone; Longo, Giovanni A. (2018). "Intercambiador de calor con aletas de tubo de calor para recuperación de calor: resultados experimentales y modelado". Ingeniería de transferencia de calor . 39 (12): 1011–1023. Código Bibliográfico :2018HTrEn..39.1011R. doi :10.1080/01457632.2017.1358483. S2CID 126263840.
- ^ Etano, 1,1-difluoro- en Linstrom, Peter J.; Mallard, William G. (eds.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69 , Instituto Nacional de Estándares y Tecnología, Gaithersburg (MD) (consultado en 2023)
- ^ "1,1-Difluoroetano". WebWISER . Biblioteca Nacional de Medicina de EE. UU . . Consultado el 2 de abril de 2022 .
- ^ "1,1-Difluoroetano". Base de datos HSDB de la Biblioteca Nacional de Medicina . 1994. Consultado el 8 de junio de 2010 .
- ^ ab Avella J, Wilson JC, Lehrer M (marzo de 2006). "Arritmia cardíaca fatal después de exposición repetida al 1,1-difluoroetano (DFE)". The American Journal of Forensic Medicine and Pathology . 27 (1): 58–60. doi :10.1097/01.paf.0000202715.71009.0e. PMID 16501351. S2CID 22312214.
- ^ Broussard LA, Brustowicz T, Pittman T, Atkins KD, Presley L (noviembre de 1997). "Dos accidentes de tráfico mortales relacionados con el uso de difluoroetano". Journal of Forensic Sciences . 42 (6): 1186–7. doi :10.1520/JFS14284J. PMID 9397568.
- ^ Hahn, T; Avella, J; Lehrer, M (2006). "Mortalidad en un accidente de tráfico por inhalación de 1,1-difluoroetano". Journal of Analytical Toxicology . 30 (8): 638–42. doi : 10.1093/jat/30.8.638 . PMID 17132266.
- ^ "Autopsia: un hombre que sufrió un accidente murió por inhalar un limpiador de computadoras". The Times News . 10 de marzo de 2012. Archivado desde el original el 12 de marzo de 2012.
- ^ Novotny, Clara B; Irvin, Sarah; Espiridion, Eduardo D (2019). "Psicosis aguda tras la inhalación de 1,1-difluoroetano". Cureus . 11 (9): e5565. doi : 10.7759/cureus.5565 . ISSN 2168-8184. PMC 6820689 . PMID 31695984.
- ^ Custer, Adam; Corse, Andrew; Vazirani, Sondra (junio de 2020). "Abuso de inhalantes de difluoroetano, fluorosis esquelética y abstinencia". Federal Practitioner . 37 (6): 288–289. ISSN 1078-4497. PMC 7357883 . PMID 32669782.
- ^ Duke, Alan (22 de julio de 2014). «La actriz de 'Patriot' Skye McCole Bartusiak murió a los 21 años». CNN . Consultado el 24 de febrero de 2019 .
- ^ ab "HFC-152a". Laboratorios de investigación del sistema terrestre de la NOAA/División de monitoreo global . Consultado el 12 de febrero de 2021 .
- ^ Greally, BR; et al. (2007). "Observaciones de 1,1-difluoroetano (HFC-152a) en las estaciones de monitoreo AGAGE y SOGE en 1994-2004 y estimaciones de emisiones regionales y globales derivadas". Journal of Geophysical Research . 112 (D06308). Código Bibliográfico :2007JGRD..112.6308G. doi : 10.1029/2006JD007527 .