Química inorgánica

La química inorgánica se ocupa de la síntesis y el comportamiento de los compuestos inorgánicos y organometálicos . Este campo abarca los compuestos químicos que no están basados en el carbono, que son objeto de la química orgánica . La distinción entre las dos disciplinas está lejos de ser absoluta, ya que existe mucha superposición en la subdisciplina de la química organometálica . Tiene aplicaciones en todos los aspectos de la industria química, incluida la catálisis , la ciencia de los materiales , los pigmentos , los surfactantes , los recubrimientos , los medicamentos , los combustibles y la agricultura . [1]
Aparición
Muchos compuestos inorgánicos se encuentran en la naturaleza como minerales . [2] El suelo puede contener sulfuro de hierro como pirita o sulfato de calcio como yeso . [3] [4] Los compuestos inorgánicos también se encuentran realizando múltiples tareas como biomoléculas : como electrolitos ( cloruro de sodio ), en el almacenamiento de energía ( ATP ) o en la construcción (la cadena principal de polifosfato en el ADN ).
Vinculación
Los compuestos inorgánicos presentan una variedad de propiedades de enlace. Algunos son compuestos iónicos , que consisten en cationes y aniones muy simples unidos por enlace iónico . Ejemplos de sales (que son compuestos iónicos) son el cloruro de magnesio MgCl 2 , que consiste en cationes magnesio Mg 2+ y aniones cloruro Cl − ; o hidróxido de sodio NaOH, que consiste en cationes sodio Na + y aniones hidróxido OH − . Algunos compuestos inorgánicos son altamente covalentes, como el dióxido de azufre y el pentacarbonilo de hierro . Muchos compuestos inorgánicos presentan enlace covalente polar , que es una forma de enlace intermedio entre el enlace covalente y el iónico. Esta descripción se aplica a muchos óxidos , carbonatos y haluros . Muchos compuestos inorgánicos se caracterizan por altos puntos de fusión . Algunas sales (por ejemplo, NaCl ) son muy solubles en agua.
Cuando un reactivo contiene átomos de hidrógeno , puede producirse una reacción mediante el intercambio de protones en la química ácido-base . En una definición más general, cualquier especie química capaz de unirse a pares de electrones se denomina ácido de Lewis ; por el contrario, cualquier molécula que tiende a donar un par de electrones se denomina base de Lewis . [5] Como un refinamiento de las interacciones ácido-base, la teoría HSAB tiene en cuenta la polarizabilidad y el tamaño de los iones.
Subdivisiones de la química inorgánica
Las subdivisiones de la química inorgánica son numerosas, pero incluyen:
- Química organometálica , compuestos con enlaces metal-carbono. Esta área se ocupa de la síntesis orgánica , que emplea muchos catalizadores y reactivos organometálicos.
- química de clústeres , compuestos con varios metales unidos entre sí mediante enlaces metal-metal o ligandos puente .
- Química bioinorgánica , biomoléculas que contienen metales. Esta área está relacionada con la química médica .
- Química de materiales y química del estado sólido , sólidos extendidos (es decir, poliméricos) que presentan propiedades que no se observan en moléculas simples. Muchos temas prácticos están asociados con estas áreas, incluida la cerámica .
Química inorgánica industrial
La química inorgánica es un área científica sumamente práctica. Tradicionalmente, la escala de la economía de una nación podía evaluarse por su productividad de ácido sulfúrico .
Un importante compuesto inorgánico creado por el hombre es el nitrato de amonio , utilizado para la fertilización. El amoníaco se produce a través del proceso Haber . [6] [7] [8] El ácido nítrico se prepara a partir del amoníaco por oxidación. Otro material inorgánico a gran escala es el cemento Portland . Los compuestos inorgánicos se utilizan como catalizadores, como el óxido de vanadio (V) para la oxidación del dióxido de azufre y el cloruro de titanio (III) para la polimerización de alquenos . Muchos compuestos inorgánicos se utilizan como reactivos en la química orgánica, como el hidruro de litio y aluminio . [ cita requerida ]
Química inorgánica descriptiva
La química inorgánica descriptiva se centra en la clasificación de los compuestos en función de sus propiedades. En parte, la clasificación se centra en la posición en la tabla periódica del elemento más pesado (el elemento con el mayor peso atómico) en el compuesto, y en parte, en la agrupación de los compuestos por sus similitudes estructurales.
Compuestos de coordinación

Los compuestos de coordinación clásicos presentan metales unidos a " pares solitarios " de electrones que residen en los átomos del grupo principal de ligandos como H 2 O, NH 3 , Cl − y CN − . En los compuestos de coordinación modernos, casi todos los compuestos orgánicos e inorgánicos pueden usarse como ligandos. El "metal" generalmente es un metal de los grupos 3 a 13, así como los trans - lantánidos y trans - actínidos , pero desde cierta perspectiva, todos los compuestos químicos pueden describirse como complejos de coordinación.
La estereoquímica de los complejos de coordinación puede ser bastante rica, como lo sugiere la separación de dos enantiómeros de [Co((OH) 2 Co(NH 3 ) 4 ) 3 ] 6+ realizada por Werner , una demostración temprana de que la quiralidad no es inherente a los compuestos orgánicos. Un tema de actualidad dentro de esta especialización es la química de coordinación supramolecular. [9]
Los compuestos de coordinación presentan una gran diversidad de estructuras, que varían desde tetraédricas para el titanio (por ejemplo, TiCl 4 ) hasta cuadradas y planas para algunos complejos de níquel y octaédricas para los complejos de coordinación de cobalto. Se puede encontrar una variedad de metales de transición en compuestos biológicamente importantes, como el hierro en la hemoglobina.
- Ejemplos: pentacarbonilo de hierro , tetracloruro de titanio , cisplatino
Compuestos del grupo principal

Estas especies presentan elementos de los grupos I, II, III, IV, V, VI, VII, 0 (excluyendo el hidrógeno) de la tabla periódica. Debido a su reactividad a menudo similar, los elementos del grupo 3 ( Sc , Y y La ) y el grupo 12 ( Zn , Cd y Hg ) también se incluyen generalmente, y los lantánidos y actínidos también se incluyen a veces. [10]
Los compuestos del grupo principal se conocen desde los inicios de la química, por ejemplo, el azufre elemental y el fósforo blanco destilable . Los experimentos con oxígeno, O2 , de Lavoisier y Priestley no solo identificaron un gas diatómico importante , sino que abrieron el camino para describir compuestos y reacciones según proporciones estequiométricas . El descubrimiento de una síntesis práctica de amoníaco utilizando catalizadores de hierro por Carl Bosch y Fritz Haber a principios del siglo XX impactó profundamente a la humanidad, demostrando la importancia de la síntesis química inorgánica. Los compuestos típicos del grupo principal son SiO2 , SnCl4 y N2O . Muchos compuestos del grupo principal también pueden clasificarse como "organometálicos", ya que contienen grupos orgánicos, por ejemplo, B( CH3 ) 3 ). Los compuestos del grupo principal también se encuentran en la naturaleza, por ejemplo, el fosfato en el ADN , y por lo tanto pueden clasificarse como bioinorgánicos. Por el contrario, los compuestos orgánicos que carecen de (muchos) ligandos de hidrógeno pueden clasificarse como "inorgánicos", como los fulerenos, los buckytubos y los óxidos de carbono binarios.
- Ejemplos: tetranitruro de tetraazufre S 4 N 4 , diborano B 2 H 6 , siliconas , buckminsterfullereno C 60 .
Los compuestos de gas noble incluyen varios derivados del xenón y el criptón .
- Ejemplos: hexafluoruro de xenón XeF 6 , trióxido de xenón XeO 3 y difluoruro de criptón KrF 2
Compuestos organometálicos

Por lo general, se considera que los compuestos organometálicos contienen el grupo MCH. [11] El metal (M) en estas especies puede ser un elemento del grupo principal o un metal de transición. Operativamente, la definición de un compuesto organometálico es más flexible para incluir también complejos altamente lipofílicos como carbonilos metálicos e incluso alcóxidos metálicos .
Los compuestos organometálicos se consideran principalmente una categoría especial porque los ligandos orgánicos suelen ser sensibles a la hidrólisis o la oxidación, lo que hace necesario que la química organometálica emplee métodos preparativos más especializados que los tradicionales en los complejos de tipo Werner. La metodología sintética, especialmente la capacidad de manipular complejos en disolventes de bajo poder de coordinación, permitió la exploración de ligandos de coordinación muy débil, como los hidrocarburos, H 2 y N 2 . Debido a que los ligandos son petroquímicos en cierto sentido, el área de la química organometálica se ha beneficiado enormemente de su relevancia para la industria.
- Ejemplos: dímero de dicarbonilo de ciclopentadienilo (C 5 H 5 )Fe(CO) 2 CH 3 , ferroceno Fe(C 5 H 5 ) 2 , hexacarbonilo de molibdeno Mo(CO) 6 , trietilborano Et 3 B, Tris(dibencilidenoacetona)dipaladio(0) Pd 2 (dba) 3 )
Compuestos en racimo
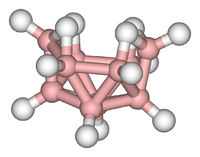

Los cúmulos se pueden encontrar en todas las clases de compuestos químicos . Según la definición comúnmente aceptada, un cúmulo consiste mínimamente en un conjunto triangular de átomos que están directamente unidos entre sí. Pero los complejos dimetálicos unidos metal-metal son muy relevantes para el área. Los cúmulos se producen en sistemas inorgánicos "puros", química organometálica, química de grupos principales y química bioinorgánica. La distinción entre cúmulos muy grandes y sólidos a granel es cada vez más difusa. Esta interfaz es la base química de la nanociencia o nanotecnología y surge específicamente del estudio de los efectos del tamaño cuántico en cúmulos de seleniuro de cadmio . Por lo tanto, los cúmulos grandes pueden describirse como una matriz de átomos unidos de carácter intermedio entre una molécula y un sólido.
- Ejemplos: Fe 3 (CO) 12 , B 10 H 14 , [Mo 6 Cl 14 ] 2− , 4Fe-4S
Compuestos bioinorgánicos

Por definición, estos compuestos se encuentran en la naturaleza, pero el subcampo incluye especies antropogénicas, como contaminantes (p. ej., metilmercurio ) y fármacos (p. ej., cisplatino ). [12] El campo, que incorpora muchos aspectos de la bioquímica, incluye muchos tipos de compuestos, p. ej., los fosfatos en el ADN, y también complejos metálicos que contienen ligandos que van desde macromoléculas biológicas, comúnmente péptidos , hasta especies mal definidas como el ácido húmico y el agua (p. ej., coordinados con complejos de gadolinio empleados para MRI ). Tradicionalmente, la química bioinorgánica se centra en la transferencia de electrones y energía en proteínas relevantes para la respiración. La química inorgánica medicinal incluye el estudio de elementos esenciales y no esenciales con aplicaciones para el diagnóstico y las terapias.
- Ejemplos: hemoglobina , metilmercurio , carboxipeptidasa
Compuestos de estado sólido
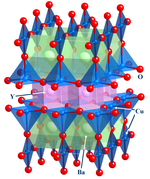
Esta importante área se centra en la estructura , [13] los enlaces y las propiedades físicas de los materiales. En la práctica, la química inorgánica del estado sólido utiliza técnicas como la cristalografía para comprender las propiedades que resultan de las interacciones colectivas entre las subunidades del sólido. En la química del estado sólido se incluyen los metales y sus aleaciones o derivados intermetálicos. Los campos relacionados son la física de la materia condensada , la mineralogía y la ciencia de los materiales .
Espectroscopia y magnetismo
A diferencia de la mayoría de los compuestos orgánicos , muchos compuestos inorgánicos son magnéticos y/o coloreados. Estas propiedades proporcionan información sobre el enlace y la estructura. El magnetismo de los compuestos inorgánicos puede ser complejo. Por ejemplo, la mayoría de los compuestos de cobre (II) son paramagnéticos, pero el Cu II 2 (OAc) 4 (H 2 O) 2 es casi diamagnético por debajo de la temperatura ambiente. La explicación se debe al acoplamiento magnético entre pares de sitios Cu (II) en el acetato.
Teorías cualitativas

La química inorgánica se ha beneficiado enormemente de las teorías cualitativas. Estas teorías son más fáciles de aprender, ya que requieren pocos conocimientos previos de teoría cuántica. Dentro de los compuestos del grupo principal, la teoría VSEPR predice poderosamente, o al menos racionaliza, las estructuras de los compuestos del grupo principal, como una explicación de por qué el NH 3 es piramidal mientras que el ClF 3 tiene forma de T. Para los metales de transición, la teoría del campo cristalino permite comprender el magnetismo de muchos complejos simples, como por qué [Fe III (CN) 6 ] 3− tiene solo un electrón desapareado, mientras que [Fe III (H 2 O) 6 ] 3+ tiene cinco. Un enfoque cualitativo particularmente poderoso para evaluar la estructura y la reactividad comienza con la clasificación de las moléculas según el recuento de electrones , centrándose en la cantidad de electrones de valencia , generalmente en el átomo central de una molécula. [ cita requerida ]
Teoría de grupos de simetría molecular
Un concepto de la química es la simetría molecular , tal como se plasma en la teoría de grupos . Los compuestos inorgánicos muestran simetrías particularmente diversas, por lo que es lógico que la teoría de grupos esté íntimamente asociada con la química inorgánica. [14] La teoría de grupos proporciona el lenguaje para describir las formas de las moléculas de acuerdo con su simetría de grupo puntual . La teoría de grupos también permite la factorización y la simplificación de los cálculos teóricos.
Se analizan y describen las características espectroscópicas con respecto a las propiedades de simetría de, entre otros , los estados vibracionales o electrónicos. El conocimiento de las propiedades de simetría de los estados fundamental y excitado permite predecir el número y la intensidad de las absorciones en los espectros vibracionales y electrónicos. Una aplicación clásica de la teoría de grupos es la predicción del número de vibraciones de CO en complejos de carbonilo metálico sustituidos. Las aplicaciones más comunes de la simetría a la espectroscopia involucran los espectros vibracionales y electrónicos.
La teoría de grupos destaca los puntos en común y las diferencias en la unión de especies que de otro modo serían dispares. Por ejemplo, los orbitales basados en metales se transforman de manera idéntica para WF 6 y W(CO) 6 , pero las energías y poblaciones de estos orbitales difieren significativamente. Existe una relación similar entre el CO 2 y el difluoruro de berilio molecular .
Termodinámica y química inorgánica
Un enfoque cuantitativo alternativo a la química inorgánica se centra en las energías de las reacciones. Este enfoque es muy tradicional y empírico , pero también es útil. Los conceptos generales que se expresan en términos termodinámicos incluyen el potencial redox , la acidez y los cambios de fase . Un concepto clásico en termodinámica inorgánica es el ciclo de Born-Haber , que se utiliza para evaluar las energías de procesos elementales como la afinidad electrónica , algunos de los cuales no se pueden observar directamente.
Química inorgánica mecanicista
Un aspecto importante de la química inorgánica se centra en las vías de reacción, es decir, los mecanismos de reacción .
Elementos del grupo principal y lantánidos
Los mecanismos de los compuestos del grupo principal de los grupos 13-18 se discuten generalmente en el contexto de la química orgánica (los compuestos orgánicos son compuestos del grupo principal, después de todo). Los elementos más pesados que C, N, O y F a menudo forman compuestos con más electrones de los predichos por la regla del octeto , como se explica en el artículo sobre moléculas hipervalentes . Los mecanismos de sus reacciones difieren de los compuestos orgánicos por esta razón. Los elementos más ligeros que el carbono ( B , Be , Li ), así como Al y Mg, a menudo forman estructuras deficientes en electrones que son electrónicamente similares a los carbocationes . Estas especies deficientes en electrones tienden a reaccionar a través de vías asociativas. La química de los lantánidos refleja muchos aspectos de la química observada para el aluminio.
Complejos de metales de transición
Los compuestos de metales de transición y del grupo principal suelen reaccionar de forma diferente. [15] El importante papel de los orbitales d en la unión influye en gran medida en las vías y las tasas de sustitución y disociación de ligandos. Estos temas se tratan en artículos sobre química de coordinación y ligandos . Se observan vías tanto asociativas como disociativas.
Un aspecto general de la química mecanicista de los metales de transición es la labilidad cinética del complejo ilustrada por el intercambio de agua libre y ligada en los complejos prototípicos [M(H 2 O) 6 ] n+ :
- [M(H2O ) 6 ] n + + 6H2O * → [M(H2O * ) 6 ] n + + 6H2O
- donde H 2 O* denota agua isotópicamente enriquecida, p. ej., H 2 17 O
Las tasas de intercambio de agua varían en 20 órdenes de magnitud a lo largo de la tabla periódica, con los complejos de lantánidos en un extremo y las especies Ir(III) siendo las más lentas.
Reacciones redox
Las reacciones redox son frecuentes en los elementos de transición. Se consideran dos clases de reacciones redox: reacciones de transferencia de átomos, como la adición oxidativa/eliminación reductora, y la transferencia de electrones . Una reacción redox fundamental es el "autointercambio", que implica la reacción degenerada entre un oxidante y un reductor. Por ejemplo, el permanganato y su pariente reducido de un electrón, el manganato, intercambian un electrón:
- [MnO 4 ] − + [Mn*O 4 ] 2− → [MnO 4 ] 2− + [Mn*O 4 ] −
Reacciones en ligandos
Los ligandos coordinados muestran una reactividad distinta a la de los ligandos libres. Por ejemplo, la acidez de los ligandos de amoniaco en [Co(NH 3 ) 6 ] 3+ es elevada en relación con el propio NH 3 . Los alquenos unidos a cationes metálicos son reactivos hacia los nucleófilos, mientras que los alquenos normalmente no lo son. El área grande e industrialmente importante de la catálisis depende de la capacidad de los metales para modificar la reactividad de los ligandos orgánicos. La catálisis homogénea ocurre en solución y la catálisis heterogénea ocurre cuando los sustratos gaseosos o disueltos interactúan con las superficies de los sólidos. Tradicionalmente, la catálisis homogénea se considera parte de la química organometálica y la catálisis heterogénea se analiza en el contexto de la ciencia de superficies , un subcampo de la química del estado sólido. Pero los principios químicos inorgánicos básicos son los mismos. Los metales de transición, casi exclusivamente, reaccionan con moléculas pequeñas como CO, H 2 , O 2 y C 2 H 4 . La importancia industrial de estas materias primas determina el área activa de la catálisis. Los ligandos también pueden sufrir reacciones de transferencia de ligando, como la transmetalación .
Caracterización de compuestos inorgánicos
Debido a la diversidad de elementos y las propiedades correspondientemente diversas de los derivados resultantes, la química inorgánica está estrechamente asociada con muchos métodos de análisis. Los métodos más antiguos tendían a examinar propiedades en masa como la conductividad eléctrica de las soluciones, los puntos de fusión , la solubilidad y la acidez . Con el advenimiento de la teoría cuántica y la correspondiente expansión de los aparatos electrónicos, se han introducido nuevas herramientas para investigar las propiedades electrónicas de las moléculas y los sólidos inorgánicos. A menudo, estas mediciones proporcionan información relevante para los modelos teóricos. Las técnicas que se encuentran comúnmente son:
- Cristalografía de rayos X : Esta técnica permite la determinación en 3D de estructuras moleculares .
- Diversas formas de espectroscopia :
- Espectroscopia ultravioleta-visible : históricamente, esta ha sido una herramienta importante, ya que muchos compuestos inorgánicos están fuertemente coloreados.
- Espectroscopia RMN : además de 1 H y 13 C, muchos otros núcleos activos en RMN (por ejemplo, 11 B , 19 F , 31 P y 195 Pt ) pueden brindar información importante sobre las propiedades y la estructura de los compuestos. La RMN de especies paramagnéticas puede proporcionar información estructural importante. La RMN de protones ( 1 H ) también es importante porque el núcleo de hidrógeno ligero no se detecta fácilmente mediante cristalografía de rayos X.
- Espectroscopia infrarroja : principalmente para absorciones de ligandos carbonílicos
- Espectroscopia de doble resonancia nuclear electrónica (ENDOR)
- Espectroscopia Mössbauer
- Resonancia de espín electrónico : ESR (o EPR) permite medir el entorno de los centros metálicos paramagnéticos .
- Electroquímica : La voltamperometría cíclica y técnicas relacionadas investigan las características redox de los compuestos.
Química inorgánica sintética
Aunque algunas especies inorgánicas pueden obtenerse en forma pura de la naturaleza, la mayoría se sintetizan en plantas químicas y en el laboratorio.
Los métodos sintéticos inorgánicos se pueden clasificar aproximadamente de acuerdo con la volatilidad o solubilidad de los reactivos componentes. [16] Los compuestos inorgánicos solubles se preparan utilizando métodos de síntesis orgánica . Para los compuestos que contienen metales que son reactivos con el aire, se siguen las técnicas de línea Schlenk y caja de guantes . Los compuestos volátiles y los gases se manipulan en "colectores de vacío" que consisten en tuberías de vidrio interconectadas a través de válvulas, la totalidad de las cuales se puede evacuar a 0,001 mm Hg o menos. Los compuestos se condensan utilizando nitrógeno líquido (punto de ebullición 78K) u otros criógenos . Los sólidos se preparan típicamente utilizando hornos de tubo, y los reactivos y productos se sellan en contenedores, a menudo hechos de sílice fundida (SiO 2 amorfo ) pero a veces materiales más especializados como tubos de Ta soldados o "barcos" de Pt. Los productos y reactivos se transportan entre zonas de temperatura para impulsar las reacciones.
Véase también
Referencias
- ^ "Carreras en química: química inorgánica". Sociedad Química Estadounidense. Archivado desde el original el 29 de octubre de 2012.
- ^ Burns, PC (1 de diciembre de 2005). "Minerales U6+ y compuestos inorgánicos: perspectivas sobre una jerarquía estructural expandida de estructuras cristalinas". The Canadian Mineralogist . 43 (6): 1839–1894. Bibcode :2005CaMin..43.1839B. doi :10.2113/gscanmin.43.6.1839. ISSN 0008-4476.
- ^ Shainberg, I.; Sumner, ME; Miller, WP; Farina, MPW; Pavan, MA; Fey, MV (1989), Lal, Rattan; Stewart, BA (eds.), "Uso de yeso en suelos: una revisión", Soil Restoration , vol. 17, Nueva York, NY: Springer New York, págs. 1–111, doi :10.1007/978-1-4612-3532-3_1, ISBN 978-1-4612-7684-5, consultado el 21 de agosto de 2022
- ^ Haaijer, Suzanne CM; Lamers, Leon PM; Smolders, Alfons JP; Jetten, Mike SM; Op den Camp, Huub JM (14 de agosto de 2007). "Sulfuro de hierro y pirita como posibles donantes de electrones para la reducción microbiana de nitrato en humedales de agua dulce". Revista de geomicrobiología . 24 (5): 391–401. doi :10.1080/01490450701436489. hdl : 2066/34570 . ISSN 0149-0451. S2CID 97227345.
- ^ Jensen, William B. (1978). "Las definiciones de ácido-base de Lewis: un informe de situación". Chemical Reviews . 78 (1): 1–22. doi :10.1021/cr60311a002. ISSN 0009-2665.
- ^ Guo, Jianping; Chen, Ping (2021). "La historia del amoníaco en ciernes". Catálisis de la naturaleza . 4 (9): 734–735. doi :10.1038/s41929-021-00676-0. ISSN 2520-1158. S2CID 237588318.
- ^ Leigh, GJ (2004), Smith, Barry E.; Richards, Raymond L.; Newton, William E. (eds.), "Haber-Bosch y otros procesos industriales", Catalysts for Nitrogen Fixation , Dordrecht: Springer Netherlands, págs. 33-54, doi :10.1007/978-1-4020-3611-8_2, ISBN 978-90-481-6675-6, consultado el 21 de agosto de 2022
- ^ Witschi, H. (1 de mayo de 2000). "Fritz Haber: 1868-1934". Ciencias toxicológicas . 55 (1): 1–2. doi : 10.1093/toxsci/55.1.1 . PMID 10788553.
- ^ Lehn, JM (1995). Química supramolecular: conceptos y perspectivas . Weinheim: VCH. ISBN 978-3-527-29311-7.
- ^ Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- ^ Elschenbroich, C.; Salzer, A. (1992). Organometálicos: una introducción concisa (2ª ed.). Weinheim: Wiley-VCH. ISBN 978-3-527-28164-0.
- ^ SJ Lippard; JM Berg (1994). Principios de química bioinorgánica . Mill Valley, CA: University Science Books. ISBN 978-0-935702-73-6.
- ^ Wells, AF (1984). Química inorgánica estructural . Oxford: Clarendon Press.
- ^ Cotton, FA (1990). Aplicaciones químicas de la teoría de grupos (3.ª ed.). Nueva York: John Wiley & Sons. ISBN 978-0-471-51094-9.
- ^ RG Wilkins (1991). Cinética y mecanismo de reacciones de complejos de metales de transición (2.ª ed.). Wiley-VCH. ISBN 978-3-527-28389-7.
- ^ Girolami, GS; Rauchfuss, TB; Angelici, RJ (1999). Síntesis y técnica en química inorgánica (3.ª ed.). Mill Valley, CA: University Science Books. ISBN 978-0-935702-48-4.
