Píldora anticonceptiva oral combinada
| Píldora anticonceptiva oral combinada | |
|---|---|
 | |
| Fondo | |
| Tipo | Hormonal |
| Estreno | 1960 (Estados Unidos) ( 1960 ) |
| Tasas de fracaso (primer año) | |
| Uso perfecto | 0,3% [1] |
| Uso típico | 9% [1] |
| Uso | |
| Efecto de duración | 1–4 días |
| Reversibilidad | Sí |
| Recordatorios para el usuario | Tomadas dentro del mismo período de 24 horas cada día. |
| Reseña clínica | 6 meses |
| Ventajas y desventajas | |
| Protección contra las ETS | No |
| Periodos | Regulado, y a menudo más ligero y menos doloroso. |
| Peso | No hay efecto comprobado |
| Beneficios | Evidencia de reducción del riesgo de mortalidad y de las tasas de mortalidad en todos los tipos de cáncer. [2] Posible reducción de los riesgos de cáncer de ovario y de endometrio . [3] [ cita requerida ] Puede tratar el acné , el síndrome de ovario poliquístico , el trastorno disfórico premenstrual y la endometriosis [ cita requerida ] |
| Riesgos | Posible pequeño aumento de algunos cánceres. [4] [5] Pequeño aumento reversible de TVP , accidente cerebrovascular , [6] enfermedad cardiovascular [7] |
| Notas médicas | |
| Afecta al antibiótico rifampicina , [8] la hierba hipérico (Hierba de San Juan) y algunos antiepilépticos, también vómitos o diarrea. Precaución si hay antecedentes de migrañas. | |
La píldora anticonceptiva oral combinada ( AOC ), a menudo denominada píldora anticonceptiva o coloquialmente como " la píldora ", es un tipo de anticonceptivo diseñado para ser tomado por vía oral por las mujeres. Es la forma oral de la anticoncepción hormonal combinada . La píldora contiene dos hormonas importantes : una progestina (una forma sintética de la hormona progestágeno / progesterona) y estrógeno (generalmente etinilestradiol o 17β estradiol ). [9] [10] [11] [12] Cuando se toma correctamente, altera el ciclo menstrual para eliminar la ovulación y prevenir el embarazo .
Los AOC se aprobaron por primera vez para uso anticonceptivo en los Estados Unidos en 1960 y siguen siendo una forma muy popular de control de la natalidad. Los usan más de 100 millones de mujeres en todo el mundo [13] [14], incluidas alrededor de 9 millones de mujeres en los Estados Unidos. [15] [16] De 2015 a 2017, el 12,6 % de las mujeres de 15 a 49 años en los EE. UU. informaron que usaban AOC, lo que lo convierte en el segundo método anticonceptivo más común en este rango de edad ( la esterilización femenina es el método más común). [17] Sin embargo, el uso de AOC varía ampliamente según el país, [18] la edad, la educación y el estado civil . Por ejemplo, un tercio de las mujeres de 16 a 49 años en el Reino Unido usan la píldora combinada o la píldora de solo progestágeno (POP), [19] [20] en comparación con menos del 3 % de las mujeres en Japón (entre 1950 y 2014). [21]
Los anticonceptivos orales combinados están en la Lista de Medicamentos Esenciales de la Organización Mundial de la Salud . [22] La píldora fue un catalizador de la revolución sexual . [23]
Fondo
Anticonceptivos orales


Los anticonceptivos orales hormonales son medicamentos preventivos que se toman por vía oral para evitar el embarazo en mujeres sexualmente activas mediante la manipulación de sus hormonas sexuales . El primer anticonceptivo oral fue aprobado por la FDA y vendido al mercado en 1960. Hay dos tipos de anticonceptivos orales hormonales, a saber, los anticonceptivos orales combinados y las píldoras de solo progesterona . Los anticonceptivos orales, ya sean combinados o de solo progesterona, pueden prevenir eficazmente el embarazo regulando los cambios hormonales en el ciclo menstrual , inhibiendo la ovulación y alterando el moco cervical para impedir la movilidad de los espermatozoides ; las píldoras combinadas tienen efectos adicionales en la regulación del ciclo menstrual y el alivio del dolor menstrual. Los usos no aprobados comunes incluyen la supresión menstrual y el alivio del acné , y los anticonceptivos orales combinados tienen beneficios adicionales en el alivio de la migraña menstrual .
Variantes
Pastillas que contienen solo progesterona (POP) Las POP utilizan progestina, la forma sintética de progesterona, como el único ingrediente farmacéutico activo en la fórmula. [24] [25] En los EE. UU., la drospirenona y la noretindrona son los compuestos más comúnmente utilizados en las fórmulas. [26]
Anticonceptivos orales combinados (AOC) Los AOC se clasifican comúnmente en generaciones, haciendo referencia a su orden de desarrollo en la historia. [27] Esta discusión también puede ayudar a identificar algunas características clave en una variedad de productos. Según EMA , la primera generación de AOC, que utilizaba solo una alta concentración de estrógeno, fueron los inventados en la década de 1960. [27] En la segunda generación de productos, se introdujeron progestágenos en la formulación mientras se reducía la concentración de estrógeno. [27] A partir de la década de 1990, la progresión en el desarrollo de AOC se ha dirigido hacia la variación del tipo de progestágeno incorporado. [27] Estos productos se conocen como la tercera y cuarta generación. [27]
Componentes de estrógeno: estradiol , etinilestradiol , estetrol . [24]
Progestina de primera generación: acetato de noretisterona , diacetato de etinodiol , linestrenol , noretinodrel . [24]
Progestina de segunda generación: levonorgestrel , dl-norgestrel . [24]
Progestina de tercera generación: norgestimato , gestodeno , desogestrel . [24]
El ciclo menstrual

Los anticonceptivos orales hormonales (AOH) interactúan con los cambios hormonales en el ciclo menstrual de las mujeres para prevenir la ovulación y, por lo tanto, lograr la anticoncepción. [24] En un ciclo menstrual de 28 días, existen la fase proliferativa, la ovulación y luego la fase secretora. [28]
La menstruación marca el comienzo de la fase proliferativa en el día 1-14. [28] En este período, la glándula pituitaria ubicada cerca del cerebro secreta la hormona folículo estimulante (FSH) en el torrente sanguíneo para indicar el desarrollo del folículo en el ovario en el sistema reproductor femenino . [28] Si bien el folículo sirve como cámara de desarrollo del óvulo, secreta estrógeno , una hormona que no solo desencadena el engrosamiento del revestimiento uterino en preparación para la implantación , sino que también inhibe la secreción de FSH en la pituitaria a través de un mecanismo de retroalimentación negativa . [28]
Específicamente en la ovulación, se permite la retroalimentación positiva transitoria del estrógeno sobre la secreción de FSH y hormona luteinizante (LH) de la pituitaria, de modo que se desencadena la liberación del óvulo maduro del folículo. [28]
En la fase secretora del día 14-28, este folículo se transforma en cuerpo lúteo y continúa liberando estrógeno con progesterona al torrente sanguíneo. [28] Mientras que el estrógeno y la progesterona ayudan principalmente al mantenimiento del grosor del revestimiento uterino, [28] la retroalimentación negativa en la pituitaria les permite inhibir la secreción de FSH y LH. [28] En ausencia de LH, el cuerpo lúteo se degenera y, en última instancia, hace que los niveles de estrógeno y progesterona en sangre disminuyan. [28] Sin estos agentes que mantienen el grosor, el revestimiento uterino se descompone y, por lo tanto, se presenta la menstruación. [28]
Mecanismo de acción
La progesterona y el estrógeno, ya sea en combinación o con progesterona sola, son los ingredientes farmacéuticos activos que se encuentran en una formulación de HOC. [29] Estos medicamentos se administran por vía oral para su absorción sistémica para ejercer sus efectos. [29] Un nivel artificialmente mejorado de progesterona a lo largo del ciclo menstrual inhibe la secreción pituitaria de FSH y LH de modo que se previenen sus acciones para estimular el desarrollo folicular y la ovulación. [24] De manera similar, un nivel aumentado de estrógeno activa el mecanismo de retroalimentación negativa para reducir la secreción de FSH de la pituitaria y, por lo tanto, previene el desarrollo folicular. [24] En ausencia de un folículo desarrollado, la ovulación no puede ocurrir de modo que la fertilización se vuelve imposible y se logra la anticoncepción . [29] En comparación, la progesterona es más eficaz que el estrógeno no solo por su acción adicional para impedir la LH, sino también por su capacidad para modular el moco cervical para que sea repelente de esperma. [24]
Las píldoras anticonceptivas orales combinadas se desarrollaron para prevenir la ovulación al suprimir la liberación de gonadotropinas . Los anticonceptivos hormonales combinados, incluidos los anticonceptivos orales combinados, inhiben el desarrollo folicular y previenen la ovulación como mecanismo de acción principal. [30] [31] [32] [33]
En circunstancias normales, la hormona luteinizante (LH) estimula las células de la teca del folículo ovárico para producir androstenediona . Las células de la granulosa del folículo ovárico luego convierten esta androstenediona en estradiol. Este proceso de conversión es catalizado por la aromatasa, una enzima producida como resultado de la estimulación de la hormona folículo estimulante (FSH). [34] En personas que usan anticonceptivos orales, la retroalimentación negativa del progestágeno disminuye la frecuencia del pulso de la liberación de la hormona liberadora de gonadotropina (GnRH) por el hipotálamo , lo que disminuye la secreción de FSH y disminuye en gran medida la secreción de LH por la hipófisis anterior . Los niveles disminuidos de FSH inhiben el desarrollo folicular, evitando un aumento en los niveles de estradiol . La retroalimentación negativa del progestágeno y la falta de retroalimentación positiva del estrógeno en la secreción de LH previenen un pico de LH a mitad del ciclo . La inhibición del desarrollo folicular y la ausencia de un pico de LH previenen la ovulación. [30] [31] [32]
El estrógeno se incluyó originalmente en los anticonceptivos orales para un mejor control del ciclo (para estabilizar el endometrio y, por lo tanto, reducir la incidencia de sangrado intermenstrual), pero también se descubrió que inhibe el desarrollo folicular y ayuda a prevenir la ovulación. La retroalimentación negativa del estrógeno sobre la hipófisis anterior disminuye en gran medida la secreción de FSH, que inhibe el desarrollo folicular y ayuda a prevenir la ovulación. [30] [31] [32]
Otro mecanismo de acción primario de todos los anticonceptivos que contienen progestágeno es la inhibición de la penetración de los espermatozoides a través del cuello uterino hacia el tracto genital superior ( útero y trompas de Falopio ) al disminuir el contenido de agua y aumentar la viscosidad del moco cervical . [30]
El estrógeno y el progestágeno presentes en los anticonceptivos orales combinados tienen otros efectos sobre el sistema reproductivo, pero no se ha demostrado que contribuyan a su eficacia anticonceptiva: [30]
- Disminución de la motilidad tubárica y del transporte de óvulos, lo que puede interferir en la fertilización .
- Atrofia endometrial y alteración del contenido de metaloproteinasas , que pueden impedir la movilidad y viabilidad de los espermatozoides o, teóricamente, inhibir la implantación .
- Edema endometrial, que puede afectar la implantación.
No existen suficientes pruebas de que los cambios en el endometrio puedan realmente impedir la implantación. Los mecanismos de acción primarios son tan eficaces que la posibilidad de fecundación durante el uso de anticonceptivos orales combinados es muy pequeña. Dado que el embarazo se produce a pesar de los cambios endometriales cuando fallan los mecanismos de acción primarios, es poco probable que los cambios endometriales desempeñen un papel importante, si es que lo tienen, en la eficacia observada de los anticonceptivos orales combinados. [30]
Formulaciones
Los anticonceptivos orales vienen en una variedad de formulaciones, algunas contienen tanto estrógeno como progestinas , y algunas solo contienen progestina . Las dosis de las hormonas componentes también varían entre los productos, y algunas píldoras son monofásicas (liberan la misma dosis de hormonas cada día) mientras que otras son multifásicas (las dosis varían cada día). Los AOC también se pueden dividir en dos grupos, aquellos con progestinas que poseen actividad androgénica ( acetato de noretisterona , diacetato de etinodiol , levonorgestrel , norgestrel , norgestimato , desogestrel , gestodeno ) o actividad antiandrógena ( acetato de ciproterona , acetato de clormadinona , drospirenona , dienogest , acetato de nomegestrol ).
En la literatura médica, los AOC se han agrupado de manera un tanto inconsistente en "generaciones" según el momento en que se introdujeron. [35] [36]
- Los AOC de primera generación a veces se definen como aquellos que contienen las progestinas noretinodrel, noretisterona, acetato de noretisterona o acetato de etinodiol; [35] y a veces se definen como todos los AOC que contienen ≥ 50 μg de etinilestradiol. [36]
- Los anticonceptivos orales combinados de segunda generación a veces se definen como aquellos que contienen las progestinas norgestrel o levonorgestrel; [35] y a veces se definen como aquellos que contienen las progestinas noretisterona, acetato de noretisterona, acetato de etinodiol, norgestrel, levonorgestrel o norgestimato y < 50 μg de etinilestradiol. [36]
- Los anticonceptivos orales combinados de tercera generación a veces se definen como aquellos que contienen las progestinas desogestrel o gestodeno; [36] y a veces se definen como aquellos que contienen desogestrel, gestodeno o norgestimato. [35]
- Los anticonceptivos orales combinados de cuarta generación a veces se definen como aquellos que contienen la progestina drospirenona; [35] y a veces se definen como aquellos que contienen drospirenona, dienogest o acetato de nomegestrol. [36]
Uso médico
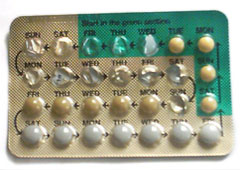
Uso de anticonceptivos
Las píldoras anticonceptivas orales combinadas son un tipo de medicamento oral que originalmente se diseñó para tomarse todos los días a la misma hora con el fin de prevenir el embarazo. [26] [37] Existen muchas formulaciones o marcas diferentes, pero el paquete promedio está diseñado para tomarse durante un período de 28 días (también conocido como ciclo). Durante los primeros 21 días del ciclo, las usuarias toman una píldora diaria que contiene dos hormonas, estrógeno y progestágeno. Durante los últimos 7 días del ciclo, las usuarias toman diariamente píldoras placebo (biológicamente inactivas) y estos días se consideran días sin hormonas. Aunque estos son días sin hormonas, las usuarias aún están protegidas del embarazo durante este tiempo.
Algunos paquetes de AOC contienen solo 21 píldoras y se recomienda a las usuarias que no tomen píldoras durante los últimos 7 días del ciclo. [9] Otras formulaciones de AOC contienen 91 píldoras, que consisten en 84 días de hormonas activas seguidas de 7 días de placebo ( Seasonale ). [26] Las formulaciones de AOC pueden contener 24 días de píldoras de hormonas activas seguidas de 4 días de píldoras de placebo (por ejemplo, Yaz 28 y Loestrin 24 Fe) como un medio para disminuir la gravedad de los efectos del placebo. [9] Estos AOC que contienen hormonas activas y un período libre de placebo/hormonas se denominan AOC cíclicos. Una vez que se completa un paquete de tratamiento con AOC cíclico, las usuarias comienzan un nuevo paquete y un nuevo ciclo. [38]
La mayoría de los AOC monofásicos se pueden utilizar de forma continua, de modo que las pacientes pueden saltarse los días de placebo y tomar continuamente píldoras activas hormonales de un paquete de AOC. [9] Una de las razones más comunes por las que las usuarias hacen esto es para evitar o disminuir el sangrado por abstinencia . La mayoría de las mujeres que toman AOC cíclicos tienen sangrado por abstinencia programado regularmente, que es un sangrado vaginal que imita los ciclos menstruales de las usuarias con la excepción de un sangrado menstrual más ligero en comparación con los patrones de sangrado antes del inicio del AOC. Como tal, un estudio informó que de 1003 mujeres que toman AOC, aproximadamente el 90% informó sangrados por abstinencia programados regularmente durante un período de referencia estándar de 90 días. [9] El sangrado por abstinencia generalmente ocurre durante los días de placebo, sin hormonas. Por lo tanto, evitar los días de placebo puede disminuir el sangrado por abstinencia entre otros efectos placebo.
Régimen
Esta sección demuestra la racionalización general de la vía de dosificación y los intervalos de los AOC; solicite asesoramiento y siga las instrucciones de los profesionales de la salud al administrar AOC específicos. Teniendo en cuenta el ciclo menstrual como un ciclo de 28 días, los AOC están disponibles en paquetes de 21, 28 o 91 comprimidos. [29] Estas píldoras generalmente se han sometido a una optimización de dosis unitaria para que sigan el patrón de administración de una vez al día, todos los días o casi todos los días de manera regular. [29] Dado que están formuladas en dosis diarias, se recomienda que el medicamento se tome a la misma hora todos los días para maximizar la eficacia . [29]

En el caso de los paquetes de 21 comprimidos, la instrucción general es tomar un comprimido al día durante 21 días, seguido de un intervalo de 7 días sin tomar AOC antes de iniciar otro paquete de 21 comprimidos. [29] En el caso de los paquetes de 28 comprimidos, el primer comprimido de un nuevo paquete debe tomarse al día siguiente de terminarse el comprimido número 28 de un paquete anterior. [29] Si bien el período de 7 días sin tomar AOC no se aplica a los paquetes de 28 comprimidos, es probable que incluyan comprimidos de colores distintivos que indican que tienen una cantidad alternativa de ingredientes activos, de lo contrario, solo ingrediente inactivo o suplemento de folato . [29] La instrucción para el paquete de 91 comprimidos sigue la de los paquetes de 28 comprimidos con algunos comprimidos de color diferenciable que contienen diferentes cantidades de medicamento o suplemento. [29]
Para obtener efectos anticonceptivos inmediatos, se recomienda iniciar la dosificación de HOC dentro del 1.º al 5.º día desde la menstruación para descartar otros medios anticonceptivos . [39] Específicamente para las píldoras de solo progesterona, incluso si la dosificación se inicia dentro de los cinco días, se sugiere un método anticonceptivo de respaldo en las primeras 48 horas desde la primera píldora. [24] En el caso de la dosificación iniciada después del 5.º día desde la menstruación, los efectos generalmente se producen después de siete días y otros métodos anticonceptivos deben permanecer en su lugar hasta entonces. [39]
Eficacia
Si se utilizan exactamente como se indica, el riesgo estimado de quedar embarazada es del 0,3%, lo que significa que aproximadamente 3 de cada 1000 mujeres que toman AOC quedarán embarazadas en el plazo de un año. [40] Sin embargo, el uso típico de AOC por parte de las usuarias a menudo consiste en errores de sincronización, píldoras olvidadas o efectos secundarios no deseados. Con un uso típico, el riesgo estimado de quedar embarazada es de alrededor del 9%, lo que significa que aproximadamente 9 de cada 100 mujeres que toman AOC quedarán embarazadas en un año. [41] La tasa de fracaso del uso perfecto se basa en una revisión de las tasas de embarazo en ensayos clínicos, y la tasa de fracaso del uso típico se basa en un promedio ponderado de estimaciones de las Encuestas Nacionales de Crecimiento Familiar (NSFG) de EE. UU. de 1995 y 2002, corregidas por la falta de notificación de abortos. [42] [43]
Varios factores explican que la eficacia del uso típico sea inferior a la eficacia del uso perfecto:
- Errores por parte de quienes imparten instrucciones sobre cómo utilizar el método
- Errores por parte del usuario
- Incumplimiento consciente de las instrucciones por parte del usuario
Por ejemplo, alguien que usa AOC puede haber recibido información incorrecta de un proveedor de atención médica acerca de la frecuencia de la medicación, haber olvidado tomar la pastilla un día o no haber ido a la farmacia a tiempo para renovar una receta de AOC.
Los AOC proporcionan una anticoncepción eficaz desde la primera píldora si se empiezan a tomar dentro de los cinco días posteriores al inicio del ciclo menstrual (dentro de los cinco días posteriores al primer día de la menstruación ). Si se empiezan a tomar en cualquier otro momento del ciclo menstrual, los AOC proporcionan una anticoncepción eficaz solo después de 7 días consecutivos de uso de píldoras activas, por lo que se debe utilizar un método anticonceptivo de respaldo (por ejemplo, condones ) en el ínterin. [44] [45]
La eficacia de los anticonceptivos orales combinados parece ser similar tanto si se toman las píldoras activas de forma continua como si se toman de forma cíclica. [46] Sin embargo, la eficacia anticonceptiva podría verse afectada por numerosos factores. Factores que pueden contribuir a una disminución de la eficacia: [44]
- Falta más de una pastilla activa en un paquete,
- Retraso en el inicio del siguiente paquete de píldoras activas (es decir, extender el período sin píldoras, píldora inactiva o píldora placebo más allá de 7 días),
- Malabsorción intestinal de comprimidos activos debido a vómitos o diarrea .
- Interacciones farmacológicas entre los AOC y otros medicamentos del usuario que disminuyen los niveles anticonceptivos de estrógeno y/o progestágeno. [44]
En cualquiera de estos casos, se debe utilizar un método anticonceptivo de respaldo hasta que se hayan tomado píldoras con hormonas activas de manera constante durante 7 días consecutivos o hasta que se hayan interrumpido o resuelto las interacciones farmacológicas o las enfermedades subyacentes. [44] Según las pautas de los Centros para el Control y la Prevención de Enfermedades (CDC) de los EE. UU., una píldora se considera "retrasada" si una usuaria la toma después del horario normal de medicación, pero no más de 24 horas después de este horario normal. Si han pasado 24 horas o más desde el momento en que la usuaria debía tomar la píldora, entonces la píldora se considera "olvidada". [40] Las pautas de los CDC analizan los posibles pasos a seguir para las usuarias que olvidaron tomar su píldora o la tomaron tarde. [47]
El papel de las pastillas placebo
La función de las píldoras placebo es doble: permitir que la usuaria continúe con la rutina de tomar una píldora todos los días y simular el ciclo menstrual promedio . Al continuar tomando una píldora todos los días, las usuarias mantienen el hábito diario incluso durante la semana sin hormonas. El hecho de no tomar píldoras durante la semana placebo no afecta la eficacia de la píldora, siempre que se reanude la ingestión diaria de píldoras activas al final de la semana. [ cita requerida ]
La semana sin hormonas o placebo que se incluye en el paquete de píldoras de 28 días simula un ciclo menstrual promedio, aunque los eventos hormonales durante un ciclo de píldoras son significativamente diferentes de los de un ciclo menstrual ovulatorio normal. Debido a que la píldora suprime la ovulación (que se analizará más en la sección sobre el mecanismo de acción), las usuarias de anticonceptivos no tienen períodos menstruales verdaderos. En cambio, es la falta de hormonas durante una semana lo que causa un sangrado por privación. [37] Se ha pensado que el sangrado por privación que ocurre durante el descanso de las píldoras activas es tranquilizador, una confirmación física de que no se está embarazada. [48] El sangrado por privación también es predecible. El sangrado intermenstrual inesperado puede ser un posible efecto secundario de los regímenes activos a largo plazo. [49]
Dado que no es raro que las mujeres que menstrúan sufran anemia, algunas píldoras placebo pueden contener un suplemento de hierro . [50] [51] Esto repone las reservas de hierro que pueden agotarse durante la menstruación. Además, las píldoras anticonceptivas, como los AOC, a veces se fortifican con ácido fólico , ya que se recomienda tomar suplementos de ácido fólico en los meses previos al embarazo para disminuir la probabilidad de defectos del tubo neural en los bebés. [52] [53]
Ningún placebo o placebos con menor frecuencia
Si la formulación de la píldora es monofásica, es decir, cada píldora hormonal contiene una dosis fija de hormonas, es posible evitar el sangrado por privación y seguir estando protegida contra la concepción si se omiten por completo las píldoras placebo y se comienza directamente con el siguiente paquete. Intentar esto con formulaciones de píldoras bifásicas o trifásicas conlleva un mayor riesgo de sangrado intermenstrual y puede ser indeseable. Sin embargo, no aumentará el riesgo de quedar embarazada.
A partir de 2003, las mujeres también han podido utilizar una versión de tres meses de la píldora. [54] De manera similar al efecto de utilizar una formulación de dosis constante y omitir las semanas de placebo durante tres meses, Seasonale brinda el beneficio de períodos menos frecuentes, con el posible inconveniente de sangrado intermenstrual. Seasonique es otra versión en la que la semana de placebo cada tres meses se reemplaza con una semana de estrógeno en dosis baja.
También se ha comercializado una versión de la píldora combinada para eliminar las píldoras placebo y los sangrados por abstinencia. Comercializada como Anya o Lybrel, los estudios han demostrado que después de siete meses, el 71% de las usuarias ya no tenían sangrados intermenstruales, el efecto secundario más común de pasar períodos más largos sin dejar de tomar las píldoras activas.
Si bien es necesario realizar más investigaciones para evaluar la seguridad a largo plazo del uso continuo de AOC, los estudios han demostrado que puede no haber diferencias en los efectos adversos a corto plazo al comparar el uso continuo versus el uso cíclico de píldoras anticonceptivas. [46]
Uso no anticonceptivo
Las hormonas de la píldora también se han utilizado para tratar otras afecciones médicas, como el síndrome de ovario poliquístico (SOP), la endometriosis , la adenomiosis , el acné, el hirsutismo, la amenorrea , los calambres menstruales, las migrañas menstruales , la menorragia (sangrado menstrual excesivo), la anemia relacionada con la menstruación o con fibromas y la dismenorrea (menstruación dolorosa). [41] [55] Además del acné, la FDA de EE. UU. no ha aprobado ningún anticonceptivo oral para los usos mencionados anteriormente a pesar de su uso extensivo para estas afecciones. [56]
SOP
La causa del síndrome de ovario poliquístico (SOP) es multifactorial y no se conoce bien. Las mujeres con SOP suelen tener niveles más altos de lo normal de hormona luteinizante (LH) y andrógenos que afectan el funcionamiento normal de los ovarios. [57] Si bien se desarrollan múltiples folículos pequeños en el ovario, ninguno puede crecer lo suficiente como para convertirse en el folículo dominante y desencadenar la ovulación. [58] Esto conduce a un desequilibrio de LH, hormona estimulante del folículo, estrógeno y progesterona. Sin ovulación, el estrógeno sin oposición puede conducir a hiperplasia endometrial o crecimiento excesivo de tejido en el útero. [59] Es más probable que este crecimiento excesivo del endometrio se vuelva canceroso que el tejido endometrial normal. [60] Por lo tanto, aunque los datos varían, la mayoría de las sociedades ginecológicas coinciden en que, debido al estrógeno sin oposición, las mujeres con SOP tienen un mayor riesgo de cáncer de endometrio. [61]
Para reducir el riesgo de cáncer de endometrio, a menudo se recomienda que las mujeres con SOP que no desean quedarse embarazadas tomen anticonceptivos hormonales para prevenir los efectos del estrógeno sin oposición. Se recomiendan tanto los anticonceptivos orales combinados como los métodos que contienen solo progestina. [ cita requerida ] Es el componente de progestina de los anticonceptivos orales combinados el que protege al endometrio de la hiperplasia y, por lo tanto, reduce el riesgo de cáncer de endometrio de una mujer con SOP. [62] Los anticonceptivos orales combinados se prefieren a los métodos que contienen solo progestina en mujeres que también tienen acné no controlado, síntomas de hirsutismo y alopecia androgénica, porque los anticonceptivos orales combinados pueden ayudar a tratar estos síntomas. [37]
Acné e hirsutismo
Los anticonceptivos orales combinados se recetan a veces para tratar los síntomas de la androgenización, como el acné y el hirsutismo. [63] El componente de estrógeno de los anticonceptivos orales combinados parece suprimir la producción de andrógenos en los ovarios. El estrógeno también conduce a un aumento de la síntesis de globulina transportadora de hormonas sexuales, lo que provoca una disminución de los niveles de testosterona libre. [64]
En última instancia, la caída del nivel de andrógenos libres conduce a una disminución en la producción de sebo, que es un contribuyente importante al desarrollo del acné. [ cita requerida ] La FDA ha aprobado cuatro anticonceptivos orales diferentes para tratar el acné moderado si la paciente tiene al menos 14 o 15 años, ya ha comenzado a menstruar y necesita anticoncepción. Estos incluyen Ortho Tri-Cyclen , Estrostep , Beyaz y YAZ . [65] [66] [67]
El hirsutismo es el crecimiento de vello grueso y oscuro, mientras que en las mujeres normalmente solo crece vello fino o no crece vello en absoluto. [68] Este crecimiento de vello en la cara, el pecho y el abdomen también está mediado por niveles más altos o la acción de los andrógenos. Por lo tanto, los AOC también funcionan para tratar estos síntomas al reducir los niveles de andrógenos circulantes libres. [69]
Los estudios han demostrado que los AOC son eficaces para reducir las lesiones de acné facial tanto inflamatorias como no inflamatorias. [70] Sin embargo, no se han estudiado comparaciones entre diferentes AOC para comprender si alguna marca es superior a las demás. [70] El estrógeno disminuye la producción de sebo al encoger la glándula sebácea , aumentar la producción de SHBG para reducir la testosterona no unida y regular los niveles de LH y FSH. [71] Actualmente, ningún estudio ha demostrado que los COP sean eficaces contra las lesiones de acné.
Endometriosis
Para el dolor pélvico asociado con la endometriosis, los AOC se consideran un tratamiento médico de primera línea, junto con los AINE, los agonistas de la GnRH y los inhibidores de la aromatasa. [72] Los AOC actúan suprimiendo el crecimiento del tejido endometrial extrauterino, lo que reduce sus efectos inflamatorios. [37] Los AOC, junto con los demás tratamientos médicos mencionados anteriormente, no eliminan el crecimiento del tejido extrauterino, solo reducen los síntomas. La cirugía es el único tratamiento definitivo. Los estudios que analizan las tasas de recurrencia del dolor pélvico después de la cirugía han demostrado que el uso continuo de AOC es más eficaz para reducir la recurrencia del dolor que el uso cíclico. [73]
Adenomiosis
Al igual que la endometriosis, la adenomiosis suele tratarse con anticonceptivos orales combinados para inhibir el crecimiento del tejido endometrial que ha crecido hacia el miometrio. Sin embargo, a diferencia de la endometriosis, los DIU que contienen levonorgestrel son más eficaces para reducir el dolor pélvico en la adenomiosis que los anticonceptivos orales combinados. [37]
Menorragia
En el ciclo menstrual promedio, una mujer suele perder entre 35 y 40 mililitros de sangre. [74] Sin embargo, hasta el 20% de las mujeres experimentan un sangrado mucho más abundante, o menorragia. [75] Esta pérdida excesiva de sangre puede provocar anemia, con síntomas de fatiga y debilidad, así como la interrupción de sus actividades normales de la vida. [76] Los AOC contienen progestina, que hace que el revestimiento del útero sea más delgado, lo que resulta en episodios de sangrado más leves para aquellas con sangrado menstrual abundante. [77]
Amenorrea
Aunque a veces se prescribe la píldora para inducir la menstruación según un cronograma regular a las mujeres que sufren ciclos menstruales irregulares, en realidad suprime el ciclo menstrual normal y luego imita un ciclo mensual regular de 28 días.
A las mujeres que sufren disfunción menstrual debido a la tríada de la atleta femenina a veces se les recetan anticonceptivos orales en forma de píldoras que pueden crear ciclos de sangrado menstrual. [78] Sin embargo, la causa subyacente de la afección es la deficiencia energética y debe tratarse corrigiendo el desequilibrio entre las calorías ingeridas y las calorías quemadas al hacer ejercicio. Los anticonceptivos orales no deben utilizarse como tratamiento inicial para la tríada de la atleta femenina. [78]
Supresión menstrual
El sangrado menstrual no es necesario en mujeres que no desean concebir, por lo tanto, la supresión menstrual puede implementarse en mujeres que no desean tener sangrado menstrual por conveniencia, trastornos ginecológicos , trastornos hemorrágicos u otras condiciones médicas. [79]
En los dos tipos de AOC, solo los AOC pueden lograr la amenorrea , mientras que las AOP solo pueden reducir la cantidad de sangre. [80] El método para usar AOC para la supresión menstrual es omitir las 7 píldoras placebo y continuar tomando píldoras activas después de las 21 píldoras activas. [81] Esto se puede usar en el método extendido o el método continuo. [81] Para el método extendido, las pacientes que toman píldoras activas durante 3, 4 o 6 meses y luego toman píldoras placebo durante un período de tiempo tendrán más probabilidades de experimentar sangrado por deprivación. [81] El intervalo puede ser decidido por las pacientes de acuerdo con sus propias preferencias. [81] Para el método continuo, las pacientes pueden tomar AOC durante un año continuamente sin ninguna píldora placebo. [81] En los primeros meses de uso prolongado o continuo de AOC, puede ocurrir sangrado o manchado no programado. [82] Sin embargo, se espera que el sangrado o manchado se resuelva después de unos meses de uso. [82]
La supresión menstrual se utiliza comúnmente por conveniencia, especialmente cuando las mujeres se van de vacaciones. [79] También se utiliza para trastornos ginecológicos como la dismenorrea (comúnmente conocida como dolor menstrual), síntomas relacionados con el cambio hormonal premenstrual y sangrado excesivo relacionado con fibromas uterinos . Las pacientes también pueden beneficiarse de la supresión menstrual para trastornos hemorrágicos o anemia crónica . [79]
Migraña menstrual
Los pacientes con migraña menstrual relacionada con estrógenos , pero sin aura ni factores de riesgo adicionales de accidente cerebrovascular, pueden beneficiarse de los AOC. [83] [84] Sin embargo, las mujeres mayores y aquellas con antecedentes familiares importantes de dolores de cabeza problemáticos pueden descubrir que el uso de AOC empeora su dolor de cabeza. [83] [84]
Beneficios
La característica distintiva de los AOC en comparación con otros métodos anticonceptivos es que son menos invasivos y no interfieren con las relaciones sexuales. [39] Datos concluyentes sugieren que la tasa de fracaso de la anticoncepción en el uso de AOC durante el primer año es del 9% en el uso típico que permite dosis olvidadas , y <1% en el uso perfecto. [24] [39] La eficacia de los AOC en la prevención del embarazo es alta en general. [24] Además, el uso regular de AOC tiende no solo a aliviar el síndrome premenstrual , sino también a permitir una menstruación más ligera y menos dolorosa. [39] Además, la asociación entre un riesgo suprimido de desarrollar cáncer de ovario y el uso de AOC está probada. [85] [86]
Contraindicaciones
Si bien los anticonceptivos orales combinados se consideran generalmente un medicamento relativamente seguro, están contraindicados para quienes padecen ciertas afecciones médicas. La Organización Mundial de la Salud y los Centros para el Control y la Prevención de Enfermedades de los Estados Unidos publican una guía, denominada criterios de elegibilidad médica , sobre la seguridad de los anticonceptivos en el contexto de afecciones médicas. [87] [41]
En términos de protección en las relaciones sexuales , la dependencia exclusiva de los AOC no protege contra infecciones de transmisión sexual como el VPH . [24] [39] Además, el sangrado intermenstrual y el manchado son excepcionalmente frecuentes en la etapa temprana del uso de AOC. [24] [29] [39] Aunque la mayoría de los efectos secundarios informados, incluidas las náuseas , el dolor de cabeza o los cambios de humor , desaparecerán a medida que progrese la terapia o al cambiar la formulación, la presión arterial elevada o los coágulos de sangre en pacientes con afecciones cardiovasculares son efectos secundarios documentados que requieren atención médica si no la interrupción de los AOC. [24] [29] [39] Esto se debe a que se ha descubierto que el uso de AOC está relacionado con un mayor riesgo de accidente cerebrovascular isquémico o infarto de miocardio , especialmente en AOC con >50 μg de estrógeno. [88] Además, no se pueden descuidar algunos estudios en curso que brindan evidencia sobre la asociación entre el uso de AOC y el aumento de los riesgos de cáncer de mama . [89] [90] [85] [86]
Según los Criterios médicos de elegibilidad para el uso de anticonceptivos de la OMS de 2015, la categoría 3 implica que el uso de dicho método anticonceptivo generalmente no se recomienda, a menos que no haya otros métodos más apropiados disponibles o aceptables y se cuente con buenos recursos de juicio clínico; la categoría 4 implica que el método anticonceptivo no se debe utilizar incluso con buenos recursos de juicio clínico. [91] Ambas categorías sugieren que el método anticonceptivo no se debe utilizar con recursos limitados para el juicio clínico. [91] Las tablas siguientes resumen las condiciones de las categorías 3 y 4 de los Criterios médicos de elegibilidad para el uso de anticonceptivos de la OMS de 2015.
Precauciones y contraindicaciones de los AOC
| Condición | Categoría |
|---|---|
| Amamantamiento | |
| durante < 6 semanas después del parto | 4 |
| durante ≥ 6 semanas a < 6 meses después del parto | 3 |
| Posparto (sin lactancia materna) | |
| < 21 días posparto sin otros factores de riesgo de TEV | 3 |
| < 21 días posparto con otros factores de riesgo de TEV | 4 |
| ≥ 21 días a 42 días después del parto con otros factores de riesgo de TEV | 3 |
| De fumar | |
| edad ≥ 35 años y tabaquismo < 15 cigarrillos/día | 3 |
| edad ≥ 35 años y tabaquismo ≥ 15 cigarrillos/día | 4 |
| Múltiples factores de riesgo de enfermedad cardiovascular arterial | 3/4* |
| Hipertensión | |
| Antecedentes de hipertensión, donde NO se puede evaluar la presión arterial | 3 |
| Hipertensión adecuadamente controlada, donde la presión arterial PUEDE evaluarse | 3 |
| niveles elevados de presión arterial (medidas tomadas correctamente) con presión sistólica de 140 a 159 o diastólica de 90 a 99 mm Hg | 3 |
| niveles elevados de presión arterial (medidas tomadas correctamente) con presión sistólica ≥ 160 o diastólica ≥ 100 mm Hg | 4 |
| Niveles elevados de presión arterial (medidos correctamente) con enfermedad vascular | 4 |
| Trombosis venosa profunda (TVP) / Embolia pulmonar (EP) | |
| con antecedentes de TVP/EP | 4 |
| con TVP/EP aguda | 4 |
| con TVP/EP y tratamiento anticoagulante establecido | 4 |
| Con cirugía mayor con inmovilización prolongada | 4 |
| Mutaciones trombogénicas conocidas | 4 |
| Historia y actualidad de la cardiopatía isquémica | 4 |
| Accidente cerebrovascular (antecedentes de accidente cerebrovascular) | 4 |
| Enfermedad cardíaca valvular complicada | 4 |
| Anticuerpos antifosfolípidos positivos (o desconocidos) Lupus eritematoso sistémico | 4 |
| Dolor de cabeza | |
| Migraña sin aura en personas ≥ 35 años (para el inicio de AOC) | 3 |
| Migraña sin aura de edad < 35 años (para continuación de AOC) | 3 |
| Migraña sin aura en personas ≥ 35 años (para continuar con AOC) | 4 |
| Migraña con aura, a cualquier edad (para inicio y continuación de AOC) | 4 |
| Cáncer de mama | |
| Cáncer de mama actual | 4 |
| Cáncer de mama en el pasado y sin evidencia de enfermedad actual durante 5 años | 3 |
| Nefropatía / retinopatía / neuropatía | 3/4* |
| Otra enfermedad vascular o diabetes de > 20 años de duración | 3/4* |
| Enfermedad de la vesícula biliar sintomática tratada médicamente | 3 |
| Enfermedad sintomática actual de la vesícula biliar | 3 |
| Historial de colestasis relacionado con AOC | 3 |
| Hepatitis viral aguda o en brote (para el inicio de AOC) | 3/4* |
| Cirrosis grave (descompensada) | 4 |
| Tumores hepáticos | |
| adenoma hepatocelular | 4 |
| maligno (hepatoma) | 4 |
| Sobre terapia anticonvulsiva | |
| con fenitoína , carbamazepina , barbitúricos , primidona , topiramato , oxcarbazepina | 3 |
| con Lamotrigina | 3 |
| Sobre terapia antimicrobiana con Rifampicina o terapia con rifabutina | |
*La categoría debe evaluarse según la gravedad de la condición.
Hipercoagulabilidad
El estrógeno en dosis altas puede aumentar el riesgo de coágulos sanguíneos. Todas las usuarias de AOC tienen un pequeño aumento en el riesgo de tromboembolia venosa en comparación con las no usuarias; este riesgo es mayor durante el primer año de uso de AOC. [92] Las personas con cualquier condición médica preexistente que también aumenta su riesgo de coágulos sanguíneos tienen un aumento más significativo en el riesgo de eventos trombóticos con el uso de AOC. [92] Estas condiciones incluyen, entre otras, presión arterial alta, enfermedad cardiovascular preexistente (como enfermedad cardíaca valvular o enfermedad cardíaca isquémica [93] ), antecedentes de tromboembolia o embolia pulmonar, accidente cerebrovascular y una tendencia familiar a formar coágulos sanguíneos (como el factor familiar V Leiden ). [94] Hay condiciones que, cuando se asocian con el uso de AOC, aumentan el riesgo de efectos adversos distintos de la trombosis. Por ejemplo, las mujeres con antecedentes de migraña con aura tienen un mayor riesgo de sufrir un accidente cerebrovascular cuando usan AOC, y las mujeres que fuman mayores de 35 años y usan AOC tienen un mayor riesgo de sufrir un infarto de miocardio . [87]
Embarazo y posparto
Las mujeres que se sabe que están embarazadas no deben tomar AOC. A las mujeres que están amamantando en el período posparto también se les recomienda no comenzar a tomar AOC hasta 4 semanas después del parto debido al mayor riesgo de coágulos sanguíneos. [40] Si bien los estudios han demostrado resultados contradictorios sobre los efectos de los AOC en la duración de la lactancia y el volumen de leche, existen preocupaciones sobre el riesgo transitorio de los AOC en la producción de leche materna cuando la lactancia se está estableciendo en el posparto temprano. [95] Debido a los riesgos indicados y las preocupaciones adicionales sobre la lactancia, no se recomienda a las mujeres que están amamantando que comiencen a tomar AOC hasta al menos seis semanas después del parto, mientras que las mujeres que no están amamantando y no tienen otros factores de riesgo de coágulos sanguíneos pueden comenzar a tomar AOC después de 21 días después del parto. [96] [87]
Cáncer de mama
La Organización Mundial de la Salud (OMS) no recomienda el uso de AOC en mujeres con cáncer de mama. [41] [97] Dado que los AOC contienen estrógeno y progestina, no se recomienda su uso en mujeres con cánceres sensibles a las hormonas, incluidos algunos tipos de cáncer de mama. [98] [ ¿ Fuente médica poco confiable? ] [99] Los métodos anticonceptivos no hormonales, como el DIU de cobre o los condones, [100] deberían ser la opción anticonceptiva de primera línea para estas pacientes en lugar de los AOC. [101] [ ¿ Fuente médica poco confiable? ]
Otro
Las mujeres con cáncer de endometrio conocido o sospechado o sangrado uterino inexplicable tampoco deben tomar AOC para evitar riesgos para la salud. [93] Los AOC también están contraindicados para personas con diabetes avanzada, tumores hepáticos, adenoma hepático o cirrosis hepática grave . [41] [94] Los AOC se metabolizan en el hígado y, por lo tanto, la enfermedad hepática puede conducir a una eliminación reducida del medicamento. Además, la hipercolesterolemia grave y la hipertrigliceridemia también son contraindicaciones, pero la evidencia que muestra que los AOC conducen a peores resultados en esta población es débil. [37] [40] La obesidad no se considera una contraindicación para tomar AOC. [40]
Efectos secundarios
En general, se acepta que los riesgos para la salud de los anticonceptivos orales son menores que los del embarazo y el parto [102] y que "los beneficios para la salud de cualquier método anticonceptivo son mucho mayores que los riesgos que pueda presentar el método". [103] Algunas organizaciones han argumentado que comparar un método anticonceptivo con ningún método (embarazo) no es relevante; en cambio, la comparación de la seguridad debería hacerse entre los métodos anticonceptivos disponibles. [104]
Común
Distintas fuentes señalan una incidencia diferente de efectos secundarios. El efecto secundario más común es el sangrado intermenstrual . Las píldoras AOC pueden mejorar afecciones como la dismenorrea, el síndrome premenstrual y el acné, [105] reducir los síntomas de la endometriosis y el síndrome de ovario poliquístico y disminuir el riesgo de anemia. [106] El uso de anticonceptivos orales también reduce el riesgo de cáncer de ovario y de endometrio a lo largo de la vida. [107] [108] [109]
Pueden presentarse náuseas, vómitos, dolor de cabeza, distensión abdominal, sensibilidad en los senos, hinchazón de tobillos o pies (retención de líquidos) o cambios de peso. Pueden presentarse sangrados vaginales entre períodos menstruales (manchado) o períodos irregulares o faltantes, especialmente durante los primeros meses de uso. [110]
Corazón y vasos sanguíneos
Los anticonceptivos orales combinados se asocian con un mayor riesgo de tromboembolia venosa , incluida la trombosis venosa profunda (TVP) y la embolia pulmonar (EP). [111] [112]
Si bien las dosis más bajas de estrógeno en las píldoras AOC pueden tener un menor riesgo de accidente cerebrovascular e infarto de miocardio en comparación con las píldoras con dosis más altas de estrógeno (50 μg/día), las usuarias de píldoras AOC con dosis bajas de estrógeno aún tienen un mayor riesgo en comparación con las no usuarias. [113] Estos riesgos son mayores en mujeres con factores de riesgo adicionales, como fumar (que aumenta el riesgo sustancialmente) y el uso prolongado de la píldora, especialmente en mujeres mayores de 35 años. [114]
El riesgo absoluto general de trombosis venosa por 100.000 mujeres-año en el uso actual de anticonceptivos orales combinados es de aproximadamente 60, en comparación con 30 en las no usuarias. [115] El riesgo de tromboembolia varía con los diferentes tipos de píldoras anticonceptivas; en comparación con los anticonceptivos orales combinados que contienen levonorgestrel (LNG), y con la misma dosis de estrógeno y duración de uso, la razón de tasas de trombosis venosa profunda para los anticonceptivos orales combinados con noretisterona es de 0,98, con norgestimato de 1,19, con desogestrel (DSG) de 1,82, con gestodeno de 1,86, con drospirenona (DRSP) de 1,64 y con acetato de ciproterona de 1,88. [115] En comparación, la tromboembolia venosa ocurre en 100-200 por 100.000 mujeres embarazadas cada año. [115]
Un estudio mostró un aumento de más del 600% en el riesgo de coágulos sanguíneos para las mujeres que tomaban AOC con drospirenona en comparación con las que no los usaban, en comparación con un 360% más alto para las mujeres que tomaban píldoras anticonceptivas que contenían levonorgestrel. [116] La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) inició estudios para evaluar la salud de más de 800.000 mujeres que tomaban AOC y descubrió que el riesgo de TEV era un 93% más alto para las mujeres que habían estado tomando AOC con drospirenona durante 3 meses o menos y un 290% más alto para las mujeres que tomaban AOC con drospirenona durante 7 a 12 meses, en comparación con las mujeres que tomaban otros tipos de anticonceptivos orales. [117]
Basándose en estos estudios, en 2012 la FDA actualizó la etiqueta de los anticonceptivos orales combinados con drospirenona para incluir una advertencia de que los anticonceptivos con drospirenona pueden tener un mayor riesgo de coágulos sanguíneos peligrosos. [118]
Una revisión sistemática y un metanálisis de 2015 descubrieron que las píldoras anticonceptivas combinadas estaban asociadas con un riesgo 7,6 veces mayor de trombosis de los senos venosos cerebrales , una forma rara de accidente cerebrovascular en el que la coagulación sanguínea ocurre en los senos venosos cerebrales. [119]
| Tipo | Ruta | Medicamentos | Razón de probabilidades ( IC del 95 %)Intervalo de confianza de la información sobre herramientas) |
|---|---|---|---|
| Terapia hormonal para la menopausia | Oral | Estradiol solo ≤1 mg/día >1 mg/día | 1,27 (1,16–1,39)* 1,22 (1,09–1,37)* 1,35 (1,18–1,55)* |
| Estrógenos conjugados solos ≤0,625 mg/día >0,625 mg/día | 1,49 (1,39–1,60)* 1,40 (1,28–1,53)* 1,71 (1,51–1,93)* | ||
| Acetato de estradiol/medroxiprogesterona | 1,44 (1,09–1,89)* | ||
| Estradiol/didrogesterona ≤1 mg/día E2 >1 mg/día E2 | 1,18 (0,98–1,42) 1,12 (0,90–1,40) 1,34 (0,94–1,90) | ||
| Estradiol/noretisterona ≤1 mg/día E2 >1 mg/día E2 | 1,68 (1,57–1,80)* 1,38 (1,23–1,56)* 1,84 (1,69–2,00)* | ||
| Estradiol/norgestrel o estradiol/drospirenona | 1,42 (1,00–2,03) | ||
| Estrógenos conjugados/acetato de medroxiprogesterona | 2,10 (1,92–2,31)* | ||
| Estrógenos conjugados/norgestrel ≤0,625 mg/día de CEE >0,625 mg/día de CEE | 1,73 (1,57–1,91)* 1,53 (1,36–1,72)* 2,38 (1,99–2,85)* | ||
| Tibolona sola | 1,02 (0,90–1,15) | ||
| Raloxifeno solo | 1,49 (1,24–1,79)* | ||
| Transdérmico | Estradiol solo ≤50 μg/día >50 μg/día | 0,96 (0,88–1,04) 0,94 (0,85–1,03) 1,05 (0,88–1,24) | |
| Estradiol / progestágeno | 0,88 (0,73–1,01) | ||
| Vaginal | Estradiol solo | 0,84 (0,73–0,97) | |
| Estrógenos conjugados solos | 1,04 (0,76–1,43) | ||
| Anticoncepción combinada | Oral | Etinilestradiol/noretisterona | 2,56 (2,15–3,06)* |
| Etinilestradiol/levonorgestrel | 2,38 (2,18–2,59)* | ||
| Etinilestradiol/norgestimato | 2,53 (2,17–2,96)* | ||
| Etinilestradiol/desogestrel | 4,28 (3,66–5,01)* | ||
| Etinilestradiol/gestodeno | 3,64 (3,00–4,43)* | ||
| Etinilestradiol/drospirenona | 4,12 (3,43–4,96)* | ||
| Acetato de etinilestradiol/ciproterona | 4,27 (3,57–5,11)* | ||
| Notas: (1) Estudios de casos y controles anidados (2015, 2019) basados en datos de las bases de datos QResearch y Clinical Practice Research Datalink (CPRD). (2) No se incluyó la progesterona bioidéntica , pero se sabe que no se asocia con ningún riesgo adicional en relación con el estrógeno solo. Notas al pie: * = Estadísticamente significativo ( p < 0,01). Fuentes : Ver plantilla. | |||
Cáncer
Disminución del riesgo de cáncer de ovario, endometrio y colorrectal.
El uso de anticonceptivos orales combinados disminuyó el riesgo de cáncer de ovario , cáncer de endometrio , [44] y cáncer colorrectal . [4] [105] [120] Dos grandes estudios de cohorte publicados en 2010 encontraron una reducción significativa en el riesgo relativo ajustado de mortalidad por cáncer de ovario y endometrio en usuarias alguna vez de AO en comparación con las que nunca los usaron. [2] [121] El uso de anticonceptivos orales (píldoras anticonceptivas) durante cinco años o más disminuye el riesgo de cáncer de ovario en la edad adulta en un 50%. [120] [122] El uso de anticonceptivos orales combinados reduce el riesgo de cáncer de ovario en un 40% y el riesgo de cáncer de endometrio en un 50% en comparación con las que nunca los usaron. La reducción del riesgo aumenta con la duración del uso, con una reducción del 80% en el riesgo de cáncer de ovario y endometrio con el uso durante más de 10 años. La reducción del riesgo de cáncer de ovario y de endometrio persiste durante al menos 20 años. [44]
Mayor riesgo de cáncer de mama, de cuello uterino y de hígado
Un informe de un grupo de trabajo de la Agencia Internacional para la Investigación sobre el Cáncer (IARC) de 2005 encontró que los AOC aumentan el riesgo de cáncer de mama , cuello uterino e hígado . [4] Una revisión sistemática de 2010 no respaldó un aumento del riesgo general de cáncer en usuarias de píldoras anticonceptivas orales combinadas, pero sí encontró un ligero aumento del riesgo de cáncer de mama entre las usuarias actuales, que desaparece entre 5 y 10 años después de haber dejado de usarlas; el estudio también encontró un mayor riesgo de cáncer de cuello uterino y de hígado. [123] Un metaanálisis de 2013 concluyó que cada uso de píldoras anticonceptivas está asociado con un modesto aumento del riesgo de cáncer de mama (riesgo relativo 1,08) y un riesgo reducido de cáncer colorrectal (riesgo relativo 0,86) y cáncer de endometrio (riesgo relativo 0,57). El riesgo de cáncer de cuello uterino en las infectadas con VPH aumenta. [124] Se observó un pequeño aumento similar del riesgo de cáncer de mama en otros metaanálisis. [125] [126] Un estudio de 1,8 millones de mujeres danesas en edad reproductiva seguidas durante 11 años encontró que el riesgo de cáncer de mama era un 20% mayor entre aquellas que usaban actualmente o recientemente anticonceptivos hormonales que entre las mujeres que nunca habían usado anticonceptivos hormonales. [127] Este riesgo aumentó con la duración del uso, con un aumento del 38% en el riesgo después de más de 10 años de uso. [127]
Peso
Una revisión sistemática de 2016 encontró evidencia de baja calidad de que los estudios sobre anticonceptivos hormonales combinados no mostraron grandes diferencias de peso en comparación con los grupos placebo o sin intervención. [128] La evidencia no fue lo suficientemente sólida como para asegurar que los métodos anticonceptivos no provoquen algún cambio de peso, pero no se encontró ningún efecto importante. [128] Esta revisión también encontró "que las mujeres no dejaron de usar la píldora o el parche debido al cambio de peso". [128]
Función sexual y aversión al riesgo
Deseo sexual
Algunos investigadores cuestionan la existencia de un vínculo causal entre el uso de AOC y la disminución de la libido ; [129] un estudio de 2007 de 1700 mujeres encontró que las usuarias de AOC no experimentaron cambios en la satisfacción sexual. [130] Un estudio de laboratorio de 2005 sobre la excitación genital evaluó a catorce mujeres antes y después de que comenzaran a tomar AOC. El estudio encontró que las mujeres experimentaron una gama significativamente más amplia de respuestas de excitación después de comenzar a usar la píldora; las disminuciones y los aumentos en las medidas de excitación fueron igualmente comunes. [131] [132]
En 2012, The Journal of Sexual Medicine publicó una revisión de investigaciones que estudiaban los efectos de los anticonceptivos hormonales en la función sexual femenina que concluyó que los efectos secundarios sexuales de los anticonceptivos hormonales no están bien estudiados y especialmente en lo que respecta a los impactos en la libido, con investigaciones que establecen solo efectos mixtos donde solo pequeños porcentajes de mujeres informan experimentar un aumento o disminución y la mayoría informan no verse afectadas. [133] En 2013, The European Journal of Contraception & Reproductive Health Care publicó una revisión de 36 estudios que incluían a 8422 sujetos femeninos en total que tomaban AOC que encontró que 5358 sujetos (o 63,6 por ciento) no informaron cambios en la libido, 1826 sujetos (o 21,7 por ciento) informaron un aumento y 1238 sujetos (o 14,7 por ciento) informaron una disminución. [134] En 2019, Neuroscience & Biobehavioral Reviews publicó un metanálisis de 22 estudios publicados y 4 no publicados (con 7529 sujetos femeninos en total) que evaluaron si las mujeres se exponen a mayores riesgos de salud en diferentes puntos del ciclo menstrual, incluida la actividad sexual con parejas, y encontraron que los sujetos en el último tercio de la fase folicular y en la ovulación (cuando aumentan los niveles de estradiol endógeno y hormonas luteinizantes) experimentaron una mayor actividad sexual con sus parejas en comparación con la fase lútea y durante la menstruación. [135]
En un estudio de 2006 sobre 124 mujeres premenopáusicas se midieron los niveles de globulina transportadora de hormonas sexuales (SHBG), incluso antes y después de interrumpir el uso de la píldora anticonceptiva oral. Las mujeres que continuaron utilizando anticonceptivos orales tenían niveles de SHBG cuatro veces más altos que las que nunca los habían utilizado, y los niveles se mantuvieron elevados incluso en el grupo que había interrumpido su uso. [136] [137] En teoría, un aumento de SHBG puede ser una respuesta fisiológica al aumento de los niveles hormonales, pero puede disminuir los niveles libres de otras hormonas, como los andrógenos, debido a la inespecificidad de su unión a las hormonas sexuales. En 2020, The Lancet Diabetes & Endocrinology publicó un estudio transversal de 588 mujeres premenopáusicas de entre 18 y 39 años de los estados australianos de Queensland , Nueva Gales del Sur y Victoria con ciclos menstruales regulares cuyos niveles de SHBG se midieron mediante inmunoensayo que encontró que después de controlar la edad, el índice de masa corporal , la etapa del ciclo, el tabaquismo, la paridad, el estado de pareja y la medicación psicoactiva, la SHBG estaba inversamente correlacionada con el deseo sexual . [138]
Atractivo y función sexual
Los anticonceptivos orales combinados pueden aumentar la lubricación vaginal natural , [139] mientras que algunas mujeres experimentan una disminución de la lubricación. [139] [140]
En 2004, las Actas de la Royal Society B: Biological Sciences publicaron un estudio en el que pares de fotografías digitales de los rostros de 48 mujeres de la Universidad de Newcastle y la Universidad Charles de entre 19 y 33 años que no tomaban anticonceptivos hormonales durante el estudio fueron fotografiadas en las fases foliculares tardías y lúteas medias tempranas de sus ciclos menstruales y las fotografías fueron calificadas por 261 sujetos ciegos (130 hombres y 131 mujeres) en sus respectivas universidades que compararon el atractivo facial de cada mujer fotografiada en sus pares de fotografías, y encontraron que los sujetos percibían las imágenes de la fase folicular tardía de las mujeres fotografiadas como más atractivas que las imágenes de la fase lútea por más de lo esperado por casualidad . [141]
En 2007, Evolution and Human Behavior publicó un estudio en el que 18 bailarinas profesionales registraron sus ciclos menstruales, turnos de trabajo y ganancias de propinas en clubes de caballeros durante 60 días y encontraron, mediante un análisis de modelo mixto de 296 turnos de trabajo (o aproximadamente 5.300 bailes eróticos), que las 11 bailarinas con ciclos menstruales normales ganaron US$ 335 por turno de 5 horas durante la fase folicular tardía y en la ovulación, US$ 260 por turno durante la fase lútea y US$ 185 por turno durante la menstruación, mientras que las 7 bailarinas que usaban anticonceptivos hormonales no mostraron un pico de ganancias durante la fase folicular tardía y en la ovulación. [142] En 2008, Evolution and Human Behavior publicó un estudio en el que se grabaron las voces de 51 estudiantes de la Universidad Estatal de Nueva York en Albany, en las que las mujeres contaban del 1 al 10 en cuatro puntos diferentes de sus ciclos menstruales y las calificaron, mediante sujetos ciegos que escucharon las grabaciones, como más atractivas en los puntos del ciclo menstrual con mayores probabilidades de concepción, mientras que las calificaciones de las voces de las mujeres que tomaban anticonceptivos hormonales no mostraron variaciones a lo largo del ciclo menstrual en cuanto a atractivo. [143]
Comportamiento de riesgo
En 1998, Evolution and Human Behavior publicó un estudio de 300 estudiantes universitarias de la Universidad Estatal de Nueva York en Albany, de entre 18 y 54 años (con una edad media de 21,9 años), que examinó la participación de las participantes en 18 comportamientos diferentes durante las 24 horas anteriores a completar el cuestionario del estudio que variaban en su riesgo de posible violación o agresión sexual y el primer día de su última menstruación, y encontró que las participantes en el momento de la ovulación mostraron una disminución estadísticamente significativa en la participación en comportamientos que arriesgaban a una violación y una agresión sexual, mientras que las participantes que tomaban píldoras anticonceptivas no mostraron variaciones a lo largo de sus ciclos menstruales en los mismos comportamientos (lo que sugiere una función psicológicamente adaptativa de las fluctuaciones hormonales durante el ciclo menstrual al provocar la evitación de comportamientos que arriesgan a una violación y una agresión sexual). [144] [145] En 2003, Evolution and Human Behavior publicó un estudio de replicación conceptual de la encuesta de 1998 que confirmó sus hallazgos. [146]
En 2006, un estudio presentado en la conferencia anual de la Sociedad de Ciencias Cognitivas encuestó a 176 estudiantes universitarias de la Universidad Estatal de Michigan (con una edad media de 19,9 años) en un experimento de toma de decisiones en el que las sujetos eligieron entre una opción con un resultado garantizado o una opción que implicaba riesgo e indicaron el primer día de su última menstruación, y encontró que las preferencias de aversión al riesgo de las sujetos variaban a lo largo del ciclo menstrual (ninguna de las sujetos en el momento de la ovulación prefirió la opción arriesgada) y solo las sujetos que no tomaban anticonceptivos hormonales mostraron el efecto del ciclo menstrual en la aversión al riesgo. [147] En el metaanálisis de Neuroscience & Biobehavioral Reviews de 2019 , la investigación revisada también evaluó si las 7.529 sujetos femeninas en los 26 estudios mostraron un mayor reconocimiento de riesgos y evitación de personas potencialmente amenazantes y situaciones peligrosas en diferentes fases del ciclo menstrual y encontró que las sujetos mostraron un mejor reconocimiento de la precisión del riesgo durante la fase folicular tardía y en la ovulación en comparación con la fase lútea. [135]
Depresión
Los niveles bajos de serotonina , un neurotransmisor del cerebro, se han relacionado con la depresión . Se ha demostrado que los niveles altos de estrógeno, como en los anticonceptivos orales combinados de primera generación, y de progestina, como en algunos anticonceptivos que solo contienen progestina, reducen los niveles de serotonina en el cerebro al aumentar la concentración de una enzima cerebral que reduce la serotonina. [ cita requerida ]
Los libros de texto de referencia médica actuales sobre anticoncepción [44] y organizaciones importantes como la ACOG estadounidense [148] , la OMS [87] y la RCOG del Reino Unido [149] coinciden en que la evidencia actual indica que es poco probable que los anticonceptivos orales combinados de dosis baja aumenten el riesgo de depresión y que empeoren la condición en mujeres que están deprimidas.
Hipertensión
La bradicinina reduce la presión arterial al provocar la dilatación de los vasos sanguíneos. Ciertas enzimas son capaces de descomponer la bradicinina (enzima convertidora de angiotensina, aminopeptidasa P). La progesterona puede aumentar los niveles de aminopeptidasa P (AP-P), aumentando así la degradación de la bradicinina, lo que aumenta el riesgo de desarrollar hipertensión. [150]
Tiroides
El estrógeno presente en los anticonceptivos orales puede aumentar la globulina transportadora de tiroides y disminuir la T4 libre. Por lo tanto, un uso prolongado de anticonceptivos orales puede estar fuertemente asociado con el hipotiroidismo, especialmente durante más de 10 años. Además, puede ser necesaria una dosis más alta de tiroxina con los anticonceptivos orales. [151]
Otros efectos
Otros efectos secundarios asociados con los AOC de dosis baja son leucorrea (aumento de las secreciones vaginales), reducción del flujo menstrual , mastalgia (sensibilidad en los senos) y disminución del acné . Los efectos secundarios asociados con los AOC de dosis alta más antiguos incluyen náuseas , vómitos , aumento de la presión arterial y melasma (decoloración de la piel del rostro); estos efectos no están fuertemente asociados con las formulaciones de dosis baja. [ cita médica requerida ]
El exceso de estrógeno, como el de las píldoras anticonceptivas, parece aumentar los niveles de colesterol en la bilis y disminuir el movimiento de la vesícula biliar, lo que puede provocar cálculos biliares . [152] Las progestinas que se encuentran en ciertas formulaciones de píldoras anticonceptivas orales pueden limitar la eficacia del entrenamiento con pesas para aumentar la masa muscular. [153] Este efecto es causado por la capacidad de algunas progestinas para inhibir los receptores de andrógenos . Un estudio afirma que la píldora puede afectar los olores corporales masculinos que prefiere una mujer, lo que a su vez puede influir en su selección de pareja. [154] [155] [156] El uso de anticonceptivos orales combinados se asocia con un riesgo reducido de endometriosis , lo que da un riesgo relativo de endometriosis de 0,63 durante el uso activo, aunque con una calidad limitada de evidencia según una revisión sistemática . [157]
La anticoncepción oral combinada disminuye los niveles de testosterona total en aproximadamente 0,5 nmol/L, la testosterona libre en aproximadamente un 60% y aumenta la cantidad de globulina transportadora de hormonas sexuales (SHBG) en aproximadamente 100 nmol/L. Se ha descubierto que los anticonceptivos que contienen progestinas de segunda generación y/o dosis de estrógeno de alrededor de 20-25 mg de EE tienen un menor impacto en las concentraciones de SHBG. [158] La anticoncepción oral combinada también puede reducir la densidad ósea. [159]
Interacciones farmacológicas
Algunos medicamentos reducen el efecto de la píldora y pueden causar sangrado intermenstrual o aumentar la probabilidad de embarazo. Entre ellos se encuentran medicamentos como la rifampicina , los barbitúricos , la fenitoína y la carbamazepina . Además, se advierte sobre los antibióticos de amplio espectro, como la ampicilina y la doxiciclina , que pueden causar problemas "al afectar la flora bacteriana responsable del reciclaje del etinilestradiol del intestino grueso" ( BNF 2003). [160] [161] [162] [163]
La hierba medicinal tradicional hipérico también se ha visto implicada debido a su regulación positiva del sistema P450 en el hígado , lo que podría aumentar el metabolismo de los componentes etinilestradiol y progestina de algunos anticonceptivos orales combinados. [164]
Accesibilidad
La disponibilidad de productos farmacéuticos para el público la determina el organismo regulador local. En los EE. UU. , la organización responsable es la FDA . Según un comunicado de prensa del 13 de julio de 2023, por primera vez se puso a disposición del público un anticonceptivo oral hormonal diario sin receta médica . [165] Aunque esta clase de medicamentos fue aprobada para su uso con receta médica ya en 1973, se necesitaron 50 años más para desescalar su estatus legal. Tal autorización se hace plausible gracias a la demostración de su uso seguro y eficaz por parte del público en general, sin necesidad de ninguna orientación por parte de los profesionales de la salud. [165] En última instancia, el organismo regulador debe actuar en consecuencia con la evidencia de los solicitantes y actualizar la legislación local. [165]
Historia
En la década de 1930, los científicos habían aislado y determinado la estructura de las hormonas esteroides y descubrieron que altas dosis de andrógenos , estrógenos o progesterona inhibían la ovulación , [173] [174] [175] [176] pero obtener estas hormonas, que se producían a partir de extractos animales, de las compañías farmacéuticas europeas era extraordinariamente caro. [177]
En 1939, Russell Marker , profesor de química orgánica en la Universidad Estatal de Pensilvania , desarrolló un método para sintetizar progesterona a partir de sapogeninas esteroides vegetales , inicialmente utilizando zarsapogenina de zarzaparrilla , que resultó demasiado cara. Después de tres años de extensa investigación botánica, descubrió un material de partida mucho mejor, la saponina de los ñames mexicanos no comestibles ( Dioscorea mexicana y Dioscorea composita ) que se encuentran en las selvas tropicales de Veracruz cerca de Orizaba . La saponina se podía convertir en el laboratorio en su fracción aglicona, la diosgenina . Incapaz de interesar a su patrocinador de investigación Parke-Davis en el potencial comercial de sintetizar progesterona a partir de ñames mexicanos, Marker dejó Penn State y en 1944 cofundó Syntex con dos socios en la Ciudad de México . Cuando dejó Syntex un año después, el comercio del ñame barbasco había comenzado y se había iniciado el período de apogeo de la industria mexicana de esteroides . Syntex rompió el monopolio de las compañías farmacéuticas europeas sobre las hormonas esteroides, reduciendo el precio de la progesterona casi 200 veces en los siguientes ocho años. [178] [179] [180]
A mediados del siglo XX, el escenario estaba preparado para el desarrollo de un anticonceptivo hormonal , pero las compañías farmacéuticas, las universidades y los gobiernos no mostraron interés en continuar la investigación. [181]
Progesterona para prevenir la ovulación
En 1937, Makepeace y sus colegas demostraron por primera vez que la progesterona administrada mediante inyecciones inhibe la ovulación en animales. [182]
En 1951, el fisiólogo reproductivo Gregory Pincus , líder en investigación hormonal y cofundador de la Fundación Worcester para la Biología Experimental (WFEB) en Shrewsbury, Massachusetts , conoció por primera vez a la fundadora del movimiento de control de la natalidad estadounidense, Margaret Sanger , en una cena en Manhattan organizada por Abraham Stone, director médico y vicepresidente de Planned Parenthood (PPFA), quien ayudó a Pincus a obtener una pequeña subvención de PPFA para comenzar la investigación sobre anticonceptivos hormonales. [183] [184] [185] La investigación comenzó en abril de 1951, con el fisiólogo reproductivo Min Chueh Chang repitiendo y ampliando los experimentos de 1937 de Makepeace et al. que se publicaron en 1953 y demostraron que las inyecciones de progesterona suprimían la ovulación en conejos. [182] En octubre de 1951, GD Searle & Company rechazó la solicitud de Pincus de financiar su investigación sobre anticonceptivos hormonales, pero lo contrató como consultor y continuó proporcionando compuestos químicos para evaluar. [177] [186] [187]
En marzo de 1952, Sanger escribió una breve nota mencionando la investigación de Pincus a su amiga y seguidora de toda la vida, la sufragista y filántropa Katharine Dexter McCormick , quien visitó la WFEB y a su cofundador y viejo amigo Hudson Hoagland en junio de 1952 para aprender sobre la investigación anticonceptiva allí. Frustrada cuando la investigación se estancó por la falta de interés de la PPFA y la escasa financiación, McCormick organizó una reunión en la WFEB en junio de 1953, con Sanger y Hoagland, donde conoció por primera vez a Pincus, quien se comprometió a expandir y acelerar drásticamente la investigación con McCormick proporcionando cincuenta veces la financiación anterior de la PPFA. [186] [188]
Pincus y McCormick reclutaron al profesor clínico de ginecología de Harvard John Rock , jefe de ginecología en el Free Hospital for Women y experto en el tratamiento de la infertilidad , para dirigir la investigación clínica con mujeres. En una conferencia científica en 1952, Pincus y Rock, que se conocían desde hacía muchos años, descubrieron que estaban utilizando enfoques similares para lograr objetivos opuestos. En 1952, Rock indujo un estado de " pseudoembarazo " anovulatorio de tres meses en ochenta de sus pacientes de infertilidad con dosis orales continuas y gradualmente crecientes de un estrógeno (5 a 30 mg/día de dietilestilbestrol ) y progesterona (50 a 300 mg/día), y dentro de los cuatro meses siguientes el 15% de las mujeres quedaron embarazadas. [186] [189] [190]
En 1953, por sugerencia de Pincus, Rock indujo un estado de "pseudoembarazo" anovulatorio de tres meses en veintisiete de sus pacientes de infertilidad con un régimen oral de 300 mg/día de solo progesterona durante 20 días desde los días 5 al 24 del ciclo seguido de días sin píldoras para producir sangrado por deprivación . [191] Esto produjo la misma tasa de embarazo del 15% durante los siguientes cuatro meses sin la amenorrea del régimen continuo anterior de estrógeno y progesterona. [191] Pero el 20% de las mujeres experimentaron sangrado intermenstrual y en el primer ciclo la ovulación se suprimió solo en el 85% de las mujeres, lo que indica que se necesitarían dosis orales de progesterona incluso más altas y más caras para suprimir inicialmente la ovulación de manera consistente. [191] De manera similar, Ishikawa y colegas encontraron que la inhibición de la ovulación ocurrió solo en una "proporción" de casos con 300 mg/día de progesterona oral. [192] A pesar de la inhibición incompleta de la ovulación por la progesterona oral, no se produjeron embarazos en los dos estudios, aunque esto podría haberse debido simplemente al azar. [192] [193] Sin embargo, Ishikawa et al. informaron que el moco cervical en mujeres que tomaban progesterona oral se volvió impenetrable para los espermatozoides, y esto puede haber explicado la ausencia de embarazos. [192] [193]
La progesterona fue abandonada como inhibidor oral de la ovulación después de estos estudios clínicos debido a las dosis altas y costosas requeridas, la inhibición incompleta de la ovulación y la frecuente incidencia de sangrado intermenstrual. [182] [194] En cambio, los investigadores recurrirían a progestágenos sintéticos mucho más potentes para su uso en anticoncepción oral en el futuro. [182] [194]
Progestinas para prevenir la ovulación
En octubre de 1951, el químico Luis Miramontes , trabajando bajo la supervisión de Carl Djerassi y la dirección de George Rosenkranz en Syntex en la Ciudad de México, sintetizó el primer anticonceptivo oral, que se basaba en la progestina altamente activa noretisterona. Frank B. Colton en Searle en Skokie, Illinois sintetizó las progestinas orales altamente activas noretinodrel (un isómero de la noretisterona) en 1952 y noretandrolona en 1953. [177]
Pincus pidió a sus contactos en las compañías farmacéuticas que le enviaran compuestos químicos con actividad progestágena. Chang analizó casi 200 compuestos químicos en animales y descubrió que los tres más prometedores eran la noretisterona de Syntex y el noretinodrel y la noretandrolona de Searle . [195]
En diciembre de 1954, Rock comenzó los primeros estudios sobre el potencial de supresión de la ovulación de dosis de 5 a 50 mg de las tres progestinas orales durante tres meses (durante 21 días por ciclo, los días 5 a 25 seguidos de días sin píldoras para producir sangrado por deprivación) en cincuenta de sus pacientes con infertilidad en Brookline, Massachusetts . Las dosis de 5 mg de noretisterona o noretinodrel y todas las dosis de noretandrolona suprimieron la ovulación pero causaron sangrado intermenstrual, pero las dosis de 10 mg y más altas de noretisterona o noretinodrel suprimieron la ovulación sin sangrado intermenstrual y llevaron a una tasa de embarazo del 14% en los siguientes cinco meses. Pincus y Rock seleccionaron el noretinodrel de Searle para los primeros ensayos anticonceptivos en mujeres, citando su falta total de androgenicidad frente a la muy leve androgenicidad de la noretisterona de Syntex en pruebas con animales. [196] [197]
Anticonceptivo oral combinado
Posteriormente se descubrió que el noretinodrel (y la noretisterona) estaban contaminados con un pequeño porcentaje del estrógeno mestranol (un intermediario en su síntesis), y que el noretinodrel del estudio de Rock de 1954-5 contenía entre un 4 y un 7 % de mestranol. Cuando una mayor purificación del noretinodrel para que contuviera menos del 1 % de mestranol provocó sangrado intermenstrual, se decidió incorporar intencionalmente un 2,2 % de mestranol, un porcentaje que no se asoció con el sangrado intermenstrual, en los primeros ensayos anticonceptivos en mujeres en 1954. La combinación de noretinodrel y mestranol recibió el nombre patentado de Enovid . [197] [198]
El primer ensayo anticonceptivo de Enovid dirigido por Celso-Ramón García y Edris Rice-Wray comenzó en abril de 1956 en Río Piedras, Puerto Rico . [199] [200] [201] Un segundo ensayo anticonceptivo de Enovid (y noretisterona) dirigido por Edward T. Tyler comenzó en junio de 1956 en Los Ángeles . [180] [202] En enero de 1957, Searle celebró un simposio en el que se revisaba la investigación ginecológica y anticonceptiva sobre Enovid hasta 1956 y concluyó que el contenido de estrógeno de Enovid podía reducirse en un 33% para reducir la incidencia de efectos secundarios gastrointestinales estrogénicos sin aumentar significativamente la incidencia de sangrado intermenstrual. [203]
Si bien estos ensayos a gran escala contribuyeron a la comprensión inicial de los efectos clínicos de la formulación de la píldora, las implicaciones éticas de los ensayos generaron una controversia significativa. Cabe destacar la aparente falta de autonomía y consentimiento informado entre los participantes de la cohorte puertorriqueña antes de los ensayos. Muchos de estos participantes provenían de entornos pobres y de clase trabajadora. [10]
Disponibilidad pública
En 2013, menos de un tercio de los países del mundo exigían receta médica para los anticonceptivos orales. [204]
Estados Unidos
_(8249451687).jpg/440px-Patient_Package_Insert_for_Oral_Contraceptives_(FDA_079)_(8249451687).jpg)
En junio de 1957, la Administración de Alimentos y Medicamentos (FDA) aprobó Enovid 10 mg (9,85 mg de noretinodrel y 150 μg de mestranol) para trastornos menstruales, basándose en datos de su uso por más de 600 mujeres. Numerosos ensayos anticonceptivos adicionales mostraron que Enovid en dosis de 10, 5 y 2,5 mg era altamente eficaz. En julio de 1959, Searle presentó una solicitud complementaria para agregar la anticoncepción como una indicación aprobada para dosis de 10, 5 y 2,5 mg de Enovid. La FDA se negó a considerar la solicitud hasta que Searle aceptó retirar las formas de dosificación más bajas de la solicitud. En mayo de 1960, la FDA anunció que aprobaría Enovid 10 mg para uso anticonceptivo, y lo hizo en junio de 1960. En ese momento, Enovid 10 mg había sido de uso general durante tres años y, según una estimación conservadora, al menos medio millón de mujeres lo habían usado. [201] [205] [206]
Aunque la FDA aprobó el Enovid para uso anticonceptivo, Searle nunca lo comercializó como anticonceptivo. Ocho meses después, en febrero de 1961, la FDA aprobó el Enovid de 5 mg para uso anticonceptivo. En julio de 1961, Searle finalmente comenzó a comercializar el Enovid de 5 mg (5 mg de noretinodrel y 75 μg de mestranol) a los médicos como anticonceptivo. [205] [207]
Aunque la FDA aprobó el primer anticonceptivo oral en 1960, los anticonceptivos no estaban disponibles para las mujeres casadas en todos los estados hasta Griswold v. Connecticut en 1965, y no estaban disponibles para las mujeres solteras en todos los estados hasta Eisenstadt v. Baird en 1972. [181] [207]
El primer informe de caso publicado de un coágulo de sangre y embolia pulmonar en una mujer que usaba Enavid (Enovid 10 mg en los EE. UU.) en una dosis de 20 mg/día no apareció hasta noviembre de 1961, cuatro años después de su aprobación, momento en el que ya lo habían usado más de un millón de mujeres. [201] [208] [209] Se necesitarían casi una década de estudios epidemiológicos para establecer de manera concluyente un mayor riesgo de trombosis venosa en usuarias de anticonceptivos orales y un mayor riesgo de accidente cerebrovascular e infarto de miocardio en usuarias de anticonceptivos orales que fuman o tienen presión arterial alta u otros factores de riesgo cardiovascular o cerebrovascular. [205] Estos riesgos de los anticonceptivos orales fueron dramatizados en el libro de 1969 The Doctors' Case Against the Pill de la periodista feminista Barbara Seaman , quien ayudó a organizar las Audiencias de la Píldora Nelson de 1970 convocadas por el Senador Gaylord Nelson . [210] Las audiencias fueron conducidas por senadores que eran todos hombres y los testigos en la primera ronda de audiencias eran todos hombres, lo que llevó a Alice Wolfson y otras feministas a protestar por las audiencias y generar atención de los medios. [207] Su trabajo condujo a ordenar la inclusión de prospectos para pacientes con anticonceptivos orales para explicar sus posibles efectos secundarios y riesgos para ayudar a facilitar el consentimiento informado . [211] [212] [213] Los anticonceptivos orales de dosis estándar actuales contienen una dosis de estrógeno que es un tercio menor que el primer anticonceptivo oral comercializado y contienen dosis más bajas de progestinas diferentes y más potentes en una variedad de formulaciones. [44] [205] [207]
A partir de 2015, algunos estados aprobaron leyes que permitían a los farmacéuticos recetar anticonceptivos orales. Se consideró que dicha legislación abordaría la escasez de médicos y reduciría las barreras a la anticoncepción para las mujeres. [214] Los farmacéuticos de Oregón, California, Colorado, Hawái, Maryland y Nuevo México tienen autoridad para recetar anticonceptivos después de recibir capacitación y certificación especializada de la Junta de Farmacia de su respectivo estado . [215] [216] A partir de enero de 2024 [actualizar], los farmacéuticos de 29 estados pueden recetar anticonceptivos orales. [217]
La FDA aprobó una píldora anticonceptiva a base de progestina ( Opill ) en 2023 y está disponible sin receta. [218] Las píldoras a base de estrógeno todavía requieren receta médica a partir de 2024.
Australia
El primer anticonceptivo oral introducido fuera de los Estados Unidos fue Anovlar de Schering ( acetato de noretisterona 4 mg + etinilestradiol 50 μg) en enero de 1961, en Australia. [219]
Alemania
El primer anticonceptivo oral introducido en Europa fue el Anovlar de Schering en junio de 1961, en Alemania Occidental . [219] La dosis hormonal más baja, todavía en uso, fue estudiada por el ginecólogo belga Ferdinand Peeters . [220] [221]
Reino Unido
Antes de mediados de la década de 1960, el Reino Unido no exigía la aprobación previa a la comercialización de los medicamentos. La Asociación Británica de Planificación Familiar (FPA), a través de sus clínicas, era entonces el principal proveedor de servicios de planificación familiar en el Reino Unido y proporcionaba únicamente anticonceptivos que estaban en su Lista Aprobada de Anticonceptivos (establecida en 1934). En 1957, Searle comenzó a comercializar Enavid (Enovid 10 mg en los EE. UU.) para trastornos menstruales. También en 1957, la FPA estableció un Consejo para la Investigación del Control de la Fertilidad (CIFC) para probar y monitorear los anticonceptivos orales, que comenzó a realizar pruebas con animales de anticonceptivos orales y en 1960 y 1961 comenzaron tres grandes ensayos clínicos en Birmingham , Slough y Londres . [201] [222]
En marzo de 1960, la FPA de Birmingham comenzó los ensayos de noretinodrel 2,5 mg + mestranol 50 μg, pero inicialmente se produjo una alta tasa de embarazo cuando las píldoras contenían accidentalmente solo 36 μg de mestranol; los ensayos continuaron con noretinodrel 5 mg + mestranol 75 μg (Conovid en el Reino Unido, Enovid 5 mg en los EE. UU.). [223] En agosto de 1960, la FPA de Slough comenzó los ensayos de noretinodrel 2,5 mg + mestranol 100 μg (Conovid-E en el Reino Unido, Enovid-E en los EE. UU.). [224] En mayo de 1961, la FPA de Londres comenzó los ensayos de Anovlar de Schering. [225]
En octubre de 1961, por recomendación del Consejo Asesor Médico de su CIFC, la FPA añadió el Conovid de Searle a su Lista Aprobada de Anticonceptivos. [226] En diciembre de 1961, Enoch Powell , entonces Ministro de Salud , anunció que la píldora anticonceptiva oral Conovid podría prescribirse a través del NHS a un precio subsidiado de 2 chelines por mes. [227] [228] En 1962, el Anovlar de Schering y el Conovid-E de Searle se agregaron a la Lista Aprobada de Anticonceptivos de la FPA. [201] [224] [225]
Francia
En diciembre de 1967, la Ley Neuwirth legalizó la anticoncepción en Francia, incluida la píldora. [229] La píldora es el método anticonceptivo más popular en Francia, especialmente entre las mujeres jóvenes. Representa el 60% de los métodos anticonceptivos utilizados en Francia. La tasa de abortos se ha mantenido estable desde la introducción de la píldora. [230]
Japón
En Japón, la Asociación Médica Japonesa impidió que la píldora se aprobara para uso general durante casi 40 años. La píldora de "segunda generación" con dosis más altas se aprobó para su uso en casos de problemas ginecológicos, pero no para el control de la natalidad. Dos de las principales objeciones planteadas por la asociación fueron las preocupaciones sobre la seguridad del uso a largo plazo de la píldora y las preocupaciones de que el uso de la píldora llevaría a una disminución del uso de preservativos y, por lo tanto, potencialmente aumentaría las tasas de infecciones de transmisión sexual (ITS). [231]
Sin embargo, cuando el Ministerio de Salud y Bienestar Social aprobó el uso de Viagra en Japón después de sólo seis meses de la presentación de la solicitud, al tiempo que seguía afirmando que la píldora requería más datos antes de su aprobación, los grupos de mujeres protestaron. [232] La píldora fue aprobada posteriormente para su uso en junio de 1999, cuando Japón se convirtió en el último país miembro de la ONU en hacerlo. [233] Sin embargo, la píldora no se ha vuelto popular en Japón. [234] Según estimaciones, sólo el 1,3 por ciento de los 28 millones de mujeres japonesas en edad fértil usan la píldora, en comparación con el 15,6 por ciento en los Estados Unidos. Las pautas de prescripción de píldoras que el gobierno ha respaldado requieren que las usuarias de la píldora visiten a un médico cada tres meses para exámenes pélvicos y se sometan a pruebas de enfermedades de transmisión sexual y cáncer de útero. En los Estados Unidos y Europa, en cambio, una visita clínica anual o bianual es estándar para las usuarias de la píldora. Sin embargo, desde 2007, muchos obstetras y ginecólogos japoneses exigen sólo una visita anual a las usuarias de píldoras, y recomiendan múltiples controles al año sólo para aquellas mayores o con mayor riesgo de sufrir efectos secundarios. [235] En 2004, los condones representaban el 80% del uso de anticonceptivos en Japón, y esto puede explicar las tasas comparativamente bajas de SIDA en ese país. [235]
Sociedad y cultura
La píldora fue aprobada por la FDA a principios de los años 1960; su uso se extendió rápidamente a finales de esa década, generando un enorme impacto social. La revista Time colocó la píldora en su portada en abril de 1967. [236] [237] En primer lugar, era más eficaz que la mayoría de los métodos reversibles de control de la natalidad anteriores, dando a las mujeres un control sin precedentes sobre su fertilidad. [238] Su uso era independiente de las relaciones sexuales, no requería preparaciones especiales en el momento de la actividad sexual que pudieran interferir con la espontaneidad o la sensación, y la elección de tomar la píldora era privada. Esta combinación de factores sirvió para que la píldora fuera inmensamente popular a los pocos años de su introducción. [178] [207]
Claudia Goldin , entre otros, sostiene que esta nueva tecnología anticonceptiva fue un factor clave en la formación del papel económico moderno de las mujeres, ya que prolongó la edad en la que las mujeres se casaban por primera vez, lo que les permitió invertir en educación y otras formas de capital humano, así como, en general, estar más orientadas hacia la carrera profesional. Poco después de que se legalizara la píldora anticonceptiva, hubo un marcado aumento en la asistencia a la universidad y las tasas de graduación de las mujeres. [239] Desde un punto de vista económico, la píldora anticonceptiva redujo el costo de permanecer en la escuela. La capacidad de controlar la fertilidad sin sacrificar las relaciones sexuales permitió a las mujeres hacer planes educativos y profesionales a largo plazo. [240]
La píldora, que fue tan eficaz y se generalizó rápidamente, también acentuó el debate sobre las consecuencias morales y sanitarias de las relaciones sexuales prematrimoniales y la promiscuidad. Nunca antes la actividad sexual había estado tan divorciada de la reproducción. Para una pareja que utilizaba la píldora, el coito se convertía en una mera expresión de amor, o un medio de placer físico, o ambas cosas; pero ya no era un medio de reproducción. Si bien esto era cierto en el caso de los anticonceptivos anteriores, sus tasas de fracaso relativamente altas y su uso menos extendido no lograron enfatizar esta distinción tan claramente como lo hizo la píldora. La difusión del uso de anticonceptivos orales llevó a muchas figuras e instituciones religiosas a debatir el papel adecuado de la sexualidad y su relación con la procreación. La Iglesia Católica Romana , en particular, después de estudiar el fenómeno de los anticonceptivos orales, volvió a enfatizar la enseñanza declarada sobre el control de la natalidad en la encíclica papal de 1968 Humanae vitae . La encíclica reiteró la enseñanza católica establecida de que la anticoncepción artificial distorsiona la naturaleza y el propósito del sexo. [241] Por otro lado, la Iglesia anglicana y otras iglesias protestantes, como la Iglesia Protestante en Alemania (EKD), aceptaron la píldora anticonceptiva oral combinada. [242]
El Senado de los Estados Unidos inició audiencias sobre la píldora en 1970, en las que se escucharon diferentes puntos de vista de profesionales médicos. El Dr. Michael Newton, presidente del Colegio de Obstetras y Ginecólogos, dijo:
Todavía no hay pruebas claras de que estas píldoras causen cáncer o estén relacionadas con él. El Comité Asesor de la FDA hizo comentarios al respecto, diciendo que si no había pruebas suficientes para indicar si estas píldoras estaban relacionadas o no con el desarrollo del cáncer, y creo que eso todavía es poco, hay que tener cuidado con ellas, pero no creo que haya pruebas claras, ni en un sentido ni en otro, de que causen cáncer o no. [243]
Otro médico, el Dr. Roy Hertz del Population Council , dijo que cualquiera que tome esta píldora debería saber "nuestro conocimiento e ignorancia en estos asuntos" y que todas las mujeres deberían ser conscientes de esto para que puedan decidir si tomar la píldora o no. [243]
El entonces Secretario de Salud, Educación y Bienestar Social , Robert Finch , anunció que el gobierno federal había aceptado una declaración de advertencia de compromiso que acompañaría todas las ventas de píldoras anticonceptivas. [243]
Resultado en la cultura popular
La introducción de la píldora anticonceptiva en 1960 permitió que más mujeres encontraran oportunidades de empleo y continuaran su educación. Como resultado de que las mujeres consiguieran más empleos y una educación, sus maridos tuvieron que empezar a hacerse cargo de las tareas domésticas, como cocinar. [244] Con el deseo de detener el cambio que se estaba produciendo en términos de normas de género en un hogar estadounidense, muchas películas, programas de televisión y otros elementos de la cultura popular retrataron cómo debería ser una familia estadounidense ideal. A continuación se enumeran algunos ejemplos:
Poema
- La píldora contra el desastre de la mina de Springhill es el poema que da título a una colección de 1968 de Richard Brautigan . [245]
Música
- La cantante Loretta Lynn comentó sobre cómo las mujeres ya no tenían que elegir entre una relación y una carrera en su álbum de 1974 con una canción titulada " The Pill ", que contaba la historia del uso de la droga por parte de una mujer casada para liberarse de su papel tradicional de esposa y madre. [246]
Impacto ambiental
Una mujer que usa AOC excreta en su orina y heces estrógenos naturales , estrona (E1) y estradiol (E2), y el estrógeno sintético etinilestradiol (EE2). [247] Estas hormonas pueden pasar a través de plantas de tratamiento de agua y a los ríos. [248] Otras formas de anticoncepción, como el parche anticonceptivo , utilizan el mismo estrógeno sintético (EE2) que se encuentra en los AOC, y pueden aumentar la concentración hormonal en el agua cuando se tiran por el inodoro. [249] Se ha demostrado que esta excreción desempeña un papel en la causa de la alteración endocrina , que afecta el desarrollo sexual y la reproducción de las poblaciones de peces salvajes en segmentos de arroyos contaminados por efluentes de aguas residuales tratadas. [247] [250] Un estudio realizado en ríos británicos respaldó la hipótesis de que la incidencia y la gravedad de las poblaciones de peces salvajes intersexuales estaban significativamente correlacionadas con las concentraciones de E1, E2 y EE2 en los ríos. [247]
Una revisión del desempeño de las plantas de lodos activados encontró que las tasas de eliminación de estrógeno variaban considerablemente, pero promediaban 78% para estrona, 91% para estradiol y 76% para etinilestradiol ( las concentraciones de efluentes de estriol están entre las de estrona y estradiol, pero el estriol es un disruptor endocrino mucho menos potente para los peces). [251]
Varios estudios han sugerido que reducir el crecimiento de la población humana mediante un mayor acceso a la anticoncepción , incluidas las píldoras anticonceptivas, puede ser una estrategia eficaz para la mitigación del cambio climático , así como para la adaptación . [252] [253] Según Thomas Wire, la anticoncepción es la "tecnología más verde" debido a su relación coste-eficacia en la lucha contra el calentamiento global : cada $7 gastados en anticonceptivos reducirían las emisiones globales de carbono en 1 tonelada en cuatro décadas, mientras que lograr el mismo resultado con tecnologías bajas en carbono requeriría $32. [254]
Véase también
- Anticonceptivo oral que contiene estradiol
- Terapia de reemplazo hormonal (TRH)
- Lista de estrógenos disponibles en Estados Unidos
- Lista de progestágenos disponibles en Estados Unidos
- Anticonceptivo inyectable de solo progestágeno
Referencias
- ^ ab Trussell J (2011). "Eficacia anticonceptiva". En Hatcher RA, Trussell J, Nelson A, Cates W, Kowal D, Policar M (eds.). Tecnología anticonceptiva (20.ª edición revisada). Nueva York: Ardent Media. págs. 779–863. ISBN 978-1-59708-004-0. ISSN 0091-9721. OCLC 781956734.Tabla 26–1 = Tabla 3–2 Porcentaje de mujeres que tuvieron un embarazo no deseado durante el primer año de uso típico y el primer año de uso perfecto de anticonceptivos, y porcentaje de mujeres que continuaron usándolos al final del primer año. Estados Unidos. Archivado el 15 de febrero de 2017 en Wayback Machine.
- ^ ab Hannaford PC, Iversen L, Macfarlane TV, Elliott AM, Angus V, Lee AJ (marzo de 2010). "Mortalidad entre las usuarias de píldoras anticonceptivas: evidencia de cohorte del estudio de anticoncepción oral del Royal College of General Practitioners". BMJ . 340 : c927. doi :10.1136/bmj.c927. PMC 2837145 . PMID 20223876.
- ^ "Anticonceptivos orales y riesgo de cáncer". Instituto Nacional del Cáncer. 22 de febrero de 2018. Archivado desde el original el 27 de mayo de 2020. Consultado el 10 de mayo de 2020 .
- ^ abc Grupo de trabajo del IARC (2007). «Anticonceptivos combinados de estrógeno y progestágeno» (PDF) . Monografías del IARC sobre la evaluación de los riesgos carcinógenos para los seres humanos . 91. Archivado (PDF) del original el 3 de agosto de 2016. Consultado el 14 de septiembre de 2010 .
- ^ Grupo colaborativo sobre factores hormonales en el cáncer de mama (junio de 1996). "Cáncer de mama y anticonceptivos hormonales: reanálisis colaborativo de datos individuales sobre 53 297 mujeres con cáncer de mama y 100 239 mujeres sin cáncer de mama de 54 estudios epidemiológicos". Lancet . 347 (9017): 1713–27. doi : 10.1016/S0140-6736(96)90806-5 . PMID 8656904. S2CID 36136756.
- ^ Kemmeren JM, Tanis BC, van den Bosch MA, Bollen EL, Helmerhorst FM, van der Graaf Y, et al. (mayo de 2002). "Estudio sobre el riesgo de trombosis arterial en relación con los anticonceptivos orales (RATIO): anticonceptivos orales y riesgo de accidente cerebrovascular isquémico". Stroke . 33 (5): 1202–8. doi : 10.1161/01.STR.0000015345.61324.3F . PMID 11988591.
- ^ Baillargeon JP, McClish DK, Essah PA, Nestler JE (julio de 2005). "Asociación entre el uso actual de anticonceptivos orales de dosis baja y enfermedad arterial cardiovascular: un metaanálisis". The Journal of Clinical Endocrinology and Metabolism . 90 (7): 3863–70. doi : 10.1210/jc.2004-1958 . PMID 15814774.
- ^ "Píldoras anticonceptivas - Píldora anticonceptiva - La píldora". Archivado desde el original el 5 de agosto de 2011. Consultado el 3 de abril de 2009 .
- ^ abcde Teal S, Edelman A (diciembre de 2021). "Selección, eficacia y efectos adversos de los métodos anticonceptivos: una revisión". JAMA . 326 (24): 2507–2518. doi : 10.1001/jama.2021.21392 . PMID 34962522. S2CID 245557522.
- ^ ab "¿Conejillos de indias o pioneros? Cómo se utilizó a las mujeres puertorriqueñas para probar la píldora anticonceptiva". The Washington Post . ISSN 0190-8286. Archivado desde el original el 8 de noviembre de 2022. Consultado el 14 de septiembre de 2022 .
- ^ "Pastillas anticonceptivas (para adolescentes) - Nemours KidsHealth". kidshealth.org . Archivado desde el original el 21 de septiembre de 2022 . Consultado el 21 de septiembre de 2022 .
- ^ Tyrer L (1999). "Introducción de la píldora y su impacto". Anticoncepción . 59 (1): 11S–16S. doi :10.1016/s0010-7824(98)00131-0. PMID 10342090.
- ^ Uso de anticonceptivos por método 2019: folleto de datos. [Nueva York, NY]: Naciones Unidas. Departamento de Asuntos Económicos y Sociales. División de Población. 2019. ISBN 978-92-1-148329-1.OCLC 1135665739 .
- ^ Christin-Maitre S (febrero de 2013). "Historia de los anticonceptivos orales y su uso en todo el mundo". Mejores prácticas e investigación. Endocrinología clínica y metabolismo . 27 (1): 3–12. doi :10.1016/j.beem.2012.11.004. PMID 23384741.
- ^ "Productos - Resúmenes de datos - Número 327 - Diciembre de 2018". Centros para el Control y la Prevención de Enfermedades (CDC) de EE. UU . . 11 de julio de 2022. Archivado desde el original el 13 de septiembre de 2022 . Consultado el 14 de septiembre de 2022 .
- ^ Sech LA, Mishell DR (noviembre de 2015). "Anticoncepción con esteroides orales". Salud de la Mujer . 11 (6): 743–748. doi : 10.2217/whe.15.82 . PMID 26673988. S2CID 6433771.
- ^ "Estado actual de los métodos anticonceptivos entre mujeres de 15 a 49 años: Estados Unidos, 2015-2017". Centros para el Control y la Prevención de Enfermedades (CDC) de EE. UU . . 7 de junio de 2019. Archivado desde el original el 13 de septiembre de 2022 . Consultado el 2 de agosto de 2019 .
- ^ División de Población de las Naciones Unidas (2006). Uso mundial de anticonceptivos 2005 (PDF) . Nueva York: Naciones Unidas. ISBN 978-92-1-151418-6. Archivado (PDF) del original el 26 de abril de 2018 . Consultado el 28 de junio de 2017 .Mujeres de 15 a 49 años casadas o en unión consensual
- ^ Delvin D (15 de junio de 2016). «Contracepción: la píldora anticonceptiva: ¿cuántas mujeres la toman en el Reino Unido?». Archivado desde el original el 4 de enero de 2011. Consultado el 25 de diciembre de 2010 .
- ^ Taylor T, Keyse L, Bryant A (2006). Anticoncepción y salud sexual, 2005/06 (PDF) . Londres: Oficina de Estadísticas Nacionales. ISBN 978-1-85774-638-9. Archivado desde el original (PDF) el 9 de enero de 2007.Mujeres británicas de 16 a 49 años: el 24 % usa la píldora en 2016 [actualizar](el 17 % usa la píldora combinada, el 5 % usa la minipíldora, el 2 % no sabe el tipo)
- ^ Yoshida H, Sakamoto H, Leslie A, Takahashi O, Tsuboi S, Kitamura K (junio de 2016). "Anticoncepción en Japón: tendencias actuales". Anticoncepción . 93 (6): 475–477. doi :10.1016/j.contraception.2016.02.006. PMID 26872717.
- ^ Organización Mundial de la Salud (2023). Selección y uso de medicamentos esenciales 2023: anexo web A: Lista modelo de medicamentos esenciales de la Organización Mundial de la Salud: 23.ª lista (2023) . Ginebra: Organización Mundial de la Salud. hdl : 10665/371090 . OMS/MHP/HPS/EML/2023.02.
- ^ Harris G (3 de mayo de 2010). «La píldora inició más de una revolución». The New York Times . Archivado desde el original el 27 de septiembre de 2015. Consultado el 21 de septiembre de 2015 .
- ^ abcdefghijklmno Cooper DB, Patel P, Mahdy H (2024), "Píldoras anticonceptivas orales", StatPearls , Treasure Island (FL): StatPearls Publishing, PMID 28613632 , consultado el 28 de febrero de 2024
- ^ Edwards M, Can AS (2024), "Progestinas", StatPearls , Treasure Island (FL): StatPearls Publishing, PMID 33085358 , consultado el 28 de febrero de 2024
- ^ abc «Cómo usar las píldoras anticonceptivas». Planned Parenthood . Archivado desde el original el 6 de diciembre de 2017. Consultado el 29 de noviembre de 2017 .
- ^ abcde «Anticonceptivos hormonales combinados | Agencia Europea del Medicamento». www.ema.europa.eu . Consultado el 28 de febrero de 2024 .
- ^ abcdefghij Thiyagarajan DK, Basit H, Jeanmonod R (2024), "Fisiología, ciclo menstrual", StatPearls , Treasure Island (FL): StatPearls Publishing, PMID 29763196 , consultado el 28 de febrero de 2024
- ^ abcdefghijkl "Estrógeno y progestina (anticonceptivos orales): información sobre medicamentos de MedlinePlus". medlineplus.gov . Consultado el 28 de febrero de 2024 .
- ^ abcdef Hatcher RA, Trussell J, Nelson A, Cates W, Kowal D, Policar M, eds. (2011). "Anticonceptivos orales combinados (AOC)". Tecnología anticonceptiva (20.ª edición revisada). Nueva York: Ardent Media. págs. 249–341. ISBN 978-1-59708-004-0. ISSN 0091-9721. OCLC 781956734.págs. 257–258:
Mecanismo de acción
Los AOC impiden la fecundación y, por lo tanto, se consideran anticonceptivos. No hay evidencia significativa de que funcionen después de la fecundación. Las progestinas en todos los AOC proporcionan la mayor parte del efecto anticonceptivo al suprimir la ovulación y espesar el moco cervical, aunque los estrógenos también hacen una pequeña contribución a la supresión de la ovulación. El control del ciclo se mejora por el estrógeno.
Debido a que los AOC suprimen tan eficazmente la ovulación y bloquean el ascenso de los espermatozoides al tracto genital superior, el impacto potencial en la receptividad endometrial a la implantación es casi académico. Cuando los dos mecanismos primarios fallan, el hecho de que el embarazo se produzca a pesar de los cambios endometriales demuestra que esos cambios endometriales no contribuyen significativamente al mecanismo de acción de la píldora. - ^ abc Speroff L, Darney PD (2011). "Anticoncepción oral". Una guía clínica para la anticoncepción (5.ª ed.). Filadelfia: Lippincott Williams & Wilkins. págs. 19-152. ISBN 978-1-60831-610-6.
- ^ abc Levin ER, Hammes SR (2011). "Estrógenos y progestinas". En Goodman LS, Brunton LL, Chabner BA, Knollmann BC (eds.). Base farmacológica de la terapéutica de Goodman y Gilman (12.ª ed.). Nueva York: McGraw-Hill Medical. págs. 1163–1194. ISBN 978-0-07-162442-8.
- ^ Glasier A (2010). "Anticoncepción". En Jameson JL, De Groot LJ (eds.). Endocrinología (6ª ed.). Filadelfia: Saunders Elsevier. págs. 2417–2427. ISBN 978-1-4160-5583-9.
- ^ Barbieri RL (2014), Rosenwaks Z, Wassarman PM (eds.), "La endocrinología del ciclo menstrual", Fertilidad humana: métodos y protocolos , Métodos en biología molecular, vol. 1154, Nueva York, NY: Springer, págs. 145-169, doi :10.1007/978-1-4939-0659-8_7, ISBN 978-1-4939-0659-8, PMID 24782009, archivado desde el original el 15 de julio de 2023 , consultado el 15 de septiembre de 2022
- ^ abcde Nelson AL, Cwiak C (2011). "Anticonceptivos orales combinados". En Hatcher RA, Trussell J, Nelson A, Cates W, Kowal D, Policar M (eds.). Tecnología anticonceptiva (20.ª edición revisada). Nueva York: Ardent Media. págs. 253–254. ISBN 978-1-59708-004-0. ISSN 0091-9721. OCLC 781956734.
En los AOC que se han vendido en Estados Unidos se han utilizado diez progestinas diferentes. Existen varios sistemas de clasificación diferentes para las progestinas, pero el sistema más comúnmente utilizado recapitula la historia de la píldora en Estados Unidos al clasificar las progestinas en las llamadas "generaciones de progestinas". Las tres primeras generaciones de progestinas se derivan de la 19-nortestosterona. La cuarta generación es la drospirenona. Las progestinas más nuevas son híbridas.
Progestinas de primera generación. Las progestinas de primera generación incluyen noretinodrel, noretisterona, acetato de noretisterona y diacetato de etinodiol... Estos compuestos tienen la potencia más baja y vidas medias relativamente cortas. La vida media corta no importaba en las primeras píldoras de dosis alta, pero a medida que se reducían las dosis de progestina en las píldoras más modernas, los problemas con el manchado y el sangrado no programados se volvieron más comunes.
Progestinas de segunda generación. Para resolver el problema del sangrado no programado y el manchado, las progestinas de segunda generación (norgestrol y levonorgestrel) fueron diseñadas para ser significativamente más potentes y tener vidas medias más largas que las progestinas relacionadas con la noretisterona... Las progestinas de segunda generación se han asociado con más efectos secundarios relacionados con los andrógenos, como efectos adversos sobre los lípidos, piel grasa, acné y crecimiento de vello facial. Progestinas de
tercera generación. Las progestinas de tercera generación (desogestrel, norgestimato y, en otros lugares, gestodeno) se introdujeron para mantener la potente actividad progestacional de las progestinas de segunda generación, pero para reducir los efectos secundarios androgénicos. La reducción de los impactos de los andrógenos permite una expresión más completa de los impactos de los estrógenos de la píldora. Esto tiene algunos beneficios clínicos... Por otro lado, surgió la preocupación de que la mayor expresión de estrógenos pudiera aumentar el riesgo de tromboembolia venosa (TEV). Esta preocupación generó un susto por las píldoras en Europa hasta que se completaron los estudios internacionales y se interpretaron correctamente.
Progestinas de cuarta generación. La drospirenona es un análogo de la espironolactona, un diurético ahorrador de potasio que se utiliza para tratar la hipertensión. La drospirenona posee propiedades antimineralocorticoides y antiandrogénicas. Estas propiedades han dado lugar a nuevas aplicaciones anticonceptivas, como el tratamiento del trastorno disfórico premenstrual y el acné... A raíz de las preocupaciones sobre el posible aumento del riesgo de TEV con formulaciones de tercera generación menos androgénicas, se anticiparon esos problemas con la drospirenona. Se respondieron claramente mediante grandes estudios internacionales.
Progestinas de próxima generación. Se han desarrollado progestinas con propiedades que comparten con diferentes generaciones de progestinas. Tienen efectos más profundos, diversos y discretos sobre el endometrio que las progestinas anteriores. Esta clase incluiría dienogest (Estados Unidos) y nomegestrol (Europa). - ^ abcde Speroff L, Darney PD (2011). "Anticoncepción oral". Una guía clínica para la anticoncepción (5.ª ed.). Filadelfia: Lippincott Williams & Wilkins. pág . 40. ISBN 978-1-60831-610-6.
- ^ abcdef Callahan TL, Caughey AB (2013). Blueprints obstetrics & gynecology (6.ª ed.). Baltimore, MD: Lippincott Williams & Wilkins. ISBN 978-1-4511-1702-8.OCLC 800907400 .
- ^ "Todas las guías sobre píldoras anticonceptivas". Octubre de 2014. Archivado desde el original el 31 de mayo de 2023. Consultado el 20 de octubre de 2018 .
- ^ abcdefgh «Pastilla combinada». nhs.uk . 21 de diciembre de 2017 . Consultado el 28 de febrero de 2024 .
- ^ abcde Organización Mundial de la Salud (2016). Recomendaciones prácticas seleccionadas para el uso de anticonceptivos (tercera edición). Ginebra: Organización Mundial de la Salud. p. 150. hdl : 10665/252267 . ISBN 978-92-4-156540-0.OCLC 985676200 .
- ^ abcde Curtis KM, Tepper NK, Jatlaoui TC, Berry-Bibee E, Horton LG, Zapata LB, et al. (julio de 2016). "Criterios médicos de elegibilidad de los EE. UU. para el uso de anticonceptivos, 2016" (PDF) . MMWR. Recomendaciones e informes . 65 (3): 1–103. doi : 10.15585/mmwr.rr6503a1 . ISSN 1057-5987. PMID 27467196. Archivado (PDF) del original el 16 de octubre de 2020 . Consultado el 11 de febrero de 2024 .
- ^ Trussell J (abril de 2009). "Entender el fracaso de los anticonceptivos". Mejores prácticas e investigación. Obstetricia y ginecología clínica . Anticoncepción y salud sexual. 23 (2): 199–209. doi :10.1016/j.bpobgyn.2008.11.008. PMC 3638203. PMID 19223239 .
- ^ Trussell J (mayo de 2011). "Fallo anticonceptivo en los Estados Unidos". Anticoncepción . 83 (5): 397–404. doi :10.1016/j.contraception.2011.01.021. PMC 3638209 . PMID 21477680.
- ^ abcdefgh Speroff L, Darney PD (2005). "Anticoncepción oral". Una guía clínica para la anticoncepción (4.ª ed.). Filadelfia: Lippincott Williams & Wilkins. págs. 21–138. ISBN 978-0-7817-6488-9.
- ^ FFPRHC (2007). "Guía clínica: primera prescripción de anticonceptivos orales combinados" (PDF) . Archivado desde el original (PDF) el 4 de julio de 2007. Consultado el 26 de junio de 2007 .
- ^ ab Edelman A, Micks E, Gallo MF, Jensen JT, Grimes DA (julio de 2014). "Uso continuo o extendido de anticonceptivos hormonales combinados en comparación con el uso cíclico". Base de datos Cochrane de revisiones sistemáticas . 2014 (7): CD004695. doi : 10.1002/14651858.CD004695.pub3. PMC 6837850. PMID 25072731.
- ^ Curtis KM, Jatlaoui TC, Tepper NK, Zapata LB, Horton LG, Jamieson DJ, et al. (julio de 2016). "Recomendaciones de prácticas seleccionadas de EE. UU. para el uso de anticonceptivos, 2016". MMWR. Recomendaciones e informes . 65 (4): 1–66. doi : 10.15585/mmwr.rr6504a1 . PMID 27467319.
- ^ Gladwell M (10 de marzo de 2000). «John Rock's Error». The New Yorker . Archivado desde el original el 11 de mayo de 2013. Consultado el 4 de febrero de 2009 .
- ^ Personal de Mayo Clinic. «Preguntas frecuentes sobre la píldora anticonceptiva: beneficios, riesgos y opciones». Mayo Clinic. Archivado desde el original el 26 de diciembre de 2012. Consultado el 1 de febrero de 2013 .
- ^ "Patente de EE. UU.: Anticonceptivo oral: Patente 6451778 Emitida el 17 de septiembre de 2002 Fecha estimada de vencimiento: 2 de julio de 2017". PatentStorm LLC. Archivado desde el original el 13 de junio de 2011. Consultado el 19 de noviembre de 2010 .
- ^ Hercberg S, Preziosi P, Galan P (abril de 2001). "Deficiencia de hierro en Europa". Public Health Nutrition . 4 (2B): 537–545. doi : 10.1079/phn2001139 . PMID 11683548.
- ^ Viswanathan M, Treiman KA, Kish-Doto J, Middleton JC, Coker-Schwimmer EJ, Nicholson WK (enero de 2017). "Suplementación con ácido fólico para la prevención de defectos del tubo neural: un informe de evidencia actualizado y una revisión sistemática para el Grupo de trabajo de servicios preventivos de EE. UU.", JAMA . 317 (2): 190–203. doi :10.1001/jama.2016.19193. PMID 28097361.
- ^ Lassi ZS, Bhutta ZA (abril de 2012). "Utilidad clínica de los anticonceptivos orales que contienen folato". Revista internacional de salud de la mujer . 4 : 185–190. doi : 10.2147/IJWH.S18611 . PMC 3346209 . PMID 22570577.
- ^ "La FDA aprueba un anticonceptivo oral estacional". Administración de Alimentos y Medicamentos de Estados Unidos (FDA) . 25 de septiembre de 2003. Archivado desde el original el 7 de octubre de 2006. Consultado el 9 de noviembre de 2006 .
- ^ Personal de CYWH (18 de octubre de 2011). «Usos médicos de la píldora anticonceptiva». Archivado desde el original el 5 de febrero de 2013. Consultado el 1 de febrero de 2013 .
- ^ "Información para consumidores (medicamentos) - Encontrar información sobre un medicamento". Administración de Alimentos y Medicamentos de Estados Unidos (FDA) . Archivado desde el original el 14 de noviembre de 2017. Consultado el 13 de diciembre de 2017 .
- ^ "Educación del paciente: síndrome de ovario poliquístico (SOP) (más allá de lo básico)". UpToDate . Archivado desde el original el 15 de septiembre de 2022 . Consultado el 15 de septiembre de 2022 .
- ^ Dumesic DA, Lobo RA (agosto de 2013). "Riesgo de cáncer y síndrome de ovario poliquístico". Esteroides . 78 (8): 782–785. doi :10.1016/j.steroids.2013.04.004. ISSN 1878-5867. PMID 23624028. S2CID 10185317.
- ^ "Síndrome de ovario poliquístico (SOP)". Colegio Estadounidense de Obstetras y Ginecólogos . Archivado desde el original el 15 de septiembre de 2022. Consultado el 15 de septiembre de 2022 .
- ^ Barakat RR, Park RC, Grigsby PW, et al. Corpus: Epithelial Tumors. En: Principles and Practice of Gynecologic Oncology, 2nd, Hoskins WH, Perez CA, Young RC (Eds), Lippincott-Raven Publishers, Filadelfia 1997. p.859
- ^ Hardiman P, Pillay OC, Atiomo W (mayo de 2003). "Síndrome de ovario poliquístico y carcinoma endometrial". Lancet . 361 (9371): 1810–2. doi :10.1016/s0140-6736(03)13409-5. PMID 12781553. S2CID 27453081.
- ^ "¿Pueden las píldoras anticonceptivas curar el síndrome de ovario poliquístico?". Colegio Estadounidense de Obstetras y Ginecólogos . Archivado desde el original el 20 de septiembre de 2022. Consultado el 18 de septiembre de 2022 .
- ^ Huber J, Walch K (enero de 2006). "Tratamiento del acné con anticonceptivos orales: uso de dosis más bajas". Anticoncepción . 73 (1): 23–9. doi :10.1016/j.contraception.2005.07.010. PMID 16371290.
- ^ "Anticonceptivos hormonales y acné: un análisis retrospectivo de 2147 pacientes". JDDonline - Revista de medicamentos en dermatología . Archivado desde el original el 19 de mayo de 2022. Consultado el 15 de septiembre de 2022 .
- ^ Chang L. "Control de la natalidad del acné". WebMD, LLC. Archivado desde el original el 26 de enero de 2013. Consultado el 1 de febrero de 2013 .
- ^ "DailyMed - ORTHO TRI CYCLEN- norgestimate and ethinyl estradiol ORTHO CYCLEN- norgestimate and ethinyl estradiol". dailymed.nlm.nih.gov . Archivado desde el original el 14 de diciembre de 2017 . Consultado el 13 de diciembre de 2017 .
- ^ "Prospecto de Beyaz" (PDF) . Administración de Alimentos y Medicamentos de Estados Unidos (FDA) . Archivado (PDF) del original el 15 de abril de 2023 . Consultado el 6 de agosto de 2019 .
- ^ "Educación del paciente: Hirsutismo (crecimiento excesivo de vello en mujeres) (Más allá de lo básico)". UpToDate . Archivado desde el original el 20 de septiembre de 2022 . Consultado el 18 de septiembre de 2022 .
- ^ "Hirsutismo: qué es, en las mujeres, causas, síndrome de ovario poliquístico y tratamiento". Clínica Cleveland . Archivado desde el original el 19 de septiembre de 2022. Consultado el 18 de septiembre de 2022 .
- ^ ab Arowojolu A, Gallo M, Grimes D, Garner S (19 de julio de 2004), The Cochrane Collaboration (ed.), "Píldoras anticonceptivas orales combinadas para el tratamiento del acné", Cochrane Database of Systematic Reviews (3), Chichester, Reino Unido: John Wiley & Sons, Ltd: CD004425, doi :10.1002/14651858.cd004425.pub2, PMID 15266533 , consultado el 28 de febrero de 2024
- ^ Frances E Casey MD (enero de 2023). "Anticoncepción y su impacto en el acné". GYN Journal . Vol 68 No 01. 68 (1).
- ^ "Preguntas frecuentes sobre endometriosis de la ACOG". Archivado desde el original el 1 de febrero de 2020. Consultado el 3 de marzo de 2019 .
- ^ Zorbas KA, Economopoulos KP, Vlahos NF (julio de 2015). "Anticonceptivos orales continuos versus cíclicos para el tratamiento de la endometriosis: una revisión sistemática". Archivos de ginecología y obstetricia . 292 (1): 37–43. doi :10.1007/s00404-015-3641-1. PMID 25644508. S2CID 23340983.
- ^ "Sangrado menstrual abundante". Colegio Americano de Obstetras y Ginecólogos . Archivado desde el original el 20 de septiembre de 2022. Consultado el 18 de septiembre de 2022 .
- ^ Apgar BS, Kaufman AH, George-Nwogu U, Kittendorf A (15 de junio de 2007). "Tratamiento de la menorragia". American Family Physician . 75 (12): 1813–1819. PMID 17619523. Archivado desde el original el 6 de octubre de 2022 . Consultado el 15 de septiembre de 2022 .
- ^ "Educación del paciente: sangrado menstrual abundante o prolongado (menorragia) (Más allá de lo básico)". UpToDate . Archivado desde el original el 15 de septiembre de 2022 . Consultado el 15 de septiembre de 2022 .
- ^ "Beneficios no anticonceptivos de las píldoras anticonceptivas". Sociedad Estadounidense de Medicina Reproductiva (ASRM) . Archivado desde el original el 13 de septiembre de 2022. Consultado el 15 de septiembre de 2022 .
- ^ ab American Medical Society for Sports Medicine (24 de abril de 2014), "Cinco cosas que los médicos y los pacientes deberían cuestionar", Choosing Wisely : una iniciativa de la Fundación ABIM , American Medical Society for Sports Medicine, archivado desde el original el 29 de julio de 2014 , consultado el 29 de julio de 2014
- ^ abc "Anticoncepción hormonal para la supresión menstrual". www.uptodate.com . Consultado el 28 de febrero de 2024 .
- ^ Irvine GA, Campbell-Brown MB, Lumsden MA, Heikkilä A, Walker JJ, Cameron IT (junio de 1998). "Ensayo comparativo aleatorizado del sistema intrauterino de levonorgestrel y noretisterona para el tratamiento de la menorragia idiopática". British Journal of Obstetrics and Gynaecology . 105 (6): 592–598. doi :10.1111/j.1471-0528.1998.tb10172.x. ISSN 0306-5456. PMID 9647148.
- ^ abcde Jacobson JC, Likis FE, Murphy PA (2012). "Regímenes anticonceptivos combinados prolongados y continuos para la supresión menstrual". Revista de obstetricia y salud de la mujer . 57 (6): 585–592. doi :10.1111/j.1542-2011.2012.00250.x. ISSN 1542-2011. PMID 23217068.
- ^ ab Sulak PJ, Scow RD, Preece C, Riggs MW, Kuehl TJ (febrero de 2000). "Síntomas de abstinencia hormonal en usuarias de anticonceptivos orales". Obstetricia y ginecología . 95 (2): 261–266. doi :10.1016/s0029-7844(99)00524-4. ISSN 0029-7844. PMID 10674591.
- ^ ab Loder EW, Buse DC, Golub JR (marzo de 2005). "Dolor de cabeza y anticonceptivos orales combinados de estrógeno y progestina: integración de evidencia, pautas y práctica clínica". Dolor de cabeza: la revista del dolor de cabeza y rostro . 45 (3): 224–231. doi :10.1111/j.1526-4610.2005.05049.x. ISSN 0017-8748. PMID 15836597.
- ^ ab Silberstein SD (septiembre de 1999). "Migraña menstrual". Revista de salud de la mujer y medicina basada en el género . 8 (7): 919–931. doi :10.1089/jwh.1.1999.8.919. ISSN 1524-6094. PMID 10534294.
- ^ ab Huber D, Seitz S, Kast K, Emons G, Ortmann O (abril de 2020). "Uso de anticonceptivos orales en portadoras de mutaciones BRCA y riesgo de cáncer de ovario y de mama: una revisión sistemática". Archivos de Ginecología y Obstetricia . 301 (4): 875–884. doi :10.1007/s00404-020-05458-w. ISSN 1432-0711. PMC 8494665 . PMID 32140806.
- ^ ab van Bommel MH, IntHout J, Veldmate G, Kets CM, de Hullu JA, van Altena AM, et al. (1 de marzo de 2023). "Anticonceptivos y riesgos de cáncer en portadores de variantes patógenas BRCA1/2: una revisión sistemática y un metanálisis". Human Reproduction Update . 29 (2): 197–217. doi :10.1093/humupd/dmac038. ISSN 1460-2369. PMC 9976973 . PMID 36383189.
- ^ abcd Organización Mundial de la Salud (2015). Criterios médicos de elegibilidad para el uso de anticonceptivos (Quinta edición). Ginebra, Suiza: Organización Mundial de la Salud. hdl : 10665/181468 . ISBN 978-92-4-154915-8. OCLC 932048744. Archivado desde el original el 11 de febrero de 2024 . Consultado el 11 de febrero de 2024 .
- ^ Roach RE, Helmerhorst FM, Lijfering WM, Stijnen T, Algra A, Dekkers OM (27 de agosto de 2015). "Anticonceptivos orales combinados: riesgo de infarto de miocardio y accidente cerebrovascular isquémico". Base de datos Cochrane de revisiones sistemáticas . 2015 (8): CD011054. doi :10.1002/14651858.CD011054.pub2. ISSN 1469-493X. PMC 6494192. PMID 26310586 .
- ^ Fitzpatrick D, Pirie K, Reeves G, Green J, Beral V (marzo de 2023). "Anticonceptivos hormonales combinados y de solo progestágeno y riesgo de cáncer de mama: un estudio de casos y controles anidado en el Reino Unido y un metanálisis". PLOS Medicine . 20 (3): e1004188. doi : 10.1371/journal.pmed.1004188 . ISSN 1549-1676. PMC 10030023 . PMID 36943819.
- ^ Anastasiou E, McCarthy KJ, Gollub EL, Ralph L, van de Wijgert JH, Jones HE (marzo de 2022). "La relación entre la anticoncepción hormonal y el control de la displasia/cáncer cervical para la infección por el virus del papiloma humano: una revisión sistemática". Anticoncepción . 107 : 1–9. doi :10.1016/j.contraception.2021.10.018. ISSN 1879-0518. PMC 8837691 . PMID 34752778.
- ^ ab "Criterios médicos de elegibilidad para el uso de anticonceptivos". www.who.int . Consultado el 28 de febrero de 2024 .
- ^ ab Black A, Guilbert E, Costescu D, Dunn S, Fisher W, Kives S, et al. (abril de 2017). "N.º 329: Consenso canadiense sobre anticoncepción, parte 4 de 4, capítulo 9: anticoncepción hormonal combinada". Revista de obstetricia y ginecología de Canadá . 39 (4): 229–268.e5. doi :10.1016/j.jogc.2016.10.005. PMID 28413042.
- ^ ab Cooper DB, Patel P, Mahdy H (2019). "Píldoras anticonceptivas orales". StatPearls . StatPearls Publishing. PMID 28613632. Archivado desde el original el 3 de mayo de 2019 . Consultado el 5 de agosto de 2019 .
- ^ ab "¿Puede cualquier mujer tomar píldoras anticonceptivas?". WebMD . Archivado desde el original el 3 de mayo de 2016 . Consultado el 8 de mayo de 2016 .
- ^ Lopez LM, Grey TW, Stuebe AM, Chen M, Truitt ST, Gallo MF, et al. (Grupo Cochrane de Regulación de la Fertilidad) (marzo de 2015). "Anticoncepción combinada hormonal versus no hormonal versus anticoncepción con progestina sola en la lactancia". Base de Datos Cochrane de Revisiones Sistemáticas . 2015 (3): CD003988. doi :10.1002/14651858.CD003988.pub2. PMC 10644229 . PMID 25793657.
- ^ "Clasificaciones de los anticonceptivos hormonales combinados". Centros para el Control y la Prevención de Enfermedades (CDC) de EE. UU . . 9 de abril de 2020. Archivado desde el original el 27 de noviembre de 2020 . Consultado el 7 de diciembre de 2020 .
- ^ Tepper NK, Curtis KM, Cox S, Whiteman MK (abril de 2020). "Actualización de los criterios de elegibilidad médica de EE. UU. para el uso de anticonceptivos, 2016: recomendaciones actualizadas para el uso de anticonceptivos entre mujeres con alto riesgo de infección por VIH" (PDF) . MMWR. Informe semanal de morbilidad y mortalidad . 69 (14): 405–410. doi : 10.15585/mmwr.mm6914a3 . PMC 7147901 . PMID 32271729. Archivado (PDF) del original el 9 de junio de 2023 . Consultado el 11 de febrero de 2024 .
- ^ "¿Existe un vínculo entre las píldoras anticonceptivas y un mayor riesgo de cáncer de mama?". www.breastcancer.org . Archivado desde el original el 20 de septiembre de 2022 . Consultado el 18 de septiembre de 2022 .
- ^ Pernambuco-Holsten C (25 de septiembre de 2018). «Control de la natalidad y riesgo de cáncer: 6 cosas que debe saber». Memorial Sloan Kettering Cancer Center . Archivado desde el original el 20 de septiembre de 2022. Consultado el 18 de septiembre de 2022 .
- ^ "¿Cuáles son las mejores opciones de control de la natalidad que no sean hormonales?". Planned Parenthood . Archivado desde el original el 20 de septiembre de 2022. Consultado el 18 de septiembre de 2022 .
- ^ "¿Los anticonceptivos hormonales aumentan el riesgo de cáncer de mama?". www.breastcancer.org . Archivado desde el original el 20 de septiembre de 2022 . Consultado el 18 de septiembre de 2022 .
- ^ Crooks RL, Baur K (2005). Nuestra sexualidad . Belmont, CA: Thomson Wadsworth. ISBN 978-0-534-65176-3.[ página necesaria ]
- ^ "Apéndice 10: Mitos sobre la anticoncepción". Herramienta de toma de decisiones para clientes y proveedores de planificación familiar. OMS . 2005. Archivado desde el original el 7 de enero de 2007. Consultado el 14 de septiembre de 2022 .
- ^ Holck S. "Seguridad de los anticonceptivos". Desafíos especiales en la salud de las mujeres del Tercer Mundo . Reunión anual de 1989 de la Asociación Estadounidense de Salud Pública. Archivado desde el original el 8 de noviembre de 2017. Consultado el 7 de octubre de 2006 .
- ^ ab Huber JC, Bentz EK, Ott J, Tempfer CB (septiembre de 2008). "Beneficios no anticonceptivos de los anticonceptivos orales". Opinión de expertos sobre farmacoterapia . 9 (13): 2317–2325. doi :10.1517/14656566.9.13.2317. PMID 18710356. S2CID 73326364.
- ^ Nelson RJ (2005). Introducción a la endocrinología conductual (3.ª ed.). Sunderland, Mass.: Sinauer Associates. ISBN 978-0-87893-617-5.[ página necesaria ]
- ^ Vo C, Carney ME (diciembre de 2007). "Efecto de riesgo hormonal y ambiental en el cáncer de ovario". Clínicas de obstetricia y ginecología de Norteamérica . 34 (4): 687–700, viii. doi :10.1016/j.ogc.2007.09.008. PMID 18061864.
- ^ Bandera CA (junio de 2005). "Avances en la comprensión de los factores de riesgo del cáncer de ovario". The Journal of Reproductive Medicine . 50 (6): 399–406. PMID 16050564.
- ^ Pragout D, Laurence V, Baffet H, Raccah-Tebeka B, Rousset-Jablonski C (diciembre de 2018). "Contracepción y cáncer. RPC Anticoncepción CNGOF" [Anticoncepción y cáncer: Directrices de anticoncepción del CNGOF]. Gynécologie Obstétrique Fertilité & Sénologie . 46 (12): 834–844. doi :10.1016/j.gofs.2018.10.010. PMID 30385358. S2CID 196536513.
- ^ "Apri oral: usos, efectos secundarios, interacciones, imágenes, advertencias y dosificación". Archivado desde el original el 13 de diciembre de 2016 . Consultado el 2 de diciembre de 2016 .
- ^ Blanco-Molina A, Monreal M (febrero de 2010). "Tromboembolismo venoso en mujeres que toman anticonceptivos hormonales". Expert Review of Cardiovascular Therapy . 8 (2): 211–5. doi :10.1586/erc.09.175. PMID 20136607. S2CID 41309800.
- ^ de Bastos M, Stegeman BH, Rosendaal FR, Van Hylckama Vlieg A, Helmerhorst FM, Stijnen T, et al. (3 de marzo de 2014). Grupo Cochrane de Regulación de la Fertilidad (ed.). "Anticonceptivos orales combinados: trombosis venosa". Base de Datos Cochrane de Revisiones Sistemáticas . 2014 (3): CD010813. doi :10.1002/14651858.CD010813.pub2. PMC 10637279. PMID 24590565.
- ^ Roach RE, Helmerhorst FM, Lijfering WM, Stijnen T, Algra A, Dekkers OM (agosto de 2015). "Anticonceptivos orales combinados: riesgo de infarto de miocardio y accidente cerebrovascular isquémico". Base de datos Cochrane de revisiones sistemáticas . 8 (8): CD011054. doi :10.1002/14651858.CD011054.pub2. PMC 6494192. PMID 26310586 .
- ^ Rang HP, Dale MM, Ritter JM, Flower RJ, Henderson G (2012). "El sistema reproductivo". Farmacología de Rang y Dale (7.ª ed.). Edimburgo: Elsevier/Churchill Livingstone. pág. 426. ISBN 978-0-7020-3471-8.
- ^ abc ESHRE Capri Workshop Group (2013). "Tromboembolismo venoso en mujeres: un riesgo específico para la salud reproductiva". Actualización en reproducción humana . 19 (5): 471–82. doi : 10.1093/humupd/dmt028 . PMID 23825156.
- ^ Lidegaard Ø, Milsom I, Geirsson RT, Skjeldestad FE (julio de 2012). "Anticoncepción hormonal y tromboembolismo venoso". Acta Obstetricia et Gynecologica Scandinavica . 91 (7): 769–78. doi : 10.1111/j.1600-0412.2012.01444.x . PMID 22568831. S2CID 2691199.
- ^ Dunn N (abril de 2011). "El riesgo de trombosis venosa profunda con anticonceptivos orales que contienen drospirenona". BMJ . 342 : d2519. doi :10.1136/bmj.d2519. PMID 21511807. S2CID 42721801.
- ^ "Aspectos destacados de la información de prescripción de Yasmin" (PDF) . Administración de Alimentos y Medicamentos de los Estados Unidos (FDA). Archivado (PDF) desde el original el 25 de abril de 2012. Consultado el 11 de noviembre de 2012 .
- ^ Amoozegar F, Ronksley PE, Sauve R, Menon BK (2015). "Anticonceptivos hormonales y riesgo de trombosis venosa cerebral: una revisión sistemática y metanálisis". Front Neurol . 6 : 7. doi : 10.3389/fneur.2015.00007 . PMC 4313700 . PMID 25699010.
- ^ ab Bast RC, Brewer M, Zou C, Hernandez MA, Daley M, Ozols R, et al. (2007). "Prevención y detección temprana del cáncer de ovario: ¿misión imposible?". Prevención del cáncer . Resultados recientes en la investigación del cáncer. Vol. 174. págs. 91–100. doi :10.1007/978-3-540-37696-5_9. ISBN 978-3-540-37695-8. Número de identificación personal 17302189.
- ^ Vessey M, Yeates D, Flynn S (septiembre de 2010). "Factores que afectan la mortalidad en un estudio de cohorte grande con especial referencia al uso de anticonceptivos orales". Anticoncepción . 82 (3): 221–9. doi :10.1016/j.contraception.2010.04.006. PMID 20705149.
- ^ Nappi RE, Pellegrinelli A, Campolo F, Lanzo G, Santamaria V, Suragna A, et al. (2 de enero de 2015). "Efectos de la anticoncepción hormonal combinada en la salud y el bienestar: conocimiento de las mujeres en el norte de Italia". The European Journal of Contraception & Reproductive Health Care . 20 (1): 36–46. doi :10.3109/13625187.2014.961598. ISSN 1362-5187. PMID 25317952. S2CID 26048792.
- ^ Cibula D, Gompel A, Mueck AO, La Vecchia C, Hannaford PC, Skouby SO, et al. (2010). "Anticoncepción hormonal y riesgo de cáncer". Human Reproduction Update . 16 (6): 631–50. doi : 10.1093/humupd/dmq022 . PMID 20543200.
- ^ Gierisch JM, Coeytaux RR, Urrutia RP, Havrilesky LJ, Moorman PG, Lowery WJ, et al. (noviembre de 2013). "Uso de anticonceptivos orales y riesgo de cáncer de mama, cuello uterino, colorrectal y endometrial: una revisión sistemática". Epidemiología del cáncer, biomarcadores y prevención . 22 (11): 1931–43. doi : 10.1158/1055-9965.EPI-13-0298 . PMID 24014598.
- ^ Anothaisintawee T, Wiratkapun C, Lerdsitthichai P, Kasamesup V, Wongwaisayawan S, Srinakarin J, et al. (septiembre de 2013). "Factores de riesgo del cáncer de mama: una revisión sistemática y un metanálisis". Revista de salud pública de Asia y el Pacífico . 25 (5): 368–87. doi :10.1177/1010539513488795. PMID 23709491. S2CID 206616972.
- ^ Zhu H, Lei X, Feng J, Wang Y (diciembre de 2012). "Uso de anticonceptivos orales y riesgo de cáncer de mama: un metaanálisis de estudios de cohorte prospectivos". The European Journal of Contraception & Reproductive Health Care . 17 (6): 402–14. doi :10.3109/13625187.2012.715357. PMID 23061743. S2CID 33708638.
- ^ ab Mørch LS, Skovlund CW, Hannaford PC, Iversen L, Fielding S, Lidegaard Ø (7 de diciembre de 2017). "La anticoncepción hormonal contemporánea y el riesgo de cáncer de mama". La Revista de Medicina de Nueva Inglaterra . 377 (23): 2228–2239. doi :10.1056/NEJMoa1700732. hdl : 2164/15157 . PMID 29211679. S2CID 4498610.
- ^ abc Lopez LM, Ramesh S, Chen M, Edelman A, Otterness C, Trussell J, et al. (28 de agosto de 2016). "Anticonceptivos de progestina sola: efectos sobre el peso". Base de Datos Cochrane de Revisiones Sistemáticas . 2016 (8): CD008815. doi :10.1002/14651858.CD008815.pub4. ISSN 1469-493X. PMC 5034734. PMID 27567593 .
- ^ Weir GC, DeGroot LJ, Grossman A, Marshall JF, Melmed S, Potts JT (2006). Endocrinología (5.ª ed.). St. Louis, Mo: Elsevier Saunders. pág. 2999. ISBN 978-0-7216-0376-6.[ página necesaria ]
- ^ Westhoff CL, Heartwell S, Edwards S, Zieman M, Stuart G, Cwiak C, et al. (abril de 2007). "Interrupción de los anticonceptivos orales: ¿importan los efectos secundarios?". American Journal of Obstetrics and Gynecology . 196 (4): 412.e1–6, discusión 412.e6–7. doi :10.1016/j.ajog.2006.12.015. PMC 1903378 . PMID 17403440.
- ^ Seal BN, Brotto LA, Gorzalka BB (agosto de 2005). "Uso de anticonceptivos orales y excitación genital femenina: consideraciones metodológicas". Journal of Sex Research . 42 (3): 249–58. doi :10.1080/00224490509552279. PMID 19817038. S2CID 10402534.
- ^ Higgins JA, Davis AR (julio de 2014). "Aceptabilidad sexual anticonceptiva: un comentario, sinopsis y agenda para futuras investigaciones". Anticoncepción . 90 (1): 4–10. doi :10.1016/j.contraception.2014.02.029. PMC 4247241 . PMID 24792147.
- ^ Burrows LJ, Basha M, Goldstein AT (2012). "Los efectos de los anticonceptivos hormonales en la sexualidad femenina: una revisión". Revista de medicina sexual . 9 (9). Elsevier : 2213–2223. doi :10.1111/j.1743-6109.2012.02848.x. PMID 22788250.
- ^ Pastor Z, Holla K, Chmel R (2013). "La influencia de los anticonceptivos orales combinados en el deseo sexual femenino: una revisión sistemática". Revista Europea de Contracepción y Salud Reproductiva . 18 (1). Taylor & Francis: 27–43. doi :10.3109/13625187.2012.728643. PMID 23320933. S2CID 34748865.
- ^ ab Boudesseul J, Gildersleeve KA, Haselton MG , Bègue L (2019). "¿Las mujeres se exponen a más riesgos relacionados con la salud en determinadas fases del ciclo menstrual? Una revisión metaanalítica". Neuroscience & Biobehavioral Reviews . 107 : 505–524. doi :10.1016/j.neubiorev.2019.08.016. PMID 31513819. Archivado desde el original el 6 de mayo de 2023. Consultado el 27 de abril de 2023 .
- ^ Panzer C, Wise S, Fantini G, Kang D, Munarriz R, Guay A, et al. (enero de 2006). "Impacto de los anticonceptivos orales en los niveles de globulina transportadora de hormonas sexuales y andrógenos: un estudio retrospectivo en mujeres con disfunción sexual". The Journal of Sexual Medicine . 3 (1): 104–13. doi :10.1111/j.1743-6109.2005.00198.x. PMID 16409223.
Descripción de los resultados del estudio en Medical News Today: "La píldora anticonceptiva podría causar problemas a largo plazo con la testosterona, según indica una nueva investigación". 4 de enero de 2006. Archivado desde el original el 24 de abril de 2011. Consultado el 9 de abril de 2011 . - ^ Panzer C, Wise S, Fantini G, Kang D, Munarriz R, Guay A, et al. (enero de 2006). "Impacto de los anticonceptivos orales en los niveles de globulina transportadora de hormonas sexuales y andrógenos: un estudio retrospectivo en mujeres con disfunción sexual". The Journal of Sexual Medicine . 3 (1): 104–13. doi :10.1111/j.1743-6109.2005.00198.x. PMID 16409223.
- ^ Zheng J, Islam RM, Skiba MA, Bell RJ, Davis SR (2020). "Asociaciones entre los andrógenos y la función sexual en mujeres premenopáusicas: un estudio transversal". The Lancet Diabetes & Endocrinology . 8 (8). Elsevier: 693–702. doi :10.1016/S2213-8587(20)30239-4. PMID 32707117. S2CID 225473332.
- ^ ab Hatcher RD, Nelson AL (2004). "Métodos anticonceptivos hormonales combinados". En Hatcher RD (ed.). Tecnología anticonceptiva (18.ª ed.). Nueva York: Ardent Media, Inc., págs. 403, 432, 434. ISBN 978-0-9664902-5-1.
- ^ Speroff L (2005). Una guía clínica para la anticoncepción (4.ª ed.). Hagerstown, MD: Lippincott Williams & Wilkins. pág. 72. ISBN 978-0-7817-6488-9.
- ^ Roberts SC, Havlicek J, Flegr J , Hruskova M, Little AC, Jones BC , et al. (2004). "El atractivo facial femenino aumenta durante la fase fértil del ciclo menstrual". Actas de la Royal Society B: Biological Sciences . 271 (Suplemento 5). Royal Society: S270–S272. doi :10.1098/rsbl.2004.0174. JSTOR 4142824. PMC 1810066. PMID 15503991 .
- ^ Miller GF , Tybur JM , Jordan BD (2007). "Efectos del ciclo ovulatorio en las propinas de las bailarinas eróticas: ¿evidencia económica del estro humano?" (PDF) . Evolución y comportamiento humano . 28 (6): 375–381. CiteSeerX 10.1.1.154.8176 . doi :10.1016/j.evolhumbehav.2007.06.002. Archivado (PDF) desde el original el 13 de junio de 2023. Consultado el 16 de mayo de 2023 .
- ^ Pipitone RN, Gallup GG (2008). "El atractivo de la voz de las mujeres varía a lo largo del ciclo menstrual". Evolución y comportamiento humano . 29 (4). Elsevier: 268–274. Bibcode :2008EHumB..29..268P. doi :10.1016/j.evolhumbehav.2008.02.001.
- ^ Chavanne TJ, Gallup GG (1998). "Variación en la conducta de toma de riesgos entre estudiantes universitarias como función del ciclo menstrual". Evolución y comportamiento humano . 19 (1). Elsevier: 27–32. Bibcode :1998EHumB..19...27C. doi :10.1016/S1090-5138(98)00016-6.
- ^ Buss DM (2016) [1994]. La evolución del deseo: estrategias de apareamiento humano (3.ª ed.). Nueva York: Basic Books . pp. 260–262. ISBN 978-0-465-09776-0.
- ^ Bröder A, Hohmann N (2003). "Variaciones en la conducta de toma de riesgos a lo largo del ciclo menstrual: una replicación mejorada". Evolución y comportamiento humano . 24 (6). Elsevier: 391–398. Bibcode :2003EHumB..24..391B. doi :10.1016/S1090-5138(03)00055-2.
- ^ Burns BD (2006). «Neuroendocrinología cognitiva: cambios en las preferencias de riesgo a lo largo del ciclo menstrual». Actas de la Reunión Anual de la Sociedad de Ciencias Cognitivas . 28 : 125–130. ISSN 1069-7977. Archivado desde el original el 27 de abril de 2023. Consultado el 27 de abril de 2023 .
- ^ Boletín de práctica del Comité ACOG sobre ginecología (2006). "Boletín de práctica del ACOG n.º 73: Uso de anticoncepción hormonal en mujeres con afecciones médicas coexistentes". Obstetricia y ginecología . 107 (6): 1453–72. doi :10.1097/00006250-200606000-00055. PMID 16738183.
- ^ FFPRHC (2006). "Criterios médicos de elegibilidad para el uso de anticonceptivos en el Reino Unido (2005/2006)" (PDF) . Archivado desde el original (PDF) el 19 de junio de 2007. Consultado el 31 de marzo de 2007 .
- ^ Cilia La Corte AL, Carter AM, Turner AJ, Grant PJ, Hooper NM (diciembre de 2008). "La aminopeptidasa P que degrada la bradicinina aumenta en mujeres que toman la píldora anticonceptiva oral". Journal of the Renin-Angiotensin-Aldosterone System . 9 (4): 221–5. doi : 10.1177/1470320308096405 . PMID 19126663. S2CID 206729914.
- ^ Qiu Y, Hu Y (23 de junio de 2021). "Píldoras anticonceptivas y riesgo de hipotiroidismo: un estudio transversal de la Encuesta Nacional de Examen de Salud y Nutrición, 2007-2012". BMJ Open . 11 (6): e046607. doi :10.1136/bmjopen-2020-046607. PMC 8230965 . PMID 34162647.
- ^ "Cálculos biliares". NDDIC. Julio de 2007. Archivado desde el original el 11 de agosto de 2010. Consultado el 13 de agosto de 2010 .
- ^ Raloff J (23 de abril de 2009). «Las píldoras anticonceptivas pueden limitar las ganancias del entrenamiento muscular». Science News . Archivado desde el original el 11 de junio de 2012. Consultado el 22 de octubre de 2018 .
- ^ "Los problemas amorosos pueden atribuirse a la píldora anticonceptiva: investigación – ABC News (Australian Broadcasting Corporation)". ABC News . Abc.net.au. 14 de agosto de 2008. Archivado desde el original el 22 de julio de 2010 . Consultado el 20 de marzo de 2010 .
- ^ Kollndorfer K, Ohrenberger I, Schöpf V (2016). "El uso de anticonceptivos afecta el rendimiento olfativo general: investigación de la dosis de estradiol y la duración de la ingesta". PLOS ONE . 11 (12): e0167520. Bibcode :2016PLoSO..1167520K. doi : 10.1371/journal.pone.0167520 . PMC 5176159 . PMID 28002464.
- ^ Roberts SC, Gosling LM, Carter V, Petrie M (diciembre de 2008). "Preferencias de olores correlacionadas con el MHC en humanos y el uso de anticonceptivos orales". Actas. Ciencias biológicas . 275 (1652): 2715–22. doi :10.1098/rspb.2008.0825. PMC 2605820. PMID 18700206 .
- ^ Vercellini P, Eskenazi B, Consonni D, Somigliana E, Parazzini F, Abbiati A, et al. (2010). "Anticonceptivos orales y riesgo de endometriosis: una revisión sistemática y un metanálisis". Actualización sobre reproducción humana . 17 (2): 159–70. doi : 10.1093/humupd/dmq042 . PMID 20833638.
- ^ Zimmerman Y, Eijkemans MJ, Coelingh Bennink HJ, Blankenstein MA, Fauser BC (2013). "El efecto de la anticoncepción oral combinada en los niveles de testosterona en mujeres sanas: una revisión sistemática y un metanálisis". Human Reproduction Update . 20 (1): 76–105. doi :10.1093/humupd/dmt038. PMC 3845679 . PMID 24082040.
- ^ Scholes D, Hubbard RA , Ichikawa LE, LaCroix AZ, Spangler L, Beasley JM, et al. (septiembre de 2011). "Uso de anticonceptivos orales y cambio de la densidad ósea en mujeres adolescentes y adultas jóvenes: un estudio prospectivo de edad, dosis hormonal y discontinuación". The Journal of Clinical Endocrinology and Metabolism . 96 (9): E1380–7. doi :10.1210/jc.2010-3027. PMC 3167673 . PMID 21752879.
- ^ Los efectos de los antibióticos de amplio espectro sobre las píldoras anticonceptivas combinadas no se encuentran en el metanálisis sistemático de interacciones (Archer, 2002), aunque "los pacientes individuales muestran grandes disminuciones en las concentraciones plasmáticas de etinilestradiol cuando toman ciertos otros antibióticos" (Dickinson, 2001). "Los expertos en este tema aún recomiendan informar a los usuarios de anticonceptivos orales sobre la posibilidad de una interacción rara" (DeRossi, 2002) y esto sigue siendo actual (2006) Consejo de la Asociación de Planificación Familiar del Reino Unido Archivado el 8 de febrero de 2007 en Wayback Machine .
- ^ Archer JS, Archer DF (junio de 2002). "Eficacia de los anticonceptivos orales e interacción con antibióticos: un mito desacreditado". Journal of the American Academy of Dermatology . 46 (6): 917–23. doi :10.1067/mjd.2002.120448. PMID 12063491.
- ^ Dickinson BD, Altman RD, Nielsen NH, Sterling ML (noviembre de 2001). "Interacciones farmacológicas entre anticonceptivos orales y antibióticos". Obstetricia y ginecología . 98 (5 Pt 1): 853–60. doi :10.1016/S0029-7844(01)01532-0. PMID 11704183. S2CID 41354899.
- ^ DeRossi SS, Hersh EV (octubre de 2002). "Antibióticos y anticonceptivos orales". Clínicas dentales de Norteamérica . 46 (4): 653–64. CiteSeerX 10.1.1.620.9933 . doi :10.1016/S0011-8532(02)00017-4. PMID 12436822.
- ^ Berry-Bibee EN, Kim MJ, Tepper NK, Riley HE, Curtis KM (diciembre de 2016). "Coadministración de la hierba de San Juan y anticonceptivos hormonales: una revisión sistemática". Anticoncepción . 94 (6): 668–677. doi :10.1016/j.contraception.2016.07.010. PMC 11283811 . PMID 27444983.
- ^ Comisionado Oo (julio de 2023). «La FDA aprueba el primer anticonceptivo oral diario sin receta». FDA . Consultado el 6 de abril de 2024 .
- ^ Marks L (2001). Química sexual: una historia de la píldora anticonceptiva. Yale University Press. págs. 73-75, 77-78. ISBN 978-0-300-08943-1Archivado desde el original el 11 de enero de 2023 . Consultado el 27 de septiembre de 2020 .
- ^ Gelijns A (1991). Innovación en la práctica clínica: la dinámica del desarrollo de la tecnología médica. Academias Nacionales. págs. 167–. NAP:13513. Archivado desde el original el 13 de enero de 2023. Consultado el 27 de septiembre de 2020 .
- ^ Blum RW (22 de octubre de 2013). Atención sanitaria a los adolescentes: cuestiones clínicas. Elsevier Science. pp. 216–. ISBN 978-1-4832-7738-7.
- ^ Tone A, Watkins ES (8 de enero de 2007). Medicating Modern America: Prescription Drugs in History [Medicando a los Estados Unidos modernos: medicamentos recetados en la historia]. NYU Press. págs. 117-119. ISBN 978-0-8147-8301-6.
- ^ McGuire JL (2000). Productos farmacéuticos, 4 volúmenes. Wiley. pág. 1580,1599. ISBN 978-3-527-29874-7.
- ^ Rao B (1 de enero de 1998). Ginecología clínica (4ª ed.). Oriente Cisne Negro. págs. 163–. ISBN 978-81-250-1622-9.
- ^ Labhart A (6 de diciembre de 2012). Endocrinología clínica: teoría y práctica. Springer Science & Business Media. pp. 571–. ISBN 978-3-642-96158-8.
- ^ Goldzieher JW, Rudel HW (octubre de 1974). "Cómo se desarrollaron los anticonceptivos orales". JAMA . 230 (3): 421–5. doi :10.1001/jama.230.3.421. PMID 4606623.
- ^ Goldzieher JW (mayo de 1982). "Estrógenos en anticonceptivos orales: perspectivas históricas". The Johns Hopkins Medical Journal . 150 (5): 165–9. PMID 7043034.
- ^ Perone N (primavera de 1993). "La historia del desarrollo de los anticonceptivos esteroides: las progestinas". Perspectivas en biología y medicina . 36 (3): 347–62. doi :10.1353/pbm.1993.0054. PMID 8506121. S2CID 46312750.
- ^ Goldzieher JW (primavera de 1993). "La historia del desarrollo de los anticonceptivos esteroides: los estrógenos". Perspectivas en biología y medicina . 36 (3): 363–8. doi :10.1353/pbm.1993.0066. PMID 8506122. S2CID 28975213.
- ^ abc Maisel AQ (1965). La búsqueda de hormonas . Nueva York: Random House. OCLC 543168.
- ^ ab Asbell B (1995). La píldora: biografía de la droga que cambió el mundo. Nueva York: Random House. ISBN 978-0-679-43555-6.
- ^ Lehmann PA, Bolivar A, Quintero R (marzo de 1973). "Russell E. Marker. Pionero de la industria mexicana de esteroides". Journal of Chemical Education . 50 (3): 195–9. Bibcode :1973JChEd..50..195L. doi :10.1021/ed050p195. PMID 4569922.
- ^ ab Vaughan P (1970). La píldora a prueba . Nueva York: Coward-McCann. OCLC 97780.
- ^ ab Tone A (2001). Dispositivos y deseos: una historia de los anticonceptivos en Estados Unidos. Nueva York: Hill and Wang. ISBN 978-0-8090-3817-6.
- ^ abcd Pincus G, Bialy G (1964). Fármacos utilizados en el control de la reproducción . Avances en farmacología. Vol. 3. Academic Press. págs. 285–313. doi :10.1016/S1054-3589(08)61115-1. ISBN 978-0-12-032903-8. PMID 14232795.
La observación original de Makepeace et al. (1937) de que la progesterona inhibía la ovulación en la coneja fue corroborada por Pincus y Chang (1953). En las mujeres, 300 mg de progesterona por día tomados por vía oral dieron como resultado la inhibición de la ovulación en el 80% de los casos (Pincus, 1956). La alta dosis y la frecuente incidencia de sangrado intermenstrual limitaron la aplicación práctica del método. Posteriormente, la utilización de potentes 19-noresteroides, que podían administrarse por vía oral, abrió el campo a la anticoncepción oral práctica.
- ^ Nance K (16 de octubre de 2014). «Jonathan Eig sobre 'El nacimiento de la píldora'». Chicago Tribune . Archivado desde el original el 19 de abril de 2019. Consultado el 19 de octubre de 2014 .
- ^ "El nacimiento de la píldora". WW Norton & Company. Archivado desde el original el 11 de octubre de 2014. Consultado el 19 de octubre de 2014 .
- ^ Manning K (17 de octubre de 2014). «Reseña del libro: 'El nacimiento de la píldora' y la reinvención del sexo, por Jonathan Eig». The Washington Post . Archivado desde el original el 9 de diciembre de 2022. Consultado el 25 de agosto de 2017 .
- ^ abc Reed J (1978). Del vicio privado a la virtud pública: el movimiento de control de la natalidad y la sociedad estadounidense desde 1830. Nueva York: Basic Books. ISBN 978-0-465-02582-4.
- ^ Speroff L (2009). Un buen hombre: Gregory Goodwin Pincus: El hombre, su historia, la píldora anticonceptiva . Portland, Oregón: Arnica. ISBN 978-0-9801942-9-6.
- ^ Fields A (2003). Katharine Dexter McCormick: pionera de los derechos de las mujeres . Westport, Connecticut: Prager. ISBN 978-0-275-98004-7.
- ^ McLaughlin L (1982). La píldora, John Rock y la Iglesia: biografía de una revolución. Boston: Little, Brown. ISBN 978-0-316-56095-5.
- ^ Rock J, Garcia CR, Pincus G (1957). "Progestinas sintéticas en el ciclo menstrual humano normal". Recent Progress in Hormone Research . 13 : 323–39, discusión 339–46. PMID 13477811.
- ^ abc Pincus G (diciembre de 1958). "El control hormonal de la ovulación y el desarrollo temprano". Medicina de posgrado . 24 (6): 654–60. doi :10.1080/00325481.1958.11692305. PMID 13614060.
- ^ abc Pincus G (1959). Agentes progestacionales y control de la fertilidad . Vitaminas y hormonas. Vol. 17. Academic Press. págs. 307–324. doi :10.1016/S0083-6729(08)60274-5. ISBN 978-0-12-709817-3. ISSN 0083-6729.
Ishikawa et al. (1957) empleando el mismo régimen de administración de progesterona también observaron supresión de la ovulación en una proporción de los casos llevados a laparotomía. Aunque las mujeres de nuestros experimentos y los de Ishikawa et al. practicaron libremente las relaciones sexuales, no se produjo ningún embarazo. Dado que la ovulación presumiblemente tuvo lugar en una proporción de ciclos, la falta de embarazos puede deberse al azar, pero Ishikawa et al. (1957) han presentado datos que indican que en las mujeres que reciben progesterona oral el moco cervical se vuelve impenetrable para los espermatozoides.
- ^ ab Diczfalusy E (diciembre de 1965). "Probable mode of action of oral contraceptives". BMJ . 2 (5475): 1394–9. doi :10.1136/bmj.2.5475.1394. PMC 1847181 . PMID 5848673.
En la Quinta Conferencia Internacional sobre Planificación Familiar en Tokio, Pincus (1955) informó sobre una inhibición de la ovulación por progesterona o noretinodrel1 tomados por vía oral por las mujeres. Este informe indicó el comienzo de una nueva era en la historia de la anticoncepción. ... Los primeros estudios de Pincus (1956, 1959) y de Ishikawa et al. (1957) sugirieron que el moco cervical podría ser uno de los principales sitios de acción. Estos investigadores encontraron que no se produjeron embarazos en mujeres tratadas por vía oral con grandes dosis de progesterona, aunque la ovulación se inhibió sólo en alrededor del 70% de los casos estudiados. ... El mecanismo de protección en este método -y probablemente en el de Pincus (1956) y de Ishikawa et al. (1957)- debe implicar un efecto sobre el moco cervical y/o el endometrio y las trompas de Falopio.
- ^ ab Ramírez de Arellano AB, Seipp C (10 de octubre de 2017). Colonialismo, catolicismo y anticoncepción: una historia del control de la natalidad en Puerto Rico. University of North Carolina Press. pp. 107–. ISBN 978-1-4696-4001-3. Archivado del original el 15 de julio de 2023 . Consultado el 2 de mayo de 2019 .
Aun así, ninguno de los dos investigadores estaba completamente satisfecho con los resultados. La progesterona tendía a causar "menstruaciones prematuras", o sangrado intermenstrual, en aproximadamente el 20 por ciento de los ciclos, un fenómeno que perturbaba a las pacientes y preocupaba a Rock.17 Además, a Pincus le preocupaba el fracaso en la inhibición de la ovulación en todos los casos. Solo grandes dosis de progesterona administrada por vía oral podían asegurar la supresión de la ovulación, y estas dosis eran caras. Por lo tanto, el uso masivo de este régimen como método anticonceptivo estaba seriamente en peligro.
- ^ Chang MC (septiembre de 1978). "Desarrollo de los anticonceptivos orales". Revista estadounidense de obstetricia y ginecología . 132 (2): 217–9. doi :10.1016/0002-9378(78)90928-6. PMID 356615.
- ^ Garcia CR, Pincus G, Rock J (noviembre de 1956). "Efectos de ciertos esteroides 19-nor en el ciclo menstrual humano normal". Science . 124 (3227): 891–3. Bibcode :1956Sci...124..891R. doi :10.1126/science.124.3227.891. PMID 13380401.
- ^ ab Rock J, García CR (1957). "Efectos observados de los esteroides 19-nor en la ovulación y la menstruación". Actas de un simposio sobre esteroides progestacionales 19-Nor . Chicago: Searle Research Laboratories. págs. 14–31. OCLC 935295.
- ^ Pincus G, Rock J, Garcia CR, Ricewray E, Paniagua M, Rodriguez I (junio de 1958). "Control de la fertilidad con medicación oral". Revista Americana de Obstetricia y Ginecología . 75 (6): 1333–46. doi :10.1016/0002-9378(58)90722-1. PMID 13545267.
- ^ García CR (diciembre de 2004). "Desarrollo de la píldora". Anales de la Academia de Ciencias de Nueva York . 1038 (1): 223–6. Bibcode :2004NYASA1038..223G. doi :10.1196/annals.1315.031. PMID 15838117. S2CID 25550745.
- ^ Strauss JF, Mastroianni L (enero de 2005). "In memoriam: Celso-Ramon Garcia, MD (1922-2004), visionario de la medicina reproductiva". Journal of Experimental & Clinical Assisted Reproduction . 2 (1): 2. doi : 10.1186/1743-1050-2-2 . PMC 548289 . PMID 15673473.
- ^ abcde Junod SW, Marks L (abril de 2002). "Ensayos clínicos en mujeres: la aprobación de la primera píldora anticonceptiva oral en los Estados Unidos y Gran Bretaña". Revista de Historia de la Medicina y Ciencias Afines . 57 (2): 117–60. doi : 10.1093/jhmas/57.2.117 . PMID 11995593. S2CID 36533080.
- ^ Tyler ET, Olson HJ (abril de 1959). "Efectos inhibidores y promotores de la fertilidad de las nuevas sustancias hormonales esteroides". Revista de la Asociación Médica Estadounidense . 169 (16): 1843–54. doi :10.1001/jama.1959.03000330015003. PMID 13640942.
- ^ Winter IC (1957). "Resumen". Actas de un simposio sobre esteroides progestacionales 19-Nor . Chicago: Searle Research Laboratories. págs. 120-122. OCLC 935295.
- ^ Grindlay K, Burns B, Grossman D (julio de 2013). "Requisitos de prescripción y acceso sin receta a anticonceptivos orales: una revisión global". Anticoncepción . 88 (1): 91–96. doi :10.1016/j.contraception.2012.11.021. ISSN 1879-0518. PMID 23352799.
- ^ abcd Marks L (2001). Química sexual: una historia de la píldora anticonceptiva. New Haven: Yale University Press. ISBN 978-0-300-08943-1.
- ^ Winter IC (mayo de 1970). «La presión industrial y el problema demográfico: la FDA y la píldora». JAMA . 212 (6): 1067–8. doi :10.1001/jama.212.6.1067. PMID 5467404.
- ^ abcde Watkins ES (1998). La píldora: una historia social de los anticonceptivos orales, 1950-1970 . Baltimore: Johns Hopkins University Press. ISBN 978-0-8018-5876-5.
- ^ Winter IC (marzo de 1965). "La incidencia de tromboembolia en usuarios de Enovid". Metabolism . 14 (Suplemento): SUPPL:422–8. doi :10.1016/0026-0495(65)90029-6. PMID 14261427.
- ^ Jordan WM, Anand JK (18 de noviembre de 1961). "Embolia pulmonar". Lancet . 278 (7212): 1146–1147. doi :10.1016/S0140-6736(61)91061-3.
- ^ Seaman B (1969). El caso de los médicos contra la píldora . Nueva York: PH Wyden. ISBN 978-0-385-14575-6.
- ^ Administración de Alimentos y Medicamentos de Estados Unidos (11 de junio de 1970). "Declaración de política sobre el etiquetado de anticonceptivos orales dirigida a los usuarios". Registro Federal . 35 (113): 9001–9003.
- ^ Administración de Alimentos y Medicamentos de Estados Unidos (31 de enero de 1978). «Anticonceptivos orales; requisito de etiquetado dirigido al paciente». Registro Federal . 43 (21): 4313–4334.
- ^ Administración de Alimentos y Medicamentos de Estados Unidos (25 de mayo de 1989). «Anticonceptivos orales; requisito de prospecto para el paciente». Registro Federal . 54 (100): 22585–22588.
- ^ "Autoridad prescriptiva para farmacéuticos: anticonceptivos orales". Pharmacy Times . Noviembre de 2018 Tos, resfriado y gripe. 84 (11). 19 de noviembre de 2018. Archivado desde el original el 2 de agosto de 2019 . Consultado el 2 de agosto de 2019 .
- ^ "Prescripción farmacéutica de medicamentos anticonceptivos hormonales". NASPA . Archivado desde el original el 2 de agosto de 2019 . Consultado el 2 de agosto de 2019 .
- ^ "Farmacéuticos autorizados a recetar anticonceptivos en más estados". NASPA . 4 de mayo de 2017. Archivado desde el original el 2 de agosto de 2019 . Consultado el 2 de agosto de 2019 .
- ^ "Doctor: Por qué me alegra que los farmacéuticos de mi estado receten píldoras anticonceptivas". CNN . 30 de enero de 2024. Archivado desde el original el 8 de febrero de 2024 . Consultado el 11 de febrero de 2024 .
- ^ Comisionado Oo (9 de agosto de 2024). «La FDA aprueba el primer anticonceptivo oral diario sin receta». FDA . Consultado el 25 de septiembre de 2024 .
- ^ ab "Historia de Schering AG". Archivado desde el original el 15 de abril de 2008. Consultado el 6 de diciembre de 2007 .
{{cite web}}: CS1 maint: bot: estado de URL original desconocido ( enlace ) - ^ Van den Broeck K (5 de marzo de 2010). "Gynaecoloog Ferdinand Peeters: De vergeten stiefvader van de pil" [Ginecólogo Ferdinand Peeters: El padrastro olvidado del pil]. Knack (en holandés). págs. 6-13. Adicional #4. Archivado desde el original el 14 de septiembre de 2022 . Consultado el 14 de septiembre de 2022 .
- ^ Hope A (24 de mayo de 2010). «La pequeña píldora que pudo». Flanders Today . Archivado desde el original el 1 de enero de 2021. Consultado el 28 de diciembre de 2014 .
- ^ Mears E (noviembre de 1961). "Ensayos clínicos de anticonceptivos orales". British Medical Journal . 2 (5261): 1179–83. doi :10.1136/bmj.2.5261.1179. PMC 1970272 . PMID 14471934.
- ^ Eckstein P, Waterhouse JA, Bond GM, Mills WG, Sandilands DM, Shotton DM (noviembre de 1961). "El ensayo de anticonceptivos orales de Birmingham". British Medical Journal . 2 (5261): 1172–9. doi :10.1136/bmj.2.5261.1172. PMC 1970253 . PMID 13889122.
- ^ ab Pullen D (octubre de 1962). ""Conovid-E" como anticonceptivo oral". British Medical Journal . 2 (5311): 1016–9. doi :10.1136/bmj.2.5311.1016. PMC 1926317 . PMID 13972503.
- ^ ab Mears E, Grant EC (julio de 1962). ""Anovlar" como anticonceptivo oral". British Medical Journal . 2 (5297): 75–9. doi :10.1136/bmj.2.5297.75. PMC 1925289 . PMID 14471933.
- ^ "Anotaciones". British Medical Journal . 2 (5258): 1007–9. Octubre de 1961. doi :10.1136/bmj.2.3490.1009. PMC 1970146 . PMID 20789252.
"Noticias médicas". BMJ . 2 (5258): 1032–1034. 1961. doi :10.1136/bmj.2.5258.1032. S2CID 51696624. - ^ Chàvez L, Takahashi A, Yoshimoto T, Su CC, Sugawara T, Fujii Y (marzo de 1990). "Cambios morfológicos en las arterias basilares caninas normales después de una angioplastia transluminal". Neurological Research . 12 (1): 12–6. doi :10.1136/bmj.2.5266.1584. PMID 1970619. S2CID 8849008.
- ^ "Subvencionar el control de la natalidad". Time . Vol. 78, núm. 24. 15 de diciembre de 1961. pág. 55. Archivado desde el original el 5 de febrero de 2008.
- ^ Dourlen Rollier AV (octubre de 1972). "[Anticoncepción: sí, pero...]". Fertilité, Orthogénie . 4 (4): 185–8. PMID 12306278.
- ^ "La generación del sida: ¿la píldora tiene prioridad?". Science Actualities. 2000. Archivado desde el original el 1 de diciembre de 2006. Consultado el 7 de septiembre de 2006 .
- ^ "Djerassi sobre el control de la natalidad en Japón: aborto 'sí', píldora 'no'" (Comunicado de prensa). Stanford University News Service. 14 de febrero de 1996. Archivado desde el original el 6 de enero de 2007. Consultado el 23 de agosto de 2006 .
- ^ Wudunn S (27 de abril de 1999). "La historia de dos pastillas en Japón: Viagra y anticonceptivos". The New York Times . Archivado desde el original el 19 de abril de 2023. Consultado el 15 de febrero de 2017 .
- ^ Efron S (3 de junio de 1999). "Japón aprueba la píldora anticonceptiva tras décadas de retraso". Los Angeles Times . Archivado desde el original el 31 de agosto de 2022 . Consultado el 31 de agosto de 2022 .
- ^ Efron S (3 de junio de 1999). «Japón aprueba la píldora anticonceptiva tras décadas de retraso». Los Angeles Times . Archivado desde el original el 10 de agosto de 2014. Consultado el 15 de enero de 2015 .
- ^ ab Hayashi A (20 de agosto de 2004). "Las mujeres japonesas evitan la píldora". CBS News . Archivado desde el original el 29 de junio de 2006. Consultado el 12 de junio de 2006 .
- ^ "La píldora". Time . 7 de abril de 1967. Archivado desde el original el 19 de febrero de 2005 . Consultado el 16 de junio de 2020 .
- ^ Westhoff C (15 de diciembre de 2015). "Cómo explica Obamacare la creciente popularidad de los DIU". Public Health Now en la Universidad de Columbia . Archivado desde el original el 23 de diciembre de 2021. Consultado el 17 de junio de 2020 .
- ^ "La píldora anticonceptiva: una historia" (PDF) . Archivado desde el original (PDF) el 9 de diciembre de 2021 . Consultado el 20 de octubre de 2018 .
- ^ Goldin C , Katz LF (2002). "El poder de la píldora: anticonceptivos orales y decisiones de las mujeres sobre su carrera y matrimonio" (PDF) . Revista de Economía Política . 110 (4): 730–770. CiteSeerX 10.1.1.473.6514 . doi :10.1086/340778. S2CID 221286686. Archivado (PDF) desde el original el 29 de mayo de 2023. Consultado el 1 de noviembre de 2017 .
- ^ "La píldora". Archivo de Igualdad . 1 de marzo de 2017. Archivado desde el original el 23 de diciembre de 2021. Consultado el 9 de marzo de 2017 .
- ^ Weigel G (2002). El coraje de ser católico: crisis, reforma y renovación de la Iglesia . Basic Books.
- ^ "Pillenverbot bleibt Streitfrage zwischen den Konfessionen". Centrarse en línea . Archivado desde el original el 6 de julio de 2021 . Consultado el 22 de marzo de 2016 .
- ^ abc "1970 Year in Review". UPI . Archivado desde el original el 23 de mayo de 2009. Consultado el 8 de abril de 2009 .
- ^ Winnick C (1968). "La época beige: despolarización de los roles sexuales en Estados Unidos". Anales de la Academia Estadounidense de Ciencias Políticas y Sociales . 376 : 18-24. doi :10.1177/000271626837600103. JSTOR 1037799. S2CID 145158114.
- ^ Brautigan R (2007). "La píldora contra el desastre de la mina Springhill". Brautigan . doi :10.7273/nvgh-ca61. Archivado desde el original el 14 de enero de 2009 . Consultado el 1 de diciembre de 2017 .
- ^ "La píldora y la revolución del matrimonio". The Clayman Institute for Gender Research . Archivado desde el original el 12 de diciembre de 2017. Consultado el 1 de diciembre de 2017 .
- ^ abc Williams RJ, Johnson AC, Smith JJ, Kanda R (mayo de 2003). "Perfiles de estrógenos esteroides a lo largo de tramos fluviales derivados de descargas de plantas de tratamiento de aguas residuales". Environmental Science & Technology . 37 (9): 1744–50. Bibcode :2003EnST...37.1744W. doi :10.1021/es0202107. PMID 12775044.
- ^ "No del todo libre de preocupaciones". Environment . 45 (1): 6–7. Enero–febrero de 2003. doi :10.1080/00139150309604545. S2CID 218496430.
- ^ Batt S (primavera de 2005). "Tirar drogas por el desagüe" (PDF) . Herizons . 18 (4): 12–3. Archivado desde el original (PDF) el 15 de marzo de 2012 . Consultado el 4 de diciembre de 2011 .
- ^ Zeilinger J, Steger-Hartmann T, Maser E, Goller S, Vonk R, Länge R (diciembre de 2009). "Efectos de los gestágenos sintéticos en la reproducción de los peces". Toxicología y química ambiental . 28 (12): 2663–70. doi : 10.1897/08-485.1 . PMID 19469587.
- ^ Johnson AC, Williams RJ, Simpson P, Kanda R (mayo de 2007). "¿Qué diferencia podría suponer el rendimiento del tratamiento de aguas residuales en la alteración endocrina de los ríos?". Environmental Pollution . 147 (1): 194–202. Bibcode :2007EPoll.147..194J. doi :10.1016/j.envpol.2006.08.032. PMID 17030080.
- ^ Potts M , Marsh L (febrero de 2010). "EL FACTOR POBLACIONARIO: ¿Cómo se relaciona con el cambio climático?" (PDF) . OurPlanet.com. Archivado desde el original (PDF) el 4 de marzo de 2016. Consultado el 22 de junio de 2015 .
- ^ Cafaro P. «Cuñas climáticas alternativas: cuña poblacional». Philip Cafaro . Archivado desde el original el 22 de junio de 2015. Consultado el 22 de junio de 2015 .
- ^ Wire T (10 de septiembre de 2009). «La anticoncepción es la tecnología más 'verde'». London School of Economics . Archivado desde el original el 22 de junio de 2015. Consultado el 22 de junio de 2015 .
Lectura adicional
- Black A, Guilbert E, Costescu D, Dunn S, Fisher W, Kives S, et al. (abril de 2017). "N.º 329: Consenso canadiense sobre anticoncepción, parte 4 de 4, capítulo 9: anticoncepción hormonal combinada". Revista de obstetricia y ginecología de Canadá . 39 (4): 229–268.e5. doi :10.1016/j.jogc.2016.10.005. PMID 28413042.
Enlaces externos
- La píldora anticonceptiva—Archivos digitales de CBC
- El nacimiento de la píldora: presentación de diapositivas de la revista Life
