Aluminio
El aluminio (o aluminum en inglés norteamericano ) es un elemento químico ; tiene símbolo Al y número atómico 13. El aluminio tiene una densidad menor que la de otros metales comunes , aproximadamente un tercio de la del acero . Tiene una gran afinidad hacia el oxígeno , formando una capa protectora de óxido en la superficie cuando se expone al aire. El aluminio se parece visualmente a la plata , tanto en su color como en su gran capacidad para reflejar la luz. Es blando, no magnético y dúctil . Tiene un isótopo estable, 27 Al, que es muy abundante, lo que convierte al aluminio en el duodécimo elemento más común en el universo. La radiactividad del 26 Al , un isótopo más inestable, lleva a que se utilice en la datación radiométrica .
Químicamente, el aluminio es un metal post-transición en el grupo del boro ; como es común para el grupo, el aluminio forma compuestos principalmente en el estado de oxidación +3 . El catión aluminio Al 3+ es pequeño y altamente cargado ; como tal, tiene más poder polarizante , y los enlaces formados por el aluminio tienen un carácter más covalente . La fuerte afinidad del aluminio por el oxígeno conduce a la aparición común de sus óxidos en la naturaleza. El aluminio se encuentra en la Tierra principalmente en rocas de la corteza , donde es el tercer elemento más abundante , después del oxígeno y el silicio , en lugar de en el manto , y prácticamente nunca como metal libre . Se obtiene industrialmente mediante la minería de bauxita , una roca sedimentaria rica en minerales de aluminio.
El descubrimiento del aluminio fue anunciado en 1825 por el físico danés Hans Christian Ørsted . La primera producción industrial de aluminio fue iniciada por el químico francés Henri Étienne Sainte-Claire Deville en 1856. El aluminio se volvió mucho más accesible al público con el proceso Hall-Héroult desarrollado independientemente por el ingeniero francés Paul Héroult y el ingeniero estadounidense Charles Martin Hall en 1886, y la producción en masa de aluminio condujo a su uso extensivo en la industria y la vida cotidiana. En la Primera y Segunda Guerra Mundial, el aluminio fue un recurso estratégico crucial para la aviación . En 1954, el aluminio se convirtió en el metal no ferroso más producido , superando al cobre . En el siglo XXI, la mayor parte del aluminio se consumió en transporte, ingeniería, construcción y embalaje en Estados Unidos, Europa Occidental y Japón.
A pesar de su prevalencia en el medio ambiente, no se conoce ningún organismo vivo que metabolice las sales de aluminio , pero este aluminio es bien tolerado por plantas y animales. Debido a la abundancia de estas sales, el potencial papel biológico de las mismas es de interés y se están realizando estudios al respecto.
Características físicas
Isótopos
De los isótopos de aluminio, sólo27
Alabama
es estable. Esta situación es común para los elementos con un número atómico impar. [b] Es el único isótopo primordial del aluminio, es decir, el único que ha existido en la Tierra en su forma actual desde la formación del planeta. Es por tanto un elemento mononucleídico y su peso atómico estándar es prácticamente el mismo que el del isótopo. Esto hace que el aluminio sea muy útil en la resonancia magnética nuclear (RMN), ya que su único isótopo estable tiene una alta sensibilidad a la RMN. [14] El peso atómico estándar del aluminio es bajo en comparación con muchos otros metales. [c]
Todos los demás isótopos del aluminio son radiactivos . El más estable de ellos es el 26Al : aunque estaba presente junto con el estable 27Al en el medio interestelar a partir del cual se formó el Sistema Solar, habiéndose producido también por nucleosíntesis estelar , su vida media es de sólo 717.000 años y por lo tanto no ha sobrevivido una cantidad detectable desde la formación del planeta. [15] Sin embargo, trazas diminutas de 26Al se producen a partir del argón en la atmósfera por espalación causada por protones de rayos cósmicos . La relación de 26Al a 10Be se ha utilizado para la radiodatación de procesos geológicos en escalas de tiempo de 10 5 a 10 6 años, en particular el transporte, la deposición, el almacenamiento de sedimentos , los tiempos de enterramiento y la erosión. [16] La mayoría de los científicos que estudian meteoritos creen que la energía liberada por la desintegración del 26Al fue responsable de la fusión y diferenciación de algunos asteroides después de su formación hace 4.550 millones de años. [17]
Los isótopos restantes del aluminio, con números másicos que van de 21 a 43, tienen vidas medias muy inferiores a una hora. Se conocen tres estados metaestables , todos con vidas medias inferiores a un minuto. [13]
Capa electrónica
Un átomo de aluminio tiene 13 electrones, dispuestos en una configuración electrónica de [ Ne ] 3s 2 3p 1 , [18] con tres electrones más allá de una configuración estable de gas noble. En consecuencia, las primeras tres energías de ionización combinadas del aluminio son mucho más bajas que la cuarta energía de ionización sola. [19] Esta configuración electrónica es compartida con los otros miembros bien caracterizados de su grupo, boro , galio , indio y talio ; también se espera para el nihonio . El aluminio puede entregar sus tres electrones más externos en muchas reacciones químicas (ver más abajo). La electronegatividad del aluminio es 1,61 (escala de Pauling). [20]

Un átomo de aluminio libre tiene un radio de 143 pm . [21] Con los tres electrones más externos eliminados, el radio se reduce a 39 pm para un átomo 4-coordinado o 53,5 pm para un átomo 6-coordinado. [21] A temperatura y presión estándar , los átomos de aluminio (cuando no se ven afectados por átomos de otros elementos) forman un sistema cristalino cúbico centrado en las caras unido por un enlace metálico proporcionado por los electrones más externos de los átomos; por lo tanto, el aluminio (en estas condiciones) es un metal. [22] Este sistema cristalino es compartido por muchos otros metales, como el plomo y el cobre ; el tamaño de una celda unitaria de aluminio es comparable al de esos otros metales. [22] El sistema, sin embargo, no es compartido por los otros miembros de su grupo: el boro tiene energías de ionización demasiado altas para permitir la metalización, el talio tiene una estructura hexagonal compacta , y el galio y el indio tienen estructuras inusuales que no están compactas como las del aluminio y el talio. Los pocos electrones disponibles para la unión metálica en el aluminio son una causa probable de que sea blando, con un punto de fusión bajo y una resistividad eléctrica baja . [23]
A granel
El aluminio metálico tiene una apariencia que va desde el blanco plateado hasta el gris opaco dependiendo de la rugosidad de su superficie . [d] Los espejos de aluminio son los más reflectantes de todos los espejos metálicos para la luz ultravioleta cercana y la luz infrarroja lejana . También es uno de los más reflectantes para la luz en el espectro visible, casi a la par con la plata en este sentido, y por lo tanto los dos parecen similares. El aluminio también es bueno para reflejar la radiación solar , aunque la exposición prolongada a la luz solar en el aire agrega desgaste a la superficie del metal; esto se puede prevenir si el aluminio está anodizado , lo que agrega una capa protectora de óxido en la superficie.
La densidad del aluminio es de 2,70 g/cm 3 , aproximadamente 1/3 de la del acero, mucho menor que la de otros metales que se encuentran comúnmente, lo que hace que las piezas de aluminio sean fácilmente identificables por su ligereza. [26] La baja densidad del aluminio en comparación con la mayoría de los otros metales surge del hecho de que sus núcleos son mucho más ligeros, mientras que la diferencia en el tamaño de la celda unitaria no compensa esta diferencia. Los únicos metales más ligeros son los metales de los grupos 1 y 2 , que, aparte del berilio y el magnesio , son demasiado reactivos para el uso estructural (y el berilio es muy tóxico). [27] El aluminio no es tan fuerte ni rígido como el acero, pero la baja densidad lo compensa en la industria aeroespacial y en muchas otras aplicaciones donde el peso ligero y la resistencia relativamente alta son cruciales. [28]
El aluminio puro es bastante blando y carece de resistencia. En la mayoría de las aplicaciones se utilizan en su lugar diversas aleaciones de aluminio debido a su mayor resistencia y dureza. [29] El límite elástico del aluminio puro es de 7 a 11 MPa , mientras que las aleaciones de aluminio tienen límites elásticos que van de 200 MPa a 600 MPa. [30] El aluminio es dúctil , con un porcentaje de elongación del 50-70%, [31] y maleable , lo que permite que se pueda estirar y extruir fácilmente . [32] También se mecaniza y se funde fácilmente . [32]
El aluminio es un excelente conductor térmico y eléctrico , con alrededor del 60% de la conductividad del cobre , tanto térmica como eléctrica, mientras que tiene solo el 30% de la densidad del cobre. [33] El aluminio es capaz de superconductividad , con una temperatura crítica superconductora de 1,2 kelvin y un campo magnético crítico de aproximadamente 100 gauss (10 militeslas ). [34] Es paramagnético y, por lo tanto, esencialmente no se ve afectado por los campos magnéticos estáticos. [35] Sin embargo, la alta conductividad eléctrica significa que se ve fuertemente afectado por los campos magnéticos alternos a través de la inducción de corrientes de Foucault . [36]
Química
El aluminio combina características de los metales pre y post-transición. Dado que tiene pocos electrones disponibles para la unión metálica, al igual que sus congéneres más pesados del grupo 13 , tiene las propiedades físicas características de un metal post-transición, con distancias interatómicas más largas de lo esperado. [23] Además, como Al 3+ es un catión pequeño y altamente cargado, es fuertemente polarizante y la unión en compuestos de aluminio tiende hacia la covalencia ; [37] este comportamiento es similar al del berilio (Be 2+ ), y los dos muestran un ejemplo de una relación diagonal . [38]
El núcleo subyacente bajo la capa de valencia del aluminio es el del gas noble precedente , mientras que los de sus congéneres más pesados galio , indio , talio y nihonio también incluyen una subcapa d llena y en algunos casos una subcapa f llena. Por lo tanto, los electrones internos del aluminio protegen a los electrones de valencia casi por completo, a diferencia de los de los congéneres más pesados del aluminio. Como tal, el aluminio es el metal más electropositivo de su grupo, y su hidróxido es de hecho más básico que el del galio. [37] [e] El aluminio también tiene similitudes menores con el metaloide boro en el mismo grupo: los compuestos AlX 3 son isoelectrónicos en valencia a los compuestos BX 3 (tienen la misma estructura electrónica de valencia), y ambos se comportan como ácidos de Lewis y forman aductos fácilmente . [39] Además, uno de los principales motivos de la química del boro son las estructuras icosaédricas regulares , y el aluminio forma una parte importante de muchas aleaciones de cuasicristales icosaédricos , incluida la clase Al–Zn–Mg. [40]
El aluminio tiene una alta afinidad química con el oxígeno, lo que lo hace adecuado para su uso como agente reductor en la reacción de la termita . Un polvo fino de aluminio reacciona de forma explosiva al entrar en contacto con el oxígeno líquido ; sin embargo, en condiciones normales, el aluminio forma una fina capa de óxido (~5 nm a temperatura ambiente) [41] que protege al metal de una mayor corrosión por oxígeno, agua o ácido diluido, un proceso denominado pasivación . [37] [42] Debido a su resistencia general a la corrosión, el aluminio es uno de los pocos metales que conserva la reflectancia plateada en forma de polvo fino, lo que lo convierte en un componente importante de las pinturas de color plata . [43] El aluminio no es atacado por ácidos oxidantes debido a su pasivación. Esto permite que el aluminio se utilice para almacenar reactivos como ácido nítrico , ácido sulfúrico concentrado y algunos ácidos orgánicos. [44]
En ácido clorhídrico concentrado caliente , el aluminio reacciona con agua con desprendimiento de hidrógeno, y en hidróxido de sodio acuoso o hidróxido de potasio a temperatura ambiente para formar aluminatos ; la pasivación protectora en estas condiciones es insignificante. [45] El agua regia también disuelve el aluminio. [44] El aluminio se corroe por cloruros disueltos , como el cloruro de sodio común , por lo que la plomería doméstica nunca se fabrica con aluminio. [45] La capa de óxido en el aluminio también se destruye por el contacto con mercurio debido a la amalgamación o con sales de algunos metales electropositivos. [37] Como tal, las aleaciones de aluminio más fuertes son menos resistentes a la corrosión debido a las reacciones galvánicas con el cobre aleado , [30] y la resistencia a la corrosión del aluminio se reduce en gran medida por las sales acuosas, particularmente en presencia de metales diferentes. [23]
El aluminio reacciona con la mayoría de los no metales al calentarse, formando compuestos como el nitruro de aluminio (AlN), el sulfuro de aluminio ( Al2S3 ) y los haluros de aluminio (AlX3 ) . También forma una amplia gama de compuestos intermetálicos que involucran metales de todos los grupos de la tabla periódica. [37]
Compuestos inorgánicos
La gran mayoría de los compuestos, incluidos todos los minerales que contienen aluminio y todos los compuestos de aluminio comercialmente importantes, presentan aluminio en el estado de oxidación 3+. El número de coordinación de dichos compuestos varía, pero generalmente el Al 3+ tiene una coordinación hexadecimal o cuadridimensional. Casi todos los compuestos de aluminio (III) son incoloros. [37]
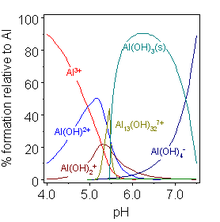
En solución acuosa, Al 3+ existe como el catión hexaaqua [Al(H 2 O) 6 ] 3+ , que tiene una K a aproximada de 10 −5 . [14] Dichas soluciones son ácidas ya que este catión puede actuar como un donante de protones e hidrolizarse progresivamente hasta que se forma un precipitado de hidróxido de aluminio , Al(OH) 3 . Esto es útil para la clarificación del agua, ya que el precipitado se nuclea en partículas suspendidas en el agua, eliminándolas así. Aumentar aún más el pH hace que el hidróxido se disuelva nuevamente como aluminato , [Al(H 2 O) 2 (OH) 4 ] − .
El hidróxido de aluminio forma sales y aluminatos y se disuelve en ácidos y álcalis, así como en la fusión con óxidos ácidos y básicos. [37] Este comportamiento de Al(OH) 3 se denomina anfoterismo y es característico de los cationes débilmente básicos que forman hidróxidos insolubles y cuyas especies hidratadas también pueden donar sus protones. Un efecto de esto es que las sales de aluminio con ácidos débiles se hidrolizan en agua al hidróxido acuoso y al hidruro no metálico correspondiente: por ejemplo, el sulfuro de aluminio produce sulfuro de hidrógeno . Sin embargo, algunas sales como el carbonato de aluminio existen en solución acuosa pero son inestables como tales; y solo tiene lugar una hidrólisis incompleta para las sales con ácidos fuertes, como los haluros, el nitrato y el sulfato . Por razones similares, las sales de aluminio anhidro no se pueden formar calentando sus "hidratos": el cloruro de aluminio hidratado no es, de hecho, AlCl 3 ·6H 2 O sino [Al(H 2 O) 6 ]Cl 3 , y los enlaces Al–O son tan fuertes que el calentamiento no es suficiente para romperlos y formar en su lugar enlaces Al–Cl: [37]
- 2 [Al(H2O ) 6 ] Cl3 calor→ Al2O3 + 6HCl + 9H2O
Los cuatro trihaluros son bien conocidos. A diferencia de las estructuras de los tres trihaluros más pesados, el fluoruro de aluminio (AlF 3 ) presenta aluminio de seis coordenadas, lo que explica su involatilidad e insolubilidad, así como su alto calor de formación . Cada átomo de aluminio está rodeado por seis átomos de flúor en una disposición octaédrica distorsionada , y cada átomo de flúor se comparte entre las esquinas de dos octaedros. Tales unidades {AlF 6 } también existen en fluoruros complejos como la criolita , Na 3 AlF 6 . [f] El AlF 3 se funde a 1290 °C (2354 °F) y se forma por reacción de óxido de aluminio con gas fluoruro de hidrógeno a 700 °C (1300 °F). [47]
Con haluros más pesados, los números de coordinación son más bajos. Los otros trihaluros son diméricos o poliméricos con centros de aluminio tetraédricos de cuatro coordenadas. [g] El tricloruro de aluminio (AlCl 3 ) tiene una estructura polimérica en capas por debajo de su punto de fusión de 192,4 °C (378 °F) pero se transforma al fundirse en dímeros de Al 2 Cl 6 . A temperaturas más altas, estos se disocian cada vez más en monómeros trigonales planares de AlCl 3 similares a la estructura del BCl 3 . El tribromuro de aluminio y el triyoduro de aluminio forman dímeros de Al 2 X 6 en las tres fases y, por lo tanto, no muestran cambios tan significativos de propiedades al cambiar de fase. [47] Estos materiales se preparan tratando el aluminio con el halógeno. Los trihaluros de aluminio forman muchos compuestos de adición o complejos; su naturaleza ácida de Lewis los hace útiles como catalizadores para las reacciones de Friedel-Crafts . El tricloruro de aluminio tiene importantes usos industriales que implican esta reacción, como en la fabricación de antraquinonas y estireno ; también se utiliza a menudo como precursor de muchos otros compuestos de aluminio y como reactivo para convertir fluoruros no metálicos en los cloruros correspondientes (una reacción de transhalogenación ). [47]
El aluminio forma un óxido estable con la fórmula química Al2O3 , comúnmente llamado alúmina . [48] Se puede encontrar en la naturaleza en el mineral corindón , α-alúmina; [49] también hay una fase γ-alúmina. [ 14] Su forma cristalina, el corindón, es muy dura ( dureza Mohs 9), tiene un alto punto de fusión de 2045 °C (3713 °F), tiene muy baja volatilidad, es químicamente inerte y un buen aislante eléctrico, a menudo se utiliza en abrasivos (como la pasta de dientes), como material refractario y en cerámica , además de ser el material de partida para la producción electrolítica de aluminio. El zafiro y el rubí son corindón impuro contaminado con trazas de otros metales. [14] Los dos principales óxidos-hidróxidos, AlO(OH), son la boehmita y la diáspora . Existen tres trihidróxidos principales: bayerita , gibbsita y nordstrandita, que difieren en su estructura cristalina ( polimorfos ). También se conocen muchas otras estructuras intermedias y relacionadas. [14] La mayoría se producen a partir de minerales mediante una variedad de procesos húmedos que utilizan ácido y base. El calentamiento de los hidróxidos conduce a la formación de corindón. Estos materiales son de importancia central para la producción de aluminio y son en sí mismos extremadamente útiles. Algunas fases de óxido mixto también son muy útiles, como la espinela (MgAl 2 O 4 ), la Na-β-alúmina (NaAl 11 O 17 ) y el aluminato tricálcico (Ca 3 Al 2 O 6 , una fase mineral importante en el cemento Portland ). [14]
Los únicos calcogenuros estables en condiciones normales son el sulfuro de aluminio (Al 2 S 3 ), el seleniuro (Al 2 Se 3 ) y el telururo (Al 2 Te 3 ). Los tres se preparan por reacción directa de sus elementos a unos 1.000 °C (1.800 °F) y se hidrolizan rápidamente por completo en agua para producir hidróxido de aluminio y el respectivo calcogenuro de hidrógeno . Como el aluminio es un átomo pequeño en relación con estos calcógenos, estos tienen aluminio tetraédrico de cuatro coordenadas con varios polimorfos que tienen estructuras relacionadas con la wurtzita , con dos tercios de los posibles sitios metálicos ocupados de manera ordenada (α) o aleatoria (β); el sulfuro también tiene una forma γ relacionada con la γ-alúmina, y una forma hexagonal inusual de alta temperatura donde la mitad de los átomos de aluminio tienen cuatro coordinaciones tetraédricas y la otra mitad tiene cinco coordinaciones bipiramidales trigonales. [50]
Se conocen cuatro pnictidos : nitruro de aluminio (AlN), fosfuro de aluminio (AlP), arseniuro de aluminio (AlAs) y antimoniuro de aluminio (AlSb). Todos ellos son semiconductores III-V isoelectrónicos al silicio y al germanio , todos los cuales, excepto el AlN, tienen la estructura de blenda de cinc . Los cuatro pueden fabricarse mediante reacción directa a alta temperatura (y posiblemente a alta presión) de sus elementos componentes. [50]
El aluminio se alea bien con la mayoría de los demás metales (con excepción de la mayoría de los metales alcalinos y los metales del grupo 13) y se conocen más de 150 intermetálicos con otros metales. La preparación implica calentar juntos los metales fijos en cierta proporción, seguido de un enfriamiento y recocido graduales . La unión en ellos es predominantemente metálica y la estructura cristalina depende principalmente de la eficiencia del empaquetamiento. [51]
Existen pocos compuestos con estados de oxidación más bajos. Existen algunos compuestos de aluminio(I) : AlF, AlCl, AlBr y AlI existen en la fase gaseosa cuando el trihaluro respectivo se calienta con aluminio y a temperaturas criogénicas. [47] Un derivado estable del monoyoduro de aluminio es el aducto cíclico formado con trietilamina , Al 4 I 4 (NEt 3 ) 4 . También existen Al 2 O y Al 2 S, pero son muy inestables. [52] Se invocan u observan compuestos de aluminio(II) muy simples en las reacciones del metal Al con oxidantes. Por ejemplo, se ha detectado monóxido de aluminio , AlO, en la fase gaseosa después de una explosión [53] y en espectros de absorción estelar. [54] Se han investigado más a fondo los compuestos de la fórmula R 4 Al 2 que contienen un enlace Al–Al y donde R es un ligando orgánico grande . [55]
Compuestos de organoaluminio e hidruros relacionados
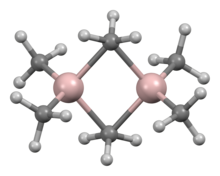
Existe una variedad de compuestos de fórmula empírica AlR 3 y AlR 1,5 Cl 1,5 . [56] Los trialquilos y triarilos de aluminio son líquidos reactivos, volátiles e incoloros o sólidos de bajo punto de fusión. Se incendian espontáneamente en el aire y reaccionan con el agua, por lo que es necesario tomar precauciones al manipularlos. A menudo forman dímeros, a diferencia de sus análogos de boro, pero esta tendencia disminuye para los alquilos de cadena ramificada (por ejemplo, Pr i , Bu i , Me 3 CCH 2 ); por ejemplo, el triisobutilaluminio existe como una mezcla de equilibrio del monómero y el dímero. [57] [58] Estos dímeros, como el trimetilaluminio (Al 2 Me 6 ), generalmente presentan centros tetraédricos de Al formados por dimerización con algún grupo alquilo que forma un puente entre ambos átomos de aluminio. Son ácidos duros y reaccionan fácilmente con ligandos, formando aductos. En la industria, se utilizan principalmente en reacciones de inserción de alquenos, como descubrió Karl Ziegler , sobre todo en "reacciones de crecimiento" que forman alquenos y alcoholes primarios no ramificados de cadena larga, y en la polimerización a baja presión de eteno y propeno . También hay algunos compuestos organoaluminios heterocíclicos y en racimo que implican enlaces Al–N. [57]
El hidruro de aluminio más importante a nivel industrial es el hidruro de litio y aluminio (LiAlH 4 ), que se utiliza como agente reductor en química orgánica . Puede producirse a partir de hidruro de litio y tricloruro de aluminio . [59] El hidruro más simple, el hidruro de aluminio o alano, no es tan importante. Es un polímero con la fórmula (AlH 3 ) n , en contraste con el hidruro de boro correspondiente que es un dímero con la fórmula (BH 3 ) 2 . [59]
Ocurrencia natural
Espacio
La abundancia de aluminio por partícula en el Sistema Solar es de 3,15 ppm (partes por millón). [60] [h] Es el duodécimo más abundante de todos los elementos y el tercero más abundante entre los elementos que tienen números atómicos impares, después del hidrógeno y el nitrógeno. [60] El único isótopo estable del aluminio, 27Al , es el decimoctavo núcleo más abundante en el universo. Se crea casi en su totalidad después de la fusión de carbono en estrellas masivas que luego se convertirán en supernovas de tipo II : esta fusión crea 26Mg , que al capturar protones y neutrones libres, se convierte en aluminio. Algunas cantidades más pequeñas de 27Al se crean en capas de combustión de hidrógeno de estrellas evolucionadas, donde 26Mg puede capturar protones libres. [61] Esencialmente todo el aluminio que existe ahora es 27Al . El 26 Al estaba presente en el Sistema Solar primitivo con una abundancia del 0,005 % en relación con el 27 Al, pero su vida media de 728 000 años es demasiado corta para que sobreviva cualquier núcleo original; por lo tanto, el 26 Al está extinto . [61] A diferencia del 27 Al, la combustión del hidrógeno es la fuente principal de 26 Al, y el nucleido surge después de que un núcleo de 25 Mg atrapa un protón libre. Sin embargo, las trazas de 26 Al que existen son el emisor de rayos gamma más común en el gas interestelar ; [61] si el 26 Al original todavía estuviera presente, los mapas de rayos gamma de la Vía Láctea serían más brillantes. [61]
Tierra

En general, la Tierra contiene aproximadamente un 1,59 % de aluminio en masa (el séptimo en abundancia por masa). [62] El aluminio se encuentra en mayor proporción en la corteza terrestre que en el universo en general. Esto se debe a que el aluminio forma fácilmente el óxido y se une a las rocas y permanece en la corteza terrestre , mientras que los metales menos reactivos se hunden hasta el núcleo. [61] En la corteza terrestre, el aluminio es el elemento metálico más abundante (8,23 % en masa [31] ) y el tercero más abundante de todos los elementos (después del oxígeno y el silicio). [63] Una gran cantidad de silicatos en la corteza terrestre contienen aluminio. [64] En contraste, el manto terrestre contiene solo un 2,38 % de aluminio en masa. [65] El aluminio también se encuentra en el agua de mar en una concentración de 2 μg/kg. [31]
Debido a su fuerte afinidad por el oxígeno, el aluminio casi nunca se encuentra en estado elemental; en cambio, se encuentra en óxidos o silicatos. Los feldespatos , el grupo más común de minerales en la corteza terrestre, son aluminosilicatos. El aluminio también se encuentra en los minerales berilo, criolita, granate, espinela y turquesa. [66] Las impurezas en Al2O3 , como el cromo y el hierro , producen las piedras preciosas rubí y zafiro , respectivamente . [ 67 ] El metal de aluminio nativo es extremadamente raro y solo se puede encontrar como una fase menor en entornos de baja fugacidad de oxígeno , como el interior de ciertos volcanes. [68] Se ha informado de aluminio nativo en filtraciones frías en la pendiente continental nororiental del mar de China Meridional . Es posible que estos depósitos sean el resultado de la reducción bacteriana del tetrahidroxoaluminato Al(OH) 4− . [69]
Aunque el aluminio es un elemento común y extendido, no todos los minerales de aluminio son fuentes económicamente viables de este metal. Casi todo el aluminio metálico se produce a partir del mineral de bauxita (AlO x (OH) 3–2 x ). La bauxita se produce como un producto de la erosión de lechos rocosos con bajo contenido de hierro y sílice en condiciones climáticas tropicales. [70] En 2017, la mayor parte de la bauxita se extrajo en Australia, China, Guinea e India. [71]
Historia

La historia del aluminio ha estado marcada por el uso del alumbre . El primer registro escrito del alumbre, realizado por el historiador griego Heródoto , se remonta al siglo V a. C. [72] Se sabe que los antiguos utilizaban el alumbre como mordiente para teñir y para la defensa de las ciudades. [72] Después de las Cruzadas , el alumbre, un producto indispensable en la industria textil europea, [73] fue objeto de comercio internacional; [74] se importó a Europa desde el Mediterráneo oriental hasta mediados del siglo XV. [75]
La naturaleza del alumbre seguía siendo desconocida. Alrededor de 1530, el médico suizo Paracelso sugirió que el alumbre era una sal de una tierra de alumbre. [76] En 1595, el médico y químico alemán Andreas Libavius confirmó esto experimentalmente. [77] En 1722, el químico alemán Friedrich Hoffmann anunció su creencia de que la base del alumbre era una tierra distinta. [78] En 1754, el químico alemán Andreas Sigismund Marggraf sintetizó alúmina hirviendo arcilla en ácido sulfúrico y luego agregando potasa . [78]
Los intentos de producir aluminio se remontan a 1760. [79] Sin embargo, el primer intento exitoso lo completó en 1824 el físico y químico danés Hans Christian Ørsted . Hizo reaccionar cloruro de aluminio anhidro con amalgama de potasio , produciendo un trozo de metal que parecía similar al estaño. [80] [81] [82] Presentó sus resultados y mostró una muestra del nuevo metal en 1825. [83] [84] En 1827, el químico alemán Friedrich Wöhler repitió los experimentos de Ørsted pero no identificó ningún aluminio. [85] (La razón de esta inconsistencia solo se descubrió en 1921). [86] Realizó un experimento similar en el mismo año mezclando cloruro de aluminio anhidro con potasio y produjo un polvo de aluminio. [82] En 1845, pudo producir pequeños trozos del metal y describió algunas propiedades físicas de este metal. [86] Durante muchos años después, a Wöhler se le atribuyó el descubrimiento del aluminio. [87]

Como el método de Wöhler no podía producir grandes cantidades de aluminio, el metal siguió siendo raro; su costo excedía al del oro. [85] La primera producción industrial de aluminio fue establecida en 1856 por el químico francés Henri Etienne Sainte-Claire Deville y compañeros. [88] Deville había descubierto que el tricloruro de aluminio podía reducirse con sodio, que era más conveniente y menos costoso que el potasio, que Wöhler había utilizado. [89] Incluso entonces, el aluminio todavía no era de gran pureza y el aluminio producido difería en propiedades según la muestra. [90] Debido a su capacidad de conducción de electricidad, el aluminio se utilizó como tapa del Monumento a Washington , terminado en 1885. El edificio más alto del mundo en ese momento, la tapa de metal no corrosivo estaba destinada a servir como pico de pararrayos .
El primer método de producción industrial a gran escala fue desarrollado independientemente en 1886 por el ingeniero francés Paul Héroult y el ingeniero estadounidense Charles Martin Hall ; ahora se conoce como el proceso Hall-Héroult . [91] El proceso Hall-Héroult convierte la alúmina en metal. El químico austríaco Carl Joseph Bayer descubrió una forma de purificar la bauxita para producir alúmina, ahora conocida como el proceso Bayer , en 1889. [92] La producción moderna de aluminio se basa en los procesos Bayer y Hall-Héroult. [93]
A medida que la producción a gran escala hizo que los precios del aluminio cayeran, el metal se volvió ampliamente utilizado en joyería, marcos de anteojos, instrumentos ópticos, vajillas y papel de aluminio , y otros artículos de uso diario en la década de 1890 y principios del siglo XX. La capacidad del aluminio para formar aleaciones duras pero ligeras con otros metales proporcionó al metal muchos usos en ese momento. [94] Durante la Primera Guerra Mundial , los principales gobiernos exigieron grandes envíos de aluminio para fuselajes ligeros y resistentes; [95] durante la Segunda Guerra Mundial , la demanda de los principales gobiernos para la aviación fue aún mayor. [96] [97] [98]
A mediados del siglo XX, el aluminio se había convertido en parte de la vida cotidiana y un componente esencial de los artículos para el hogar. [99] En 1954, la producción de aluminio superó a la de cobre , [i] históricamente segundo en producción solo después del hierro, [102] lo que lo convierte en el metal no ferroso más producido . A mediados del siglo XX, el aluminio surgió como un material de ingeniería civil, con aplicaciones de construcción tanto en la construcción básica como en el trabajo de acabado interior, [103] y se utiliza cada vez más en ingeniería militar, tanto para aviones como para motores de vehículos blindados terrestres. [104] El primer satélite artificial de la Tierra , lanzado en 1957, consistía en dos semiesferas de aluminio separadas unidas y todos los vehículos espaciales posteriores han utilizado aluminio en cierta medida. [93] La lata de aluminio se inventó en 1956 y se empleó como almacenamiento de bebidas en 1958. [105]
A lo largo del siglo XX, la producción de aluminio aumentó rápidamente: mientras que la producción mundial de aluminio en 1900 era de 6.800 toneladas métricas, la producción anual superó por primera vez las 100.000 toneladas métricas en 1916; 1.000.000 de toneladas en 1941; 10.000.000 de toneladas en 1971. [100] En la década de 1970, la mayor demanda de aluminio lo convirtió en un producto de intercambio; entró en la Bolsa de Metales de Londres , la bolsa de metales industriales más antigua del mundo, en 1978. [93] La producción siguió creciendo: la producción anual de aluminio superó los 50.000.000 de toneladas métricas en 2013. [100]
El precio real del aluminio disminuyó de 14.000 dólares por tonelada métrica en 1900 a 2.340 dólares en 1948 (en dólares estadounidenses de 1998). [100] Los costos de extracción y procesamiento se redujeron con el progreso tecnológico y la escala de las economías. Sin embargo, la necesidad de explotar depósitos de menor calidad y el uso de costos de insumos en rápido aumento (sobre todo, energía) aumentaron el costo neto del aluminio; [106] el precio real comenzó a crecer en la década de 1970 con el aumento del costo de la energía. [107] La producción se trasladó de los países industrializados a países donde la producción era más barata. [108] Los costos de producción a fines del siglo XX cambiaron debido a los avances en la tecnología, los precios más bajos de la energía, los tipos de cambio del dólar estadounidense y los precios de la alúmina. [109] La participación combinada de los países BRIC en la producción primaria y el consumo primario creció sustancialmente en la primera década del siglo XXI. [110] China está acumulando una parte especialmente grande de la producción mundial gracias a una abundancia de recursos, energía barata y estímulos gubernamentales; [111] también aumentó su participación en el consumo del 2% en 1972 al 40% en 2010. [112] En Estados Unidos, Europa occidental y Japón, la mayor parte del aluminio se consumió en transporte, ingeniería, construcción y embalaje. [113] En 2021, los precios de los metales industriales como el aluminio se han disparado a niveles casi récord a medida que la escasez de energía en China aumenta los costos de la electricidad. [114]
Etimología
Los nombres aluminio y aluminio se derivan de la palabra alúmina , un término obsoleto para la alúmina , [j] el principal óxido natural de aluminio . [116] Alúmina se tomó prestado del francés, que a su vez lo derivó de alumen , el nombre latino clásico para el alumbre , el mineral del que se obtenía. [117] La palabra latina alumen proviene de la raíz protoindoeuropea *alu- que significa "amargo" o "cerveza". [118]

Orígenes
El químico británico Humphry Davy , que realizó una serie de experimentos destinados a aislar el metal, es reconocido como la persona que nombró al elemento. El primer nombre propuesto para el metal que se aislaría del alumbre fue alumium , que Davy sugirió en un artículo de 1808 sobre su investigación electroquímica, publicado en Philosophical Transactions of the Royal Society . [119] Parecía que el nombre se creó a partir de la palabra inglesa alum y el sufijo latino -ium ; pero era costumbre entonces dar a los elementos nombres originados en latín, por lo que este nombre no fue adoptado universalmente. Este nombre fue criticado por químicos contemporáneos de Francia, Alemania y Suecia, que insistieron en que el metal debería llamarse por el óxido, alúmina, del que se aislaría. [120] El nombre inglés alum no proviene directamente del latín, mientras que alumine / alumina obviamente proviene de la palabra latina alumen (al declinar , alumen cambia a alumin- ).
Un ejemplo fue Essai sur la Nomenclature chimique (julio de 1811), escrito en francés por un químico sueco, Jöns Jacob Berzelius , en el que se da el nombre de aluminio al elemento que se sintetizaría a partir del alumbre. [121] [k] (Otro artículo en el mismo número de la revista también se refiere al metal cuyo óxido es la base del zafiro , es decir, el mismo metal, que al aluminio ). [123] Un resumen de enero de 1811 de una de las conferencias de Davy en la Royal Society mencionó el nombre aluminio como una posibilidad. [124] Al año siguiente, Davy publicó un libro de texto de química en el que utilizó la ortografía aluminio . [125] Ambas grafías han coexistido desde entonces. Su uso es actualmente regional: el aluminio domina en los Estados Unidos y Canadá; el aluminio prevalece en el resto del mundo angloparlante. [126]
Ortografía
En 1812, el científico británico Thomas Young [127] escribió una reseña anónima del libro de Davy, en la que propuso el nombre aluminio en lugar de aluminio , que pensaba que tenía un "sonido menos clásico". [128] Este nombre persistió: aunque la ortografía -um se usó ocasionalmente en Gran Bretaña, el lenguaje científico estadounidense usó -ium desde el principio. [129] La mayoría de los científicos de todo el mundo usaron -ium en el siglo XIX; [126] y se afianzó en varios otros idiomas europeos, como el francés , el alemán y el holandés . [l] En 1828, un lexicógrafo estadounidense, Noah Webster , introdujo solo la ortografía aluminio en su American Dictionary of the English Language . [130] En la década de 1830, la ortografía -um ganó uso en los Estados Unidos; en la década de 1860, se había convertido en la ortografía más común allí fuera de la ciencia. [129] En 1892, Hall utilizó la ortografía -um en su folleto publicitario para su nuevo método electrolítico de producción del metal, a pesar de su uso constante de la ortografía -ium en todas las patentes que presentó entre 1886 y 1903. Se desconoce si esta ortografía se introdujo por error o intencionalmente, pero Hall prefirió el aluminio desde su introducción porque se parecía al platino , el nombre de un metal prestigioso. [131] Para 1890, ambas ortografías habían sido comunes en los Estados Unidos, siendo la ortografía -ium ligeramente más común; para 1895, la situación se había revertido; para 1900, el aluminio se había vuelto dos veces más común que el aluminio ; en la década siguiente, la ortografía -um dominó el uso estadounidense. En 1925, la Sociedad Química Estadounidense adoptó esta ortografía. [126]
La Unión Internacional de Química Pura y Aplicada (IUPAC) adoptó el aluminio como el nombre internacional estándar para el elemento en 1990. [132] En 1993, reconocieron al aluminio como una variante aceptable; [132] la edición más reciente de 2005 de la nomenclatura de química inorgánica de la IUPAC también reconoce esta ortografía. [133] Las publicaciones oficiales de la IUPAC utilizan la ortografía -ium como principal, y enumeran ambas cuando es apropiado. [m]
Producción y refinamiento
| País | Producción (miles de toneladas) |
|---|---|
 Porcelana Porcelana | 36.000 |
 India India | 3.700 |
 Rusia Rusia | 3.600 |
 Canadá Canadá | 2.900 |
 Emiratos Árabes Unidos Emiratos Árabes Unidos | 2.700 |
 Australia Australia | 1.600 |
 Bahréin Bahréin | 1.400 |
 Noruega Noruega | 1.300 |
 Estados Unidos Estados Unidos | 1.100 |
 Islandia Islandia | 850 |
| Otros países | 9.200 |
| Total | 64.000 |
La producción de aluminio comienza con la extracción de la roca de bauxita del suelo. La bauxita se procesa y se transforma mediante el proceso Bayer en alúmina , que luego se procesa mediante el proceso Hall-Héroult , dando como resultado el aluminio final.
La producción de aluminio consume mucha energía, por lo que los productores tienden a ubicar fundiciones en lugares donde la energía eléctrica es abundante y barata. [136] La producción de un kilogramo de aluminio requiere 7 kilogramos de equivalente de energía del petróleo, en comparación con 1,5 kilogramos para el acero y 2 kilogramos para el plástico. [137] En 2019, las fundiciones de aluminio más grandes del mundo se encuentran en China, India, Rusia, Canadá y los Emiratos Árabes Unidos, [135] mientras que China es, con diferencia, el principal productor de aluminio, con una cuota mundial del 55%.
Según el informe Metal Stocks in Society del Panel Internacional de Recursos , el stock mundial per cápita de aluminio en uso en la sociedad (es decir, en automóviles, edificios, productos electrónicos, etc.) es de 80 kg (180 lb). Gran parte de este stock se encuentra en los países más desarrollados (350–500 kg (770–1.100 lb) per cápita) en lugar de en los países menos desarrollados (35 kg (77 lb) per cápita). [138]
Proceso Bayer
La bauxita se convierte en alúmina mediante el proceso Bayer. La bauxita se mezcla para obtener una composición uniforme y luego se muele. La suspensión resultante se mezcla con una solución caliente de hidróxido de sodio ; luego, la mezcla se trata en un recipiente digestor a una presión muy superior a la atmosférica, disolviendo el hidróxido de aluminio en la bauxita mientras se convierten las impurezas en compuestos relativamente insolubles: [139]
Después de esta reacción, la suspensión se encuentra a una temperatura superior a su punto de ebullición atmosférico. Se enfría eliminando el vapor a medida que se reduce la presión. El residuo de bauxita se separa de la solución y se descarta. La solución, libre de sólidos, se siembra con pequeños cristales de hidróxido de aluminio; esto provoca la descomposición de los iones [Al(OH) 4 ] − en hidróxido de aluminio. Después de que aproximadamente la mitad del aluminio haya precipitado, la mezcla se envía a clasificadores. Los pequeños cristales de hidróxido de aluminio se recogen para que sirvan como agentes de siembra; las partículas gruesas se convierten en alúmina mediante calentamiento; el exceso de solución se elimina por evaporación, (si es necesario) se purifica y se recicla. [139]
Proceso Hall-Héroult

La conversión de alúmina en aluminio se logra mediante el proceso Hall-Héroult . En este proceso de alto consumo de energía, una solución de alúmina en una mezcla fundida (950 y 980 °C (1740 y 1800 °F)) de criolita ( Na3AlF6 ) con fluoruro de calcio se electroliza para producir aluminio metálico. El aluminio líquido se hunde hasta el fondo de la solución y se extrae, y generalmente se moldea en grandes bloques llamados tochos de aluminio para su posterior procesamiento. [44]
Los ánodos de la celda de electrólisis están hechos de carbono (el material más resistente a la corrosión por fluoruro) y se hornean en el proceso o se hornean previamente. Los primeros, también llamados ánodos Söderberg, son menos eficientes energéticamente y los humos liberados durante la cocción son costosos de recolectar, por lo que se están reemplazando por ánodos precocidos, aunque ahorran la energía, la mano de obra y la potencia que supone precocer los cátodos. El carbono para los ánodos debe ser preferiblemente puro para que ni el aluminio ni el electrolito se contaminen con cenizas. A pesar de la resistividad del carbono a la corrosión, se sigue consumiendo a un ritmo de 0,4 a 0,5 kg por cada kilogramo de aluminio producido. Los cátodos están hechos de antracita ; no se requiere una alta pureza para ellos porque las impurezas se filtran muy lentamente. El cátodo se consume a un ritmo de 0,02 a 0,04 kg por cada kilogramo de aluminio producido. Una celda suele terminarse después de 2 a 6 años tras una falla del cátodo. [44]
El proceso Hall-Heroult produce aluminio con una pureza superior al 99 %. Se puede realizar una mayor purificación mediante el proceso Hoopes . Este proceso implica la electrólisis del aluminio fundido con un electrolito de sodio, bario y fluoruro de aluminio. El aluminio resultante tiene una pureza del 99,99 %. [44] [140]
La energía eléctrica representa entre el 20 y el 40% del costo de producción de aluminio, dependiendo de la ubicación de la fundición. La producción de aluminio consume aproximadamente el 5% de la electricidad generada en los Estados Unidos. [132] Debido a esto, se han investigado alternativas al proceso Hall-Héroult, pero ninguna ha resultado económicamente viable. [44]
Reciclaje

La recuperación del metal a través del reciclaje se ha convertido en una tarea importante de la industria del aluminio. El reciclaje era una actividad de bajo perfil hasta finales de la década de 1960, cuando el uso creciente de latas de aluminio para bebidas lo hizo conocido por el público. [141] El reciclaje implica la fusión de la chatarra, un proceso que requiere solo el 5% de la energía utilizada para producir aluminio a partir del mineral, aunque una parte significativa (hasta el 15% del material de entrada) se pierde en forma de escoria (óxido similar a la ceniza). [142] Una fundición de aluminio produce significativamente menos escoria, con valores informados por debajo del 1%. [143]
La escoria blanca de la producción primaria de aluminio y de las operaciones de reciclado secundario todavía contiene cantidades útiles de aluminio que se pueden extraer industrialmente . El proceso produce tochos de aluminio, junto con un material de desecho altamente complejo. Este desecho es difícil de manejar. Reacciona con el agua, liberando una mezcla de gases (incluidos, entre otros, hidrógeno , acetileno y amoníaco ), que se enciende espontáneamente al contacto con el aire; [144] el contacto con el aire húmedo da como resultado la liberación de grandes cantidades de gas amoníaco. A pesar de estas dificultades, el desecho se utiliza como relleno en asfalto y hormigón . [145]
Aplicaciones

Metal
La producción mundial de aluminio en 2016 fue de 58,8 millones de toneladas métricas, cifra superior a la de cualquier otro metal, excepto el hierro (1.231 millones de toneladas métricas). [146] [147]
El aluminio casi siempre se alea, lo que mejora notablemente sus propiedades mecánicas, especialmente cuando se templa . Por ejemplo, las láminas de aluminio comunes y las latas de bebidas son aleaciones de 92% a 99% de aluminio. [148] Los principales agentes de aleación son cobre , zinc , magnesio , manganeso y silicio (por ejemplo, duraluminio ) con los niveles de otros metales en un pequeño porcentaje en peso. [149] El aluminio, tanto forjado como fundido, se ha aleado con: manganeso , silicio , magnesio , cobre y zinc , entre otros. [150]

Los principales usos del aluminio son: [151]
- Transporte ( automóviles , aviones, camiones , vagones de ferrocarril , buques, bicicletas , naves espaciales, etc. ). El aluminio se utiliza debido a su baja densidad;
- Embalajes ( latas , láminas, marcos, etc.). Se utiliza aluminio porque no es tóxico (ver más abajo), no se adsorbe y es resistente a las astillas ;
- Construcción y edificación ( ventanas , puertas , revestimientos , cables de construcción, revestimientos, techados, etc. ). Como el acero es más barato, se utiliza aluminio cuando son importantes la ligereza, la resistencia a la corrosión o las características de ingeniería;
- Usos relacionados con la electricidad (aleaciones de conductores, motores y generadores, transformadores, condensadores, etc. ). El aluminio se utiliza porque es relativamente barato, muy conductor, tiene una resistencia mecánica adecuada y una baja densidad, y resiste la corrosión;
- Una amplia gama de artículos para el hogar , desde utensilios de cocina hasta muebles . La baja densidad, el buen aspecto, la facilidad de fabricación y la durabilidad son los factores clave del uso del aluminio;
- Maquinaria y equipos (equipos de procesamiento, tuberías, herramientas). El aluminio se utiliza por su resistencia a la corrosión, su no piroforicidad y su resistencia mecánica.
Compuestos
La gran mayoría (alrededor del 90%) del óxido de aluminio se convierte en aluminio metálico. [139] Al ser un material muy duro ( dureza Mohs 9), [152] la alúmina se usa ampliamente como abrasivo; [153] al ser extraordinariamente inerte químicamente, es útil en entornos altamente reactivos como las lámparas de sodio de alta presión . [154] El óxido de aluminio se usa comúnmente como catalizador para procesos industriales; [139] por ejemplo, el proceso Claus para convertir sulfuro de hidrógeno en azufre en refinerías y para alquilar aminas . [155] [156] Muchos catalizadores industriales están soportados por alúmina, lo que significa que el costoso material catalizador se dispersa sobre una superficie de alúmina inerte. [157] Otro uso principal es como agente secante o absorbente. [139] [158]

Varios sulfatos de aluminio tienen aplicaciones industriales y comerciales. El sulfato de aluminio (en su forma hidratada) se produce a una escala anual de varios millones de toneladas métricas. [159] Aproximadamente dos tercios se consumen en el tratamiento del agua . [159] La siguiente aplicación importante es en la fabricación de papel. [159] También se utiliza como mordiente en el teñido, en el decapado de semillas, en la desodorización de aceites minerales, en el curtido del cuero y en la producción de otros compuestos de aluminio. [159] Dos tipos de alumbre, el alumbre de amonio y el alumbre de potasio , se utilizaban anteriormente como mordientes y en el curtido del cuero, pero su uso ha disminuido significativamente tras la disponibilidad de sulfato de aluminio de alta pureza. [159] El cloruro de aluminio anhidro se utiliza como catalizador en las industrias química y petroquímica, en la industria del teñido y en la síntesis de varios compuestos inorgánicos y orgánicos. [159] Los hidroxicloruros de aluminio se utilizan para purificar el agua, en la industria del papel y como antitranspirantes . [159] El aluminato de sodio se utiliza en el tratamiento de agua y como acelerador de la solidificación del cemento. [159]
Muchos compuestos de aluminio tienen aplicaciones específicas, por ejemplo:
- El acetato de aluminio en solución se utiliza como astringente . [160]
- El fosfato de aluminio se utiliza en la fabricación de productos de vidrio, cerámica, pulpa y papel, cosméticos , pinturas, barnices y en cemento dental . [161]
- El hidróxido de aluminio se utiliza como antiácido y mordiente; también se emplea en la purificación del agua , en la fabricación de vidrio y cerámica y en la impermeabilización de tejidos . [162] [163]
- El hidruro de litio y aluminio es un potente agente reductor utilizado en química orgánica . [164] [165]
- Los organoaluminios se utilizan como ácidos de Lewis y cocatalizadores. [166]
- El metilaluminoxano es un cocatalizador para la polimerización de olefinas Ziegler-Natta para producir polímeros de vinilo como el polietileno . [167]
- Los iones de aluminio acuosos (como el sulfato de aluminio acuoso) se utilizan para tratar parásitos de peces como Gyrodactylus salaris . [168]
- En muchas vacunas , ciertas sales de aluminio sirven como adyuvante inmunológico (reforzador de la respuesta inmunológica) para permitir que la proteína de la vacuna alcance suficiente potencia como estimulante inmunológico. [169] Hasta 2004, la mayoría de los adyuvantes utilizados en las vacunas tenían adyuvante de aluminio. [170]
Biología

A pesar de su amplia presencia en la corteza terrestre, el aluminio no tiene ninguna función conocida en biología. [44] A un pH de 6 a 9 (relevante para la mayoría de las aguas naturales), el aluminio precipita del agua como hidróxido y, por lo tanto, no está disponible; la mayoría de los elementos que se comportan de esta manera no tienen ningún papel biológico o son tóxicos. [172] El sulfato de aluminio tiene una LD 50 de 6207 mg/kg (oral, ratón), lo que corresponde a 435 gramos (aproximadamente una libra) para un ratón de 70 kg (150 lb).
Toxicidad
El aluminio está clasificado como no cancerígeno por el Departamento de Salud y Servicios Humanos de los Estados Unidos . [173] [n] Una revisión publicada en 1988 dijo que había poca evidencia de que la exposición normal al aluminio presente un riesgo para los adultos sanos, [176] y una revisión toxicológica de múltiples elementos de 2014 no pudo encontrar efectos nocivos del aluminio consumido en cantidades no mayores a 40 mg/día por kg de masa corporal . [173] La mayor parte del aluminio consumido saldrá del cuerpo en las heces; la mayor parte de la pequeña parte que ingresa al torrente sanguíneo se excretará a través de la orina; [177] sin embargo, algo de aluminio pasa la barrera hematoencefálica y se aloja preferentemente en los cerebros de los pacientes de Alzheimer. [178] [179] La evidencia publicada en 1989 indica que, para los pacientes de Alzheimer, el aluminio puede actuar reticulando electrostáticamente las proteínas, regulando así a la baja los genes en el giro temporal superior . [180]
Efectos
El aluminio, aunque raramente, puede causar osteomalacia resistente a la vitamina D , anemia microcítica resistente a la eritropoyetina y alteraciones del sistema nervioso central. Las personas con insuficiencia renal tienen un riesgo especial. [173] La ingestión crónica de silicatos de aluminio hidratados (para controlar el exceso de acidez gástrica) puede provocar la unión del aluminio al contenido intestinal y una mayor eliminación de otros metales, como el hierro o el zinc ; dosis suficientemente altas (>50 g/día) pueden causar anemia. [173]

Durante el incidente de contaminación del agua de Camelford de 1988, los habitantes de Camelford tuvieron el agua potable contaminada con sulfato de aluminio durante varias semanas. Un informe final sobre el incidente, publicado en 2013, concluyó que era poco probable que esto hubiera causado problemas de salud a largo plazo. [181]
Se ha sospechado que el aluminio es una posible causa de la enfermedad de Alzheimer , [182] pero las investigaciones al respecto durante más de 40 años no han encontrado, hasta 2018 [actualizar], ninguna buena evidencia de un efecto causal. [183] [184]
El aluminio aumenta la expresión de genes relacionados con el estrógeno en células de cáncer de mama humanas cultivadas en el laboratorio. [185] En dosis muy altas, el aluminio se asocia con una función alterada de la barrera hematoencefálica. [186] Un pequeño porcentaje de personas [187] tienen alergias de contacto al aluminio y experimentan erupciones rojas con picazón, dolor de cabeza, dolor muscular, dolor en las articulaciones, mala memoria, insomnio, depresión, asma, síndrome del intestino irritable u otros síntomas al entrar en contacto con productos que contienen aluminio. [188]
La exposición al aluminio en polvo o a los humos de soldadura de aluminio puede causar fibrosis pulmonar . [189] El polvo fino de aluminio puede encenderse o explotar, lo que representa otro peligro en el lugar de trabajo. [190] [191]
Vías de exposición
Los alimentos son la principal fuente de aluminio. El agua potable contiene más aluminio que los alimentos sólidos; [173] sin embargo, el aluminio presente en los alimentos puede absorberse más que el aluminio del agua. [192] Las principales fuentes de exposición oral humana al aluminio incluyen los alimentos (debido a su uso en aditivos alimentarios, envases de alimentos y bebidas y utensilios de cocina), el agua potable (debido a su uso en el tratamiento de aguas municipales) y los medicamentos que contienen aluminio (en particular, antiácidos/antiulcerosos y formulaciones de aspirina tamponada). [193] La exposición alimentaria en los europeos es de media de 0,2 a 1,5 mg/kg/semana, pero puede llegar a 2,3 mg/kg/semana. [173] Los niveles más altos de exposición al aluminio se limitan principalmente a los mineros, los trabajadores de la producción de aluminio y los pacientes de diálisis . [ 194 ]
El consumo de antiácidos , antitranspirantes, vacunas y cosméticos proporciona posibles vías de exposición. [195] El consumo de alimentos ácidos o líquidos con aluminio mejora la absorción de aluminio, [196] y se ha demostrado que el maltol aumenta la acumulación de aluminio en los tejidos nerviosos y óseos. [197]
Tratamiento
En caso de sospecha de ingesta repentina de una gran cantidad de aluminio, el único tratamiento es el mesilato de deferoxamina , que puede administrarse para ayudar a eliminar el aluminio del cuerpo mediante terapia de quelación . [198] [199] Sin embargo, esto debe aplicarse con precaución ya que reduce no solo los niveles corporales de aluminio, sino también los de otros metales como el cobre o el hierro. [198]
Efectos ambientales

En las cercanías de las minas se encuentran altos niveles de aluminio; en las centrales eléctricas de carbón o en los incineradores se liberan pequeñas cantidades de aluminio al medio ambiente . [177] El aluminio presente en el aire es arrastrado por la lluvia o normalmente se deposita, pero pequeñas partículas de aluminio permanecen en el aire durante mucho tiempo. [177]
La precipitación ácida es el principal factor natural para movilizar aluminio de fuentes naturales [173] y la principal razón de los efectos ambientales del aluminio; [200] sin embargo, el principal factor de la presencia de aluminio en la sal y el agua dulce son los procesos industriales que también liberan aluminio al aire. [173]
En el agua, el aluminio actúa como un agente tóxico en animales que respiran por branquias , como los peces , cuando el agua es ácida, en cuyo caso el aluminio puede precipitarse en las branquias, [201] lo que causa la pérdida de iones plasmáticos y hemolinfa, lo que lleva a una falla osmorreguladora . [200] Los complejos orgánicos de aluminio pueden absorberse fácilmente e interferir con el metabolismo en mamíferos y aves, aunque esto rara vez sucede en la práctica. [200]
El aluminio es uno de los principales factores que reducen el crecimiento de las plantas en suelos ácidos. Aunque generalmente es inofensivo para el crecimiento de las plantas en suelos con pH neutro, en suelos ácidos la concentración de cationes tóxicos Al 3+ aumenta y altera el crecimiento y el funcionamiento de las raíces. [202] [203] [204] [205] El trigo ha desarrollado una tolerancia al aluminio, liberando compuestos orgánicos que se unen a los cationes de aluminio nocivos . Se cree que el sorgo tiene el mismo mecanismo de tolerancia. [206]
La producción de aluminio plantea sus propios desafíos para el medio ambiente en cada paso del proceso de producción. El mayor desafío son las emisiones de gases de efecto invernadero . [194] Estos gases resultan del consumo eléctrico de las fundiciones y de los subproductos del procesamiento. Los más potentes de estos gases son los perfluorocarbonos del proceso de fundición. [194] El dióxido de azufre liberado es uno de los principales precursores de la lluvia ácida . [194]
La biodegradación del aluminio metálico es extremadamente rara; la mayoría de los organismos que lo corroen no atacan ni consumen directamente, sino que producen desechos corrosivos. [207] [208] El hongo Geotrichum candidum puede consumir el aluminio en discos compactos . [209] [210] [211] La bacteria Pseudomonas aeruginosa y el hongo Cladosporium resinae se detectan comúnmente en los tanques de combustible de los aviones que utilizan combustibles a base de queroseno (no avgas ), y los cultivos de laboratorio pueden degradar el aluminio. [212]
Véase también
- Granulados de aluminio
- Unión de aluminio
- Batería de aluminio y aire
- Acero aluminizado , para resistencia a la corrosión y otras propiedades.
- Pantalla aluminizada , para dispositivos de visualización
- Tela aluminizada , para reflejar el calor.
- Mylar aluminizado , para reflejar el calor.
- Tinción de los bordes del panel
- Reloj cuántico
Notas
- ^ El uso que Davy hizo de la palabra aluminio en 1812 fue anterior al uso que otros autores hicieron de la palabra aluminio . Sin embargo, a menudo se menciona a Davy como la persona que nombró el elemento; fue el primero en acuñar un nombre para el aluminio: utilizó alumium en 1808. Otros autores no aceptaron ese nombre y eligieron aluminio en su lugar. Vea a continuación para obtener más detalles.
- ^ Ningún elemento con número atómico impar tiene más de dos isótopos estables; los elementos con número par tienen múltiples isótopos estables, siendo el estaño (elemento 50) el que tiene el mayor número de isótopos estables de todos los elementos, diez. La única excepción es el berilio , que tiene un número par pero solo tiene un isótopo estable. [13] Véase Núcleos atómicos pares e impares para más detalles.
- ^ La mayoría de los demás metales tienen pesos atómicos estándar mayores: por ejemplo, el del hierro es55.845 ; cobre63.546 ; plomo207.2 . [3] lo que tiene consecuencias para las propiedades del elemento (ver más abajo)
- ^ Las dos caras del papel de aluminio difieren en su brillo: una es brillante y la otra es opaca. La diferencia se debe al pequeño daño mecánico en la superficie de la cara opaca que surge del proceso tecnológico de fabricación del papel de aluminio. [24] Ambas caras reflejan cantidades similares de luz visible, pero la cara brillante refleja una proporción mucho mayor de luz visible de forma especular, mientras que la cara opaca difunde la luz casi exclusivamente. Ambas caras del papel de aluminio sirven como buenos reflectores (aproximadamente el 86%) de la luz visible y como un excelente reflector (hasta el 97%) de la radiación infrarroja media y lejana . [25]
- ^ De hecho, el comportamiento electropositivo del aluminio, su alta afinidad por el oxígeno y su potencial de electrodo estándar altamente negativo están mejor alineados con los del escandio , el itrio , el lantano y el actinio , que como el aluminio tienen tres electrones de valencia fuera de un núcleo de gas noble; esta serie muestra tendencias continuas, mientras que las del grupo 13 se interrumpen por la primera subcapa d añadida en el galio y la contracción resultante del bloque d y la primera subcapa f añadida en el talio y la contracción resultante del lantánido . [37]
- ^ Estos no deben considerarse aniones complejos [AlF 6 ] 3− ya que los enlaces Al–F no son significativamente diferentes en tipo de los otros enlaces M–F. [47]
- ^ Estas diferencias en la coordinación entre los fluoruros y los haluros más pesados no son inusuales y ocurren, por ejemplo, en Sn IV y Bi III ; diferencias aún mayores ocurren entre CO 2 y SiO 2 . [47]
- ^ Las abundancias en la fuente se enumeran en relación con el silicio en lugar de en notación por partícula. La suma de todos los elementos por cada 10 6 partes de silicio es 2,6682 × 1010 partes; el aluminio comprende 8,410 × 104 partes.
- ^ Compare las estadísticas anuales de producción de aluminio [100] y cobre [101] del USGS.
- ^ La ortografía alumine proviene del francés, mientras que la ortografía alumina proviene del latín. [115]
- ^ Davy descubrió varios otros elementos, incluidos los que llamó sodio y potasio , a partir de las palabras inglesas soda y potash . Berzelius se refirió a ellos como natrium y kalium . La sugerencia de Berzelius se amplió en 1814 [122] con su sistema propuesto de símbolos químicos de una o dos letras , que se utilizan hasta el día de hoy; el sodio y el potasio tienen los símbolos Na y K , respectivamente, después de sus nombres en latín.
- ^ Algunos idiomas europeos, como el español o el italiano , usan un sufijo diferente del latín -um / -ium para formar el nombre de un metal, algunos, como el polaco o el checo , tienen una base diferente para el nombre del elemento, y algunos, como el ruso o el griego , no usan la escritura latina en absoluto.
- ^ Por ejemplo, véase la edición de noviembre-diciembre de 2013 de Chemistry International : en una tabla de (algunos) elementos, el elemento figura como "aluminio (aluminio)". [134]
- ^ Si bien el aluminio en sí no es cancerígeno, la producción de aluminio de Söderberg, como lo señala la Agencia Internacional para la Investigación sobre el Cáncer [174] , probablemente se deba a la exposición a hidrocarburos aromáticos policíclicos. [175]
Referencias
- ^ "aluminio" . Diccionario Oxford de inglés (edición en línea). Oxford University Press . (Se requiere suscripción o membresía a una institución participante).
- ^ "Pesos atómicos estándar: aluminio". CIAAW . 2017.
- ^ ab Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip JH; Gröning, Manfred; Holden, Norman E.; Meijer, Harro AJ (4 de mayo de 2022). "Pesos atómicos estándar de los elementos 2021 (Informe técnico de la IUPAC)". Química pura y aplicada . doi :10.1515/pac-2019-0603. ISSN 1365-3075.
- ^ Zhang, Yiming; Evans, Julian RG; Yang, Shoufeng (2011). "Valores corregidos para puntos de ebullición y entalpías de vaporización de elementos en manuales". J. Chem. Eng. Data . 56 (2): 328–337. doi :10.1021/je1011086.
- ^ abc Arblaster, John W. (2018). Valores seleccionados de las propiedades cristalográficas de los elementos . Materials Park, Ohio: ASM International. ISBN 978-1-62708-155-9.
- ^ Se ha detectado un carbonilo inestable de Al(0) en la reacción de Al2 ( CH3 ) 6 con monóxido de carbono; véase Sanchez, Ramiro; Arrington, Caleb; Arrington Jr., CA (1 de diciembre de 1989). "Reacción de trimetilaluminio con monóxido de carbono en matrices de baja temperatura". American Chemical Society . 111 (25): 9110-9111. doi :10.1021/ja00207a023. OSTI 6973516.
- ^ Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . pág. 28. ISBN 978-0-08-037941-8.
- ^ Dohmeier, C.; Loos, D.; Schnöckel, H. (1996). "Compuestos de aluminio(I) y galio(I): síntesis, estructuras y reacciones". Angewandte Chemie International Edition . 35 (2): 129–149. doi :10.1002/anie.199601291.
- ^ Tyte, DC (1964). "Sistema de bandas rojas (B2Π–A2σ) del monóxido de aluminio". Nature . 202 (4930): 383. Bibcode :1964Natur.202..383T. doi :10.1038/202383a0. S2CID 4163250.
- ^ Lide, DR (2000). "Susceptibilidad magnética de los elementos y compuestos inorgánicos" (PDF) . CRC Handbook of Chemistry and Physics (81.ª ed.). CRC Press . ISBN 0849304814.
- ^ Kondev, FG; Wang, M.; Huang, WJ; Naimi, S.; Audi, G. (2021). "La evaluación NUBASE2020 de las propiedades nucleares" (PDF) . Chinese Physics C . 45 (3): 030001. doi :10.1088/1674-1137/abddae.
- ^ Mougeot, X. (2019). "Hacia un cálculo de alta precisión de las desintegraciones por captura de electrones". Applied Radiation and Isotopes . 154 (108884). doi :10.1016/j.apradiso.2019.108884.
- ^ ab OIEA – Sección de Datos Nucleares (2017). «Livechart – Tabla de nucleidos – Datos de estructura y desintegración nuclear». www-nds.iaea.org . Organismo Internacional de Energía Atómica . Archivado desde el original el 23 de marzo de 2019 . Consultado el 31 de marzo de 2017 .
- ^ abcdef Greenwood y Earnshaw 1997, págs. 242-252.
- ^ "Aluminio". Comisión de Abundancias Isotópicas y Pesos Atómicos. Archivado desde el original el 23 de septiembre de 2020. Consultado el 20 de octubre de 2020 .
- ^ Dickin, AP (2005). "Isótopos cosmogénicos in situ". Geología de isótopos radiogénicos . Cambridge University Press. ISBN 978-0-521-53017-0Archivado desde el original el 6 de diciembre de 2008 . Consultado el 16 de julio de 2008 .
- ^ Dodd, RT (1986). Piedras de trueno y estrellas fugaces . Harvard University Press. págs. 89-90. ISBN 978-0-674-89137-1.
- ^ Decano 1999, pág. 4.2.
- ^ Decano 1999, pág. 4.6.
- ^ Decano 1999, pág. 4.29.
- ^ desde Dean 1999, pág. 4.30.
- ^ ab Enghag, Per (2008). Enciclopedia de los elementos: datos técnicos, historia, procesamiento y aplicaciones. John Wiley & Sons. págs. 139, 819, 949. ISBN 978-3-527-61234-5Archivado desde el original el 25 de diciembre de 2019 . Consultado el 7 de diciembre de 2017 .
- ^ abc Greenwood y Earnshaw, págs. 222–4
- ^ "Lámina de alta resistencia". Reynolds Kitchens . Archivado desde el original el 23 de septiembre de 2020. Consultado el 20 de septiembre de 2020 .
- ^ Pozzobon, V.; Levasseur, W.; Do, Kh.-V.; et al. (2020). "Medidas de reflectividad del lado mate y brillante de papel de aluminio doméstico: aplicación al diseño de un concentrador de luz de fotobiorreactor". Informes de biotecnología . 25 : e00399. doi :10.1016/j.btre.2019.e00399. ISSN 2215-017X. PMC 6906702 . PMID 31867227.
- ^ Lide 2004, pág. 4-3.
- ^ Puchta, Ralph (2011). "Un berilio más brillante". Nature Chemistry . 3 (5): 416. Bibcode :2011NatCh...3..416P. doi : 10.1038/nchem.1033 . PMID 21505503.
- ^ Davis 1999, págs. 1–3.
- ^ Davis 1999, pág. 2.
- ^ de Polmear, IJ (1995). Aleaciones ligeras: metalurgia de los metales ligeros (3.ª ed.). Butterworth-Heinemann . ISBN 978-0-340-63207-9.
- ^ abc Cardarelli, François (2008). Manual de materiales: una referencia de escritorio concisa (2.ª ed.). Londres: Springer. pp. 158–163. ISBN 978-1-84628-669-8.OCLC 261324602 .
- ^Ab Davis 1999, pág. 4.
- ^ Davis 1999, págs. 2-3.
- ^ Cochran, JF; Mapother, DE (1958). "Transición superconductora en aluminio". Physical Review . 111 (1): 132–142. Código Bibliográfico :1958PhRv..111..132C. doi :10.1103/PhysRev.111.132.
- ^ Schmitz 2006, pág. 6.
- ^ Schmitz 2006, pág. 161.
- ^ abcdefghi Greenwood y Earnshaw 1997, págs. 224-227.
- ^ Greenwood y Earnshaw 1997, págs. 112-113.
- ^ Rey 1995, pág. 241.
- ^ Rey 1995, págs. 235-236.
- ^ Hatch, John E. (1984). Aluminio: propiedades y metalurgia física . Metals Park, Ohio: Sociedad Estadounidense de Metales, Asociación del Aluminio. p. 242. ISBN 978-1-61503-169-6.OCLC 759213422 .
- ^ Vargel, Christian (2004) [edición francesa publicada en 1999]. Corrosión del aluminio. Elsevier. ISBN 978-0-08-044495-6. Archivado desde el original el 21 de mayo de 2016.
- ^ Macleod, HA (2001). Filtros ópticos de película delgada . CRC Press. pág. 158159. ISBN 978-0-7503-0688-1.
- ^ abcdefg Frank, WB (2009). "Aluminio". Enciclopedia de química industrial de Ullmann . Wiley-VCH. doi :10.1002/14356007.a01_459.pub2. ISBN 978-3-527-30673-2.
- ^ ab Beal, Roy E. (1999). Pruebas de refrigerantes de motores: cuarto volumen. ASTM International. pág. 90. ISBN 978-0-8031-2610-7Archivado desde el original el 24 de abril de 2016.
- ^ * Baes, CF; Mesmer, RE (1986) [1976]. La hidrólisis de cationes . Robert E. Krieger. ISBN 978-0-89874-892-5.
- ^ abcdef Greenwood y Earnshaw 1997, págs. 233-237.
- ^ Eastaugh, Nicholas; Walsh, Valentine; Chaplin, Tracey; Siddall, Ruth (2008). Compendio de pigmentos. Routledge. ISBN 978-1-136-37393-0Archivado del original el 15 de abril de 2021 . Consultado el 1 de octubre de 2020 .
- ^ Roscoe, Henry Enfield; Schorlemmer, Carl (1913). Tratado de química. Macmillan. Archivado desde el original el 15 de abril de 2021. Consultado el 1 de octubre de 2020 .
- ^ desde Greenwood y Earnshaw 1997, págs. 252-257.
- ^ Downs, AJ (1993). Química del aluminio, el galio, el indio y el talio. Springer Science & Business Media. pág. 218. ISBN 978-0-7514-0103-5Archivado del original el 15 de abril de 2021 . Consultado el 1 de octubre de 2020 .
- ^ Dohmeier, C.; Loos, D.; Schnöckel, H. (1996). "Compuestos de aluminio(I) y galio(I): síntesis, estructuras y reacciones". Angewandte Chemie International Edition . 35 (2): 129–149. doi :10.1002/anie.199601291.
- ^ Tyte, DC (1964). "Sistema de bandas rojas (B2Π–A2σ) del monóxido de aluminio". Nature . 202 (4930): 383–384. Código Bibliográfico :1964Natur.202..383T. doi :10.1038/202383a0. S2CID 4163250.
- ^ Merrill, PW; Deutsch, AJ; Keenan, PC (1962). "Espectros de absorción de las variables Mira de tipo M". The Astrophysical Journal . 136 : 21. Bibcode :1962ApJ...136...21M. doi :10.1086/147348.
- ^ Uhl, W. (2004). "Compuestos organoelementales que poseen enlaces sencillos AlAl, GaGa, InIn y TlTl". Avances en química organometálica, volumen 51. Vol. 51. págs. 53–108. doi :10.1016/S0065-3055(03)51002-4. ISBN 978-0-12-031151-4.
- ^ Elschenbroich, C. (2006). Organometálicos . Wiley-VCH. ISBN 978-3-527-29390-2.
- ^ desde Greenwood y Earnshaw 1997, págs. 257–67.
- ^ Smith, Martin B. (1970). "Los equilibrios monómero-dímero de alquilos de aluminio líquidos". Journal of Organometallic Chemistry . 22 (2): 273–281. doi :10.1016/S0022-328X(00)86043-X.
- ^ desde Greenwood y Earnshaw 1997, págs. 227-232.
- ^ ab Lodders, K. (2003). "Solar System absorptions and condensation temperatures of the elements" (PDF) . The Astrophysical Journal . 591 (2): 1220–1247. Bibcode :2003ApJ...591.1220L. doi :10.1086/375492. ISSN 0004-637X. S2CID 42498829. Archivado (PDF) desde el original el 12 de abril de 2019 . Consultado el 15 de junio de 2018 .
- ^ abcde Clayton, D. (2003). Manual de isótopos en el cosmos: del hidrógeno al galio. Leiden: Cambridge University Press. págs. 129-137. ISBN 978-0-511-67305-4. OCLC 609856530. Archivado desde el original el 11 de junio de 2021 . Consultado el 13 de septiembre de 2020 .
- ^ William F McDonough La composición de la Tierra. quake.mit.edu, archivado por Internet Archive Wayback Machine.
- ^ Greenwood y Earnshaw, págs. 217-9
- ^ Wade, K.; Banister, AJ (2016). La química del aluminio, el galio, el indio y el talio: química inorgánica integral. Elsevier. pág. 1049. ISBN 978-1-4831-5322-3Archivado desde el original el 30 de noviembre de 2019 . Consultado el 17 de junio de 2018 .
- ^ Palme, H.; O'Neill, Hugh St. C. (2005). "Estimaciones cosmoquímicas de la composición del manto" (PDF) . En Carlson, Richard W. (ed.). El manto y el núcleo . Elseiver. pág. 14. Archivado (PDF) del original el 3 de abril de 2021 . Consultado el 11 de junio de 2021 .
- ^ Downs, AJ (1993). Química del aluminio, el galio, el indio y el talio. Springer Science & Business Media. ISBN 978-0-7514-0103-5Archivado del original el 25 de julio de 2020 . Consultado el 14 de junio de 2017 .
- ^ Kotz, John C.; Treichel, Paul M.; Townsend, John (2012). Química y reactividad química. Cengage Learning. pág. 300. ISBN 978-1-133-42007-1Archivado desde el original el 22 de diciembre de 2019 . Consultado el 17 de junio de 2018 .
- ^ Barthelmy, D. "Datos minerales de aluminio". Base de datos de mineralogía . Archivado desde el original el 4 de julio de 2008. Consultado el 9 de julio de 2008 .
- ^ Chen, Z.; Huang, Chi-Yue; Zhao, Meixun; Yan, Wen; Chien, Chih-Wei; Chen, Muhong; Yang, Huaping; Machiyama, Hideaki; Lin, Saulwood (2011). "Características y posible origen del aluminio nativo en sedimentos de filtraciones frías del noreste del Mar de China Meridional". Revista de Ciencias de la Tierra de Asia . 40 (1): 363–370. Código Bibliográfico :2011JAESc..40..363C. doi :10.1016/j.jseaes.2010.06.006.
- ^ Guilbert, JF; Park, CF (1986). La geología de los yacimientos minerales . WH Freeman. págs. 774–795. ISBN 978-0-7167-1456-9.
- ^ United States Geological Survey (2018). «Bauxita y alúmina» (PDF) . Resúmenes de materias primas minerales. Archivado (PDF) del original el 11 de marzo de 2018. Consultado el 17 de junio de 2018 .
- ^ desde Drozdov 2007, pág. 12.
- ^ Clapham, John Harold; Power, Eileen Edna (1941). Historia económica de Europa de Cambridge: desde la decadencia del Imperio romano. Archivo CUP. p. 207. ISBN 978-0-521-08710-0.
- ^ Drozdov 2007, pág. 16.
- ^ Setton, Kenneth M. (1976). El papado y el Levante: 1204-1571. 1 Los siglos XIII y XIV . American Philosophical Society. ISBN 978-0-87169-127-9.OCLC 165383496 .
- ^ Drozdov 2007, pág. 25.
- ^ Weeks, Mary Elvira (1968). Descubrimiento de los elementos. Vol. 1 (7.ª ed.). Revista de educación química. pág. 187. ISBN 9780608300177.
- ^ por Richards 1896, pág. 2.
- ^ Richards 1896, pág. 3.
- ^ Örsted, HC (1825). Oversigt over det Kongelige Danske Videnskabernes Selskabs Forhanlingar og dets Medlemmerz Arbeider, fra 31 de mayo de 1824 hasta el 31 de mayo de 1825 [ Resumen de las actuaciones de la Real Sociedad Científica Danesa y el trabajo de sus miembros, del 31 de mayo de 1824 al 31 de mayo de 1825 ] (en danés) . págs. 15-16. Archivado desde el original el 16 de marzo de 2020 . Consultado el 27 de febrero de 2020 .
- ^ Real Academia Danesa de Ciencias y Letras (1827). Det Kongelige Danske Videnskabernes Selskabs philosophiske og historiske afhandlinger [Las disertaciones filosóficas e históricas de la Real Sociedad Científica Danesa ] (en danés). Papá. págs. xxv-xxvi. Archivado desde el original el 24 de marzo de 2017 . Consultado el 11 de marzo de 2016 .
- ^ ab Wöhler, Friedrich (1827). "Ueber das Aluminio". Annalen der Physik und Chemie . 2. 11 (9): 146–161. Código bibliográfico : 1828AnP....87..146W. doi : 10.1002/andp.18270870912. S2CID 122170259. Archivado desde el original el 11 de junio de 2021 . Consultado el 11 de marzo de 2016 .
- ^ Drozdov 2007, pág. 36.
- ^ Fontani, Marco; Costa, Mariagracia; Orna, María Virginia (2014). Los elementos perdidos: el lado oscuro de la tabla periódica. Prensa de la Universidad de Oxford. pag. 30.ISBN 978-0-19-938334-4.
- ^ por Venetski, S. (1969). "'Plata' a partir de arcilla". Metalúrgico . 13 (7): 451–453. doi :10.1007/BF00741130. S2CID 137541986.
- ^ desde Drozdov 2007, pág. 38.
- ^ Holmes, Harry N. (1936). "Cincuenta años de aluminio industrial". The Scientific Monthly . 42 (3): 236–239. Código Bibliográfico :1936SciMo..42..236H. JSTOR 15938.
- ^ Drozdov 2007, pág. 39.
- ^ Sainte-Claire Deville, ÉL (1859). De l'aluminium, ses propriétés, sa fabrication. París: Mallet-Bachelier. Archivado desde el original el 30 de abril de 2016.
- ^ Drozdov 2007, pág. 46.
- ^ Drozdov 2007, págs. 55–61.
- ^ Drozdov 2007, pág. 74.
- ^ abc «Historia del aluminio». Todo sobre el aluminio . Archivado desde el original el 7 de noviembre de 2017. Consultado el 7 de noviembre de 2017 .
- ^ Drozdov 2007, págs. 64–69.
- ^ Ingulstad, Mats (2012). "'Queremos aluminio, sin excusas': relaciones entre empresas y gobiernos en la industria del aluminio estadounidense, 1917-1957". En Ingulstad, Mats; Frøland, Hans Otto (eds.). De la guerra al bienestar: relaciones entre empresas y gobiernos en la industria del aluminio . Tapir Academic Press. págs. 33-68. ISBN 978-82-321-0049-1Archivado del original el 25 de julio de 2020 . Consultado el 7 de mayo de 2020 .
- ^ Seldes, George (1943). Hechos y fascismo (5.ª ed.). In Fact, Inc., pág. 261.
- ^ Thorsheim, Peter (2015). Waste into Weapons [De los residuos a las armas]. Cambridge University Press. Págs. 66-69. ISBN. 978-1-107-09935-7Archivado del original el 6 de abril de 2020 . Consultado el 7 de enero de 2021 .
- ^ Weeks, Albert Loren (2004). El salvavidas de Rusia: la ayuda de préstamo y arriendo a la URSS en la Segunda Guerra Mundial. Lexington Books . p. 135. ISBN 978-0-7391-0736-2Archivado del original el 6 de abril de 2020 . Consultado el 7 de enero de 2021 .
- ^ Drozdov 2007, págs. 69-70.
- ^ abcd «Aluminio». Estadísticas históricas de materias primas minerales en los Estados Unidos (informe). Servicio Geológico de los Estados Unidos . 2017. Archivado desde el original el 8 de marzo de 2018. Consultado el 9 de noviembre de 2017 .
- ^ "Cobre. Estadísticas de oferta y demanda". Estadísticas históricas de materias primas minerales en Estados Unidos (informe). Servicio Geológico de los Estados Unidos . 2017. Archivado desde el original el 8 de marzo de 2018. Consultado el 4 de junio de 2019 .
- ^ Gregersen, Erik. «Cobre». Enciclopedia Británica . Archivado desde el original el 22 de junio de 2019. Consultado el 4 de junio de 2019 .
- ^ Drozdov 2007, págs. 165-166.
- ^ Drozdov 2007, pág. 85.
- ^ Drozdov 2007, pág. 135.
- ^ Nappi 2013, pág. 9.
- ^ Nappi 2013, págs. 9–10.
- ^ Nappi 2013, pág. 10.
- ^ Nappi 2013, págs. 14-15.
- ^ Nappi 2013, pág. 17.
- ^ Nappi 2013, pág. 20.
- ^ Nappi 2013, pág. 22.
- ^ Nappi 2013, pág. 23.
- ^ "Los precios del aluminio alcanzan su nivel más alto en 13 años en medio de la escasez de energía en China". Nikkei Asia . 22 de septiembre de 2021.
- ^ Black, J. (1806). Lecciones sobre los elementos de la química: dictadas en la Universidad de Edimburgo. Vol. 2. Graves, B. pág. 291.
Los químicos franceses han dado un nuevo nombre a esta tierra pura: alúmina en francés y alúmina en latín. Confieso que no me gusta esta alúmina.
- ^ "aluminio, n." Oxford English Dictionary, tercera edición . Oxford University Press. Diciembre de 2011. Archivado desde el original el 11 de junio de 2021. Consultado el 30 de diciembre de 2020 .
Origen: Formado dentro del inglés, por derivación. Étimos: alumine n. , sufijo -ium , aluminum n.
- ^ "aluminio, n." Oxford English Dictionary, tercera edición . Oxford University Press. Diciembre de 2011. Archivado desde el original el 11 de junio de 2021. Consultado el 30 de diciembre de 2020 .
Etimología: < francés alumine (LB Guyton de Morveau 1782, Observ. sur la Physique 19 378) < latín clásico alūmin- , alūmen alum n. 1 , después del sufijo francés -ine -ine 4 .
- ↑ Pokorny, Julius (1959). «alu- (-d-, -t-)». Indogermanisches etymologisches Wörterbuch [ Diccionario etimológico indoeuropeo ] (en alemán). A. Francke Verlag. pp. 33–34. Archivado desde el original el 23 de noviembre de 2017. Consultado el 13 de noviembre de 2017 .
- ^ Davy, Humphry (1808). «Investigaciones electroquímicas sobre la descomposición de las tierras; con observaciones sobre los metales obtenidos a partir de las tierras alcalinas y sobre la amalgama obtenida a partir del amoníaco». Philosophical Transactions of the Royal Society . 98 : 353. Bibcode :1808RSPT...98..333D. doi : 10.1098/rstl.1808.0023 . Archivado desde el original el 15 de abril de 2021 . Consultado el 10 de diciembre de 2009 .
- ^ Richards 1896, págs. 3-4.
- ^ Berzelius, JJ (1811). "Ensayo sobre la nomenclatura química". Revista de físico . 73 : 253–286. Archivado desde el original el 15 de abril de 2021 . Consultado el 27 de diciembre de 2020 ..
- ^ Berzelius, J. (1814). Thomson, Th. (ed.). "Ensayo sobre la causa de las proporciones químicas y sobre algunas circunstancias relacionadas con ellas: junto con un método breve y sencillo para expresarlas". Anales de filosofía . III . Baldwin, R.: 51–62. Archivado desde el original el 15 de julio de 2014 . Consultado el 13 de diciembre de 2014 .
- ^ Delaméntherie, J.-C. (1811). "Leçonse de minéralogie. Données au collége de France". Revista de físico . 73 : 469–470. Archivado desde el original el 15 de abril de 2021 . Consultado el 27 de diciembre de 2020 ..
- ^ "Transacciones filosóficas de la Royal Society de Londres. Para el año 1810. — Parte I". The Critical Review: Or, Annals of Literature . La tercera. XXII : 9. Enero de 1811. hdl :2027/chi.36013662.
El potasio, actuando sobre el alúmina y la glucina, produce sustancias pirofóricas de color gris oscuro, que ardían, desprendiendo chispas brillantes y dejando tras de sí álcali y tierra, y que, al arrojarlas al agua, la descomponían con gran violencia. El resultado de este experimento no es del todo decisivo en cuanto a la existencia de lo que podría llamarse aluminio y glucinio .
- ^ Davy, Humphry (1812). «De los metales; sus composiciones primarias con otros cuerpos no compuestos y entre sí». Elementos de filosofía química: Parte 1. Vol. 1. Bradford e Inskeep. pág. 201. Archivado desde el original el 14 de marzo de 2020. Consultado el 4 de marzo de 2020 .
- ^ abc «aluminio, n.» Oxford English Dictionary, tercera edición . Oxford University Press. Diciembre de 2011. Archivado desde el original el 11 de junio de 2021. Consultado el 30 de diciembre de 2020 .
El aluminio n. coexistió con su sinónimo aluminio n. durante todo el siglo XIX. Desde principios del siglo XX, el aluminio se convirtió gradualmente en la forma predominante en América del Norte; fue adoptado como el nombre oficial del metal en los Estados Unidos por la Sociedad Química Estadounidense en 1925. En otros lugares, el aluminio fue reemplazado gradualmente por el aluminio , que fue aceptado como estándar internacional por la IUPAC en 1990.
- ^ Cutmore, Jonathan (febrero de 2005). «Archivo de Quarterly Review». Romantic Circles . Universidad de Maryland. Archivado desde el original el 1 de marzo de 2017. Consultado el 28 de febrero de 2017 .
- ^ Young, Thomas (1812). "Elementos de filosofía química por Sir Humphry Davy". Quarterly Review . VIII (15): 72. ISBN 978-0-217-88947-6. 210. Archivado desde el original el 25 de julio de 2020 . Consultado el 10 de diciembre de 2009 .
- ^ ab Quinion, Michael (2005). Port Out, Starboard Home: The Fascinating Stories We Tell About the words We Use [Puerto a la vista, a estribor: las fascinantes historias que contamos sobre las palabras que usamos]. Penguin Books Limited. págs. 23-24. ISBN 978-0-14-190904-2.
- ^ Webster, Noah (1828). "aluminio". Diccionario Americano de la Lengua Inglesa. Archivado desde el original el 13 de noviembre de 2017. Consultado el 13 de noviembre de 2017 .
- ^ Kean, S. (2018). "Los elementos como dinero". La cuchara que desaparece: y otros cuentos reales de rivalidad, aventuras e historia del mundo a partir de la tabla periódica de los elementos (edición para lectores jóvenes). Little, Brown Books for Young Readers. ISBN 978-0-316-38825-2Archivado del original el 15 de abril de 2021 . Consultado el 14 de enero de 2021 .
- ^ abc Emsley, John (2011). Los elementos básicos de la naturaleza: una guía de la A a la Z de los elementos. OUP Oxford. págs. 24-30. ISBN 978-0-19-960563-7Archivado desde el original el 22 de diciembre de 2019 . Consultado el 16 de noviembre de 2017 .
- ^ Connelly, Neil G.; Damhus, Ture, eds. (2005). Nomenclatura de la química inorgánica. Recomendaciones de la IUPAC 2005 (PDF) . RSC Publishing . p. 249. ISBN 978-0-85404-438-2. Archivado desde el original (PDF) el 22 de diciembre de 2014.
- ^ "Pesos atómicos estándar revisados" (PDF) . Chemistry International . 35 (6): 17–18. ISSN 0193-6484. Archivado desde el original (PDF) el 11 de febrero de 2014.
- ^ ab "Información sobre minerales del USGS: Resúmenes de productos minerales" (PDF) . minerals.usgs.gov . doi :10.3133/70194932. Archivado (PDF) del original el 22 de enero de 2021 . Consultado el 17 de diciembre de 2020 .
- ^ Brown, TJ (2009). Producción mundial de minerales 2003-2007. British Geological Survey . Archivado desde el original el 13 de julio de 2019. Consultado el 1 de diciembre de 2014 .
- ^ Lama, F. (2023). Por qué Occidente no puede ganar: de Bretton Woods a un mundo multipolar . Clarity Press, Inc. pág. 19. ISBN 978-1-949762-74-7.
- ^ Graedel, TE; et al. (2010). Existencias de metales en la sociedad: síntesis científica (PDF) (Informe). Panel Internacional de Recursos. pág. 17. ISBN 978-92-807-3082-1. Archivado (PDF) del original el 26 de abril de 2018 . Consultado el 18 de abril de 2017 .
- ^ abcde Hudson, L. Keith; Misra, Chanakya; Perrotta, Anthony J.; et al. (2005). "Óxido de aluminio". Enciclopedia de química industrial de Ullmann . Wiley-VCH.
- ^ Totten, GE; Mackenzie, DS (2003). Manual de aluminio. Marcel Dekker . pág. 40. ISBN 978-0-8247-4843-2Archivado desde el original el 15 de junio de 2016.
- ^ Schlesinger, Mark (2006). Reciclaje de aluminio. CRC Press. pág. 248. ISBN 978-0-8493-9662-5Archivado desde el original el 15 de febrero de 2017 . Consultado el 25 de junio de 2018 .
- ^ "Beneficios del reciclaje". Departamento de Recursos Naturales de Ohio . Archivado desde el original el 24 de junio de 2003.
- ^ "Uso teórico/práctico de energía en operaciones de fundición de metales" (PDF) . Archivado desde el original (PDF) el 31 de octubre de 2013 . Consultado el 28 de octubre de 2013 .
- ^ "¿Por qué son preocupantes la escoria y el revoque de sal?". www.experts123.com . Archivado desde el original el 14 de noviembre de 2012.
- ^ Dunster, AM; et al. (2005). "Valor añadido del uso de nuevos flujos de residuos industriales como agregados secundarios en hormigón y asfalto" (PDF) . Programa de Acción sobre Residuos y Recursos . Archivado desde el original el 2 de abril de 2010.
- ^ Brown, TJ; Idoine, NE; Raycraft, ER; et al. (2018). Producción mundial de minerales: 2012-2016. British Geological Survey. ISBN 978-0-85272-882-6Archivado del original el 16 de mayo de 2020 . Consultado el 10 de julio de 2018 .
- ^ "Aluminio". Encyclopædia Britannica . Archivado desde el original el 12 de marzo de 2012. Consultado el 6 de marzo de 2012 .
- ^ Millberg, LS "Aluminum Foil". Cómo se fabrican los productos . Archivado desde el original el 13 de julio de 2007. Consultado el 11 de agosto de 2007 .
- ^ Lyle, JP; Granger, DA; Sanders, RE (2005). "Aleaciones de aluminio". Ullmann's Encyclopedia of Industrial Chemistry . Wiley-VCH. doi :10.1002/14356007.a01_481. ISBN 978-3-527-30673-2.
- ^ Ross, RB (2013). Manual de especificaciones de materiales metálicos. Springer Science & Business Media. ISBN 9781461534822Archivado del original el 11 de junio de 2021 . Consultado el 3 de junio de 2021 .
- ^ Davis 1999, págs. 17–24.
- ^ Lumley, Roger (2010). Fundamentos de la metalurgia del aluminio: producción, procesamiento y aplicaciones. Elsevier Science. pág. 42. ISBN 978-0-85709-025-6Archivado desde el original el 22 de diciembre de 2019 . Consultado el 13 de julio de 2018 .
- ^ Mortensen, Andreas (2006). Enciclopedia concisa de materiales compuestos. Elsevier. pág. 281. ISBN 978-0-08-052462-7Archivado desde el original el 20 de diciembre de 2019 . Consultado el 13 de julio de 2018 .
- ^ Sociedad Cerámica de Japón (2012). Tecnologías y productos cerámicos avanzados. Springer Science & Business Media. pág. 541. ISBN 978-4-431-54108-0Archivado desde el original el 29 de noviembre de 2019 . Consultado el 13 de julio de 2018 .
- ^ Slesser, Malcolm (1988). Diccionario de energía. Palgrave Macmillan, Reino Unido. pág. 138. ISBN. 978-1-349-19476-6Archivado del original el 11 de junio de 2021 . Consultado el 13 de julio de 2018 .
- ^ Supp, Emil (2013). Cómo producir metanol a partir de carbón. Springer Science & Business Media. pp. 164–165. ISBN 978-3-662-00895-9Archivado desde el original el 26 de diciembre de 2019 . Consultado el 13 de julio de 2018 .
- ^ Ertl, Gerhard; Knözinger, Helmut; Weitkamp, Jens (2008). Preparación de Catalizadores Sólidos. John Wiley e hijos. pag. 80.ISBN 978-3-527-62068-5Archivado desde el original el 24 de diciembre de 2019 . Consultado el 13 de julio de 2018 .
- ^ Armarego, WLF; Chai, Christina (2009). Purificación de productos químicos de laboratorio. Butterworth-Heinemann. págs. 73, 109, 116, 155. ISBN 978-0-08-087824-9Archivado desde el original el 22 de diciembre de 2019 . Consultado el 13 de julio de 2018 .
- ^ abcdefgh Helmboldt, O. (2007). "Compuestos de aluminio inorgánicos". Ullmann's Encyclopedia of Industrial Chemistry . Wiley-VCH . págs. 1–17. doi :10.1002/14356007.a01_527.pub2. ISBN 978-3-527-30673-2.
- ^ Organización Mundial de la Salud (2009). Stuart MC, Kouimtzi M, Hill SR (eds.). Formulario Modelo de la OMS 2008. Organización Mundial de la Salud. hdl : 10665/44053 . ISBN 9789241547659.
- ^ Enfermedades cutáneas ocupacionales. Grune & Stratton. 1983. ISBN 978-0-8089-1494-5Archivado del original el 15 de abril de 2021 . Consultado el 14 de junio de 2017 .
- ^ Galbraith, A; Bullock, S; Manias, E; Hunt, B; Richards, A (1999). Fundamentos de farmacología: un texto para enfermeras y profesionales de la salud . Harlow: Pearson. pág. 482.
- ^ Papich, Mark G. (2007). "Hidróxido de aluminio y carbonato de aluminio". Saunders Handbook of Veterinary Drugs (2.ª ed.). St. Louis, Mo: Saunders/Elsevier. págs. 15-16. ISBN 978-1-4160-2888-8.
- ^ Brown, Weldon G. (15 de marzo de 2011), John Wiley & Sons, Inc. (ed.), "Reducciones por hidruro de litio y aluminio", Organic Reactions , Hoboken, NJ, EE. UU.: John Wiley & Sons, Inc., págs. 469–510, doi :10.1002/0471264180.or006.10, ISBN 978-0-471-26418-7, archivado del original el 11 de junio de 2021 , consultado el 22 de mayo de 2021
- ^ Gerrans, GC; Hartmann-Petersen, P. (2007). "Hidruro de litio y aluminio". Enciclopedia de ciencia y tecnología de SASOL . New Africa Books. pág. 143. ISBN 978-1-86928-384-1Archivado desde el original el 23 de agosto de 2017 . Consultado el 6 de septiembre de 2017 .
- ^ M. Witt; HW Roesky (2000). "La química del organoaluminio a la vanguardia de la investigación y el desarrollo" (PDF) . Curr. Sci . 78 (4): 410. Archivado desde el original (PDF) el 6 de octubre de 2014.
- ^ A. Andresen; HG Cordes; J. Herwig; W. Kaminsky; A. Merck; R. Mottweiler; J. Pein; H. Sinn; HJ Vollmer (1976). "Catalizadores Ziegler solubles libres de halógenos para la polimerización de etileno". Angew. Chem. Int. Ed. 15 (10): 630–632. doi :10.1002/anie.197606301.
- ^ Aas, Øystein; Klemetsen, Anders; Einum, Sigurd; et al. (2011). Ecología del salmón del Atlántico. John Wiley e hijos. pag. 240.ISBN 978-1-4443-4819-4Archivado desde el original el 21 de diciembre de 2019 . Consultado el 14 de julio de 2018 .
- ^ Singh, Manmohan (2007). Adyuvantes de vacunas y sistemas de administración. John Wiley & Sons. págs. 81–109. ISBN 978-0-470-13492-4Archivado desde el original el 20 de diciembre de 2019 . Consultado el 14 de julio de 2018 .
- ^ Lindblad, Erik B (octubre de 2004). "Compuestos de aluminio para su uso en vacunas". Inmunología y biología celular . 82 (5): 497–505. doi :10.1111/j.0818-9641.2004.01286.x. PMID 15479435. S2CID 21284189.
- ^ ab Exley, C. (2013). "Exposición humana al aluminio". Ciencias ambientales: procesos e impactos . 15 (10): 1807–1816. doi : 10.1039/C3EM00374D . PMID 23982047.
- ^ "Aplicaciones ambientales. Parte I. Formas comunes de los elementos en el agua". Universidad de Western Oregon . Universidad de Western Oregon. Archivado desde el original el 11 de diciembre de 2018. Consultado el 30 de septiembre de 2019 .
- ^ abcdefgh Dolara, Piero (21 de julio de 2014). "Presencia, exposición, efectos, ingesta recomendada y posible uso dietético de compuestos traza seleccionados (aluminio, bismuto, cobalto, oro, litio, níquel, plata)". Revista Internacional de Ciencias de la Alimentación y Nutrición . 65 (8): 911–924. doi :10.3109/09637486.2014.937801. ISSN 1465-3478. PMID 25045935. S2CID 43779869.
- ^ Compuestos aromáticos polinucleares. Parte 3, Exposiciones industriales en la producción de aluminio, gasificación de carbón, producción de coque y fundición de hierro y acero. Agencia Internacional para la Investigación sobre el Cáncer. 1984. Págs. 51-59. ISBN 92-832-1534-6. OCLC 11527472. Archivado desde el original el 11 de junio de 2021 . Consultado el 7 de enero de 2021 .
- ^ Wesdock, JC; Arnold, IMF (2014). "Salud ocupacional y ambiental en la industria del aluminio". Revista de medicina ocupacional y ambiental . 56 (5 Suppl): S5–S11. doi :10.1097/JOM.0000000000000071. ISSN 1076-2752. PMC 4131940 . PMID 24806726.
- ^ Fisiología del aluminio en el hombre. Aluminio y salud. CRC Press. 1988. pág. 90. ISBN 0-8247-8026-4Archivado desde el original el 19 de mayo de 2016.
- ^ abc «Declaración de salud pública: aluminio». ATSDR . Archivado desde el original el 12 de diciembre de 2016 . Consultado el 18 de julio de 2018 .
- ^ Xu, N.; Majidi, V.; Markesbery, WR; Ehmann, WD (1992). "Aluminio cerebral en la enfermedad de Alzheimer utilizando un método GFAAS mejorado". Neurotoxicología . 13 (4): 735–743. PMID 1302300.
- ^ Yumoto, Sakae; Kakimi, Shigeo; Ohsaki, Akihiro; Ishikawa, Akira (2009). "Demostración de aluminio en fibras amiloides en los núcleos de placas seniles en el cerebro de pacientes con enfermedad de Alzheimer". Revista de bioquímica inorgánica . 103 (11): 1579-1584. doi :10.1016/j.jinorgbio.2009.07.023. PMID 19744735.
- ^ Crapper Mclachlan, DR; Lukiw, WJ; Kruck, TPA (1989). "Nueva evidencia de un papel activo del aluminio en la enfermedad de Alzheimer". Revista Canadiense de Ciencias Neurológicas . 16 (4 Suppl): 490–497. doi : 10.1017/S0317167100029826 . PMID 2680008.
- ^ "Es poco probable que el incidente de contaminación del agua en Lowermoor haya causado efectos a largo plazo en la salud" (PDF) . Comité sobre toxicidad de sustancias químicas en alimentos, productos de consumo y medio ambiente. 18 de abril de 2013. Archivado (PDF) del original el 21 de diciembre de 2019. Consultado el 21 de diciembre de 2019 .
- ^ Tomljenovic, Lucija (21 de marzo de 2011). "Aluminio y enfermedad de Alzheimer: después de un siglo de controversia, ¿existe un vínculo plausible?". Journal of Alzheimer's Disease . 23 (4): 567–598. doi :10.3233/JAD-2010-101494. PMID 21157018. Archivado desde el original el 11 de junio de 2021 . Consultado el 11 de junio de 2021 .
- ^ "Aluminio y demencia: ¿existe una relación?". Alzheimer Society Canada. 24 de agosto de 2018. Archivado desde el original el 21 de diciembre de 2019. Consultado el 21 de diciembre de 2019 .
- ^ Santibáñez, Miguel; Bolumar, Francisco; García, Ana M (2007). "Factores de riesgo ocupacional en la enfermedad de Alzheimer: una revisión que evalúa la calidad de los estudios epidemiológicos publicados". Medicina del trabajo y medioambiental . 64 (11): 723–732. doi :10.1136/oem.2006.028209. ISSN 1351-0711. PMC 2078415 . PMID 17525096.
- ^ Darbre, PD (2006). "Metaloestrógenos: una clase emergente de xenoestrógenos inorgánicos con potencial para aumentar la carga estrogénica de la mama humana". Journal of Applied Toxicology . 26 (3): 191–197. doi :10.1002/jat.1135. PMID 16489580. S2CID 26291680.
- ^ Banks, WA; Kastin, AJ (1989). "Neurotoxicidad inducida por aluminio: alteraciones en la función de la membrana en la barrera hematoencefálica". Neurosci Biobehav Rev . 13 (1): 47–53. doi :10.1016/S0149-7634(89)80051-X. PMID 2671833. S2CID 46507895.
- ^ Bingham, Eula; Cohrssen, Barbara (2012). Toxicología de Patty, 6 volúmenes. John Wiley & Sons. pág. 244. ISBN 978-0-470-41081-3Archivado desde el original el 20 de diciembre de 2019 . Consultado el 23 de julio de 2018 .
- ^ "Síntomas y diagnóstico de la alergia al aluminio". Allergy-symptoms.org . 20 de septiembre de 2016. Archivado desde el original el 23 de julio de 2018 . Consultado el 23 de julio de 2018 .
- ^ al-Masalkhi, A.; Walton, SP (1994). "Fibrosis pulmonar y exposición ocupacional al aluminio". Revista de la Asociación Médica de Kentucky . 92 (2): 59–61. ISSN 0023-0294. PMID 8163901.
- ^ "CDC – NIOSH Pocket Guide to Chemical Hazards – Aluminum" (Guía de bolsillo de los CDC sobre los peligros químicos del aluminio). www.cdc.gov . Archivado desde el original el 30 de mayo de 2015. Consultado el 11 de junio de 2015 .
- ^ "CDC – NIOSH Pocket Guide to Chemical Hazards – Aluminium (pyro powders and Welding fumes, as Al)" (Guía de bolsillo de los CDC sobre peligros químicos del NIOSH: aluminio (polvos pirotécnicos y humos de soldadura, como Al)). www.cdc.gov . Archivado desde el original el 30 de mayo de 2015. Consultado el 11 de junio de 2015 .
- ^ Yokel RA; Hicks CL; Florence RL (2008). "Biodisponibilidad del aluminio a partir de fosfato de aluminio y sodio básico, un agente emulsionante aditivo alimentario aprobado, incorporado en el queso". Toxicología alimentaria y química . 46 (6): 2261–2266. doi :10.1016/j.fct.2008.03.004. PMC 2449821. PMID 18436363 .
- ^ Departamento de Salud y Servicios Humanos de los Estados Unidos (1999). Perfil toxicológico del aluminio (PDF) (Informe). Archivado (PDF) del original el 9 de mayo de 2020. Consultado el 3 de agosto de 2018 .
- ^ abcd «Aluminio». The Environmental Literacy Council . Archivado desde el original el 27 de octubre de 2020. Consultado el 29 de julio de 2018 .
- ^ Chen, Jennifer K.; Thyssen, Jacob P. (2018). Alergia a los metales: desde la dermatitis hasta el fallo de los implantes y dispositivos. Springer. pág. 333. ISBN 978-3-319-58503-1Archivado desde el original el 26 de diciembre de 2019 . Consultado el 23 de julio de 2018 .
- ^ Slanina, P.; French, W.; Ekström, LG; Lööf, L.; Slorach, S.; Cedergren, A. (1986). "El ácido cítrico dietético mejora la absorción de aluminio en antiácidos". Química clínica . 32 (3): 539–541. doi :10.1093/clinchem/32.3.539. PMID 3948402.
- ^ Van Ginkel, MF; Van Der Voet, GB; D'haese, PC; De Broe, ME; De Wolff, FA (1993). "Efecto del ácido cítrico y el maltol en la acumulación de aluminio en el cerebro y el hueso de ratas". The Journal of Laboratory and Clinical Medicine . 121 (3): 453–460. PMID 8445293.
- ^ ab "ARL: Toxicidad del aluminio". www.arltma.com . Archivado desde el original el 31 de agosto de 2019 . Consultado el 24 de julio de 2018 .
- ^ Toxicidad del aluminio Archivado el 3 de febrero de 2014 en Wayback Machine desde NYU Langone Medical Center . Última revisión en noviembre de 2012 por Igor Puzanov, MD
- ^ abc Rosseland, BO; Eldhuset, TD; Staurnes, M. (1990). "Efectos ambientales del aluminio". Geoquímica ambiental y salud . 12 (1–2): 17–27. Bibcode :1990EnvGH..12...17R. doi :10.1007/BF01734045. ISSN 0269-4042. PMID 24202562. S2CID 23714684.
- ^ Baker, Joan P.; Schofield, Carl L. (1982). "Toxicidad del aluminio para peces en aguas ácidas". Contaminación del agua, el aire y el suelo . 18 (1–3): 289–309. Bibcode :1982WASP...18..289B. doi :10.1007/BF02419419. ISSN 0049-6979. S2CID 98363768. Archivado desde el original el 11 de junio de 2021 . Consultado el 27 de diciembre de 2020 .
- ^ Belmonte Pereira, Luciane; Apuntó Tabaldi, Luciane; Fabbrin Gonçalves, Jamile; Jucoski, Gladis Oliveira; Pauletto, Mareni María; Nardin Weis, Simone; Texeira Nicoloso, Fernando; Hermano, Denise; Batista Teixeira Rocha, João; Chitolina Schetinger, María Rosa Chitolina (2006). "Efecto del aluminio sobre la deshidratasa del ácido δ-aminolevulínico (ALA-D) y el desarrollo del pepino ( Cucumis sativus )". Botánica Ambiental y Experimental . 57 (1–2): 106–115. Código Bib : 2006EnvEB..57..106P. doi :10.1016/j.envexpbot.2005.05.004.
- ^ Andersson, Maud (1988). "Toxicidad y tolerancia del aluminio en plantas vasculares". Contaminación del agua, el aire y el suelo . 39 (3–4): 439–462. Bibcode :1988WASP...39..439A. doi :10.1007/BF00279487. S2CID 82896081. Archivado desde el original el 28 de febrero de 2020 . Consultado el 28 de febrero de 2020 .
- ^ Horst, Walter J. (1995). "El papel del apoplasto en la toxicidad del aluminio y la resistencia de las plantas superiores: una revisión". Zeitschrift für Pflanzenernährung und Bodenkunde . 158 (5): 419–428. doi :10.1002/jpln.19951580503.
- ^ Ma, Jian Feng; Ryan, PR; Delhaize, E. (2001). "Tolerancia al aluminio en plantas y el papel complejante de los ácidos orgánicos". Tendencias en la ciencia de las plantas . 6 (6): 273–278. Bibcode :2001TPS.....6..273M. doi :10.1016/S1360-1385(01)01961-6. PMID 11378470.
- ^ Magalhaes, JV; Garvin, DF; Wang, Y.; Sorrells, ME; Klein, PE; Schaffert, RE; Li, L.; Kochian, LV (2004). "Mapeo comparativo de un importante gen de tolerancia al aluminio en el sorgo y otras especies de Poaceae". Genética . 167 (4): 1905–1914. doi :10.1534/genetics.103.023580. PMC 1471010 . PMID 15342528.
- ^ "Contaminación y falta de combustible en el sistema". Duncan Aviation. 2011. Archivado desde el original el 25 de febrero de 2015.
- ^ Romero, Elvira; Ferreira, Patricia; Martínez, Ángel T.; Jesús Martínez, María (abril de 2009). "Nueva oxidasa del anamorfo artroconidial de Bjerkandera que oxida alcoholes bencílicos tanto fenólicos como no fenólicos". Biochimica et Biophysica Acta (BBA) - Proteínas y Proteómica . Proteínas y Proteómica 1794 (4): 689–697. doi :10.1016/j.bbapap.2008.11.013. PMID 19110079.
Los autores aislaron
un hongo artroconidial tipo
Geotrichum de un disco compacto deteriorado encontrado en Belice (América Central)....En el presente artículo, informamos sobre la purificación y caracterización de una oxidasa extracelular generadora de H
2
O
2
producida por este hongo, que comparte propiedades catalíticas con
P. eryngii
AAO y
P. simplicissimum
VAO.
Véase también el resumen de Romero et al. 2007.
- ^ Bosch, Xavier (27 de junio de 2001). «Fungus eats CD». Nature : news010628–11. doi :10.1038/news010628-11. Archivado desde el original el 31 de diciembre de 2010.
- ^ Garcia-Guinea, Javier; Cárdenes, Victor; Martínez, Angel T.; Jesús Martínez, Maria (2001). "Caminos de bioturbación fúngica en un disco compacto". Comunicación breve. Naturwissenschaften . 88 (8): 351–354. Bibcode :2001NW.....88..351G. doi :10.1007/s001140100249. PMID 11572018. S2CID 7599290.
- ^ Romero, Elvira; Esperanza, Mariela; García-Guinea, Javier; Martínez, Ángel T.; Jesús Martínez, María (8 de agosto de 2007). Antes, Bernard (ed.). "Un anamorfo del hongo de pudrición blanca Bjerkandera adusta capaz de colonizar y degradar los componentes del disco compacto". FEMS Microbiol Lett . 275 (1). Blackwell Publishing Ltd.: 122-129. doi : 10.1111/j.1574-6968.2007.00876.x . hdl : 10261/47650 . PMID 17854471.
- ^ Sheridan, JE; Nelson, Jan; Tan, YL "Estudios sobre el "hongo del queroseno" Cladosporium resinae (Lindau) De Vries: Parte I. El problema de la contaminación microbiana de los combustibles de aviación". Tuatara . 19 (1): 29. Archivado desde el original el 13 de diciembre de 2013.
Bibliografía
- Davis, JR (1999). Corrosión del aluminio y sus aleaciones. ASM International. ISBN 978-1-61503-238-9.
- Dean, JA (1999). Manual de química de Lange (15.ª ed.). McGraw-Hill. ISBN 978-0-07-016384-3.OCLC 40213725 .
- Drozdov, A. (2007). Aluminio: el decimotercer elemento . Biblioteca RUSAL . ISBN 978-5-91523-002-5.
- Greenwood, NN ; Earnshaw, A. (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- King, RB (1995). Química inorgánica de los elementos de los grupos principales . Wiley-VCH. ISBN 978-0-471-18602-1.
- Lide, DR, ed. (2004). Manual de química y física (84.ª ed.). CRC Press . ISBN 978-0-8493-0566-5.
- Nappi, C. (2013). La industria mundial del aluminio a 40 años de 1972 (PDF) (Informe). Instituto Internacional del Aluminio. Archivado (PDF) del original el 9 de octubre de 2022.
- Richards, JW (1896). Aluminio: su historia, aparición, propiedades, metalurgia y aplicaciones, incluidas sus aleaciones (3.ª ed.). Henry Carey Baird & Co.
- Schmitz, C. (2006). Manual de reciclaje de aluminio. Vulkan-Verlag GmbH. ISBN 978-3-8027-2936-2.
Lectura adicional
- Mimi Sheller, El sueño del aluminio: la creación de la modernidad ligera . Cambridge, Mass.: Massachusetts Institute of Technology Press, 2014.
Enlaces externos
- El aluminio en la tabla periódica de vídeos (Universidad de Nottingham)
- Perfil toxicológico del aluminio (PDF) (septiembre de 2008): informe de 357 páginas del Departamento de Salud y Servicios Humanos de los Estados Unidos , Servicio de Salud Pública, Agencia para Sustancias Tóxicas y Registro de Enfermedades
- Entrada sobre aluminio (última revisión el 30 de octubre de 2019) en la Guía de bolsillo de NIOSH sobre peligros químicos publicada por el Instituto Nacional de Seguridad y Salud Ocupacional de los CDC
- Precios actuales e históricos (1998-presente) de futuros de aluminio en el mercado mundial de materias primas
- El cortometraje Aluminio está disponible para su visualización y descarga gratuita en Internet Archive .







