Motor molecular

Los motores moleculares son máquinas moleculares naturales (biológicas) o artificiales que son los agentes esenciales del movimiento en los organismos vivos. En términos generales, un motor es un dispositivo que consume energía en una forma y la convierte en movimiento o trabajo mecánico ; por ejemplo, muchos motores moleculares basados en proteínas aprovechan la energía libre química liberada por la hidrólisis del ATP para realizar trabajo mecánico. [1] En términos de eficiencia energética, este tipo de motor puede ser superior a los motores artificiales disponibles actualmente. Una diferencia importante entre los motores moleculares y los motores macroscópicos es que los motores moleculares funcionan en el baño térmico , un entorno en el que las fluctuaciones debidas al ruido térmico son significativas.
Ejemplos
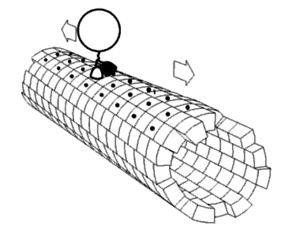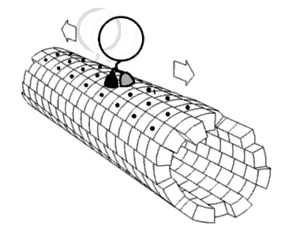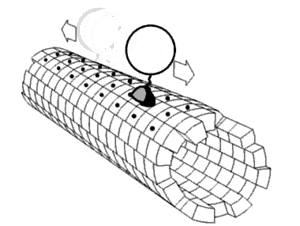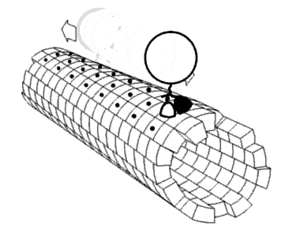
Algunos ejemplos de motores moleculares biológicamente importantes: [2]
- Motores del citoesqueleto
- Las miosinas son responsables de la contracción muscular, del transporte de carga intracelular y de la producción de tensión celular.
- La kinesina mueve la carga dentro de las células lejos del núcleo a lo largo de los microtúbulos , en el transporte anterógrado .
- La dineína produce el movimiento axonemal de los cilios y flagelos y también transporta carga a lo largo de los microtúbulos hacia el núcleo celular, en transporte retrógrado .
- Motores de polimerización
- La polimerización de actina genera fuerzas y puede utilizarse para propulsión. Se utiliza ATP .
- Polimerización de microtúbulos utilizando GTP .
- La dinamina es responsable de la separación de las yemas de clatrina de la membrana plasmática. Se utiliza GTP .
- Motores rotativos:
- La familia de proteínas F o F 1 -ATP sintasa convierte la energía química del ATP en energía potencial electroquímica de un gradiente de protones a través de una membrana o viceversa. La catálisis de la reacción química y el movimiento de protones están acoplados entre sí a través de la rotación mecánica de partes del complejo. Esto está involucrado en la síntesis de ATP en las mitocondrias y los cloroplastos , así como en el bombeo de protones a través de la membrana vacuolar . [3]
- El flagelo bacteriano responsable de la natación y volteretas de E. coli y otras bacterias actúa como una hélice rígida impulsada por un motor rotatorio. Este motor es impulsado por el flujo de protones a través de una membrana, posiblemente utilizando un mecanismo similar al que se encuentra en el motor F o de la ATP sintasa.

- Motores de ácidos nucleicos:
- La ARN polimerasa transcribe el ARN a partir de una plantilla de ADN . [5]
- La ADN polimerasa convierte el ADN monocatenario en ADN bicatenario. [6]
- Las helicasas separan las cadenas dobles de ácidos nucleicos antes de la transcripción o replicación. Se utiliza ATP .
- Las topoisomerasas reducen el superenrollamiento del ADN en la célula. Se utiliza ATP .
- Los complejos RSC y SWI/SNF remodelan la cromatina en células eucariotas. Se utiliza ATP .
- Proteínas SMC responsables de la condensación cromosómica en células eucariotas. [7]
- Los motores de empaquetamiento del ADN viral inyectan ADN genómico viral en las cápsides como parte de su ciclo de replicación, comprimiéndolo muy fuertemente. [8] Se han propuesto varios modelos para explicar cómo la proteína genera la fuerza necesaria para impulsar el ADN hacia la cápside. Una propuesta alternativa es que, a diferencia de todos los demás motores biológicos, la fuerza no es generada directamente por la proteína, sino por el propio ADN. [9] En este modelo, la hidrólisis de ATP se utiliza para impulsar cambios conformacionales de la proteína que alternativamente deshidratan y rehidratan el ADN, impulsándolo cíclicamente del B-ADN al A-ADN y viceversa. El A-ADN es un 23% más corto que el B-ADN, y el ciclo de contracción/expansión del ADN está acoplado a un ciclo de agarre/liberación de proteína-ADN para generar el movimiento hacia adelante que impulsa el ADN hacia la cápside.
- Motores enzimáticos: Se ha demostrado que las enzimas que se indican a continuación se difunden más rápido en presencia de sus sustratos catalíticos, lo que se conoce como difusión mejorada. También se ha demostrado que se mueven direccionalmente en un gradiente de sus sustratos, lo que se conoce como quimiotaxis . Sus mecanismos de difusión y quimiotaxis aún se debaten. Los posibles mecanismos incluyen la flotabilidad solutal, la foresis o los cambios conformacionales que conducen a un cambio en la difusividad efectiva [10] [11] [12] y la asimetría cinética. [13]
- Catalasa
- Ureasa
- Aldolasa
- Hexoquinasa
- Fosfoglucosa isomerasa
- Fosfofructoquinasa
- Glucosa oxidasa
Un estudio reciente también ha demostrado que ciertas enzimas, como la hexoquinasa y la glucosa oxidasa, se agregan o fragmentan durante la catálisis, lo que modifica su tamaño hidrodinámico, lo que puede afectar a las mediciones de difusión mejoradas. [14]
- Los químicos han creado motores moleculares sintéticos que producen rotación, posiblemente generando torque. [15]
Transporte de orgánulos y vesículas
Existen dos familias principales de motores moleculares que transportan orgánulos por toda la célula. Estas familias incluyen la familia de las dineínas y la familia de las kinesinas. Ambas tienen estructuras muy diferentes entre sí y diferentes formas de lograr un objetivo similar de mover orgánulos por la célula. Estas distancias, aunque son de solo unos pocos micrómetros, están planificadas previamente utilizando microtúbulos. [16]
- Kinesina : estos motores moleculares siempre se mueven hacia el extremo positivo de la célula.
- Utiliza la hidrólisis de ATP durante el proceso de conversión de ATP a ADP.
- Este proceso consiste en...
- El "pie" del motor se une con ATP, el "pie" avanza un paso y luego se desprende ADP. Esto se repite hasta que se alcanza el destino.
- Este proceso consiste en...
- La familia de las kinesinas consta de una multitud de tipos de motores diferentes.
- Kinesina-1 (convencional)
- Kinesina-2 (heterotrimérica)
- Kinesina-5 (Bipolar)
- Kinesina-13
- Utiliza la hidrólisis de ATP durante el proceso de conversión de ATP a ADP.
- Dineína : estos motores moleculares siempre se mueven hacia el extremo negativo de la célula.
- Utiliza la hidrólisis de ATP durante el proceso de conversión de ATP a ADP.
- A diferencia de la kinesina, la dineína está estructurada de una manera diferente, lo que requiere que tenga diferentes métodos de movimiento.
- Uno de estos métodos incluye el golpe de potencia, que permite que la proteína motora se "arrastre" a lo largo del microtúbulo hasta su ubicación.
- La estructura de la dineína consta de
- Un tallo que contiene
- Una región que se une a la dinactina
- Cadenas intermedias/ligeras que se unirán a la región de enlace de dinactina.
- Adelante
- Un tallo
- Con un dominio que se unirá al microtúbulo
- Un tallo que contiene
- Estos motores moleculares tienden a seguir el camino de los microtúbulos . Esto se debe probablemente a que los microtúbulos surgen del centrosoma y rodean todo el volumen de la célula. Esto, a su vez, crea un "sistema de rieles" de toda la célula y caminos que conducen a sus orgánulos.
Consideraciones teóricas
| Parte de una serie sobre |
| Movimiento microbiano y microrobot |
|---|
 |
| Micronadadores |
| Motores moleculares |
Debido a que los eventos motores son estocásticos , los motores moleculares suelen modelarse con la ecuación de Fokker-Planck o con métodos de Monte Carlo . Estos modelos teóricos son especialmente útiles cuando se trata al motor molecular como un motor browniano .
Observación experimental
En biofísica experimental , la actividad de los motores moleculares se observa con muchos enfoques experimentales diferentes, entre ellos:
- Métodos de fluorescencia: transferencia de energía por resonancia de fluorescencia ( FRET ), espectroscopia de correlación de fluorescencia ( FCS ), fluorescencia de reflexión interna total ( TIRF ).
- Las pinzas magnéticas también pueden ser útiles para el análisis de motores que operan en fragmentos largos de ADN.
- La espectroscopia de eco de espín de neutrones se puede utilizar para observar el movimiento en escalas de tiempo de nanosegundos.
- Las pinzas ópticas (que no deben confundirse con las pinzas moleculares en el contexto) son adecuadas para estudiar motores moleculares debido a sus bajas constantes de resorte.
- Técnicas de dispersión: seguimiento de partículas individuales basado en microscopía de campo oscuro o microscopía de dispersión interferométrica (iSCAT)
- La electrofisiología de moléculas individuales se puede utilizar para medir la dinámica de canales iónicos individuales.
También se utilizan muchas otras técnicas. A medida que se desarrollen nuevas tecnologías y métodos, se espera que el conocimiento de los motores moleculares naturales sea útil para construir motores sintéticos a escala nanométrica.
No biológico
Recientemente, los químicos y aquellos involucrados en la nanotecnología han comenzado a explorar la posibilidad de crear motores moleculares de novo. [17] Estos motores moleculares sintéticos actualmente sufren muchas limitaciones que confinan su uso al laboratorio de investigación. Sin embargo, muchas de estas limitaciones pueden superarse a medida que aumenta nuestra comprensión de la química y la física a escala nanométrica. Un paso hacia la comprensión de la dinámica a escala nanométrica se dio con el estudio de la difusión del catalizador en el sistema catalizador de Grubb. [18] Otros sistemas como los nanocoches , aunque técnicamente no son motores, también son ilustrativos de los esfuerzos recientes hacia los motores sintéticos a escala nanométrica.
Otras moléculas que no reaccionan también pueden comportarse como motores. Esto se ha demostrado utilizando moléculas de colorante que se mueven direccionalmente en gradientes de solución de polímero a través de interacciones hidrofóbicas favorables. [19] Otro estudio reciente ha demostrado que las moléculas de colorante, las partículas coloidales duras y blandas pueden moverse a través de gradientes de solución de polímero a través de efectos de volumen excluidos. [20]
Véase también
- Motor browniano
- Trinquete browniano
- Citoesqueleto
- Máquinas moleculares
- Mecánica molecular
- Hélice molecular
- Proteínas motoras
- Nanomotor
- Dinámica de proteínas
- Motores moleculares sintéticos
Referencias
- ^ Bustamante C, Chemla YR, Forde NR, Izhaky D (2004). "Procesos mecánicos en bioquímica". Revista anual de bioquímica . 73 : 705–48. doi :10.1146/annurev.biochem.72.121801.161542. PMID 15189157. S2CID 28061339.
- ^ Nelson P, Radosavljevic M, Bromberg S (2004). Física biológica . Freeman.
- ^ Tsunoda SP, Aggeler R, Yoshida M, Capaldi RA (enero de 2001). "Rotación del oligómero de la subunidad c en la ATP sintasa F1Fo completamente funcional". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 98 (3): 898–902. Bibcode :2001PNAS...98..898T. doi : 10.1073/pnas.031564198 . PMC 14681 . PMID 11158567.
- ^ Palma CA, Björk J, Rao F, Kühne D, Klappenberger F, Barth JV (agosto de 2014). "Dinámica topológica en rotores supramoleculares". Nano Letters . 14 (8): 4461–8. Código Bibliográfico :2014NanoL..14.4461P. doi :10.1021/nl5014162. PMID 25078022.
- ^ Dworkin J, Losick R (octubre de 2002). "¿Ayuda la ARN polimerasa a impulsar la segregación cromosómica en bacterias?". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 99 (22): 14089–94. Bibcode :2002PNAS...9914089D. doi : 10.1073/pnas.182539899 . PMC 137841 . PMID 12384568.
- ^ Hubscher U, Maga G, Spadari S (2002). "ADN polimerasas eucariotas". Revisión anual de bioquímica . 71 : 133–63. doi :10.1146/annurev.biochem.71.090501.150041. PMID 12045093. S2CID 26171993.
- ^ Peterson CL (noviembre de 1994). "La familia SMC: ¿nuevas proteínas motoras para la condensación cromosómica?". Cell . 79 (3): 389–92. doi :10.1016/0092-8674(94)90247-X. PMID 7954805. S2CID 28364947.
- ^ Smith DE, Tans SJ, Smith SB, Grimes S, Anderson DL, Bustamante C (octubre de 2001). "El motor portal phi29 recto del bacteriófago puede empaquetar ADN contra una gran fuerza interna". Nature . 413 (6857): 748–52. Bibcode :2001Natur.413..748S. doi :10.1038/35099581. PMID 11607035. S2CID 4424168.
- ^ Harvey SC (enero de 2015). "La hipótesis del gusano scrunchworm: las transiciones entre el ADN-A y el ADN-B proporcionan la fuerza impulsora para el empaquetamiento del genoma en bacteriófagos de ADN de doble cadena". Journal of Structural Biology . 189 (1): 1–8. doi :10.1016/j.jsb.2014.11.012. PMC 4357361 . PMID 25486612.
- ^ Zhao X, Gentile K, Mohajerani F, Sen A (octubre de 2018). "Impulsando el movimiento con enzimas". Accounts of Chemical Research . 51 (10): 2373–2381. doi :10.1021/acs.accounts.8b00286. PMID 30256612. S2CID 52845451.
- ^ Ghosh S, Somasundar A, Sen A (10 de marzo de 2021). "Enzimas como materia activa". Revisión anual de física de la materia condensada . 12 (1): 177–200. Código Bibliográfico :2021ARCMP..12..177G. doi : 10.1146/annurev-conmatphys-061020-053036 . S2CID 229411011.
- ^ Zhang Y, Hess H (junio de 2019). "Difusión mejorada de enzimas catalíticamente activas". ACS Central Science . 5 (6): 939–948. doi :10.1021/acscentsci.9b00228. PMC 6598160 . PMID 31263753.
- ^ Mandal, Niladri Sekhar; Sen, Ayusman; Astumian, R. Dean (15 de marzo de 2023). "Asimetría cinética versus disipación en la evolución de sistemas químicos ejemplificados por la quimiotaxis de una sola enzima". Revista de la Sociedad Química Estadounidense . 145 (10): 5730–5738. arXiv : 2206.05626 . doi :10.1021/jacs.2c11945. ISSN 0002-7863. PMID 36867055. S2CID 249625518.
- ^ Gentile, Kayla; Bhide, Ashlesha; Kauffman, Joshua; Ghosh, Subhadip; Maiti, Subhabrata; Adair, James; Lee, Tae-Hee; Sen, Ayusman (22 de septiembre de 2021). "Agregación y fragmentación enzimática inducida por especies relevantes para la catálisis". Química física Física química . 23 (36): 20709–20717. Bibcode :2021PCCP...2320709G. doi :10.1039/D1CP02966E. ISSN 1463-9084. PMID 34516596. S2CID 237507756.
- ^ Kay, Euan R.; Leigh, David A.; Zerbetto, Francesco (enero de 2007). "Motores moleculares sintéticos y máquinas mecánicas". Angewandte Chemie International Edition . 46 (1–2): 72–191. doi :10.1002/anie.200504313. PMID 17133632.
- ^ Lodish H, Berk A, Kaiser CA, Krieger M, Bretscher A, Ploegh H, Amon A, Martin KC (2014). Biología celular molecular (8.ª ed.). Nueva York, NY: whfreeman, Macmillan Learning. ISBN 978-1-4641-8339-3.
- ^ Korosec, Chapin S.; Unksov, Ivan N.; Surendiran, Pradheebha; Lyttleton, Roman; Curmi, Paul MG; Angstmann, Christopher N.; Eichhorn, Ralf; Linke, Heiner; Forde, Nancy R. (23 de febrero de 2024). "Motilidad de un motor artificial autónomo basado en proteínas que funciona a través de un principio de puente quemado". Nature Communications . 15 (1511): 1511. Bibcode :2024NatCo..15.1511K. doi :10.1038/s41467-024-45570-y. PMC 10891099 . PMID 38396042.
- ^ Dey KK, Pong FY, Breffke J, Pavlick R, Hatzakis E, Pacheco C, Sen A (enero de 2016). "Acoplamiento dinámico en la escala Ångström". Angewandte Chemie . 55 (3): 1113–7. Bibcode :2016AngCh.128.1125D. doi : 10.1002/ange.201509237 . PMID 26636667.
- ^ Guha R, Mohajerani F, Collins M, Ghosh S, Sen A, Velegol D (noviembre de 2017). "Quimiotaxis de colorantes moleculares en gradientes de polímeros en solución". Revista de la Sociedad Química Estadounidense . 139 (44): 15588–15591. doi :10.1021/jacs.7b08783. PMID 29064685.
- ^ Collins M, Mohajerani F, Ghosh S, Guha R, Lee TH, Butler PJ, et al. (agosto de 2019). "El hacinamiento no uniforme mejora el transporte". ACS Nano . 13 (8): 8946–8956. doi :10.1021/acsnano.9b02811. PMID 31291087. S2CID 195879481.
Enlaces externos
- MBInfo - Actividad motora molecular
- MBInfo - Transporte intracelular dependiente del citoesqueleto
- Cymobase: una base de datos con información sobre secuencias de proteínas motoras y del citoesqueleto
- Jonathan Howard (2001), Mecánica de las proteínas motoras y el citoesqueleto. ISBN 9780878933334
