Alcohol isopropílico
| |||
 | |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido Propan-2-ol [2] | |||
| Otros nombres | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| 635639 | |||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.000.601 | ||
| 1464 | |||
| BARRIL | |||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
| Número de la ONU | 1219 | ||
Panel de control CompTox ( EPA ) |
| ||
| |||
| Propiedades | |||
| C3H8O | |||
| Masa molar | 60,096 g/mol | ||
| Apariencia | Líquido incoloro | ||
| Olor | Olor penetrante a alcohol | ||
| Densidad | 0,786 g/cm3 ( 20 °C) | ||
| Punto de fusión | -89 °C (-128 °F; 184 K) | ||
| Punto de ebullición | 82,6 °C (180,7 °F; 355,8 K) | ||
| Miscible con agua | |||
| Solubilidad | Miscible con benceno , cloroformo , etanol , éter dietílico , glicerol ; soluble en acetona. | ||
| registro P | -0,16 [3] | ||
| Acidez (p K a ) | 16.5 [4] | ||
| −45,794·10 −6 cm3 / mol | |||
Índice de refracción ( n D ) | 1.3776 | ||
| Viscosidad | 2,86 cP a 15 °C 1,96 cP a 25 °C [5] 1,77 cP a 30 °C [5] | ||
| 1,66 D (gasolina) | |||
| Farmacología | |||
| D08AX05 ( OMS ) | |||
| Peligros | |||
| Seguridad y salud en el trabajo (SST/OHS): | |||
Principales peligros | Inflamable, ligeramente tóxico [6] | ||
| Etiquetado SGA : | |||
  | |||
| Peligro | |||
| H225 , H302 , H319 , H336 | |||
| P210 , P261 , P305+P351+P338 | |||
| NFPA 704 (rombo cortafuegos) | |||
| punto de inflamabilidad | Vaso abierto: 11,7 °C (53,1 °F; 284,8 K) Vaso cerrado: 13 °C (55 °F) | ||
| 399 °C (750 °F; 672 K) | |||
| Límites de explosividad | 2–12,7% | ||
Valor límite umbral (TLV) | 980 mg/m3 ( promedio ponderado en el tiempo), 1225 mg/m3 ( límite de exposición profesional) | ||
| Dosis o concentración letal (LD, LC): | |||
LD 50 ( dosis media ) |
| ||
LC 50 ( concentración media ) |
| ||
LC Lo ( valor más bajo publicado ) |
| ||
| NIOSH (límites de exposición a la salud en EE. UU.): | |||
PEL (Permisible) | TWA 400 ppm (980 mg/m3 ) [ 7] | ||
REL (recomendado) | TWA 400 ppm (980 mg/m3 ) , ST 500 ppm (1225 mg/m3 ) [ 7] | ||
IDLH (Peligro inmediato) | 2000 ppm [7] | ||
| Ficha de datos de seguridad (FDS) | [1] | ||
| Compuestos relacionados | |||
Alcoholes relacionados | 1-propanol , etanol , 2-butanol | ||
| Página de datos complementarios | |||
| Alcohol isopropílico (página de datos) | |||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
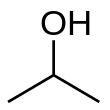
El alcohol isopropílico ( nombre IUPAC propan-2-ol y también llamado isopropanol o 2-propanol ) es un compuesto orgánico incoloro , inflamable , con un olor alcohólico penetrante . [9]
El alcohol isopropílico, una molécula polar orgánica , es miscible en agua, etanol y cloroformo , lo que demuestra su capacidad para disolver una amplia gama de sustancias, incluidas la etilcelulosa , el polivinil butiral , los aceites, los alcaloides y las resinas naturales . En particular, no es miscible con soluciones salinas y se puede separar añadiendo cloruro de sodio en un proceso conocido como salificación . Forma un azeótropo con el agua, lo que da como resultado un punto de ebullición de 80,37 °C y se caracteriza por su sabor ligeramente amargo. El alcohol isopropílico se vuelve viscoso a temperaturas más bajas, congelándose a -89,5 °C, y tiene una absorbancia ultravioleta -visible significativa a 205 nm. Químicamente, se puede oxidar a acetona o sufrir varias reacciones para formar compuestos como isopropóxidos o isopropóxido de aluminio. Como grupo isopropilo unido a un grupo hidroxilo ( fórmula química (CH 3 ) 2 CHOH ) es el ejemplo más simple de un alcohol secundario , donde el átomo de carbono del alcohol está unido a otros dos átomos de carbono. Es un isómero estructural del propan-1-ol y del etil metil éter . Todos ellos tienen la fórmula C 3 H 8 O .
Fue sintetizado por primera vez en 1853 por Alexander William Williamson y luego producido para la preparación de cordita . Se produce a través de la hidratación de propeno o hidrogenación de acetona, con procesos modernos que logran alcohol anhidro a través de destilación azeotrópica . Más allá de su producción, el alcohol isopropílico sirve en entornos médicos como alcohol isopropílico y desinfectante de manos , y en aplicaciones industriales y domésticas como solvente. Es un ingrediente común en productos como antisépticos , desinfectantes y detergentes . Anualmente se producen más de un millón de toneladas en todo el mundo. A pesar de su utilidad, el alcohol isopropílico plantea riesgos de seguridad debido a su inflamabilidad y potencial de formación de peróxido . Su ingestión o absorción conduce a efectos tóxicos que incluyen depresión del sistema nervioso central y coma , tratados principalmente con medidas de apoyo.
Propiedades
El alcohol isopropílico es miscible en agua, etanol y cloroformo , ya que es una molécula polar orgánica . Disuelve etilcelulosa , polivinil butiral , muchos aceites, alcaloides y resinas naturales. [10] A diferencia del etanol o el metanol , el alcohol isopropílico no es miscible con soluciones salinas y se puede separar de las soluciones acuosas añadiendo una sal como el cloruro de sodio . El proceso se denomina coloquialmente "salificación" y hace que el alcohol isopropílico concentrado se separe en una capa distinta. [11]
El alcohol isopropílico forma un azeótropo con el agua, lo que da un punto de ebullición de 80,37 °C (176,67 °F) y una composición de 87,7 % en masa (91 % en volumen) de alcohol isopropílico. Tiene un sabor ligeramente amargo y no es seguro beberlo. [11] [12]
El alcohol isopropílico se vuelve cada vez más viscoso a medida que disminuye la temperatura y se congela a -89,5 °C (-129,1 °F). [9] Las mezclas con agua tienen puntos de congelación más altos: 99 % a -89,5 °C (-129,1 °F), 91 % (el azeótropo) a -75,5 °C (-103,9 °F) y 70 % a -61,7 °C (-79,1 °F). [13]
El alcohol isopropílico tiene una absorbancia máxima a 205 nm en un espectro ultravioleta - visible . [14] [15]
Reacciones
El alcohol isopropílico se puede oxidar a acetona , que es la cetona correspondiente . Esto se puede lograr utilizando agentes oxidantes como el ácido crómico , o mediante la deshidrogenación del alcohol isopropílico sobre un catalizador de cobre calentado :
El alcohol isopropílico se utiliza a menudo como disolvente y fuente de hidruro en la reducción de Meerwein-Ponndorf-Verley y otras reacciones de hidrogenación por transferencia . El alcohol isopropílico se puede convertir en 2-bromopropano utilizando tribromuro de fósforo o deshidratarse a propeno calentándolo con ácido sulfúrico .
Como la mayoría de los alcoholes, el alcohol isopropílico reacciona con metales activos como el potasio para formar alcóxidos que se denominan isopropóxidos . Con el tetracloruro de titanio , el alcohol isopropílico reacciona para dar isopropóxido de titanio :
Esta y otras reacciones similares suelen llevarse a cabo en presencia de una base.
La reacción con el aluminio se inicia con una traza de mercurio para dar isopropóxido de aluminio . [16]
Historia
El químico Alexander William Williamson fue el primero en sintetizar el alcohol isopropílico en 1853. Lo logró calentando una mezcla de propeno y ácido sulfúrico. La Standard Oil produjo alcohol isopropílico hidratando propeno . El alcohol isopropílico se oxidó a acetona para la preparación de cordita , un propulsor sin humo y de baja explosividad . [17]
Producción
En 1994, se produjeron 1,5 millones de toneladas de alcohol isopropílico en los Estados Unidos, Europa y Japón. [18] Se produce principalmente combinando agua y propeno en una reacción de hidratación o hidrogenando acetona . [18] [19] Hay dos rutas para el proceso de hidratación y ambos procesos requieren que el alcohol isopropílico se separe del agua y otros subproductos por destilación . El alcohol isopropílico y el agua forman un azeótropo , y la destilación simple da un material que es 87,9% en masa de alcohol isopropílico y 12,1% en masa de agua. [20] El alcohol isopropílico puro ( anhidro ) se fabrica mediante destilación azeotrópica del alcohol isopropílico húmedo utilizando éter diisopropílico o ciclohexano como agentes azeotrópicos. [18]
Biológico
En la cetoacidosis diabética se producen pequeñas cantidades de alcohol isopropílico en el cuerpo . [21]
Hidratación indirecta
La hidratación indirecta hace reaccionar el propeno con ácido sulfúrico para formar una mezcla de ésteres de sulfato. Este proceso puede utilizar propeno de baja calidad y es predominante en los EE. UU. Estos procesos dan principalmente alcohol isopropílico en lugar de 1-propanol, porque la adición de agua o ácido sulfúrico al propeno sigue la regla de Markovnikov . La hidrólisis posterior de estos ésteres con vapor produce alcohol isopropílico, por destilación. El éter diisopropílico es un subproducto significativo de este proceso; se recicla nuevamente al proceso y se hidroliza para dar el producto deseado. [18]
Hidratación directa
La hidratación directa hace reaccionar el propeno y el agua, ya sea en fase gaseosa o líquida , a altas presiones en presencia de catalizadores ácidos sólidos o soportados. Este tipo de proceso suele requerir propileno de mayor pureza (> 90%). [18] La hidratación directa se utiliza con más frecuencia en Europa.
Hidrogenación de acetona
El alcohol isopropílico se puede preparar mediante la hidrogenación de acetona , pero este enfoque implica un paso adicional en comparación con los métodos anteriores, ya que la acetona normalmente se prepara a partir de propeno a través del proceso de cumeno . [18] El costo del IPA está determinado principalmente por el costo de la materia prima, y esta forma es económica cuando la acetona es más barata que el propileno como subproducto de la producción de fenol (la coexistencia de dos formas en la mayoría de los mercados les permite equilibrar los precios).
Un problema conocido es la formación de MIBK y otros productos de autocondensación. El níquel Raney fue uno de los catalizadores industriales originales; los catalizadores modernos suelen estar soportados por materiales bimetálicos.
Usos

En 1990, se utilizaron 45.000 toneladas métricas de alcohol isopropílico en los Estados Unidos, principalmente como disolvente para revestimientos o para procesos industriales. En ese año, se utilizaron 5.400 toneladas métricas para fines domésticos y en productos de cuidado personal. El alcohol isopropílico es popular en particular para aplicaciones farmacéuticas, [18] debido a su baja toxicidad. Una parte del alcohol isopropílico se utiliza como intermediario químico. El alcohol isopropílico puede convertirse en acetona, pero el proceso del cumeno es más significativo. [18]
Solvente
El alcohol isopropílico disuelve una amplia gama de compuestos no polares . Se evapora rápidamente y los grados disponibles normalmente tienden a no dejar rastros de aceite cuando se utilizan como líquido de limpieza a diferencia de otros disolventes comunes. También es relativamente no tóxico. Por lo tanto, se utiliza ampliamente como disolvente y como líquido de limpieza, especialmente donde hay aceites o residuos a base de aceite que no se limpian fácilmente con agua, evaporándose convenientemente y (dependiendo del contenido de agua y otras variables) presentando un menor riesgo de corrosión u oxidación que el agua simple. Junto con el etanol , el n -butanol y el metanol , pertenece al grupo de disolventes alcohólicos.
El alcohol isopropílico se utiliza comúnmente para limpiar anteojos , contactos eléctricos , cabezales de cintas de audio o video , lentes de DVD y otros discos ópticos , bongs , [22] y para quitar pasta térmica de disipadores de calor en CPU [23] y otros paquetes de circuitos integrados .
Intermedio
El alcohol isopropílico se esterifica para dar acetato de isopropilo , otro disolvente. Reacciona con disulfuro de carbono e hidróxido de sodio para dar isopropilxantato de sodio, que se utiliza como herbicida y reactivo de flotación de minerales . [24] El alcohol isopropílico reacciona con tetracloruro de titanio y aluminio metálico para dar isopropóxidos de titanio y aluminio , respectivamente, el primero un catalizador y el segundo un reactivo químico. [18] Este compuesto puede servir como reactivo químico en sí mismo, al actuar como donante de dihidrógeno en la hidrogenación por transferencia .
Médico
El alcohol isopropílico , el desinfectante de manos y las almohadillas desinfectantes suelen contener una solución de alcohol isopropílico o etanol en agua al 60-70 % . El agua es necesaria para abrir los poros de la membrana bacteriana, que actúa como puerta de entrada para el alcohol isopropílico. Se puede utilizar una solución al 75 % v/v en agua como desinfectante de manos. [25] El alcohol isopropílico se utiliza como ayuda para secar con agua para la prevención de la otitis externa , más conocida como oído de nadador. [26]
El alcohol isopropílico inhalado se puede utilizar para tratar las náuseas en algunos entornos colocando una gasa desinfectante debajo de la nariz. [27]
Usos tempranos como anestésico
Aunque el alcohol isopropílico puede utilizarse para anestesia, sus numerosos atributos negativos o desventajas prohíben su uso. El alcohol isopropílico también puede utilizarse de forma similar al éter como disolvente [28] o como anestésico inhalando los vapores o por vía oral. Los primeros usos incluyeron el uso del disolvente como anestésico general para pequeños mamíferos [29] y roedores por parte de científicos y algunos veterinarios. Sin embargo, pronto se interrumpió, ya que surgieron muchas complicaciones, incluida la irritación respiratoria, hemorragia interna y problemas visuales y auditivos. En casos raros, se observó insuficiencia respiratoria que provocó la muerte de los animales.
Automotor
El alcohol isopropílico es un ingrediente importante en los aditivos de combustible "secadores de gas" . En cantidades significativas, el agua es un problema en los tanques de combustible, ya que se separa de la gasolina y puede congelarse en las líneas de suministro a bajas temperaturas. El alcohol no elimina el agua de la gasolina, pero el alcohol solubiliza el agua en la gasolina. Una vez soluble , el agua no representa el mismo riesgo que el agua insoluble, ya que ya no se acumula en las líneas de suministro y se congela, sino que se disuelve dentro del propio combustible. El alcohol isopropílico se vende a menudo en latas de aerosol como descongelante para parabrisas o cerraduras de puertas. El alcohol isopropílico también se utiliza para eliminar los restos de líquido de frenos de los sistemas de frenado hidráulico, de modo que el líquido de frenos (generalmente DOT 3 , DOT 4 o aceite mineral ) no contamine las pastillas de freno y provoque un frenado deficiente. Las mezclas de alcohol isopropílico y agua también se utilizan comúnmente en el líquido lavaparabrisas casero.
Laboratorio
Como conservante de muestras biológicas, el alcohol isopropílico constituye una alternativa relativamente no tóxica al formaldehído y otros conservantes sintéticos. Para conservar las muestras se utilizan soluciones de alcohol isopropílico al 70-99 %.
El alcohol isopropílico se utiliza a menudo en la extracción de ADN . Un trabajador de laboratorio lo añade a una solución de ADN para precipitar el ADN, que luego forma un gránulo después de la centrifugación. Esto es posible porque el ADN es insoluble en alcohol isopropílico.
Semiconductores
El alcohol isopropílico se utiliza como aditivo en el grabado anisotrópico alcalino de silicio monocristalino , como con hidróxido de potasio o hidróxido de tetrametilamonio . Este proceso se utiliza en la texturización de células solares de silicio y la microfabricación (por ejemplo, en dispositivos MEMS ). El alcohol isopropílico aumenta la anisotropía del grabado al aumentar la tasa de grabado del plano [100] en relación con los planos de índice más alto . [30]
Seguridad
El vapor de alcohol isopropílico es más denso que el aire y es inflamable , con un rango de inflamabilidad de entre el 2% y el 12,7% en el aire. Debe mantenerse alejado del calor, las chispas y las llamas abiertas. [31] Se ha informado que la destilación de alcohol isopropílico sobre magnesio forma peróxidos , que pueden explotar al concentrarse. [32] [33] El alcohol isopropílico puede reaccionar con el aire y el oxígeno con el tiempo para formar peróxidos inestables que pueden explotar. [34]
Toxicología
El alcohol isopropílico, a través de sus metabolitos, es algo más tóxico que el etanol, pero considerablemente menos tóxico que el etilenglicol o el metanol . La muerte por ingestión o absorción incluso de cantidades relativamente grandes es rara. Tanto el alcohol isopropílico como su metabolito , la acetona , actúan como depresores del sistema nervioso central (SNC) . [35] La intoxicación puede ocurrir por ingestión, inhalación o absorción cutánea. [36] Los síntomas de intoxicación por alcohol isopropílico incluyen sofocos , dolor de cabeza , mareos , depresión del SNC , náuseas , vómitos , anestesia , hipotermia , presión arterial baja , shock , depresión respiratoria y coma . [35] Las sobredosis pueden causar un olor afrutado en el aliento como resultado de su metabolismo a acetona . [37] El alcohol isopropílico no causa una acidosis por brecha aniónica , pero produce una brecha osmolal entre las osmolalidades calculadas y medidas del suero, al igual que los otros alcoholes. [35] El hallazgo de acetona sin acidosis conduce a la condición sine qua non de “cetosis sin acidosis”.
El alcohol isopropílico se oxida para formar acetona por acción de la alcohol deshidrogenasa en el hígado [35] y tiene una vida media biológica en humanos de entre 2,5 y 8,0 horas. [35] A diferencia de la intoxicación por metanol o etilenglicol , los metabolitos del alcohol isopropílico son considerablemente menos tóxicos y el tratamiento es en gran medida de apoyo. Además, no hay ninguna indicación para el uso de fomepizol , un inhibidor de la alcohol deshidrogenasa, a menos que se sospeche una ingestión concomitante con metanol o etilenglicol. [38]
En patología forense , las personas que han muerto como resultado de cetoacidosis diabética o cetoacidosis alcohólica , sin ingestión de alcohol isopropílico, suelen tener concentraciones sanguíneas detectables de alcohol isopropílico de 1 a 40 mg/dL, mientras que aquellas por ingestión fatal de alcohol isopropílico suelen tener concentraciones sanguíneas de cientos de mg/dL. [21]
Referencias
- ^ "Reglamento C-201.1 sobre alcoholes". Nomenclatura de la química orgánica (Libro azul de la IUPAC), secciones A, B, C, D, E, F y H. Oxford: Pergamon Press. 1979.
Designaciones como isopropanol, sec-butanol y terc-butanol son incorrectas porque no existen hidrocarburos como isopropano, sec-butano y terc-butano a los que se les pueda añadir el sufijo "-ol"; dichos nombres deberían abandonarse. Sin embargo, el alcohol isopropílico, el alcohol sec-butílico y el alcohol terc-butílico son permisibles (véase el Reglamento C-201.3) porque existen los radicales isopropilo, sec-butilo y terc-butilo.
- ^ Favre, Henri A.; Powell, Warren H. (2014). Nomenclatura de la química orgánica: recomendaciones de la IUPAC y nombres preferidos 2013 (Libro azul) . Cambridge: The Royal Society of Chemistry . pág. 631. doi :10.1039/9781849733069. ISBN . 978-0-85404-182-4.
- ^ "Isopropanol_msds". chemsrc.com. Archivado desde el original el 10 de marzo de 2020. Consultado el 4 de mayo de 2018 .
- ^ Reeve, W.; Erikson, CM; Aluotto, PF (1979). "Un nuevo método para la determinación de las acideces relativas de alcoholes en soluciones alcohólicas. Las nucleofilias y reactividades competitivas de alcóxidos y fenóxidos". Can. J. Chem . 57 (20): 2747–2754. doi : 10.1139/v79-444 .
- ^ ab Yaws, CL (1999). Manual de propiedades químicas . McGraw-Hill . ISBN 978-0-07-073401-2.
- ^ Toxicidad del alcohol isopropílico
- ^ abc Guía de bolsillo del NIOSH sobre peligros químicos. "#0359". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ abcd "Alcohol isopropílico". Concentraciones inmediatamente peligrosas para la vida o la salud (IDLH) . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ ab "Isopropanol". PubChem . Archivado desde el original el 12 de febrero de 2019 . Consultado el 10 de febrero de 2019 .
- ^ Doolittle, Arthur K. (1954). La tecnología de disolventes y plastificantes . Nueva York: John Wiley & Sons, Inc., pág. 628.
- ^ ab El índice Merck (10.ª ed.). Rahway, Nueva Jersey: Merck & Co. 1983. pág. 749. ISBN 9780911910278.
- ^ Logsden, John E.; Loke, Richard A. (1999). "Alcoholes propílicos". En Kroschwitz, Jacqueline I. (ed.). Kirk-Othmer Concise Encyclopedia of Chemical Technology (4.ª ed.). Nueva York: John Wiley & Sons, Inc., págs. 1654-1656. ISBN 978-0-471-41961-7.
- ^ "¿Cuál es el punto de congelación del alcohol isopropílico?". 21 de septiembre de 2023. Consultado el 18 de diciembre de 2023 .
- ^ "Alcohol isopropílico, apto para cromatografía líquida, extracto/espectrofotometría UV". VWR International . Archivado desde el original el 31 de marzo de 2016. Consultado el 25 de agosto de 2014 .
- ^ "UV Cutoff" (PDF) . Universidad de Toronto . Archivado (PDF) del original el 8 de octubre de 2013 . Consultado el 25 de agosto de 2014 .
- ^ Ishihara, K.; Yamamoto, H. (2001). "Isopropóxido de aluminio". Enciclopedia de reactivos para síntesis orgánica . John Wiley & Sons . doi :10.1002/047084289X.ra084. ISBN . 0471936235.
- ^ Wittcoff, MM; Green, HA (2003). Principios de química orgánica y práctica industrial (1.ª ed., 1.ª reimpresión). Weinheim: Wiley-VCH. p. 4. ISBN 978-3-527-30289-5.
- ^ abcdefghi Papa, AJ "Propanols". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a22_173. ISBN 978-3527306732.
- ^ Logsdon, John E.; Loke, Richard A. (4 de diciembre de 2000). "Alcohol isopropílico". Enciclopedia Kirk-Othmer de tecnología química . Enciclopedia Kirk-Othmer de tecnología química . John Wiley & Sons. doi :10.1002/0471238961.0919151612150719.a01. ISBN 978-0471238966.
- ^ Manual CRC de química y física , 44.ª ed., págs. 2143–2184.
- ^ ab Petersen, Thomas H.; Williams, Timoteo; Nuwayhid, Naziha; Harruff, Richard (2012). "Detección post mortem de isopropanol en cetoacidosis". Revista de Ciencias Forenses . 57 (3): 674–678. doi :10.1111/j.1556-4029.2011.02045.x. ISSN 0022-1198. PMID 22268588. S2CID 21101240.
- ^ Directo-Meston, Danielle (9 de febrero de 2021). «Cómo limpiar correctamente tu bong, según los expertos en cannabis». Rolling Stone . Consultado el 31 de marzo de 2024 .
- ^ Método de aplicación de Intel arcticsilver.com
- ^ "Sodium Isopropyl Xanthate, SIPX, Xanthate". 3DChem.com. Archivado desde el original el 4 de mayo de 2012. Consultado el 17 de junio de 2012 .
- ^ "Guía de producción local: fórmulas recomendadas por la OMS para la desinfección de manos" (PDF) . Organización Mundial de la Salud. Agosto de 2009. Archivado (PDF) desde el original el 19 de mayo de 2009 . Consultado el 5 de octubre de 2020 .
- ^ Otitis externa (oído del nadador). Facultad de Medicina de Wisconsin.
- ^ Lindblad, Adrienne J.; Ting, Rhonda; Harris, Kevin (agosto de 2018). "Alcohol isopropílico inhalado para náuseas y vómitos en el servicio de urgencias". Canadian Family Physician . 64 (8): 580. ISSN 1715-5258. PMC 6189884 . PMID 30108075.
- ^ Burlage, Henry M.; Welch, H.; Price, CW (2006). "Aplicaciones farmacéuticas del alcohol isopropílico II. Solubilidades de los anestésicos locales". Revista de la Asociación Farmacéutica Estadounidense . 36 (1): 17–19. doi :10.1002/jps.3030360105. PMID 20285822.
- ^ Society for Experimental Biology and Medicine (1922). Actas de la Society for Experimental Biology and Medicine, Volumen 19. pág. 85. Archivado desde el original el 20 de diciembre de 2021. Consultado el 24 de septiembre de 2016 .
- ^ Zubel, Irena; Kramkowska, Małgorzata (30 de octubre de 2002). "El efecto de los aditivos alcohólicos sobre las características de grabado en soluciones de KOH". Sensores y Actuadores A: Físicos . 101 (3): 255–261. doi :10.1016/S0924-4247(02)00265-0. ISSN 0924-4247.
- ^ "Isopropanol". Sigma-Aldrich. 19 de enero de 2012. Archivado desde el original el 17 de enero de 2021. Consultado el 6 de julio de 2012 .
- ^ Mirafzal, Gholam A.; Baumgarten, Henry E. (1988). "Control de compuestos peroxidables: una adenda". Revista de educación química . 65 (9): A226. Código Bibliográfico :1988JChEd..65A.226M. doi :10.1021/ed065pA226.
- ^ "Seguridad química: formación de peróxido en 2-propanol". Chemical & Engineering News . 94 (31): 2. 1 de agosto de 2016. Archivado desde el original el 7 de noviembre de 2017 . Consultado el 2 de noviembre de 2017 .
- ^ "Hoja informativa sobre sustancias peligrosas" (PDF) . Sitio oficial del estado de Nueva Jersey . Consultado el 4 de noviembre de 2023 .
- ^ abcde Slaughter RJ, Mason RW, Beasley DM, Vale JA, Schep LJ (2014). "Intoxicación por isopropanol". Toxicología clínica . 52 (5): 470–8. doi :10.3109/15563650.2014.914527. PMID 24815348. S2CID 30223646.
- ^ Chavez, Andrew R.; Sweeney, Michael; Akpunonu, Peter (14 de diciembre de 2021). "Un caso de intoxicación involuntaria por isopropanol mediante absorción transdérmica retrasada por hemodiálisis semanal". The American Journal of Case Reports . 22 : e934529. doi :10.12659/AJCR.934529. ISSN 1941-5923. PMC 8689373 . PMID 34905533.
- ^ Kalapos, MP (2003). "Sobre el metabolismo de la acetona en mamíferos: de la química a las implicaciones clínicas". Biochimica et Biophysica Acta (BBA) - Temas generales . 1621 (2): 122–39. doi :10.1016/S0304-4165(03)00051-5. PMID 12726989.
- ^ "Intoxicación por alcohol isopropílico". uptodate.com . Archivado desde el original el 10 de octubre de 2017. Consultado el 10 de octubre de 2017 .
Enlaces externos
- CDC – Guía de bolsillo de NIOSH sobre peligros químicos: alcohol isopropílico
- Criterios de salud ambiental 103: 2-propanol