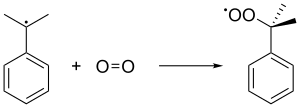Proceso de cumeno


El proceso cumeno ( proceso cumeno-fenol , proceso Hock ) es un proceso industrial para sintetizar fenol y acetona a partir de benceno y propileno . El término proviene del cumeno (isopropilbenceno), el material intermedio durante el proceso. Fue inventado por R. Ūdris y P. Sergeyev en 1942 (URSS), [1] e independientemente por Heinrich Hock en 1944. [2] [3]
Este proceso convierte dos materias primas relativamente baratas, el benceno y el propileno , en otras dos más valiosas, el fenol y la acetona . Otros reactivos necesarios son el oxígeno del aire y pequeñas cantidades de un iniciador de radicales . La mayor parte de la producción mundial de fenol y acetona se basa ahora en este método. En 2022, se produjeron casi 10,8 millones de toneladas de fenol mediante el proceso del cumeno. [4] Para que este proceso sea económico, también debe haber demanda del subproducto acetona , además del fenol . [5]
Pasos del proceso
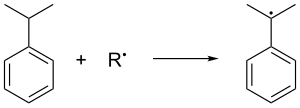
El cumeno se forma en la alquilación de Friedel-Crafts en fase gaseosa del benceno con propeno. El benceno y el propeno se comprimen juntos a una presión de 30 atmósferas estándar a 250 °C en presencia de un ácido de Lewis catalítico . El ácido fosfórico suele preferirse a los haluros de aluminio . El cumeno se oxida en el aire, lo que elimina el hidrógeno bencílico terciario del cumeno y, por lo tanto, forma un radical cumeno :
El radical cumeno se une entonces a una molécula de oxígeno para formar el radical peróxido de cumeno , que a su vez forma hidroperóxido de cumeno (C 6 H 5 C(CH 3 ) 2 O 2 H) mediante la abstracción de un hidrógeno bencílico de otra molécula de cumeno. Este último cumeno se convierte en radical cumeno y retroalimenta las formaciones de cadenas subsiguientes de hidroperóxidos de cumeno. Se utiliza una presión de 5 atm para garantizar que el peróxido inestable se mantenga en estado líquido.
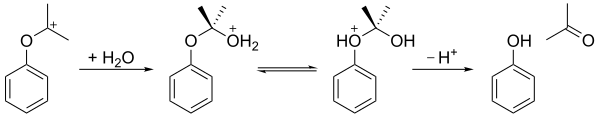
El hidroperóxido de cumeno sufre una reacción de reordenamiento en un medio ácido ( reordenamiento de Hock ) para dar fenol y acetona . En el primer paso, se protona el átomo de oxígeno terminal del hidroperóxido. A esto le sigue un paso en el que el grupo fenilo migra del carbono bencílico al oxígeno adyacente y se pierde una molécula de agua, produciendo un carbocatión terciario estabilizado por resonancia . El mecanismo concertado de este paso es similar a los mecanismos de la oxidación de Baeyer-Villiger [6] y las reacciones de reordenamiento de Criegee , y también al paso de oxidación del proceso de hidroboración-oxidación . [7] En 2009, se demostró que una arcilla bentonita acidificada era un catalizador más económico que el ácido sulfúrico como medio ácido.
El carbocatión resultante es atacado por el agua y forma una estructura similar a la de un hemiacetal . Después de transferir un protón del oxígeno del hidroxilo al oxígeno del éter, el ion se descompone en fenol y acetona.
Reacciones y modificaciones relacionadas
Alternativas a la coproducción de acetona
El ciclohexilbenceno puede reemplazar al isopropilbenceno. A través de la transposición de Hock, el hidroperóxido de ciclohexilbenceno se escinde para dar fenol y ciclohexanona . La ciclohexanona es un precursor importante de algunos nailones . [8]
A partir de la alquilación del benceno con una mezcla de 1 y 2-butenos , el proceso del cumeno produce fenol y butanonas . [5]
Alternativas a la producción de fenol
- La hidroquinona se prepara por dialquilación de benceno con propeno para dar 1,4-diisopropilbenceno . Este compuesto reacciona con el aire para dar bis(hidroperóxido). De manera análoga al comportamiento del hidroperóxido de cumeno , se reorganiza en ácido para dar acetona e hidroquinona. La oxidación de la hidroquinona da 1,4-benzoquinona: [9]
- El resorcinol se prepara de manera análoga convirtiendo el 1,3-diisopropilbenceno en bis(hidroperóxido), que se fragmenta en resorcinol y acetona. [10]
- El 2-naftol también se puede producir mediante un método análogo al proceso del cumeno. [11]
- El 3-clorofenol , que no surge por cloración del fenol, se puede producir mediante el proceso de cumeno comenzando con la alquilación de clorobenceno con propileno. [12]
- Los cresoles se producen a partir de isopropiltolueno. [13]
Procesamiento de acetona
La acetona cruda se hidrogena en fase líquida sobre níquel Raney o una mezcla de óxido de cobre y cromo para producir alcohol isopropílico . Este proceso es útil cuando se combina con una producción excesiva de acetona. [14] Mitsui & Co. desarrolló pasos adicionales para hidrogenar la acetona y deshidratar el producto de isopropanol a propeno, que se recicla como reactivo de partida. [5]
Subproductos
Los subproductos del proceso de cumeno para producir fenol y acetona son acetofenona y alfa-metilestireno .
Véase también
- Bisfenol A
- Proceso Dow (fenol)
- Alquilación de Friedel Crafts
- Oxidación de Baeyer-Villiger
- Proceso Raschig-Hooker (también produce fenol)
Referencias
- ^ "Letón". Archivado desde el original el 3 de marzo de 2016. Consultado el 27 de febrero de 2011 .
- ^ Hock, H. y Lang, S. (1944), Autooxidación von Kohlenwasserstoffen, IX. Mitteil.: Über Peroxyde von Benzol-Dirivaten. Berichte der deutschen chemischen Gesellschaft (Series A y B), 77: 257–264 doi :10.1002/cber.19440770321
- ^ Enciclopedia concisa de química (1993) Mary Eagleso
- ^ "Tamaño, participación, análisis y pronóstico del mercado de fenol, 2035 – ChemAnalyst". ChemAnalyst . Consultado el 9 de abril de 2024 .
- ^ abc "Rutas directas al fenol". Archivado desde el original el 9 de abril de 2007. Consultado el 26 de diciembre de 2006 .
- ^ Streitwieser, A; Heathcock, CH (1992). "30". Introducción a la química orgánica . Kosower, EM (4.ª ed.). Nueva York: MacMillan. pp. 1018. ISBN. 0-02-418170-6.
- ^ KPC, Vollhardt; NE Schore (2003). "22". Química orgánica: estructura y función (4.ª ed.). Nueva York: Freeman. pág. 988. ISBN 0-7167-4374-4.
- ^ Plotkin, Jeffrey S. (21 de marzo de 2016). "¿Qué hay de nuevo en la producción de fenol?". Sociedad Química Estadounidense. Archivado desde el original el 27 de octubre de 2019. Consultado el 2 de enero de 2018 .
- ^ Gerhard Franz, Roger A. Sheldon "Oxidación" en Ullmann's Encyclopedia of Industrial Chemistry , Wiley-VCH, Weinheim, 2000 doi :10.1002/14356007.a18_261
- ^ KW Schmiedel; D. Decker (2012). "Resorcinol". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a23_111.pub2. ISBN 978-3527306732.
- ^ Gerald Booth "Derivados de naftaleno" en Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. doi :10.1002/14356007.a17_009.
- ^ François Muller; Liliane Caillard (2011). "Clorofenoles". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a07_001.pub2. ISBN 978-3527306732.
- ^ Roger A. Sheldon (1983). Patai, Saul (ed.). Síntesis y usos de hidroperóxidos y dialquilperóxidos . Química de grupos funcionales de PATAI. John Wiley & Sons. doi :10.1002/9780470771730.ch6.
- ^ Papa, AJ "Propanols". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a22_173. ISBN 978-3527306732.
Enlaces externos
- Fenol - La industria química esencial en línea