Cloruro de aluminio
 Tricloruro de aluminio hexahidratado, puro (arriba) y contaminado con cloruro de hierro (III) (abajo) | |||
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC Cloruro de aluminio | |||
| Otros nombres Cloruro de aluminio (III) Tricloruro de aluminio Tricloroaluminio | |||
| Identificadores | |||
Modelo 3D ( JSmol ) | |||
| EBICh | |||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.028.371 | ||
| Número CE |
| ||
| 1876 | |||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
Panel de control CompTox ( EPA ) |
| ||
| |||
| Propiedades | |||
| AlCl3 | |||
| Masa molar |
| ||
| Apariencia | Cristales incoloros, higroscópicos. | ||
| Densidad |
| ||
| Punto de fusión |
| ||
| |||
| Solubilidad |
| ||
| Presión de vapor |
| ||
| Viscosidad |
| ||
| Estructura | |||
| Monoclínico , mS16 | |||
| C12/m1, n.º 12 [3] | |||
a = 0,591 nm, b = 0,591 nm, c = 1,752 nm [3] | |||
Volumen reticular ( V ) | 0,52996 nm 3 | ||
Unidades de fórmula ( Z ) | 6 | ||
| Octaédrico (sólido) Tetraédrico (líquido) | |||
| Planar trigonal ( vapor monomérico ) | |||
| Termoquímica | |||
Capacidad calorífica ( C ) | 91,1 J/(mol·K) [4] | ||
Entropía molar estándar ( S ⦵ 298 ) | 109,3 J/(mol·K) [4] | ||
Entalpía estándar de formación (Δ f H ⦵ 298 ) | −704,2 kJ/mol [4] | ||
Energía libre de Gibbs (Δ f G ⦵ ) | −628,8 kJ/mol [4] | ||
| Farmacología | |||
| D10AX01 ( OMS ) | |||
| Peligros | |||
| Etiquetado SGA : [6] | |||
 | |||
| Peligro | |||
| H314 | |||
| P260 , P280 , P301+P330+P331 , P303+P361+P353 , P305+P351+P338+P310 , P310 | |||
| NFPA 704 (rombo cortafuegos) | |||
| Dosis o concentración letal (LD, LC): | |||
LD 50 ( dosis media ) | 380 mg/kg, rata (oral, anhidro) 3311 mg/kg, rata (oral, hexahidrato) | ||
| NIOSH (límites de exposición a la salud en EE. UU.): | |||
PEL (Permisible) | Ninguno [5] | ||
REL (recomendado) | 2 mg/m3 [ 5] | ||
IDLH (Peligro inmediato) | En Dakota del Norte [5] | ||
| Compuestos relacionados | |||
Otros aniones | |||
Otros cationes | |||
Ácidos de Lewis relacionados | |||
| Página de datos complementarios | |||
| Cloruro de aluminio (página de datos) | |||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
| Datos clínicos | |
|---|---|
| AHFS / Drogas.com | Monografía |
| Datos de licencia |
|
| Vías de administración | Actual |
| Código ATC |
|
| Identificadores | |
| Panel de control CompTox ( EPA ) |
|
| Tarjeta informativa de la ECHA | 100.028.371 |
| Página de datos | |
| Cloruro de aluminio (página de datos) | |
El cloruro de aluminio , también conocido como tricloruro de aluminio , es un compuesto inorgánico con la fórmula AlCl 3 . Forma un hexahidrato con la fórmula [Al(H 2 O) 6 ]Cl 3 , que contiene seis moléculas de agua de hidratación . Tanto la forma anhidra como el hexahidrato son cristales incoloros, pero las muestras a menudo están contaminadas con cloruro de hierro (III) , lo que les da un color amarillo.
La forma anhidra es importante desde el punto de vista comercial. Tiene un punto de fusión y ebullición bajo. Se produce y consume principalmente en la producción de aluminio, pero también se utilizan grandes cantidades en otras áreas de la industria química. [7] El compuesto se cita a menudo como un ácido de Lewis . Es un ejemplo de un compuesto inorgánico que cambia reversiblemente de un polímero a un monómero a temperatura suave.
Estructura

Anhidro
AlCl 3 adopta tres estructuras, dependiendo de la temperatura y el estado (sólido, líquido, gas). El AlCl 3 sólido tiene una estructura en capas similar a una lámina con iones de cloruro cúbicos empaquetados. En este marco, los centros de Al exhiben una geometría de coordinación octaédrica . [8] El cloruro de itrio (III) adopta la misma estructura, al igual que una variedad de otros compuestos. Cuando el tricloruro de aluminio está en su estado fundido, existe como el dímero Al 2 Cl 6 , con aluminio tetracoordinado . Este cambio en la estructura está relacionado con la menor densidad de la fase líquida (1,78 g/cm 3 ) frente al tricloruro de aluminio sólido (2,48 g/cm 3 ). Los dímeros de Al 2 Cl 6 también se encuentran en la fase de vapor . A temperaturas más altas, los dímeros de Al 2 Cl 6 se disocian en el monómero AlCl 3 trigonal planar , que es estructuralmente análogo al BF 3 . El metal fundido conduce mal la electricidad , [9] a diferencia de los haluros más iónicos como el cloruro de sodio .
El monómero de cloruro de aluminio pertenece al grupo puntual D 3h en su forma monomérica y D 2h en su forma dimérica.
Hexahidrato
El hexahidrato consta de centros catiónicos octaédricos [Al(H 2 O) 6 ] 3+ y aniones cloruro ( Cl − ) como contraiones . Los enlaces de hidrógeno unen el catión y los aniones. [10] La forma hidratada del cloruro de aluminio tiene una geometría molecular octaédrica, con el ion aluminio central rodeado por seis moléculas de ligando de agua . Al estar saturado de manera coordinada, el hidrato tiene poco valor como catalizador en la alquilación de Friedel-Crafts y reacciones relacionadas.
Usos
Alquilación y acilación de arenos
El AlCl 3 es un catalizador ácido de Lewis común para las reacciones de Friedel-Crafts , tanto acilaciones como alquilaciones. [11] Los productos importantes son los detergentes y el etilbenceno . Estos tipos de reacciones son el principal uso del cloruro de aluminio, por ejemplo, en la preparación de antraquinona (utilizada en la industria de los colorantes ) a partir de benceno y fosgeno . [9] En la reacción general de Friedel-Crafts, un cloruro de acilo o un haluro de alquilo reacciona con un sistema aromático como se muestra: [11]
La reacción de alquilación se utiliza más ampliamente que la reacción de acilación , aunque su práctica es más exigente técnicamente. Para ambas reacciones, el cloruro de aluminio, así como otros materiales y el equipo, deben estar secos, aunque es necesario un rastro de humedad para que la reacción se lleve a cabo. [12] Existen procedimientos detallados disponibles para la alquilación [13] y la acilación [14] [15] de arenos.
Un problema general de la reacción de Friedel-Crafts es que a veces se requiere el catalizador de cloruro de aluminio en cantidades estequiométricas completas, porque forma complejos fuertemente con los productos. Esta complicación a veces genera una gran cantidad de desechos corrosivos . Por estas y otras razones similares, el uso de cloruro de aluminio a menudo ha sido reemplazado por zeolitas . [7]
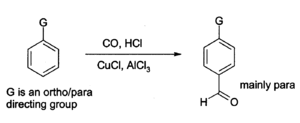
El cloruro de aluminio también se puede utilizar para introducir grupos aldehído en anillos aromáticos , por ejemplo a través de la reacción de Gattermann-Koch que utiliza monóxido de carbono , cloruro de hidrógeno y un cocatalizador de cloruro de cobre (I) . [16]
Otras aplicaciones en síntesis orgánica y organometálica
El cloruro de aluminio encuentra una amplia variedad de otras aplicaciones en la química orgánica . [17] Por ejemplo, puede catalizar la reacción eno , como la adición de 3-buten-2-ona (metil vinil cetona) a carvona : [18]
Se utiliza para inducir una variedad de acoplamientos y reordenamientos de hidrocarburos. [19] [20]
El cloruro de aluminio combinado con aluminio en presencia de un areno se puede utilizar para sintetizar complejos metálicos de bis(areno), por ejemplo, bis(benceno)cromo , a partir de ciertos haluros metálicos mediante la síntesis de Fischer-Hafner . La diclorofenilfosfina se prepara mediante la reacción de benceno y tricloruro de fósforo catalizada por cloruro de aluminio. [21]
Médico
El cloruro de aluminio hexahidratado tópico se utiliza para el tratamiento de la hiperhidrosis (sudoración excesiva). [22] [23] [24]
Reacciones
El cloruro de aluminio anhidro es un potente ácido de Lewis , capaz de formar aductos ácido-base de Lewis incluso con bases de Lewis débiles como la benzofenona y el mesitileno . [11] Forma tetracloroaluminato ( [AlCl 4 ] − ) en presencia de iones cloruro .
El cloruro de aluminio reacciona con hidruros de calcio y magnesio en tetrahidrofurano formando tetrahidroaluminatos. [ cita requerida ]
Reacciones con agua
El cloruro de aluminio anhidro es higroscópico y tiene una afinidad muy pronunciada por el agua. Emite humo en el aire húmedo y silba cuando se mezcla con agua líquida, ya que los ligandos Cl − se desplazan con moléculas de H 2 O para formar el hexahidrato [Al(H 2 O) 6 ]Cl 3 . La fase anhidra no se puede recuperar al calentar el hexahidrato. En cambio, se pierde HCl y queda hidróxido de aluminio o alúmina (óxido de aluminio):
- [Al(H2O ) 6 ] Cl3 → Al( OH ) 3 + 3 HCl + 3 H2O
Al igual que los complejos acuosos metálicos , el AlCl3 acuoso es ácido debido a la ionización de los ligandos acuosos :
- [Al(H 2 O) 6 ] 3+ ⇌ [Al(OH)(H 2 O) 5 ] 2+ + H +
Las soluciones acuosas se comportan de manera similar a otras sales de aluminio que contienen iones Al 3+ hidratados , dando un precipitado gelatinoso de hidróxido de aluminio al reaccionar con hidróxido de sodio diluido :
- AlCl 3 + 3 NaOH → Al(OH) 3 + 3 NaCl
Síntesis
El cloruro de aluminio se fabrica a gran escala mediante la reacción exotérmica del metal de aluminio con cloro o cloruro de hidrógeno a temperaturas entre 650 y 750 °C (1202 y 1382 °F). [9]
- 2Al + 3Cl2 → 2AlCl3
- 2Al + 6HCl → 2AlCl3 + 3H2
El cloruro de aluminio se puede formar a través de una única reacción de desplazamiento entre el cloruro de cobre (II) y el aluminio.
- 2 Al + 3 CuCl 2 → 2 AlCl 3 + 3 Cu
En Estados Unidos en 1993 se produjeron aproximadamente 21.000 toneladas, sin contar las cantidades consumidas en la producción de aluminio. [7]
El tricloruro de aluminio hidratado se prepara disolviendo óxidos de aluminio en ácido clorhídrico . El aluminio metálico también se disuelve fácilmente en ácido clorhídrico, liberando gas hidrógeno y generando un calor considerable. Calentar este sólido no produce tricloruro de aluminio anhidro, el hexahidrato se descompone en hidróxido de aluminio cuando se calienta:
- [Al(H2O ) 6 ] Cl3 → Al( OH ) 3 + 3 HCl + 3 H2O
El aluminio también forma un cloruro inferior , el cloruro de aluminio (I) (AlCl), pero es muy inestable y sólo se presenta en fase de vapor. [9]
Ocurrencia natural
El cloruro de aluminio anhidro no se encuentra como mineral. Sin embargo, el hexahidrato se conoce como cloraluminita, un mineral poco común. [25] Un mineral de cloruro de aluminio más complejo, básico e hidratado es la cadwaladerita . [26] [25]
Seguridad
El AlCl3 anhidro reacciona vigorosamente con las bases , por lo que se requieren precauciones adecuadas. Puede causar irritación en los ojos, la piel y el sistema respiratorio si se inhala o entra en contacto. [27]
Véase también
Referencias
- ^ abcd Haynes WM, ed. (2011). Manual de química y física del CRC (92.ª edición). Boca Raton, FL: CRC Press . pág. 4.45. ISBN 1-4398-5511-0.
- ^ ab "Propiedades de la sustancia: Cloruro de aluminio". Chemister.ru . 2007-03-19. Archivado desde el original el 2014-05-05 . Consultado el 2017-03-17 .
- ^ ab Ketelaar JA (1935). "Die Kristallstruktur der Aluminiumhalogenide II". Zeitschrift für Kristallographie – Materiales cristalinos . 90 (1–6): 237–255. doi :10.1524/zkri.1935.90.1.237. S2CID 100796636.
- ^ abcd Haynes WM, ed. (2011). Manual de química y física del CRC (92.ª edición). Boca Raton, FL: CRC Press . pág. 5.5. ISBN 1-4398-5511-0.
- ^ abc Guía de bolsillo del NIOSH sobre peligros químicos. "#0024". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ Sigma-Aldrich Co. , Cloruro de aluminio.
- ^ abc Helmboldt O, Keith Hudson L, Misra C, Wefers K, Heck W, Stark H, et al. (2007). "Compuestos de aluminio inorgánicos". Ullmann's Encyclopedia of Industrial Chemistry . Weinheim: Wiley-VCH. doi :10.1002/14356007.a01_527.pub2. ISBN 978-3527306732.
- ^ Wells AF (1984). Química inorgánica estructural . Oxford , Reino Unido.: Oxford Press. ISBN 0198553706
Por el contrario,
elAlBr
3
tiene una estructura más molecular, con los centros
Al
3+
ocupando agujeros tetraédricos adyacentes del marco compacto de iones
Br
−
.
- ^ abcd Greenwood NN , Earnshaw A (1984). Química de los elementos. Oxford: Pergamon Press . ISBN 978-0-08-022057-4.
- ^ Andress KR, Carpintero C (1934). "Kristallhidrato II. Die Struktur von Chromchlorid- und Aluminiumchloridhexahidrato". Zeitschrift für Kristallographie – Materiales cristalinos . 87 . doi :10.1524/zkri.1934.87.1.446. S2CID 263857074.
- ^ abc Olah GA, ed. (1963). Friedel-Crafts y reacciones relacionadas . Vol. 1. Ciudad de Nueva York: Interscience.
- ^ Nenitzescu CD, Cantuniari IP (1933). "Durch Aluminiumchlorid Katalysierte Reaktion, VI. Mitteil.: Die Umlagerung des Cyclohexans in Metyl-cyclopentan". Berichte der Deutschen Chemischen Gesellschaft (Series A y B) . 66 (8): 1097-1100. doi :10.1002/cber.19330660817. ISSN 1099-0682.
- ^ Reeves JT, Tan Z, Fandrick DR, Song JJ, Yee NK, Senanayake CH (2012). "Síntesis de trifluorometilcetonas a partir de ácidos carboxílicos: 4-(3,4-dibromofenil)-1,1,1-trifluoro-4-metilpentan-2-ona". Organic Syntheses . 89 : 210. doi : 10.15227/orgsyn.089.0210 .
- ^ Paruch K, Vyklicky L, Katz TJ (2003). "Preparación de 9,10-dimetoxifenantreno y 3,6-diacetil-9,10-dimetoxifenantreno". Organic Syntheses . 80 : 227. doi :10.15227/orgsyn.080.0227.
- ^ Seed AJ, Sonpatki V, Herbert MR (2002). "Ácido 3-(4-bromobenzoil)propanoico". Síntesis orgánicas . 79 : 204. doi :10.15227/orgsyn.079.0204.
- ^ Wade LG (2003). Química orgánica (5.ª ed.). Upper Saddle River, Nueva Jersey : Prentice Hall . ISBN 013033832X.
- ^ Galatsis P (1999). "Cloruro de aluminio". En Reich HJ, Rigby JH (eds.). Reactivos ácidos y básicos . Manual de reactivos para síntesis orgánica. Ciudad de Nueva York : Wiley . págs. 12-15. ISBN. 978-0-471-97925-8.
- ^ Snider BB (1980). "Reacciones de eno catalizadas por ácido de Lewis". Acc. Chem. Res. 13 (11): 426. doi :10.1021/ar50155a007.
- ^ Rieke RD, Bales SE, Hudnall PM, Burns TP, Poindexter GS (1979). "Magnesio altamente reactivo para la preparación de reactivos de Grignard: ácido 1-norbornanocarboxílico". Organic Syntheses . 59 : 85. doi :10.15227/orgsyn.059.0085.
- ^ Shama SA, Wamser CC (1983). "Hexametil Dewar Benzene". Síntesis orgánicas . 61 : 62. doi :10.15227/orgsyn.061.0062.
- ^ Buchner B, Lockhart Jr LB (1951). "Fenildiclorofosfina". Síntesis orgánicas . 31 : 88. doi :10.15227/orgsyn.031.0088.
- ^ McConaghy JR, Fosselman D (junio de 2018). "Hiperhidrosis: opciones de tratamiento". American Family Physician . 97 (11): 729–734. PMID 30215934.
- ^ Nawrocki S, Cha J (septiembre de 2019). "La etiología, el diagnóstico y el tratamiento de la hiperhidrosis: una revisión exhaustiva: opciones terapéuticas". Revista de la Academia Estadounidense de Dermatología . 81 (3): 669–680. doi :10.1016/j.jaad.2018.11.066. PMID 30710603.
- ^ "Cloruro de aluminio (tópico) (monografía)". Sociedad Estadounidense de Farmacéuticos del Sistema de Salud (ASHP) . drugs.com.
- ^ ab "Lista de minerales". www.ima-mineralogy.org . Asociación Mineralógica Internacional . 21 de marzo de 2011.
- ^ "Cadwaladerita". www.mindat.org .
- ^ Cloruro de aluminio. solvaychemicals.us
Enlaces externos
- Ficha internacional de seguridad química 1125
- Índice de procedimientos de síntesis orgánica que utilizan AlCl3
- Los cloruros del periodo 3
- MSDS Archivado el 22 de julio de 2011 en Wayback Machine.
- Hojas informativas y preguntas frecuentes del Gobierno de Canadá: Sales de aluminio