Mesitileno
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido 1,3,5-Trimetilbenceno [1] | |||
| Otros nombres Mesitileno [1] sim -Trimetilbenceno | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| EBICh | |||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.003.278 | ||
| Número CE |
| ||
| BARRIL | |||
Identificador de centro de PubChem |
| ||
| UNIVERSIDAD | |||
| Número de la ONU | 2325 | ||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| C9H12 | |||
| Masa molar | 120,19 g/mol | ||
| Apariencia | Líquido incoloro [2] | ||
| Olor | Distintivo, aromático [2] | ||
| Densidad | 0,8637 g/cm3 a 20 °C | ||
| Punto de fusión | -44,8 °C (-48,6 °F; 228,3 K) | ||
| Punto de ebullición | 164,7 °C (328,5 °F; 437,8 K) | ||
| 0,002 % (20 °C) [2] | |||
| Presión de vapor | 2 mmHg (20 °C) [2] | ||
| -92,32·10 −6 cm3 / mol | |||
| Estructura | |||
| 0,047 D [3] | |||
| Peligros | |||
| punto de inflamabilidad | 50 °C; 122 °F; 323 K [2] | ||
| NIOSH (límites de exposición a la salud en EE. UU.): | |||
PEL (Permisible) | ninguno [2] | ||
REL (recomendado) | TWA 25 ppm (125 mg/m3 ) [ 2] | ||
IDLH (Peligro inmediato) | Dakota del Norte [2] | ||
| Ficha de datos de seguridad (FDS) | [1] | ||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El mesitileno o 1,3,5-trimetilbenceno es un derivado del benceno con tres sustituyentes metilo colocados simétricamente alrededor del anillo. Los otros dos trimetilbencenos isoméricos son el 1,2,4-trimetilbenceno (pseudocumeno) y el 1,2,3-trimetilbenceno (hemimeliteno). Los tres compuestos tienen la fórmula C 6 H 3 (CH 3 ) 3 , que comúnmente se abrevia C 6 H 3 Me 3 . El mesitileno es un líquido incoloro con un olor aromático dulce. Es un componente del alquitrán de hulla , que es su fuente tradicional. Es un precursor de diversos productos químicos finos . El grupo mesitilo (Mes) es un sustituyente con la fórmula C 6 H 2 Me 3 y se encuentra en varios otros compuestos. [4]
Preparación
El mesitileno se prepara mediante transalquilación de xileno sobre un catalizador ácido sólido : [4]
- 2C6H4 ( CH3 ) 2 ⇌ C6H3 ( CH3 ) 3 + C6H5CH3
- C6H4 ( CH3 ) 2 + CH3OH → C6H3 ( CH3 ) 3 + H2O
Aunque no es práctico, se podría preparar mediante trimerización de propino , que también requiere un catalizador ácido , y produce una mezcla de 1,3,5- y 1,2,4-trimetilbencenos.
La trimerización de acetona a través de condensación aldólica , que es catalizada y deshidratada por ácido sulfúrico , es otro método de sintetizar mesitileno. [5]
Reacciones
La oxidación del mesitileno con ácido nítrico produce ácido trimésico , C 6 H 3 (COOH) 3 . Utilizando dióxido de manganeso , un agente oxidante más suave , se forma 3,5-dimetil benzaldehído . El mesitileno se oxida con ácido trifluoroperacético para producir mesitol (2,4,6-trimetilfenol). [6] La bromación se produce fácilmente, dando bromuro de mesitilo : [7]
- ( CH3 ) 3C6H3 + Br2 → ( CH3 ) 3C6H2Br + HBr
El mesitileno es un ligando en la química organometálica , un ejemplo es el complejo de organomolibdeno [( η6 - C6H3Me3 ) Mo(CO) 3 ] [ 8] que se puede preparar a partir de hexacarbonilo de molibdeno .
Aplicaciones
El mesitileno se utiliza principalmente como precursor de la 2,4,6-trimetilanilina , un precursor de los colorantes. Este derivado se prepara mediante mononitración selectiva del mesitileno, evitando la oxidación de los grupos metilo. [9]
Usos de nicho
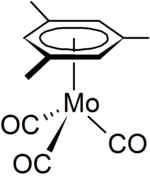
El mesitileno se utiliza en el laboratorio como disolvente especial. En la industria electrónica, el mesitileno se ha utilizado como revelador para siliconas fotomodelables debido a sus propiedades disolventes.
Los tres átomos de hidrógeno aromático del mesitileno se encuentran en entornos de desplazamiento químico idénticos. Por lo tanto, solo dan un único pico cerca de 6,8 ppm en el espectro de RMN de 1 H ; lo mismo sucede con los nueve protones de metilo , que dan un singlete cerca de 2,3 ppm. Por este motivo, el mesitileno se utiliza a veces como estándar interno en muestras de RMN que contienen protones aromáticos. [10]
El ácido uvítico se obtiene oxidando el mesitileno o condensando el ácido pirúvico con agua de barita . [11]
La reacción de Gattermann se puede simplificar reemplazando la combinación HCN/AlCl 3 por cianuro de cinc (Zn(CN) 2 ). [12] Aunque es altamente tóxico, el Zn(CN) 2 es un sólido, lo que lo hace más seguro para trabajar que el cianuro de hidrógeno gaseoso (HCN). [13] El Zn(CN) 2 reacciona con el HCl para formar el reactivo clave HCN y ZnCl 2 que sirve como catalizador de ácido de Lewis in situ . Un ejemplo del método Zn(CN) 2 es la síntesis de mesitaldehído a partir de mesitileno. [14]
Historia
El mesitileno fue preparado por primera vez en 1837 por Robert Kane , un químico irlandés, calentando acetona con ácido sulfúrico concentrado. [15] Llamó a su nueva sustancia "mesitileno" porque el químico alemán Carl Reichenbach había llamado a la acetona "mesit" (del griego μεσίτης, el mediador), [16] y Kane creía que su reacción había deshidratado el mesit, convirtiéndolo en un alqueno , "mesitileno". [17] Sin embargo, la determinación de Kane de la composición química ("fórmula empírica") del mesitileno era incorrecta. La fórmula empírica correcta fue proporcionada por August W. von Hofmann en 1849. [18] En 1866 Adolf von Baeyer dio una fórmula empírica correcta del mesitileno; sin embargo, con una estructura incorrecta de tetraciclo[3.1.1.1 1, 3.1 3,5 ]nonano. [19] Una prueba concluyente de que el mesitileno era trimetilbenceno fue proporcionada por Albert Ladenburg en 1874; sin embargo, se asumió una estructura de benceno incorrecta del prismano . [20]
- Estructuras históricas del mesitileno
- Mesitileno de Adolf von Baeyer (tetraciclo[3.1.1.1 1, 3.1 3,5 ]nonano)
- Mesitileno de Albert Ladenburg (1,2,6-trimetilprismano)
Grupo mesitilo
El grupo (CH 3 ) 3 C 6 H 2 - se llama mesitilo (símbolo de grupo orgánico: Mes). Los derivados de mesitilo, por ejemplo tetramesitilo hierro , se preparan típicamente a partir del reactivo de Grignard (CH 3 ) 3 C 6 H 2 MgBr. [21] Debido a su gran demanda estérica, el grupo mesitilo se utiliza como un gran grupo de bloqueo en catálisis asimétrica (para mejorar la diastereo- o enantioselectividad) y química organometálica (para estabilizar centros metálicos de bajo estado de oxidación o bajo número de coordinación). Análogos más grandes con una demanda estérica aún mayor, por ejemplo 2,6-diisopropilfenilo (Dipp) y los grupos análogamente nombrados Tripp (( i Pr) 3 C 6 H 2 , Is) y supermesitilo (( t Bu) 3 C 6 H 2 , Mes*), pueden ser incluso más efectivos para lograr estos objetivos.
Seguridad y medio ambiente
El mesitileno es también un importante compuesto orgánico volátil (COV) urbano que resulta de la combustión . Desempeña un papel importante en la formación de aerosoles y ozono troposférico , así como en otras reacciones de la química atmosférica . [ cita requerida ]
Referencias
- ^ ab Nomenclatura de la química orgánica: recomendaciones de la IUPAC y nombres preferidos 2013 (Libro azul) . Cambridge: The Royal Society of Chemistry . 2014. pág. 139. doi :10.1039/9781849733069-FP001. ISBN . 978-0-85404-182-4.
- ^ abcdefgh Guía de bolsillo del NIOSH sobre peligros químicos. "#0639". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ Zhao, Jun; Zhang, Renyi (2004). "Constantes de velocidad de reacción de transferencia de protones entre el ion hidronio (H 3 O + ) y compuestos orgánicos volátiles". Atmospheric Environment . 38 (14): 2177–2185. Bibcode :2004AtmEn..38.2177Z. doi :10.1016/j.atmosenv.2004.01.019.
- ^ ab Karl Griesbaum, Arno Behr, Dieter Biedenkapp, Heinz-Werner Voges, Dorothea Garbe, Christian Paetz, Gerd Collin, Dieter Mayer, Hartmut Höke “Hidrocarburos” en la Enciclopedia de química industrial de Ullmann 2002 Wiley-VCH, Weinheim. doi :10.1002/14356007.a13_227.
- ^ Cumming, WM (1937). Química orgánica sistemática (3E). Nueva York, EE. UU.: D. Van Nostrand Company. pág. 57.
- ^ Chambers, Richard D. (2004). "Compuestos funcionales que contienen oxígeno, azufre o nitrógeno y sus derivados". El flúor en la química orgánica . CRC Press . pp. 242–243. ISBN 9780849317903.
- ^ Lee Irvin Smith (1931). "Bromomesitileno". Org. Synth . 11 : 24. doi :10.15227/orgsyn.011.0024.
- ^ Girolami, GS ; Rauchfuss, TB y Angelici, RJ , Síntesis y técnica en química inorgánica, University Science Books: Mill Valley, CA, 1999. ISBN 0-93570248-2 .
- ^ Gerald Booth (2007). "Compuestos nitro, aromáticos". Ullmann's Encyclopedia of Industrial Chemistry . Weinheim: Wiley-VCH. doi :10.1002/14356007.a17_411. ISBN 978-3527306732.
- ^ "Mesitileno (1,3,5-trimetilbenceno)".
- ^ "Definición de ácido uvítico". merriam-webster.com . Consultado el 31 de octubre de 2016 .
- ^ Adams R. ; Levine, I. (1923). "Simplificación de la síntesis de Gattermann de hidroxialdehídos". J. Am. Chem. Soc. 45 (10): 2373–77. doi :10.1021/ja01663a020.
- ^ Adams, Roger (1957). Reacciones orgánicas, volumen 9. Nueva York: John Wiley & Sons, Inc., págs. 38 y 53-54. doi :10.1002/0471264180.or009.02. ISBN 9780471007265.
- ^ Fuson, RC; Horning, EC; Rowland, SP; Ward, ML (1955). "Mesitaldehído". Síntesis orgánicas . doi :10.15227/orgsyn.023.0057; Volúmenes recopilados , vol. 3, pág. 549.
- ^ Robert Kane (1839) "Sobre una serie de combinaciones derivadas del alcohol piroacético [acetona]" Transactions of the Royal Irish Academy , vol. 18, páginas 99–125.
- ^ La investigación de Reichenbach está extraída en: C. Reichenbach (1834) "Ueber Mesit (Essiggeist) und Holzgeist" (Sobre mesit (aguardiente de vinagre) y aguardiente de madera), Annalen der Pharmacie , vol. 10, núm. 3, páginas 298–314.
- ^ Para una explicación del nombre original "mesitileno", véase también: Henry E. Roscoe, A Treatise on Chemistry (Nueva York, Nueva York: D. Appleton and Co., 1889), vol. III, página 102, nota al pie 2.
- ^ AW Hofmann (1849) "Sobre la composición del mesitilol [mesitileno] y algunos de sus derivados", The Quarterly Journal of the Chemical Society of London , vol. 2, páginas 104-115. (Nota: La fórmula empírica del mesitileno que se indica en el artículo de Hofmann (C 18 H 12 ) es incorrecta; sin embargo, esto sucedió porque Hofmann utilizó 6 como el peso atómico del carbono, en lugar del peso atómico correcto de 12. Una vez que se utiliza el peso atómico correcto en los cálculos de Hofmann, sus resultados dan la fórmula empírica correcta de C 9 H 12 .)
- ^ Adolf von Baeyer (1866) "Ueber die Condensationsproducte des Acetons" (Sobre los productos de condensación de acetona), Annalen der Chemie und Pharmacie , vol. 140, páginas 297–306.
- ^ Albert Ladenburg (1874) "Ueber das Mesitylen" (Sobre el mesityleno), Berichte der deutschen chemischen Gesellschaft , vol. 7, páginas 1133–1137. doi :10.1002/cber.18740070261
- ^ Lee Irvin Smith (1931). "Isodureno". Org. Sintetizador . 11 : 66. doi : 10.15227/orgsyn.011.0066.





![Mesitileno de Adolf von Baeyer (tetraciclo[3.1.1.11,3.13,5]nonano)](http://upload.wikimedia.org/wikipedia/commons/thumb/0/0e/Mesitylen_by_Adolf_von_Baeyer.png/260px-Mesitylen_by_Adolf_von_Baeyer.png)
