Metabolismo de los ácidos grasos
El metabolismo de los ácidos grasos consiste en varios procesos metabólicos que involucran o están estrechamente relacionados con los ácidos grasos , una familia de moléculas clasificadas dentro de la categoría de macronutrientes lipídicos . Estos procesos se pueden dividir principalmente en (1) procesos catabólicos que generan energía y (2) procesos anabólicos donde sirven como bloques de construcción para otros compuestos. [1]
En el catabolismo, los ácidos grasos se metabolizan para producir energía, principalmente en forma de trifosfato de adenosina (ATP). En comparación con otras clases de macronutrientes (carbohidratos y proteínas), los ácidos grasos producen la mayor cantidad de ATP en términos de energía por gramo cuando se oxidan completamente a CO2 y agua mediante la betaoxidación y el ciclo del ácido cítrico . [2] Por lo tanto, los ácidos grasos (principalmente en forma de triglicéridos ) son la principal forma de almacenamiento de combustible en la mayoría de los animales y, en menor medida, en las plantas.
En el anabolismo, los ácidos grasos intactos son precursores importantes de los triglicéridos, fosfolípidos, segundos mensajeros, hormonas y cuerpos cetónicos . Por ejemplo, los fosfolípidos forman las bicapas de fosfolípidos a partir de las cuales se construyen todas las membranas de la célula a partir de ácidos grasos. Los fosfolípidos comprenden la membrana plasmática y otras membranas que encierran todos los orgánulos dentro de las células, como el núcleo , las mitocondrias , el retículo endoplasmático y el aparato de Golgi . En otro tipo de anabolismo, los ácidos grasos se modifican para formar otros compuestos como segundos mensajeros y hormonas locales . Las prostaglandinas hechas de ácido araquidónico almacenado en la membrana celular son probablemente las más conocidas de estas hormonas locales.
Catabolismo de los ácidos grasos




Los ácidos grasos se almacenan en forma de triglicéridos en los depósitos de grasa del tejido adiposo . Entre comidas se liberan de la siguiente manera:
- La lipólisis , la eliminación de las cadenas de ácidos grasos del glicerol al que están unidas en su forma de almacenamiento como triglicéridos (o grasas), la llevan a cabo las lipasas . Estas lipasas se activan por los altos niveles de epinefrina y glucagón en la sangre (o norepinefrina secretada por los nervios simpáticos en el tejido adiposo), causados por la disminución de los niveles de glucosa en sangre después de las comidas, lo que simultáneamente reduce el nivel de insulina en la sangre. [1]
- Una vez liberados del glicerol , los ácidos grasos libres entran en la sangre, que los transporta, unidos a la albúmina plasmática , por todo el cuerpo. [4]
- Los ácidos grasos libres de cadena larga ingresan a las células metabolizadoras (es decir, la mayoría de las células vivas del cuerpo excepto los glóbulos rojos y las neuronas del sistema nervioso central ) a través de proteínas de transporte específicas , como la proteína de transporte de ácidos grasos de la familia SLC27 . [5] [6] Los glóbulos rojos no contienen mitocondrias y, por lo tanto, son incapaces de metabolizar los ácidos grasos; los tejidos del sistema nervioso central no pueden utilizar los ácidos grasos, a pesar de contener mitocondrias, porque los ácidos grasos de cadena larga (a diferencia de los ácidos grasos de cadena media [7] [8] ) no pueden cruzar la barrera hematoencefálica [9] hacia los fluidos intersticiales que bañan estas células.
- Una vez dentro de la célula, la ligasa de ácidos grasos de cadena larga-CoA cataliza la reacción entre una molécula de ácido graso con ATP (que se descompone en AMP y pirofosfato inorgánico) para dar un acil-adenilato graso, que luego reacciona con la coenzima A libre para dar una molécula de acil-CoA graso .
- Para que el acil-CoA entre en la mitocondria se utiliza la lanzadera de carnitina: [10] [11] [12]
- El acil-CoA es transferido al grupo hidroxilo de la carnitina por la carnitina palmitoiltransferasa I , ubicada en las caras citosólicas de las membranas mitocondriales externas e internas .
- La acil-carnitina es transportada hacia el interior por una translocasa carnitina-acilcarnitina , al igual que una carnitina es transportada hacia el exterior.
- La acil-carnitina se convierte nuevamente en acil-CoA por acción de la carnitina palmitoiltransferasa II , ubicada en la cara interna de la membrana mitocondrial . La carnitina liberada se transporta nuevamente al citosol, al igual que la acil-CoA se transporta hacia la matriz mitocondrial.
- La beta oxidación , en la matriz mitocondrial, corta entonces las largas cadenas carbonadas de los ácidos grasos (en forma de moléculas de acil-CoA) en una serie de unidades de dos carbonos ( acetato ), que, combinadas con la coenzima A , forman moléculas de acetil CoA , que se condensan con oxaloacetato para formar citrato en el "inicio" del ciclo del ácido cítrico . [2] Es conveniente pensar en esta reacción como la que marca el "punto de partida" del ciclo, ya que es cuando se añade combustible -acetil-CoA- al ciclo, que se disipará como CO2 y H2O con la liberación de una cantidad sustancial de energía capturada en forma de ATP , durante el curso de cada vuelta del ciclo y la posterior fosforilación oxidativa .
- Brevemente, los pasos de la beta oxidación son los siguientes: [2]
- Deshidrogenación por la acil-CoA deshidrogenasa , produciendo 1 FADH 2
- Hidratación por enoil-CoA hidratasa
- Deshidrogenación por la 3-hidroxiacil-CoA deshidrogenasa , produciendo 1 NADH + H +
- Escisión por tiolasa , produciendo 1 acetil-CoA y un ácido graso que ahora se ha acortado en 2 carbonos (formando un nuevo acil-CoA acortado )
- Esta reacción de beta oxidación se repite hasta que el ácido graso se haya reducido completamente a acetil-CoA o, en el caso de ácidos grasos con un número impar de átomos de carbono, acetil-CoA y 1 molécula de propionil-CoA por molécula de ácido graso. Cada corte beta oxidativo de la molécula de acil-CoA produce finalmente 5 moléculas de ATP en la fosforilación oxidativa. [13] [14]
- El acetil-CoA producido por la beta oxidación entra en el ciclo del ácido cítrico en la mitocondria al combinarse con oxaloacetato para formar citrato . Acoplado a la fosforilación oxidativa, esto da como resultado la combustión completa del acetil-CoA a CO2 y agua. La energía liberada en este proceso se captura en forma de 1 molécula de GTP y 11 moléculas de ATP por molécula de acetil-CoA oxidada. [2] [10] Este es el destino del acetil-CoA dondequiera que ocurra la beta oxidación de ácidos grasos, excepto bajo ciertas circunstancias en el hígado .
- El propionil-CoA se convierte luego en succinil-CoA a través de la propionil-CoA carboxilasa dependiente de biotina (PCC) y la metilmalonil-CoA mutasa dependiente de vitamina B 12 (MCM), secuencialmente. [15] [16] El succinil-CoA se convierte primero en malato y luego en piruvato, donde luego se transporta a la matriz para ingresar al ciclo del ácido cítrico.
En el hígado, el oxaloacetato puede desviarse total o parcialmente hacia la vía gluconeogénica durante el ayuno, la inanición, una dieta baja en carbohidratos, el ejercicio extenuante prolongado y en la diabetes mellitus tipo 1 no controlada . En estas circunstancias, el oxaloacetato se hidrogena a malato , que luego se elimina de las mitocondrias de las células hepáticas para convertirse en glucosa en el citoplasma de las células hepáticas, desde donde se libera a la sangre. [10] Por lo tanto, en el hígado, el oxaloacetato no está disponible para la condensación con acetil-CoA cuando la gluconeogénesis significativa ha sido estimulada por concentraciones bajas (o ausentes) de insulina y altas de glucagón en la sangre. En estas condiciones, el acetil-CoA se desvía hacia la formación de acetoacetato y beta-hidroxibutirato . [10] El acetoacetato, el beta-hidroxibutirato y su producto de degradación espontánea, la acetona , se conocen con frecuencia, aunque de forma confusa, como cuerpos cetónicos (ya que no son "cuerpos" en absoluto, sino sustancias químicas solubles en agua). Las cetonas son liberadas por el hígado a la sangre. Todas las células con mitocondrias pueden captar cetonas de la sangre y reconvertirlas en acetil-CoA, que luego puede usarse como combustible en sus ciclos de ácido cítrico, ya que ningún otro tejido puede desviar su oxaloacetato hacia la vía gluconeogénica de la forma en que esto puede ocurrir en el hígado. A diferencia de los ácidos grasos libres, las cetonas pueden atravesar la barrera hematoencefálica y, por lo tanto, están disponibles como combustible para las células del sistema nervioso central , actuando como un sustituto de la glucosa, con la que estas células normalmente sobreviven. [10] La aparición de altos niveles de cetonas en la sangre durante la inanición, una dieta baja en carbohidratos, ejercicio intenso prolongado o diabetes mellitus tipo 1 no controlada se conoce como cetosis y, en su forma extrema, en la diabetes mellitus tipo 1 fuera de control, como cetoacidosis .
- El glicerol liberado por la acción de la lipasa es fosforilado por la glicerol quinasa en el hígado (el único tejido en el que puede ocurrir esta reacción), y el glicerol 3-fosfato resultante se oxida a dihidroxiacetona fosfato . La enzima glucolítica triosa fosfato isomerasa convierte este compuesto en gliceraldehído 3-fosfato , que se oxida mediante glucólisis o se convierte en glucosa mediante gluconeogénesis .
Los ácidos grasos como fuente de energía

Los ácidos grasos, almacenados como triglicéridos en un organismo, son una fuente concentrada de energía porque contienen poco oxígeno y son anhidros . El rendimiento energético de un gramo de ácidos grasos es de aproximadamente 9 kcal (37 kJ), mucho mayor que las 4 kcal (17 kJ) de los carbohidratos. Dado que la porción hidrocarbonada de los ácidos grasos es hidrófoba , estas moléculas se pueden almacenar en un entorno relativamente anhidro (sin agua). Los carbohidratos, por otro lado, están más hidratados. Por ejemplo, 1 g de glucógeno se une aproximadamente a 2 g de agua , lo que se traduce en 1,33 kcal/g (4 kcal/3 g). Esto significa que los ácidos grasos pueden contener más de seis veces la cantidad de energía por unidad de masa almacenada. Dicho de otra manera, si el cuerpo humano dependiera de los carbohidratos para almacenar energía, entonces una persona necesitaría llevar 31 kg (67,5 lb ) de glucógeno hidratado para tener la energía equivalente a 4,6 kg (10 lb) de grasa . [10]
Los animales que hibernan son un buen ejemplo de la utilización de las reservas de grasa como combustible. Por ejemplo, los osos hibernan durante unos siete meses y, durante todo ese período, la energía se obtiene de la degradación de las reservas de grasa. Las aves migratorias también acumulan grandes reservas de grasa antes de emprender sus viajes intercontinentales. [17]
Las reservas de grasa de los adultos jóvenes promedian entre 10 y 20 kg, pero varían mucho según el género y la disposición individual. [18] Por el contrario, el cuerpo humano almacena solo unos 400 g de glucógeno , de los cuales 300 g están bloqueados dentro de los músculos esqueléticos y no están disponibles para el cuerpo en su conjunto. Los 100 g aproximadamente de glucógeno almacenados en el hígado se agotan en el plazo de un día después de la inanición. [10] A partir de entonces, la glucosa que el hígado libera en la sangre para uso general de los tejidos corporales tiene que sintetizarse a partir de los aminoácidos glucogénicos y algunos otros sustratos gluconeogénicos , que no incluyen los ácidos grasos. [1] No obstante, la lipólisis libera glicerol que puede entrar en la vía de la gluconeogénesis.
Síntesis de carbohidratos a partir de glicerol y ácidos grasos.
Los ácidos grasos se descomponen en acetil-CoA mediante beta-oxidación dentro de las mitocondrias, mientras que los ácidos grasos se sintetizan a partir de acetil-CoA fuera de las mitocondrias, en el citosol. Las dos vías son distintas, no solo en donde ocurren, sino también en las reacciones que ocurren y los sustratos que se utilizan. Las dos vías son mutuamente inhibidoras, evitando que el acetil-CoA producido por beta-oxidación entre en la vía sintética a través de la reacción de la acetil-CoA carboxilasa . [1] Tampoco se puede convertir en piruvato ya que la reacción del complejo de la piruvato deshidrogenasa es irreversible. [10] En cambio, el acetil-CoA producido por la beta-oxidación de los ácidos grasos se condensa con oxaloacetato , para entrar en el ciclo del ácido cítrico . Durante cada vuelta del ciclo, dos átomos de carbono abandonan el ciclo en forma de CO2 en las reacciones de descarboxilación catalizadas por la isocitrato deshidrogenasa y la alfa-cetoglutarato deshidrogenasa . Por lo tanto, cada vuelta del ciclo del ácido cítrico oxida una unidad de acetil-CoA mientras se regenera la molécula de oxaloacetato con la que el acetil-CoA se había combinado originalmente para formar ácido cítrico. Las reacciones de descarboxilación ocurren antes de que se forme el malato en el ciclo. [1] Solo las plantas poseen las enzimas para convertir el acetil-CoA en oxaloacetato a partir del cual se puede formar el malato para finalmente convertirse en glucosa. [1]
Sin embargo, el acetil-CoA se puede convertir en acetoacetato, que puede descarboxilarse a acetona (ya sea espontáneamente o catalizada por la acetoacetato descarboxilasa ). Luego puede metabolizarse aún más a isopropanol que se excreta en el aliento/orina, o por CYP2E1 en hidroxiacetona (acetol). El acetol se puede convertir en propilenglicol . Este se convierte en piruvato (por dos enzimas alternativas), o propionaldehído , o en L -lactaldehído y luego L -lactato (el isómero común del lactato). [19] [20] [21] Otra vía convierte el acetol en metilglioxal , luego en piruvato , o en D -lactaldehído (a través de SD -lactoil-glutatión o de otra manera) y luego en D -lactato . [20] [22] [23] El metabolismo del D-lactato (a glucosa) es lento o está alterado en los seres humanos, por lo que la mayor parte del D-lactato se excreta en la orina; por lo tanto, el D -lactato derivado de la acetona puede contribuir significativamente a la acidosis metabólica asociada con la cetosis o la intoxicación por isopropanol. [20] El L -lactato puede completar la conversión neta de ácidos grasos en glucosa. El primer experimento que mostró la conversión de acetona en glucosa se llevó a cabo en 1951. Este y otros experimentos utilizaron el marcaje isotópico de carbono . [21] Hasta el 11% de la glucosa puede derivarse de la acetona durante la inanición en humanos. [21]
El glicerol liberado a la sangre durante la lipólisis de los triglicéridos en el tejido adiposo sólo puede ser absorbido por el hígado. Allí se convierte en glicerol 3-fosfato por acción de la glicerol quinasa , que hidroliza una molécula de ATP por molécula de glicerol que se fosforila. A continuación, el glicerol 3-fosfato se oxida a dihidroxiacetona fosfato , que, a su vez, se convierte en gliceraldehído 3-fosfato por acción de la enzima triosa fosfato isomerasa . A partir de aquí, los tres átomos de carbono del glicerol original pueden oxidarse mediante glucólisis o convertirse en glucosa mediante gluconeogénesis . [10]
Otras funciones y usos de los ácidos grasos
Señalización intracelular

Los ácidos grasos son una parte integral de los fosfolípidos que forman la mayor parte de las membranas plasmáticas , o membranas celulares, de las células. Estos fosfolípidos pueden escindirse en diacilglicerol (DAG) y trifosfato de inositol (IP 3 ) a través de la hidrólisis del fosfolípido, fosfatidilinositol 4,5-bisfosfato (PIP 2 ), por la enzima unida a la membrana celular fosfolipasa C (PLC). [24]
Hormonas paracrinas eicosanoides


Un producto del metabolismo de los ácidos grasos son las prostaglandinas , compuestos que tienen diversos efectos similares a los de las hormonas en los animales. Se han encontrado prostaglandinas en casi todos los tejidos de los seres humanos y otros animales. Se derivan enzimáticamente del ácido araquidónico, un ácido graso poliinsaturado de 20 carbonos. Por lo tanto, cada prostaglandina contiene 20 átomos de carbono , incluido un anillo de 5 carbonos . Son una subclase de eicosanoides y forman la clase prostanoides de derivados de ácidos grasos. [25]
Las prostaglandinas se sintetizan en la membrana celular por la escisión del araquidonato de los fosfolípidos que forman la membrana. Esto es catalizado por la fosfolipasa A 2 que actúa directamente sobre un fosfolípido de la membrana, o por una lipasa que actúa sobre DAG (diacil-glicerol). El araquidonato es entonces actuado por el componente ciclooxigenasa de la prostaglandina sintasa . Esto forma un anillo de ciclopentano aproximadamente en el medio de la cadena de ácido graso. La reacción también añade 4 átomos de oxígeno derivados de dos moléculas de O 2 . La molécula resultante es prostaglandina G 2 , que es convertida por el componente hidroperoxidasa del complejo enzimático en prostaglandina H 2 . Este compuesto altamente inestable se transforma rápidamente en otras prostaglandinas, prostaciclina y tromboxanos. [25] Estos luego se liberan en los fluidos intersticiales que rodean las células que han fabricado la hormona eicosanoide.
Si el araquidonato es activado por una lipoxigenasa en lugar de una ciclooxigenasa, se forman ácidos hidroxieicosatetraenoicos y leucotrienos , que también actúan como hormonas locales.
Las prostaglandinas tienen dos derivados: las prostaciclinas y los tromboxanos . Las prostaciclinas son potentes vasodilatadores de acción local e inhiben la agregación de las plaquetas sanguíneas . A través de su papel en la vasodilatación, las prostaciclinas también están involucradas en la inflamación . Se sintetizan en las paredes de los vasos sanguíneos y cumplen la función fisiológica de prevenir la formación innecesaria de coágulos, así como de regular la contracción del tejido muscular liso . [26] Por el contrario, los tromboxanos (producidos por las células plaquetarias) son vasoconstrictores y facilitan la agregación plaquetaria. Su nombre proviene de su papel en la formación de coágulos ( trombosis ).
Fuentes dietéticas de ácidos grasos, su digestión, absorción, transporte en la sangre y almacenamiento



Una parte importante de los ácidos grasos presentes en el organismo se obtiene a través de la dieta, en forma de triglicéridos de origen animal o vegetal. Los ácidos grasos presentes en las grasas obtenidas de animales terrestres tienden a ser saturados, mientras que los ácidos grasos presentes en los triglicéridos de pescados y plantas suelen ser poliinsaturados y, por tanto, se presentan en forma de aceites.
Estos triglicéridos no pueden ser absorbidos por el intestino . [27] Se descomponen en mono- y diglicéridos más ácidos grasos libres (pero no glicerol libre) por la lipasa pancreática , que forma un complejo 1:1 con una proteína llamada colipasa (también un componente del jugo pancreático), que es necesaria para su actividad. El complejo activado puede funcionar solo en una interfaz agua-grasa. Por lo tanto, es esencial que las grasas se emulsionen primero con sales biliares para una actividad óptima de estas enzimas. [28] Los productos de la digestión consisten en una mezcla de tri-, di- y monoglicéridos y ácidos grasos libres, que, junto con los otros contenidos liposolubles de la dieta (por ejemplo, las vitaminas liposolubles y el colesterol) y las sales biliares forman micelas mixtas , en el contenido duodenal acuoso (ver diagramas a la derecha). [27] [29]
El contenido de estas micelas (pero no las sales biliares) ingresa a los enterocitos (células epiteliales que recubren el intestino delgado), donde se resintetizan en triglicéridos y se envasan en quilomicrones que se liberan en los vasos lácticos (los capilares del sistema linfático de los intestinos). [30] Estos vasos lácticos drenan en el conducto torácico que desemboca en la sangre venosa en la unión de las venas yugular izquierda y subclavia izquierda en el lado inferior izquierdo del cuello. Esto significa que los productos liposolubles de la digestión se descargan directamente en la circulación general, sin pasar primero por el hígado, a diferencia de todos los demás productos de la digestión. Se desconoce la razón de esta peculiaridad. [31]

Los quilomicrones circulan por todo el cuerpo, dando al plasma sanguíneo una apariencia lechosa o cremosa después de una comida rica en grasas. [ cita requerida ] La lipoproteína lipasa en las superficies endoteliales de los capilares, especialmente en el tejido adiposo , pero en menor medida también en otros tejidos, digiere parcialmente los quilomicrones en ácidos grasos libres, glicerol y restos de quilomicrones. Los ácidos grasos son absorbidos por los adipocitos [ cita requerida ] , pero el glicerol y los restos de quilomicrones permanecen en el plasma sanguíneo, para finalmente ser eliminados de la circulación por el hígado. Los ácidos grasos libres liberados por la digestión de los quilomicrones son absorbidos por los adipocitos [ cita requerida ] , donde se resintetizan en triglicéridos utilizando glicerol derivado de la glucosa en la vía glucolítica [ cita requerida ] . Estos triglicéridos se almacenan, hasta que son necesarios para los requerimientos de combustible de otros tejidos, en la gota de grasa del adipocito .
El hígado absorbe una parte de la glucosa de la sangre en la vena porta que viene de los intestinos. Una vez que el hígado ha repuesto sus reservas de glucógeno (que ascienden a sólo unos 100 g de glucógeno cuando están llenas), gran parte del resto de la glucosa se convierte en ácidos grasos como se describe a continuación. Estos ácidos grasos se combinan con glicerol para formar triglicéridos que se empaquetan en gotitas muy similares a los quilomicrones, pero conocidas como lipoproteínas de muy baja densidad (VLDL). Estas gotitas de VLDL se procesan exactamente de la misma manera que los quilomicrones, excepto que el remanente de VLDL se conoce como lipoproteína de densidad intermedia (IDL), que es capaz de eliminar el colesterol de la sangre. Esto convierte la IDL en lipoproteína de baja densidad (LDL), que es absorbida por las células que necesitan colesterol para incorporarlo a sus membranas celulares o para fines sintéticos (por ejemplo, la formación de las hormonas esteroides ). El resto de las LDL es eliminado por el hígado. [32]
El tejido adiposo y las glándulas mamarias lactantes también absorben glucosa de la sangre para convertirla en triglicéridos. Esto ocurre de la misma manera que en el hígado, excepto que estos tejidos no liberan los triglicéridos así producidos como VLDL en la sangre. Las células del tejido adiposo almacenan los triglicéridos en sus gotitas de grasa, para finalmente liberarlos nuevamente como ácidos grasos libres y glicerol en la sangre (como se describió anteriormente), cuando la concentración plasmática de insulina es baja y la de glucagón y/o epinefrina es alta. [33] Las glándulas mamarias descargan la grasa (como gotitas de grasa cremosa) en la leche que producen bajo la influencia de la hormona de la hipófisis anterior prolactina .
Todas las células del cuerpo necesitan fabricar y mantener sus membranas y las membranas de sus orgánulos. No se sabe si dependen completamente de los ácidos grasos libres absorbidos de la sangre o si son capaces de sintetizar sus propios ácidos grasos a partir de la glucosa sanguínea. Las células del sistema nervioso central casi con certeza tendrán la capacidad de fabricar sus propios ácidos grasos, ya que estas moléculas no pueden llegar a ellas a través de la barrera hematoencefálica . [34] Sin embargo, se desconoce cómo llegan a ellas los ácidos grasos esenciales , que los mamíferos no pueden sintetizar por sí mismos pero que, sin embargo, son componentes importantes de las membranas celulares (y otras funciones descritas anteriormente).
Síntesis de ácidos grasos

Al igual que la beta-oxidación , la síntesis de ácidos grasos de cadena lineal ocurre a través de las seis reacciones recurrentes que se muestran a continuación, hasta que se produce el ácido palmítico de 16 carbonos. [35] [36]
Los diagramas presentados muestran cómo se sintetizan los ácidos grasos en los microorganismos y enumeran las enzimas que se encuentran en Escherichia coli . [35] Estas reacciones son realizadas por la sintasa de ácidos grasos II (FASII), que en general contiene múltiples enzimas que actúan como un solo complejo. La FASII está presente en procariotas , plantas, hongos y parásitos, así como en las mitocondrias . [37]
En los animales, así como en algunos hongos como la levadura, estas mismas reacciones ocurren en la sintetasa de ácidos grasos I (FASI), una proteína dimérica grande que tiene todas las actividades enzimáticas necesarias para crear un ácido graso. La FASI es menos eficiente que la FASII; sin embargo, permite la formación de más moléculas, incluidos los ácidos grasos de "cadena media" a través de la terminación temprana de la cadena. [37] Las enzimas, aciltransferasas y transacilasas, incorporan ácidos grasos en fosfolípidos, triacilgliceroles, etc. mediante la transferencia de ácidos grasos entre un aceptor y un donador de acilo. También tienen la tarea de sintetizar lípidos bioactivos, así como sus moléculas precursoras. [38]
Una vez que se ha formado un ácido graso de 16:0 carbonos, puede sufrir una serie de modificaciones, lo que da como resultado la desaturación y/o elongación. La elongación, que comienza con el estearato (18:0), se realiza principalmente en el retículo endoplásmico mediante varias enzimas unidas a la membrana. Los pasos enzimáticos involucrados en el proceso de elongación son principalmente los mismos que los que se llevan a cabo en la síntesis de ácidos grasos , pero los cuatro pasos principales sucesivos de la elongación los realizan proteínas individuales, que pueden estar asociadas físicamente. [39] [40]
| Paso | Enzima | Reacción | Descripción |
|---|---|---|---|
| (a) | Acetil-CoA:ACP transacilasa | 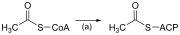 | Activa el acetil-CoA para la reacción con malonil-ACP |
| (b) | Malonil-CoA:ACP transacilasa |  | Activa el malonil-CoA para la reacción con acetil-ACP |
| (do) | 3-cetoacil-ACP sintasa | 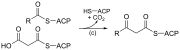 | Reacciona la cadena acilo unida a ACP con el malonil-ACP extensor de cadena. |
| (d) | 3-cetoacil-ACP reductasa | 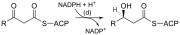 | Reduce la cetona de carbono 3 a un grupo hidroxilo |
| (mi) | 3-Hidroxiacil ACP deshidrasa | 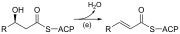 | Elimina el agua |
| (F) | Enoil-ACP reductasa |  | Reduce el doble enlace C2-C3. |
Abreviaturas: ACP – Proteína transportadora de acilo , CoA – Coenzima A , NADP – Fosfato de dinucleótido de nicotinamida y adenina .
Nótese que durante la síntesis de grasas el agente reductor es NADPH , mientras que NAD es el agente oxidante en la beta-oxidación (la descomposición de los ácidos grasos en acetil-CoA). Esta diferencia ejemplifica un principio general de que el NADPH se consume durante las reacciones biosintéticas, mientras que el NADH se genera en reacciones que producen energía. [34] (Por lo tanto, el NADPH también es necesario para la síntesis de colesterol a partir de acetil-CoA; mientras que el NADH se genera durante la glucólisis ). La fuente del NADPH es doble. Cuando el malato es descarboxilado oxidativamente por la " enzima málica unida a NADP + " piruvato , se forman CO2 y NADPH. El NADPH también se forma por la vía de la pentosa fosfato que convierte la glucosa en ribosa, que puede usarse en la síntesis de nucleótidos y ácidos nucleicos , o puede catabolizarse a piruvato. [34]
Los productos finales glucolíticos se utilizan en la conversión de carbohidratos en ácidos grasos.
En los seres humanos, los ácidos grasos se forman a partir de carbohidratos predominantemente en el hígado y el tejido adiposo , así como en las glándulas mamarias durante la lactancia. El piruvato producido por la glucólisis es un intermediario importante en la conversión de carbohidratos en ácidos grasos y colesterol. [34] Esto ocurre a través de la conversión de piruvato en acetil-CoA en la mitocondria. Sin embargo, este acetil-CoA necesita ser transportado al citosol donde ocurre la síntesis de ácidos grasos y colesterol. Esto no puede ocurrir directamente. Para obtener acetil-CoA citosólico, el citrato (producido por la condensación de acetil-CoA con oxaloacetato) se elimina del ciclo del ácido cítrico y se transporta a través de la membrana mitocondrial interna hasta el citosol. [34] Allí es escindido por la ATP citrato liasa en acetil-CoA y oxaloacetato. El oxaloacetato regresa a la mitocondria como malato (y luego se convierte nuevamente en oxaloacetato para transferir más acetil-CoA fuera de la mitocondria). [41] La acetil-CoA citosólica es carboxilada por la acetil-CoA carboxilasa en malonil-CoA , el primer paso comprometido en la síntesis de ácidos grasos. [41] [42]
Regulación de la síntesis de ácidos grasos
El acetil-CoA se transforma en malonil-CoA por acción de la acetil-CoA carboxilasa , momento en el que la malonil-CoA se destina a alimentar la vía de síntesis de ácidos grasos. La acetil-CoA carboxilasa es el punto de regulación en la síntesis de ácidos grasos saturados de cadena lineal y está sujeta tanto a la fosforilación como a la regulación alostérica . La regulación por fosforilación se produce principalmente en mamíferos, mientras que la regulación alostérica se produce en la mayoría de los organismos. El control alostérico se produce como inhibición por retroalimentación por parte del palmitoil-CoA y activación por el citrato. Cuando hay altos niveles de palmitoil-CoA, el producto final de la síntesis de ácidos grasos saturados, inactiva alostéricamente la acetil-CoA carboxilasa para evitar la acumulación de ácidos grasos en las células. El citrato actúa para activar la acetil-CoA carboxilasa en niveles altos, porque los niveles altos indican que hay suficiente acetil-CoA para alimentar el ciclo de Krebs y producir energía. [43]
Los altos niveles plasmáticos de insulina en el plasma sanguíneo (por ejemplo, después de las comidas) provocan la desfosforilación y activación de la acetil-CoA carboxilasa, promoviendo así la formación de malonil-CoA a partir de acetil-CoA y, en consecuencia, la conversión de carbohidratos en ácidos grasos, mientras que la epinefrina y el glucagón (liberados en la sangre durante la inanición y el ejercicio) provocan la fosforilación de esta enzima, inhibiendo la lipogénesis a favor de la oxidación de ácidos grasos a través de la beta-oxidación . [34] [42]
Trastornos
Los trastornos del metabolismo de los ácidos grasos pueden describirse en términos de, por ejemplo, hipertrigliceridemia (nivel demasiado alto de triglicéridos ) u otros tipos de hiperlipidemia . Estas pueden ser hereditarias o adquiridas.
Los tipos familiares de trastornos del metabolismo de los ácidos grasos se clasifican generalmente como errores congénitos del metabolismo de los lípidos . Estos trastornos pueden describirse como trastornos de la oxidación de los ácidos grasos o como trastornos del almacenamiento de lípidos , y son cualquiera de los diversos errores congénitos del metabolismo que resultan de defectos enzimáticos o de proteínas de transporte que afectan la capacidad del cuerpo para oxidar los ácidos grasos con el fin de producir energía en los músculos, el hígado y otros tipos de células . Cuando un trastorno de la oxidación de los ácidos grasos afecta a los músculos, se trata de una miopatía metabólica .
Además, las células cancerosas pueden mostrar un metabolismo irregular de los ácidos grasos con respecto tanto a la síntesis de ácidos grasos [44] como a la oxidación mitocondrial de ácidos grasos (FAO) [45] que están involucradas en diversos aspectos de la tumorigénesis y el crecimiento celular.
Referencias
- ^ abcdef Stryer, Lubert (1995). "Metabolismo de los ácidos grasos". En: Biochemistry (cuarta edición). Nueva York: WH Freeman and Company. págs. 603–628. ISBN 0-7167-2009-4.
- ^ abcd Oxidación de ácidos grasos
- ^ Zechner R, Strauss JG, Haemmerle G, Lass A, Zimmermann R (2005). "Lipólisis: vía en construcción". Curr. Opin. Lipidol . 16 (3): 333–40. doi :10.1097/01.mol.0000169354.20395.1c. PMID 15891395. S2CID 35349649.
- ^ Movilización y captación celular de grasas almacenadas (triacilgliceroles) (con animación)
- ^ Stahl, Andreas (1 de febrero de 2004). "Una revisión actual de las proteínas transportadoras de ácidos grasos (SLC27)". Pflügers Archiv: Revista Europea de Fisiología . 447 (5): 722–727. doi :10.1007/s00424-003-1106-z. PMID 12856180. S2CID 2769738.
- ^ Anderson, Courtney M.; Stahl, Andreas (abril de 2013). "Proteínas transportadoras de ácidos grasos SLC27". Aspectos moleculares de la medicina . 34 (2–3): 516–528. doi :10.1016/j.mam.2012.07.010. PMC 3602789 . PMID 23506886.
- ^ Ebert, D.; Haller, RG.; Walton, ME. (julio de 2003). "Contribución energética del octanoato al metabolismo del cerebro intacto de rata medido mediante espectroscopia de resonancia magnética nuclear de 13C". J Neurosci . 23 (13): 5928–35. doi : 10.1523/JNEUROSCI.23-13-05928.2003 . PMC 6741266 . PMID 12843297.
- ^ Marin-Valencia, I.; Good, LB.; Ma, Q.; Malloy, CR.; Pascual, JM. (febrero de 2013). "El heptanoato como combustible neuronal: precursores energéticos y de neurotransmisores en cerebros normales y deficientes en el transportador de glucosa I (G1D)". J Cereb Blood Flow Metab . 33 (2): 175–82. doi :10.1038/jcbfm.2012.151. PMC 3564188 . PMID 23072752.
- ^ Stryer, Lubert (1995). "Metabolismo de los ácidos grasos". En: Biochemistry (cuarta edición). Nueva York: WH Freeman and Company. págs. 770–771. ISBN 0-7167-2009-4.
- ^ abcdefghi Stryer, Lubert (1995). Bioquímica (cuarta edición). Nueva York: WH Freeman and Company. págs. 510–515, 581–613, 775–778. ISBN 0-7167-2009-4.
- ^ Activación y transporte de ácidos grasos a las mitocondrias a través de la lanzadera de carnitina (con animación)
- ^ Vivo, Darryl C.; Bohan, Timothy P.; Coulter, David L.; Dreifuss, Fritz E.; Greenwood, Robert S.; Nordli, Douglas R.; Shields, W. Donald; Stafstrom, Carl E.; Tein, Ingrid (1998). "Suplementación con l-carnitina en la epilepsia infantil: perspectivas actuales". Epilepsia . 39 (11): 1216–1225. doi : 10.1111/j.1528-1157.1998.tb01315.x . ISSN 0013-9580. PMID 9821988. S2CID 28692799.
- ^ Oxidación de ácidos grasos de cadena de longitud impar de carbono
- ^ Oxidación de ácidos grasos insaturados
- ^ Wongkittichote P, Ah Mew N, Chapman KA (diciembre de 2017). "Propionil-CoA carboxilasa: una revisión". Genética molecular y metabolismo . 122 (4): 145–152. doi :10.1016/j.ymgme.2017.10.002. PMC 5725275 . PMID 29033250.
- ^ Halarnkar PP, Blomquist GJ (1989). "Aspectos comparativos del metabolismo del propionato". Comp. Biochem. Physiol. B . 92 (2): 227–31. doi :10.1016/0305-0491(89)90270-8. PMID 2647392.
- ^ Stryer, Lubert (1995). Bioquímica (cuarta edición). Nueva York: WH Freeman and Company. pág. 777. ISBN 0-7167-2009-4.
- ^ Sloan, AW; Koeslag, JH; Bredell, GAG (1973). "Capacidad de trabajo de composición corporal y eficiencia laboral de hombres jóvenes activos e inactivos". Revista Europea de Fisiología Aplicada . 32 : 17–24. doi :10.1007/bf00422426. S2CID 39812342.
- ^ Ruddick JA (1972). "Toxicología, metabolismo y bioquímica del 1,2-propanodiol". Toxicol Appl Pharmacol . 21 (1): 102–111. Bibcode :1972ToxAP..21..102R. doi :10.1016/0041-008X(72)90032-4. PMID 4553872.
- ^ abc Glew, Robert H. "Puede llegar allí desde aquí: la acetona, las cetonas aniónicas y los ácidos grasos de carbono par pueden proporcionar sustratos para la gluconeogénesis". Revista nigeriana de ciencias fisiológicas . 25 (1). Revisión por invitación: 2–4. Archivado desde el original el 26 de septiembre de 2013 . Consultado el 7 de agosto de 2016 .
- ^ abc Park, Sung M.; Klapa, Maria I.; Sinskey, Anthony J.; Stephanopoulos, Gregory (1999). "Equilibrio de metabolitos e isotopómeros en el análisis de ciclos metabólicos: II. Aplicaciones" (PDF) . Biotecnología y Bioingeniería . 62 (4): 398. doi :10.1002/(sici)1097-0290(19990220)62:4<392::aid-bit2>3.0.co;2-s. ISSN 0006-3592. PMID 9921151.
- ^ Miller DN, Bazzano G; Bazzano (1965). "Metabolismo del propanodiol y su relación con el metabolismo del ácido láctico". Ann NY Acad Sci . 119 (3): 957–973. Bibcode :1965NYASA.119..957M. doi :10.1111/j.1749-6632.1965.tb47455.x. PMID 4285478. S2CID 37769342.
- ^ DL Vander Jagt; B. Robinson; KK Taylor; LA Hunsaker (1992). "Reducción de triosas por aldo-ceto reductasas dependientes de NADPH. Aldosa reductasa, metilglioxal y complicaciones diabéticas". The Journal of Biological Chemistry . 267 (7): 4364–4369. doi : 10.1016/S0021-9258(18)42844-X . PMID 1537826.
- ^ Stryer, Lubert (1995). "Cascadas de transducción de señales". En: Biochemistry (Cuarta edición). Nueva York: WH Freeman and Company. pp. 343–350. ISBN 0-7167-2009-4.
- ^ ab Stryer, Lubert (1995). "Las hormonas eicosanoides se derivan de los ácidos grasos". En: Biochemistry (Cuarta edición). Nueva York: WH Freeman and Company. pp. 624–627. ISBN 0-7167-2009-4.
- ^ Nelson, Randy F. (2005). Introducción a la endocrinología conductual (3.ª ed.). Sunderland, Mass.: Sinauer Associates. pág. 100. ISBN 978-0-87893-617-5.
- ^ ab Digestión de grasas (triacilgliceroles)
- ^ Hofmann AF (1963). "La función de las sales biliares en la absorción de grasas. Las propiedades disolventes de soluciones micelares diluidas de sales biliares conjugadas". Biochem. J . 89 (1): 57–68. doi :10.1042/bj0890057. PMC 1202272 . PMID 14097367.
- ^ Stryer, Lubert (1995). "Estructuras y dinámica de membranas". En: Biochemistry (cuarta edición). Nueva York: WH Freeman and Company. págs. 268-270. ISBN 0-7167-2009-4.
- ^ Gropper, Sareen S.; Smith, Jack L. (2013). Nutrición avanzada y metabolismo humano (6.ª ed.). Belmont, CA: Wadsworth/Cengage Learning. ISBN 978-1133104056.
- ^ Williams, Peter L.; Warwick, Roger; Dyson, Mary; Bannister, Lawrence H. (1989). "Angiología". En: Anatomía de Gray (37.ª ed.). Edimburgo: Churchill Livingstone. págs. 841–843. ISBN 0443-041776.
- ^ Stryer, Lubert (1995). "Biosíntesis de lípidos de membrana y esteroides". En: Biochemistry (Cuarta edición). Nueva York: WH Freeman and Company. págs. 697–700. ISBN 0-7167-2009-4.
- ^ Stralfors, Peter; Honnor, Rupert C. (1989). "Desfosforilación inducida por insulina de la lipasa sensible a hormonas". Revista Europea de Bioquímica . 182 (2): 379–385. doi : 10.1111/j.1432-1033.1989.tb14842.x . PMID 2661229.
- ^ abcdef Stryer, Lubert (1995). Bioquímica (cuarta edición). Nueva York: WH Freeman and Company. págs. 559–565, 614–623. ISBN 0-7167-2009-4.
- ^ ab Dijkstra, Albert J., RJ Hamilton y Wolf Hamm. "Biosíntesis de ácidos grasos". Ácidos grasos trans. Oxford: Blackwell Pub., 2008. 12. Impreso.
- ^ "Vía MetaCyc: supervía de biosíntesis de ácidos grasos". Base de datos de vías metabólicas MetaCyc . BioCyc. ( E. coli ).
- ^ ab Christie, William W. (20 de abril de 2011). "Ácidos grasos: saturados de cadena lineal, estructura, aparición y biosíntesis". En American Oil Chemists' Society (ed.). Biblioteca de lípidos de la AOCS. Archivado desde el original el 21 de julio de 2011. Consultado el 2 de mayo de 2011 .
- ^ Yamashita, Atsushi; Hayashi, Yasuhiro; Nemoto-Sasaki, Yoko; Ito, Makoto; Ok, Saori; Tanikawa, Takashi; Waku, Keizo; Sugiura, Takayuki (1 de enero de 2014). "Aciltransferasas y transacilasas que determinan la composición de ácidos grasos de los glicerolípidos y el metabolismo de mediadores lipídicos bioactivos en células de mamíferos y organismos modelo". Avances en la investigación de lípidos . 53 : 18–81. doi :10.1016/j.plipres.2013.10.001. ISSN 0163-7827. PMID 24125941.
- ^ "Vía metacrítica: biosíntesis de estearato I (animales)". Base de datos de vías metabólicas MetaCyc . BioCyc.
- ^ "Vía MetaCyc: biosíntesis de ácidos grasos de cadena muy larga II". Base de datos de vías metabólicas MetaCyc . BioCyc.
- ^ ab Ferre, P.; F. Foufelle (2007). "Factor de transcripción SREBP-1c y homeostasis lipídica: perspectiva clínica". Investigación hormonal . 68 (2): 72–82. doi : 10.1159/000100426 . PMID 17344645. Consultado el 30 de agosto de 2010.
Este proceso se describe gráficamente en la página 73
. - ^ ab Voet, Donald; Judith G. Voet; Charlotte W. Pratt (2006). Fundamentos de Bioquímica, 2ª Edición . John Wiley and Sons, Inc. págs. 547, 556. ISBN 978-0-471-21495-3.
- ^ Diwan, Joyce J. "Síntesis de ácidos grasos". Instituto Politécnico Rensselaer (RPI) :: Arquitectura, Negocios, Ingeniería, TI, Humanidades, Ciencias. Web. 30 de abril de 2011. < "Síntesis de ácidos grasos". Archivado desde el original el 7 de junio de 2011. Consultado el 2 de mayo de 2011 .>.
- ^ Ezzeddini R, Taghikhani M, Somi MH, Samadi N, Rasaee, MJ (mayo de 2019). "Importancia clínica de FASN en relación con HIF-1α y SREBP-1c en el adenocarcinoma gástrico". Ciencias de la vida . 224 : 169–176. doi :10.1016/j.lfs.2019.03.056. PMID 30914315. S2CID 85532042.
- ^ Ezzeddini R, Taghikhani M, Salek Farrokhi A, Somi MH, Samadi N, Esfahani A, Rasaee, MJ (mayo de 2021). "Regulación negativa de la oxidación de ácidos grasos por la participación de HIF-1α y PPARγ en el adenocarcinoma gástrico humano y su importancia clínica relacionada". Revista de fisiología y bioquímica . 77 (2): 249–260. doi :10.1007/s13105-021-00791-3. ISSN 1138-7548. PMID 33730333. S2CID 232300877.