ADN fetal libre de células
El ADN fetal libre de células ( cffDNA ) es ADN fetal que circula libremente en la sangre materna . La sangre materna se obtiene mediante venopunción . El análisis de cffDNA es un método de diagnóstico prenatal no invasivo que se solicita con frecuencia en mujeres embarazadas de edad materna avanzada . Dos horas después del parto, el cffDNA ya no es detectable en la sangre materna.
Fondo

El cffDNA se origina a partir de los trofoblastos placentarios . [1] [2] El ADN fetal se fragmenta cuando las micropartículas placentarias se liberan en la circulación sanguínea materna . [3]
Los fragmentos de cffDNA tienen una longitud de aproximadamente 200 pares de bases (pb). Son significativamente más pequeños que los fragmentos de ADN materno . [4] La diferencia de tamaño permite distinguir el cffDNA de los fragmentos de ADN materno. [5] [6]
Aproximadamente entre el 11 y el 13,4 por ciento del ADN libre de células en la sangre materna es de origen fetal. La cantidad varía ampliamente de una mujer embarazada a otra. [7] El cffDNA está presente después de la quinta a séptima semana de gestación. La cantidad de cffDNA aumenta a medida que avanza el embarazo. [8] La cantidad de cffDNA en la sangre materna disminuye rápidamente después del parto. Dos horas después del parto, el cffDNA ya no es detectable en la sangre materna. [9]
El análisis de cffDNA puede proporcionar un diagnóstico más temprano de las afecciones fetales que las técnicas actuales. Como el cffDNA se encuentra en la sangre materna, la toma de muestras no conlleva ningún riesgo asociado de aborto espontáneo . [10] [11] [12] [13] [14] El análisis de cffDNA tiene los mismos problemas éticos y prácticos que otras técnicas como la amniocentesis y la toma de muestras de vellosidades coriónicas . [15]
Algunas desventajas del muestreo de cffDNA incluyen una baja concentración de cffDNA en la sangre materna; variación en la cantidad de cffDNA entre individuos; una alta concentración de ADN libre de células maternas en comparación con el cffDNA en la sangre materna. [16]
Nuevas evidencias muestran que la tasa de falla de la prueba cffDNA es mayor, la fracción fetal (proporción de ADN fetal versus materno en la muestra de sangre materna) es menor y el VPP para las trisomías 18, 13 y SCA disminuye en los embarazos de FIV en comparación con los concebidos espontáneamente. [ aclaración necesaria ] [17]
Métodos de laboratorio
Se han desarrollado varios métodos de laboratorio para la detección de defectos genéticos en el ADN fetal libre de células. Los principales son (1) la secuenciación masiva paralela (MPSS), (2) la secuenciación masiva paralela dirigida (t-MPS) y (3) el enfoque basado en polimorfismos de un solo nucleótido (SNP). [18] [19] [20]
Se toma una muestra de sangre periférica materna mediante venesección aproximadamente a las diez semanas de gestación. [21]
Separación de cffDNA
El plasma sanguíneo se separa de la muestra de sangre materna utilizando una centrífuga de laboratorio . Luego se aísla y purifica el cffDNA. [22] Se redactó un protocolo estandarizado para realizar esto mediante una evaluación de la literatura científica . El mayor rendimiento en la extracción de cffDNA se obtuvo con el "QIAamp DSP Virus Kit". [23]
La adición de formaldehído a las muestras de sangre materna aumenta la producción de cffDNA. El formaldehído estabiliza las células intactas y, por lo tanto, inhibe la liberación posterior de ADN materno. Con la adición de formaldehído, el porcentaje de cffDNA recuperado de una muestra de sangre materna varía entre el 0,32 por ciento y el 40 por ciento, con una media del 7,7 por ciento. [24] Sin la adición de formaldehído, el porcentaje medio de cffDNA recuperado se ha medido en un 20,2 por ciento. Sin embargo, otras cifras varían entre el 5 y el 96 por ciento. [25] [26]
La recuperación de cffDNA puede estar relacionada con la longitud de los fragmentos de ADN. Otra forma de aumentar el ADN fetal se basa en la longitud física de los fragmentos de ADN. Los fragmentos más pequeños pueden representar hasta el setenta por ciento del ADN libre total de células en la muestra de sangre materna. [ cita requerida ]
Análisis de cffDNA
En la PCR en tiempo real, se utilizan sondas fluorescentes para controlar la acumulación de amplicones . La señal fluorescente del reportero es proporcional al número de amplicones generados. El protocolo de PCR en tiempo real más adecuado se diseña según la mutación o el genotipo particular que se desea detectar. Las mutaciones puntuales se analizan con PCR en tiempo real cualitativa con el uso de sondas específicas de alelos . Las inserciones y deleciones se analizan mediante mediciones de dosis utilizando PCR cuantitativa en tiempo real. [ cita requerida ]
El cffDNA se puede detectar encontrando secuencias de ADN heredadas paternamente mediante la reacción en cadena de la polimerasa (PCR). [27] [28]
PCR cuantitativa en tiempo real
Se analizaron mediante PCR cuantitativa en tiempo real (RT-qPCR) el gen de la región determinante del sexo Y (SRY) y la repetición corta en tándem "DYS14" del cromosoma Y en cffDNA de 511 embarazos. En 401 de 403 embarazos en los que se extrajo sangre materna a las siete semanas de gestación o más, se encontraron ambos segmentos de ADN. [29]
PCR anidada
Se evaluó el uso de la reacción en cadena de la polimerasa anidada (PCR anidada) para determinar el sexo mediante la detección de una señal específica del cromosoma Y en el cffDNA del plasma materno. La PCR anidada detectó 53 de 55 fetos masculinos. El cffDNA del plasma de 3 de 25 mujeres con fetos femeninos contenía la señal específica del cromosoma Y. La sensibilidad de la PCR anidada en este experimento fue del 96 por ciento. La especificidad fue del 88 por ciento. [30]
PCR digital
Los dispositivos microfluídicos permiten la cuantificación de segmentos de cffDNA en plasma materno con una precisión superior a la de la PCR en tiempo real. Las mutaciones puntuales , la pérdida de heterocigosidad y la aneuploidía se pueden detectar en un solo paso de PCR. [31] [32] [33] La PCR digital puede diferenciar entre el plasma sanguíneo materno y el ADN fetal de forma multiplexada . [31]
Secuenciación de escopeta
La secuenciación shotgun de alto rendimiento con herramientas como Solexa o Illumina produce aproximadamente 5 millones de etiquetas de secuencia por muestra de suero materno. Los embarazos aneuploides, como la trisomía, se identificaron al realizar la prueba en la decimocuarta semana de gestación. El mapeo completo del genoma fetal mediante el análisis de haplotipos parentales se completó utilizando la secuenciación de cffDNA del suero materno. [13] Se estudiaron hembras embarazadas utilizando una secuenciación masiva paralela de ADN plasmático materno de 2 plex y se diagnosticó trisomía con una puntuación z superior a 3. [34] La secuenciación arrojó una sensibilidad del 100 por ciento, una especificidad del 97,9 por ciento, un valor predictivo positivo del 96,6 por ciento y un valor predictivo negativo del 100 por ciento. [ cita requerida ]
Espectrometría de masas
La espectrometría de masas de tiempo de vuelo con desorción /ionización láser asistida por matriz (MALDI-TOF MS) combinada con la extensión de una sola base después de la PCR permite la detección de cffDNA con especificidad de una sola base y sensibilidad de una sola molécula de ADN. [35] El ADN se amplifica por PCR. Luego, la amplificación lineal con reacción de extensión de base (con un tercer cebador) está diseñada para annealing a la región corriente arriba del sitio de mutación . Una o dos bases se agregan al cebador de extensión para producir dos productos de extensión a partir de ADN de tipo salvaje y ADN mutante. La especificidad de una sola base proporciona ventajas sobre las técnicas basadas en hibridación que utilizan sondas de hidrólisis TaqMan . Al evaluar la técnica, no se encontraron falsos positivos o negativos al buscar cffDNA para determinar el sexo fetal en dieciséis muestras de plasma materno. [35] El sexo de noventa y un fetos masculinos se detectó correctamente utilizando la espectrometría de masas MALDI-TOF. La técnica tuvo precisión, sensibilidad y especificidad de más del 99 por ciento. [36]
Modificaciones epigenéticas
Las diferencias en la activación genética entre el ADN materno y fetal pueden ser explotadas. Las modificaciones epigenéticas (modificaciones hereditarias que cambian la función genética sin cambiar la secuencia del ADN) pueden ser utilizadas para detectar cffDNA. [37] [38] El promotor hipermetilado RASSF1A es un marcador fetal universal utilizado para confirmar la presencia de cffDNA. [39] Se describió una técnica en la que se extrajo cffDNA del plasma materno y luego se digirió con enzimas de restricción sensibles e insensibles a la metilación . Luego, se realizó un análisis de PCR en tiempo real de RASSF1A, SRY y DYS14. [39] El procedimiento detectó 79 de 90 (88 por ciento) muestras de sangre materna donde estaba presente RASSF1A hipermetilado. [ cita requerida ]
ARNm
Las transcripciones de ARNm de genes expresados en la placenta son detectables en el plasma materno. [40] En este procedimiento, el plasma se centrifuga para que aparezca una capa acuosa. Esta capa se transfiere y de ella se extrae el ARN . La RT-PCR se utiliza para detectar una expresión seleccionada de ARN. Por ejemplo, el lactógeno placentario humano (hPL) y el ARNm de beta-hCG son estables en el plasma materno y se pueden detectar. (Ng et al. 2002). Esto puede ayudar a confirmar la presencia de cffDNA en el plasma materno. [16]
Aplicaciones
Discernimiento prenatal del sexo
El análisis de cffDNA de una muestra de plasma materno permite la determinación prenatal del sexo . Las aplicaciones de la determinación prenatal del sexo incluyen:
- Pruebas de enfermedades : el sexo del feto, ya sea masculino o femenino, permite determinar el riesgo de un trastorno genético recesivo ligado al cromosoma X en un embarazo particular, especialmente cuando la madre es portadora genética del trastorno. [41]
- Preparación para cualquier aspecto de la crianza que dependa del sexo. [ cita requerida ]
- Selección de sexo , que después del diagnóstico genético preimplantacional puede realizarse seleccionando solo embriones del sexo preferido o, después de métodos postimplantacionales, realizando un aborto selectivo por sexo dependiendo del resultado de la prueba y la preferencia personal.
En comparación con la ecografía obstétrica , que no es confiable para la determinación del sexo en el primer trimestre, y la amniocentesis, que conlleva un pequeño riesgo de aborto espontáneo , la toma de muestras de plasma materno para el análisis de cffDNA no presenta ningún riesgo. [42] Los principales objetivos del análisis de cffDNA son el gen responsable de la proteína de la región determinante del sexo Y (SRY) en el cromosoma Y y la secuencia DYS14. [43] [44]
Hiperplasia suprarrenal congénita
En la hiperplasia suprarrenal congénita , la corteza suprarrenal carece de la síntesis apropiada de corticosteroides, lo que conduce a un exceso de andrógenos suprarrenales y afecta a los fetos femeninos. [45] Hay una masculinización externa de los genitales en los fetos femeninos. [46] A las madres de fetos en riesgo se les administra dexametasona a las 6 semanas de gestación para suprimir la liberación de andrógenos de la glándula pituitaria . [47]
Si el análisis de cffDNA obtenido de una muestra de plasma materno carece de marcadores genéticos que se encuentran únicamente en el cromosoma Y, esto es indicativo de un feto femenino. Sin embargo, también podría indicar un fallo del análisis en sí (un resultado falso negativo). Los polimorfismos genéticos paternos y los marcadores independientes del sexo pueden utilizarse para detectar cffDNA. Para esta aplicación, debe estar presente un alto grado de heterocigosidad de estos marcadores. [48]
Prueba de paternidad
La prueba de paternidad por ADN prenatal está disponible comercialmente. La prueba se puede realizar a las nueve semanas de gestación. [ cita requerida ]
Trastornos monogénicos
Los trastornos autosómicos dominantes y recesivos de un solo gen que se han diagnosticado prenatalmente mediante el análisis del ADN heredado paternalmente incluyen fibrosis quística , beta talasemia , anemia de células falciformes , atrofia muscular espinal y distrofia miotónica . [27] [43] El diagnóstico prenatal de trastornos de un solo gen que se deben a una mutación autosómica recesiva, una mutación autosómica dominante heredada de la madre o mutaciones de secuencia grande que incluyen duplicación, expansión o inserción de secuencias de ADN es más difícil. [49]
En el cffDNA, los fragmentos de 200 a 300 pb de longitud implicados en trastornos de un solo gen son más difíciles de detectar. [ cita requerida ]
Por ejemplo, la acondroplasia , una enfermedad autosómica dominante, es causada por la mutación puntual del gen FGFR3. [50] En dos embarazos con un feto con acondroplasia se encontró una mutación G1138A heredada paternamente del cffDNA de una muestra de plasma materno en uno y una mutación G1138A de novo en el otro. [50]
En estudios sobre la genética de la corea de Huntington mediante qRT-PCR de cffDNA de muestras de plasma materno, se han detectado repeticiones de CAG en niveles normales (17, 20 y 24). [51]
El cffDNA también se puede utilizar para diagnosticar trastornos de un solo gen . [15] Los avances en los procesos de laboratorio que utilizan cffDNA pueden permitir el diagnóstico prenatal de aneuploidías como la trisomía 21 (síndrome de Down) en el feto. [52] [32]
Enfermedad hemolítica del feto y del recién nacido
La incompatibilidad de los antígenos RhD fetales y maternos es la principal causa de la enfermedad hemolítica del recién nacido . [53] Aproximadamente el 15 por ciento de las mujeres caucásicas , entre el 3 y el 5 por ciento de las mujeres de África negra y menos del 3 por ciento de las mujeres asiáticas son RhD negativas. [54]
El diagnóstico prenatal preciso es importante porque la enfermedad puede ser fatal para el recién nacido y porque el tratamiento, que incluye inmunoglobulina intramuscular (Anti-D) o inmunoglobulina intravenosa , se puede administrar a madres en riesgo. [55]
La PCR para detectar los exones 5 y 7 del gen RHD (gen) a partir de cffDNA obtenido de plasma materno entre las 9 y 13 semanas de gestación proporciona un alto grado de especificidad, sensibilidad y precisión diagnóstica (>90 por ciento) en comparación con la determinación de RhD a partir del suero de sangre del cordón umbilical del recién nacido . [53] Se obtuvieron resultados similares al identificar los exones 7 y 10. [56] La PCR digital de gotas en la determinación de RhD fetal fue comparable a una técnica de PCR en tiempo real de rutina. [57]
La determinación rutinaria del estado RhD fetal a partir del cffDNA en suero materno permite el manejo temprano de embarazos de riesgo y al mismo tiempo reduce el uso innecesario de Anti-D en más del 25 por ciento. [58]
Aneuploidía
- Cromosomas sexuales
El análisis del cffDNA del suero materno mediante secuenciación de alto rendimiento puede detectar aneuploidías comunes de los cromosomas sexuales fetales, como el síndrome de Turner , el síndrome de Klinefelter y el síndrome triple X , pero el valor predictivo positivo del procedimiento es bajo. [59]
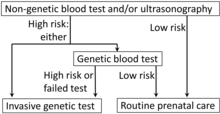
- Trisomía 21
La trisomía fetal del cromosoma 21 es la causa del síndrome de Down. Esta trisomía se puede detectar mediante el análisis del cffDNA de la sangre materna mediante secuenciación masiva paralela shotgun (MPSS). [61] Otra técnica es el análisis digital de regiones seleccionadas (DANSR). [61] Estas pruebas muestran una sensibilidad de alrededor del 99% y una especificidad de más del 99,9%. Por lo tanto, no se pueden considerar procedimientos de diagnóstico, pero se pueden utilizar para confirmar una prueba de detección materna positiva, como una prueba de detección del primer trimestre o marcadores ecográficos de la enfermedad. [61] [62]
- Trisomía 13 y 18
Es posible realizar un análisis de cffDNA del plasma materno con MPSS en busca de trisomía 13 o 18 [63]
Los factores que limitan la sensibilidad y especificidad incluyen los niveles de cffDNA en el plasma materno; los cromosomas maternos pueden tener mosaicismo . [64]
Se pueden detectar varias moléculas de ácido nucleico fetal derivadas de cromosomas aneuploides, incluyendo el ARNm de SERPINEB2, clad B, SERPINB5 hipometilado del cromosoma 18, placenta-specific 4 (PLAC4), holocarboxilasa sintetasa hipermetilada (HLCS) y el ARNm c21orf105 del cromosoma 12. [65] Con la trisomía completa, los alelos de ARNm en el plasma materno no tienen la proporción normal de 1:1, sino que de hecho son 2:1. Las proporciones alélicas determinadas por marcadores epigenéticos también se pueden utilizar para detectar las trisomías completas. La secuenciación paralela masiva y la PCR digital para la detección de aneuploidía fetal se pueden utilizar sin restricción para las moléculas de ácido nucleico fetales específicas. Se estima que la secuenciación masiva paralela (MPSS) tiene una sensibilidad de entre el 96 y el 100% y una especificidad de entre el 94 y el 100% para detectar el síndrome de Down. Se puede realizar a las 10 semanas de edad gestacional . [66] Un estudio en los Estados Unidos estimó una tasa de falsos positivos del 0,3% y un valor predictivo positivo del 80% al utilizar cffDNA para detectar el síndrome de Down. [67]
Preeclampsia
La preeclampsia es una afección compleja del embarazo que cursa con hipertensión y proteinuria , generalmente después de las 20 semanas de gestación. [68] Se asocia con una invasión citotrofoblástica deficiente del miometrio . La aparición de la afección entre las 20 y 34 semanas de gestación se considera "temprana". [69] Las muestras de plasma materno en embarazos complicados por preeclampsia tienen niveles significativamente más altos de cffDNA que en embarazos normales. [70] [71] [72] Esto es válido para la preeclampsia de aparición temprana. [69]
Historia
En 1997, el Dr. Yuk Ming Dennis Lo , junto con su equipo, empleó por primera vez el ensayo Y-PCR para identificar secuencias del cromosoma Y fetal (porque las secuencias específicas del cromosoma Y son secuencias genéticas del feto que no están en el genoma materno [73] ) en muestras de plasma materno. [74] Por este trabajo innovador, fue honrado con el Premio de Investigación Médica Clínica Lasker DeBakey 2022. [75]
Perspectivas futuras
La secuenciación de nueva generación puede utilizarse para obtener una secuencia completa del genoma a partir de cffDNA. Esto plantea cuestiones éticas. [76] Sin embargo, la utilidad del procedimiento puede aumentar a medida que se descubran asociaciones claras entre variantes genéticas específicas y estados patológicos. [77] [78]
Véase también
Referencias
- ^ Alberry M, Maddocks D, Jones M, Abdel Hadi M, Abdel-Fattah S, Avent N, Soothill PW (mayo de 2007). "ADN fetal libre en el plasma materno en embarazos anembrionarios: confirmación de que el origen es el trofoblasto". Diagnóstico prenatal . 27 (5). Wiley-Blackwell: 415–8. doi :10.1002/pd.1700. PMID 17286310. S2CID 39693586.
- ^ Gupta AK, Holzgreve W, Huppertz B, Malek A, Schneider H, Hahn S (noviembre de 2004). "Detección de ADN y ARN fetal en micropartículas de sinciciotrofoblasto derivadas de placenta generadas in vitro". Química clínica . 50 (11). Asociación Estadounidense de Química Clínica (AACC): 2187–90. doi : 10.1373/clinchem.2004.040196 . PMID 15502097.
- ^ Smets EM, Visser A, Go AT, van Vugt JM, Oudejans CB (febrero de 2006). "Nuevos biomarcadores en preeclampsia". Clínica Química Acta; Revista Internacional de Química Clínica . 364 (1–2). Elsevier BV: 22-32. doi :10.1016/j.cca.2005.06.011. PMID 16139262.
- ^ Chan KC, Zhang J, Hui AB, Wong N, Lau TK, Leung TN, Lo KW, Huang DW, Lo YM (enero de 2004). "Distribuciones de tamaño del ADN materno y fetal en el plasma materno". Química clínica . 50 (1). Asociación Estadounidense de Química Clínica (AACC): 88–92. doi : 10.1373/clinchem.2003.024893 . PMID 14709639.
- ^ Li Y, Zimmermann B, Rusterholz C, Kang A, Holzgreve W, Hahn S (junio de 2004). "La separación por tamaño del ADN circulante en el plasma materno permite la detección rápida de polimorfismos del ADN fetal" (PDF) . Química clínica . 50 (6). Asociación Estadounidense de Química Clínica (AACC): 1002–11. doi : 10.1373/clinchem.2003.029835 . PMID 15073090.
- ^ Li Y, Di Naro E, Vitucci A, Zimmermann B, Holzgreve W, Hahn S (febrero de 2005). "Detección de mutaciones puntuales fetales heredadas por vía paterna para la beta-talasemia utilizando ADN libre de células fraccionado por tamaño en el plasma materno". JAMA . 293 (7). Asociación Médica Estadounidense (AMA): 843–9. doi : 10.1001/jama.293.7.843 . PMID 15713774.
- ^ Wang E, Batey A, Struble C, Musci T, Song K, Oliphant A (julio de 2013). "Efectos de la edad gestacional y el peso materno en el ADN fetal libre en el plasma materno". Diagnóstico prenatal . 33 (7): 662–6. doi : 10.1002/pd.4119 . PMID 23553731. S2CID 31630351.
- ^ Lo YM, Tein MS, Lau TK, Haines CJ, Leung TN, Poon PM, Wainscoat JS, Johnson PJ, Chang AM, Hjelm NM (abril de 1998). "Análisis cuantitativo del ADN fetal en el plasma y suero maternos: implicaciones para el diagnóstico prenatal no invasivo". American Journal of Human Genetics . 62 (4). Elsevier BV: 768–75. doi :10.1086/301800. PMC 1377040 . PMID 9529358.
- ^ Lo YM, Zhang J, Leung TN, Lau TK, Chang AM, Hjelm NM (enero de 1999). "Aclaramiento rápido del ADN fetal del plasma materno". American Journal of Human Genetics . 64 (1). Elsevier BV: 218–24. doi :10.1086/302205. PMC 1377720 . PMID 9915961.
- ^ Lo YM, Hjelm NM, Fidler C, Sargent IL, Murphy MF, Chamberlain PF, Poon PM, Redman CW, Wainscoat JS (diciembre de 1998). "Diagnóstico prenatal del estado RhD fetal mediante análisis molecular del plasma materno". The New England Journal of Medicine . 339 (24). New England Journal of Medicine (NEJM/MMS): 1734–8. doi : 10.1056/nejm199812103392402 . PMID 9845707.
- ^ Allyse M, Sayres LC, King JS, Norton ME, Cho MK (noviembre de 2012). "Pruebas de ADN fetal en células libres para aneuploidía fetal y más allá: desafíos de integración clínica en el contexto estadounidense". Human Reproduction . 27 (11). Oxford University Press (OUP): 3123–31. doi :10.1093/humrep/des286. PMC 3472618 . PMID 22863603.
- ^ Mujezinovic F, Alfirevic Z (septiembre de 2007). "Complicaciones relacionadas con el procedimiento de amniocentesis y muestreo de vellosidades coriónicas: una revisión sistemática". Obstetricia y ginecología . 110 (3). Ovid Technologies (Wolters Kluwer Health): 687–94. doi :10.1097/01.aog.0000278820.54029.e3. PMID 17766619. S2CID 25548568.
- ^ ab Lo YM (agosto de 2008). "Ácidos nucleicos fetales en el plasma materno". Anales de la Academia de Ciencias de Nueva York . 1137 (1). Wiley-Blackwell: 140–3. Bibcode :2008NYASA1137..140L. doi :10.1196/annals.1448.004. PMID 18837938. S2CID 3445205.
- ^ "Diagnóstico prenatal no invasivo, fiable y preciso". Proyecto RAPID del NHS . Archivado desde el original el 2019-03-01 . Consultado el 2016-07-08 .
- ^ ab Hahn S, Chitty LS (abril de 2008). "Diagnóstico prenatal no invasivo: práctica actual y perspectivas futuras". Current Opinion in Obstetrics & Gynecology . 20 (2): 146–51. doi :10.1097/GCO.0b013e3282f73349. PMID 18388814. S2CID 7222299.
- ^ ab Wright CF, Burton H (22 de octubre de 2008). "El uso de ácidos nucleicos fetales libres de células en sangre materna para el diagnóstico prenatal no invasivo". Actualización en reproducción humana . 15 (1). Oxford University Press (OUP): 139–51. doi : 10.1093/humupd/dmn047 . PMID 18945714.
- ^ Lee TJ, Rolnik DL, Menezes MA, McLennan AC, da Silva Costa F (abril de 2018). "Pruebas de ADN fetal libre de células en concepciones de FIV de feto único". Human Reproduction . 33 (4): 572–578. doi : 10.1093/humrep/dey033 . PMID 29462319.
- ^ Dar P, Shani H, Evans MI (junio de 2016). "ADN libre de células: comparación de tecnologías". Clinics in Laboratory Medicine . 36 (2): 199–211. doi :10.1016/j.cll.2016.01.015. PMID 27235906.
- ^ Grace MR, Hardisty E, Dotters-Katz SK, Vora NL, Kuller JA (agosto de 2016). "Cribado de ADN fetal libre: complejidades y desafíos de la implementación clínica". Encuesta obstétrica y ginecológica . 71 (8): 477–87. doi :10.1097/OGX.0000000000000342. PMC 5548289 . PMID 27526871.
- ^ Allen S, Young E, Bowns B (abril de 2017). "Diagnóstico prenatal no invasivo para trastornos de un solo gen". Current Opinion in Obstetrics & Gynecology . 29 (2): 73–79. doi :10.1097/GCO.0000000000000347. PMID 28134670. S2CID 33474139.
- ^ Guibert J, Benachi A, Grebille AG, Ernault P, Zorn JR, Costa JM (agosto de 2003). "Cinética de la aparición del gen SRY en suero materno: detección por PCR en tiempo real en el embarazo temprano después de una técnica de reproducción asistida". Human Reproduction . 18 (8): 1733–6. doi : 10.1093/humrep/deg320 . PMID 12871892.
- ^ Chiu RW, Poon LL, Lau TK, Leung TN, Wong EM, Lo YM (septiembre de 2001). "Efectos de los protocolos de procesamiento de sangre en la cuantificación de ADN fetal y total en plasma materno". Química clínica . 47 (9): 1607–13. doi : 10.1093/clinchem/47.9.1607 . PMID 11514393.
- ^ Legler TJ, Liu Z, Mavrou A, Finning K, Hromadnikova I, Galbiati S, Meaney C, Hultén MA, Crea F, Olsson ML, Maddocks DG, Huang D, Fisher SA, Sprenger-Haussels M, Soussan AA, van der Schoot CE (septiembre de 2007). "Informe del taller sobre extracción de ADN fetal a partir de plasma materno". Diagnóstico Prenatal . 27 (9). Wiley-Blackwell: 824–9. doi :10.1002/pd.1783. PMID 17604339. S2CID 38860225.
- ^ Dhallan R, Au WC, Mattagajasingh S, Emche S, Bayliss P, Damewood M, Cronin M, Chou V, Mohr M (marzo de 2004). "Métodos para aumentar el porcentaje de ADN fetal libre recuperado de la circulación materna". JAMA . 291 (9). Asociación Médica Estadounidense (AMA): 1114–9. doi : 10.1001/jama.291.9.1114 . PMID 14996781.
- ^ Benachi A, Yamgnane A, Olivi M, Dumez Y, Gautier E, Costa JM (enero de 2005). "Impacto del formaldehído en la proporción in vitro de ADN fetal en plasma y suero maternos". Química clínica . 51 (1). Asociación Estadounidense de Química Clínica (AACC): 242–4. doi : 10.1373/clinchem.2004.038125 . PMID 15514098.
- ^ Chinnapapagari SK, Holzgreve W, Lapaire O, Zimmermann B, Hahn S (marzo de 2005). "El tratamiento de muestras de sangre materna con formaldehído no altera la proporción de ácidos nucleicos fetales circulantes (ADN y ARNm) en el plasma materno". Química clínica . 51 (3). Asociación Estadounidense de Química Clínica (AACC): 652–5. doi : 10.1373/clinchem.2004.042119 . PMID 15738521.
- ^ ab Traeger-Synodinos J (2006). "PCR en tiempo real para el diagnóstico genético prenatal y preimplantacional de enfermedades monogénicas". Aspectos moleculares de la medicina . 27 (2–3). Elsevier BV: 176–91. doi :10.1016/j.mam.2005.12.004. PMID 16430951.
- ^ Boon EM, Schlecht HB, Martin P, Daniels G, Vossen RH, den Dunnen JT, Bakker B, Elles R (octubre de 2007). "Detección del cromosoma Y mediante PCR en tiempo real y polimerización activada por pirofosforólisis utilizando ADN fetal libre aislado del plasma materno". Diagnóstico prenatal . 27 (10). Wiley-Blackwell: 932–7. doi :10.1002/pd.1804. PMID 17600849. S2CID 24498216.
- ^ Hill M, Pařízek A, Cibula D, Kancheva R, Jirásek JE, Jirkovská M, Velíková M, Kubátová J, Klímková M, Pašková A, Zižka Z, Kancheva L, Kazihnitková H, Zamrazilová L, Stárka L (octubre de 2010). "Metaboloma de esteroides en fluidos corporales fetales y maternos en la última etapa del embarazo humano". La Revista de Bioquímica de Esteroides y Biología Molecular . 122 (4). Elsevier BV: 114–32. doi :10.1016/j.jsbmb.2010.05.007. PMID 20580824. S2CID 25820012.
- ^ Al-Yatama MK, Mustafa AS, Ali S, Abraham S, Khan Z, Khaja N (mayo de 2001). "Detección de ADN específico del cromosoma Y en el plasma y la orina de mujeres embarazadas mediante reacción en cadena de la polimerasa anidada". Diagnóstico prenatal . 21 (5). Wiley-Blackwell: 399–402. doi :10.1002/pd.69. PMID 11360283. S2CID 20169086.
- ^ ab Zimmermann BG, Grill S, Holzgreve W, Zhong XY, Jackson LG, Hahn S (diciembre de 2008). "PCR digital: ¿una nueva y poderosa herramienta para el diagnóstico prenatal no invasivo?". Diagnóstico prenatal . 28 (12). Wiley-Blackwell: 1087–93. doi : 10.1002/pd.2150 . PMID 19003785. S2CID 2909830.
- ^ ab Lo YM, Lun FM, Chan KC, Tsui NB, Chong KC, Lau TK, Leung TY, Zee BC, Cantor CR, Chiu RW (agosto de 2007). "PCR digital para la detección molecular de aneuploidía cromosómica fetal". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 104 (32). Actas de la Academia Nacional de Ciencias: 13116–21. Bibcode :2007PNAS..10413116L. doi : 10.1073/pnas.0705765104 . PMC 1934923 . PMID 17664418.
- ^ Quake S (julio de 2007). "En la interfase de la física y la biología". BioTechniques . 43 (1): 19. PMID 17695250.
- ^ Chiu RW, Lo YM (noviembre de 2010). "MicroARN asociados al embarazo en el plasma materno: ¿un canal para la comunicación materno-fetal?". Química clínica . 56 (11). Asociación Estadounidense de Química Clínica (AACC): 1656–7. doi : 10.1373/clinchem.2010.153684 . PMID 20837782.
- ^ ab Ding C (2008). "Espectrometría de masas MALDI-TOF para analizar ADN fetal libre de células en plasma materno". Diagnóstico prenatal . Métodos en biología molecular. Vol. 444. Totowa, NJ: Humana Press. págs. 253–67. doi :10.1007/978-1-59745-066-9_20. ISBN . 978-1-58829-803-4. Número de identificación personal 18425487.
- ^ Akolekar R, Farkas DH, VanAgtmael AL, Bombard AT, Nicolaides KH (octubre de 2010). "Determinación del sexo fetal mediante ADN fetal libre de células circulantes (ccffDNA) entre las 11 y 13 semanas de gestación". Diagnóstico prenatal . 30 (10). Wiley-Blackwell: 918–23. doi :10.1002/pd.2582. PMID 20721878. S2CID 20744999.
- ^ Tong YK, Chiu RW, Chan KC, Leung TY, Lo YM (septiembre de 2012). "Preocupaciones técnicas sobre la inmunoprecipitación de ADN fetal metilado para el diagnóstico no invasivo de la trisomía 21". Nature Medicine . 18 (9). Springer Nature: 1327–8, respuesta del autor 1328–9. doi :10.1038/nm.2915. PMID 22961155. S2CID 31316176.
- ^ Papageorgiou EA, Karagrigoriou A, Tsaliki E, Velissariou V, Carter NP, Patsalis PC (abril de 2011). "La relación de metilación del ADN fetal específica permite el diagnóstico prenatal no invasivo de la trisomía 21". Nature Medicine . 17 (4). Springer Nature: 510–3. doi :10.1038/nm.2312. PMC 3977039 . PMID 21378977.
- ^ ab White HE, Dent CL, Hall VJ, Crolla JA, Chitty LS (14 de septiembre de 2012). Oudejans C (ed.). "Evaluación de un nuevo ensayo para la detección del marcador fetal RASSF1A: facilitando una mayor fiabilidad diagnóstica del diagnóstico prenatal no invasivo". PLOS ONE . 7 (9). Biblioteca Pública de Ciencias (PLoS): e45073. Bibcode :2012PLoSO...745073W. doi : 10.1371/journal.pone.0045073 . PMC 3443218 . PMID 23024794.
- ^ Ng EK, Tsui NB, Lam NY, Chiu RW, Yu SC, Wong SC, Lo ES, Rainer TH, Johnson PJ, Lo YM (agosto de 2002). "Presencia de ARNm filtrable y no filtrable en el plasma de pacientes con cáncer e individuos sanos". Química clínica . 48 (8): 1212–7. doi : 10.1093/clinchem/48.8.1212 . PMID 12142376.
- ^ Baird PA, Anderson TW, Newcombe HB, Lowry RB (mayo de 1988). "Trastornos genéticos en niños y adultos jóvenes: un estudio de población". American Journal of Human Genetics . 42 (5): 677–93. PMC 1715177 . PMID 3358420.
- ^ Scheffer PG, van der Schoot CE, Page-Christiaens GC, Bossers B, van Erp F, de Haas M (enero de 2010). "Fiabilidad de la determinación del sexo fetal mediante plasma materno". Obstetricia y Ginecología . 115 (1). Tecnologías Ovid (Wolters Kluwer Health): 117–26. doi :10.1097/aog.0b013e3181c3c938. PMID 20027043. S2CID 26126381.
- ^ ab Bustamante-Aragones A, Gonzalez-Gonzalez C, de Alba MR, Ainse E, Ramos C (marzo de 2010). "Diagnóstico prenatal no invasivo utilizando ccffDNA en sangre materna: estado del arte". Revisión experta de Molecular Diagnostics . 10 (2). Informa UK Limited: 197–205. doi :10.1586/erm.09.86. PMID 20214538. S2CID 207219250.
- ^ Zimmermann B, El-Sheikhah A, Nicolaides K, Holzgreve W, Hahn S (septiembre de 2005). "Medición cuantitativa optimizada de PCR en tiempo real de ADN fetal masculino en plasma materno". Química clínica . 51 (9). Asociación Estadounidense de Química Clínica (AACC): 1598–604. doi : 10.1373/clinchem.2005.051235 . PMID 16020496.
- ^ Finning KM, Chitty LS (abril de 2008). "Determinación no invasiva del sexo fetal: impacto en la práctica clínica". Seminarios en Medicina Fetal y Neonatal . 13 (2). Elsevier BV: 69–75. doi :10.1016/j.siny.2007.12.007. PMID 18243829.
- ^ Markey CM, Wadia PR, Rubin BS, Sonnenschein C, Soto AM (junio de 2005). "Efectos a largo plazo de la exposición fetal a dosis bajas del xenoestrógeno bisfenol-A en el tracto genital de ratones hembra". Biología de la reproducción . 72 (6). Oxford University Press (OUP): 1344–51. doi : 10.1095/biolreprod.104.036301 . PMID 15689538.
- ^ Sayres LC, Cho MK (julio de 2011). "Prueba de ácido nucleico fetal libre de células: una revisión de la tecnología y sus aplicaciones". Encuesta de Obstetricia y Ginecología . 66 (7). Ovid Technologies (Wolters Kluwer Health): 431–42. doi :10.1097/ogx.0b013e31822dfbe2. PMID 21944155. S2CID 17018886.
- ^ Hill M, Barrett AN, White H, Chitty LS (octubre de 2012). "Usos del ADN fetal libre de células en la circulación materna". Mejores prácticas e investigación. Obstetricia y ginecología clínica . 26 (5). Elsevier BV: 639–54. doi :10.1016/j.bpobgyn.2012.03.004. PMID 22542961.
- ^ Norbury G, Norbury CJ (abril de 2008). "Diagnóstico prenatal no invasivo de trastornos de un solo gen: ¿cuán cerca estamos?". Seminarios en Medicina Fetal y Neonatal . 13 (2). Elsevier BV: 76–83. doi :10.1016/j.siny.2007.12.008. PMID 18234572.
- ^ ab Li Y, Page-Christiaens GC, Gille JJ, Holzgreve W, Hahn S (enero de 2007). "Detección prenatal no invasiva de acondroplasia en ADN libre de células fraccionado por tamaño mediante ensayo de espectrometría de masas MALDI-TOF". Diagnóstico prenatal . 27 (1). Wiley-Blackwell: 11–7. doi :10.1002/pd.1608. PMID 17154237. S2CID 5808436.
- ^ [1] de Die-Smulders CE, de Wert GM, Liebaers I, Tibben A, Evers-Kiebooms G (2013). "Opciones reproductivas para futuros padres en familias con enfermedad de Huntington: reflexiones clínicas, psicológicas y éticas". Human Reproduction Update . 19 (3): 304–15. doi : 10.1093/humupd/dms058 . PMID 23377865.
- ^ Fan HC, Blumenfeld YJ, Chitkara U, Hudgins L, Quake SR (octubre de 2008). "Diagnóstico no invasivo de aneuploidía fetal mediante secuenciación de ADN de sangre materna". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 105 (42). Actas de la Academia Nacional de Ciencias: 16266–71. Bibcode :2008PNAS..10516266F. doi : 10.1073/pnas.0808319105 . PMC 2562413 . PMID 18838674.
- ^ ab Cardo L, García BP, Alvarez FV (agosto de 2010). "Genotipado fetal no invasivo de RHD en el primer trimestre del embarazo". Química clínica y medicina de laboratorio . 48 (8). Walter de Gruyter GmbH: 1121–6. doi :10.1515/cclm.2010.234. PMID 20482298. S2CID 31027958.
- ^ Chinen PA, Nardozza LM, Martinhago CD, Camano L, Daher S, Pares DB, Minett T, Araujo Júnior E, Moron AF (noviembre de 2010). "Determinación no invasiva del grupo sanguíneo rh fetal, estado del antígeno D mediante análisis de ADN libre de células en plasma materno: experiencia en una población brasileña". Revista Estadounidense de Perinatología . 27 (10). Georg Thieme Verlag KG: 759–62. doi :10.1055/s-0030-1253560. PMID 20408112. S2CID 25705372.
- ^ Okwundu CI, Afolabi BB (enero de 2013). "Anti-D intramuscular versus intravenoso para prevenir la aloinmunización Rh durante el embarazo". Base de datos Cochrane de revisiones sistemáticas (1): CD007885. doi :10.1002/14651858.CD007885.pub2. PMID 23440818.
- ^ Aykut A, Onay H, Sagol S, Gunduz C, Ozkinay F, Cogulu O (diciembre de 2013). "Determinación del estado rhesus d fetal mediante análisis de ADN del plasma materno". Revista Balcánica de Genética Médica . 16 (2). Walter de Gruyter GmbH: 33–8. doi :10.2478/bjmg-2013-0029. PMC 4001413 . PMID 24778561.
- ^ Svobodová I, Pazourková E, Hořínek A, Novotná M, Calda P, Korabečná M (2015). "Rendimiento de la PCR digital de gotas en el genotipado de RHD fetal no invasivo: comparación con un enfoque basado en PCR de rutina en tiempo real". MÁS UNO . 10 (11): e0142572. Código Bib : 2015PLoSO..1042572S. doi : 10.1371/journal.pone.0142572 . PMC 4642940 . PMID 26562517.
- ^ Papasavva T, Martin P, Legler TJ, Liasides M, Anastasiou G, Christofides A, Christodoulou T, Demetriou S, Kerimis P, Kontos C, Leontiades G, Papapetrou D, Patroclos T, Phylaktou M, Zottis N, Karitzie E, Pavlou E, Kountouris P, Veldhuisen B, van der Schoot E, Kleanthous M (abril de 2016). "Prevalencia del estado de RhD y aplicación clínica de la determinación prenatal no invasiva de RHD fetal en plasma materno: una experiencia de 5 años en Chipre". Notas de investigación de BMC . 9 (1). Naturaleza Springer: 198. doi : 10.1186/s13104-016-2002-x . PMC 4818414 . PMID 27036548.
- ^ Zhang B, Lu BY, Yu B, Zheng FX, Zhou Q, Chen YP, Zhang XQ (abril de 2017). "Detección prenatal no invasiva de aneuploidías de cromosomas sexuales fetales comunes a partir de sangre materna". Revista de investigación médica internacional . 45 (2). Publicaciones SAGE: 621–630. doi :10.1177/0300060517695008. PMC 5536640 . PMID 28357876.
- ^ Diagrama de Mikael Häggström, MD, que utiliza la siguiente fuente: Jacquelyn V Halliday, MSGeralyn M Messerlian, PhDLenn E Palomaki, PhD. "Educación del paciente: ¿Debería realizarme una prueba de detección del síndrome de Down durante el embarazo? (Más allá de lo básico)". UpToDate .
{{cite web}}: CS1 maint: varios nombres: lista de autores ( enlace )Este tema se actualizó por última vez el 16 de febrero de 2023. - ^ abc Kazemi M, Salehi M, Kheirollahi M (10 de agosto de 2016). "Síndrome de Down: estado actual, desafíos y perspectivas futuras". Revista internacional de medicina molecular y celular . 5 (3): 125–133. PMC 5125364 . PMID 27942498.
- ^ Mersy E, Smits LJ, van Winden LA, de Die-Smulders CE, Paulussen AD, Macville MV, Coumans AB, Frints SG (2013). "Detección no invasiva de la trisomía fetal 21: revisión sistemática e informe de la calidad y los resultados de los estudios de precisión diagnóstica realizados entre 1997 y 2012". Human Reproduction Update . 19 (4): 318–29. doi : 10.1093/humupd/dmt001 . PMID 23396607.
- ^ Clark-Ganheart CA, Iqbal SN, Brown DL, Black S, Fries MH (mayo de 2014). "Comprensión de las limitaciones del ADN fetal libre de células circulantes: un ejemplo de dos casos únicos". Revista de ginecología y obstetricia clínica . 3 (2): 38–70. doi :10.14740/jcgo229w. PMC 4185925 . PMID 25298847.
- ^ Wataganara T, LeShane ES, Farina A, Messerlian GM, Lee T, Canick JA, Bianchi DW (febrero de 2003). "Los niveles de ADN fetal libre de células en suero materno aumentan en casos de trisomía 13 pero no de trisomía 18". Human Genetics . 112 (2): 204–8. doi :10.1007/s00439-002-0853-9. PMID 12522563. S2CID 9721963.
- ^ Chiu RW, Lo YM (abril de 2011). "Diagnóstico prenatal no invasivo mediante análisis de ácidos nucleicos fetales en plasma materno: la llegada de la edad adulta". Seminarios en Medicina Fetal y Neonatal . 16 (2). Elsevier BV: 88–93. doi :10.1016/j.siny.2010.10.003. PMID 21075065.
- ^ Diagnóstico prenatal no invasivo de aneuploidía fetal mediante ácidos nucleicos fetales libres en sangre materna: política clínica (vigente a partir del 1 de mayo de 2013) Archivado el 7 de marzo de 2014 en Wayback Machine desde Oxford Health Plans
- ^ Bianchi DW, Parker RL, Wentworth J, Madankumar R, Saffer C, Das AF, Craig JA, Chudova DI, Devers PL, Jones KW, Oliver K, Rava RP, Sehnert AJ (febrero de 2014). "Secuenciación de ADN frente a detección prenatal estándar de aneuploidía". The New England Journal of Medicine . 370 (9): 799–808. doi : 10.1056/NEJMoa1311037 . PMID 24571752. S2CID 13278444.Un estudio reciente publicado en el New England Journal of Medicine demostró la viabilidad de utilizar NIPT en una población de bajo riesgo.
- ^ Henderson JT, Thompson JH, Burda BU, Cantor A (abril de 2017). "Detección de preeclampsia: informe de evidencia y revisión sistemática para el Grupo de trabajo de servicios preventivos de EE. UU.", JAMA . 317 (16). Asociación Médica Estadounidense (AMA): 1668–1683. doi :10.1001/jama.2016.18315. PMID 28444285. S2CID 205077025.
- ^ ab Seval MM, Karabulut HG, Tükün A, Koç A (2015). "ADN fetal libre de células en el plasma de mujeres embarazadas con preeclampsia". Obstetricia y ginecología clínica y experimental . 42 (6): 787–91. doi : 10.12891/ceog1982.2015 . PMID 26753487. S2CID 20971322.
- ^ Lo YM, Lau TK, Zhang J, Leung TN, Chang AM, Hjelm NM, Elmes RS, Bianchi DW (octubre de 1999). "Aumento de las concentraciones de ADN fetal en el plasma de mujeres embarazadas con fetos con trisomía 21". Química clínica . 45 (10): 1747–51. doi : 10.1093/clinchem/45.10.1747 . PMID 10508120.
- ^ Leung TN, Zhang J, Lau TK, Chan LY, Lo YM (enero de 2001). "Aumento de las concentraciones plasmáticas de ADN fetal en mujeres que finalmente desarrollan preeclampsia". Química clínica . 47 (1): 137–9. doi : 10.1093/clinchem/47.1.137 . PMID 11148193.
- ^ Zhong XY, Holzgreve W, Hahn S (2002). "Los niveles de ADN fetal libre de células circulantes en el plasma materno están elevados antes del inicio de la preeclampsia". Hipertensión en el embarazo . 21 (1). Informa UK Limited: 77–83. doi :10.1081/prg-120002911. PMID 12044339. S2CID 72519129.
- ^ Ramezanzadeh, Mahboubeh; Khosravi, Sharifeh; Salehi, Rasoul (2017). "Marcadores identificadores de ácidos nucleicos fetales libres de células en la circulación materna". Investigación biomédica avanzada . 6 (1): 89. doi : 10.4103/2277-9175.211800 . ISSN 2277-9175. PMC 5549546 . PMID 28828340.
- ^ Lo, YM Dennis; Corbetta, Noemi; Chamberlain, Paul F; Rai, Vik; Sargent, Ian L; Redman, Christopher WG; Wainscoat, James S (16 de agosto de 1997). "Presencia de ADN fetal en el plasma y suero maternos". The Lancet . 350 (9076): 485–487. doi :10.1016/S0140-6736(97)02174-0. PMID 9274585.
- ^ Hofschneider, Mark. "Pruebas prenatales no invasivas con ADN fetal". Fundación Lasker . Consultado el 6 de mayo de 2024 .
- ^ Yurkiewicz IR, Korf BR, Lehmann LS (enero de 2014). "Secuenciación prenatal del genoma completo: ¿es ética la búsqueda de conocer el futuro del feto?". The New England Journal of Medicine . 370 (3): 195–7. doi :10.1056/NEJMp1215536. PMID 24428465. S2CID 205109276.
- ^ Wellcome Trust Case Control Consortium (junio de 2007). "Estudio de asociación de todo el genoma de 14.000 casos de siete enfermedades comunes y 3.000 controles compartidos". Nature . 447 (7145): 661–78. Bibcode :2007Natur.447..661B. doi :10.1038/nature05911. PMC 2719288 . PMID 17554300.
- ^ Mailman MD, Feolo M, Jin Y, Kimura M, Tryka K, Bagoutdinov R, et al. (octubre de 2007). "La base de datos NCBI dbGaP de genotipos y fenotipos". Nature Genetics . 39 (10): 1181–6. doi :10.1038/ng1007-1181. PMC 2031016 . PMID 17898773.