Amoníaco
 | |||
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC Amoniaco [1] | |||
| Nombre sistemático de la IUPAC Azane | |||
Otros nombres
| |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| 3DMet |
| ||
| 3587154 | |||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.028.760 | ||
| Número CE |
| ||
| 79 | |||
| BARRIL | |||
| Malla | Amoníaco | ||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
| Número de la ONU | 1005 | ||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| NH3 | |||
| Masa molar | 17,031 g·mol −1 | ||
| Apariencia | Gas incoloro | ||
| Olor | Olor fuerte y penetrante | ||
| Densidad |
| ||
| Punto de fusión | −77,73 °C (−107,91 °F; 195,42 K) ( punto triple a 6,060 kPa, 195,4 K) | ||
| Punto de ebullición | -33,34 °C (-28,01 °F; 239,81 K) | ||
| Punto crítico ( T , P ) | 132,4 °C (405,5 K), 111,3 atm (11 280 kPa) | ||
| |||
| Solubilidad | soluble en cloroformo , éter , etanol , metanol | ||
| Presión de vapor | 857,3 kPa | ||
| Acidez (p K a ) | 32,5 (−33 °C), [6] 9,24 (de amonio) | ||
| Basicidad (p K b ) | 4,75 | ||
| Ácido conjugado | Amonio | ||
| Base conjugada | Amida | ||
| −18,0 × 10 −6 cm3 / mol | |||
Índice de refracción ( n D ) | 1.3327 | ||
| Viscosidad |
| ||
| Estructura | |||
| C 3v | |||
| Pirámide trigonal | |||
| 1,42 D | |||
| Termoquímica | |||
Entropía molar estándar ( S ⦵ 298 ) | 193 J/(mol·K) [8] | ||
Entalpía estándar de formación (Δ f H ⦵ 298 ) | −46 kJ/mol [8] | ||
| Peligros | |||
| Etiquetado SGA : [11] | |||
    | |||
| Peligro | |||
| H280 , H314 , H331 , H410 | |||
| P260 , P273 , P280 , P303+P361+P353 , P304+P340+P311 , P305+P351+P338+P310 | |||
| NFPA 704 (rombo cortafuegos) | |||
| 651 °C (1204 °F; 924 K) | |||
| Límites de explosividad | 15,0–33,6 % | ||
| Dosis o concentración letal (LD, LC): | |||
LD 50 ( dosis media ) | 350 mg/kg (rata, oral) [9] | ||
LC 50 ( concentración media ) |
| ||
LC Lo ( valor más bajo publicado ) | 5000 ppm (mamífero, 5 min) 5000 ppm (humano, 5 min) [10] | ||
| NIOSH (límites de exposición a la salud en EE. UU.): [12] | |||
PEL (Permisible) | 50 ppm (25 ppm ACGIH - TLV; 35 ppm STEL ) | ||
REL (recomendado) | TWA 25 ppm (18 mg/m3 ) ST 35 ppm (27 mg/ m3 ) | ||
IDLH (Peligro inmediato) | 300 ppm | ||
| Ficha de datos de seguridad (FDS) | ICSC 0414 (anhidro) | ||
| Compuestos relacionados | |||
Hidruros de nitrógeno relacionados | Hidrazina Ácido hidrazoico | ||
Compuestos relacionados | |||
| Página de datos complementarios | |||
| Amoniaco (página de datos) | |||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El amoníaco es un compuesto químico inorgánico de nitrógeno e hidrógeno con la fórmula N H 3 . Un hidruro binario estable y el hidruro pictógeno más simple, el amoníaco es un gas incoloro con un olor penetrante distintivo. Biológicamente, es un desecho nitrogenado común y contribuye significativamente a las necesidades nutricionales de los organismos terrestres al servir como precursor de fertilizantes . [13] Alrededor del 70% del amoníaco producido industrialmente se utiliza para fabricar fertilizantes [14] en varias formas y composiciones, como la urea y el fosfato diamónico . El amoníaco en forma pura también se aplica directamente al suelo.
El amoniaco, ya sea directa o indirectamente, también es un componente básico para la síntesis de muchas sustancias químicas.
El amoniaco se encuentra en la naturaleza y se ha detectado en el medio interestelar. En muchos países está clasificado como una sustancia extremadamente peligrosa . [15]
El amoníaco se produce biológicamente en un proceso llamado fijación de nitrógeno , pero se genera aún más industrialmente mediante el proceso Haber . El proceso ayudó a revolucionar la agricultura al proporcionar fertilizantes baratos. La producción industrial mundial de amoníaco en 2021 fue de 235 millones de toneladas. [16] [17] El amoníaco industrial se transporta en vagones cisterna o cilindros. [18]
El NH3 hierve a -33,34 °C (-28,012 °F) a una presión de una atmósfera , pero el líquido a menudo se puede manipular en el laboratorio sin refrigeración externa. El amoníaco doméstico o hidróxido de amonio es una solución de NH3 en agua.
Etimología
Plinio , en el Libro XXXI de su Historia Natural , se refiere a una sal llamada hammoniacum , llamada así por la proximidad de su fuente al Templo de Júpiter Amón ( griego Ἄμμων Ammon ) en la provincia romana de Cirenaica . [19] Sin embargo, la descripción que Plinio da de la sal no se ajusta a las propiedades del cloruro de amonio . Según el comentario de Herbert Hoover en su traducción al inglés de De re metallica de Georgius Agricola , es probable que haya sido sal marina común. [20] En cualquier caso, esa sal en última instancia dio al amoníaco y a los compuestos de amonio su nombre.
Ocurrencia natural (biológica)
En el agua de lluvia se encuentran trazas de amoníaco/amonio. El cloruro de amonio ( sal amoniacal ) y el sulfato de amonio se encuentran en las zonas volcánicas. En guano patagónico se han encontrado cristales de bicarbonato de amonio . [21]
El amoníaco se encuentra en todo el Sistema Solar en Marte , Júpiter , Saturno , Urano , Neptuno y Plutón , entre otros lugares: en cuerpos más pequeños y helados como Plutón, el amoníaco puede actuar como un anticongelante geológicamente importante, ya que una mezcla de agua y amoníaco puede tener un punto de fusión tan bajo como -100 °C (-148 °F; 173 K) si la concentración de amoníaco es lo suficientemente alta y, por lo tanto, permitir que dichos cuerpos retengan océanos internos y geología activa a una temperatura mucho más baja de lo que sería posible con agua sola. [22] [23] Las sustancias que contienen amoníaco, o aquellas que son similares a él, se denominan amoniacales . [24]
Propiedades
El amoníaco es un gas incoloro con un olor característico acre . Es más ligero que el aire , su densidad es 0,589 veces la del aire . Se licúa fácilmente debido a los fuertes enlaces de hidrógeno entre las moléculas. El amoníaco gaseoso se convierte en un líquido incoloro , que hierve a -33,1 °C (-27,58 °F) y se congela en cristales incoloros [21] a -77,7 °C (-107,86 °F). Hay pocos datos disponibles a temperaturas y presiones muy altas, pero el punto crítico líquido-vapor se produce a 405 K y 11,35 MPa. [25]
Sólido
La simetría del cristal es cúbica, símbolo de Pearson cP16, grupo espacial P2 1 3 No.198, constante reticular 0,5125 nm . [26]
Líquido
El amoníaco líquido posee fuertes poderes ionizantes que reflejan su alto ε de 22 a -35 °C (-31 °F). [27] El amoníaco líquido tiene un cambio de entalpía estándar de vaporización muy alto (23,5 kJ/mol ; [28] a modo de comparación, el del agua es de 40,65 kJ/mol, el del metano de 8,19 kJ/mol y el de la fosfina de 14,6 kJ/mol) y se puede transportar en recipientes presurizados o refrigerados; sin embargo, a temperatura y presión estándar, el amoníaco anhidro líquido se vaporizará. [29]
Propiedades de los disolventes
El amoniaco se disuelve fácilmente en agua. En una solución acuosa, se puede expulsar por ebullición. La solución acuosa de amoniaco es básica y puede describirse como amoniaco acuoso o hidróxido de amonio . [30] La concentración máxima de amoniaco en agua (una solución saturada ) tiene una gravedad específica de 0,880 y a menudo se la conoce como "amoniaco .880". [31]
| Temperatura (°C) | Densidad (kg/ m3 ) | Calor específico (kJ/(kg·K)) | Viscosidad cinemática (m2 / s) | Conductividad térmica (W/(m·K)) | Difusividad térmica (m2 / s) | Número de Prandtl | Módulo volumétrico (K −1 ) |
|---|---|---|---|---|---|---|---|
| -50 | 703,69 | 4.463 | 4,35 × 10 −7 | 0,547 | 1,74 × 10 −7 | 2.6 | |
| -40 | 691.68 | 4.467 | 4,06×10 −7 | 0,547 | 1,78×10 −7 | 2.28 | |
| -30 | 679.34 | 4.476 | 3,87×10 −7 | 0,549 | 1,80×10 −7 | 2.15 | |
| -20 | 666,69 | 4.509 | 3,81×10 −7 | 0,547 | 1,82×10 −7 | 2.09 | |
| -10 | 653,55 | 4.564 | 3,78×10 −7 | 0,543 | 1,83×10 −7 | 2.07 | |
| 0 | 640.1 | 4.635 | 3,73×10 −7 | 0,54 | 1,82×10 −7 | 2.05 | |
| 10 | 626,16 | 4.714 | 3,68×10 −7 | 0,531 | 1,80×10 −7 | 2.04 | |
| 20 | 611,75 | 4.798 | 3,59×10 −7 | 0,521 | 1,78×10 −7 | 2.02 | 2,45×10 −3 |
| 30 | 596.37 | 4.89 | 3,49×10 −7 | 0,507 | 1,74 × 10 −7 | 2.01 | |
| 40 | 580,99 | 4.999 | 3,40×10 −7 | 0,493 | 1,70×10 −7 | 2 | |
| 50 | 564.33 | 5.116 | 3,30×10 −7 | 0,476 | 1,65 × 10 −7 | 1,99 |
| Temperatura (K) | Densidad (kg/ m3 ) | Calor específico (kJ/(kg·K)) | Viscosidad dinámica (kg/(m·s)) | Viscosidad cinemática (m2 / s) | Conductividad térmica (W/(m·K)) | Difusividad térmica (m2 / s) | Número de Prandtl |
|---|---|---|---|---|---|---|---|
| 273 | 0,7929 | 2.177 | 9,35 × 10 −6 | 1,18×10 −5 | 0,022 | 1,31×10 −5 | 0.9 |
| 323 | 0,6487 | 2.177 | 1,10×10 −5 | 1,70×10 −5 | 0,027 | 1,92×10 −5 | 0,88 |
| 373 | 0,559 | 2.236 | 1,29×10 −5 | 1,30×10 −5 | 0,0327 | 2,62×10 −5 | 0,87 |
| 423 | 0,4934 | 2.315 | 1,47×10 −5 | 2,97×10 −5 | 0,0391 | 3,43×10 −5 | 0,87 |
| 473 | 0,4405 | 2.395 | 1,65 × 10 −5 | 3,74×10 −5 | 0,0467 | 4,42×10 −5 | 0,84 |
| 480 | 0,4273 | 2.43 | 1,67×10 −5 | 3,90×10 −5 | 0,0492 | 4,74×10 −5 | 0,822 |
| 500 | 0,4101 | 2.467 | 1,73×10 −5 | 4,22×10 −5 | 0,0525 | 5,19×10 −5 | 0,813 |
| 520 | 0,3942 | 2.504 | 1,80×10 −5 | 4,57×10 −5 | 0,0545 | 5,52×10 −5 | 0,827 |
| 540 | 0,3795 | 2.54 | 1,87×10 −5 | 4,91×10 −5 | 0,0575 | 5,97×10 −5 | 0,824 |
| 560 | 0,3708 | 2.577 | 1,93×10 −5 | 5,20×10 −5 | 0,0606 | 6,34×10 −5 | 0,827 |
| 580 | 0,3533 | 2.613 | 2,00×10 −5 | 5,65 × 10 −5 | 0,0638 | 6,91×10 −5 | 0,817 |
El amoníaco líquido es un disolvente ionizante no acuoso ampliamente estudiado. Su propiedad más destacada es su capacidad para disolver metales alcalinos para formar soluciones altamente coloreadas y eléctricamente conductoras que contienen electrones solvatados . Aparte de estas notables soluciones, gran parte de la química del amoníaco líquido se puede clasificar por analogía con reacciones relacionadas en soluciones acuosas . La comparación de las propiedades físicas del NH 3 con las del agua muestra que el NH 3 tiene el punto de fusión, el punto de ebullición, la densidad, la viscosidad , la constante dieléctrica y la conductividad eléctrica más bajos . Estas diferencias se atribuyen al menos en parte al enlace de hidrógeno más débil en el NH 3. La constante de autodisociación iónica del NH 3 líquido a −50 °C es de aproximadamente 10 −33 .

| Solubilidad (g de sal por 100 g de NH 3 líquido ) | |
|---|---|
| Acetato de amonio | 253.2 |
| Nitrato de amonio | 389.6 |
| Nitrato de litio | 243,7 |
| Nitrato de sodio | 97.6 |
| Nitrato de potasio | 10.4 |
| Fluoruro de sodio | 0,35 |
| Cloruro de sodio | 157.0 |
| Bromuro de sodio | 138.0 |
| Yoduro de sodio | 161,9 |
| Tiocianato de sodio | 205,5 |
El amoníaco líquido es un disolvente ionizante, aunque menos que el agua, y disuelve una variedad de compuestos iónicos, incluidos muchos nitratos , nitritos , cianuros , tiocianatos , complejos de ciclopentadienilo metálico y bis(trimetilsilil)amidas metálicas . [32] La mayoría de las sales de amonio son solubles y actúan como ácidos en soluciones de amoníaco líquido. La solubilidad de las sales de haluro aumenta de fluoruro a yoduro . Una solución saturada de nitrato de amonio ( solución de Divers , llamada así por Edward Divers ) contiene 0,83 moles de soluto por mol de amoníaco y tiene una presión de vapor de menos de 1 bar incluso a 25 °C (77 °F). Sin embargo, pocas sales de oxianiones con otros cationes se disuelven. [34]
El amoníaco líquido disolverá todos los metales alcalinos y otros metales electropositivos como Ca , [35] Sr , Ba , Eu e Yb (también Mg mediante un proceso electrolítico [33] ). En concentraciones bajas (<0,06 mol/L), se forman soluciones de color azul intenso: estas contienen cationes metálicos y electrones solvatados , electrones libres que están rodeados por una jaula de moléculas de amoníaco.
Estas soluciones son agentes reductores fuertes. En concentraciones más altas, las soluciones tienen un aspecto metálico y una conductividad eléctrica mejor. A bajas temperaturas, los dos tipos de soluciones pueden coexistir como fases inmiscibles.
Propiedades redox del amoniaco líquido

| E ° (V, amoniaco) | E ° (V, agua) | |
|---|---|---|
| Li + + e − ⇌ Li | -2,24 | -3,04 |
| K + + e − ⇌ K | -1,98 | -2,93 |
| Na + + e − ⇌ Na | -1,85 | -2,71 |
| Zn2 + + 2e − ⇌Zn | -0,53 | -0,76 |
| 2 [NH 4 ] + + 2 e − ⇌ H 2 + 2 NH 3 | 0.00 | — |
| Cu2 + + 2 e − ⇌ Cu | +0,43 | +0,34 |
| Ag + + e − ⇌ Ag | +0,83 | +0,80 |
El rango de estabilidad termodinámica de las soluciones de amoníaco líquido es muy estrecho, ya que el potencial de oxidación a dinitrógeno, E ° ( N2 +6[NH4 ] ++ 6e − ⇌8NH3 ) , es solo +0,04 V. En la práctica, tanto la oxidación a dinitrógeno como la reducción a dihidrógeno son lentas. Esto es particularmente cierto en el caso de las soluciones reductoras: las soluciones de los metales alcalinos mencionados anteriormente son estables durante varios días y se descomponen lentamente en la amida metálica y el dihidrógeno. La mayoría de los estudios que involucran soluciones de amoníaco líquido se realizan en condiciones reductoras; aunque la oxidación del amoníaco líquido suele ser lenta, todavía existe el riesgo de explosión, particularmente si hay iones de metales de transición como posibles catalizadores.
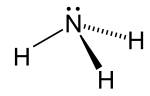
Estructura
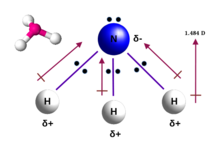

La molécula de amoníaco tiene una forma piramidal trigonal , como lo predice la teoría de repulsión de pares electrónicos de la capa de valencia (teoría VSEPR) con un ángulo de enlace determinado experimentalmente de 106,7°. [36] El átomo de nitrógeno central tiene cinco electrones externos con un electrón adicional de cada átomo de hidrógeno. Esto da un total de ocho electrones, o cuatro pares de electrones que están dispuestos tetraédricamente . Tres de estos pares de electrones se utilizan como pares de enlace, lo que deja un par solitario de electrones. El par solitario se repele con más fuerza que los pares de enlace; por lo tanto, el ángulo de enlace no es 109,5°, como se esperaba para una disposición tetraédrica regular, sino 106,8°. [36] Esta forma le da a la molécula un momento dipolar y la hace polar . La polaridad de la molécula, y especialmente su capacidad para formar enlaces de hidrógeno , hace que el amoníaco sea altamente miscible con agua. El par solitario hace que el amoníaco sea una base , un aceptor de protones. El amoníaco es moderadamente básico; Una solución acuosa de 1,0 M tiene un pH de 11,6 y si a dicha solución se le añade un ácido fuerte hasta que la solución se vuelve neutra ( pH = 7 ), el 99,4% de las moléculas de amoniaco están protonadas . La temperatura y la salinidad también afectan a la proporción de amonio [NH 4 ] + . Este último tiene la forma de un tetraedro regular y es isoelectrónico con el metano .
La molécula de amoniaco sufre fácilmente una inversión de nitrógeno a temperatura ambiente; una analogía útil es la de un paraguas que se da vuelta con un fuerte viento. La barrera energética para esta inversión es de 24,7 kJ/mol y la frecuencia de resonancia es de 23,79 GHz , que corresponde a una radiación de microondas de una longitud de onda de 1,260 cm. La absorción a esta frecuencia fue el primer espectro de microondas que se observó [37] y se utilizó en el primer máser .
Anfotericidad
Una de las propiedades más características del amoniaco es su basicidad . Se considera que el amoniaco es una base débil. Se combina con ácidos para formar sales de amonio ; así, con ácido clorhídrico forma cloruro de amonio (sal amoniacal); con ácido nítrico , nitrato de amonio , etc. El gas amoniaco perfectamente seco no se combinará con el gas cloruro de hidrógeno perfectamente seco ; la humedad es necesaria para que se produzca la reacción. [38] [39]
Como experimento de demostración bajo aire con humedad ambiental, se abren botellas de soluciones concentradas de amoníaco y ácido clorhídrico y se produce una nube de cloruro de amonio que parece surgir "de la nada" a medida que se forma el aerosol de sal donde las dos nubes de reactivos que se difunden se encuentran entre las dos botellas.
- NH3 + HCl → [NH4 ] Cl
Las sales producidas por la acción del amoniaco sobre los ácidos se conocen como sales de amonio y todas contienen el ion amonio ( [NH 4 ] + ). [38]
Aunque el amoniaco es bien conocido como una base débil, también puede actuar como un ácido extremadamente débil. Es una sustancia prótica y es capaz de formar amidas (que contienen el ion NH − 2 ). Por ejemplo, el litio se disuelve en amoniaco líquido para dar una solución azul ( electrón solvatado ) de amida de litio :
- 2 Li + 2 NH 3 → 2 LiNH 2 + H 2
Autodisociación
Al igual que el agua, el amoníaco líquido sufre autoionización molecular para formar sus conjugados ácidos y básicos :
- 2NH3 ⇌NH + 4 + NH − 2
El amoniaco suele funcionar como una base débil , por lo que tiene cierta capacidad amortiguadora . Los cambios en el pH harán que haya más o menos cationes amonio ( NH + 4 ) y aniones amida ( NH − 2 ) presentes en la solución . A presión y temperatura estándar,
- K = [NH + 4 ] × [NH - 2 ] = 10 -30 .
Combustión
El amoníaco no arde fácilmente ni mantiene la combustión , excepto en mezclas estrechas de combustible y aire de 15 a 28 % de amoníaco por volumen en el aire. [40] Cuando se mezcla con oxígeno , arde con una llama de color verde amarillento pálido. La ignición ocurre cuando el cloro pasa al amoníaco, formando nitrógeno y cloruro de hidrógeno ; si el cloro está presente en exceso, también se forma el altamente explosivo tricloruro de nitrógeno ( NCl 3 ).
La combustión del amoniaco para formar nitrógeno y agua es exotérmica :
- 4 NH 3 + 3 O 2 → 2 N 2 + 6 H 2 O(g) , Δ H ° r = −1267,20 kJ (o −316,8 kJ/mol si se expresa por mol de NH 3 )
El cambio de entalpía estándar de la combustión , Δ H ° c , expresado por mol de amoniaco y con condensación del agua formada, es de −382,81 kJ/mol. El dinitrógeno es el producto termodinámico de la combustión : todos los óxidos de nitrógeno son inestables con respecto al N 2 y al O 2 , lo que constituye el principio que subyace al convertidor catalítico . Los óxidos de nitrógeno se pueden formar como productos cinéticos en presencia de catalizadores apropiados , una reacción de gran importancia industrial en la producción de ácido nítrico :
- 4NH3 + 5O2 → 4NO + 6H2O
Una reacción posterior conduce al NO 2 :
- 2NO2 + O2 → 2NO2
La combustión de amoníaco en el aire es muy difícil en ausencia de un catalizador (como una gasa de platino o un óxido de cromo (III) caliente ), debido al calor de combustión relativamente bajo, una velocidad de combustión laminar más baja, una temperatura de autoignición alta , un calor de vaporización alto y un rango de inflamabilidad estrecho . Sin embargo, estudios recientes han demostrado que se puede lograr una combustión eficiente y estable de amoníaco utilizando cámaras de combustión de remolino, reavivando así el interés de la investigación en el amoníaco como combustible para la producción de energía térmica. [41] El rango de inflamabilidad del amoníaco en aire seco es de 15,15 a 27,35% y en aire con una humedad relativa del 100% es de 15,95 a 26,55%. [42] [ aclaración necesaria ] Para estudiar la cinética de la combustión del amoníaco, se requiere el conocimiento de un mecanismo de reacción confiable y detallado, pero esto ha sido un desafío para obtener. [43]
Precursor de compuestos organonitrógenos
El amoníaco es un precursor directo o indirecto de la mayoría de los compuestos nitrogenados manufacturados. Es el precursor del ácido nítrico, que es la fuente de la mayoría de los compuestos aromáticos N-sustituidos.
Las aminas se pueden formar mediante la reacción del amoníaco con haluros de alquilo o, más comúnmente, con alcoholes :
- CH3OH + NH3 → CH3NH2 + H2O
Su reacción de apertura de anillo con óxido de etileno produce etanolamina , dietanolamina y trietanolamina .
Las amidas se pueden preparar mediante la reacción del amoniaco con el ácido carboxílico y sus derivados. Por ejemplo, el amoniaco reacciona con el ácido fórmico (HCOOH) para producir formamida ( HCONH 2 ) cuando se calienta. Los cloruros de acilo son los más reactivos, pero el amoniaco debe estar presente en al menos un exceso del doble para neutralizar el cloruro de hidrógeno formado. Los ésteres y anhídridos también reaccionan con el amoniaco para formar amidas. Las sales de amonio de los ácidos carboxílicos se pueden deshidratar para formar amidas calentándolas a 150–200 °C, siempre que no haya grupos sensibles al calor.
- Aminoácidos , utilizando la síntesis de aminoácidos de Strecker
- Acrilonitrilo , en el proceso Sohio
Otros compuestos organonitrógenos incluyen alprazolam , etanolamina , carbamato de etilo y hexametilentetramina .
Precursor de compuestos nitrogenados inorgánicos
El ácido nítrico se genera mediante el proceso de Ostwald por oxidación del amoníaco con aire sobre un catalizador de platino a 700–850 °C (1292–1562 °F), ≈9 atm. El óxido nítrico y el dióxido de nitrógeno son intermediarios en esta conversión: [44]
- NH 3 + 2 O 2 → HNO 3 + H 2 O
El ácido nítrico se utiliza para la producción de fertilizantes , explosivos y muchos compuestos organonitrógenos.
El hidrógeno del amoniaco es susceptible de ser reemplazado por una gran cantidad de sustituyentes. El gas amoniaco reacciona con el sodio metálico para formar sodamida , NaNH 2 . [38]
Con el cloro se forma monocloramina .
El amoníaco pentavalente se conoce como λ 5 -amina; el pentahidruro de nitrógeno se descompone espontáneamente en amoníaco trivalente (λ 3 -amina) y gas hidrógeno en condiciones normales. Esta sustancia se investigó como posible combustible sólido para cohetes en 1966. [45]
El amoniaco también se utiliza para fabricar los siguientes compuestos:
- Hidracina , en el proceso Olin Raschig y en el proceso de peróxido
- Cianuro de hidrógeno , en el proceso BMA y el proceso Andrussow
- Hidroxilamina y carbonato de amonio , en el proceso Raschig
- Urea , en el proceso de urea Bosch-Meiser y en la síntesis de Wöhler
- perclorato de amonio , nitrato de amonio y bicarbonato de amonio
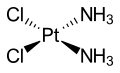
El amoníaco es un ligando que forma complejos de amina metálica . Por razones históricas, el amoníaco se denomina amina en la nomenclatura de compuestos de coordinación . Un complejo de amina notable es el cisplatino ( Pt(NH 3 ) 2 Cl 2 , un fármaco anticancerígeno ampliamente utilizado. Los complejos de amina de cromo (III) formaron la base de la teoría revolucionaria de Alfred Werner sobre la estructura de los compuestos de coordinación. Werner observó que solo se podían formar dos isómeros ( fac - y mer -) del complejo [CrCl 3 (NH 3 ) 3 ] , y concluyó que los ligandos deben estar dispuestos alrededor del ion metálico en los vértices de un octaedro .
El amoníaco forma aductos 1:1 con una variedad de ácidos de Lewis, como I 2 , fenol y Al(CH 3 ) 3 . El amoníaco es una base dura (teoría HSAB) y sus parámetros E y C son E B = 2,31 y C B = 2,04. Su fuerza donante relativa hacia una serie de ácidos, en comparación con otras bases de Lewis, se puede ilustrar mediante gráficos CB .
Detección y determinación
Amoniaco en solución
El amoníaco y las sales de amonio se pueden detectar fácilmente, en trazas muy pequeñas, mediante la adición de la solución de Nessler , que da una coloración amarilla distintiva en presencia de la más mínima traza de amoníaco o sales de amonio. La cantidad de amoníaco en las sales de amonio se puede estimar cuantitativamente mediante la destilación de las sales con sodio (NaOH) o hidróxido de potasio (KOH), absorbiendo el amoníaco desprendido en un volumen conocido de ácido sulfúrico estándar y determinando luego volumétricamente el exceso de ácido ; o el amoníaco se puede absorber en ácido clorhídrico y el cloruro de amonio así formado precipitar como hexacloroplatinato de amonio , [NH 4 ] 2 [PtCl 6 ] . [46]
Amoniaco gaseoso
Las barras de azufre se queman para detectar pequeñas fugas en los sistemas de refrigeración industriales de amoníaco. Se pueden detectar cantidades mayores calentando las sales con un álcali cáustico o con cal viva , cuando el olor característico del amoníaco será inmediatamente evidente. [46] El amoníaco es un irritante y la irritación aumenta con la concentración; el límite de exposición permisible es de 25 ppm y letal por encima de 500 ppm en volumen. [47] Los detectores convencionales apenas detectan concentraciones más altas, el tipo de detector se elige de acuerdo con la sensibilidad requerida (por ejemplo, semiconductor, catalítico, electroquímico). Se han propuesto sensores holográficos para detectar concentraciones de hasta 12,5% en volumen. [48]
En un laboratorio, el amoníaco gaseoso se puede detectar utilizando ácido clorhídrico concentrado o cloruro de hidrógeno gaseoso. De la reacción entre el amoníaco y el HCl(g) surge un humo blanco denso (que es vapor de cloruro de amonio ). [49]
Nitrógeno amoniacal (NH3-NORTE)
El nitrógeno amoniacal (NH3 - N) es una medida que se utiliza habitualmente para medir la cantidad de iones de amonio , derivados de forma natural del amoniaco y que se devuelven al amoniaco a través de procesos orgánicos, en el agua o en líquidos residuales. Es una medida que se utiliza principalmente para cuantificar valores en sistemas de tratamiento de residuos y de purificación de agua , así como para medir la salud de las reservas de agua naturales y artificiales. Se mide en unidades de mg/L ( miligramo por litro ).
Historia


El historiador griego Heródoto mencionó que había afloramientos de sal en una zona de Libia que estaba habitada por un pueblo llamado los 'ammonios' (ahora el oasis de Siwa en el noroeste de Egipto, donde todavía existen lagos salados). [50] [51] El geógrafo griego Estrabón también mencionó la sal de esta región. Sin embargo, los autores antiguos Dioscórides , Apicio , Arriano , Sinesio y Aecio de Amida describieron esta sal como formando cristales transparentes que podían usarse para cocinar y que eran esencialmente sal de roca . [52] Hammoniacus sal aparece en los escritos de Plinio , [53] aunque no se sabe si el término es equivalente al más moderno sal ammoniac (cloruro de amonio). [21] [54] [55]
La fermentación de la orina por las bacterias produce una solución de amoníaco ; por lo tanto, la orina fermentada se utilizaba en la Antigüedad clásica para lavar telas y ropa, para quitar el pelo de las pieles en preparación para el curtido, para servir como mordiente para teñir telas y para eliminar el óxido del hierro. [56] También la utilizaban los dentistas antiguos para lavar los dientes. [57] [58] [59]
En forma de sal amoniacal (نشادر, nushadir ), el amoníaco era importante para los alquimistas musulmanes . Fue mencionado en el Libro de las Piedras , probablemente escrito en el siglo IX y atribuido a Jābir ibn Hayyān . [60] También fue importante para los alquimistas europeos del siglo XIII, siendo mencionado por Alberto Magno . [21] También fue utilizado por los tintoreros en la Edad Media en forma de orina fermentada para alterar el color de los tintes vegetales. En el siglo XV, Basilio Valentín demostró que el amoníaco podía obtenerse mediante la acción de álcalis sobre la sal amoniacal. [61] En un período posterior, cuando la sal amoniacal se obtenía destilando las pezuñas y los cuernos de los bueyes y neutralizando el carbonato resultante con ácido clorhídrico , el nombre de "espíritu de cuerno de ciervo" se aplicó al amoníaco. [21] [62]
El amoníaco gaseoso fue aislado por primera vez por Joseph Black en 1756 al hacer reaccionar sal amónica ( cloruro de amonio ) con magnesia calcinada ( óxido de magnesio ). [63] [64] Fue aislado nuevamente por Peter Woulfe en 1767, [65] [66] por Carl Wilhelm Scheele en 1770 [67] y por Joseph Priestley en 1773 y fue denominado por él "aire alcalino". [21] [68] Once años después, en 1785, Claude Louis Berthollet determinó su composición. [69] [21]
La producción de amoniaco a partir del nitrógeno del aire (y del hidrógeno) fue inventada por Fritz Haber y Robert LeRossignol. La patente fue enviada en 1909 (USPTO Nr 1,202,995) y otorgada en 1916. Más tarde, Carl Bosch desarrolló el método industrial para la producción de amoniaco ( proceso Haber-Bosch ). Se utilizó por primera vez a escala industrial en Alemania durante la Primera Guerra Mundial , [70] tras el bloqueo aliado que cortó el suministro de nitratos desde Chile . El amoniaco se utilizó para producir explosivos para sostener los esfuerzos de guerra. [71] El Premio Nobel de Química de 1918 fue otorgado a Fritz Haber "por la síntesis de amoniaco a partir de sus elementos".
Antes de la disponibilidad del gas natural, el hidrógeno como precursor de la producción de amoníaco se producía mediante la electrólisis del agua o utilizando el proceso cloro-álcali .
Con la llegada de la industria del acero en el siglo XX, el amoníaco se convirtió en un subproducto de la producción de carbón de coque .
Aplicaciones
Fertilizante
En los EE. UU., en 2019 [actualizar], aproximadamente el 88% del amoníaco se utilizó como fertilizante, ya sea como sales, soluciones o anhidro. [72] Cuando se aplica al suelo, ayuda a aumentar el rendimiento de cultivos como el maíz y el trigo . [73] El 30% del nitrógeno agrícola aplicado en los EE. UU. está en forma de amoníaco anhidro y, en todo el mundo, se aplican 110 millones de toneladas cada año. [74] Las soluciones de amoníaco que varían del 16% al 25% se utilizan en la industria de la fermentación como fuente de nitrógeno para microorganismos y para ajustar el pH durante la fermentación. [75]
Refrigeración–R717
Debido a las propiedades de vaporización del amoníaco, es un refrigerante útil . [70] Se usaba comúnmente antes de la popularización de los clorofluorocarbonos (freones). El amoníaco anhidro se usa ampliamente en aplicaciones de refrigeración industrial y pistas de hockey debido a su alta eficiencia energética y bajo costo. Sufre la desventaja de la toxicidad y requiere componentes resistentes a la corrosión, lo que restringe su uso doméstico y a pequeña escala. Junto con su uso en la refrigeración moderna por compresión de vapor, se usa en una mezcla junto con hidrógeno y agua en refrigeradores de absorción . El ciclo Kalina , que es de creciente importancia para las plantas de energía geotérmica, depende del amplio rango de ebullición de la mezcla de amoníaco y agua.
El refrigerante de amoníaco también se utiliza en los radiadores a bordo de la Estación Espacial Internacional en circuitos que se utilizan para regular la temperatura interna y permitir experimentos que dependen de la temperatura. [76] [77] El amoníaco está bajo suficiente presión para permanecer líquido durante todo el proceso. Los sistemas de refrigeración de amoníaco monofásicos también sirven a la electrónica de potencia en cada par de paneles solares.
La importancia potencial del amoníaco como refrigerante ha aumentado con el descubrimiento de que los CFC y HFC liberados son gases de efecto invernadero potentes y estables. [78]
Agente antimicrobiano para productos alimenticios
Ya en 1895, se sabía que el amoníaco era "fuertemente antiséptico ... se requieren 1,4 gramos por litro para conservar el té de carne (caldo)". [79] En un estudio, el amoníaco anhidro destruyó el 99,999% de las bacterias zoonóticas en tres tipos de alimento para animales , pero no en el ensilado . [80] [81] El amoníaco anhidro se utiliza actualmente comercialmente para reducir o eliminar la contaminación microbiana de la carne de vacuno . [82] [83] La carne de vacuno magra de textura fina (conocida popularmente como " baba rosa ") en la industria de la carne de vacuno se elabora a partir de recortes grasos de carne de vacuno (c. 50-70% de grasa) eliminando la grasa mediante calor y centrifugación , y luego tratándola con amoníaco para matar E. coli . El proceso fue considerado eficaz y seguro por el Departamento de Agricultura de los EE. UU. basándose en un estudio que encontró que el tratamiento reduce E. coli a niveles indetectables. [84] Ha habido preocupaciones sobre la seguridad del proceso, así como quejas de los consumidores sobre el sabor y el olor de la carne tratada con amoníaco. [85]
Combustible

El amoníaco se ha utilizado como combustible y se ha propuesto como alternativa a los combustibles fósiles y al hidrógeno. Al ser líquido a temperatura ambiente bajo su propia presión de vapor y tener una alta densidad de energía volumétrica y gravimétrica, se considera un transportador adecuado para el hidrógeno [86] y puede ser más económico que el transporte directo de hidrógeno líquido [87] .
En comparación con el hidrógeno, el amoníaco es más fácil de almacenar. En comparación con el hidrógeno como combustible , el amoníaco es mucho más eficiente energéticamente y podría producirse, almacenarse y distribuirse a un costo mucho menor que el hidrógeno, que debe mantenerse comprimido o como líquido criogénico. [88] [89] La densidad energética bruta del amoníaco líquido es de 11,5 MJ/L, [88] que es aproximadamente un tercio de la del diésel .
El amoníaco se puede convertir nuevamente en hidrógeno para ser utilizado en el suministro de energía a las celdas de combustible de hidrógeno, o se puede utilizar directamente en celdas de combustible de amoníaco directo de óxido sólido de alta temperatura para proporcionar fuentes de energía eficientes que no emitan gases de efecto invernadero . [90] [91] La conversión de amoníaco en hidrógeno se puede lograr a través del proceso de amida de sodio [92] o la descomposición catalítica del amoníaco utilizando catalizadores sólidos. [93]

Se han propuesto y utilizado ocasionalmente motores de amoníaco o motores de amoníaco, que utilizan amoníaco como fluido de trabajo . [94] El principio es similar al utilizado en una locomotora sin fuego , pero con amoníaco como fluido de trabajo, en lugar de vapor o aire comprimido. Los motores de amoníaco se utilizaron experimentalmente en el siglo XIX por Goldsworthy Gurney en el Reino Unido y la línea de tranvías de St. Charles Avenue en Nueva Orleans en las décadas de 1870 y 1880, [95] y durante la Segunda Guerra Mundial se utilizó amoníaco para impulsar autobuses en Bélgica . [96]
El amoníaco se propone a veces como una alternativa práctica al combustible fósil para motores de combustión interna . [96] [97] [98] [99] Sin embargo, el amoníaco no se puede utilizar fácilmente en los motores de ciclo Otto existentes debido a su rango de inflamabilidad muy estrecho. A pesar de esto, se han realizado varias pruebas. [100] [101] [102] Su alto índice de octano de 120 [103] y baja temperatura de llama [104] permiten el uso de altas relaciones de compresión sin una penalización de alta producción de NO x . Dado que el amoníaco no contiene carbono, su combustión no puede producir dióxido de carbono , monóxido de carbono , hidrocarburos u hollín .
La producción de amoníaco genera actualmente el 1,8% de las emisiones globales de CO2 . El “amoníaco verde” es el amoníaco producido utilizando hidrógeno verde (hidrógeno producido por electrólisis), mientras que el “amoníaco azul” es el amoníaco producido utilizando hidrógeno azul (hidrógeno producido por reformado de metano con vapor, donde el dióxido de carbono ha sido capturado y almacenado). [105]
Los motores de cohetes también han sido alimentados con amoníaco. El motor de cohete Reaction Motors XLR99 que propulsó el avión de investigación hipersónico X-15 utilizó amoníaco líquido. Aunque no es tan potente como otros combustibles, no deja hollín en el motor de cohete reutilizable y su densidad coincide aproximadamente con la densidad del oxidante, el oxígeno líquido , lo que simplificó el diseño del avión.
En 2020, Arabia Saudita envió 40 toneladas métricas de "amoniaco azul" líquido a Japón para su uso como combustible. [106] Se produjo como subproducto de las industrias petroquímicas y se puede quemar sin emitir gases de efecto invernadero . Su densidad energética por volumen es casi el doble de la del hidrógeno líquido. Si el proceso de creación se puede ampliar a través de recursos puramente renovables, produciendo amoniaco verde, podría marcar una gran diferencia para evitar el cambio climático . [107] La empresa ACWA Power y la ciudad de Neom han anunciado la construcción de una planta de hidrógeno y amoniaco verde en 2020. [108]
El amoniaco verde se considera un combustible potencial para los futuros buques portacontenedores. En 2020, las empresas DSME y MAN Energy Solutions anunciaron la construcción de un buque a base de amoniaco; DSME planea comercializarlo en 2025. [109] También se está explorando el uso del amoniaco como posible combustible alternativo para los motores a reacción de los aviones . [110]
Japón tiene la intención de implementar un plan para desarrollar una tecnología de co-combustión de amoníaco que pueda aumentar el uso de amoníaco en la generación de energía, como parte de los esfuerzos para ayudar a las empresas de servicios públicos nacionales y de otros países asiáticos a acelerar su transición a la neutralidad de carbono . [111] En octubre de 2021, se celebró la primera Conferencia Internacional sobre Amoníaco Combustible (ICFA2021). [112] [113]
En junio de 2022, IHI Corporation logró reducir los gases de efecto invernadero en más del 99% durante la combustión de amoníaco líquido en una turbina de gas de 2000 kilovatios, logrando una generación de energía verdaderamente libre de CO2 . [ 114] En julio de 2022, las naciones del Quad (Japón, EE . UU., Australia e India) acordaron promover el desarrollo tecnológico para el hidrógeno y el amoníaco de combustión limpia como combustibles en la primera reunión de energía del grupo de seguridad. [115] Sin embargo, a partir de 2022 [actualizar], se producen cantidades significativas de NOx. [ 116] El óxido nitroso también puede ser un problema, ya que es un " gas de efecto invernadero que se sabe que posee hasta 300 veces el potencial de calentamiento global (GWP) del dióxido de carbono ". [117]
A alta temperatura y en presencia de un catalizador adecuado , el amoníaco se descompone en sus elementos constituyentes. [118] La descomposición del amoníaco es un proceso ligeramente endotérmico que requiere 23 kJ/mol (5,5 kcal/mol ) de amoníaco y produce hidrógeno y nitrógeno gaseoso.
Otro
Remediación de emisiones gaseosas
El amoníaco se utiliza para depurar el SO2 de la quema de combustibles fósiles, y el producto resultante se convierte en sulfato de amonio para su uso como fertilizante. El amoníaco neutraliza los contaminantes de óxido de nitrógeno ( NOx ) emitidos por los motores diésel. Esta tecnología, llamada SCR ( reducción catalítica selectiva ), se basa en un catalizador basado en vanadio . [119]
Se puede utilizar amoníaco para mitigar los derrames gaseosos de fosgeno . [120]
Estimulante

El amoníaco, en forma de vapor liberado por las sales aromáticas , ha encontrado un uso significativo como estimulante respiratorio. El amoníaco se utiliza comúnmente en la fabricación ilegal de metanfetamina mediante una reducción de Birch . [122] El método Birch para fabricar metanfetamina es peligroso porque el metal alcalino y el amoníaco líquido son extremadamente reactivos, y la temperatura del amoníaco líquido lo hace susceptible a una ebullición explosiva cuando se agregan reactivos. [123]
Textil
El amoníaco líquido se utiliza para el tratamiento de tejidos de algodón, confiriéndoles propiedades como la mercerización , mediante el uso de álcalis. En particular, se utiliza para el prelavado de la lana. [124]
Gas de elevación
A temperatura y presión estándar, el amoníaco es menos denso que la atmósfera y tiene aproximadamente entre el 45 y el 48 % del poder de sustentación del hidrógeno o el helio . El amoníaco se ha utilizado a veces para llenar globos como gas de sustentación . Debido a su punto de ebullición relativamente alto (en comparación con el helio y el hidrógeno), el amoníaco podría refrigerarse y licuarse a bordo de un dirigible para reducir la sustentación y agregar lastre (y volver a convertirse en gas para agregar sustentación y reducir el lastre). [125]
Fumando
Se ha utilizado amoníaco para oscurecer el roble blanco aserrado en cuartos en muebles de estilo Arts & Crafts y Mission. Los vapores de amoníaco reaccionan con los taninos naturales de la madera y hacen que cambie de color. [126]
Seguridad

La Administración de Seguridad y Salud Ocupacional de los Estados Unidos (OSHA) ha establecido un límite de exposición de 15 minutos para el amoníaco gaseoso de 35 ppm por volumen en el aire ambiental y un límite de exposición de 8 horas de 25 ppm por volumen. [128] El Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH) redujo recientemente el IDLH (Inmediatamente Peligroso para la Vida y la Salud, el nivel al que un trabajador sano puede estar expuesto durante 30 minutos sin sufrir efectos irreversibles para la salud) de 500 a 300 basándose en interpretaciones recientes más conservadoras de la investigación original de 1943. Otras organizaciones tienen diferentes niveles de exposición. Estándares de la Marina de los Estados Unidos [US Bureau of Ships 1962] concentraciones máximas permitidas (MAC): para exposición continua (60 días) es 25 ppm; para exposición de 1 hora es 400 ppm. [129]
El vapor de amoníaco tiene un olor penetrante, fuerte e irritante que actúa como advertencia de una exposición potencialmente peligrosa. El umbral de olor promedio es de 5 ppm, muy por debajo de cualquier peligro o daño. La exposición a concentraciones muy altas de amoníaco gaseoso puede provocar daño pulmonar y muerte. [128] El amoníaco está regulado en los EE. UU. como un gas no inflamable, pero cumple con la definición de material tóxico por inhalación y requiere un permiso de seguridad peligroso cuando se transporta en cantidades superiores a 3500 galones estadounidenses (13 000 L; 2900 galones imperiales). [130]
El amoníaco líquido es peligroso porque es higroscópico y puede provocar quemaduras cáusticas . Para obtener más información, consulte el apartado Gasero § Efectos sobre la salud de cargas específicas transportadas en gaseros .
Toxicidad
La toxicidad de las soluciones de amoníaco no suele causar problemas para los seres humanos y otros mamíferos, ya que existe un mecanismo específico para evitar su acumulación en el torrente sanguíneo. El amoníaco se convierte en carbamoil fosfato por la enzima carbamoil fosfato sintetasa , y luego entra en el ciclo de la urea para incorporarse a los aminoácidos o excretarse en la orina. [131] Los peces y los anfibios carecen de este mecanismo, ya que normalmente pueden eliminar el amoníaco de sus cuerpos por excreción directa. El amoníaco incluso en concentraciones diluidas es altamente tóxico para los animales acuáticos, y por esta razón se clasifica como peligroso para el medio ambiente . El amoníaco atmosférico juega un papel clave en la formación de partículas finas . [132]
El amoniaco es un componente del humo del tabaco . [133]
Aguas residuales de coquización
El amoníaco está presente en las corrientes de aguas residuales de la coquización, como un subproducto líquido de la producción de coque a partir de carbón . [134] En algunos casos, el amoníaco se descarga al medio marino donde actúa como contaminante. La acería Whyalla en Australia del Sur es un ejemplo de una instalación de producción de coque que descarga amoníaco en aguas marinas. [135]
Acuicultura
Se cree que la toxicidad del amoníaco es una causa de pérdidas inexplicables en los criaderos de peces . El exceso de amoníaco puede acumularse y provocar alteraciones del metabolismo o aumentos del pH corporal del organismo expuesto. La tolerancia varía entre las especies de peces. [136] En concentraciones más bajas, alrededor de 0,05 mg/L, el amoníaco no ionizado es perjudicial para las especies de peces y puede provocar un crecimiento deficiente y tasas de conversión alimenticia, una fecundidad y fertilidad reducidas y un aumento del estrés y la susceptibilidad a infecciones y enfermedades bacterianas. [137] Expuestos al exceso de amoníaco, los peces pueden sufrir pérdida de equilibrio, hiperexcitabilidad, aumento de la actividad respiratoria y la absorción de oxígeno y aumento de la frecuencia cardíaca. [136] En concentraciones superiores a 2,0 mg/L, el amoníaco provoca daños en las branquias y los tejidos, letargo extremo, convulsiones, coma y muerte. [136] [138] Los experimentos han demostrado que la concentración letal para una variedad de especies de peces varía de 0,2 a 2,0 mg/L. [138]
Durante el invierno, cuando se administran menos alimentos a los peces de acuicultura, los niveles de amoníaco pueden ser más altos. Las temperaturas ambientales más bajas reducen la tasa de fotosíntesis de las algas, por lo que las algas presentes eliminan menos amoníaco. En un entorno de acuicultura, especialmente a gran escala, no existe un remedio de acción rápida para los niveles elevados de amoníaco. Se recomienda la prevención en lugar de la corrección para reducir el daño a los peces de cultivo [138] y, en sistemas de agua abierta, al entorno circundante.
Información de almacenamiento
Similar al propano , el amoníaco anhidro hierve por debajo de la temperatura ambiente cuando está a presión atmosférica. Un recipiente de almacenamiento capaz de 250 psi (1,7 MPa ) es adecuado para contener el líquido. [139] El amoníaco se utiliza en numerosas aplicaciones industriales diferentes que requieren recipientes de almacenamiento de acero inoxidable o de carbono. El amoníaco con al menos un 0,2% en peso de contenido de agua no es corrosivo para el acero al carbono. Los tanques de almacenamiento de construcción de acero al carbono NH3 con 0,2% en peso o más de agua podrían durar más de 50 años en servicio. [140] Los expertos advierten que no se debe permitir que los compuestos de amonio entren en contacto con bases (a menos que sea en una reacción intencionada y contenida), ya que podrían liberarse cantidades peligrosas de gas amoníaco.
Laboratorio
.jpg/440px-Ammonia_solution_(25-28%).jpg)
Los peligros de las soluciones de amoniaco dependen de la concentración: las soluciones de amoniaco "diluidas" suelen tener una concentración del 5 al 10 % en peso (< 5,62 mol/L); las soluciones "concentradas" se preparan normalmente a una concentración >25 % en peso. Una solución al 25 % (en peso) tiene una densidad de 0,907 g/cm 3 , y una solución con una densidad menor estará más concentrada. La clasificación de la Unión Europea de las soluciones de amoniaco se muestra en la tabla.
| Concentración en peso (p/p) | Molaridad | Concentración masa/volumen (p/v) | Pictogramas del SGA | Frases con H |
|---|---|---|---|---|
| 5–10% | 2,87–5,62 mol/l | 48,9–95,7 g/l |  | H314 |
| 10–25% | 5,62–13,29 mol/l | 95,7–226,3 g/l |   | H314 , H335 , H400 |
| >25% | >13,29 mol/L | >226,3 g/L |    | H314 , H335 , H400 , H411 |
El vapor de amoníaco de las soluciones concentradas de amoníaco es muy irritante para los ojos y el tracto respiratorio , y los expertos advierten que estas soluciones solo se deben manipular en una campana extractora de humos . Las soluciones saturadas ('0,880'; consulte § Propiedades ) pueden desarrollar una presión significativa dentro de una botella cerrada en climas cálidos, y los expertos también advierten que la botella se debe abrir con cuidado. Esto no suele ser un problema para las soluciones al 25 % ('0,900').
Los expertos advierten que las soluciones de amoniaco no deben mezclarse con halógenos , ya que se forman productos tóxicos y/o explosivos. Los expertos también advierten que el contacto prolongado de las soluciones de amoniaco con sales de plata , mercurio o yoduro también puede dar lugar a productos explosivos: este tipo de mezclas se forman a menudo en el análisis inorgánico cualitativo y que es necesario acidificarlas ligeramente, pero no concentrarlas (<6% p/v) antes de desecharlas una vez finalizado el ensayo.
Uso en laboratorio de amoniaco anhidro (gas o líquido)
El amoníaco anhidro está clasificado como tóxico ( T ) y peligroso para el medio ambiente ( N ). El gas es inflamable ( temperatura de autoignición : 651 °C) y puede formar mezclas explosivas con el aire (16–25%). El límite de exposición permisible (PEL) en los Estados Unidos es de 50 ppm (35 mg/m 3 ), mientras que la concentración IDLH se estima en 300 ppm. La exposición repetida al amoníaco reduce la sensibilidad al olor del gas: normalmente, el olor es detectable en concentraciones inferiores a 50 ppm, pero las personas desensibilizadas pueden no detectarlo incluso en concentraciones de 100 ppm. El amoníaco anhidro corroe las aleaciones que contienen cobre y zinc , lo que hace que los accesorios de latón no sean apropiados para manipular el gas. El amoníaco líquido también puede atacar el caucho y ciertos plásticos.
El amoniaco reacciona violentamente con los halógenos . El triyoduro de nitrógeno , un explosivo primario de alto poder , se forma cuando el amoniaco entra en contacto con el yodo . El amoniaco provoca la polimerización explosiva del óxido de etileno . También forma compuestos explosivos fulminantes con compuestos de oro , plata , mercurio , germanio o telurio , y con estibina . También se han descrito reacciones violentas con acetaldehído , soluciones de hipoclorito , ferricianuro de potasio y peróxidos .
Producción
El amoniaco tiene una de las tasas de producción más altas de cualquier sustancia química inorgánica. La producción a veces se expresa en términos de "nitrógeno fijado". Se estimó que la producción mundial fue de 160 millones de toneladas en 2020 (147 toneladas de nitrógeno fijado). [142] China representó el 26,5% de esa cantidad, seguida de Rusia con el 11,0%, Estados Unidos con el 9,5% y la India con el 8,3%. [142]
Antes del inicio de la Primera Guerra Mundial , la mayor parte del amoníaco se obtenía mediante la destilación en seco [143] de desechos vegetales y animales nitrogenados, incluido el estiércol de camello , donde se destilaba mediante la reducción de ácido nitroso y nitritos con hidrógeno; además, se producía mediante la destilación de carbón , y también mediante la descomposición de sales de amonio mediante hidróxidos alcalinos [144] como la cal viva : [21]
Para la síntesis de laboratorio a pequeña escala, se puede calentar urea e hidróxido de calcio o hidróxido de sodio :
- (NH 2 ) 2 CO + Ca(OH) 2 → CaCO 3 + 2 NH 3
Haber-Bosch

El proceso Haber , [145] también llamado proceso Haber-Bosch, es el principal procedimiento industrial para la producción de amoniaco . [146] [147] Convierte el nitrógeno atmosférico (N 2 ) en amoniaco (NH 3 ) mediante una reacción con hidrógeno (H 2 ) utilizando un catalizador de metal de hierro finamente dividido :
Esta reacción es ligeramente favorable en términos de entalpía , pero desfavorable en términos de entropía porque cuatro equivalentes de gases reactivos se convierten en dos equivalentes de gas producto. Como resultado, se necesitan altas presiones y temperaturas moderadamente altas para impulsar la reacción .
Los químicos alemanes Fritz Haber y Carl Bosch desarrollaron el proceso en la primera década del siglo XX, y su eficiencia mejorada sobre los métodos existentes como los procesos Birkeland-Eyde y Frank-Caro fue un avance importante en la producción industrial de amoníaco. [148] [149] [150] El proceso Haber se puede combinar con el reformado con vapor para producir amoníaco con solo tres insumos químicos: agua, gas natural y nitrógeno atmosférico. Tanto Haber como Bosch finalmente recibieron el Premio Nobel de Química : Haber en 1918 por la síntesis de amoníaco específicamente, y Bosch en 1931 por contribuciones relacionadas con la química de alta presión .Electroquímica
El amoniaco se puede sintetizar electroquímicamente. Los únicos insumos necesarios son fuentes de nitrógeno (potencialmente atmosférico) e hidrógeno (agua), lo que permite su generación en el punto de uso. La disponibilidad de energía renovable crea la posibilidad de una producción con cero emisiones. [151] [152]
El amoniaco verde es el nombre que recibe el amoniaco producido a partir de hidrógeno, que a su vez se produce a partir de fuentes libres de carbono, como la electrólisis del agua. El amoniaco de esta fuente se puede utilizar como combustible líquido sin contribuir en nada al cambio climático global .
Otro modo de síntesis electroquímica implica la formación reductora de nitruro de litio , que puede ser protonado a amoníaco, dada una fuente de protones , que puede ser hidrógeno. En los primeros años del desarrollo de este proceso, se ha utilizado etanol como tal fuente. El primer uso de esta química se informó en 1930, donde se utilizaron soluciones de litio en etanol para producir amoníaco a presiones de hasta 1000 bar. [153] En 1994, Tsuneto et al. utilizaron electrodeposición de litio en tetrahidrofurano para sintetizar amoníaco a presiones más moderadas con una eficiencia faradaica razonable . [154] Estudios posteriores han explorado más a fondo el sistema etanol-tetrahidrofurano para la síntesis electroquímica de amoníaco. [155] [156] Más allá de simplemente mediar la transferencia de protones a la reacción de reducción de nitrógeno, se ha descubierto que el etanol desempeña un papel multifacético, influyendo en las transformaciones de electrolitos y contribuyendo a la formación de la interfase de electrolito sólido, lo que mejora la eficiencia general de la reacción [157] [155]
En 2020, se demostró que un electrodo de difusión de gas independiente del solvente mejora el transporte de nitrógeno al litio reactivo. Se lograron tasas de producción de NH3 de hasta 30 ± 5 nmol/s/cm2 y eficiencias faradaicas de hasta 47,5 ± 4 % a temperatura ambiente y 1 bar de presión. [158]
El etanol se puede reemplazar con una sal de tetraalquilfosfonio . [159] El estudio observó tasas de producción de NH3 de 53 ± 1 nmol/s/cm2 en experimentos de eficiencia faradaica de 69 ± 1% bajo una presión parcial de hidrógeno de 0,5 bar y nitrógeno de 19,5 bar a temperatura ambiente. [159]
En 2022, se produjo amoníaco mediante un proceso mediado por litio en un electrolizador de flujo continuo, demostrando también que el gas hidrógeno es una fuente de protones. El estudio sintetizó amoníaco con una eficiencia faradaica del 61 ± 1 % a una densidad de corriente de −6 mA/cm 2 a 1 bar y temperatura ambiente. [160]
Bioquímica y medicina

El amoniaco es esencial para la vida. [162] Por ejemplo, es necesario para la formación de aminoácidos y ácidos nucleicos , componentes básicos de la vida. Sin embargo, el amoniaco es bastante tóxico. Por ello, la naturaleza utiliza transportadores para el amoniaco. Dentro de la célula, el glutamato cumple esta función. En el torrente sanguíneo, la glutamina es una fuente de amoniaco. [163]
La etanolamina, necesaria para las membranas celulares, es el sustrato de la etanolamina amoniaco-liasa , que produce amoniaco: [164]
- H 2 NCH 2 CH 2 OH → NH 3 + CH 3 CHO
El amoníaco es tanto un residuo metabólico como un insumo metabólico en toda la biosfera . Es una fuente importante de nitrógeno para los sistemas vivos. Aunque el nitrógeno atmosférico abunda (más del 75%), pocas criaturas vivientes son capaces de utilizar el nitrógeno atmosférico en su forma diatómica , el gas N2 . Por lo tanto, la fijación de nitrógeno es necesaria para la síntesis de aminoácidos , que son los componentes básicos de las proteínas . Algunas plantas dependen del amoníaco y otros desechos nitrogenados incorporados al suelo por la materia en descomposición. Otras, como las legumbres fijadoras de nitrógeno , se benefician de las relaciones simbióticas con las bacterias rizobias que crean amoníaco a partir del nitrógeno atmosférico. [165]
En los seres humanos, la inhalación de amoníaco en altas concentraciones puede ser mortal. La exposición al amoníaco puede causar dolores de cabeza , edemas , deterioro de la memoria, convulsiones y coma , ya que es neurotóxico por naturaleza. [166]
Biosíntesis
En ciertos organismos, el amoníaco se produce a partir del nitrógeno atmosférico mediante enzimas llamadas nitrogenasas . El proceso global se denomina fijación de nitrógeno . Se han hecho grandes esfuerzos para comprender el mecanismo de la fijación biológica del nitrógeno . El interés científico en este problema está motivado por la estructura inusual del sitio activo de la enzima, que consiste en un conjunto Fe7MoS9 . [167]
El amoníaco también es un producto metabólico de la desaminación de aminoácidos catalizada por enzimas como la glutamato deshidrogenasa 1. La excreción de amoníaco es común en animales acuáticos. En los humanos, se convierte rápidamente en urea (por el hígado ), que es mucho menos tóxica, particularmente menos básica. Esta urea es un componente principal del peso seco de la orina . La mayoría de los reptiles, aves, insectos y caracoles excretan ácido úrico únicamente como desecho nitrogenado.
Fisiología
El amoníaco desempeña un papel en la fisiología animal normal y anormal . Se biosintetiza a través del metabolismo normal de aminoácidos y es tóxico en altas concentraciones. El hígado convierte el amoníaco en urea a través de una serie de reacciones conocidas como el ciclo de la urea . La disfunción hepática, como la que se observa en la cirrosis , puede provocar cantidades elevadas de amoníaco en la sangre ( hiperamonemia ). Del mismo modo, los defectos en las enzimas responsables del ciclo de la urea, como la ornitina transcarbamilasa , provocan hiperamonemia . La hiperamonemia contribuye a la confusión y al coma de la encefalopatía hepática , así como a la enfermedad neurológica común en personas con defectos del ciclo de la urea y acidurias orgánicas . [168]
El amoníaco es importante para el equilibrio ácido/base normal de los animales. Después de la formación de amonio a partir de glutamina , el α-cetoglutarato puede degradarse para producir dos iones de bicarbonato , que luego están disponibles como amortiguadores para los ácidos de la dieta. El amonio se excreta en la orina, lo que da como resultado una pérdida neta de ácido. El amoníaco puede difundirse a través de los túbulos renales , combinarse con un ion de hidrógeno y, de este modo, permitir una mayor excreción de ácido . [169]
Excreción
Los iones de amonio son un producto de desecho tóxico del metabolismo de los animales . En los peces y los invertebrados acuáticos, se excreta directamente en el agua. En los mamíferos, tiburones y anfibios, se convierte en el ciclo de la urea en urea , que es menos tóxica y se puede almacenar de forma más eficiente. En las aves, los reptiles y los caracoles terrestres, el amonio metabólico se convierte en ácido úrico , que es sólido y, por lo tanto, se puede excretar con una pérdida mínima de agua. [170]
Aparición extraterrestre

Se ha detectado amoníaco en las atmósferas de los planetas gigantes Júpiter , Saturno , Urano y Neptuno , junto con otros gases como metano , hidrógeno y helio . El interior de Saturno puede incluir cristales de amoníaco congelados. [171] Se encuentra en Deimos y Fobos , las dos lunas de Marte . [ cita requerida ]
Espacio interestelar
El amoníaco se detectó por primera vez en el espacio interestelar en 1968, basándose en emisiones de microondas procedentes de la dirección del núcleo galáctico . [172] Esta fue la primera molécula poliatómica en ser detectada de esta manera. La sensibilidad de la molécula a una amplia gama de excitaciones y la facilidad con la que se puede observar en varias regiones han hecho del amoníaco una de las moléculas más importantes para los estudios de nubes moleculares . [173] La intensidad relativa de las líneas de amoníaco se puede utilizar para medir la temperatura del medio emisor.
Se han detectado las siguientes especies isotópicas de amoniaco: NH 3 , 15 NH 3 , NH 2 D , NHD 2 y ND 3 . La detección de amoniaco triplemente deuterado se consideró una sorpresa ya que el deuterio es relativamente escaso. Se cree que las condiciones de baja temperatura permiten que esta molécula sobreviva y se acumule. [174]
Desde su descubrimiento interestelar, el NH3 ha demostrado ser una herramienta espectroscópica inestimable en el estudio del medio interestelar. Con una gran cantidad de transiciones sensibles a una amplia gama de condiciones de excitación, el NH3 ha sido ampliamente detectado astronómicamente; su detección ha sido reportada en cientos de artículos de revistas. A continuación, se incluye una muestra de artículos de revistas que destacan la variedad de detectores que se han utilizado para identificar el amoníaco.
El estudio del amoníaco interestelar ha sido importante para diversas áreas de investigación en las últimas décadas. Algunas de ellas se describen a continuación y se basan principalmente en el uso del amoníaco como termómetro interestelar.
Mecanismos de formación interestelar
Se ha medido la abundancia interestelar de amoníaco en diversos entornos. Se ha estimado que la relación [ NH 3 ]/[ H 2 ] varía entre 10 −7 en pequeñas nubes oscuras [175] y 10 −5 en el núcleo denso del complejo de nubes moleculares de Orión . [176] Aunque se han propuesto un total de 18 rutas de producción totales, [177] el principal mecanismo de formación del NH 3 interestelar es la reacción:
- [NH 4 ] + + mi − → NH 3 + H
La constante de velocidad, k , de esta reacción depende de la temperatura del entorno, con un valor de a 10 K. [178] La constante de velocidad se calculó a partir de la fórmula . Para la reacción de formación primaria, a = 1,05 × 10 −6 y B = −0,47 . Suponiendo unaabundancia de NH + 4 y una abundancia de electrones de 10 −7 típica de las nubes moleculares, la formación se realizará a una velocidad de1,6 × 10 −9 cm −3 s −1 en una nube molecular de densidad total10 5 cm −3 . [179]
Todas las demás reacciones de formación propuestas tienen constantes de velocidad de entre dos y 13 órdenes de magnitud menores, lo que hace que su contribución a la abundancia de amoníaco sea relativamente insignificante. [180] Como ejemplo de la pequeña contribución de otras reacciones de formación, la reacción:
- H2 + NH2 → NH3 + H
tiene una constante de velocidad de 2,2 × 10 −15 . Suponiendo densidades de H 2 de 10 5 y una relación [ NH 2 ]/[ H 2 ] de 10 −7 , esta reacción avanza a una velocidad de 2,2 × 10 −12 , más de tres órdenes de magnitud más lenta que la reacción primaria anterior.
Algunas de las otras posibles reacciones de formación son:
- H − + [NH 4 ] + → NH 3 + H 2
- [PNH3 ] + + e− → P+ NH3
Mecanismos de destrucción interestelar
Se han propuesto 113 reacciones en total que conducen a la destrucción del NH 3 . De ellas, 39 se tabularon en extensas tablas de la química entre los compuestos de C, N y O. [181] Una revisión del amoníaco interestelar cita las siguientes reacciones como los principales mecanismos de disociación: [173]
| NH 3 + [H 3 ] + → [NH 4 ] + + H 2 | ( 1 ) |
| NH 3 + HCO + → [NH 4 ] + + CO | ( 2 ) |
con constantes de velocidad de 4,39×10 −9 [182] y 2,2×10 −9 , [183] respectivamente. Las ecuaciones anteriores ( 1 , 2 ) se ejecutan a una velocidad de 8,8×10 −9 y 4,4×10 −13 , respectivamente. Estos cálculos asumieron las constantes de velocidad y abundancias dadas de [ NH 3 ]/[ H 2 ] = 10 −5 , [ [H 3 ] + ]/[ H 2 ] = 2×10 −5 , [ HCO + ]/[ H 2 ] = 2×10 −9 , y densidades totales de n = 10 5 , típicas de nubes moleculares densas y frías. [184] Claramente, entre estas dos reacciones primarias, la ecuación ( 1 ) es la reacción de destrucción dominante, con una velocidad ≈10.000 veces más rápida que la ecuación ( 2 ). Esto se debe a la abundancia relativamente alta de [H 3 ] + .
Detecciones de antena única
Las observaciones de radio de NH3 realizadas con el radiotelescopio Effelsberg de 100 m revelan que la línea de amoníaco está dividida en dos componentes: una cresta de fondo y un núcleo no resuelto. El fondo se corresponde bien con las ubicaciones en las que se había detectado CO anteriormente. [185] El telescopio Chilbolton de 25 m en Inglaterra detectó firmas de radio de amoníaco en regiones H II , máseres HNH2O , objetos H–H y otros objetos asociados con la formación de estrellas. Una comparación de los anchos de las líneas de emisión indica que las velocidades turbulentas o sistemáticas no aumentan en los núcleos centrales de las nubes moleculares. [186]
Se observó radiación de microondas del amoníaco en varios objetos galácticos, entre ellos W3(OH), Orión A , W43 , W51 y cinco fuentes en el centro galáctico. La alta tasa de detección indica que se trata de una molécula común en el medio interestelar y que las regiones de alta densidad son comunes en la galaxia. [187]
Estudios interferométricos
Las observaciones del VLA de NH 3 en siete regiones con efluentes gaseosos de alta velocidad revelaron condensaciones de menos de 0,1 pc en L1551, S140 y Cepheus A. Se detectaron tres condensaciones individuales en Cepheus A, una de ellas con una forma muy alargada. Pueden desempeñar un papel importante en la creación del efluente bipolar en la región. [188]
El amoníaco extragaláctico se fotografió utilizando el VLA en IC 342. El gas caliente tiene temperaturas superiores a 70 K, lo que se dedujo a partir de las proporciones de las líneas de amoníaco y parece estar estrechamente asociado con las porciones más internas de la barra nuclear observada en CO. [189] El NH3 también fue monitoreado por el VLA hacia una muestra de cuatro regiones HII ultracompactas galácticas: G9.62+0.19, G10.47+0.03, G29.96-0.02 y G31.41+0.31. Con base en los diagnósticos de temperatura y densidad, se concluye que, en general, dichos cúmulos son probablemente los sitios de formación de estrellas masivas en una fase evolutiva temprana antes del desarrollo de una región HII ultracompacta. [190]
Detecciones infrarrojas
Se registró una absorción a 2,97 micrómetros debida al amoníaco sólido en los granos interestelares del objeto Becklin-Neugebauer y probablemente también en NGC 2264-IR. Esta detección ayudó a explicar la forma física de las líneas de absorción de hielo relacionadas con ellas, que hasta entonces no se entendían bien. [191]
Se obtuvo un espectro del disco de Júpiter del Observatorio Aerotransportado Kuiper , que cubre el rango espectral de 100 a 300 cm −1 . El análisis del espectro proporciona información sobre las propiedades medias globales del gas amoniaco y de una neblina de hielo de amoniaco. [192]
Se estudiaron un total de 149 posiciones de nubes oscuras en busca de evidencia de "núcleos densos" utilizando la línea de inversión rotatoria (J,K) = (1,1) de NH 3 . En general, los núcleos no tienen forma esférica, con relaciones de aspecto que varían de 1,1 a 4,4. También se encontró que los núcleos con estrellas tienen líneas más anchas que los núcleos sin estrellas. [193]
Se ha detectado amoníaco en la Nebulosa Draco y en una o posiblemente dos nubes moleculares, que están asociadas con los cirros infrarrojos galácticos de alta latitud . El hallazgo es significativo porque pueden representar los lugares de nacimiento de las estrellas de tipo B de metalicidad de Población I en el halo galáctico que podrían haber surgido en el disco galáctico. [194]
Observaciones de nubes oscuras cercanas
Al equilibrar la emisión estimulada con la emisión espontánea, es posible construir una relación entre la temperatura de excitación y la densidad. Además, dado que los niveles de transición de amoníaco pueden aproximarse mediante un sistema de 2 niveles a bajas temperaturas, este cálculo es bastante simple. Esta premisa se puede aplicar a las nubes oscuras, regiones sospechosas de tener temperaturas extremadamente bajas y posibles sitios para la futura formación de estrellas. Las detecciones de amoníaco en nubes oscuras muestran líneas muy estrechas, lo que indica no solo bajas temperaturas, sino también un bajo nivel de turbulencia en el interior de las nubes. Los cálculos de la relación de líneas proporcionan una medición de la temperatura de las nubes que es independiente de las observaciones previas de CO. Las observaciones de amoníaco fueron consistentes con las mediciones de CO de temperaturas de rotación de ≈10 K. Con esto, se pueden determinar las densidades, y se han calculado que oscilan entre 10 4 y 10 5 cm −3 en las nubes oscuras. El mapeo de NH 3 da tamaños de nubes típicos de 0,1 pc y masas cercanas a 1 masa solar. Estos núcleos fríos y densos son los sitios de la futura formación de estrellas.
Regiones UC HII
Las regiones HII ultracompactas se encuentran entre los mejores indicadores de la formación de estrellas de alta masa. El material denso que rodea las regiones UCHII es probablemente principalmente molecular. Dado que un estudio completo de la formación de estrellas masivas implica necesariamente la nube a partir de la cual se formó la estrella, el amoníaco es una herramienta invaluable para comprender este material molecular circundante. Dado que este material molecular se puede resolver espacialmente, es posible restringir las fuentes de calor/ionización, las temperaturas, las masas y los tamaños de las regiones. Los componentes de velocidad desplazados por Doppler permiten la separación de regiones distintas de gas molecular que pueden rastrear los flujos de salida y los núcleos calientes que se originan a partir de estrellas en formación.
Detección extragaláctica
Se ha detectado amoniaco en galaxias externas [195] [196] y, midiendo simultáneamente varias líneas, es posible medir directamente la temperatura del gas en estas galaxias. Las relaciones de las líneas implican que las temperaturas del gas son cálidas (≈50 K) y se originan en nubes densas con tamaños de decenas de pársecs. Esta imagen es consistente con la imagen dentro de nuestra galaxia, la Vía Láctea : núcleos moleculares densos y calientes se forman alrededor de estrellas recién formadas incrustadas en nubes más grandes de material molecular en la escala de varios cientos de pársecs (nubes moleculares gigantes; GMC).
Véase también
- Amoniaco (página de datos) – Página de datos químicos
- Fuente de amoniaco – Tipo de demostración química
- Producción de amoniaco : descripción general de la historia y los métodos para producir NH3
- Solución de amoniaco – Compuesto químico
- Coste de la electricidad por fuente – Comparación de costes de distintas fuentes de generación de electricidad
- Formación de gas : mezcla de hidrógeno y nitrógeno.
- Proceso Haber – Proceso industrial para la producción de amoniaco
- Hidracina : líquido incoloro e inflamable con un olor similar al del amoníaco.
- Purificación del agua : proceso de eliminación de impurezas del agua.
Referencias
- ^ "NOMENCLATURA DE LA QUÍMICA INORGÁNICA Recomendaciones de la IUPAC 2005" (PDF) . Archivado (PDF) desde el original el 9 de octubre de 2022.
- ^ "Gases – Densidades" . Consultado el 3 de marzo de 2016 .
- ^ Yost, Don M. (2007). "Amoníaco y soluciones de amoníaco líquido". Química inorgánica sistemática . LEER LIBROS. p. 132. ISBN 978-1-4067-7302-6.
- ^ Blum, Alexander (1975). "Sobre el carácter cristalino del amoníaco sólido transparente". Efectos de la radiación y defectos en sólidos . 24 (4): 277. Bibcode :1975RadEf..24..277B. doi :10.1080/00337577508240819.
- ^ "Amoniaco". The American Chemical Society. 8 de febrero de 2021. Consultado el 20 de marzo de 2024 .
- ^ Perrin, DD, Constantes de ionización de ácidos y bases inorgánicos en solución acuosa ; 2.ª ed., Pergamon Press: Oxford, 1982 .
- ^ Iwasaki, Hiroji; Takahashi, Mitsuo (1968). "Estudios sobre las propiedades de transporte de fluidos a alta presión". Revista de Química Física de Japón . 38 (1).
- ^ de Zumdahl, Steven S. (2009). Principios químicos, sexta edición . Houghton Mifflin Company. pág. A22. ISBN 978-0-618-94690-7.
- ^ "Hoja de datos de seguridad del amoniaco anhidro" (PDF) . Universidad de Florida . Consultado el 19 de abril de 2024 .
- ^ ab "Amoníaco". Concentraciones inmediatamente peligrosas para la vida o la salud (IDLH) . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ Sigma-Aldrich Co. , Amoníaco.
- ^ Guía de bolsillo del NIOSH sobre peligros químicos. "#0028". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ Ritchie, Hannah . "¿A cuántas personas alimenta el fertilizante sintético?". Our World in Data . Consultado el 4 de septiembre de 2021 .
- ^ "Hoja de ruta de la tecnología del amoniaco: análisis". 11 de octubre de 2021.
- ^ "40 CFR: Apéndice A de la Parte 355: Lista de sustancias extremadamente peligrosas y sus cantidades límite de planificación". Oficina de Imprenta del Gobierno .
- ^ "Capacidad de producción anual mundial de amoniaco".
- ^ "Mitsubishi Heavy Industries BrandVoice: Aumentar la producción de amoníaco para el suministro mundial de alimentos". Forbes .
- ^ R. Norris Shreve ; Joseph Brink (1977). Industrias de procesos químicos (4.ª ed.). McGraw-Hill. pág. 276. ISBN 978-0-07-057145-7.Ver también Gasero y Gas envasado .
- ^ "Plinio el Viejo, Historia natural, LIBRO XXXI. REMEDIOS DERIVADOS DE LA PRODUCCIÓN ACUÁTICA, CAP. 39. (7.)—LOS DIVERSOS TIPOS DE SAL; LOS MÉTODOS DE PREPARARLA Y LOS REMEDIOS DERIVADOS DE ELLA. DOSCIENTAS CUATRO OBSERVACIONES AL RESPECTO". www.perseus.tufts.edu .
- ^ Hoover, Herbert (1950). Georgius Agricola De Re Metallica – Traducido de la primera edición latina de 1556. Nueva York: Dover Publications. pág. 560. ISBN 978-0486600062.
- ^ abcdefgh Chisholm 1911, pág. 861.
- ^ Shannon, Francis Patrick (1938) Tablas de propiedades de soluciones de agua y amoníaco. Parte 1 de La termodinámica de la refrigeración por absorción. Estudios de la Universidad de Lehigh. Serie de ciencia y tecnología
- ^ Una mezcla de amoniaco y agua podría arremolinarse bajo la superficie helada de Plutón. Universidad de Purdue (9 de noviembre de 2015)
- ^ "amoniacal (adj.)". Diccionario Oxford de inglés . Julio de 2023. doi :10.1093/OED/3565252514.
- ^ Pimputkar, Siddha; Nakamura, Shuji (enero de 2016). "Descomposición de amoníaco supercrítico y modelado de soluciones supercríticas de amoníaco-nitrógeno-hidrógeno con aplicabilidad hacia condiciones amonotérmicas". The Journal of Supercritical Fluids . 107 : 17–30. doi : 10.1016/j.supflu.2015.07.032 .
- ^ Hewat, AW; Riekel, C. (1979). "La estructura cristalina del deuteroamoniaco entre 2 y 180 K mediante refinamiento del perfil de polvo de neutrones". Acta Crystallographica Sección A . 35 (4): 569. Bibcode :1979AcCrA..35..569H. doi :10.1107/S0567739479001340.
- ^ Billaud, Gerard; Demortier, Antoine (diciembre de 1975). "Constante dieléctrica del amoníaco líquido de -35 a + 50 grados y su influencia en la asociación entre electrones solvatados y cationes". The Journal of Physical Chemistry . 79 (26): 3053–3055. doi :10.1021/j100593a053. ISSN 0022-3654.
- ^ Amoniaco en Linstrom, Peter J.; Mallard, William G. (eds.); NIST Chemistry WebBook, Base de datos de referencia estándar del NIST número 69 , Instituto Nacional de Estándares y Tecnología, Gaithersburg (MD)
- ^ Jepsen, S. Dee; McGuire, Kent (27 de noviembre de 2017). "Manejo seguro de amoníaco anhidro". Extensión de la Universidad Estatal de Ohio .
- ^ "Pautas de manejo médico para el amoníaco". Agencia para Sustancias Tóxicas y el Registro de Enfermedades . 12 de enero de 2017.
- ^ Hawkins, Nehemiah (1909). Diccionario mecánico de Hawkins: una enciclopedia de palabras, términos, frases y datos utilizados en las artes, los oficios y las ciencias mecánicas. T. Audel. pág. 15.
- ^ abc Neufeld, R.; Michel, R.; Herbst-Irmer, R.; Schöne, R.; Stalke, D. (2016). "Introducción de un donador de enlaces de hidrógeno en una base de Brønsted débilmente nucleófila: hexametildisilazidas de metales alcalinos (MHMDS, M = Li, Na, K, Rb y Cs) con amoníaco". Química. Eur. J. 22 (35): 12340–12346. doi :10.1002/chem.201600833. PMID 27457218.
- ^ abc Combellas, C; Kanoufi, F; Thiébault, A (2001). "Soluciones de electrones solvatados en amoníaco líquido". Journal of Electroanalytical Chemistry . 499 : 144–151. doi :10.1016/S0022-0728(00)00504-0.
- ^ Audrieth, Ludwig F.; Kleinberg, Jacob (1953). Disolventes no acuosos. Nueva York: John Wiley & Sons. pág. 45. LCCN 52-12057.
- ^ Edwin M. Kaiser (2001). "Calcio-amoníaco". Enciclopedia de reactivos para síntesis orgánica . doi :10.1002/047084289X.rc003. ISBN 978-0471936237.
- ^ ab Haynes, William M., ed. (2013). Manual de química y física del CRC (94.ª edición). CRC Press . pp. 9–26. ISBN 9781466571143.
- ^ Cleeton, CE; Williams, NH (1934). "Ondas electromagnéticas de 1,1 cm (0 pulgadas). Longitud de onda y espectro de absorción del amoníaco". Physical Review . 45 (4): 234. Bibcode :1934PhRv...45..234C. doi :10.1103/PhysRev.45.234.
- ^ abc Chisholm 1911, pág. 862.
- ^ Baker, HB (1894). "Influencia de la humedad en el cambio químico". J. Chem. Soc . 65 : 611–624. doi :10.1039/CT8946500611.
- ^ "Amoniaco". PubChem .
- ^ Kobayashi, Hideaki; Hayakawa, Akihiro; Somarathne, KD Kunkuma A.; Okafor, Ekenechukwu C. (2019). "Ciencia y tecnología de la combustión de amoniaco". Actas del Instituto de la Combustión . 37 (1): 109-133. Código Bib : 2019PComI..37..109K. doi : 10.1016/j.proci.2018.09.029 .
- ^ Khan, AS; Kelley, RD; Chapman, KS; Fenton, DL (1995). Límites de inflamabilidad de mezclas de amoníaco y aire . EE. UU.: Oficina de Información Científica y Técnica del Departamento de Energía de EE. UU. OSTI 215703.
- ^ Shrestha, Krishna P.; Seidel, Lars; Zeuch, Thomas; Mauss, Fabian (7 de julio de 2018). "Mecanismo cinético detallado de la oxidación del amoníaco, incluida la formación y reducción de óxidos de nitrógeno" (PDF) . Energía y combustibles . 32 (10): 10202–10217. doi :10.1021/acs.energyfuels.8b01056. ISSN 0887-0624. S2CID 103854263. Archivado (PDF) desde el original el 9 de octubre de 2022.
- ^ Holleman, AF; Wiberg, E. (2001). Química inorgánica . San Diego: Academic Press. ISBN 978-0-12-352651-9.
- ^ Sterrett, KF; Caron, AP (1966). "Química de alta presión de combustibles hidrogenados". Northrop Space Labs. Archivado desde el original el 23 de agosto de 2011. Consultado el 24 de diciembre de 2009 .
- ^ desde Chisholm 1911, pág. 863.
- ^ (OSHA) Fuente: Sax, N. Irving (1984) Propiedades peligrosas de los materiales industriales . 6.ª edición. Van Nostrand Reinhold. ISBN 0-442-28304-0 .
- ^ Hurtado, JL Martinez; Lowe, CR (2014). "Estructuras fotónicas sensibles al amoniaco fabricadas en membranas de Nafion mediante ablación láser". ACS Applied Materials & Interfaces . 6 (11): 8903–8908. doi :10.1021/am5016588. ISSN 1944-8244. PMID 24803236.
- ^ Holleman, AF; Wiberg, Egon; Wiberg, Nils; Eagleson, Mary; Brewer, William; Aylett, Bernhard J., eds. (2001). Química inorgánica de Holleman-Wiberg . San Diego, California. Londres: Academic. ISBN. 978-0-12-352651-9.
- ^ Heródoto con George Rawlinson, trad., The History of Herodotus (Nueva York, Nueva York: Tandy-Thomas Co., 1909), vol. 2, libro 4, § 181, págs. 304–305.
- ^ La tierra de los amonios se menciona en otras partes de la Historia de Heródoto y en la Descripción de Grecia de Pausanias :
- Heródoto con George Rawlinson, trad., The History of Herodotus (Nueva York, Nueva York: Tandy-Thomas Co., 1909), vol. 1, Libro 2, § 42, pág. 245, vol. 2, Libro 3, § 25, pág. 73, y vol. 2, Libro 3, § 26, pág. 74.
- Pausanias con WHS Jones, trad., Descripción de Grecia (Londres, Inglaterra: William Heinemann Ltd., 1979), vol. 2, Libro 3, Cap. 18, § 3, págs. 109 y 111 y vol. 4, Libro 9, Cap. 16, § 1, pág. 239.
- ^ Kopp, Hermann, Geschichte der Chemie [Historia de la química] (Braunschweig, (Alemania): Friedrich Vieweg und Sohn, 1845), parte 3, p. 237. [en alemán]
- ^ Chisholm 1911 cita a Plinio, Nat. Hist. xxxi. 39. Véase: Plinio el Viejo con John Bostock y HT Riley, eds., The Natural History (Londres, Inglaterra: HG Bohn, 1857), vol. 5, Libro 31, § 39, p. 502.
- ^ "Sal-amoniaco". Webmineral . Consultado el 7 de julio de 2009 .
- ^ Plinio también mencionó que cuando algunas muestras de lo que se suponía que era natrón (del latín nitrum , carbonato de sodio impuro) se trataban con cal (carbonato de calcio) y agua, el natrón emitía un olor penetrante, que algunos autores han interpretado como que significaba que el natrón era cloruro de amonio o estaba contaminado con él. Véase:
- Plinio con WHS Jones, trad., Natural History (Londres, Inglaterra: William Heinemann Ltd., 1963), vol. 8, Libro 31, § 46, págs. 448–449. De las págs. 448-449: "Adulteratur in Aegypto calce, deprehenditur gusto. Sincerum enim statim resolvitur, adulteratum calce pungit et asperum [o aspersum ] reddit odorem vehementer". (En Egipto [es decir, natrón] se adultera con cal, lo cual se detecta por el gusto; porque el natrón puro se derrite al instante, pero el natrón adulterado pica a causa de la cal y emite un olor fuerte y amargo [o: cuando se rocía [( aspersum ) con agua] emite un olor vehemente])
- Kidd, John, Esquemas de mineralogía (Oxford, Inglaterra: N. Bliss, 1809), vol. 2, pág. 6.
- Moore, Nathaniel Fish, Mineralogía antigua: o una investigación sobre las sustancias minerales mencionadas por los antiguos: ... (Nueva York, Nueva York: G. & C. Carvill & Co., 1834), págs. 96–97.
- ^ Ver:
- Forbes, RJ, Estudios en tecnología antigua , vol. 5, 2.ª ed. (Leiden, Países Bajos: EJ Brill, 1966), págs. 19, 48 y 65.
- Moeller, Walter O., El comercio de lana de la antigua Pompeya (Leiden, Países Bajos: EJ Brill, 1976), pág. 20.
- Faber, GA (seudónimo de: Goldschmidt, Günther) (mayo de 1938) "Teñido y curtido en la antigüedad clásica", Ciba Review , 9 : 277–312. Disponible en: Elizabethan Costume
- Smith, William, A Dictionary of Greek and Roman Antiquities (Londres, Inglaterra: John Murray, 1875), artículo: "Fullo" (es decir, bataneros o lavanderos), págs. 551–553.
- Rousset, Henri (31 de marzo de 1917) "Las lavanderías de los antiguos", Scientific American Supplement , 83 (2152): 197.
- Bond, Sarah E., Comercio y tabú: Profesiones deshonrosas en el Mediterráneo romano (Ann Arbor, Michigan: University of Michigan Press, 2016), pág. 112.
- Binz, Arthur (1936) "Altes und Neues über die technische Verwendung des Harnes" ([Información] antigua y moderna sobre el uso tecnológico de la orina), Zeitschrift für Angewandte Chemie , 49 (23): 355–360. [en alemán]
- Witty, Michael (diciembre de 2016) "Química de la orina en la antigua Roma", Acta Archaeologica , 87 (1): 179-191. Witty especula que los romanos obtenían amoníaco en forma concentrada añadiendo ceniza de madera ( carbonato de potasio impuro ) a la orina que había estado fermentada durante varias horas. De este modo, se precipita la estruvita (fosfato de amonio y magnesio), y el rendimiento de estruvita se puede aumentar tratando luego la solución con avetoro , una solución rica en magnesio que es un subproducto de la fabricación de sal a partir de agua de mar. Al tostar la estruvita se liberan vapores de amoníaco.
- ^ Lenkeit, Roberta Edwards (23 de octubre de 2018). Tacones altos y pies vendados: y otros ensayos sobre antropología cotidiana, segunda edición. Waveland Press. pág. 72. ISBN 978-1-4786-3841-4.
- ^ Perdigão, Jorge (3 de agosto de 2016). Blanqueamiento dental: una perspectiva basada en la evidencia. Springer. p. 170. ISBN 978-3-319-38849-6.
- ^ Bonitz, Michael; Lopez, Jose; Becker, Kurt; Thomsen, Hauke (9 de abril de 2014). Plasmas complejos: desafíos científicos y oportunidades tecnológicas. Springer Science & Business Media. pág. 465. ISBN 978-3-319-05437-7.
- ^ Haq, Syed Nomanul (1995). Nombres, naturalezas y cosas: el alquimista Jabir Ibn Hayyan y su Kitab Al-Ahjar (Libro de las piedras). Springer. ISBN 978-0-7923-3254-1.
- ^ Spiritus salis urinæ (espíritu de la sal de la orina, es decir, carbonato de amonio) aparentemente había sido producido antes de Valentino, aunque él presentó un método nuevo y más simple para prepararlo en su libro: Valentinus, Basilius, Vier Tractätlein Fr. Basilii Valentini ... [Cuatro ensayos del hermano Basilio Valentín ...] (Frankfurt am Main, (Alemania): Luca Jennis, 1625), "Supplementum oder Zugabe" (Suplemento o apéndice), pp. 80-81: "Der Weg zum Universal, damit die drei Stein zusammen kommen". (El camino hacia lo Universal, para que las tres piedras se junten). De la p. 81: "Der Spiritus salis Urinæ nimbt langes wesen zubereiten / dieser proceß aber ist waß leichter unnd näher auß dem Salz von Armenia, ... Nun nimb sauberen schönen Armenischen Salz armoniac ohn alles sublimiren / thue ihn in ein Kolben / giesse ein Oleum Tartari drauff / daß es wie in Muß oder Brey werde / vermachs baldt / dafür thu auch ein grosen vorlag / so lege sich als baldt der Spiritus Salis Urinæ im Helm an Crystallisch..." (El espíritu de la sal de orina [es decir, carbonato de amonio] requiere un método largo [es decir, procedimiento] para prepararse; este proceso [es decir, de San Valentín] [comenzando] a partir de la sal de Armenia [es decir, cloruro de amonio], sin embargo, es algo más fácil y más corto ... Ahora tome sal armenia limpia y agradable, sin sublimarla toda [; póngala en un matraz [de destilación]; vierta aceite de tártaro [es decir, carbonato de potasio que se ha disuelto solo en el agua que ha absorbido del aire] sobre ella, [de modo que] [es decir, la mezcla] se vuelva como una papilla o pasta; ensámblelo [es decir, el aparato de destilación ( alambique )] rápidamente; para ese [propósito] conecte un matraz receptor grande; luego pronto el espíritu de la sal de orina se deposita como cristales en el "casco" [es decir, la salida para los vapores, que está encima del matraz de destilación] ...)
Véase también: Kopp, Hermann, Geschichte der Chemie [Historia de la química] (Braunschweig, (Alemania): Friedrich Vieweg und Sohn, 1845), Parte 3, pág. 243. [en alemán] - ^ Maurice P. Crosland (2004). Estudios históricos sobre el lenguaje de la química. Courier Dover Publications. pág. 72. ISBN 978-0-486-43802-3.
- ^ Black, Joseph (1893) [1755]. Experimentos con magnesia alba, cal viva y otras sustancias alcalinas. Edimburgo: WF Clay.
- ^ Jacobson, Mark Z. (23 de abril de 2012). Contaminación del aire y calentamiento global: historia, ciencia y soluciones. Cambridge University Press. ISBN 9781107691155.
- ^ "La botella de Woulfe". Chemistry World . Consultado el 1 de julio de 2017 .
- ^ Woulfe, Peter (1 de enero de 1767). "Experimentos sobre la destilación de ácidos, álcalis volátiles, etc. que muestran cómo se pueden condensar sin pérdida y cómo, de ese modo, podemos evitar humos desagradables y nocivos: en una carta del Sr. Peter Woulfe, FRS a John Ellis, Esq; FRS" Philosophical Transactions . 57 : 517–536. Bibcode :1767RSPT...57..517W. doi : 10.1098/rstl.1767.0052 . ISSN 0261-0523.
- ^ Urdang, George (1942). Historia de vida ilustrada del químico boticario Carl Wilhelm Scheele . Instituto Americano de Historia de la Farmacia. hdl :1811/28946/Pictorial%20Life%20History_Scheele.pdf.
- ^ Ver:
- Priestley, Joseph (1773) "Extrait d'une lettre de M. Priestley, en date du 14 Octobre 1773" (Extracto de una carta del Sr. Priestley, fechada el 14 de octubre de 1773), Observations sur la Physique ..., 2 : 389.
- Priestley, Joseph, Experimentos y observaciones sobre diferentes tipos de aire , vol. 1, 2.ª ed. (Londres, Inglaterra: 1775), Parte 2, § 1: Observaciones sobre aire alcalino, págs. 163–177.
- Schofield, Robert E., El ilustrado Joseph Priestley: un estudio de su vida y obra de 1773 a 1804 (University Park, Pensilvania: Pennsylvania State University Press, 2004), págs. 93–94.
- En 1775, Priestley había observado que la electricidad podía descomponer el amoniaco ("aire alcalino"), produciendo un gas inflamable (hidrógeno). Véase: Priestley, Joseph, Experiments and Observations on Different Kinds of Air , vol. 2 (Londres, Inglaterra: J. Johnson, 1775), págs. 239-240.
- ^ Berthollet (1785) "Analyse de l'alkali volatil" (Análisis de álcalis volátiles), Mémoires de l'Académie Royale des Sciences , 316–326.
- ^ ab Max Appl (2006). "Amoníaco". Amoníaco, en Ullmann's Encyclopedia of Industrial Chemistry . Weinheim: Wiley-VCH. doi :10.1002/14356007.a02_143.pub2. ISBN 978-3527306732.
- ^ Smith, Roland (2001). La conquista de la química . Sídney: McGraw-Hill. ISBN 978-0-07-470146-1.
- ^ "Resúmenes de productos minerales 2020, pág. 117 – Nitrógeno" (PDF) . USGS . 2020. Archivado (PDF) del original el 9 de octubre de 2022 . Consultado el 12 de febrero de 2020 .
- ^ Lassaletta, Luis; Billen, Gilles; Grizzetti, Bruna; Anglade, Juliette; Garnier, Josette (2014). "Tendencias de 50 años en la eficiencia del uso de nitrógeno en los sistemas agrícolas mundiales: la relación entre el rendimiento y el aporte de nitrógeno a las tierras de cultivo". Environmental Research Letters . 9 (10): 105011. Bibcode :2014ERL.....9j5011L. doi : 10.1088/1748-9326/9/10/105011 . ISSN 1748-9326.
- ^ David Brown (18 de abril de 2013). «Fertilizante de amoníaco anhidro: abundante, importante, peligroso». Washington Post . Consultado el 23 de abril de 2013 .
- ^ "Aplicaciones del amoniaco anhidro y del amoniaco acuoso". www.mysoreammonia.com . Consultado el 2 de febrero de 2022 .
- ^ Wright, Jerry (13 de abril de 2015). «El sistema de refrigeración mantiene la seguridad y la productividad de la estación espacial». NASA . Archivado desde el original el 12 de enero de 2017. Consultado el 1 de julio de 2017 .
- ^ "Sistema de refrigeración de la Estación Espacial Internacional: cómo funciona (infografía)". Space.com . Consultado el 1 de julio de 2017 .
- ^ "Reducción del uso y las emisiones de hidrofluorocarbonos (HFC) en el sector federal a través del SNAP" (PDF) . Archivado (PDF) del original el 9 de octubre de 2022 . Consultado el 2 de diciembre de 2018 .
- ^ Samuel Rideal (1895). Desinfección y desinfectantes: Introducción al estudio de. Londres: Charles Griffin and Company. pág. 109.
- ^ Tajkarimi, Mehrdad; Riemann, HP; Hajmeer, MN; Gomez, EL; Razavilar, V.; Cliver, DO; et al. (2008). "Desinfección con amoniaco de alimentos para animales – Estudio de laboratorio". Revista internacional de microbiología de alimentos . 122 (1–2): 23–28. doi :10.1016/j.ijfoodmicro.2007.11.040. PMID 18155794.
- ^ Kim, JS; Lee, YY; Kim, TH (enero de 2016). "Una revisión sobre la tecnología de pretratamiento alcalino para la bioconversión de biomasa lignocelulósica". Tecnología de recursos biológicos . 199 : 42–48. Código Bibliográfico :2016BiTec.199...42K. doi :10.1016/j.biortech.2015.08.085. PMID 26341010.
- ^ "Evaluación de métodos de tratamiento para reducir las bacterias en la carne de res texturizada", Jensen, Jean L et al. , Reunión anual de la Sociedad Estadounidense de Ingenieros Agrícolas y Biológicos 2009
- ^ Documento de referencia: Intervenciones antimicrobianas para la carne de res , Dawna Winkler y Kerri B. Harris, Centro para la Seguridad Alimentaria, Departamento de Ciencia Animal, Universidad Texas A&M , mayo de 2009, página 12
- ^ Moss, Michael (3 de octubre de 2009). "La hamburguesa que destrozó su vida". The New York Times .
- ^ Moss, Michael (31 de diciembre de 2009). "Se cuestiona la seguridad del método de procesamiento de la carne vacuna". The New York Times .
- ^ "MOL estudia el concepto de FSRU de amoniaco". Offshore Energy . 3 de febrero de 2022 . Consultado el 3 de febrero de 2022 .
- ^ Collins (l_collins), Leigh (27 de enero de 2022). "INFORME ESPECIAL | Por qué el envío de hidrógeno puro a todo el mundo podría estar ya en el olvido | Recharge". Recharge | Últimas noticias sobre energías renovables . Consultado el 3 de febrero de 2022 .
- ^ ab Lan, Rong; Tao, Shanwen (28 de agosto de 2014). "El amoníaco como combustible adecuado para las pilas de combustible". Frontiers in Energy Research . 2 : 35. doi : 10.3389/fenrg.2014.00035 .
- ^ Lindzon, Jared (27 de febrero de 2019). "Está creando un nuevo combustible de la nada, por 85 centavos el galón". OZY . Archivado desde el original el 26 de abril de 2019 . Consultado el 26 de abril de 2019 .
- ^ Giddey, S.; Badwal, SPS; Munnings, C.; Dolan, M. (10 de octubre de 2017). "El amoníaco como medio de transporte de energía renovable". ACS Sustainable Chemistry & Engineering . 5 (11): 10231–10239. doi :10.1021/acssuschemeng.7b02219.
- ^ Afif, Ahmed; Radenahmad, Nikdilila; Cheok, Quentin; Shams, Shahriar; Hyun Kim, Jung; Azad, Abul (12 de febrero de 2016). «Pilas de combustible alimentadas con amoníaco: una revisión exhaustiva». Renewable and Sustainable Energy Reviews . 60 : 822–835. Bibcode :2016RSERv..60..822A. doi :10.1016/j.rser.2016.01.120 . Consultado el 1 de enero de 2021 .
- ^ David, William IF; Makepeace, Joshua W.; Callear, Samantha K.; Hunter, Hazel MA; Taylor, James D.; Wood, Thomas J.; Jones, Martin O. (24 de septiembre de 2014). "Producción de hidrógeno a partir de amoníaco utilizando amida de sodio". Revista de la Sociedad Química Estadounidense . 136 (38): 13082–13085. doi : 10.1021/ja5042836 . ISSN : 0002-7863. PMID: 24972299.
- ^ Lucentini, Ilaria; García Colli, Germán; Luzi, Carlos D.; Serrano, Isabel; Martínez, Osvaldo M.; Llorca, Jordi (5 de junio de 2021). "Descomposición catalítica de amoniaco sobre Ni-Ru soportada sobre CeO2 para la producción de hidrógeno: efecto de la carga de metal y análisis cinético". Catálisis Aplicada B: Ambiental . 286 : 119896. Código bibliográfico : 2021AppCB.28619896L. doi : 10.1016/j.apcatb.2021.119896. hdl : 2117/364129 . ISSN 0926-3373. S2CID 233540470.
- ^ Douglas Self (1 de octubre de 2007). «Ammonia Motors» . Consultado el 28 de noviembre de 2010 .
- ^ Louis C. Hennick; Elbridge Harper Charlton (1965). Los tranvías de Nueva Orleans . Pelican Publishing. págs. 14-16. ISBN 9781455612598.
- ^ ab "Amoníaco como combustible para el transporte IV" (PDF) . Norm Olson – Iowa Energy Center. 15-16 de octubre de 2007. Archivado desde el original (PDF) el 7 de febrero de 2012.
- ^ Lee, Dongeun; Min, Hyungeun; Park, Hyunho; Song, Han Ho (1 de noviembre de 2017). "Desarrollo de una nueva estrategia de combustión para motores de combustión interna alimentados con amoníaco puro" (PDF) . Universidad Nacional de Seúl, Departamento de Ingeniería Mecánica. Archivado (PDF) del original el 9 de octubre de 2022. Consultado el 29 de enero de 2019 .
- ^ Brohi, Emtiaz Ali (2014). "¿El amoniaco como combustible para motores de combustión interna?" (PDF) . Universidad Tecnológica de Chalmers. Archivado (PDF) del original el 9 de octubre de 2022. Consultado el 29 de enero de 2019 .
- ^ Elucidare (2 de febrero de 2008). "Amoniaco: Nuevas posibilidades para el almacenamiento y transporte de hidrógeno" (PDF) . Elucidare Limited . Archivado (PDF) del original el 8 de octubre de 2010.
- ^ Coche propulsado por amoniaco en YouTube
- ^ "Mira 'Ammonia Fuel'". Greg Vezina . Consultado el 7 de julio de 2009 .
- ^ "Bienvenido a NH3 Car". NH3Car.com .
- ^ "Amoniaco". chm.bris.ac.uk . Consultado el 3 de marzo de 2016 .
- ^ Zacharakis-Jutz, George; Kong, Song-Charng (2013). "Características de un motor SI que utiliza inyección directa de amoníaco" (PDF) . Departamento de Ingeniería Mecánica, Universidad Estatal de Iowa. Archivado (PDF) del original el 9 de octubre de 2022. Consultado el 29 de enero de 2019 .
- ^ "Amoniaco verde | Royal Society". royalsociety.org .
- ^ "Arabia Saudita envía amoníaco azul a Japón en el primer envío del mundo". Bloomberg.com . 27 de septiembre de 2020 . Consultado el 28 de septiembre de 2020 .
- ^ Service, Robert F. (12 de julio de 2018). «El amoníaco, un combustible renovable elaborado a partir del sol, el aire y el agua, podría alimentar al planeta sin carbono». Ciencia | AAAS . Consultado el 28 de septiembre de 2020 .
- ^ "¿Construirá Arabia Saudita la planta de hidrógeno y amoníaco verde más grande del mundo?". energypost.eu . 17 de septiembre de 2020 . Consultado el 9 de octubre de 2020 .
- ^ "DSME obtiene LR AIP para un portacontenedores de 23.000 TEU propulsado por amoníaco". Offshore Energy . 6 de octubre de 2020 . Consultado el 9 de octubre de 2020 .
- ^ "¿Qué propulsará a los aviones en el futuro?". Aviafuture . 30 de marzo de 2022 . Consultado el 24 de mayo de 2022 .
- ^ "Japón avanzará en la tecnología de co-combustión de amoniaco". Argus Media . 24 de junio de 2021 . Consultado el 8 de noviembre de 2021 .
- ^ "Primera Conferencia Internacional sobre Amoniaco Combustible 2021". ICFA . 6 de octubre de 2021. Archivado desde el original el 7 de noviembre de 2021 . Consultado el 7 de noviembre de 2021 .
- ^ "Se celebra la primera conferencia internacional sobre amoníaco combustible". METI, Japón . 12 de octubre de 2021. Consultado el 7 de noviembre de 2021 .
- ^ "Generación de energía sin CO2 lograda con la primera turbina de gas del mundo que utiliza 100% de amoníaco líquido" (Nota de prensa). IHI Corporation . 16 de junio de 2022 . Consultado el 1 de julio de 2022 .
- ^ Masaya Kato (14 de julio de 2022). "Los miembros del Quad acuerdan promover la tecnología de combustible de hidrógeno y amoníaco". The Nikkei . Consultado el 14 de julio de 2022 .
- ^ "Sobre el uso del amoniaco como combustible: una perspectiva" (PDF) .
- ^ "Óxidos de nitrógeno como subproducto de los regímenes de combustión de amoníaco/hidrógeno" (PDF) .
- ^ White, Alfred H.; Melville, Wm. (abril de 1905). "La descomposición del amoniaco a altas temperaturas". Revista de la Sociedad Química Americana . 27 (4): 373–386. doi :10.1021/ja01982a005. ISSN 0002-7863.
- ^ "Diesel: más ecológico de lo que crees". Archivado desde el original el 10 de mayo de 2008. Consultado el 7 de julio de 2009 .
- ^ "Fosgeno: Guía de salud y seguridad". Programa Internacional de Seguridad Química . 1998.
- ^ "Las esclusas de los tanques de amoníaco anhidro tienen fallas". Cedar Rapids Gazette . 6 de octubre de 2009.
- ^ "Fiscal general de Illinois | Conocimiento básico sobre la metanfetamina". Illinoisattorneygeneral.gov. Archivado desde el original el 10 de septiembre de 2010. Consultado el 21 de mayo de 2011 .
- ^ Greenberg, Michael I. (1 de enero de 2003). Toxicología ocupacional, industrial y ambiental. Elsevier Health Sciences. ISBN 978-0323013406.
- ^ Włochowicz, A.; Stelmasiak, E. (1983). "Cambio en las propiedades térmicas de la lana después del tratamiento con amoníaco líquido". Revista de análisis térmico y calorimetría . 26 (1): 17. doi :10.1007/BF01914084. S2CID 96930751.
- ^ Horkheimer, Donald (2005). "Amoniaco: una solución para dirigibles que exigen cambios rápidos en la flotabilidad neta". 5.ª Conferencia de la AIAA sobre tecnología de sistemas y globos aerostáticos ATIO y 16.ª Conferencia de la AIAA sobre sistemas más ligeros que el aire . doi :10.2514/6.2005-7393. ISBN 978-1-62410-067-3. Recuperado el 27 de octubre de 2022 .
- ^ Roble blanco ahumado. woodweb.com
- ^ Anuario de minerales, vol. 3
- ^ ab "Hoja de preguntas frecuentes sobre toxicidad del amoníaco" (PDF) . Agencia para Sustancias Tóxicas y el Registro de Enfermedades (ATSDR). Septiembre de 2004. Archivado (PDF) desde el original el 9 de octubre de 2022.
- ^ Amoniaco, documentación IDLH
- ^ ¿ El amoníaco anhidro está cubierto por el Programa de Permisos de Seguridad de Materiales Peligrosos? del sitio web del Departamento de Transporte de los Estados Unidos (DOT)
- ^ Berg, JM; Tymoczko, JL; Stryer, L. (2002). "23.4: El ion amonio se convierte en urea en la mayoría de los vertebrados terrestres". Bioquímica (5.ª ed.).
- ^ Wang, Mingyi; Kong, Weimeng; Marten, Ruby; He, Xu-Cheng; Chen, Dexian; Pfeifer, Joschka; Heitto, Arto; Kontkanen, Jenni; Dada, Lubna; Kürten, Andreas; Yli-Juuti, Taina (13 de mayo de 2020). "Crecimiento rápido de nuevas partículas atmosféricas por condensación de ácido nítrico y amoníaco". Nature . 581 (7807): 184–189. Bibcode :2020Natur.581..184W. doi :10.1038/s41586-020-2270-4. ISSN 1476-4687. PMC 7334196 . PMID 32405020.
- ^ Talhout, Reinskje; Schulz, Thomas; Florek, Ewa; Van Benthem, enero; Wester, Piet; Opperhuizen, Antoon (2011). "Compuestos peligrosos del humo del tabaco". Revista Internacional de Investigación Ambiental y Salud Pública . 8 (12): 613–628. doi : 10.3390/ijerph8020613 . ISSN 1660-4601. PMC 3084482 . PMID 21556207.
- ^ "Soluciones de vanguardia para la reutilización de aguas residuales de coquización para cumplir con el estándar de los sistemas de refrigeración por circulación". www.wateronline.com . Consultado el 16 de enero de 2016 .
- ^ Vasudevan Rajaram; Subijoy Dutta; Krishna Parameswaran (30 de junio de 2005). Prácticas mineras sostenibles: una perspectiva global. CRC Press. pág. 113. ISBN 978-1-4398-3423-7.
- ^ abc Oram, Brian. "Amoníaco en aguas subterráneas, escorrentías y arroyos". The Water Centre . Consultado el 3 de diciembre de 2014 .
- ^ Hargreaves, JA; Tucker, CS (2004). Manejo del amoníaco en estanques de peces . Centro Regional de Acuicultura del Sur.
- ^ abc Sergeant, Chris (5 de febrero de 2014). "La gestión de los niveles de amoniaco en un entorno de acuicultura". Agua/Aguas residuales . Consultado el 3 de diciembre de 2014 .
- ^ Código Electrónico de Reglamentos Federales: Archivado el 4 de noviembre de 2011 en Wayback Machine . Ecfr.gpoaccess.gov. Recuperado el 22 de diciembre de 2011.
- ^ "Tanques de amoníaco: construcción en acero inoxidable y carbono". ammoniatanks.com . Consultado el 28 de junio de 2021 .
- ^ "Estadísticas e información sobre nitrógeno del Servicio Geológico de Estados Unidos". www.usgs.gov . Consultado el 24 de enero de 2023 .
- ^ ab "Nitrógeno (fijo) - Amoniaco (2022)" (PDF) . Centro Nacional de Información Mineral de EE. UU . . Consultado el 24 de enero de 2023 .
- ^ «Premio Nobel de Química (1918) – Proceso Haber-Bosch» . Consultado el 7 de julio de 2009 .
- ^ "Química de los elementos del grupo 2: Be, Mg, Ca, Sr, Ba, Ra". BBC.co.uk. Consultado el 7 de julio de 2009 .
- ^ Proceso químico de Habers . India: Publicaciones Arihant. 2018. Pág. 264. ISBN 978-93-131-6303-9.
- ^ Appl, M. (1982). "El proceso Haber-Bosch y el desarrollo de la ingeniería química". Un siglo de ingeniería química . Nueva York: Plenum Press. pp. 29–54. ISBN 978-0-306-40895-3.
- ^ Appl, Max (2006). "Amoníaco". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a02_143.pub2. ISBN 978-3527306732.
- ^ Smil, Vaclav (2004). Enriqueciendo la Tierra: Fritz Haber, Carl Bosch y la transformación de la producción mundial de alimentos (1.ª ed.). Cambridge, MA: MIT. ISBN 978-0-262-69313-4.
- ^ Hager, Thomas (2008). La alquimia del aire: un genio judío, un magnate condenado y el descubrimiento científico que alimentó al mundo pero impulsó el ascenso de Hitler (1.ª ed.). Nueva York, Nueva York: Harmony Books. ISBN 978-0-307-35178-4.
- ^ Sittig, Marshall (1979). Industria de fertilizantes: procesos, control de la contaminación y conservación de la energía . Park Ridge, Nueva Jersey: Noyes Data Corp. ISBN 978-0-8155-0734-5.
- ^ Lavars, Nick (30 de noviembre de 2021). «El avance de la electrólisis de amoníaco verde podría acabar finalmente con Haber–Bosch». New Atlas . Archivado desde el original el 30 de noviembre de 2021 . Consultado el 3 de diciembre de 2021 .
- ^ Blaine, Loz (19 de noviembre de 2021). «FuelPositive promete amoniaco verde a un coste del 60 % del gris actual». New Atlas . Archivado desde el original el 19 de noviembre de 2021 . Consultado el 3 de diciembre de 2021 .
- ^ Fichter, padre; Girard, Pedro; Erlenmeyer, Hans (1 de diciembre de 1930). "Elektrolytische Bindung von komprimiertem Stickstoff bei gewöhnlicher Temperatur". Helvetica Chimica Acta . 13 (6): 1228-1236. doi :10.1002/hlca.19300130604.
- ^ Tsuneto, Akira; Kudo, Akihiko; Sakata, Tadayoshi (4 de marzo de 1994). "Reducción electroquímica mediada por litio de N2 a NH3 a alta presión". Revista de química electroanalítica . 367 (1): 183–188. doi :10.1016/0022-0728(93)03025-K. ISSN 1572-6657.
- ^ ab Lazouski, Nikifar; Schiffer, Zachary J.; Williams, Kindle; Manthiram, Karthish (17 de abril de 2019). "Comprensión de la reducción electroquímica de nitrógeno mediada por litio continua". Joule . 3 (4): 1127–1139. Bibcode :2019Joule...3.1127L. doi : 10.1016/j.joule.2019.02.003 . ISSN 2542-4351. S2CID 107985507.
- ^ Andersen, Suzanne Z.; Čolić, Viktor; Yang, Sungeun; Schwalbe, Jay A.; Nielander, Adam C.; McEnaney, Josué M.; Enemark-Rasmussen, Kasper; Panadero, Jon G.; Singh, Aayush R.; Rohr, Brian A.; Statt, Michael J. (junio de 2019). "Un riguroso protocolo de síntesis electroquímica de amoníaco con mediciones cuantitativas de isótopos". Naturaleza . 570 (7762): 504–508. Código Bib :2019Natur.570..504A. doi :10.1038/s41586-019-1260-x. hdl : 10044/1/72812 . ISSN 1476-4687. Número de modelo: PMID 31117118. Número de modelo: S2CID 162182383.
- ^ Bjarke Valbæk Mygind, Jon; Pedersen, Jakob B.; Li, Katja; Deissler, Niklas H.; Saccoccio, Mattia; Fu, Xianbiao; Li, Shaofeng; Sažinas, Rokas; Andersen, Suzanne Z.; Enemark-Rasmussen, Kasper; Vesborg, Peter CK; Doganli-Kibsgaard, Jakob; Chorkendorff, Ib (22 de noviembre de 2023). "¿Es el etanol esencial para la reacción de reducción del nitrógeno mediada por litio?". ChemSusChem . 16 (22). Código Bib :2023ChSCh..16E1011B. doi :10.1002/cssc.202301011. ISSN 1864-5631. Número de modelo: PMID37681646.
- ^ Lazouski, Nikifar; Chung, Minju; Williams, Kindle; Gala, Michal L.; Manthiram, Karthish (1 de mayo de 2020). "Electrodos de difusión de gas no acuoso para la síntesis rápida de amoníaco a partir de nitrógeno e hidrógeno derivado de la división del agua". Nature Catalysis . 3 (5): 463–469. doi :10.1038/s41929-020-0455-8. ISSN 2520-1158. S2CID 218495730.
- ^ ab Suryanto, Bryan HR; Matuszek, Karolina; Choi, Jaecheol; Hodgetts, Rebecca Y.; Du, Hoang-Long; Bakker, Jacinta M.; Kang, Colin SM; Cherepanov, Pavel V.; Simonov, Alexandr N.; MacFarlane, Douglas R. (11 de junio de 2021). "Reducción de nitrógeno a amoníaco con alta eficiencia y tasas basadas en un transbordador de protones de fosfonio". Science . 372 (6547): 1187–1191. Bibcode :2021Sci...372.1187S. doi :10.1126/science.abg2371. ISSN 0036-8075. PMID 34112690. S2CID 235396282.
- ^ Fu, Xianbiao; Pedersen, Jakob B.; Zhou, Yuanyuan; Saccoccio, Mattia; Li, Shaofeng; Sažinas, Rokas; Li, Katja; Andersen, Suzanne Z.; Xu, Aoni; Deissler, Niklas H.; Mygind, Jon Bjarke Valbaek; Wei, Chao; Kibsgaard, Jakob; Vesborg, Peter CK; Nørskov, Jens K.; Chorkendorff, Ib (16 de febrero de 2022). "Electrosíntesis de amoníaco en flujo continuo por reducción de nitrógeno y oxidación de hidrógeno". Ciencia . 379 (6633): 707–712. doi : 10.1126/ciencia.adf4403. PMID 36795804.
- ^ Roth, Karl S. "Especialidades de eMedicine > Enfermedades metabólicas > Hiperamonemia" . Consultado el 7 de julio de 2009 .
- ^ Mohiuddin, SS; Khattar, D. (2023). "Bioquímica, amoníaco". StatPearls . La isla del tesoro. PMID 31082083.
- ^ Nelson, David L.; Cox, Michael M. (2005). Principios de bioquímica (4.ª ed.). Nueva York: W. H. Freeman. págs. 632-633. ISBN 0-7167-4339-6.
- ^ Shibata, Naoki; Tamagaki, Hiroko; Hieda, Naoki; Akita, Keita; Komori, Hirofumi; Shomura, Yasuhito; Terawaki, Shin-Ichi; Mori, Koichi; Yasuoka, Noritake; Higuchi, Yoshiki; Toraya, Tetsuo (2010). "Estructuras cristalinas de etanolamina amoniaco-liasa complejada con sustratos y análogos de coenzima B12". Revista de Química Biológica . 285 (34): 26484–26493. doi : 10.1074/jbc.M110.125112 . PMC 2924083 . PMID 20519496.
- ^ Adjei, MB; Quesenberry, KH; Chamblis, CG (junio de 2002). "Fijación de nitrógeno e inoculación de leguminosas forrajeras". Extensión IFAS de la Universidad de Florida. Archivado desde el original el 20 de mayo de 2007.
- ^ Identificación de los efectos directos del amoniaco en el cerebro – PubMed
- ^ Igarashi, Robert Y.; Laryukhin, Mikhail; Dos Santos, Patricia C.; Lee, Hong-In; Dean, Dennis R.; Seefeldt, Lance C.; Hoffman, Brian M. (mayo de 2005). "Atrapamiento de H- unido al sitio activo del cofactor FeMo de la nitrogenasa durante la evolución de H2: caracterización mediante espectroscopia ENDOR". Journal of the American Chemical Society . 127 (17): 6231–6241. doi :10.1021/ja043596p. PMID 15853328.
- ^ Zschocke, Johannes; Hoffman, Georg (2004). Metabolismo vademécum . Schattauer Verlag. ISBN 978-3794523856.
- ^ Rose, Burton; Helmut Rennke (1994). Fisiopatología renal. Baltimore: Williams & Wilkins. ISBN 978-0-683-07354-6.
- ^ Campbell, Neil A .; Jane B. Reece (2002). "44". Biología (6ª ed.). San Francisco: Pearson Education, Inc. págs. ISBN 978-0-8053-6624-2.
- ^ Editado por Kirk Munsell. Crédito de la imagen: Instituto Lunar y Planetario. NASA. "NASA's Solar Exploration: Multimedia: Gallery: Gas Giant Interiors Archivado el 20 de febrero de 2006 en Wayback Machine ". Consultado el 26 de abril de 2006.
- ^ Cheung, AC; Rank, DM; Townes, CH; Thornton, DD; Welch, WJ (1968). "Detección de moléculas de NH3 en el medio interestelar por su emisión de microondas". Phys. Rev. Lett . 21 (25): 1701. Bibcode :1968PhRvL..21.1701C. doi :10.1103/PhysRevLett.21.1701.
- ^ ab Ho, PTP; Townes, CH (1983). "Amoníaco interestelar". Annu. Rev. Astron. Astrophys . 21 (1): 239–70. Código Bibliográfico :1983ARA&A..21..239H. doi :10.1146/annurev.aa.21.090183.001323.
- ^ Millar, TJ (2003). "Fraccionamiento de deuterio en nubes interestelares". Space Science Reviews . 106 (1): 73–86. Código Bibliográfico :2003SSRv..106...73M. doi :10.1023/A:1024677318645. S2CID 189793190.
- ^ Ungerechts, H.; Walmsley, CM; Winnewisser, G. (1980). "Observaciones de amoniaco y cianoacetileno del núcleo de alta densidad de L-183 (L-134-N)". Astron. Astrophys . 88 : 259. Bibcode :1980A&A....88..259U.
- ^ Genzel, R.; Downes, D.; Ho, PTP (1982). "NH 3 en Orión-KL: una nueva interpretación". Astrophysical Journal . 259 : L103. Código Bibliográfico :1982ApJ...259L.103G. doi :10.1086/183856.
- ^ "Los datos de la UMIST para la astroquímica" . Consultado el 7 de julio de 2009 .
- ^ Vikor, L.; Al-Khalili, A.; Danared, H.; Djuric, N.; Dunn, GH; Larsson, M.; Le Padellec, A.; Rosen, S.; Af Ugglas, M. (1999). "Fracciones de ramificación de la recombinación disociativa de iones moleculares NH4+ y NH2+". Astronomía y Astrofísica . 344 : 1027. Bibcode :1999A&A...344.1027V.
- ^ van Dishoeck, EF; Black, JH (1986). "Modelos integrales de nubes interestelares difusas: condiciones físicas y abundancias moleculares" (PDF) . Astrophys. J. Suppl. Ser . 62 : 109–145. Bibcode :1986ApJS...62..109V. doi :10.1086/191135. hdl : 1887/1980 .
- ^ "astrochemistry.net". astrochemistry.net . Consultado el 21 de mayo de 2011 .
- ^ Prasad, SS; Huntress, WT (1980). "Un modelo para la química de la fase gaseosa en nubes interestelares". The Astrophysical Journal Supplement Series . 43 : 1. Bibcode :1980ApJS...43....1P. doi : 10.1086/190665 .
- ^ Lininger, W.; Albritton, DL; Fehsenfeld, FC; Schmeltekopf, AL; Ferguson, EE (1975). "Medidas de dependencia de la energía cinética de algunas constantes de velocidad de transferencia de protones exotérmicas mediante tubos de flujo-deriva". J. Chem. Phys . 62 (9): 3549. Bibcode :1975JChPh..62.3549L. doi :10.1063/1.430946.
- ^ Smith, D.; Adams, NG (1977). "Reacciones de iones CH + n con amoníaco a 300 K". Chemical Physics Letters . 47 (1): 145. Bibcode :1977CPL....47..145S. doi :10.1016/0009-2614(77)85326-8.
- ^ Wooten, A.; Bozyan, EP; Garrett, DB (1980). "Detección de C 2 H en nubes oscuras y frías". Astrophysical Journal . 239 : 844. Bibcode :1980ApJ...239..844W. doi :10.1086/158168.
- ^ Wilson, TL; Downes, D.; Bieging, J. (1979). "Amoníaco en Orión". Astronomía y Astrofísica . 71 (3): 275. Bibcode :1979A&A....71..275W.
- ^ MacDonald, GH; Little, LT; Brown, AT; Riley, PW; Matheson, DN; Felli, M. (1981). "Detección de nuevas fuentes de amoniaco". MNRAS . 195 (2): 387. Bibcode :1981MNRAS.195..387M. doi : 10.1093/mnras/195.2.387 .
- ^ Morris, M.; Zuckerman, B.; Palmer, P.; Turner, BE (1973). "Amoníaco interestelar". Astrophysical Journal . 186 : 501. Bibcode :1973ApJ...186..501M. doi :10.1086/152515.
- ^ Torrelles, JM; Ho, PTP; Rodríguez, LF; Canto, J. (1985). "Observaciones del VLA de amoniaco y continuum en regiones con efluentes gaseosos de alta velocidad". Astrophysical Journal . 288 : 595. Bibcode :1985ApJ...288..595T. doi :10.1086/162825. S2CID 123014355.
- ^ Ho, PTP; Martin, RN; Turner, JL; Jackson, JM (1990). "Imágenes del VLA de amoníaco extragaláctico: gas caliente en el núcleo de IC 342". Astrophysical Journal Letters . 355 : L19. Código Bibliográfico :1990ApJ...355L..19H. doi : 10.1086/185728 .
- ^ Cesaroni, R.; Churchwell, E.; Hofner, P.; Walmsley, CM; Kurtz, S. (1994). "Amoníaco caliente hacia regiones HII compactas". Astronomía y Astrofísica . 288 : 903. Bibcode :1994A&A...288..903C.
- ^ Knacke, RF; McCorkle, S.; Puetter, RC; Erickson, EF; Kraetschmer, W. (1982). "Observación de hielo de amoníaco interestelar". Astrophysical Journal . 260 : 141. Bibcode :1982ApJ...260..141K. doi : 10.1086/160241 .
- ^ Orton, GS; Aumann, HH; Martonchik, JV; Appleby, JF (1982). "Espectroscopia aérea de Júpiter en la región de 100 a 300 cm −1 : Propiedades globales del gas amoniaco y la neblina de hielo". Icarus . 52 (1): 81. Bibcode :1982Icar...52...81O. doi :10.1016/0019-1035(82)90170-1.
- ^ Benson, PJ; Myers, P. (1989). "Un estudio de núcleos densos en nubes oscuras". Serie de suplementos de revistas astrofísicas . 71 : 89. Bibcode :1989ApJS...71...89B. doi : 10.1086/191365 .
- ^ Mebold, U.; Heithausen, A.; Reif, K. (1987). "Amoníaco en el halo galáctico y en los cirros infrarrojos". Astronomía y Astrofísica . 180 : 213. Bibcode :1987A&A...180..213M.
- ^ Martin, RN; Ho, PTP (1979). "Detección de amoníaco extragaláctico". Astronomía y Astrofísica . 74 (1): L7. Código Bibliográfico :1979A&A....74L...7M.
- ^ Takano, S.; Nakai, N.; Kawaguchi, K. (1 de abril de 2002). "Observaciones de amoníaco en galaxias externas I. NGC 253 y M 82". Publicaciones de la Sociedad Astronómica de Japón . 54 (2): 195–207. Código Bib : 2002PASJ...54..195T. doi : 10.1093/pasj/54.2.195 .
Obras citadas
- "Amoniaco acuático". airgasspecialtyproducts.com. Archivado desde el original el 19 de noviembre de 2010. Consultado el 28 de noviembre de 2010 .
- Este artículo incorpora texto de una publicación que ahora es de dominio público : Chisholm, Hugh , ed. (1911). "Amoníaco". Encyclopædia Britannica . Vol. 1 (11.ª ed.). Cambridge University Press. págs. 861–863.
- Clark, Jim (abril de 2013) [2002]. "El proceso Haber" . Consultado el 15 de diciembre de 2018 .
Lectura adicional
- Bretherick, L., ed. (1986). Peligros en el laboratorio químico (4.ª ed.). Londres: Royal Society of Chemistry. ISBN 978-0-85186-489-1.OCLC 16985764 .
- Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- Housecroft, CE; Sharpe, AG (2000). Química inorgánica (1.ª ed.). Nueva York: Prentice Hall. ISBN 978-0-582-31080-3.
- Weast, RC, ed. (1972). Manual de química y física (53.ª ed.). Cleveland, Ohio: Chemical Rubber Co.
Enlaces externos
- Ficha internacional de seguridad química 0414 (amoniaco anhidro), ilo.org.
- Ficha internacional de seguridad química 0215 (soluciones acuosas), ilo.org.
- CID 222 de PubChem
- "Ammoniac etsolutions aqueuses" (en francés). Instituto Nacional de Investigación y Seguridad. Archivado desde el original el 11 de diciembre de 2010.
- Respuesta de emergencia a derrames de fertilizantes de amoníaco para el Departamento de Agricultura de Minnesota.ammoniaspills.org
- Instituto Nacional de Seguridad y Salud Ocupacional: página sobre amoníaco, cdc.gov
- Guía de bolsillo del NIOSH sobre peligros químicos: amoníaco, cdc.gov
- Amoniaco, vídeo











