Hemoglobina
| Hemoglobina | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| (heterotetrámero, ( α β ) 2 ) | |||||||||||||
 Estructura de la hemoglobina humana. Las subunidades de globina α y β están en rojo y azul, respectivamente, y los grupos hemo que contienen hierro en verde. De PDB : 1GZX Proteopedia Hemoglobin | |||||||||||||
| Tipo de proteína | metaloproteína , cromoproteína , globulina | ||||||||||||
| Función | transporte de oxígeno | ||||||||||||
| Cofactor(es) | hemo (4) | ||||||||||||
| |||||||||||||
La hemoglobina ( hemoglobina , [a] Hb o Hgb ) es una proteína que contiene hierro y que facilita el transporte de oxígeno en los glóbulos rojos . Casi todos los vertebrados contienen hemoglobina, [3] con la única excepción de la familia de peces Channichthyidae . [4] La hemoglobina en la sangre transporta oxígeno desde los órganos respiratorios ( pulmones o branquias ) a los demás tejidos del cuerpo, donde libera el oxígeno para permitir la respiración aeróbica que impulsa el metabolismo del animal . Un humano sano tiene de 12 a 20 gramos de hemoglobina en cada 100 ml de sangre. La hemoglobina es una metaloproteína , una cromoproteína y una globulina .
En los mamíferos , la hemoglobina constituye aproximadamente el 96% del peso seco de un glóbulo rojo (excluyendo el agua) y alrededor del 35% del peso total (incluyendo el agua). [5] La hemoglobina tiene una capacidad de unión al oxígeno de 1,34 mL de O 2 por gramo, [6] lo que aumenta la capacidad total de oxígeno en sangre setenta veces en comparación con el oxígeno disuelto en el plasma sanguíneo solo. [7] La molécula de hemoglobina de los mamíferos puede unir y transportar hasta cuatro moléculas de oxígeno. [8]
La hemoglobina también transporta otros gases. Se lleva parte del dióxido de carbono respiratorio del cuerpo (aproximadamente el 20-25% del total) [9] como carbaminohemoglobina , en la que el CO 2 se une a la proteína hemo . La molécula también transporta la importante molécula reguladora óxido nítrico unida a un grupo tiol en la proteína globina, liberándola al mismo tiempo que el oxígeno. [10]
La hemoglobina también se encuentra en otras células, incluidas las neuronas dopaminérgicas A9 de la sustancia negra , los macrófagos , las células alveolares , los pulmones, el epitelio pigmentario de la retina, los hepatocitos, las células mesangiales del riñón, las células endometriales, las células cervicales y las células epiteliales vaginales. [11] En estos tejidos, la hemoglobina absorbe el oxígeno innecesario como antioxidante y regula el metabolismo del hierro . [12] El exceso de glucosa en la sangre puede unirse a la hemoglobina y elevar el nivel de hemoglobina A1c. [13]
La hemoglobina y las moléculas similares a la hemoglobina también se encuentran en muchos invertebrados, hongos y plantas. [14] En estos organismos, las hemoglobinas pueden transportar oxígeno, o pueden transportar y regular otras moléculas pequeñas e iones como el dióxido de carbono, el óxido nítrico, el sulfuro de hidrógeno y el sulfuro. Una variante llamada leghemoglobina sirve para extraer oxígeno de los sistemas anaeróbicos como los nódulos fijadores de nitrógeno de las plantas leguminosas , lo que evita el envenenamiento por oxígeno.
La afección médica llamada hemoglobinemia , una forma de anemia , es causada por hemólisis intravascular , en la cual la hemoglobina se filtra de los glóbulos rojos al plasma sanguíneo .
Historial de investigación

En 1825, Johann Friedrich Engelhart descubrió que la proporción de hierro y proteína es idéntica en las hemoglobinas de varias especies. [16] [17] A partir de la masa atómica conocida del hierro, calculó la masa molecular de la hemoglobina con la fórmula n × 16000 ( n = número de átomos de hierro por molécula de hemoglobina, que ahora se sabe que es 4), la primera determinación de la masa molecular de una proteína. Esta "conclusión apresurada" provocó el ridículo de sus colegas, que no podían creer que una molécula pudiera ser tan grande. Sin embargo, Gilbert Smithson Adair confirmó los resultados de Engelhart en 1925 midiendo la presión osmótica de las soluciones de hemoglobina. [18]
Aunque se sabía que la sangre transportaba oxígeno al menos desde 1794, [19] [20] la propiedad de transporte de oxígeno de la hemoglobina fue descrita por Hünefeld en 1840. [21] En 1851, el fisiólogo alemán Otto Funke publicó una serie de artículos en los que describía el crecimiento de cristales de hemoglobina diluyendo sucesivamente glóbulos rojos con un disolvente como agua pura, alcohol o éter, seguido de una evaporación lenta del disolvente de la solución de proteína resultante. [22] [23] La oxigenación reversible de la hemoglobina fue descrita unos años más tarde por Felix Hoppe-Seyler . [24]
Con el desarrollo de la cristalografía de rayos X , se hizo posible secuenciar estructuras de proteínas. [25] En 1959, Max Perutz determinó la estructura molecular de la hemoglobina. [26] [27] Por este trabajo compartió el Premio Nobel de Química de 1962 con John Kendrew , quien secuenció la proteína globular mioglobina . [25] [28]
El papel de la hemoglobina en la sangre fue dilucidado por el fisiólogo francés Claude Bernard .
El nombre hemoglobina (o hemoglobina ) se deriva de las palabras hemo (o haem ) y globina , lo que refleja el hecho de que cada subunidad de la hemoglobina es una proteína globular con un grupo hemo incrustado . Cada grupo hemo contiene un átomo de hierro, que puede unirse a una molécula de oxígeno a través de fuerzas dipolares inducidas por iones. El tipo más común de hemoglobina en los mamíferos contiene cuatro de estas subunidades. [29]
Genética
La hemoglobina está formada por subunidades proteicas ( moléculas de globina ), que son polipéptidos , largas cadenas plegadas de aminoácidos específicos que determinan las propiedades químicas y la función de la proteína. La secuencia de aminoácidos de cualquier polipéptido se traduce a partir de un segmento de ADN, el gen correspondiente .
Hay más de un gen de hemoglobina. En los humanos, la hemoglobina A (la principal forma de hemoglobina en adultos) está codificada por los genes HBA1 , HBA2 y HBB . [30] Las subunidades alfa 1 y alfa 2 están codificadas respectivamente por los genes HBA1 y HBA2 juntos en el cromosoma 16, mientras que la subunidad beta está codificada por el gen HBB en el cromosoma 11. Las secuencias de aminoácidos de las subunidades de globina suelen diferir entre especies, y la diferencia aumenta con la distancia evolutiva. Por ejemplo, las secuencias de hemoglobina más comunes en humanos, bonobos y chimpancés son completamente idénticas, con exactamente las mismas cadenas de proteína de globina alfa y beta. [31] [32] [33] La hemoglobina humana y de gorila difieren en un aminoácido en las cadenas alfa y beta, y estas diferencias aumentan entre especies menos relacionadas. [ cita requerida ]
Las mutaciones en los genes de la hemoglobina pueden dar lugar a variantes de la hemoglobina dentro de una misma especie, aunque una secuencia suele ser la "más común" en cada especie. [34] [35] Muchas de estas mutaciones no causan ninguna enfermedad, pero algunas causan un grupo de enfermedades hereditarias llamadas hemoglobinopatías . La hemoglobinopatía más conocida es la anemia falciforme , que fue la primera enfermedad humana cuyo mecanismo se comprendió a nivel molecular. Un conjunto mayoritariamente separado de enfermedades llamadas talasemias implica una producción insuficiente de hemoglobinas normales y, a veces, anormales, a través de problemas y mutaciones en la regulación del gen de la globina . Todas estas enfermedades producen anemia . [36]

Las variaciones en las secuencias de hemoglobina, al igual que con otras proteínas, pueden ser adaptativas. Por ejemplo, se ha descubierto que la hemoglobina se adapta de diferentes maneras al aire enrarecido a grandes altitudes, donde una menor presión parcial de oxígeno disminuye su unión a la hemoglobina en comparación con las presiones más altas a nivel del mar. Estudios recientes de ratones ciervos encontraron mutaciones en cuatro genes que pueden explicar las diferencias entre las poblaciones de alta y baja altitud. Se encontró que los genes de las dos razas son "prácticamente idénticos, excepto aquellos que gobiernan la capacidad de transporte de oxígeno de su hemoglobina... La diferencia genética permite a los ratones de las tierras altas hacer un uso más eficiente de su oxígeno". [37] La hemoglobina de mamut presentó mutaciones que permitieron el suministro de oxígeno a temperaturas más bajas, lo que permitió a los mamuts migrar a latitudes más altas durante el Pleistoceno . [38] Esto también se encontró en los colibríes que habitan en los Andes. Los colibríes ya gastan mucha energía y por lo tanto tienen altas demandas de oxígeno y, sin embargo, se ha descubierto que los colibríes andinos prosperan en grandes altitudes. Las mutaciones no sinónimas en el gen de la hemoglobina de múltiples especies que viven en grandes altitudes ( Oreotrochilus, A. castelnaudii, C. violifer, P. gigas y A. viridicuada ) han hecho que la proteína tenga menos afinidad por el hexafosfato de inositol (IHP), una molécula que se encuentra en las aves y que tiene un papel similar al 2,3-BPG en los humanos; esto da como resultado la capacidad de unirse al oxígeno en presiones parciales más bajas. [39]
Los pulmones circulatorios únicos de las aves también promueven un uso eficiente del oxígeno a bajas presiones parciales de O 2 . Estas dos adaptaciones se refuerzan entre sí y explican el notable desempeño de las aves a gran altitud. [ cita requerida ]
La adaptación de la hemoglobina se extiende también a los humanos. Existe una mayor tasa de supervivencia de la descendencia entre las mujeres tibetanas con genotipos de alta saturación de oxígeno que residen a 4.000 m. [40] La selección natural parece ser la principal fuerza que actúa sobre este gen porque la tasa de mortalidad de la descendencia es significativamente menor para las mujeres con mayor afinidad hemoglobina-oxígeno en comparación con la tasa de mortalidad de la descendencia de mujeres con baja afinidad hemoglobina-oxígeno. Si bien el genotipo exacto y el mecanismo por el cual esto ocurre aún no están claros, la selección está actuando sobre la capacidad de estas mujeres para fijar el oxígeno en presiones parciales bajas, lo que en general les permite sostener mejor los procesos metabólicos cruciales. [ cita requerida ]
Síntesis
La hemoglobina (Hb) se sintetiza en una serie compleja de pasos. La parte hemo se sintetiza en una serie de pasos en las mitocondrias y el citosol de los glóbulos rojos inmaduros, mientras que las partes proteínicas de la globina se sintetizan en los ribosomas en el citosol. [41] La producción de Hb continúa en la célula durante todo su desarrollo temprano desde el proeritroblasto hasta el reticulocito en la médula ósea . En este punto, el núcleo se pierde en los glóbulos rojos de los mamíferos, pero no en las aves y muchas otras especies. Incluso después de la pérdida del núcleo en los mamíferos, el ARN ribosómico residual permite una mayor síntesis de Hb hasta que el reticulocito pierde su ARN poco después de entrar en la vasculatura (de hecho, este ARN sintético de hemoglobina le da al reticulocito su apariencia reticulada y su nombre). [42]
Estructura del hemo

La hemoglobina tiene una estructura cuaternaria característica de muchas proteínas globulares de múltiples subunidades. [43] La mayoría de los aminoácidos de la hemoglobina forman hélices alfa , y estas hélices están conectadas por segmentos cortos no helicoidales. Los enlaces de hidrógeno estabilizan las secciones helicoidales dentro de esta proteína, lo que provoca atracciones dentro de la molécula, lo que luego hace que cada cadena polipeptídica se pliegue en una forma específica. [44] La estructura cuaternaria de la hemoglobina proviene de sus cuatro subunidades en una disposición aproximadamente tetraédrica. [43]
En la mayoría de los vertebrados, la molécula de hemoglobina es un conjunto de cuatro subunidades proteicas globulares . Cada subunidad está compuesta por una cadena proteica estrechamente asociada con un grupo hemo prostético no proteico . Cada cadena proteica se organiza en un conjunto de segmentos estructurales de hélice alfa conectados entre sí en una disposición de pliegues de globina . Se le da este nombre porque esta disposición es el mismo motivo de plegamiento utilizado en otras proteínas hemo/globina como la mioglobina . [45] [46] Este patrón de plegamiento contiene un bolsillo que une fuertemente al grupo hemo. [ cita requerida ]
Un grupo hemo consiste en un ion de hierro (Fe) retenido en un anillo heterocíclico , conocido como porfirina . Este anillo de porfirina consiste en cuatro moléculas de pirrol unidas cíclicamente entre sí (por puentes de metino ) con el ion de hierro unido en el centro. [47] El ion de hierro, que es el sitio de unión del oxígeno, se coordina con los cuatro átomos de nitrógeno en el centro del anillo, que se encuentran todos en un plano. El hemo está unido fuertemente (covalentemente) a la proteína globular a través de los átomos de N del anillo de imidazol del residuo de histidina F8 (también conocido como histidina proximal) debajo del anillo de porfirina. Una sexta posición puede unir reversiblemente el oxígeno mediante un enlace covalente coordinado , [48] completando el grupo octaédrico de seis ligandos. Esta unión reversible con el oxígeno es la razón por la que la hemoglobina es tan útil para transportar oxígeno por el cuerpo. [49] El oxígeno se une en una geometría de "doblado de extremo a extremo" donde un átomo de oxígeno se une al Fe y el otro sobresale en un ángulo. Cuando el oxígeno no está unido, una molécula de agua con un enlace muy débil llena el sitio, formando un octaedro distorsionado .
Aunque el dióxido de carbono es transportado por la hemoglobina, no compite con el oxígeno por las posiciones de unión del hierro, sino que está unido a los grupos amina de las cadenas de proteínas unidas a los grupos hemo.
El ion hierro puede estar en el estado ferroso Fe 2+ o en el férrico Fe 3+ , pero la ferrihemoglobina ( metahemoglobina ) (Fe 3+ ) no puede unirse al oxígeno. [50] En la unión, el oxígeno oxida temporal y reversiblemente (Fe 2+ ) a (Fe 3+ ) mientras que el oxígeno se convierte temporalmente en el ion superóxido , por lo que el hierro debe existir en el estado de oxidación +2 para unirse al oxígeno. Si el ion superóxido asociado a Fe 3+ está protonado, el hierro de la hemoglobina permanecerá oxidado e incapaz de unirse al oxígeno. En tales casos, la enzima metahemoglobina reductasa podrá eventualmente reactivar la metahemoglobina reduciendo el centro de hierro.
En los adultos, el tipo de hemoglobina más común es un tetrámero (que contiene cuatro subunidades proteicas) llamado hemoglobina A , que consta de dos subunidades α y dos β unidas de forma no covalente, cada una formada por 141 y 146 residuos de aminoácidos, respectivamente. Esto se denota como α 2 β 2 . Las subunidades son estructuralmente similares y aproximadamente del mismo tamaño. Cada subunidad tiene un peso molecular de aproximadamente 16.000 daltons , [51] para un peso molecular total del tetrámero de aproximadamente 64.000 daltons (64.458 g/mol). [52] Por lo tanto, 1 g/dL = 0,1551 mmol/L. La hemoglobina A es la molécula de hemoglobina más estudiada. [ cita requerida ]
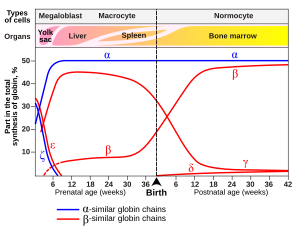
En los bebés humanos, la molécula de hemoglobina fetal está formada por dos cadenas α y dos cadenas γ. Las cadenas γ se reemplazan gradualmente por cadenas β a medida que el bebé crece. [53]
Las cuatro cadenas polipeptídicas están unidas entre sí por puentes salinos , enlaces de hidrógeno y el efecto hidrofóbico .
Saturación de oxígeno
En general, la hemoglobina puede estar saturada con moléculas de oxígeno (oxihemoglobina) o desaturada con moléculas de oxígeno (desoxihemoglobina). [54]
Oxihemoglobina
La oxihemoglobina se forma durante la respiración fisiológica cuando el oxígeno se une al componente hemo de la proteína hemoglobina en los glóbulos rojos. Este proceso ocurre en los capilares pulmonares adyacentes a los alvéolos de los pulmones. Luego, el oxígeno viaja a través del torrente sanguíneo para ser descargado en las células, donde se utiliza como aceptor terminal de electrones en la producción de ATP mediante el proceso de fosforilación oxidativa . Sin embargo, no ayuda a contrarrestar una disminución del pH sanguíneo. La ventilación , o respiración, puede revertir esta condición mediante la eliminación de dióxido de carbono , lo que provoca un aumento del pH. [55]
La hemoglobina existe en dos formas, una forma tensa (T) y una forma relajada (R). Varios factores como el pH bajo, el CO2 alto y el 2,3 BPG alto a nivel de los tejidos favorecen la forma tensa, que tiene baja afinidad por el oxígeno y libera oxígeno en los tejidos. Por el contrario, un pH alto, un CO2 bajo o un 2,3 BPG bajo favorecen la forma relajada, que puede unirse mejor al oxígeno. [56] La presión parcial del sistema también afecta la afinidad por el O2 donde, a altas presiones parciales de oxígeno (como las presentes en los alvéolos), se favorece el estado relajado (alta afinidad, R). Inversamente, a bajas presiones parciales (como las presentes en los tejidos respiratorios), se favorece el estado tenso (baja afinidad, T). [57] Además, la unión del oxígeno al hemo de hierro (II) empuja el hierro hacia el plano del anillo de porfirina, lo que provoca un ligero cambio conformacional. El cambio estimula la unión del oxígeno a las tres unidades de hemo restantes dentro de la hemoglobina (por lo tanto, la unión del oxígeno es cooperativa). [ cita requerida ]
Clásicamente, el hierro en la oxihemoglobina se considera existente en el estado de oxidación del hierro (II). Sin embargo, el complejo de oxígeno con el hierro hemo es diamagnético , mientras que tanto el oxígeno como el hierro (II) de alto espín son paramagnéticos . La evidencia experimental sugiere firmemente que el hierro hemo está en el estado de oxidación del hierro (III) en la oxihemoglobina, y que el oxígeno existe como anión superóxido (O 2 •− ) o en un complejo de transferencia de carga covalente. [58]
Hemoglobina desoxigenada
La hemoglobina desoxigenada (desoxihemoglobina) es la forma de hemoglobina sin el oxígeno unido. Los espectros de absorción de la oxihemoglobina y la desoxihemoglobina difieren. La oxihemoglobina tiene una absorción significativamente menor en la longitud de onda de 660 nm que la desoxihemoglobina, mientras que en la de 940 nm su absorción es ligeramente mayor. Esta diferencia se utiliza para medir la cantidad de oxígeno en la sangre de un paciente mediante un instrumento llamado oxímetro de pulso . Esta diferencia también explica la presentación de cianosis , el color azul a violáceo que desarrollan los tejidos durante la hipoxia . [59]
La hemoglobina desoxigenada es paramagnética ; es débilmente atraída por los campos magnéticos . [60] [61] Por el contrario, la hemoglobina oxigenada exhibe diamagnetismo , una repulsión débil de un campo magnético. [61]
Evolución de la hemoglobina en vertebrados
Los científicos coinciden en que el evento que separó la mioglobina de la hemoglobina ocurrió después de que las lampreas divergieran de los vertebrados con mandíbulas . [ 62] Esta separación de la mioglobina y la hemoglobina permitió que surgieran y se desarrollaran las diferentes funciones de las dos moléculas: la mioglobina tiene más que ver con el almacenamiento de oxígeno, mientras que la hemoglobina se encarga del transporte de oxígeno. [63] Los genes de globina similares a α y β codifican las subunidades individuales de la proteína. [30] Los predecesores de estos genes surgieron a través de otro evento de duplicación también después del ancestro común gnatosoma derivado de los peces sin mandíbula, hace aproximadamente 450-500 millones de años. [62] Los estudios de reconstrucción ancestral sugieren que el ancestro de preduplicación de los genes α y β era un dímero compuesto de subunidades de globina idénticas, que luego evolucionaron para ensamblarse en una arquitectura tetramérica después de la duplicación. [64] El desarrollo de los genes α y β creó la posibilidad de que la hemoglobina estuviera compuesta de múltiples subunidades distintas, una composición física fundamental para la capacidad de la hemoglobina de transportar oxígeno. La presencia de múltiples subunidades contribuye a la capacidad de la hemoglobina de unirse al oxígeno de manera cooperativa, así como de ser regulada alostéricamente. [63] [64] Posteriormente, el gen α también experimentó un evento de duplicación para formar los genes HBA1 y HBA2 . [65] Estas duplicaciones y divergencias posteriores han creado una gama diversa de genes de globina similares a α y β que están regulados de modo que ciertas formas ocurren en diferentes etapas del desarrollo. [63]
La mayoría de los peces de hielo de la familia Channichthyidae han perdido sus genes de hemoglobina como adaptación al agua fría. [4]
Cooperatividad
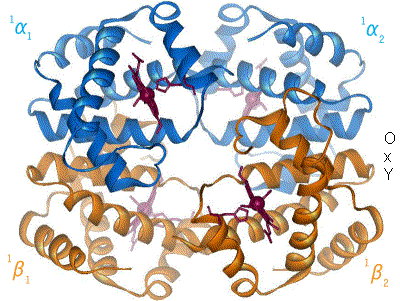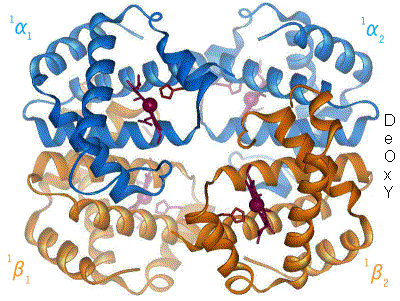
Cuando el oxígeno se une al complejo de hierro, hace que el átomo de hierro se mueva hacia atrás, hacia el centro del plano del anillo de porfirina (ver diagrama de movimiento). Al mismo tiempo, la cadena lateral de imidazol del residuo de histidina que interactúa en el otro polo del hierro es atraída hacia el anillo de porfirina. Esta interacción fuerza al plano del anillo hacia el exterior del tetrámero y también induce una tensión en la hélice de la proteína que contiene la histidina a medida que se acerca al átomo de hierro. Esta tensión se transmite a los tres monómeros restantes en el tetrámero, donde induce un cambio conformacional similar en los otros sitios del hemo, de modo que la unión del oxígeno a estos sitios se vuelve más fácil.
A medida que el oxígeno se une a un monómero de hemoglobina, la conformación del tetrámero cambia del estado T (tenso) al estado R (relajado). Este cambio promueve la unión del oxígeno a los grupos hemo de los tres monómeros restantes, saturando así la molécula de hemoglobina con oxígeno. [66]
En la forma tetramérica de la hemoglobina adulta normal, la unión del oxígeno es, por tanto, un proceso cooperativo . La afinidad de unión de la hemoglobina por el oxígeno aumenta con la saturación de oxígeno de la molécula, y las primeras moléculas de oxígeno unidas influyen en la forma de los sitios de unión de las siguientes, de forma favorable para la unión. Esta unión cooperativa positiva se consigue mediante cambios conformacionales estéricos del complejo proteico de la hemoglobina, como se ha comentado anteriormente; es decir, cuando una subunidad proteica de la hemoglobina se oxigena, se inicia un cambio conformacional o estructural en todo el complejo, lo que hace que las demás subunidades adquieran una mayor afinidad por el oxígeno. Como consecuencia, la curva de unión del oxígeno de la hemoglobina es sigmoidea , o en forma de S , a diferencia de la curva hiperbólica normal asociada a la unión no cooperativa.
Se ha discutido el mecanismo dinámico de la cooperatividad en la hemoglobina y su relación con la resonancia de baja frecuencia . [67]
Unión de ligandos distintos del oxígeno
Además del ligando de oxígeno , que se une a la hemoglobina de manera cooperativa, los ligandos de hemoglobina también incluyen inhibidores competitivos como el monóxido de carbono (CO) y ligandos alostéricos como el dióxido de carbono (CO 2 ) y el óxido nítrico (NO). El dióxido de carbono se une a los grupos amino de las proteínas de globina para formar carbaminohemoglobina ; se cree que este mecanismo explica aproximadamente el 10% del transporte de dióxido de carbono en mamíferos. El óxido nítrico también puede ser transportado por la hemoglobina; se une a grupos tiol específicos en la proteína globina para formar un S-nitrosotiol, que se disocia en óxido nítrico libre y tiol nuevamente, a medida que la hemoglobina libera oxígeno de su sitio hemo. Se plantea la hipótesis de que este transporte de óxido nítrico a los tejidos periféricos ayuda al transporte de oxígeno en los tejidos, al liberar óxido nítrico vasodilatador a los tejidos en los que los niveles de oxígeno son bajos. [68]
Competitivo
La unión del oxígeno se ve afectada por moléculas como el monóxido de carbono (por ejemplo, del tabaco para fumar , los gases de escape y la combustión incompleta en los hornos). El CO compite con el oxígeno en el sitio de unión del hemo. La afinidad de unión de la hemoglobina por el CO es 250 veces mayor que su afinidad por el oxígeno, [69] [70] Dado que el monóxido de carbono es un gas incoloro, inodoro e insípido, y plantea una amenaza potencialmente mortal, los detectores de monóxido de carbono se han vuelto disponibles comercialmente para advertir de niveles peligrosos en las residencias. Cuando la hemoglobina se combina con el CO, forma un compuesto rojo muy brillante llamado carboxihemoglobina , que puede hacer que la piel de las víctimas de intoxicación por CO parezca rosada al morir, en lugar de blanca o azul. Cuando el aire inspirado contiene niveles de CO tan bajos como 0,02%, se producen dolor de cabeza y náuseas ; si la concentración de CO aumenta a 0,1%, seguirá la inconsciencia. En los fumadores empedernidos, hasta el 20% de los sitios activos de oxígeno pueden estar bloqueados por el CO.
De manera similar, la hemoglobina también tiene afinidad competitiva por el cianuro (CN − ), el monóxido de azufre (SO) y el sulfuro (S 2− ), incluido el sulfuro de hidrógeno (H 2 S). Todos ellos se unen al hierro en el hemo sin cambiar su estado de oxidación, pero, no obstante, inhiben la unión del oxígeno, lo que provoca una grave toxicidad.
El átomo de hierro en el grupo hemo debe estar inicialmente en el estado de oxidación ferroso (Fe 2+ ) para favorecer la unión y el transporte del oxígeno y otros gases (cambia temporalmente a férrico durante el tiempo en que el oxígeno está unido, como se explicó anteriormente). La oxidación inicial al estado férrico (Fe 3+ ) sin oxígeno convierte la hemoglobina en "hem i globina" o metahemoglobina , que no puede unirse al oxígeno. La hemoglobina en los glóbulos rojos normales está protegida por un sistema de reducción para evitar que esto suceda. El óxido nítrico es capaz de convertir una pequeña fracción de la hemoglobina en metahemoglobina en los glóbulos rojos. La última reacción es una actividad remanente de la función más antigua de la dioxigenasa del óxido nítrico de las globinas.
Alostérico
El dióxido de carbono ocupa un sitio de unión diferente en la hemoglobina. En los tejidos, donde la concentración de dióxido de carbono es mayor, el dióxido de carbono se une al sitio alostérico de la hemoglobina, lo que facilita la descarga de oxígeno de la hemoglobina y, en última instancia, su eliminación del cuerpo después de que el oxígeno se haya liberado a los tejidos que experimentan el metabolismo. Esta mayor afinidad por el dióxido de carbono por parte de la sangre venosa se conoce como efecto Bohr . A través de la enzima anhidrasa carbónica , el dióxido de carbono reacciona con el agua para dar ácido carbónico , que se descompone en bicarbonato y protones :
- CO 2 + H 2 O → H 2 CO 3 → HCO 3 − + H +

Por lo tanto, la sangre con altos niveles de dióxido de carbono también tiene un pH más bajo (más ácida ). La hemoglobina puede unirse a protones y dióxido de carbono, lo que provoca un cambio conformacional en la proteína y facilita la liberación de oxígeno. Los protones se unen en varios lugares de la proteína, mientras que el dióxido de carbono se une al grupo α-amino. [71] El dióxido de carbono se une a la hemoglobina y forma carbaminohemoglobina . [72] Esta disminución de la afinidad de la hemoglobina por el oxígeno por la unión del dióxido de carbono y el ácido se conoce como efecto Bohr . El efecto Bohr favorece el estado T en lugar del estado R. (desplaza la curva de saturación de O 2 hacia la derecha ). Por el contrario, cuando los niveles de dióxido de carbono en la sangre disminuyen (es decir, en los capilares pulmonares), el dióxido de carbono y los protones se liberan de la hemoglobina, lo que aumenta la afinidad de la proteína por el oxígeno. La reducción de la capacidad total de unión de la hemoglobina al oxígeno (es decir, el desplazamiento de la curva hacia abajo, no solo hacia la derecha) debido a la reducción del pH se denomina efecto raíz y se observa en los peces óseos.
La hemoglobina necesita liberar el oxígeno que se une a ella; si no, no tiene sentido unirlo. La curva sigmoidea de la hemoglobina la hace eficiente en la unión (captación de O2 en los pulmones) y eficiente en la descarga (descarga de O2 en los tejidos). [73]
En las personas aclimatadas a grandes altitudes, la concentración de 2,3-Bisfosfoglicerato (2,3-BPG) en la sangre aumenta, lo que permite a estos individuos entregar una mayor cantidad de oxígeno a los tejidos en condiciones de menor tensión de oxígeno . Este fenómeno, donde la molécula Y afecta la unión de la molécula X a una molécula de transporte Z, se llama efecto alostérico heterotrópico . La hemoglobina en organismos a grandes altitudes también se ha adaptado de tal manera que tiene menos afinidad por el 2,3-BPG y, por lo tanto, la proteína se desplazará más hacia su estado R. En su estado R, la hemoglobina se unirá al oxígeno más fácilmente, lo que permite a los organismos realizar los procesos metabólicos necesarios cuando el oxígeno está presente a bajas presiones parciales. [74]
Los animales distintos de los humanos utilizan moléculas diferentes para unirse a la hemoglobina y cambiar su afinidad por el O2 en condiciones desfavorables. Los peces utilizan tanto ATP como GTP . Estos se unen a un "bolsillo" de fosfato en la molécula de hemoglobina del pez, lo que estabiliza el estado tenso y, por lo tanto, disminuye la afinidad por el oxígeno. [75] El GTP reduce la afinidad por el oxígeno de la hemoglobina mucho más que el ATP, lo que se cree que se debe a un enlace de hidrógeno adicional formado que estabiliza aún más el estado tenso. [76] En condiciones hipóxicas, la concentración tanto de ATP como de GTP se reduce en los glóbulos rojos de los peces para aumentar la afinidad por el oxígeno. [77]
En el feto en desarrollo se encuentra una variante de la hemoglobina, denominada hemoglobina fetal (HbF, α 2 γ 2 ), que se une al oxígeno con mayor afinidad que la hemoglobina adulta. Esto significa que la curva de unión al oxígeno de la hemoglobina fetal está desplazada hacia la izquierda (es decir, un mayor porcentaje de hemoglobina tiene oxígeno unido a ella a una menor tensión de oxígeno), en comparación con la de la hemoglobina adulta. Como resultado, la sangre fetal en la placenta puede tomar oxígeno de la sangre materna.
La hemoglobina también transporta óxido nítrico (NO) en la parte globina de la molécula. Esto mejora el suministro de oxígeno en la periferia y contribuye al control de la respiración. El NO se une de forma reversible a un residuo de cisteína específico en la globina; la unión depende del estado (R o T) de la hemoglobina. La hemoglobina S-nitrosada resultante influye en varias actividades relacionadas con el NO, como el control de la resistencia vascular, la presión arterial y la respiración. El NO no se libera en el citoplasma de los glóbulos rojos, sino que se transporta fuera de ellos mediante un intercambiador de aniones llamado AE1 . [78]
Tipos de hemoglobina en humanos
Las variantes de la hemoglobina son parte del desarrollo embrionario y fetal normal . También pueden ser formas mutantes patológicas de la hemoglobina en una población , causadas por variaciones en la genética. Algunas variantes de la hemoglobina bien conocidas, como la anemia de células falciformes , son responsables de enfermedades y se consideran hemoglobinopatías . Otras variantes no causan ninguna patología detectable y, por lo tanto, se consideran variantes no patológicas. [34] [79]
En embriones :
- Gower 1 ( ζ2ε2 ) .
- Gower 2 (α 2 ε 2 ) ( PDB : 1A9W ).
- Hemoglobina Portland I (ζ 2 γ 2 ).
- Hemoglobina Portland II (ζ 2 β 2 ).
En los fetos:
- Hemoglobina F (α 2 γ 2 ) ( PDB : 1FDH ).
En neonatos (recién nacidos inmediatamente después del nacimiento):
- Hemoglobina A (hemoglobina adulta) (α 2 β 2 ) ( PDB : 1BZ0 ) – La más común con una cantidad normal superior al 95 %
- La síntesis de la cadena δ de la hemoglobina A 2 (α 2 δ 2 ) comienza a finales del tercer trimestre y, en los adultos, tiene un rango normal de 1,5 a 3,5 %.
- Hemoglobina F (hemoglobina fetal) (α 2 γ 2 ): en los adultos, la hemoglobina F se limita a una población limitada de glóbulos rojos llamados células F. Sin embargo, el nivel de Hb F puede estar elevado en personas con enfermedad de células falciformes y beta-talasemia .
Formas anormales que se presentan en enfermedades:
- Hemoglobina D – (α 2 β D 2 ) – Una forma variante de hemoglobina.
- Hemoglobina H (β 4 ): una forma variante de la hemoglobina, formada por un tetrámero de cadenas β, que puede estar presente en variantes de la talasemia α .
- Hemoglobina de Barts (γ 4 ): una forma variante de hemoglobina, formada por un tetrámero de cadenas γ, que puede estar presente en variantes de la talasemia α.
- Hemoglobina S (α 2 β S 2 ): una variante de la hemoglobina que se encuentra en personas con anemia falciforme. Existe una variación en el gen de la cadena β, que provoca un cambio en las propiedades de la hemoglobina, lo que da como resultado la formación de células falciformes en los glóbulos rojos.
- Hemoglobina C (α 2 β C 2 ): Otra variante debida a una variación en el gen de la cadena β. Esta variante causa una anemia hemolítica crónica leve .
- Hemoglobina E (α 2 β E 2 ): Otra variante debida a una variación en el gen de la cadena β. Esta variante causa una anemia hemolítica crónica leve.
- Hemoglobina AS: una forma heterocigótica que causa el rasgo de células falciformes con un gen adulto y un gen de enfermedad de células falciformes
- Enfermedad de la hemoglobina SC: una forma heterocigótica compuesta con un gen falciforme y otro que codifica la hemoglobina C.
- Hemoglobina Hopkins-2 : una variante de la hemoglobina que a veces se considera que, en combinación con la hemoglobina S, produce la enfermedad de células falciformes.
Degradación en animales vertebrados
Cuando los glóbulos rojos llegan al final de su vida debido al envejecimiento o a defectos, son eliminados de la circulación por la actividad fagocítica de los macrófagos en el bazo o el hígado o se hemolizan dentro de la circulación. La hemoglobina libre luego se elimina de la circulación a través del transportador de hemoglobina CD163 , que se expresa exclusivamente en monocitos o macrófagos. Dentro de estas células, la molécula de hemoglobina se descompone y el hierro se recicla. Este proceso también produce una molécula de monóxido de carbono por cada molécula de hemo degradada. [80] La degradación del hemo es la única fuente natural de monóxido de carbono en el cuerpo humano y es responsable de los niveles normales de monóxido de carbono en la sangre en personas que respiran aire normal. [81]
El otro producto final importante de la degradación del hemo es la bilirrubina . Se detectan mayores niveles de esta sustancia química en la sangre si los glóbulos rojos se destruyen más rápidamente de lo habitual. La proteína hemoglobina degradada de forma inadecuada o la hemoglobina que se ha liberado de las células sanguíneas demasiado rápido puede obstruir los vasos sanguíneos pequeños, especialmente los delicados vasos de filtrado de sangre de los riñones , lo que provoca daño renal. El hierro se elimina del hemo y se recupera para su uso posterior, se almacena como hemosiderina o ferritina en los tejidos y se transporta en el plasma por las betaglobulinas como transferrinas . Cuando se rompe el anillo de porfirina, los fragmentos normalmente se secretan como un pigmento amarillo llamado bilirrubina, que se secreta en los intestinos como bilis. Los intestinos metabolizan la bilirrubina en urobilinógeno. El urobilinógeno sale del cuerpo en las heces, en un pigmento llamado estercobilina. La globulina se metaboliza en aminoácidos que luego se liberan en la circulación.
Enfermedades relacionadas con la hemoglobina
La deficiencia de hemoglobina puede ser causada por una cantidad disminuida de moléculas de hemoglobina, como en la anemia , o por una capacidad disminuida de cada molécula para unirse al oxígeno a la misma presión parcial de oxígeno. Las hemoglobinopatías (defectos genéticos que resultan en una estructura anormal de la molécula de hemoglobina) [82] pueden causar ambas. En cualquier caso, la deficiencia de hemoglobina disminuye la capacidad de transporte de oxígeno en la sangre . La deficiencia de hemoglobina, en general, se distingue estrictamente de la hipoxemia , definida como una presión parcial disminuida de oxígeno en la sangre, [83] [84] [85] [86] aunque ambas son causas de hipoxia (suministro insuficiente de oxígeno a los tejidos).
Otras causas comunes de hemoglobina baja incluyen pérdida de sangre, deficiencia nutricional, problemas de médula ósea, quimioterapia, insuficiencia renal o hemoglobina anormal (como la de la enfermedad de células falciformes).
La capacidad de cada molécula de hemoglobina para transportar oxígeno normalmente se modifica por el pH de la sangre o el CO 2 alterados , lo que provoca una curva de disociación oxígeno-hemoglobina alterada . Sin embargo, también puede verse alterada patológicamente, por ejemplo, en caso de intoxicación por monóxido de carbono .
La disminución de la hemoglobina, con o sin una disminución absoluta de los glóbulos rojos, conduce a síntomas de anemia. La anemia tiene muchas causas diferentes, aunque la deficiencia de hierro y la anemia ferropénica resultante son las causas más comunes en el mundo occidental. Como la ausencia de hierro disminuye la síntesis del hemo, los glóbulos rojos en la anemia ferropénica son hipocrómicos (carecen del pigmento rojo de la hemoglobina) y microcíticos (más pequeños de lo normal). Otras anemias son más raras. En la hemólisis (degradación acelerada de los glóbulos rojos), la ictericia asociada es causada por el metabolito de la hemoglobina, la bilirrubina, y la hemoglobina circulante puede causar insuficiencia renal .
Algunas mutaciones en la cadena de globina están asociadas con hemoglobinopatías , como la anemia falciforme y la talasemia . Otras mutaciones, como se comentó al principio del artículo, son benignas y se las denomina simplemente variantes de la hemoglobina .
Existe un grupo de trastornos genéticos, conocidos como porfirias , que se caracterizan por errores en las vías metabólicas de la síntesis del hemo. El rey Jorge III del Reino Unido fue probablemente el más famoso de los afectados por porfirias.
En pequeña medida, la hemoglobina A se combina lentamente con la glucosa en la valina terminal (un aminoácido alfa) de cada cadena β. La molécula resultante a menudo se denomina Hb A 1c , una hemoglobina glucosilada . La unión de la glucosa a los aminoácidos en la hemoglobina se produce de forma espontánea (sin la ayuda de una enzima) en muchas proteínas, y no se sabe que tenga un propósito útil. Sin embargo, a medida que aumenta la concentración de glucosa en la sangre, aumenta el porcentaje de Hb A que se convierte en Hb A 1c . En los diabéticos cuya glucosa suele ser alta, el porcentaje de Hb A 1c también es alto. Debido a la lenta tasa de combinación de Hb A con glucosa, el porcentaje de Hb A 1c refleja un promedio ponderado de los niveles de glucosa en sangre durante la vida de los glóbulos rojos, que es de aproximadamente 120 días. [87] Por lo tanto, los niveles de hemoglobina glucosilada se miden para monitorear el control a largo plazo de la enfermedad crónica de la diabetes mellitus tipo 2 (T2DM). Un control deficiente de la diabetes de tipo 2 produce niveles elevados de hemoglobina glucosilada en los glóbulos rojos. El rango de referencia normal es de aproximadamente 4,0 a 5,9 %. Aunque es difícil obtenerlos, se recomiendan valores inferiores al 7 % para las personas con diabetes de tipo 2. Los niveles superiores al 9 % se asocian con un control deficiente de la hemoglobina glucosilada, y los niveles superiores al 12 % se asocian con un control muy deficiente. Los diabéticos que mantienen sus niveles de hemoglobina glucosilada cerca del 7 % tienen muchas más posibilidades de evitar las complicaciones que pueden acompañar a la diabetes (que aquellos cuyos niveles son del 8 % o superiores). [88] Además, el aumento de la hemoglobina glucosilada aumenta su afinidad por el oxígeno, lo que impide su liberación en el tejido e induce un nivel de hipoxia en casos extremos. [89]
Los niveles elevados de hemoglobina se asocian con un aumento en la cantidad o el tamaño de los glóbulos rojos, lo que se denomina policitemia . Esta elevación puede ser causada por una cardiopatía congénita , cor pulmonale , fibrosis pulmonar , demasiada eritropoyetina o policitemia vera . [90] Los niveles elevados de hemoglobina también pueden ser causados por la exposición a grandes altitudes, el tabaquismo, la deshidratación (artificialmente mediante la concentración de Hb), la enfermedad pulmonar avanzada y ciertos tumores. [53]
Un estudio reciente realizado en Pondicherry, India, muestra su importancia en la enfermedad de la arteria coronaria. [91]
Usos diagnósticos

La medición de la concentración de hemoglobina es una de las pruebas de sangre que se realizan con más frecuencia , generalmente como parte de un hemograma completo . Por ejemplo, normalmente se analiza antes o después de la donación de sangre . Los resultados se informan en g / L , g/ dL o mol /L. 1 g/dL equivale aproximadamente a 0,6206 mmol/L, aunque las últimas unidades no se utilizan con tanta frecuencia debido a la incertidumbre con respecto al estado polimérico de la molécula. [92] Este factor de conversión, que utiliza el peso molecular de la unidad de globina única de 16.000 Da , es más común para la concentración de hemoglobina en sangre. Para la MCHC (concentración de hemoglobina corpuscular media), es más común el factor de conversión 0,155, que utiliza el peso del tetrámero de 64.500 Da. [93] Los niveles normales son:
- Hombres: 13,8 a 18,0 g/dl (138 a 180 g/l, o 8,56 a 11,17 mmol/l)
- Mujeres: 12,1 a 15,1 g/dl (121 a 151 g/l, o 7,51 a 9,37 mmol/l)
- Niños: 11 a 16 g/dL (110 a 160 g/L, o 6,83 a 9,93 mmol/L)
- Mujeres embarazadas: 11 a 14 g/dL (110 a 140 g/L, o 6,83 a 8,69 mmol/L) (9,5 a 15 valor habitual durante el embarazo) [94] [b]
Los valores normales de hemoglobina en el 1er y 3er trimestre de la embarazada deben ser de al menos 11 g/dL y de al menos 10,5 g/dL durante el 2do trimestre. [96]
La deshidratación o hiperhidratación pueden influir en gran medida en los niveles de hemoglobina medidos. La albúmina puede indicar el estado de hidratación.
Si la concentración es inferior a la normal, se denomina anemia. Las anemias se clasifican según el tamaño de los glóbulos rojos, las células que contienen la hemoglobina en los vertebrados. La anemia se denomina "microcítica" si los glóbulos rojos son pequeños, "macrocítica" si son grandes y "normocítica" en caso contrario.
El hematocrito , la proporción del volumen sanguíneo ocupado por glóbulos rojos, es típicamente alrededor de tres veces la concentración de hemoglobina medida en g/dl. Por ejemplo, si la hemoglobina se mide en 17 g/dl, eso se compara con un hematocrito del 51%. [97]
Los métodos de análisis de hemoglobina en laboratorio requieren una muestra de sangre (arterial, venosa o capilar) y su análisis en un analizador hematológico y un oxímetro de CO. Además, también está disponible un nuevo método de análisis de hemoglobina (SpHb) no invasivo llamado oximetría de pulso con una precisión comparable a la de los métodos invasivos. [98]
Las concentraciones de oxi y desoxihemoglobina se pueden medir de forma continua, regional y no invasiva utilizando NIRS . [99] [100] [101] [102] [103] NIRS se puede utilizar tanto en la cabeza como en los músculos. Esta técnica se utiliza a menudo para la investigación en, por ejemplo, entrenamiento deportivo de élite, ergonomía, rehabilitación, monitorización de pacientes, investigación neonatal, monitorización funcional del cerebro, interfaz cerebro-computadora , urología (contracción de la vejiga), neurología (acoplamiento neurovascular) y más.
La masa de hemoglobina se puede medir en humanos utilizando la técnica de reinhalación de monóxido de carbono (CO) no radiactivo que se ha utilizado durante más de 100 años. Con esta técnica, se inhala un pequeño volumen de gas CO puro y se vuelve a respirar durante unos minutos. Durante la reinhalación, el CO se une a la hemoglobina presente en los glóbulos rojos. En función del aumento del CO en sangre después del período de reinhalación, se puede determinar la masa de hemoglobina mediante el principio de dilución. Aunque el gas CO en grandes volúmenes es tóxico para los humanos, el volumen de CO utilizado para evaluar los volúmenes de sangre corresponde al que se inhalaría al fumar un cigarrillo. Si bien los investigadores suelen utilizar circuitos de reinhalación hechos a medida, el Detalo Performance de Detalo Health ha automatizado el procedimiento y ha puesto la medición a disposición de un grupo más amplio de usuarios. [104]
El control a largo plazo de la concentración de azúcar en sangre se puede medir mediante la concentración de Hb A 1c . Medirla directamente requeriría muchas muestras porque los niveles de azúcar en sangre varían ampliamente a lo largo del día. La Hb A 1c es el producto de la reacción irreversible de la hemoglobina A con la glucosa. Una concentración de glucosa más alta da como resultado más Hb A 1c . Debido a que la reacción es lenta, la proporción de Hb A 1c representa el nivel de glucosa en sangre promediado durante la vida media de los glóbulos rojos, que suele ser de ~120 días. Una proporción de Hb A 1c de 6,0 % o menos muestra un buen control de la glucosa a largo plazo, mientras que los valores superiores al 7,0 % son elevados. Esta prueba es especialmente útil para los diabéticos. [c]
La máquina de resonancia magnética funcional (fMRI) utiliza la señal de la desoxihemoglobina, que es sensible a los campos magnéticos ya que es paramagnética. La medición combinada con NIRS muestra una buena correlación con la señal de oxihemoglobina y desoxihemoglobina en comparación con la señal BOLD . [105]
Usos del seguimiento atlético y del auto-seguimiento
La hemoglobina se puede rastrear de forma no invasiva, para construir un conjunto de datos individuales que rastrean los efectos de hemoconcentración y hemodilución de las actividades diarias para una mejor comprensión del rendimiento deportivo y el entrenamiento. Los atletas a menudo se preocupan por la resistencia y la intensidad del ejercicio. El sensor utiliza diodos emisores de luz que emiten luz roja e infrarroja a través del tejido a un detector de luz, que luego envía una señal a un procesador para calcular la absorción de luz por la proteína hemoglobina. [106] Este sensor es similar a un oxímetro de pulso , que consiste en un pequeño dispositivo sensor que se sujeta al dedo.
Análogos en organismos no vertebrados
En los organismos de los reinos animal y vegetal existe una variedad de proteínas transportadoras y transportadoras de oxígeno. Organismos como bacterias , protozoos y hongos tienen proteínas similares a la hemoglobina, cuyas funciones conocidas y predichas incluyen la unión reversible de ligandos gaseosos . Dado que muchas de estas proteínas contienen globinas y la fracción hemo (hierro en un soporte de porfirina plano), a menudo se las llama hemoglobinas, incluso si su estructura terciaria general es muy diferente de la de la hemoglobina de los vertebrados. En particular, la distinción entre "mioglobina" y hemoglobina en animales inferiores es a menudo imposible, porque algunos de estos organismos no contienen músculos . O pueden tener un sistema circulatorio separado reconocible pero no uno que se ocupe del transporte de oxígeno (por ejemplo, muchos insectos y otros artrópodos ). En todos estos grupos, las moléculas que contienen hemo/globina (incluso las de globina monomérica) que se ocupan de la unión de gases se denominan oxihemoglobinas. Además de ocuparse del transporte y la detección de oxígeno, también pueden ocuparse de NO, CO 2 , compuestos de sulfuro e incluso de la eliminación de O 2 en entornos que deben ser anaeróbicos. [107] Incluso pueden ocuparse de la desintoxicación de materiales clorados de una manera análoga a las enzimas P450 y peroxidasas que contienen hemo.

La estructura de las hemoglobinas varía entre las especies. La hemoglobina se encuentra en todos los reinos de organismos, pero no en todos. Las especies primitivas, como las bacterias, los protozoos, las algas y las plantas , suelen tener hemoglobinas de una sola globina. Muchos gusanos nematodos , moluscos y crustáceos contienen moléculas multisubunitarias muy grandes, mucho más grandes que las de los vertebrados. En particular, las hemoglobinas quiméricas que se encuentran en los hongos y los anélidos gigantes pueden contener tanto globina como otros tipos de proteínas. [14]
Una de las apariciones y usos más llamativos de la hemoglobina en los organismos es en el gusano tubícola gigante ( Riftia pachyptila , también llamado Vestimentifera), que puede alcanzar los 2,4 metros de longitud y puebla los respiraderos volcánicos oceánicos . En lugar de un tracto digestivo , estos gusanos contienen una población de bacterias que constituye la mitad del peso del organismo. Las bacterias oxidan el H2S del respiradero con el O2 del agua para producir energía para fabricar alimentos a partir de H2O y CO2 . El extremo superior de los gusanos es una estructura en forma de abanico de color rojo oscuro ("pluma"), que se extiende dentro del agua y absorbe H2S y O2 para las bacterias, y CO2 para su uso como materia prima sintética similar a las plantas fotosintéticas. Las estructuras son de color rojo brillante debido a su contenido de varias hemoglobinas extraordinariamente complejas que tienen hasta 144 cadenas de globina, cada una de las cuales incluye estructuras de hemo asociadas. Estas hemoglobinas son notables por su capacidad de transportar oxígeno en presencia de sulfuro, e incluso de transportar sulfuro, sin ser completamente "envenenadas" o inhibidas por él, como lo son las hemoglobinas en la mayoría de las otras especies. [108] [109]
Otras proteínas que se unen al oxígeno
- Mioglobina
- Presente en el tejido muscular de muchos vertebrados, incluidos los humanos, le da al tejido muscular un color rojo o gris oscuro característico. Es muy similar a la hemoglobina en estructura y secuencia, pero no es un tetrámero; en cambio, es un monómero que carece de unión cooperativa. Se utiliza para almacenar oxígeno en lugar de transportarlo.
- Hemocianina
- La segunda proteína transportadora de oxígeno más común que se encuentra en la naturaleza se encuentra en la sangre de muchos artrópodos y moluscos. Utiliza grupos prostéticos de cobre en lugar de grupos hemo de hierro y es de color azul cuando está oxigenada.
- Hemeritrina
- Algunos invertebrados marinos y algunas especies de anélidos utilizan esta proteína no hemo que contiene hierro para transportar oxígeno en la sangre. Tiene un color rosa/violeta cuando está oxigenada y es transparente cuando no lo está.
- Clorocruorina
- Presente en muchos anélidos, es muy similar a la eritrocruorina, pero el grupo hemo tiene una estructura muy diferente. Aparece verde cuando está desoxigenada y roja cuando está oxigenada.
- Vanabinos
- También conocidos como cromógenos de vanadio , se encuentran en la sangre de las ascidias . En un principio se planteó la hipótesis de que utilizaban el metal vanadio como grupo prostético que se une al oxígeno. Sin embargo, aunque contienen vanadio de forma preferente, aparentemente se unen poco al oxígeno y, por lo tanto, tienen otra función que no se ha dilucidado (las ascidias también contienen algo de hemoglobina). Pueden actuar como toxinas.
- Eritrocruorina
- Presente en muchos anélidos, incluidas las lombrices de tierra , es una proteína sanguínea gigante que flota libremente y que contiene muchas docenas (posiblemente cientos) de subunidades proteicas que contienen hierro y hemo unidas entre sí en un único complejo proteico con una masa molecular superior a 3,5 millones de daltons.
- Leghemoglobin
- En las plantas leguminosas, como la alfalfa o la soja, las bacterias fijadoras de nitrógeno de las raíces están protegidas del oxígeno por esta proteína fijadora de oxígeno que contiene hierro hemo. La enzima específica protegida es la nitrogenasa , que es incapaz de reducir el gas nitrógeno en presencia de oxígeno libre.
- Coboglobin
- Porfirina sintética a base de cobalto. La coboproteína parece incolora cuando está oxigenada, pero amarilla cuando está en las venas.
Presencia en células no eritroides
Algunas células no eritroides (es decir, células distintas de la línea de glóbulos rojos) contienen hemoglobina. En el cerebro, estas incluyen las neuronas dopaminérgicas A9 en la sustancia negra , los astrocitos en la corteza cerebral y el hipocampo , y en todos los oligodendrocitos maduros . [12] Se ha sugerido que la hemoglobina cerebral en estas células puede permitir el "almacenamiento de oxígeno para proporcionar un mecanismo homeostático en condiciones anóxicas, lo que es especialmente importante para las neuronas DA A9 que tienen un metabolismo elevado con un alto requerimiento de producción de energía". [12] Se ha observado además que " las neuronas dopaminérgicas A9 pueden tener un riesgo particular de degeneración anóxica ya que además de su alta actividad mitocondrial están bajo un estrés oxidativo intenso causado por la producción de peróxido de hidrógeno a través de la autooxidación y/o la desaminación mediada por monoaminooxidasa (MAO) de la dopamina y la posterior reacción del hierro ferroso accesible para generar radicales hidroxilo altamente tóxicos". [12] Esto puede explicar el riesgo de degeneración de estas células en la enfermedad de Parkinson . [12] El hierro derivado de la hemoglobina en estas células no es la causa de la oscuridad post-mortem de estas células (origen del nombre en latín, substantia nigra ), sino que se debe a la neuromelanina .
Fuera del cerebro, la hemoglobina tiene funciones no relacionadas con el transporte de oxígeno, como antioxidante y regulador del metabolismo del hierro en los macrófagos , [110] las células alveolares , [111] y las células mesangiales del riñón. [112]
En historia, arte y música
.jpg/440px-Heart_of_Steel_(Hemoglobin).jpg)
Históricamente, una asociación entre el color de la sangre y el óxido ocurre en la asociación del planeta Marte , con el dios romano de la guerra, ya que el planeta es de un rojo anaranjado, que recordaba a los antiguos a la sangre. Aunque el color del planeta se debe a los compuestos de hierro en combinación con el oxígeno en el suelo marciano, es un error común pensar que el hierro en la hemoglobina y sus óxidos le dan a la sangre su color rojo. El color se debe en realidad a la fracción de porfirina de la hemoglobina a la que está unido el hierro, no al hierro en sí, [113] aunque la ligadura y el estado redox del hierro pueden influir en las transiciones electrónicas de pi a pi* o n a pi* de la porfirina y, por lo tanto, en sus características ópticas.
El artista Julian Voss-Andreae creó una escultura llamada Corazón de acero (hemoglobina) en 2005, basada en la estructura de la proteína. La escultura fue hecha de vidrio y acero corten . La oxidación intencional de la obra de arte inicialmente brillante refleja la reacción química fundamental de la hemoglobina, la unión del oxígeno con el hierro. [114] [115]
El artista de Montreal Nicolas Baier creó Lustre (Hémoglobine) , una escultura de acero inoxidable que muestra la estructura de la molécula de hemoglobina. Se exhibe en el atrio del centro de investigación del Centro de Salud de la Universidad McGill en Montreal. La escultura mide aproximadamente 10 metros × 10 metros × 10 metros. [116] [117]
Véase también
- Carbaminohemoglobina (Hb asociada al CO 2 )
- Carboxihemoglobina (Hb asociada al CO)
- Clorofila (Mg hemo)
- Hemograma completo
- Globina delta
- Hemoglobinómetro
- Hemoproteína
- Metahemoglobina (Hb férrica o ferrihemoglobina)
- Oxihemoglobina (con oxígeno diatómico , de color rojo sangre)
- Tegillarca granosa - "almeja de sangre"
- Complejo de Vaska : complejo organometálico de iridio que destaca por su capacidad de unirse al O 2 de forma reversible.
Referencias
Notas
- ^ de la palabra griega αἷμα, haîma 'sangre' + latín glóbulo 'bola, esfera' + -in ; / ˌ h iː m ə ˈ ɡ l oʊ b ɪ n , ˈ h ɛ m oʊ ˌ -/ [1] [2]
- ^ Aunque otras fuentes pueden tener valores ligeramente diferentes, como el General Practice Notebook del Reino Unido. [95]
- ^ Este nivel de Hb A 1c sólo es útil en individuos que tienen glóbulos rojos (RBC) con supervivencias normales (es decir, vida media normal). En individuos con glóbulos rojos anormales, ya sea debido a moléculas de hemoglobina anormales (como la hemoglobina S en la anemia de células falciformes) o defectos de la membrana de los glóbulos rojos, u otros problemas, la vida media de los glóbulos rojos se acorta con frecuencia. En estos individuos, se puede utilizar una prueba alternativa llamada "nivel de fructosamina". Mide el grado de glicación (unión de glucosa) a la albúmina, la proteína sanguínea más común, y refleja los niveles promedio de glucosa en sangre durante los 18 a 21 días anteriores, que es la vida media de las moléculas de albúmina en la circulación.
Fuentes
- ^ Wells, John C. (2008). Diccionario de pronunciación Longman (3.ª ed.). Longman. ISBN 978-1-4058-8118-0.
- ^ Jones, Daniel (2011). Roach, Peter ; Setter, Jane ; Esling, John (eds.). Diccionario de pronunciación de Cambridge English (18.ª ed.). Cambridge University Press. ISBN 978-0-521-15255-6.
- ^ Maton, Anthea; Jean Hopkins; Charles William McLaughlin; Susan Johnson; Maryanna Quon Warner; David LaHart; Jill D. Wright (1993). Biología humana y salud. Englewood Cliffs, Nueva Jersey, EE. UU.: Prentice Hall. ISBN 978-0-13-981176-0.
- ^ ab Sidell, Bruce; Kristin O'Brien (2006). "Cuando a los peces buenos les pasan cosas malas: la pérdida de la expresión de hemoglobina y mioglobina en los peces de hielo antárticos". The Journal of Experimental Biology . 209 (Pt 10): 1791–802. doi :10.1242/jeb.02091. PMID 16651546. S2CID 29978182.
- ^ Weed, Robert I.; Reed, Claude F.; Berg, George (1963). "¿Es la hemoglobina un componente estructural esencial de las membranas de los eritrocitos humanos?". J Clin Invest . 42 (4): 581–88. doi :10.1172/JCI104747. PMC 289318 . PMID 13999462.
- ^ Dominguez de Villota ED, Ruiz Carmona MT, Rubio JJ, de Andrés S (1981). "Igualdad de la capacidad de unión al oxígeno in vivo e in vitro de la hemoglobina en pacientes con enfermedad respiratoria grave". Br J Anaesth . 53 (12): 1325–28. doi : 10.1093/bja/53.12.1325 . PMID 7317251. S2CID 10029560.
- ^ Rhodes, Carl E.; Denault, Deanna; Varacallo, Matthew (4 de marzo de 2019). Fisiología, transporte de oxígeno. Treasure Island (FL): StatPearls Publishing. PMID 30855920. Archivado desde el original el 27 de agosto de 2021. Consultado el 4 de mayo de 2019 a través de NCBI Bookshelf.
- ^ Costanzo, Linda S. (2007). Fisiología. Hagerstwon, MD: Lippincott Williams & Wilkins. ISBN 978-0-7817-7311-9.
- ^ Patton, Kevin T. (10 de febrero de 2015). Anatomía y fisiología. Elsevier Health Sciences. ISBN 978-0-323-31687-3Archivado desde el original el 26 de abril de 2016. Consultado el 9 de enero de 2016 .
- ^ Epstein, FH; Hsia, CCW (1998). "Función respiratoria de la hemoglobina". New England Journal of Medicine . 338 (4): 239–47. doi :10.1056/NEJM199801223380407. PMID 9435331.
- ^ Saha, D.; Reddy, KVR; Patgaonkar, M.; Ayyar, K.; Bashir, T.; Shroff, A. (2014). "Expresión de hemoglobina en células no eritroides: ¿novedosa o ubicua?". Revista internacional de inflamación . 2014 (803237): 1–8. doi : 10.1155/2014/803237 . PMC 4241286. PMID 25431740 .
- ^ abcde Biagioli M, Pinto M, Cesselli D, et al. (2009). "Expresión inesperada de alfa y beta-globina en neuronas dopaminérgicas mesencefálicas y células gliales". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 106 (36): 15454–59. Bibcode :2009PNAS..10615454B. doi : 10.1073/pnas.0813216106 . PMC 2732704 . PMID 19717439.
- ^ "Análisis de sangre". Instituto Nacional del Corazón, los Pulmones y la Sangre (NHLBI) . Archivado desde el original el 9 de abril de 2019. Consultado el 27 de abril de 2019 .
- ^ ab Weber RE, Vinogradov SN (2001). "Hemoglobinas no vertebrados: funciones y adaptaciones moleculares". Physiol. Rev. 81 ( 2): 569–628. doi :10.1152/physrev.2001.81.2.569. PMID 11274340. S2CID 10863037.
- ^ "Max Perutz, padre de la biología molecular, muere a los 87 años". The New York Times . 8 de febrero de 2002. Archivado desde el original el 23 de abril de 2016.
- ^ Engelhart, Johann Friedrich (1825). Commentatio de vera materia sanguini purpureum colorem impertientis natura (en latín). Gotinga: Dietrich. Archivado desde el original el 16 de junio de 2020 . Consultado el 16 de junio de 2020 .
- ^ "Engelhard & Rose sobre la materia colorante de la sangre". Revista Médica y Quirúrgica de Edimburgo . 27 (90): 95–102. 1827. PMC 5763191 . PMID 30330061.
- ^ Adair, Gilbert Smithson (1925). "Un estudio crítico del método directo de medición de la presión osmótica de la hemoglobina". Proc. R. Soc. Londres . 108 (750): 292–300. Código Bibliográfico :1925RSPSA.109..292A. doi : 10.1098/rspa.1925.0126 .
- ^ Parry, CH (1794). Cartas del Dr. Withering, ... Dr. Ewart, ... Dr. Thorton ... y Dr. Biggs ... junto con otros artículos, complementarios a dos publicaciones sobre asma, tisis, fiebre y otras enfermedades, por T. Beddoes. pág. 43. Archivado desde el original el 2022-01-31 . Consultado el 2021-11-30 .
- ^ Beddoes, T. (1796). Consideraciones sobre el uso medicinal y sobre la producción de aires facticios: Parte I. Por Thomas Beddoes, MD Parte II. Por James Watt, ingeniero; "Parte 1, sección 2, "De la respiración del hombre y de los animales familiares". Bulgin y Rosser. Parte 1, pág. 9-13. Archivado desde el original el 2022-01-31 . Consultado el 2021-11-30 .
- ^ Hünefeld, Friedrich Ludwig (1840). Der Chemismus in der thierischen Organization (en alemán). Leipzig: FA Brockhaus. Archivado desde el original el 14 de abril de 2021 . Consultado el 26 de febrero de 2021 .
- ^ Funke O (1851). "Über das milzvenenblut". Z Rata Med . 1 : 172–218.
- ^ "Una receta de la NASA para la cristalografía de proteínas" (PDF) . Informe educativo . Administración Nacional de Aeronáutica y del Espacio. Archivado desde el original (PDF) el 2008-04-10 . Consultado el 2008-10-12 .
- ^ Hoppe-Seyler F (1866). "Über die oxidation in lebendem blute". Laboratorio médico-químico Untersuch . 1 : 133–40.
- ^ ab Stoddart, Charlotte (1 de marzo de 2022). "Biología estructural: cómo las proteínas consiguieron su primer plano". Revista Knowable . doi : 10.1146/knowable-022822-1 . Consultado el 25 de marzo de 2022 .
- ^ Perutz, MF; Rossmann, MG; Cullis, AF; Muirhead, H.; Will, G.; North, ACT (1960). "Estructura de la hemoglobina: una síntesis de Fourier tridimensional con una resolución de 5,5 Å, obtenida mediante análisis de rayos X". Nature . 185 (4711): 416–22. Bibcode :1960Natur.185..416P. doi :10.1038/185416a0. PMID 18990801. S2CID 4208282.
- ^ Perutz MF (1960). "Estructura de la hemoglobina". Simposios de Brookhaven sobre biología . 13 : 165–83. PMID 13734651.
- ^ de Chadarevian, Soraya (junio de 2018). "John Kendrew y la mioglobina: determinación de la estructura de las proteínas en la década de 1950: John Kendrew y la mioglobina". Protein Science . 27 (6): 1136–1143. doi :10.1002/pro.3417. PMC 5980623 . PMID 29607556.
- ^ Nishi, Hiroshi; Inagi, Reiko; Kato, Hideki; Tanemoto, Masayuki; Kojima, Ichiro; Hijo, Daisuke; Fujita, Toshiro; Nangaku, Masaomi (agosto de 2008). "La hemoglobina se expresa en células mesangiales y reduce el estrés oxidativo". Revista de la Sociedad Estadounidense de Nefrología . 19 (8): 1500-1508. doi :10.1681/ASN.2007101085. ISSN 1046-6673. PMC 2488266 . PMID 18448584.
- ^ ab Hardison, Ross C. (1 de diciembre de 2012). "Evolución de la hemoglobina y sus genes". Cold Spring Harbor Perspectives in Medicine . 2 (12): a011627. doi :10.1101/cshperspect.a011627. ISSN 2157-1422. PMC 3543078 . PMID 23209182.
- ^ Offner, Susan (1 de abril de 2010). "Uso de las bases de datos genómicas del NCBI para comparar los genes de la hemoglobina beta humana y de chimpancé". The American Biology Teacher . 72 (4): 252–56. doi :10.1525/abt.2010.72.4.10. ISSN 0002-7685. S2CID 84499907. Archivado desde el original el 26 de diciembre de 2019 . Consultado el 26 de diciembre de 2019 .
- ^ "HBB – Subunidad beta de la hemoglobina – Pan paniscus (chimpancé pigmeo) – Gen y proteína HBB". uniprot.org . Archivado desde el original el 2020-08-01 . Consultado el 2020-03-10 .
- ^ "HBA1 – Subunidad alfa de la hemoglobina – Pan troglodytes (Chimpancé) – Gen y proteína HBA1". uniprot.org . Archivado desde el original el 2020-08-01 . Consultado el 2020-03-10 .
- ^ ab Huisman THJ (1996). "Un programa de estudios sobre variantes de la hemoglobina humana". Globin Gene Server . Universidad Estatal de Pensilvania. Archivado desde el original el 2008-12-11 . Consultado el 2008-10-12 .
- ^ Variantes de hemoglobina Archivado el 5 de noviembre de 2006 en Wayback Machine . Labtestsonline.org. Consultado el 5 de septiembre de 2013.
- ^ Uthman, Ed. "Hemoglobinopatías y talasemias". Archivado desde el original el 15 de diciembre de 2007. Consultado el 26 de diciembre de 2007 .
- ^ Reed, Leslie. "Adaptación encontrada en genes de ratones". Omaha World-Herald , 11 de agosto de 2009: EBSCO. [ página necesaria ]
- ^ "Los mamuts tenían sangre 'anticongelante'". BBC. 2 de mayo de 2010. Archivado desde el original el 4 de mayo de 2010. Consultado el 2 de mayo de 2010 .
- ^ Projecto-García, Joana; Natarajan, Chandrasekhar; Moriyama, Hideaki; Weber, Roy E.; Fago, Angela; Cheviron, Zachary A.; Dudley, Robert; McGuire, Jimmy A.; Witt, Christopher C. (17 de diciembre de 2013). "Transiciones elevacionales repetidas en la función de la hemoglobina durante la evolución de los colibríes andinos". Actas de la Academia Nacional de Ciencias . 110 (51): 20669–74. Bibcode :2013PNAS..11020669P. doi : 10.1073/pnas.1315456110 . ISSN 0027-8424. PMC 3870697 . PMID 24297909.
- ^ Beall, Cynthia M.; Song, Kijoung; Elston, Robert C.; Goldstein, Melvyn C. (28 de septiembre de 2004). "Mayor supervivencia de la descendencia entre mujeres tibetanas con genotipos de alta saturación de oxígeno que residen a 4000 m". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 101 (39): 14300–04. Bibcode :2004PNAS..10114300B. doi : 10.1073/pnas.0405949101 . ISSN 0027-8424. PMC 521103 . PMID 15353580.
- ^ "Síntesis de hemoglobina". 14 de abril de 2002. Archivado desde el original el 26 de diciembre de 2007. Consultado el 26 de diciembre de 2007 .
- ^ Burka, Edward (1969). "Características de la degradación del ARN en la célula eritroide". The Journal of Clinical Investigation . 48 (7): 1266–72. doi : 10.1172/jci106092 . PMC 322349 . PMID 5794250.
- ^ ab Van Kessel, Hans (2002). "Proteínas: poliamidas naturales". Nelson Chemistry 12. Toronto: Thomson. pág. 122. ISBN 978-0-17-625986-0.
- ^ "Tutorial sobre hemoglobina". Archivado el 26 de noviembre de 2009 en Wayback Machine. Universidad de Massachusetts Amherst. Web. 23 de octubre de 2009.
- ^ Steinberg, MH (2001). Trastornos de la hemoglobina: genética, fisiopatología y tratamiento clínico. Cambridge University Press. pág. 95. ISBN 978-0-521-63266-9Archivado desde el original el 17 de noviembre de 2016. Consultado el 18 de febrero de 2016 .
- ^ Hardison, RC (1996). "Una breve historia de las hemoglobinas: plantas, animales, protistas y bacterias". Proc Natl Acad Sci USA . 93 (12): 5675–79. Bibcode :1996PNAS...93.5675H. doi : 10.1073/pnas.93.12.5675 . PMC 39118 . PMID 8650150.
- ^ "Hemoglobina". Archivado el 13 de noviembre de 2009 en la Wayback Machine. Facultad de Química – Universidad de Bristol – Reino Unido. Web. 12 de octubre de 2009.
- ^ WikiPremed > Química de coordinación Archivado el 23 de agosto de 2009 en Wayback Machine . Consultado el 2 de julio de 2009.
- ^ Biología básica (2015). «Células sanguíneas». Archivado desde el original el 18 de julio de 2021. Consultado el 27 de marzo de 2020 .
- ^ Linberg R, Conover CD, Shum KL, Shorr RG (1998). "Transportadores de oxígeno basados en hemoglobina: ¿cuánta metahemoglobina es demasiada?". Artif Cells Blood Substit Immobil Biotechnol . 26 (2): 133–48. doi : 10.3109/10731199809119772 . PMID 9564432.
- ^ Hemoglobina Archivado el 15 de marzo de 2017 en Wayback Machine . Worthington-biochem.com. Consultado el 5 de septiembre de 2013.
- ^ Van Beekvelt MC, Colier WN, Wevers RA, Van Engelen BG (2001). "Rendimiento de la espectroscopia de infrarrojo cercano en la medición del consumo local de O2 y el flujo sanguíneo en el músculo esquelético". J Appl Physiol . 90 (2): 511–19. doi :10.1152/jappl.2001.90.2.511. PMID 11160049. S2CID 15468862.
- ^ ab "Hemoglobina". Archivado el 24 de enero de 2012 en Wayback Machine. MedicineNet. Web. 12 de octubre de 2009.
- ^ "Hemoglobin Home". Archivado el 1 de diciembre de 2009 en Wayback Machine. Biology @ Davidson. Web. 12 de octubre de 2009.
- ^ "Gráfico de saturación de hemoglobina". altitude.org. Archivado desde el original el 2010-08-31 . Consultado el 2010-07-06 .
- ^ King, Michael W. "La página de bioquímica médica: hemoglobina". Archivado desde el original el 4 de marzo de 2012. Consultado el 20 de marzo de 2012 .
- ^ Voet, D. (2008) Fundamentos de bioquímica , 3.ª ed., Fig. 07_06, John Wiley & Sons. ISBN 0470129301
- ^ Shikama K (2006). "Naturaleza del enlace FeO2 en la mioglobina y la hemoglobina: un nuevo paradigma molecular". Prog Biophys Mol Biol . 91 (1–2): 83–162. doi : 10.1016/j.pbiomolbio.2005.04.001 . PMID 16005052.
- ^ Ahrens; Kimberley, Basham (1993). Fundamentos de la oxigenación: implicaciones para la práctica clínica . Jones & Bartlett Learning. pág. 194. ISBN 978-0-86720-332-5.
- ^ Ogawa, S; Menon, RS; Tank, DW; Kim, SG; Merkle, H; Ellermann, JM; Ugurbil, K (1993). "Mapeo funcional del cerebro mediante resonancia magnética de contraste dependiente del nivel de oxigenación sanguínea. Una comparación de las características de la señal con un modelo biofísico". Revista Biofísica . 64 (3): 803–12. Código Bibliográfico :1993BpJ....64..803O. doi :10.1016/S0006-3495(93)81441-3. PMC 1262394 . PMID 8386018.
- ^ ab Bren KL, Eisenberg R, Gray HB (2015). "Descubrimiento del comportamiento magnético de la hemoglobina: un comienzo de la química bioinorgánica". Proc Natl Acad Sci USA . 112 (43): 13123–27. Bibcode :2015PNAS..11213123B. doi : 10.1073/pnas.1515704112 . PMC 4629386 . PMID 26508205.
- ^ ab Goodman, Morris; Moore, G. William; Matsuda, Genji (20 de febrero de 1975). "Evolución darwiniana en la genealogía de la hemoglobina". Nature . 253 (5493): 603–08. Bibcode :1975Natur.253..603G. doi :10.1038/253603a0. PMID 1089897. S2CID 2979887.
- ^ abc Storz, Jay F.; Opazo, Juan C.; Hoffmann, Federico G. (1 de febrero de 2013). "Duplicación génica, duplicación genómica y diversificación funcional de globinas de vertebrados". Filogenética molecular y evolución . 66 (2): 469–78. Bibcode :2013MolPE..66..469S. doi :10.1016/j.ympev.2012.07.013. ISSN 1095-9513. PMC 4306229 . PMID 22846683.
- ^ ab Pillai, Arvind S.; Chandler, Shane A.; Liu, Yang; Signore, Anthony V.; Cortez-Romero, Carlos R.; Benesch, Justin LP; Laganowsky, Arthur; Storz, Jay F.; Hochberg, Georg KA; Thornton, Joseph W. (mayo de 2020). "Origen de la complejidad en la evolución de la hemoglobina". Nature . 581 (7809): 480–85. Bibcode :2020Natur.581..480P. doi :10.1038/s41586-020-2292-y. ISSN 1476-4687. PMC 8259614 . PMID 32461643. S2CID 218761566.
- ^ Zimmer EA, Martin SL, Beverley SM, Kan YW, Wilson AC (1980-04-01). "Duplicación rápida y pérdida de genes que codifican las cadenas alfa de la hemoglobina". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 77 (4): 2158–62. Bibcode :1980PNAS...77.2158Z. doi : 10.1073/pnas.77.4.2158 . ISSN 0027-8424. PMC 348671 . PMID 6929543.
- ^ Mihailescu, Mihaela-Rita; Russu, Irina M. (27 de marzo de 2001). "Una firma de la transición T → R en la hemoglobina humana". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 98 (7): 3773–77. Bibcode :2001PNAS...98.3773M. doi : 10.1073/pnas.071493598 . ISSN 0027-8424. PMC 31128 . PMID 11259676.
- ^ Chou KC (1989). "Resonancia de baja frecuencia y cooperatividad de la hemoglobina". Trends Biochem. Sci . 14 (6): 212–13. doi :10.1016/0968-0004(89)90026-1. PMID 2763333.
- ^ Jensen, Frank B (2009). "El doble papel de los glóbulos rojos en el suministro de oxígeno a los tejidos: transportadores de oxígeno y reguladores del flujo sanguíneo local". Journal of Experimental Biology . 212 (Pt 21): 3387–93. doi :10.1242/jeb.023697. PMID 19837879. S2CID 906177.
- ^ Hall, John E. (2010). Guyton and Hall textbook of medical physiology (12.ª ed.). Filadelfia, Pensilvania: Saunders/Elsevier. pág. 502. ISBN 978-1-4160-4574-8.
- ^ Rhodes, Carl E.; Denault, Deanna; Varacallo, Matthew (4 de marzo de 2019). Fisiología, transporte de oxígeno. Treasure Island (FL): StatPearls Publishing. PMID 30855920. Archivado desde el original el 27 de agosto de 2021. Consultado el 4 de mayo de 2019 a través de NCBI Bookshelf.
Es importante señalar que, en el contexto de la carboxihemoglobinemia, no es una reducción en la capacidad de transporte de oxígeno lo que causa la patología, sino una entrega deficiente de oxígeno ligado a los tejidos objetivo.
- ^ Nelson, DL; Cox, MM (2000). Principios de bioquímica de Lehninger , 3.ª ed. Nueva York: Worth Publishers. pág. 217, ISBN 1572599316 .
- ^ Guyton, Arthur C.; John E. Hall (2006). Libro de texto de fisiología médica (11.ª ed.). Filadelfia: Elsevier Saunders. pág. 511. ISBN 978-0-7216-0240-0.
- ^ Conferencia – 12 Mioglobina y hemoglobina en YouTube
- ^ Bioquímica (octava edición). Nueva York: WH Freeman. 2015. ISBN 978-1-4641-2610-9.[ página necesaria ]
- ^ Rutjes, HA; Nieveen, MC; Weber, RE; Witte, F.; Van den Thillart, GEEJM (20 de junio de 2007). "Las múltiples estrategias de los cíclidos del lago Victoria para hacer frente a la hipoxia de por vida incluyen el cambio de hemoglobina". AJP: Fisiología reguladora, integradora y comparativa . 293 (3): R1376–83. doi :10.1152/ajpregu.00536.2006. PMID 17626121.
- ^ Gronenborn, Angela M.; Clore, G. Marius; Brunori, Maurizio; Giardina, Bruno; Falcioni, Giancarlo; Perutz, Max F. (1984). "Estereoquímica del ATP y el GTP unidos a las hemoglobinas de los peces". Journal of Molecular Biology . 178 (3): 731–42. doi :10.1016/0022-2836(84)90249-3. PMID 6492161.
- ^ Weber, Roy E.; Frank B. Jensen (1988). "Adaptaciones funcionales en hemoglobinas de vertebrados ectotérmicos". Revista Anual de Fisiología . 50 : 161–79. doi :10.1146/annurev.ph.50.030188.001113. PMID 3288089.
- ^ Rang, HP; Dale, MM; Ritter, JM; Moore, PK (2003). Farmacología, quinta edición . Elsevier. ISBN 978-0-443-07202-4.[ página necesaria ]
- ^ "Variantes de hemoglobina". Pruebas de laboratorio en línea . Asociación Estadounidense de Química Clínica. 10 de noviembre de 2007. Archivado desde el original el 20 de septiembre de 2008. Consultado el 12 de octubre de 2008 .
- ^ Kikuchi, G.; Yoshida, T.; Noguchi, M. (2005). "Heme oxygenase and heme reduction". Comunicaciones de investigación bioquímica y biofísica . 338 (1): 558–67. doi :10.1016/j.bbrc.2005.08.020. PMID 16115609.
- ^ Coomes, Marguerite W. (2011). "Metabolismo de los aminoácidos y del hemo". En Devlin, Thomas M. (ed.). Textbook of Biochemistry: With Clinical Correlations (7.ª ed.). Hoboken, NJ: John Wiley & Sons. pág. 797. ISBN 978-0-470-28173-4.
- ^ "hemoglobinopatía" en el Diccionario médico de Dorland
- ^ hipoxemia Archivado el 2 de febrero de 2009 en Wayback Machine . Encyclopædia Britannica , que indica hipoxemia (tensión reducida de oxígeno en la sangre) .
- ^ Biology-Online.org --> Diccionario » H » Hipoxemia Archivado el 21 de noviembre de 2009 en Wayback Machine. Última modificación el 29 de diciembre de 2008.
- ^ William, C. Wilson; Grande, Christopher M.; Hoyt, David B. (2007). "Fisiopatología de la insuficiencia respiratoria aguda". Trauma, Volumen II: Cuidados críticos . Taylor & Francis. pág. 430. ISBN 978-1-4200-1684-0Archivado desde el original el 17 de noviembre de 2016. Consultado el 18 de febrero de 2016 .
- ^ McGaffigan, PA (1996). "Riesgos de la hipoxemia: cómo proteger a su paciente de los niveles bajos de oxígeno". Enfermería . 26 (5): 41–46, cuestionario 46. doi : 10.1097/00152193-199626050-00013 . PMID 8710285.
- ^ "NGSP: HbA1c y eAG". ngsp.org . Archivado desde el original el 15 de octubre de 2015 . Consultado el 28 de octubre de 2015 .
- ^ "Definición de hemoglobina glucosilada". Archivado el 23 de enero de 2014 en Wayback Machine. Medicine Net. Web. 12 de octubre de 2009.
- ^ Madsen, H; Ditzel, J (1984). "Transporte de oxígeno en sangre en el primer trimestre del embarazo diabético". Acta Obstetricia et Gynecologica Scandinavica . 63 (4): 317–20. doi :10.3109/00016348409155523. PMID 6741458. S2CID 12771673.
- ^ Hemoglobina Archivado el 10 de junio de 2016 en Wayback Machine en Medline Plus
- ^ Padmanaban, P.; Toora, B. (2011). "Hemoglobina: marcador emergente en la enfermedad coronaria estable". Crónicas de jóvenes científicos . 2 (2): 109. doi : 10.4103/2229-5186.82971 .
- ^ Sociedad para la Investigación Biomédica de la Diabetes. Calculadora de conversión de unidades del SI Archivado el 9 de marzo de 2013 en Wayback Machine .
- ^ Handin, Robert I.; Lux, Samuel E. y StosselBlood, Thomas P. (2003). Sangre: principios y práctica de la hematología . Lippincott Williams & Wilkins, ISBN 0781719933
- ^ "Prueba del nivel de hemoglobina". Ibdcrohns.about.com . 2013-08-16. Archivado desde el original el 2007-01-29 . Consultado el 2013-09-05 .
- ^ "hemoglobina (rango de referencia)". Cuaderno de Medicina General . Archivado desde el original el 25 de septiembre de 2009.
- ^ Murray SS y McKinney ES (2006). Fundamentos de enfermería materno-neonatal . 4.ª ed., pág. 919. Filadelfia: Saunders Elsevier. ISBN 1416001417 .
- ^ "Hematocrito (HCT) o volumen corpuscular (PCV)". DoctorsLounge.com. Archivado desde el original el 2008-01-02 . Consultado el 2007-12-26 .
- ^ Frasca, D.; Dahyot-Fizelier, C.; Catherine, K.; Levrat, Q.; Debaene, B.; Mimoz, O. (2011). "Precisión de un monitor continuo no invasivo de hemoglobina en pacientes de la unidad de cuidados intensivos*". Medicina de cuidados críticos . 39 (10): 2277–82. doi :10.1097/CCM.0b013e3182227e2d. PMID 21666449. S2CID 205541592.
- ^ Ferrari, M.; Binzoni, T.; Quaresima, V. (1997). "Metabolismo oxidativo en el músculo". Philosophical Transactions of the Royal Society B: Biological Sciences . 352 (1354): 677–83. Bibcode :1997RSPTB.352..677F. doi :10.1098/rstb.1997.0049. PMC 1691965 . PMID 9232855.
- ^ Madsen, PL; Secher, NH (1999). "Oximetría del cerebro en el infrarrojo cercano". Progreso en neurobiología . 58 (6): 541–60. doi :10.1016/S0301-0082(98)00093-8. PMID 10408656. S2CID 1092056.
- ^ McCully, KK; Hamaoka, T. (2000). "Espectroscopia de infrarrojo cercano: ¿Qué nos puede decir sobre la saturación de oxígeno en el músculo esquelético?". Reseñas de ciencias del deporte y el ejercicio . 28 (3): 123–27. PMID 10916704.
- ^ Perrey, SP (2008). "Espectroscopia NIR no invasiva de la función cerebral humana durante el ejercicio". Métodos . 45 (4): 289–99. doi :10.1016/j.ymeth.2008.04.005. PMID 18539160.
- ^ Rolfe, P. (2000). "Espectroscopia infrarroja invivoneal". Revisión anual de ingeniería biomédica . 2 : 715–54. doi :10.1146/annurev.bioeng.2.1.715. PMID 11701529.
- ^ Siebenmann, Christoph; Keiser, Stefanie; Robach, Paul; Lundby, Carsten (29 de junio de 2017). "CORP: La evaluación de la masa total de hemoglobina mediante la reinhalación de monóxido de carbono". Revista de fisiología aplicada . 123 (3): 645–654. doi : 10.1152/japplphysiol.00185.2017 . ISSN 8750-7587. PMID 28663373.
- ^ Mehagnoul-Schipper DJ, van der Kallen BF, Colier WN, van der Sluijs MC, van Erning LJ, Thijssen HO, Oeseburg B, Hoefnagels WH, Jansen RW (2002). "Medidas simultáneas de los cambios en la oxigenación cerebral durante la activación cerebral mediante espectroscopia de infrarrojo cercano e imágenes por resonancia magnética funcional en sujetos sanos jóvenes y mayores". Hum Brain Mapp . 16 (1): 14–23. doi :10.1002/hbm.10026. PMC 6871837 . PMID 11870923.
- ^ "Cercacor: cómo funciona la tecnología de hemoglobina no invasiva de Ember". technology.cercacor.com . Archivado desde el original el 2016-11-04 . Consultado el 2016-11-03 .
- ^ L. Int Panis; B. Goddeeris; R Verheyen (1995). "La concentración de hemoglobina de larvas de Chironomus cf. Plumosus L. (Diptera: Chironomidae) de dos hábitats lénticos". Netherlands Journal of Aquatic Ecology . 29 (1): 1–4. Bibcode :1995NJAqE..29....1P. doi :10.1007/BF02061785. S2CID 34214741. Archivado desde el original el 2018-09-05 . Consultado el 2013-11-10 .
- ^ Zal F, Lallier FH, Green BN, Vinogradov SN, Toulmond A (1996). "El sistema multihemoglobina del gusano tubular de los respiraderos hidrotermales Riftia pachyptila. II. Composición completa de la cadena polipeptídica investigada mediante análisis de máxima entropía de espectros de masas". J. Biol. Chem . 271 (15): 8875–81. doi : 10.1074/jbc.271.15.8875 . PMID 8621529.
- ^ Minic Z, Hervé G (2004). "Aspectos bioquímicos y enzimológicos de la simbiosis entre el gusano tubícola de aguas profundas Riftia pachyptila y su endosimbionte bacteriano". Eur. J. Biochem . 271 (15): 3093–102. doi : 10.1111/j.1432-1033.2004.04248.x . PMID 15265029.
- ^ Liu L, Zeng M, Stamler JS (1999). "Inducción de hemoglobina en macrófagos de ratón". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 96 (12): 6643–47. Bibcode :1999PNAS...96.6643L. doi : 10.1073/pnas.96.12.6643 . PMC 21968 . PMID 10359765.
- ^ Newton DA, Rao KM, Dluhy RA, Baatz JE (2006). "La hemoglobina se expresa en las células epiteliales alveolares". Revista de química biológica . 281 (9): 5668–76. doi : 10.1074/jbc.M509314200 . PMID 16407281.
- ^ Nishi, H.; Inagi, R.; Kato, H.; Tanemoto, M.; Kojima, I.; Son, D.; Fujita, T.; Nangaku, M. (2008). "La hemoglobina se expresa en las células mesangiales y reduce el estrés oxidativo". Revista de la Sociedad Americana de Nefrología . 19 (8): 1500–08. doi :10.1681/ASN.2007101085. PMC 2488266 . PMID 18448584.
- ^ Boh, Larry (2001). Manual de práctica farmacéutica: una guía para la experiencia clínica. Lippincott Williams & Wilkins. ISBN 978-0-7817-2541-5.
- ^ Holden, Constance (2005). "Sangre y acero". Science . 309 (5744): 2160. doi :10.1126/science.309.5744.2160d. S2CID 190178048.
- ^ Moran L, Horton RA, Scrimgeour G, Perry M (2011). Principios de bioquímica . Boston, MA: Pearson. pág. 127. ISBN. 978-0-321-70733-8.
- ^ Henry, Sean (7 de agosto de 2014). "Eche un vistazo a la colección de arte del MUHC". CBC News. Archivado desde el original el 5 de febrero de 2016. Consultado el 1 de febrero de 2016 .
- ^ "Lustre (Hémoglobine) 2014". Art Public Montréal . Montreal. Archivado desde el original el 1 de febrero de 2016 . Consultado el 1 de febrero de 2016 .
Lectura adicional
- Campbell, MK (1999). Bioquímica (tercera edición). Harcourt. ISBN 978-0-03-024426-1.
- Eshaghian, S; Horwich, TB; Fonarow, GC (2006). "Una relación inversa inesperada entre los niveles de HbA1c y la mortalidad en pacientes con diabetes e insuficiencia cardíaca sistólica avanzada". Am Heart J . 151 (1): 91.e1–91.e6. doi :10.1016/j.ahj.2005.10.008. PMID 16368297.
- Ganong, WF (2003). Revista de fisiología médica (21.ª edición). Lange. ISBN 978-0-07-140236-1.
- Hager, T (1995). La fuerza de la naturaleza: la vida de Linus Pauling. Simon and Schuster. ISBN 978-0-684-80909-0.
- Hazelwood, Loren (2001) No puedo vivir sin ella: La historia de la hemoglobina en la enfermedad y en la salud , Nova Science Publishers ISBN 1-56072-907-4
- Kneipp J, Balakrishnan G, Chen R, Shen TJ, Sahu SC, Ho NT, Giovannelli JL, Simplaceanu V, Ho C, Spiro T (2005). "Dinámica de la alosteria en la hemoglobina: funciones de los penúltimos enlaces tirosina H". J Mol Biol . 356 (2): 335–53. doi :10.1016/j.jmb.2005.11.006. PMID 16368110.
- Hardison, Ross C. (2012). "Evolución de la hemoglobina y sus genes". Cold Spring Harbor Perspectives in Medicine . 2 (12): a011627. doi :10.1101/cshperspect.a011627. ISSN 2157-1422. PMC 3543078 . PMID 23209182.
Enlaces externos
- Proteopedia Hemoglobin
- Consejo Nacional de Acción contra la Anemia en anemia.org
- Un nuevo tipo de hemoglobina provoca un diagnóstico simulado con oxímetros de pulso Archivado el 9 de marzo de 2016 en Wayback Machine en www.life-of-science.net Archivado el 7 de marzo de 2017 en Wayback Machine
- Animación de la hemoglobina: de la forma desoxi a la forma oxi en vimeo.com


