Inositol
 | |
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC mio -inositol | |
| Nombre sistemático de la IUPAC ( 1R ,2S , 3r , 4R , 5S , 6s ) -Ciclohexano-1,2,3,4,5,6-hexol | |
| Otros nombres cis -1,2,3,5- trans -4,6-Ciclohexanohexol Ciclohexanohexol Factor antialopecia de ratón Nucite Faseomanita Faseomanitol Factor antiojos de rata Escilita (para el isómero escilo -inositol) Vitamina B 8 | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| EBICh | |
| Química biológica | |
| Araña química | |
| Tarjeta informativa de la ECHA | 100.027.295 |
| |
| BARRIL | |
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C6H12O6 | |
| Masa molar | 180,16 g/mol |
| Densidad | 1,752 g/ cm3 |
| Punto de fusión | 225 a 227 °C (437 a 441 °F; 498 a 500 K) |
| Termoquímica [2] | |
Entalpía estándar de formación (Δ f H ⦵ 298 ) | −1329,3 kJ/mol |
Entalpía estándar de combustión (Δ c H ⦵ 298 ) | -2747 kJ/mol |
| Farmacología | |
| A11HA07 ( OMS ) | |
| Peligros | |
| NFPA 704 (rombo cortafuegos) | |
| punto de inflamabilidad | 143 °C (289 °F; 416 K) |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
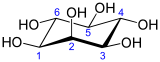
En bioquímica , medicina y ciencias relacionadas, el término inositol se refiere generalmente al mioinositol ( anteriormente mesoinositol ), el estereoisómero más importante del compuesto químico ciclohexano-1,2,3,4,5,6-hexol . Su fórmula es C6H12O6 ; la molécula tiene un anillo de seis átomos de carbono , cada uno con un átomo de hidrógeno y un grupo hidroxilo (–OH). En el mioinositol , dos de los hidroxilos, ni adyacentes ni opuestos, se encuentran por encima de los respectivos hidrógenos en relación con el plano medio del anillo.
El compuesto es un carbohidrato , específicamente un alcohol de azúcar (a diferencia de las aldosas como la glucosa ) con la mitad de dulzura que la sacarosa (azúcar de mesa). Es uno de los componentes más antiguos de los seres vivos con múltiples funciones en eucariotas, incluidos lípidos estructurales y mensajeros secundarios . [3] Un riñón humano produce alrededor de dos gramos por día de glucosa , pero otros tejidos también la sintetizan. La concentración más alta está en el cerebro, donde juega un papel importante en la unión de otros neurotransmisores y algunas hormonas esteroides a sus receptores. [4] En otros tejidos, media la transducción de señales celulares en respuesta a una variedad de hormonas , neurotransmisores y factores de crecimiento y participa en la osmorregulación . [5] En la mayoría de las células de mamíferos, las concentraciones de mioinositol son de 5 a 500 veces mayores dentro de las células que fuera de ellas. [6]
Un metanálisis de 2023 concluyó que el inositol es un tratamiento seguro y eficaz para el tratamiento del síndrome de ovario poliquístico (SOP). [7] Sin embargo, solo hay evidencia de muy baja calidad sobre su eficacia para aumentar la fertilidad en mujeres con SOP mediante FIV. [8]
Los otros estereoisómeros naturales del ciclohexano-1,2,3,4,5,6-hexol son escilo , muco , D - quiro , L - quiro y neo -inositol , aunque se encuentran en cantidades mínimas en comparación con el mio -inositol. Los otros isómeros posibles son alo , epi y cis -inositol .
Historia
El mio -inositol fue aislado por primera vez de extractos musculares por Johanes Joseph Scherer (1814-1869) en 1850. [3] Anteriormente se lo llamaba meso -inositol para distinguirlo de los isómeros quiro- . Sin embargo, dado que todos los demás isómeros son compuestos meso (no quirales ), ahora se prefiere el nombre mio -inositol ( myo- es un prefijo médico para "músculo").
El inositol alguna vez fue considerado un miembro del complejo de vitamina B , es decir, la vitamina B8 antes de que se descubriera que se produce naturalmente en el cuerpo humano y, por lo tanto, no puede ser una vitamina o un nutriente esencial . [9]
Propiedades químicas
El mio -inositol es un compuesto meso , lo que significa que es ópticamente inactivo porque tiene un plano de simetría . [10] Es un polvo cristalino blanco, relativamente estable en el aire. Es muy soluble en agua, ligeramente soluble en ácido acético glacial , etanol , glicol y glicerina , pero insoluble en cloroformo y éter . [3]
En su conformación más estable , el isómero myo -inositol asume la conformación de silla , que mueve el número máximo de hidroxilos a la posición ecuatorial, donde están más separados entre sí. En esta conformación, el isómero myo natural tiene una estructura en la que cinco de los seis hidroxilos (el primero, tercero, cuarto, quinto y sexto) son ecuatoriales , mientras que el segundo grupo hidroxilo es axial . [11]
Funciones fisiológicas
El mio -inositol desempeña un papel importante como base estructural de varios mensajeros secundarios en las células eucariotas , los diversos fosfatos de inositol . Además, el inositol sirve como un componente importante de los lípidos estructurales fosfatidilinositol (PI) y sus diversos fosfatos, los lípidos fosfatidilinositol fosfato (PIP).
Biosíntesis
En los seres humanos, el mioinositol se sintetiza de novo, pero el D - quiroinositol no. [6] El mioinositol se sintetiza a partir de glucosa 6-fosfato (G6P) en dos pasos. Primero, la G6P es isomerizada por una enzima inositol-3-fosfato sintasa (por ejemplo, ISYNA1) a mioinositol 1-fosfato, que luego es desfosforilado por una enzima inositol monofosfatasa (por ejemplo, IMPA1 ) para dar mioinositol libre . En los seres humanos, la mayor parte del inositol se sintetiza en los riñones, seguido de los testículos, típicamente en cantidades de unos pocos gramos por día. [5]
A nivel periférico, el mio -inositol se convierte en D - quiro -inositol por una epimerasa específica. Sólo una fracción menor del mio -inositol se convierte en D - quiro- inositol . [6] La actividad de esta epimerasa es dependiente de la insulina, lo que provoca una reducción del D - quiro -inositol en el músculo, la grasa y el hígado cuando hay resistencia a la insulina . [12] [6] El D - quiro -inositol reduce la conversión de testosterona a estrógeno, por lo que aumenta los niveles de testosterona y empeora el SOP. [6]
Ácido fítico en las plantas
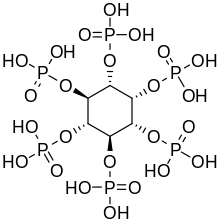
El hexafosfato de inositol, también llamado ácido fítico o IP6, es un fitoquímico y la principal forma de almacenamiento de fósforo en muchos tejidos vegetales , especialmente el salvado y las semillas . [13] El fósforo y el inositol en forma de fitato generalmente no son biodisponibles para los animales no rumiantes porque estos animales carecen de la enzima digestiva fitasa requerida para eliminar los grupos fosfato. Los rumiantes digieren fácilmente el fitato debido a la fitasa producida por microorganismos en el rumen . [14] Además, el ácido fítico también quela minerales importantes como calcio , magnesio , hierro y zinc , haciéndolos inabsorbibles y contribuyendo a las deficiencias minerales en personas cuyas dietas dependen en gran medida del salvado y las semillas para su ingesta mineral, como ocurre en los países en desarrollo . [15] [16]
El penta- (IP5), tetra- (IP4) y trifosfato (IP3) de inositol también se denominan "fitatos".
El inositol o sus fosfatos y lípidos asociados se encuentran en muchos alimentos, en particular frutas, especialmente melón y naranjas . [17] En las plantas, el hexafosfato de inositol, ácido fítico o sus sales, los fitatos, sirven como reservas de fosfato en las semillas, por ejemplo en nueces y frijoles. [18] El ácido fítico también se encuentra en cereales con alto contenido de salvado . Sin embargo, el fitato no está directamente biodisponible para los humanos en la dieta, ya que no es digerible. Algunas técnicas de preparación de alimentos descomponen parcialmente los fitatos para cambiar esto. Sin embargo, el inositol en forma de fosfolípidos , como se encuentra en ciertas sustancias derivadas de plantas como las lecitinas , se absorbe bien y es relativamente biodisponible.
Función biológica
El inositol, el fosfatidilinositol y algunos de sus monofosfatos y polifosfatos funcionan como mensajeros secundarios en diversas vías de transducción de señales intracelulares . Intervienen en diversos procesos biológicos, entre ellos:
- Transducción de señales de insulina [19]
- Ensamblaje del citoesqueleto
- Guía nerviosa ( epsina )
- Control de la concentración intracelular de calcio (Ca 2+ ) [20]
- Mantenimiento del potencial de membrana celular [21]
- Descomposición de grasas [22]
- Expresión genética [23] [24]
En una importante familia de vías, el fosfatidilinositol 4,5-bisfosfato (PIP 2 ) se almacena en las membranas celulares hasta que es liberado por alguna de varias proteínas de señalización y se transforma en varios mensajeros secundarios, por ejemplo, diacilglicerol y trifosfato de inositol . [25]
' El mio -inositol tiene una toxicidad muy baja, con una DL50 informada de 10 000 mg/kg de peso corporal (oral) en ratas. [3]
Usos industriales
Industria de explosivos
En la reunión de la Sociedad Química Americana de 1936 , el profesor Edward Bartow de la Universidad de Iowa presentó un método comercialmente viable para extraer grandes cantidades de inositol del ácido fítico presente de forma natural en los desechos de maíz. Como posible uso para el producto químico, sugirió el "nitrato de inositol" como una alternativa más estable a la nitroglicerina . [26] Hoy en día, el nitrato de inositol se utiliza para gelatinizar la nitrocelulosa en muchos explosivos modernos y propulsores sólidos para cohetes. [27]
Sal de carretera
Cuando las plantas se exponen a concentraciones cada vez mayores de sal para carreteras , las células vegetales se vuelven disfuncionales y sufren apoptosis , lo que conduce a una inhibición del crecimiento. El pretratamiento con inositol podría reducir estos efectos. [28]
Investigación y aplicaciones clínicas
Tricotilomanía
Se pueden utilizar dosis altas de inositol para tratar la tricotilomanía (arrancarse compulsivamente el cabello) y trastornos relacionados. [29]
Otras enfermedades
El D- quiro -inositol es una molécula mensajera importante en la señalización de la insulina. [30] Se ha demostrado que la suplementación con inositol reduce significativamente los triglicéridos y el colesterol LDL en pacientes con enfermedades metabólicas . [30]
El mioinositol es importante para la síntesis de la hormona tiroidea . [31] La depleción de mioinositol puede predisponer al desarrollo de hipotiroidismo . [31] Los pacientes con hipotiroidismo tienen una mayor demanda de mioinositol que los sujetos sanos. [31]
El inositol no debe administrarse de forma rutinaria en el tratamiento de bebés prematuros que padecen o corren riesgo de padecer síndrome de dificultad respiratoria infantil (SDR). [32] El mioinositol ayuda a prevenir defectos del tubo neural con particular eficacia en combinación con ácido fólico . [33]
El inositol se considera un tratamiento seguro y eficaz para el síndrome de ovario poliquístico (SOP). [7] Funciona aumentando la sensibilidad a la insulina, lo que ayuda a mejorar la función ovárica y reducir el hiperandrogenismo . [34] También se ha demostrado que reduce el riesgo de enfermedad metabólica en mujeres con SOP. [35] Además, gracias a su papel como segundo mensajero de la FSH, el mioinositol es eficaz para restablecer la relación FSH/LH y la regularización del ciclo menstrual. [36] El papel del mioinositol como segundo mensajero de la FSH conduce a una correcta maduración del folículo ovárico y, en consecuencia, a una mayor calidad de los ovocitos. Al mejorar la calidad de los ovocitos tanto en mujeres con SOP como sin él, el mioinositol puede considerarse un posible enfoque para aumentar las posibilidades de éxito en las tecnologías de reproducción asistida. [37] [38] Por el contrario, el D - quiro -inositol puede perjudicar la calidad de los ovocitos de forma dependiente de la dosis. [39] El alto nivel de DCI parece estar relacionado con los niveles elevados de insulina recuperados en aproximadamente el 70% de las mujeres con SOP. [40] En este sentido, la insulina estimula la conversión irreversible de mioinositol a D - quiroinositol causando una reducción drástica de mioinositol . El agotamiento de mioinositol es particularmente dañino para los folículos ováricos porque está involucrado en la señalización de FSH, que se ve afectada debido al agotamiento de mioinositol . [12] La evidencia reciente informa una mejora más rápida de los parámetros metabólicos y hormonales cuando estos dos isómeros se administran en su proporción fisiológica. La proporción plasmática de mioinositol y D - quiroinositol en sujetos sanos es 40:1 de mioinositol y D - quiroinositol respectivamente. [41] El uso de la proporción 40:1 muestra la misma eficacia del mioinositol solo pero en un tiempo más corto. Además, la proporción fisiológica no afecta la calidad de los ovocitos. [42]
El uso de inositoles en el SOP está ganando cada vez más importancia, y se ha informado de una eficacia superior al 70% con un fuerte perfil de seguridad. Por otro lado, alrededor del 30% de los pacientes podrían mostrarse resistentes al inositol. [43] Nuevas evidencias sobre la etiopatogenia del SOP describen una alteración en las especies y la cantidad de cada cepa que caracteriza la flora gastrointestinal normal. Esta alteración podría conducir a una inflamación crónica de bajo nivel y malabsorción. [44] Una posible solución podría estar representada por la combinación de mioinositol y α-lactoalbúmina . Esta combinación muestra un efecto sinérgico en el aumento de la absorción de mioinositol. [45] Un estudio reciente informó que la combinación de mioinositol y α-lactoalbúmina aumenta el contenido plasmático de mioinositol en pacientes resistentes al inositol con una mejora relativa de los parámetros hormonales y metabólicos. [46]
Utilizar como agente de corte
El inositol se ha utilizado como adulterante o agente de corte para muchas drogas ilegales, como la cocaína , la metanfetamina y, a veces, la heroína , [47] probablemente debido a su solubilidad, textura en polvo o dulzura reducida (50%) en comparación con los azúcares más comunes.
El inositol también se utiliza como sustituto de la cocaína en el cine . [48] [49]
Fuentes nutricionales
El mio -inositol está presente de forma natural en una variedad de alimentos, aunque las tablas de composición de alimentos no siempre distinguen entre lecitina , la forma lipídica relativamente biodisponible y la forma de fitato/fosfato bioindisponible. [17] Los alimentos que contienen las concentraciones más altas de mio -inositol y sus compuestos incluyen frutas, frijoles, granos y nueces. [17] Las frutas en particular, especialmente las naranjas y el melón, contienen las mayores cantidades de mio -inositol. [50] También está presente en frijoles, nueces y granos, sin embargo, estos contienen grandes cantidades de mio -inositol en forma de fitato, que no es biodisponible sin la transformación por las enzimas fitasas . Bacillus subtilis , el microorganismo que produce el alimento fermentado natto , produce enzimas fitasas que pueden convertir el ácido fítico en una forma más biodisponible de polifosfato de inositol en el intestino. [51] Además, las especies de Bacteroides en el intestino secretan vesículas que contienen una enzima activa que convierte la molécula de fitato en fósforo biodisponible y polifosfato de inositol, que es una molécula de señalización importante en el cuerpo humano. [52]
El mio -inositol también se puede encontrar como ingrediente en bebidas energéticas , [53] ya sea en combinación con la glucosa o como sustituto de esta. [54]
En los seres humanos, el mioinositol se produce naturalmente a partir de glucosa-6-fosfato mediante desfosforilación enzimática. [50]
Producción
A partir de 2021, el principal proceso industrial para la producción de mioinositol (principalmente en China y Japón) comenzó con el fitato (IP6) extraído del agua de remojo resultante del procesamiento del salvado de maíz y arroz. Después de la purificación, el fitato se hidroliza y el mioinositol se separa por cristalización. [3]
Otra ruta es la fermentación microbiana de carbohidratos por varios organismos, como el hongo Neurospora crassa (Beadle y Tatum, 1945), Candida boidini (Shirai et al., 1997), Saccharomyces cerevisiae (Culbertson et al., 1976), Escherichia coli (Hansen, 1999). [3] Alternativamente, los extractos enzimáticos de cultivos microbianos se pueden utilizar in vitro para obtener mioinositol a partir de varios sustratos, incluyendo glucosa, sacarosa , almidón , xilosa y amilosa . [3]
Referencias
- ^ Índice Merck (11.ª ed.). pág. 4883.
- ^ Knyazev, AV; Emel'yanenko, VN; Shipílova, AS; Zaitsau, DH; Lelet, MI; Knyazeva, SS; Gusarova, EV; Varfolomeev, MA (2018). "Propiedades termodinámicas del mioinositol". La Revista de Termodinámica Química . 116 : 76–84. Código Bib :2018JChTh.116...76K. doi :10.1016/j.jct.2017.08.028. ISSN 0021-9614.
- ^ abcdefgh Yunjie Li, Pingping Han, Juan Wang, Ting Shi, Chun You (2021): "Producción de mioinositol: avance reciente y prospectiva". Biotechnology and Applied Biochemistry , volumen 69, número 3, páginas 1101-1111. doi :10.1002/bab.2181
- ^ Croze, ML; Soulage, CO (octubre de 2013). "Potencial papel e intereses terapéuticos del mioinositol en enfermedades metabólicas". Biochimie . 95 (10): 1811–1827. doi :10.1016/j.biochi.2013.05.011. PMID 23764390.
- ^ ab Parthasarathy, LK; Seelan, RS; Tobias, C.; Casanova, MF; Parthasarathy, RN (2006). Sintetasa de inositol 3-fosfato de mamíferos: su papel en la biosíntesis de inositol cerebral y su uso clínico como agente psicoactivo . Bioquímica subcelular. Vol. 39. págs. 293–314. doi :10.1007/0-387-27600-9_12. ISBN 978-0-387-27599-4. Número de identificación personal 17121280.
- ^ abcde Kiani AK, Paolacci S, Bertelli M (2021). "Vías moleculares de mioinositol a D-quiroinositol". Revista Europea de Ciencias Médicas y Farmacológicas . 25 (5): 2390–2402. doi :10.26355/eurrev_202103_25279. PMID 33755975.
- ^ ab Greff, Dorina; Juhász, Anna E.; Váncsa, Szilárd; Varadi, Alex; Sipos, Zoltán; Szinte, Julia; Parque, sol de junio; Hegyi, Peter; Nyirády, Péter; Ács, Nándor; Várbíró, Szabolcs; Horváth, Eszter M. (2023). "El inositol es un tratamiento eficaz y seguro en el síndrome de ovario poliquístico: una revisión sistemática y metanálisis de ensayos controlados aleatorios". Biología Reproductiva y Endocrinología . 21 (1): 10. doi : 10.1186/s12958-023-01055-z . PMC 9878965 . PMID 36703143.
- ^ Showell, MG; Mackenzie-Proctor, R.; Jordan, V.; Hodgson, R.; Farquhar, C. (2018). "Inositol para mujeres subfértiles con síndrome de ovario poliquístico". Base de Datos Cochrane de Revisiones Sistemáticas . 2018 ( 12): CD012378. doi :10.1002/14651858.CD012378.pub2. PMC 6516980. PMID 30570133.
- ^ ab JEF Reynolds (1993): Martindale: The Extra Pharmacopoeia , volumen 30. Cita (página 1379): "Un isómero de glucosa que tradicionalmente se ha considerado una vitamina B, aunque tiene un estatus incierto como vitamina y no se ha identificado un síndrome de deficiencia en el hombre". ISBN 978-0-85369-300-0
- ^ ab Majumder, AL; Biswas, BB (3 de octubre de 2006). Biología de inositoles y fosfoinosítidos. Springer Science & Business Media. ISBN 9780387276007.
- ^ Brady, S.; Siegel, G.; Albers, RW; Price, D. (2005). Neuroquímica básica: aspectos moleculares, celulares y médicos. Academic Press. pág. 348. ISBN 9780080472072.
- ^ ab Carlomagno, G.; Unfer, V.; Roseff, S. (2011). "La paradoja del D-chiro-inositol en el ovario". Fertilidad y esterilidad . 95 (8): 2515–6. doi : 10.1016/j.fertnstert.2011.05.027 . PMID 21641593.
- ^ "Ácido fítico". phytochemicals.info . Archivado desde el original el 7 de marzo de 2018 . Consultado el 2 de mayo de 2018 .
{{cite web}}: CS1 maint: URL no apta ( enlace ) - ^ Klopfenstein, TJ; Angel, R.; Cromwell, G.; Erickson, GE; Fox, DG; Parsons, C.; Satter, LD; Sutton, AL; Baker, DH (julio de 2002). "Modificación de la dieta animal para reducir el potencial de contaminación por nitrógeno y fósforo". Consejo de Ciencia y Tecnología Agrícolas . 21 . Archivado desde el original el 11 de junio de 2011.
- ^ Hurrell, RF (septiembre de 2003). "Influencia de las fuentes de proteína vegetal en la biodisponibilidad de oligoelementos y minerales". The Journal of Nutrition . 133 (9): 2973S–2977S. doi : 10.1093/jn/133.9.2973S . PMID 12949395.
- ^ Comité de Protección de Alimentos; Junta de Alimentos y Nutrición; Consejo Nacional de Investigación (1973). "Fitatos". Sustancias tóxicas presentes de forma natural en los alimentos. Academia Nacional de Ciencias. págs. 363–371. ISBN 978-0-309-02117-3.
- ^ abc Clements, RS; Darnell, B. (septiembre de 1980). "Contenido de mioinositol en alimentos comunes: desarrollo de una dieta rica en mioinositol". The American Journal of Clinical Nutrition . 33 (9): 1954–1967. doi : 10.1093/ajcn/33.9.1954 . PMID 7416064. S2CID 4442333.
- ^ "Ácido fítico". phytochemicals.info . Archivado desde el original el 2017-08-06 . Consultado el 2017-10-02 .
{{cite web}}: CS1 maint: URL no apta ( enlace ) - ^ Larner, J. (2002). "D-chiro-Inositol—su papel funcional en la acción de la insulina y su déficit en la resistencia a la insulina". Revista Internacional de Investigación Experimental sobre Diabetes . 3 (1): 47–60. doi :10.1080/15604280212528. PMC 2478565 . PMID 11900279.
- ^ Gerasimenko, JV; Flowerdew, SE; Voronina, SG; Sukhomlin, TK; Tepikin, AV; Petersen, OH; Gerasimenko, OV (diciembre de 2006). "Los ácidos biliares inducen la liberación de Ca2+ tanto del retículo endoplasmático como de los depósitos de calcio intracelular ácido a través de la activación de los receptores de trifosfato de inositol y los receptores de rianodina". The Journal of Biological Chemistry . 281 (52): 40154–40163. doi : 10.1074/jbc.M606402200 . PMID 17074764.
- ^ Kukuljan, M.; Vergara, L.; Stojilković, SS (febrero de 1997). "Modulación de la cinética de las oscilaciones de [Ca2+]i inducidas por el inositol 1,4,5-trifosfato mediante la entrada de calcio en gonadotrofos hipofisarios". Biophysical Journal . 72 (2 Pt 1): 698–707. Bibcode :1997BpJ....72..698K. doi :10.1016/S0006-3495(97)78706-X. PMC 1185595 . PMID 9017197.
- ^ Rapiejko, PJ; Northup, JK; Evans, T.; Brown, JE; Malbon, CC (noviembre de 1986). "Proteínas G de las células grasas. Función en la regulación hormonal del inositol 1,4,5-trifosfato intracelular". The Biochemical Journal . 240 (1): 35–40. doi :10.1042/bj2400035. PMC 1147372 . PMID 3103610.
- ^ Shen, X.; Xiao, H.; Ranallo, R.; Wu, W.-H.; Wu, C. (enero de 2003). "Modulación de complejos de remodelación de cromatina dependientes de ATP por polifosfatos de inositol". Science . 299 (5603): 112–114. Bibcode :2003Sci...299..112S. doi : 10.1126/science.1078068 . PMID 12434013. S2CID 8381889.
- ^ Steger, DJ; Haswell, ES; Miller, AL; Wente, SR; O'Shea, EK (enero de 2003). "Regulación de la remodelación de la cromatina por polifosfatos de inositol". Science . 299 (5603): 114–116. Bibcode :2003Sci...299..114S. doi :10.1126/science.1078062. PMC 1458531 . PMID 12434012.
- ^ Mathews, CK; Van Holde, KE; Ahern, KG (2000). Bioquímica (3.ª ed.). San Francisco, CA: Benjamin Cummings. pág. 855. ISBN 978-0805330663.OCLC 42290721 .
- ^ Laurence, WL (17 de abril de 1936). "Los subproductos del maíz producen rendimientos explosivos". The New York Times . p. 7. Archivado desde el original el 12 de mayo de 2013.
- ^ Ledgard, J. (2007). Manual preparatorio de explosivos. Ledgard. pág. 366. ISBN 9780615142906.
- ^ Chatterjee, J.; Majumder, AL (septiembre de 2010). "Anormalidades inducidas por sal en las células mitóticas de la punta de la raíz de Allium cepa : prevención mediante pretratamiento con inositol". Protoplasma . 245 (1–4): 165–172. doi :10.1007/s00709-010-0170-4. PMID 20559853. S2CID 9128286.
- ^ Sani, Gabriele; Gualtieri, Ida; Paolini, Marco; et al. (25 de julio de 2019). "Tratamiento farmacológico de la tricotilomanía (trastorno de arrancarse el pelo), el trastorno de excoriación (pellizcarse la piel) y la mordedura de uñas (onicofagia)". Neurofarmacología actual . 17 (8): 775–786. doi :10.2174/1570159X17666190320164223. PMC 7059154 . PMID 30892151.
- ^ ab Tabrizi R, Ostadmohammadi V, Asemi Z (2018). "Los efectos de la suplementación con inositol en los perfiles lipídicos entre pacientes con enfermedades metabólicas: una revisión sistemática y metanálisis de ensayos controlados aleatorizados". Lípidos en la salud y la enfermedad . 17 (1): 123. doi : 10.1186/s12944-018-0779-4 . PMC 5968598 . PMID 29793496.
- ^ abc Benvenga S, Nordio M, Laganà AS, Unfer V (2021). "El papel del inositol en la fisiología tiroidea y en el tratamiento del hipotiroidismo subclínico". Frontiers in Endocrinology . 12 : 662582. doi : 10.3389/fendo.2021.662582 . PMC 8143049 . PMID 34040582.
- ^ Howlett, Alexandra; Ohlsson, Arne; Plakkal, Nishad (8 de julio de 2019). "Inositol en lactantes prematuros con riesgo de síndrome de dificultad respiratoria o que lo padecen". Base de Datos Cochrane de Revisiones Sistemáticas . 7 (7): CD000366. doi :10.1002/14651858.CD000366.pub4. ISSN 1469-493X. PMC 6613728 . PMID 31283839.
- ^ Cavalli, P.; Ronda, E. (2017). "Mioinositol: el puente (PONTI) para alcanzar un embarazo saludable". Revista Internacional de Endocrinología . 2017 : 5846286. doi : 10.1155/2017/5846286 . PMC 5274721. PMID 28243254 .
- ^ Monastra, G.; Unfer, V.; Harrath, AH; Bizzarri, M. (enero de 2017). "La combinación del tratamiento con mio -inositol y D- quiro -inositol (40:1) es eficaz para restablecer la función ovárica y el equilibrio metabólico en pacientes con SOP". Endocrinología ginecológica . 33 (1): 1–9. doi :10.1080/09513590.2016.1247797. hdl :11573/944617. PMID 27898267. S2CID 24836559.
- ^ Nordio, M.; Proietti, E. (mayo de 2012). "La terapia combinada con mioinositol y D- quiroinositol reduce el riesgo de enfermedad metabólica en pacientes con sobrepeso y SOP en comparación con la suplementación con mioinositol solo". Revista Europea de Ciencias Médicas y Farmacológicas . 16 (5): 575–581. PMID 22774396.
- ^ Unfer, V.; et al. (2012). "Efectos del mio -inositol en mujeres con SOP: una revisión sistemática de ensayos controlados aleatorizados". Endocrinología ginecológica . 28 (7): 509–15. doi :10.3109/09513590.2011.650660. PMID 22296306. S2CID 24582338.
- ^ Ciotta, L.; et al. (2011). "Efectos de la suplementación con mioinositol en la calidad de los ovocitos en pacientes con SOP: un ensayo doble ciego". Revista Europea de Ciencias Médicas y Farmacológicas . 15 (5): 509–14. PMID 21744744.
- ^ Papaleo, E.; et al. (2009). "Contribución del mio -inositol a la reproducción". Revista Europea de Obstetricia y Ginecología y Biología Reproductiva . 147 (2): 120–3. doi :10.1016/j.ejogrb.2009.09.008. PMID 19800728.
- ^ Isabella, R.; Raffone, E. (2012). "¿El ovario necesita D-chiro-inositol?". Journal of Ovarian Research . 5 (1): 14. doi : 10.1186/1757-2215-5-14 . PMC 3447676 . PMID 22587479. (Este artículo actualmente tiene una expresión de preocupación , consulte doi : 10.1186/s13048-018-0431-y, PMID 29976256, Retraction Watch )
- ^ Moghetti, P. (2016). "Resistencia a la insulina y síndrome de ovario poliquístico". Current Pharmaceutical Design . 22 (36): 5526–5534. doi :10.2174/1381612822666160720155855. PMID 27510482.
- ^ Facchinetti, F.; et al. (2015). "Resultados de la Conferencia de Consenso Internacional sobre mio -inositol y D- quiro -inositol en obstetricia y ginecología: el vínculo entre el síndrome metabólico y el síndrome de ovario poliquístico". Revista Europea de Obstetricia y Ginecología y Biología Reproductiva . 195 : 72–6. doi :10.1016/j.ejogrb.2015.09.024. PMID 26479434.
- ^ Colazingari, S.; et al. (2013). "La terapia combinada de mio -inositol más D- chiro -inositol, en lugar de D- chiro -inositol, es capaz de mejorar los resultados de la FIV: resultados de un ensayo controlado aleatorizado". Archivos de Ginecología y Obstetricia . 288 (6): 1405–11. doi :10.1007/s00404-013-2855-3. PMID 23708322. S2CID 45611717.
- ^ Kamenov, Z.; et al. (2015). "Inducción de la ovulación con mioinositol solo y en combinación con citrato de clomifeno en pacientes con síndrome de ovario poliquístico y resistencia a la insulina". Endocrinología ginecológica . 31 (2): 131–5. doi :10.3109/09513590.2014.964640. PMID 25259724. S2CID 24469378.
- ^ González, F. (2012). "Inflamación en el síndrome de ovario poliquístico: fundamento de la resistencia a la insulina y la disfunción ovárica". Esteroides . 77 (4): 300–5. doi :10.1016/j.steroids.2011.12.003. PMC 3309040 . PMID 22178787.
- ^ Monastra, G.; et al. (2018). " Efecto de la alfa -lactalbúmina en la absorción intestinal de mio -inositol: in vivo e in vitro". Current Drug Delivery . 15 (9): 1305–1311. doi :10.2174/1567201815666180509102641. PMID 29745333. S2CID 13691602.
- ^ Oliva, MM; et al. (2018). "Efectos del mioinositol más alfa-lactalbúmina en mujeres con SOP resistentes al mioinositol". Journal of Ovarian Research . 11 (1): 38. doi : 10.1186/s13048-018-0411-2 . PMC 5944130 . PMID 29747700.
- ^ "Inositol, guía nerviosa, fabricante de agente de corte". Tianyu Feed Additive. Archivado desde el original el 8 de septiembre de 2014. Consultado el 21 de julio de 2013 .
- ^ Golianopoulos, T. (12 de mayo de 2012). "Dobles de drogas: lo que los actores realmente fuman y esnifan frente a la cámara". Wired . Archivado desde el original el 14 de mayo de 2012. Consultado el 14 de mayo de 2012 .
- ^ Cómo se fabrican medicamentos falsos para las películas | Movies Insider, 12 de diciembre de 2020 , consultado el 26 de septiembre de 2022
- ^ ab Awuchi, Chinaza (2017). "Alcoholes de azúcar: química, producción, problemas de salud e importancia nutricional del manitol, sorbitol, xilitol y eritritol". Revista internacional de investigación académica avanzada . 5 (11): 1954–1967.
- ^ Borgi MA, Boudebbouze S, Mkaouar H, Maguin E, Rhimi M (2015). "Fitasas de Bacillus: estado actual y perspectivas futuras". Bioingeniería . 5 (4): 233–236. doi :10.1080/21655979.2015.1048050. PMC 4601277 . PMID 25946551.
- ^ Stentz R, Osborne S, Horn N, Li AW, Hautefort I, Bongaerts R, Rouyer M, Bailey P, Shears SB, Hemmings AM, Brearley CA, Carding SR (27 de febrero de 2014). "Un homólogo bacteriano de una enzima de señalización de fosfato de inositol eucariota media el diálogo entre reinos en el intestino de los mamíferos". Cell Reports . 6 (4): 646–656. doi : 10.1016/j.celrep.2014.01.021 . PMC 3969271 . PMID 24529702.
- ^ Ehlers, Anke; Marakis, Georgios; Lampen, Alfonso; Hirsch-Ernst, Karen Ildico (1 de agosto de 2019). "Evaluación de riesgos de las bebidas energéticas con especial atención a los parámetros cardiovasculares y el consumo de bebidas energéticas en Europa". Toxicología alimentaria y química . 130 : 109–121. doi : 10.1016/j.fct.2019.05.028 . ISSN 0278-6915. PMID 31112702.
- ^ DiSalvo, David. "Sabemos que hay cafeína en las bebidas energéticas como Monster, pero ¿qué pasa con los demás ingredientes?". Forbes . Consultado el 22 de diciembre de 2020 .
Enlaces externos
- Espectro de MS de inositol
- Inositol unido a proteínas en el PDB




