Embolia pulmonar
| Embolia pulmonar | |
|---|---|
 | |
| Ilustración de un pulmón que muestra una embolia pulmonar en la que un trombo (coágulo de sangre) que ha viajado desde otra región del cuerpo provoca la oclusión de la arteria bronquial pulmonar , lo que lleva a una trombosis arterial de los lóbulos superior e inferior del pulmón izquierdo. | |
| Especialidad | Hematología , cardiología , neumología |
| Síntomas | Dificultad para respirar , dolor en el pecho , tos con sangre [1] |
| Complicaciones | Desmayo , presión arterial anormalmente baja , muerte súbita ; [2] hipertensión pulmonar tromboembólica crónica (complicación a largo plazo) |
| Inicio habitual | Edad avanzada [3] |
| Factores de riesgo | Cáncer , reposo prolongado en cama , traumatismo cerrado , tabaquismo , accidente cerebrovascular , ciertas enfermedades genéticas , medicación a base de estrógenos , embarazo , obesidad , después de una cirugía [3] |
| Método de diagnóstico | Basado en los síntomas, dímero D , angiografía pulmonar por TC , gammagrafía de ventilación/perfusión pulmonar [4] |
| Tratamiento | Anticoagulantes ( heparina , warfarina , DOAC ) [5] |
| Frecuencia | ~450.000 al año (EE. UU.), 430.000 (Europa) [6] [7] [8] |
| Fallecidos | >10–12 000 por año (EE. UU.), [9] >30–40 000 por año (Europa) [10] |
La embolia pulmonar ( EP ) es un bloqueo de una arteria en los pulmones por una sustancia que se ha trasladado desde otra parte del cuerpo a través del torrente sanguíneo ( embolia ). [6] Los síntomas de una EP pueden incluir dificultad para respirar , dolor en el pecho particularmente al inspirar y tos con sangre . [1] También pueden estar presentes síntomas de un coágulo de sangre en la pierna , como una pierna roja , caliente, hinchada y dolorosa. [1] Los signos de una EP incluyen niveles bajos de oxígeno en sangre , respiración rápida , frecuencia cardíaca rápida y, a veces, fiebre leve . [11] Los casos graves pueden provocar desmayos , presión arterial anormalmente baja , shock obstructivo y muerte súbita . [2]
La EP generalmente es el resultado de un coágulo de sangre en la pierna que viaja al pulmón. [6] El riesgo de coágulos de sangre aumenta con la edad avanzada , el cáncer , el reposo prolongado en cama y la inmovilización, el tabaquismo , el accidente cerebrovascular, los viajes de larga distancia de más de 4 horas, ciertas condiciones genéticas , la medicación a base de estrógenos , el embarazo , la obesidad , el traumatismo o la fractura ósea y después de algunos tipos de cirugía. [3] [12] Una pequeña proporción de los casos se deben a la embolización de aire , grasa o líquido amniótico . [13] [14] El diagnóstico se basa en signos y síntomas en combinación con los resultados de las pruebas. [4] Si el riesgo es bajo, un análisis de sangre conocido como dímero D puede descartar la afección. [4] De lo contrario, una angiografía pulmonar por TC , una exploración de ventilación/perfusión pulmonar o una ecografía de las piernas pueden confirmar el diagnóstico. [4] En conjunto, la trombosis venosa profunda y la EP se conocen como tromboembolia venosa (TEV). [15]
Los esfuerzos para prevenir la EP incluyen comenzar a moverse lo antes posible después de la cirugía, ejercicios para la parte inferior de las piernas durante los períodos en que se está sentado y el uso de anticoagulantes después de algunos tipos de cirugía. [16] El tratamiento es con anticoagulantes como heparina , warfarina o uno de los anticoagulantes orales de acción directa (DOAC). [5] Estos se recomiendan durante al menos tres meses. [5] Sin embargo, el tratamiento con anticoagulantes no se recomienda para aquellos con alto riesgo de sangrado, así como para aquellos con insuficiencia renal. [17] Los casos graves pueden requerir trombólisis con medicamentos como el activador tisular del plasminógeno (tPA) administrado por vía intravenosa o a través de un catéter, y algunos pueden requerir cirugía (una trombectomía pulmonar ). [18] Si los anticoagulantes no son apropiados, se puede utilizar un filtro temporal en la vena cava . [18]
Las embolias pulmonares afectan a unas 430.000 personas cada año en Europa. [8] En los Estados Unidos, se producen entre 300.000 y 600.000 casos cada año, [6] [7] que contribuyen a al menos 40.000 muertes. [9] Las tasas son similares en hombres y mujeres. [3] Se vuelven más comunes a medida que las personas envejecen. [3]
Signos y síntomas
Los síntomas de la embolia pulmonar suelen aparecer de forma repentina y pueden incluir uno o varios de los siguientes: disnea (dificultad para respirar), taquipnea (respiración rápida), dolor torácico de naturaleza "pleurítica" (que empeora con la respiración), tos y hemoptisis (tos con sangre). [19] Los casos más graves pueden incluir signos como cianosis (coloración azulada, generalmente de los labios y los dedos), colapso e inestabilidad circulatoria debido a la disminución del flujo sanguíneo a través de los pulmones y hacia el lado izquierdo del corazón. Alrededor del 15 % de todos los casos de muerte súbita son atribuibles a la EP. [2] Si bien la EP puede presentarse con síncope (desmayo), menos del 1 % de los casos de síncope se deben a la EP. [20]
En el examen físico, los pulmones suelen ser normales. Ocasionalmente, puede escucharse un roce pleural sobre el área afectada del pulmón (principalmente en EP con infarto ). A veces hay un derrame pleural exudativo, detectable por una disminución del tono de percusión, ruidos respiratorios audibles y resonancia vocal. La tensión en el ventrículo derecho puede detectarse como un tirón paraesternal izquierdo, un componente pulmonar fuerte del segundo ruido cardíaco y/o presión venosa yugular elevada . [2] Puede haber fiebre baja , particularmente si hay hemorragia pulmonar o infarto asociados. [21]
Como los émbolos pulmonares más pequeños tienden a alojarse en áreas más periféricas sin circulación colateral, es más probable que causen infarto pulmonar y pequeños derrames (ambos dolorosos), pero no hipoxia, disnea o inestabilidad hemodinámica como taquicardia. Los émbolos pulmonares más grandes, que tienden a alojarse centralmente, generalmente causan disnea, hipoxia, presión arterial baja , frecuencia cardíaca rápida y desmayos , pero a menudo son indoloros porque no hay infarto pulmonar debido a la circulación colateral. La presentación clásica de émbolo pulmonar con dolor pleurítico, disnea y taquicardia probablemente sea causada por un gran émbolo fragmentado que causa émbolos pulmonares grandes y pequeños. Por lo tanto, los émbolos pulmonares pequeños a menudo se pasan por alto porque causan dolor pleurítico solo sin ningún otro hallazgo y los émbolos pulmonares grandes a menudo se pasan por alto porque son indoloros e imitan otras afecciones que a menudo causan cambios en el ECG y pequeños aumentos en los niveles de troponina y péptido natriurético cerebral. [22]
Las EP se describen a veces como masivas, submasivas y no masivas según los signos y síntomas clínicos. Aunque las definiciones exactas de estas no están claras, una definición aceptada de EP masiva es aquella en la que hay inestabilidad hemodinámica. Esta es una causa de shock obstructivo, que se presenta como presión arterial baja sostenida, frecuencia cardíaca lenta o ausencia de pulso. [23]
Factores de riesgo

Alrededor del 90% de los émbolos se deben a una trombosis venosa profunda localizada por encima de la rodilla, denominada TVP proximal , que incluye una TVP iliofemoral . [24] El síndrome del desfiladero venoso torácico, poco frecuente , también puede ser una causa de TVP, especialmente en hombres jóvenes sin factores de riesgo significativos. [25] Las TVP tienen el riesgo de desplazarse y migrar a la circulación pulmonar. Las afecciones generalmente se consideran un continuo conocido como tromboembolia venosa (TEV). [ cita requerida ]
La TEV es mucho más común en personas inmunodeprimidas, así como en personas con comorbilidades que incluyen:
- Aquellos que se someten a cirugía ortopédica en la cadera o debajo de ella sin profilaxis. [26]
- Esto se debe a la inmovilidad durante o después de la cirugía, así como al daño venoso durante la cirugía. [26]
- Pacientes con cáncer de páncreas y de colon (otras formas de cáncer también pueden ser factores, pero estas son las más comunes) [26]
- Esto se debe a la liberación de procoagulantes. [26]
- El riesgo de TEV es mayor durante el diagnóstico y el tratamiento, pero disminuye durante la remisión. [26]
- Esto se debe a la liberación de procoagulantes. [26]
- Pacientes con tumores de alto grado [26]
- Mujeres embarazadas [26]
- A medida que el cuerpo se pone en lo que se conoce como un "estado de hipercoagulabilidad", el riesgo de una hemorragia durante el parto disminuye y se regula mediante el aumento de la expresión de los factores VII, VIII, X, Von Willebrand y fibrinógeno . [26]
- Aquellos que toman medicación con estrógenos [26] [27] [28] [29]
El desarrollo de la trombosis se debe clásicamente a un grupo de causas denominadas tríada de Virchow (alteraciones del flujo sanguíneo, factores de la pared vascular y factores que afectan a las propiedades de la sangre). A menudo, está presente más de un factor de riesgo. [ cita requerida ]
- Alteraciones del flujo sanguíneo : inmovilización (después de una cirugía, un vuelo de larga distancia), lesión , embarazo (también procoagulante), obesidad (también procoagulante), cáncer (también procoagulante)
- Factores que actúan sobre la pared vascular : cirugías, cateterismos que provocan lesiones directas ("lesión endotelial")
- Factores que afectan las propiedades de la sangre (estado procoagulante):
- Medicamentos que contienen estrógeno ( terapia hormonal para transexuales , terapia hormonal para la menopausia y anticonceptivos hormonales ) [28] [27] [29]
- Trombofilia genética ( factor V Leiden , mutación de protrombina G20210A , deficiencia de proteína C , deficiencia de proteína S , deficiencia de antitrombina , hiperhomocisteinemia y trastornos del plasminógeno / fibrinólisis )
- Trombofilia adquirida ( síndrome antifosfolípido , síndrome nefrótico , hemoglobinuria paroxística nocturna )
- Cáncer (debido a la secreción de procoagulantes)
Aunque la mayoría de las embolias pulmonares son el resultado de TVP proximales , todavía existen muchos otros factores de riesgo que también pueden provocar una embolia pulmonar.
- Los factores de riesgo incluyen:
- Varices causadas por daño vascular [30]
- Hipertensión pulmonar [30]
- Diabetes [30]
- Fracturas traumáticas de cadera que inmovilizan al paciente [30]
- Fijación articular (principalmente en las piernas) [26]
Causas subyacentes
Después de una primera EP, la búsqueda de causas secundarias suele ser breve. Sólo cuando se produce una segunda EP, y especialmente cuando esto sucede mientras todavía se está bajo tratamiento anticoagulante , se realiza una búsqueda adicional de enfermedades subyacentes. Esto incluirá pruebas ("cribado de trombofilia") para la mutación del factor V Leiden , anticuerpos antifosfolípidos, niveles de proteína C y S y antitrombina , y más tarde mutación de protrombina, mutación de MTHFR , concentración de factor VIII y anomalías de coagulación hereditarias más raras . [31]
Diagnóstico
Para diagnosticar una embolia pulmonar, se recomienda una revisión de los criterios clínicos para determinar la necesidad de realizar pruebas. [32] En aquellos que tienen un riesgo bajo, edad menor de 50 años, frecuencia cardíaca menor de 100 latidos por minuto, nivel de oxígeno mayor del 94% con aire ambiente y sin hinchazón de piernas, tos con sangre, cirugía o trauma en las últimas cuatro semanas, coágulos de sangre previos o uso de estrógenos, generalmente no se necesitan más pruebas. [33]
En situaciones con individuos de mayor riesgo, se necesitan más pruebas. Una angiografía pulmonar por TC (CTPA) es el método preferido para el diagnóstico de una embolia pulmonar debido a su fácil administración y precisión. [34] Aunque se prefiere una CTPA, también hay otras pruebas que se pueden realizar. Por ejemplo, se puede utilizar una ecografía de compresión proximal de miembros inferiores (CUS). [34] Esta es una prueba que se utiliza principalmente como prueba confirmatoria, lo que significa que confirma un análisis previo que muestra la presencia o sospecha de presencia de una embolia pulmonar. [34] Según un estudio transversal, las pruebas CUS tienen una sensibilidad del 41% y una especificidad del 96%. [34]
Si existen inquietudes, se realizan pruebas para determinar la probabilidad de poder confirmar un diagnóstico mediante imágenes, seguidas de imágenes si otras pruebas han demostrado que existe la probabilidad de un diagnóstico de EP. [32] [35] [36]
El diagnóstico de EP se basa principalmente en criterios clínicos validados combinados con pruebas selectivas porque la presentación clínica típica ( dificultad para respirar , dolor torácico ) no se puede diferenciar definitivamente de otras causas de dolor torácico y falta de aire. La decisión de realizar imágenes médicas se basa en el razonamiento clínico, es decir, la historia clínica , los síntomas y los hallazgos en el examen físico , seguido de una evaluación de la probabilidad clínica. [2]
Prueba de probabilidad
El método más comúnmente utilizado para predecir la probabilidad clínica, la puntuación de Wells , es una regla de predicción clínica , cuyo uso se complica por la disponibilidad de múltiples versiones. En 1995, Philip Steven Wells , desarrolló inicialmente una regla de predicción (basada en una búsqueda bibliográfica) para predecir la probabilidad de TVP, basándose en criterios clínicos. [37] Se creó una nueva puntuación de predicción para EP en 1998 [38] Esta regla de predicción fue revisada por Wells et al. en 2000. [39] En la publicación de 2000, Wells propuso dos sistemas de puntuación diferentes utilizando puntos de corte de 2 o 4 con la misma regla de predicción, y también incluyó la prueba del dímero D en la descartación de EP en pacientes de baja probabilidad. [39] En 2001, Wells publicó resultados utilizando el punto de corte más conservador de 2 para crear tres categorías. [40] Se propuso una versión adicional, la "versión extendida modificada", que utiliza el punto de corte más reciente de 2 pero que incluye los hallazgos de los estudios iniciales de Wells [37] [38] . [41] Más recientemente, un estudio posterior volvió al uso anterior de Wells de un límite de corte de 4 puntos [39] para crear solo dos categorías. [42]
Existen reglas de predicción adicionales para la EP, como la regla de Ginebra . Más importante aún, el uso de cualquier regla se asocia con una reducción de la tromboembolia recurrente . [43]
Puntuación de Wells : [44]
- TVP clínicamente sospechada : 3,0 puntos
- El diagnóstico alternativo es menos probable que la EP: 3,0 puntos
- Taquicardia (frecuencia cardíaca > 100) – 1,5 puntos
- Inmovilización (≥ 3 días)/cirugía en las cuatro semanas anteriores – 1,5 puntos
- Historial de TVP o EP: 1,5 puntos
- hemoptisis – 1,0 puntos
- Malignidad (con tratamiento dentro de los seis meses) o paliativo – 1,0 puntos
Interpretación tradicional [39] [40] [45]
- Puntuación >6,0: alta (probabilidad del 59 % según datos agrupados) [35]
- Puntuación de 2,0 a 6,0: moderada (probabilidad del 29 % según datos agrupados) [35]
- Puntuación <2,0 – Baja (probabilidad del 15 % según datos agrupados) [35]
Interpretación alternativa [39] [42]
- Puntuación > 4: es probable que haya EP. Considere la posibilidad de realizar pruebas de diagnóstico por imagen.
- Puntuación 4 o menos: EP poco probable. Considere la posibilidad de dímero D para descartar EP.
Los investigadores de PIOPED publicaron recomendaciones para un algoritmo de diagnóstico ; sin embargo, estas recomendaciones no reflejan la investigación que utiliza TCMD de 64 cortes. [35] Estos investigadores recomendaron:
- Baja probabilidad clínica. Si el dímero D es negativo, se descarta EP. Si el dímero D es positivo, se realiza una TCMD y se basa el tratamiento en los resultados.
- Probabilidad clínica moderada. Si el dímero D es negativo, se excluye la EP. Sin embargo , a los autores no les preocupaba que una TCMD negativa con dímero D negativo en este contexto tenga una probabilidad del 5 % de ser falsa. Es de suponer que la tasa de error del 5 % disminuirá a medida que se utilice más comúnmente la TCMD de 64 cortes. Si el dímero D es positivo, se debe obtener una TCMD y basar el tratamiento en los resultados.
- Alta probabilidad clínica. Proceder a TCMD. Si es positivo, tratar; si es negativo, se necesitan más pruebas para descartar EP. Un dímero D de menos de 750 ug/L no descarta EP en personas con alto riesgo. [46]
Criterios de descartamiento de embolia pulmonar
Los criterios de descarte de embolia pulmonar (PERC) ayudan a evaluar a las personas en quienes se sospecha embolia pulmonar, pero es poco probable. A diferencia de la escala de Wells y la escala de Ginebra , que son reglas de predicción clínica destinadas a estratificar el riesgo de las personas con sospecha de EP, la regla PERC está diseñada para descartar el riesgo de EP en personas cuando el médico ya las ha estratificado en una categoría de bajo riesgo. [47] [45]
Las personas en esta categoría de bajo riesgo sin ninguno de estos criterios pueden no someterse a más pruebas para EP: saturación baja de oxígeno – Sa O2 < 95%, hinchazón unilateral de la pierna, tos con sangre, TVP o EP previa, cirugía o traumatismo reciente, edad >50, uso de hormonas, frecuencia cardíaca rápida. La razón detrás de esta decisión es que más pruebas (específicamente angiografía por TC del tórax) pueden causar más daño (por exposición a la radiación y al medio de contraste) que el riesgo de EP. [48] La regla PERC tiene una sensibilidad del 97,4% y una especificidad del 21,9% con una tasa de falsos negativos del 1,0% (16/1666). [47]
Análisis de sangre
En personas con una sospecha baja o moderada de EP, un nivel normal de dímero D (mostrado en un análisis de sangre ) es suficiente para excluir la posibilidad de EP trombótica, con un riesgo de tres meses de eventos tromboembólicos del 0,14%. [49] El dímero D es altamente sensible pero no específico (especificidad alrededor del 50%). En otras palabras, un dímero D positivo no es sinónimo de EP, pero un dímero D negativo es, con un buen grado de certeza, una indicación de ausencia de EP. [50] Una baja probabilidad previa a la prueba también es valiosa para descartar EP. [51] El punto de corte típico es de 500 μg/L, aunque esto varía según el ensayo. [52] Sin embargo, en personas mayores de 50 años, se recomienda cambiar el valor de corte a la edad de la persona multiplicada por 10 μg/L (teniendo en cuenta el ensayo que se ha utilizado), ya que disminuye el número de pruebas falsamente positivas sin pasar por alto ningún caso adicional de EP. [33] [52] [53]
Cuando se sospecha una EP, se realizan varios análisis de sangre para descartar causas secundarias importantes de EP. Esto incluye un hemograma completo , el estado de la coagulación ( TP , TTPa , TT ) y algunas pruebas de detección ( velocidad de sedimentación globular , función renal , enzimas hepáticas , electrolitos ). Si alguno de estos es anormal, podrían justificarse más investigaciones al respecto. [54]
Los niveles de troponina aumentan entre un 16 y un 47% en la embolia pulmonar. [55]
Imágenes
En personas típicas que no se sabe que tienen un alto riesgo de EP, las imágenes son útiles para confirmar o excluir un diagnóstico de EP después de que se utilizan pruebas de primera línea más simples. [32] [35] [56] Las sociedades médicas recomiendan pruebas como el dímero D para proporcionar primero evidencia de apoyo para la necesidad de imágenes, y las imágenes se realizarían si otras pruebas confirmaran una probabilidad moderada o alta de encontrar evidencia para apoyar un diagnóstico de EP. [35] [56]
La angiografía pulmonar por TC es la prueba de diagnóstico por imágenes de primera línea recomendada en la mayoría de las personas. [57]
La ecografía de las piernas puede confirmar la presencia de una EP, pero no puede descartarla. [58]
Angiografía pulmonar por TC
La angiografía pulmonar por TC (APTC) es una angiografía pulmonar que se obtiene mediante tomografía computarizada (TC) con contraste radiológico en lugar de cateterismo cardíaco derecho. Sus ventajas son que es precisa, no es invasiva, está disponible con mayor frecuencia y puede identificar otros trastornos pulmonares en caso de que no haya embolia pulmonar. La precisión y la naturaleza no invasiva de la APTC también la hacen ventajosa para las mujeres embarazadas. [59]
- En la tomografía computarizada , las embolias pulmonares se pueden clasificar según el nivel a lo largo del árbol arterial.
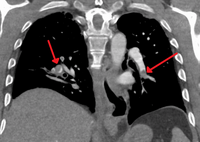
- Embolia pulmonar segmentaria y subsegmentaria en ambos lados
- Angiografía pulmonar por TC que muestra un "émbolo en silla de montar" en la bifurcación de la arteria pulmonar principal y una carga de trombos en las arterias lobulares de ambos lados.
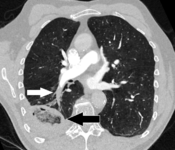
- Embolia pulmonar (flecha blanca) de larga duración que ha provocado un infarto pulmonar (flecha negra) que se observa como un signo de halo invertido .
La evaluación de la precisión de la angiografía pulmonar por TC se ve obstaculizada por los rápidos cambios en el número de filas de detectores disponibles en las máquinas de TC multidetector (MDCT). [60] Según un estudio de cohorte , la TC espiral de corte único puede ayudar a diagnosticar la detección entre personas con sospecha de embolia pulmonar. [61] En este estudio, la sensibilidad fue del 69% y la especificidad del 84%. En este estudio, que tuvo una prevalencia de detección del 32%, el valor predictivo positivo del 67,0% y el valor predictivo negativo del 85,2%. Sin embargo, los resultados de este estudio pueden estar sesgados debido a un posible sesgo de incorporación, ya que la tomografía computarizada fue la herramienta de diagnóstico final en personas con embolia pulmonar. Los autores señalaron que una tomografía computarizada de corte único negativa es insuficiente para descartar la embolia pulmonar por sí sola. Un estudio independiente con una combinación de escáneres de 4 y 16 cortes informó una sensibilidad del 83% y una especificidad del 96%, lo que significa que es una buena prueba para descartar una embolia pulmonar si no se ve en las imágenes y que es muy buena para confirmar la presencia de una embolia pulmonar si se ve. Este estudio señaló que es necesario realizar pruebas adicionales cuando la probabilidad clínica es inconsistente con los resultados de las imágenes. [62] La CTPA no es inferior a la exploración VQ e identifica más émbolos (sin mejorar necesariamente el resultado) en comparación con la exploración VQ. [63]
Gammagrafía de ventilación/perfusión

(A) Después de la inhalación de 20 mCi de gas Xenón -133, se obtuvieron imágenes gammagráficas en la proyección posterior , que muestran una ventilación uniforme a los pulmones.
(B) Después de la inyección intravenosa de 4 mCi de albúmina marcada con Tecnecio -99m , imágenes gammagráficas que se muestran aquí en la proyección posterior. Esta y otras vistas mostraron una actividad disminuida en múltiples regiones.
Una gammagrafía de ventilación/perfusión (o gammagrafía V/Q o gammagrafía pulmonar ) muestra que algunas áreas del pulmón están ventiladas pero no perfundidas con sangre (debido a la obstrucción por un coágulo). [19] Este tipo de examen es tan preciso como la TC multicorte, pero se utiliza menos debido a la mayor disponibilidad de la tecnología de TC. Es particularmente útil en personas alérgicas al contraste yodado , con función renal alterada o embarazadas (debido a su menor exposición a la radiación en comparación con la TC). [64] [65] [66] La prueba se puede realizar con imágenes bidimensionales planas o con tomografía computarizada por emisión de fotón único (SPECT), que permite obtener imágenes tridimensionales. [57] Los dispositivos híbridos que combinan SPECT y TC (SPECT/TC) permiten además la caracterización anatómica de cualquier anomalía. [67]
Pruebas diagnósticas de baja probabilidad/pruebas no diagnósticas
Pruebas que se realizan con frecuencia y que no son sensibles para la EP, pero que pueden ser diagnósticas.
- Las radiografías de tórax se realizan a menudo en personas con dificultad para respirar para ayudar a descartar otras causas, como insuficiencia cardíaca congestiva y fractura de costilla . Las radiografías de tórax en la EP rara vez son normales, [68] pero generalmente carecen de signos que sugieran el diagnóstico de EP (por ejemplo, signo de Westermark , joroba de Hampton ).
- Ecografía de las piernas, también conocida como Doppler de piernas, en busca de trombosis venosa profunda (TVP). La presencia de TVP, como se muestra en la ecografía de las piernas, es en sí suficiente para justificar la anticoagulación, sin requerir las tomografías computarizadas V/Q o espirales (debido a la fuerte asociación entre TVP y EP). Este puede ser un enfoque válido en el embarazo , en el que las otras modalidades aumentarían el riesgo de defectos de nacimiento en el feto. Sin embargo, una exploración negativa no descarta la EP, y puede ser necesaria una exploración con baja dosis de radiación si se considera que la madre tiene alto riesgo de tener una embolia pulmonar. Por lo tanto, el principal uso de la ecografía de las piernas es en aquellos con síntomas clínicos sugestivos de trombosis venosa profunda. [66]
Angiografía pulmonar fluoroscópica

Históricamente, el estándar de oro para el diagnóstico era la angiografía pulmonar por fluoroscopia , pero ésta ha caído en desuso con la mayor disponibilidad de técnicas no invasivas que ofrecen una precisión diagnóstica similar. [69]
Electrocardiograma

El uso principal del ECG es descartar otras causas de dolor torácico. [70] Un electrocardiograma (ECG) se realiza rutinariamente en personas con dolor torácico para diagnosticar rápidamente infartos de miocardio (ataques cardíacos), un diagnóstico diferencial importante en un individuo con dolor torácico. Si bien pueden ocurrir ciertos cambios en el ECG con EP, ninguno es lo suficientemente específico para confirmar o lo suficientemente sensible para descartar el diagnóstico. [70] Un ECG puede mostrar signos de distensión del corazón derecho o cor pulmonale agudo en casos de EP grandes: los signos clásicos son una onda S grande en la derivación I, una onda Q grande en la derivación III y una onda T invertida en la derivación III (S1Q3T3), que ocurre en el 12-50% de las personas con el diagnóstico, pero también ocurre en el 12% sin el diagnóstico. [71] [72]
Esto se presenta ocasionalmente (ocurre en hasta el 20% de las personas), pero también puede ocurrir en otras afecciones pulmonares agudas y, por lo tanto, tiene un valor diagnóstico limitado. Los signos que se observan con más frecuencia en el ECG son taquicardia sinusal , desviación del eje a la derecha y bloqueo de la rama derecha del haz de His . [73] Sin embargo, la taquicardia sinusal todavía se encuentra solo en el 8-69% de las personas con EP. [74]
Los hallazgos del ECG asociados con embolias pulmonares pueden sugerir un peor pronóstico ya que los seis hallazgos identificados con la tensión del ventrículo derecho en el ECG (frecuencia cardíaca > 100 latidos por minuto, S1Q3T3, ondas T invertidas en las derivaciones V1-V4, elevación del segmento ST en aVR, bloqueo completo de rama derecha y fibrilación auricular) se asocian con un mayor riesgo de shock circulatorio y muerte. [75]
Los casos con T invertida en las derivaciones V 1-3 se sospechan de EP o infarto de miocardio inferior. Los casos de EP muestran ondas T invertidas en las derivaciones II y aV F , pero los casos de infarto de miocardio inferior no muestran ondas T invertidas en II y aV F . [76]
Ecocardiografía
En la EP masiva y submasiva, la disfunción del lado derecho del corazón puede verse en la ecocardiografía , una indicación de que la arteria pulmonar está gravemente obstruida y el ventrículo derecho , una bomba de baja presión, no puede igualar la presión. Algunos estudios (ver a continuación) sugieren que este hallazgo puede ser una indicación de trombolisis . No todas las personas con una embolia pulmonar (sospechada) requieren un ecocardiograma, pero las elevaciones de las troponinas cardíacas o del péptido natriurético cerebral pueden indicar un esfuerzo cardíaco y justificar un ecocardiograma, [77] y ser importantes en el pronóstico. [78]
La apariencia específica del ventrículo derecho en la ecocardiografía se conoce como el signo de McConnell . Se trata del hallazgo de acinesia de la pared media libre pero un movimiento normal del ápex. Este fenómeno tiene una sensibilidad del 77% y una especificidad del 94% para el diagnóstico de embolia pulmonar aguda en el contexto de disfunción ventricular derecha. [79]

- Ecografía del corazón que muestra signos de EP [80]
- Ecografía del corazón que muestra signos de EP [80]
Prevención
La embolia pulmonar puede prevenirse en aquellas personas con factores de riesgo. Las personas hospitalizadas pueden recibir medicación preventiva, incluida heparina no fraccionada , heparina de bajo peso molecular (HBPM) o fondaparinux , y medias antitrombóticas para reducir el riesgo de una TVP en la pierna que podría desplazarse y migrar a los pulmones. [81]
Una vez finalizada la anticoagulación en aquellos con EP previa, la aspirina a largo plazo es útil para prevenir la recurrencia. [5]
Tratamiento
La terapia anticoagulante es la base del tratamiento. En casos agudos, pueden ser necesarios tratamientos de apoyo, como oxígeno o analgésicos . Las personas suelen ser hospitalizadas en las primeras etapas del tratamiento y tienden a permanecer bajo atención hospitalaria hasta que el INR haya alcanzado niveles terapéuticos (si se utiliza warfarina). Sin embargo, cada vez más, los casos de bajo riesgo se tratan en casa de una manera ya común en el tratamiento de la TVP. [5] [82] La evidencia que apoya un enfoque frente al otro es débil. [83] [ necesita actualización ]
Anticoagulación
La terapia anticoagulante es la base del tratamiento. Durante muchos años, los antagonistas de la vitamina K (warfarina o con menos frecuencia acenocumarol o fenprocumón ) han sido la piedra angular. Como los antagonistas de la vitamina K no actúan de inmediato, el tratamiento inicial se realiza con anticoagulantes inyectables de acción rápida: heparina no fraccionada (HNF), heparina de bajo peso molecular (HBPM) o fondaparinux , mientras que los antagonistas orales de la vitamina K se inician y se titulan (generalmente como parte de la atención hospitalaria para pacientes internados) hasta el índice internacional normalizado , una prueba que determina la dosis. [5] En términos de tratamientos inyectables, la HBPM puede reducir el sangrado entre las personas con embolia pulmonar en comparación con la HNF. [84] Según la misma revisión, la HBPM redujo la incidencia de complicaciones trombóticas recurrentes y redujo el tamaño del trombo en comparación con la heparina. No hubo diferencias en la mortalidad general entre los participantes tratados con HBPM y los tratados con heparina no fraccionada. [84] Los antagonistas de la vitamina K requieren un ajuste frecuente de la dosis y la monitorización del índice internacional normalizado (INR). En la EP, los INR entre 2,0 y 3,0 se consideran generalmente ideales. [5] Si se produce otro episodio de EP durante el tratamiento con warfarina, la ventana de INR puede aumentarse a, por ejemplo, 2,5-3,5 (a menos que haya contraindicaciones) [ cita requerida ] o se puede cambiar la anticoagulación a un anticoagulante diferente, por ejemplo, HBPM. [5]
En los últimos años, se han introducido muchos anticoagulantes que ofrecen una eficacia similar a la warfarina, pero sin necesidad de ajuste de la dosis según el INR. Conocidos como anticoagulantes orales de acción directa , estos tratamientos son ahora preferidos por las guías profesionales estadounidenses a los antagonistas de la vitamina K. [5] Dos de ellos ( rivaroxabán y apixabán ) no requieren tratamiento inicial con heparina o fondaparinux, mientras que dabigatrán y edoxabán sí lo requieren. [5] Una revisión Cochrane encontró que no hay evidencia de una diferencia entre los ITD orales (dabigatrán, rivaroxabán, edoxabán, apixabán) y la anticoagulación estándar en la prevención de la embolia pulmonar recurrente. [85]
En personas con cáncer que desarrollan embolia pulmonar, se prefiere la terapia con un ciclo de HBPM sobre la warfarina u otros anticoagulantes orales. [5] [86] De manera similar, las mujeres embarazadas son tratadas con heparina de bajo peso molecular hasta después del parto para evitar los efectos teratogénicos conocidos de la warfarina, especialmente en las primeras etapas del embarazo, pero se puede utilizar durante la lactancia. [66]
La terapia anticoagulante suele continuar durante 3 a 6 meses, o "de por vida" si ha habido TVP o EP previos, o no está presente ninguno de los factores de riesgo transitorios habituales. [5] [86] En aquellos sin una causa conocida que pueda revertirse, 2 años de tratamiento pueden ser mejores que 6 meses. [87] Para aquellos con EP pequeños (conocidos como EP subsegmentarios) se desconocen los efectos de la anticoagulación, ya que no se ha estudiado adecuadamente hasta 2020. [88]
Trombólisis
La EP masiva que causa inestabilidad hemodinámica (shock y/o presión arterial baja, definida como una presión arterial sistólica <90 mmHg o una caída de presión de 40 mmHg durante >15 min si no es causada por arritmia de nueva aparición, hipovolemia o sepsis) es una indicación para trombólisis , la destrucción enzimática del coágulo con medicación. En esta situación, es el mejor tratamiento disponible en aquellos sin contraindicaciones y está respaldado por las guías clínicas. [36] [86] [89] También se recomienda en aquellos en paro cardíaco con una EP conocida. [90] La trombólisis dirigida por catéter (TDC) es una nueva técnica que se ha encontrado que es relativamente segura y efectiva para las EP masivas. Esto implica acceder al sistema venoso colocando un catéter en una vena en la ingle y guiándolo a través de las venas utilizando imágenes fluoroscópicas hasta que se ubica junto a la EP en la circulación pulmonar. El medicamento que disuelve los coágulos sanguíneos se libera a través del catéter de modo que su concentración más alta esté directamente al lado del émbolo pulmonar. La CDT es realizada por radiólogos intervencionistas o cirujanos vasculares , y en los centros médicos que ofrecen CDT, puede ofrecerse como tratamiento de primera línea. [91] Se está investigando la trombólisis asistida por ultrasonido basada en catéter. [92]
El uso de la trombolisis en EP no masivas aún es objeto de debate. [93] [94] Algunos han descubierto que el tratamiento disminuye el riesgo de muerte y aumenta el riesgo de sangrado, incluida la hemorragia intracraneal . [95] Otros no han encontrado ninguna disminución en el riesgo de muerte. [94]
Filtro de vena cava inferior

Hay dos situaciones en las que se considera ventajoso un filtro de vena cava inferior : si la terapia anticoagulante está contraindicada (por ejemplo, poco después de una operación importante) o si una persona tiene una embolia pulmonar a pesar de estar anticoagulada. [86] En estos casos, se puede implantar para evitar que las TVP nuevas o existentes entren en la arteria pulmonar y se combinen con un bloqueo existente. [86] A pesar de la ventaja teórica del dispositivo de prevenir las embolias pulmonares, no hay evidencia que respalde su eficacia. [96]
Los filtros de la vena cava inferior deben retirarse tan pronto como sea seguro comenzar a utilizar anticoagulantes. [86] Aunque los filtros modernos están pensados para ser recuperables, algunas complicaciones pueden impedir que se retiren algunos. No se conoce el perfil de seguridad a largo plazo de dejar un filtro permanentemente dentro del cuerpo. [96]
Cirugía
El tratamiento quirúrgico de la embolia pulmonar aguda ( trombectomía pulmonar ) es poco común y se ha abandonado en gran medida debido a los malos resultados a largo plazo. Sin embargo, recientemente ha experimentado un resurgimiento con la revisión de la técnica quirúrgica y se cree que beneficia a ciertas personas. [97] La embolia pulmonar crónica que conduce a hipertensión pulmonar (conocida como hipertensión tromboembólica crónica ) se trata con un procedimiento quirúrgico conocido como tromboendarterectomía pulmonar . [98]
Pronóstico

Menos del 5 al 10% de las EP sintomáticas son fatales dentro de la primera hora de síntomas. [36] [90]
Existen varios marcadores que se utilizan para la estratificación del riesgo y que también son predictores independientes de resultados adversos. Entre ellos se incluyen la hipotensión, el shock cardiogénico, el síncope, la evidencia de disfunción del corazón derecho y las enzimas cardíacas elevadas. [36] Algunos cambios en el ECG, incluido el S1Q3T3 , también se correlacionan con un peor pronóstico a corto plazo. [23] Se ha considerado que otros factores relacionados con el paciente, como la EPOC y la insuficiencia cardíaca crónica, también desempeñan un papel en el pronóstico. [36]
El pronóstico depende de la cantidad de pulmón afectado y de la coexistencia de otras afecciones médicas; la embolización crónica del pulmón puede provocar hipertensión pulmonar . Después de una EP masiva, el émbolo debe resolverse de alguna manera para que el paciente sobreviva. En la EP trombótica, el coágulo sanguíneo puede descomponerse por fibrinólisis , o puede organizarse y recanalizarse de modo que se forme un nuevo canal a través del coágulo. El flujo sanguíneo se restablece más rápidamente en el primer o segundo día después de una EP. [99] La mejoría se ralentiza a partir de entonces y algunos déficits pueden ser permanentes. Existe controversia sobre si las EP subsegmentarias pequeñas necesitan tratamiento o no [100] y existe cierta evidencia de que los pacientes con EP subsegmentarias pueden evolucionar bien sin tratamiento. [62] [101]
Una vez que se suspende la anticoagulación, el riesgo de una embolia pulmonar mortal es del 0,5 % por año. [102]
Se dice que la mortalidad por EP no tratada fue del 26%. Esta cifra proviene de un ensayo publicado en 1960 por Barrit y Jordan, que comparó la anticoagulación con placebo para el tratamiento de la EP. Barritt y Jordan realizaron su estudio en el Bristol Royal Infirmary en 1957. [103] Este estudio es el único ensayo controlado con placebo que jamás se ha realizado para examinar el lugar de los anticoagulantes en el tratamiento de la EP, cuyos resultados fueron tan convincentes que el ensayo nunca se ha repetido, por lo que hacerlo se consideraría poco ético. [ cita requerida ] Dicho esto, la tasa de mortalidad informada del 26% en el grupo placebo es probablemente una exageración, dado que la tecnología de la época puede haber detectado solo EP graves. [104]
Predicción de la mortalidad
Las herramientas de puntuación PESI y sPESI (= Índice de Gravedad de Embolia Pulmonar simplificado) permiten estimar la mortalidad de los pacientes. Las reglas de predicción de Ginebra y los criterios de Wells se utilizan para calcular una probabilidad previa a la prueba de los pacientes para predecir quién tiene una embolia pulmonar. Estas puntuaciones son herramientas que se deben utilizar con criterio clínico para decidir las pruebas diagnósticas y los tipos de terapia. [105] El algoritmo PESI comprende 11 variables clínicas disponibles de forma rutinaria. [106] Coloca a los sujetos en una de cinco clases (I–V), con una mortalidad a 30 días que varía de 1,1% a 24,5%. Aquellos en las clases I y II son de bajo riesgo y aquellos en las clases III–V son de alto riesgo. [106]
Epidemiología
Cada año se producen aproximadamente 10 millones de casos de embolias pulmonares. [26] En Estados Unidos, las embolias pulmonares son la causa principal de al menos 10 000 a 12 000 muertes al año y contribuyen a al menos 30 000 a 40 000 muertes al año. [9] Se desconoce la incidencia real de las embolias pulmonares porque a menudo no se diagnostican o pasan desapercibidas hasta la autopsia. [26] Entre 1993 y 2012, ha habido un aumento en el número de admisiones en hospitales debido a embolias pulmonares, que han pasado de 23 casos por cada 100 000 personas a 65 casos por cada 100 000 personas. [26] A pesar de este aumento, ha habido una disminución de la mortalidad durante ese mismo período de tiempo debido a los avances médicos que se han producido. [26]
La tromboembolia venosa (TEV), un factor de riesgo común, está presente en tasas mucho más altas en personas mayores de 70 años (tres veces más alta en comparación con las personas de 45 a 69 años). [26] Esto probablemente se deba a que existe un nivel generalmente más bajo de actividad entre los ancianos, lo que resulta en tasas más altas de inmovilidad y obesidad. [26] La TEV tiene una tasa de letalidad alta y en continuo aumento. [26] Esta tasa es de aproximadamente el 10% después de 30 días, el 15% después de tres meses y hasta el 20% después de un año. [26] Las embolias pulmonares por sí solas (cuando resultan en hospitalizaciones) tienen una tasa de letalidad de aproximadamente el 5% al 10%, por lo que la TEV puede desempeñar un papel importante en la gravedad de las embolias. [26]
Si se consideran todos los casos, la tasa de embolias pulmonares fatales ha disminuido del 6% al 2% en los últimos 25 años en los Estados Unidos. [107] En Europa, se informó un promedio de aproximadamente 40.000 muertes por año con embolia pulmonar como causa principal entre 2013 y 2015, una estimación conservadora debido al posible subdiagnóstico. [10]
Referencias
- ^ abc "¿Cuáles son los signos y síntomas de la embolia pulmonar?". NHLBI . 1 de julio de 2011. Archivado desde el original el 9 de marzo de 2016. Consultado el 12 de marzo de 2016 .
- ^ abcde Goldhaber SZ (2005). "Tromboembolia pulmonar". En Kasper DL, Braunwald E, Fauci AS, et al. (eds.). Harrison's Principles of Internal Medicine (16.ª ed.). Nueva York: McGraw-Hill. págs. 1561–65. ISBN 978-0-07-139140-5.
- ^ abcde "¿Quién corre riesgo de sufrir embolia pulmonar?". NHLBI . 1 de julio de 2011. Archivado desde el original el 15 de febrero de 2016. Consultado el 12 de marzo de 2016 .
- ^ abcd "¿Cómo se diagnostica la embolia pulmonar?". NHLBI . 1 de julio de 2011. Archivado desde el original el 7 de abril de 2016. Consultado el 12 de marzo de 2016 .
- ^ abcdefghijkl Kearon C, Akl EA, Ornelas J, Blaivas A, Jimenez D, Bounameaux H, et al. (febrero de 2016). "Terapia antitrombótica para la enfermedad de TEV: guía CHEST e informe del panel de expertos". Chest . 149 (2): 315–52. doi :10.1016/j.chest.2015.11.026. PMID 26867832.
- ^ abcd "¿Qué es la embolia pulmonar?". NHLBI . 1 de julio de 2011. Archivado desde el original el 12 de marzo de 2016. Consultado el 12 de marzo de 2016 .
- ^ ab Rahimtoola A, Bergin JD (febrero de 2005). "Embolia pulmonar aguda: actualización sobre diagnóstico y tratamiento". Problemas actuales en cardiología . 30 (2): 61–114. doi :10.1016/j.cpcardiol.2004.06.001. PMID 15650680.
- ^ ab Raskob GE, Angchaisuksiri P, Blanco AN, Buller H, Gallus A, Hunt BJ, et al. (noviembre de 2014). "Trombosis: un importante contribuyente a la carga mundial de enfermedad". Arteriosclerosis, trombosis y biología vascular . 34 (11): 2363–71. doi : 10.1161/atvbaha.114.304488 . PMID 25304324.
- ^ abc Barco S, Valerio L, Ageno W, Cohen AT, Goldhaber SZ, Hunt BJ, et al. (octubre de 2020). "Mortalidad relacionada con la embolia pulmonar específica por edad y sexo en los EE. UU. y Canadá, 2000-18: un análisis de la base de datos de mortalidad de la OMS y de la base de datos de causas múltiples de muerte de los CDC". The Lancet. Medicina respiratoria . 9 (1): 33–42. doi :10.1016/S2213-2600(20)30417-3. PMC 7550106 . PMID 33058771.
- ^ ab Barco S, Mahmoudpour SH, Valerio L, Klok FA, Münzel T, Middeldorp S, et al. (marzo de 2020). "Tendencias en la mortalidad relacionada con la embolia pulmonar en la región europea, 2000-15: análisis de los datos del registro civil de la base de datos de mortalidad de la OMS". The Lancet. Medicina respiratoria . 8 (3): 277–87. doi :10.1016/S2213-2600(19)30354-6. hdl : 1887/3637096 . PMID: 31615719. S2CID : 204740186.
- ^ Tintinalli JE (2010). Medicina de urgencias: una guía de estudio completa (Medicina de urgencias (Tintinalli)) (7.ª ed.). Nueva York: McGraw-Hill Companies. pág. 432. ISBN 978-0-07-148480-0.
- ^ Di Nisio, Marcello; Van Es, Nick; Büller, Harry R. (30 de junio de 2016). "Trombosis venosa profunda y embolia pulmonar". The Lancet . 388 (10063): 3060–3073. doi :10.1016/S0140-6736(16)30514-1. PMID 27375038. S2CID 25712161 . Consultado el 18 de noviembre de 2022 .
- ^ "¿Qué causa la embolia pulmonar?". NHLBI . 1 de julio de 2011. Archivado desde el original el 7 de abril de 2016. Consultado el 12 de marzo de 2016 .
- ^ Pantaleo G, Luigi N, Federica T, Paola S, Margherita N, Tahir M (2014). "Embolia de líquido amniótico: revisión". Biotecnología farmacéutica actual . 14 (14): 1163–67. doi :10.2174/1389201015666140430161404. PMID 24804726.
- ^ "Otros nombres de la embolia pulmonar". 1 de julio de 2011. Archivado desde el original el 16 de marzo de 2016 . Consultado el 12 de marzo de 2016 .
- ^ "¿Cómo se puede prevenir la embolia pulmonar?". NHLBI . 1 de julio de 2011. Archivado desde el original el 7 de abril de 2016. Consultado el 12 de marzo de 2016 .
- ^ Tarbox, Abigail K; Swaroop, Mamta (2013). "Embolia pulmonar". Revista internacional de enfermedades críticas y ciencia de lesiones . 3 (1): 69–72. doi : 10.4103/2229-5151.109427 . PMC: 3665123. PMID: 23724389 .
- ^ ab "¿Cómo se trata la embolia pulmonar?". NHLBI . 1 de julio de 2011. Archivado desde el original el 9 de marzo de 2016. Consultado el 12 de marzo de 2016 .
- ^ ab Lewis S, Dirksen S, Heitkemper M, Bucher L (2014). Enfermería médico-quirúrgica: evaluación y gestión de problemas clínicos (novena edición). St. Louis, MO: Elsevier Mosby. pág. 552. ISBN 978-0-323-08678-3.
- ^ Oqab Z, Ganshorn H, Sheldon R (abril de 2018). "Prevalencia de embolia pulmonar en pacientes que presentan síncope. Una revisión sistemática y un metanálisis". The American Journal of Emergency Medicine . 36 (4): 551–55. doi :10.1016/j.ajem.2017.09.015. PMID 28947223. S2CID 5012417.
- ^ Stein PD, Sostman HD, Hull RD, Goodman LR, Leeper KV, Gottschalk A, et al. (marzo de 2009). "Diagnóstico de embolia pulmonar en la unidad de cuidados coronarios". The American Journal of Cardiology . 103 (6): 881–86. doi :10.1016/j.amjcard.2008.11.040. PMC 2717714 . PMID 19268750.
- ^ Pregerson DB, Quick Essentials: Emergency Medicine , 4.ª edición. EMresource.org [ ISBN faltante ] [ página necesaria ]
- ^ ab Jaff MR, McMurtry MS, Archer SL, Cushman M, Goldenberg N, Goldhaber SZ, et al. (abril de 2011). "Manejo de la embolia pulmonar masiva y submasiva, la trombosis venosa profunda iliofemoral y la hipertensión pulmonar tromboembólica crónica: una declaración científica de la American Heart Association". Circulation . 123 (16). Consejo de la American Heart Association sobre cardiopulmonar, cuidados críticos, perioperatorios y reanimación, Consejo de la American Heart Association sobre enfermedades vasculares periféricas, Consejo de la American Heart Association sobre arteriosclerosis, trombosis y biología vascular: 1788–830. doi : 10.1161/CIR.0b013e318214914f . PMID 21422387.
- ^ Ferri F (2012). Asesor clínico de Ferri . St. Louis: Mosby's.
- ^ Saleem T, Baril DT (2021). "Síndrome de Paget-Schroetter". StatPearls [Internet] . Treasure Island (Florida): StatPearls Publishing. PMID 29494023.
- ^ abcdefghijklmnopqrs Turetz M, Sideris AT, Friedman OA, Triphathi N, Horowitz JM (junio de 2018). "Epidemiología, fisiopatología e historia natural de la embolia pulmonar". Seminarios en radiología intervencionista . 35 (2): 92–98. doi :10.1055/s-0038-1642036. PMC 5986574. PMID 29872243 .
- ^ ab Archer DF, Oger E (junio de 2012). "Efecto del estrógeno y el progestágeno en la tromboembolia venosa en mujeres menopáusicas". Climaterio . 15 (3): 235–240. doi :10.3109/13697137.2012.664401. PMID 22612609. S2CID 43061502.
- ^ ab Tchaikovski SN, Rosing J (julio de 2010). "Mecanismos de tromboembolia venosa inducida por estrógenos". Investigación sobre la trombosis . 126 (1): 5–11. doi :10.1016/j.thromres.2010.01.045. PMID 20163835.
- ^ ab Nolan BJ, Cheung AS (septiembre de 2020). "Terapia con estradiol en el período perioperatorio: implicaciones para las personas transgénero que se someten a terapia hormonal feminizante". The Yale Journal of Biology and Medicine . 93 (4): 539–548. PMC 7513447 . PMID 33005118.
- ^ abcd Toplis E, Mortimore G (enero de 2020). "El diagnóstico y el tratamiento de la embolia pulmonar". British Journal of Nursing . 29 (1): 22–26. doi :10.12968/bjon.2020.29.1.22. hdl :10545/624428. PMID 31917939. S2CID 210131969.
- ^ "Émbolo pulmonar". Enciclopedia Médica MedlinePlus . Archivado desde el original el 25 de abril de 2017. Consultado el 24 de abril de 2017 .
- ^ abc Colegio Americano de Radiología . "Cinco cosas que los médicos y los pacientes deberían cuestionar" (PDF) . Elegir sabiamente: una iniciativa de la Fundación ABIM . Colegio Americano de Radiología . Archivado (PDF) del original el 16 de abril de 2012. Consultado el 17 de agosto de 2012 .
- ^ ab Raja AS, Greenberg JO, Qaseem A, Denberg TD, Fitterman N, Schuur JD (noviembre de 2015). "Evaluación de pacientes con sospecha de embolia pulmonar aguda: recomendaciones de mejores prácticas del Comité de pautas clínicas del Colegio Americano de Médicos". Anales de Medicina Interna . 163 (9): 701–11. doi : 10.7326/M14-1772 . PMID 26414967.
- ^ abcd Ullah S, Jan SU, Rehman HU, Butt NI, Rauf MA, Shah S, Jan MY (marzo de 2019). "Productividad de la investigación en la revista Pakistan Heart Journal de 2005 a 2018: un estudio cienciométrico". Pakistan Heart Journal . 52 (2). doi :10.47144/phj.v52i2.1763 (inactivo el 1 de noviembre de 2024).
{{cite journal}}: CS1 maint: DOI inactive as of November 2024 (link) - ^ abcdefg Stein PD, Woodard PK, Weg JG, Wakefield TW, Tapson VF, Sostman HD, et al. (enero de 2007). "Vías diagnósticas en la embolia pulmonar aguda: recomendaciones de los investigadores de PIOPED II". Radiología . 242 (1): 15–21. doi :10.1148/radiol.2421060971. PMID 17185658.
- ^ abcde Konstantinides SV, Torbicki A, Agnelli G, Danchin N, Fitzmaurice D, Galiè N, et al. (noviembre de 2014). "Guías ESC 2014 sobre el diagnóstico y el tratamiento de la embolia pulmonar aguda". European Heart Journal . 35 (43): 3033–69, 3069a–69k. doi : 10.1093/eurheartj/ehu283 . PMID 25173341.
- ^ ab Wells PS, Hirsh J, Anderson DR, Lensing AW, Foster G, Kearon C, et al. (mayo de 1995). "Precisión de la evaluación clínica de la trombosis venosa profunda". Lancet . 345 (8961): 1326–30. doi :10.1016/S0140-6736(95)92535-X. PMID 7752753. S2CID 23107192.
- ^ ab Wells PS, Ginsberg JS, Anderson DR, Kearon C, Gent M, Turpie AG, et al. (diciembre de 1998). "Uso de un modelo clínico para el tratamiento seguro de pacientes con sospecha de embolia pulmonar". Anales de Medicina Interna . 129 (12): 997–1005. doi :10.7326/0003-4819-129-12-199812150-00002. PMID 9867786. S2CID 41389736.
- ^ abcde Wells PS, Anderson DR, Rodger M, Ginsberg JS, Kearon C, Gent M, et al. (marzo de 2000). "Derivación de un modelo clínico simple para categorizar la probabilidad de embolismo pulmonar de los pacientes: aumento de la utilidad de los modelos con el dímero D SimpliRED". Trombosis y hemostasia . 83 (3): 416–20. doi :10.1055/s-0037-1613830. PMID 10744147. S2CID 10013631.
- ^ ab Wells PS, Anderson DR, Rodger M, Stiell I, Dreyer JF, Barnes D, et al. (julio de 2001). "Exclusión de embolia pulmonar en la cabecera del paciente sin diagnóstico por imagen: tratamiento de pacientes con sospecha de embolia pulmonar que acuden al servicio de urgencias mediante un modelo clínico simple y dímero D". Anales de Medicina Interna . 135 (2): 98–107. doi :10.7326/0003-4819-135-2-200107170-00010. PMID 11453709. S2CID 2708155.
- ^ Sanson BJ, Lijmer JG, Mac Gillavry MR, Turkstra F, Prins MH, Büller HR (febrero de 2000). "Comparación de una estimación de probabilidad clínica y dos modelos clínicos en pacientes con sospecha de embolia pulmonar. Grupo de estudio ANTELOPE". Trombosis y hemostasia . 83 (2): 199–203. doi :10.1055/s-0037-1613785. PMID 10739372. S2CID 26531577.
- ^ ab van Belle A, Büller HR, Huisman MV, Huisman PM, Kaasjager K, Kamphuisen PW, et al. (enero de 2006). "Eficacia del tratamiento de la embolia pulmonar sospechada mediante un algoritmo que combina probabilidad clínica, pruebas de dímero D y tomografía computarizada". JAMA . 295 (2): 172–79. doi : 10.1001/jama.295.2.172 . PMID 16403929.
- ^ Roy PM, Meyer G, Vielle B, Le Gall C, Verschuren F, Carpentier F, et al. (febrero de 2006). "Idoneidad del tratamiento diagnóstico y resultados de la embolia pulmonar sospechada". Anales de Medicina Interna . 144 (3): 157–64. CiteSeerX 10.1.1.1032.7193 . doi :10.7326/0003-4819-144-3-200602070-00003. PMID 16461959. S2CID 38894349.
- ^ Neff MJ (agosto de 2003). "ACEP publica una política clínica sobre evaluación y tratamiento de la embolia pulmonar". American Family Physician . 68 (4): 759–60. PMID 12952389. Archivado desde el original el 26 de septiembre de 2007.
- ^ ab Yap KS, Kalff V, Turlakow A, Kelly MJ (septiembre de 2007). "Una reevaluación prospectiva de la utilidad de la escala Wells para identificar la embolia pulmonar". The Medical Journal of Australia . 187 (6): 333–6. doi :10.5694/j.1326-5377.2007.tb01274.x. PMID 17874979. S2CID 17476982.
- ^ van Es N, van der Hulle T, Büller HR, Klok FA, Huisman MV, Galipienzo J, Di Nisio M (febrero de 2017). "¿Es segura la prueba de dímero D independiente para descartar una embolia pulmonar aguda?". Journal of Thrombosis and Haemostasis . 15 (2): 323–28. doi : 10.1111/jth.13574 . PMID 27873439.
- ^ ab Kline JA, Courtney DM, Kabrhel C, Moore CL, Smithline HA, Plewa MC, et al. (mayo de 2008). "Evaluación multicéntrica prospectiva de los criterios de descarte de embolia pulmonar". Journal of Thrombosis and Haemostasis . 6 (5): 772–80. doi : 10.1111/j.1538-7836.2008.02944.x . PMID 18318689. S2CID 25488146.
- ^ Kline JA, Mitchell AM, Kabrhel C, Richman PB, Courtney DM (agosto de 2004). "Criterios clínicos para prevenir pruebas diagnósticas innecesarias en pacientes del servicio de urgencias con sospecha de embolia pulmonar". Journal of Thrombosis and Haemostasis . 2 (8): 1247–55. doi :10.1111/j.1538-7836.2004.00790.x. PMID 15304025. S2CID 19311896.
- ^ Carrier M, Righini M, Djurabi RK, Huisman MV, Perrier A, Wells PS, et al. (mayo de 2009). "Dímero D VIDAS en combinación con probabilidad clínica previa a la prueba para descartar embolia pulmonar. Una revisión sistemática de estudios de resultados de manejo". Trombosis y hemostasia . 101 (5): 886–92. doi :10.1160/TH-08-10-0689. PMID 19404542. S2CID 23851417.
- ^ Schrecengost JE, LeGallo RD, Boyd JC, Moons KG, Gonias SL, Rose CE, Bruns DE (septiembre de 2003). "Comparación de la precisión diagnóstica en pacientes ambulatorios y hospitalizados de las pruebas de dímero D para la evaluación de la sospecha de embolia pulmonar". Química clínica . 49 (9): 1483–90. doi : 10.1373/49.9.1483 . PMID 12928229.
- ^ Crawford F, Andras A, Welch K, Sheares K, Keeling D, Chappell FM, et al. (Grupo Vascular Cochrane) (agosto de 2016). "Prueba del dímero D para excluir el diagnóstico de embolia pulmonar". Base de Datos Cochrane de Revisiones Sistemáticas . 2016 (8): CD010864. doi :10.1002/14651858.CD010864.pub2. PMC 6457638. PMID 27494075 .
- ^ ab Schouten HJ, Geersing GJ, Koek HL, Zuithoff NP, Janssen KJ, Douma RA, et al. (mayo de 2013). "Precisión diagnóstica de los valores de corte del dímero D convencionales o ajustados por edad en pacientes mayores con sospecha de tromboembolia venosa: revisión sistemática y metanálisis". BMJ . 346 : f2492. doi :10.1136/bmj.f2492. PMC 3643284 . PMID 23645857.
- ^ van Es N, van der Hulle T, van Es J, den Exter PL, Douma RA, Goekoop RJ, et al. (agosto de 2016). "Regla de Wells y prueba del dímero D para descartar embolia pulmonar: una revisión sistemática y un metanálisis de datos de pacientes individuales". Annals of Internal Medicine . 165 (4): 253–61. doi :10.7326/m16-0031. PMID 27182696. S2CID 207538572.
- ^ Werman HA, Karren K, Mistovich J (2014). "Otras afecciones que causan dificultad respiratoria: embolia pulmonar". En Howard WA, Mistovich J, Karren K (eds.). Atención de emergencia prehospitalaria, 10.ª edición . Pearson Education , Inc., pág. 456.
- ^ Söhne M, Ten Wolde M, Büller HR (noviembre de 2004). "Biomarcadores en la embolia pulmonar". Current Opinion in Cardiology . 19 (6): 558–62. doi :10.1097/01.hco.0000138991.82347.0e. PMID 15502498. S2CID 39899682.
- ^ ab Torbicki A, Perrier A, Konstantinides S, Agnelli G, Galiè N, Pruszczyk P, et al. (septiembre de 2008). "Directrices para el diagnóstico y el tratamiento de la embolia pulmonar aguda: el grupo de trabajo para el diagnóstico y el tratamiento de la embolia pulmonar aguda de la Sociedad Europea de Cardiología (ESC)". Revista Europea del Corazón . 29 (18): 2276–315. doi : 10.1093/eurheartj/ehn310 . PMID 18757870.
- ^ ab Stein PD, Freeman LM, Sostman HD, Goodman LR, Woodard PK, Naidich DP, et al. (diciembre de 2009). "SPECT en embolia pulmonar aguda". Revista de Medicina Nuclear (Revisión). 50 (12): 1999–2007. doi : 10.2967/jnumed.109.063958 . PMID 19949025.
- ^ Da Costa Rodrigues J, Alzuphar S, Combescure C, Le Gal G, Perrier A (septiembre de 2016). "Características diagnósticas de la ecografía de compresión venosa de miembros inferiores en casos de sospecha de embolia pulmonar: un metaanálisis". Journal of Thrombosis and Haemostasis . 14 (9): 1765–72. doi : 10.1111/jth.13407 . PMID 27377039.
- ^ van Mens TE, Scheres LJ, de Jong PG, Leeflang MM, Nijkeuter M, Middeldorp S, et al. (Grupo Vascular Cochrane) (enero de 2017). "Imágenes para la exclusión de embolia pulmonar en el embarazo". Base de Datos Cochrane de Revisiones Sistemáticas . 1 (1): CD011053. doi :10.1002/14651858.CD011053.pub2. PMC 6464730 . PMID 28124411.
- ^ Schaefer-Prokop C, Prokop M (noviembre de 2005). "MDCT para el diagnóstico de la embolia pulmonar aguda". Radiología europea . 15 (Supl 4): D37–41. doi :10.1007/s10406-005-0144-3. PMID 16479644. S2CID 6074.
- ^ Van Strijen MJ, De Monye W, Kieft GJ, Pattynama PM, Prins MH, Huisman MV (enero de 2005). "Precisión de la TC espiral de detector único en el diagnóstico de embolia pulmonar: un estudio de cohorte multicéntrico prospectivo de pacientes consecutivos con gammagrafía de perfusión anormal". Journal of Thrombosis and Haemostasis . 3 (1): 17–25. doi : 10.1111/j.1538-7836.2004.01064.x . PMID 15634261. S2CID 38746246.
- ^ ab Stein PD, Fowler SE, Goodman LR, Gottschalk A, Hales CA, Hull RD, et al. (junio de 2006). "Tomografía computarizada con detector múltiple para la embolia pulmonar aguda". The New England Journal of Medicine . 354 (22): 2317–27. doi : 10.1056/NEJMoa052367 . PMID 16738268.
- ^ Anderson DR, Kahn SR, Rodger MA, Kovacs MJ, Morris T, Hirsch A, et al. (diciembre de 2007). "Angiografía pulmonar por tomografía computarizada frente a gammagrafía pulmonar con ventilación-perfusión en pacientes con sospecha de embolia pulmonar: un ensayo controlado aleatorizado". JAMA . 298 (23): 2743–53. doi : 10.1001/jama.298.23.2743 . PMID 18165667.
- ^ Scarsbrook AF, Gleeson FV (febrero de 2007). "Investigación de la sospecha de embolia pulmonar en el embarazo". BMJ . 334 (7590): 418–19. doi :10.1136/bmj.39071.617257.80. PMC 1804186 . PMID 17322258. Archivado desde el original el 4 de septiembre de 2007.
- ^ Leung AN, Bull TM, Jaeschke R, Lockwood CJ, Boiselle PM, Hurwitz LM, et al. (noviembre de 2011). "Guía oficial de práctica clínica de la American Thoracic Society/Society of Thoracic Radiology: evaluación de la sospecha de embolia pulmonar en el embarazo". American Journal of Respiratory and Critical Care Medicine . 184 (10): 1200–08. doi :10.1164/rccm.201108-1575ST. PMID 22086989.
- ^ abc Thomson AJ, Greer IA (abril de 2015). "Trombosis y embolia durante el embarazo y el puerperio: tratamiento agudo (Directriz Green-top n.º 37b)". Royal College of Obstetricians & Gynaecologists . Consultado el 4 de junio de 2018 .
- ^ Mortensen J, Gutte H (mayo de 2014). "SPECT/CT y embolia pulmonar". Revista Europea de Medicina Nuclear e Imágenes Moleculares . 41 (Supl 1): S81–S90. doi :10.1007/s00259-013-2614-5. PMC 4003400 . PMID 24213621.
- ^ Worsley DF, Alavi A, Aronchick JM, Chen JT, Greenspan RH, Ravin CE (octubre de 1993). "Hallazgos radiográficos de tórax en pacientes con embolia pulmonar aguda: observaciones del estudio PIOPED". Radiología . 189 (1): 133–36. doi :10.1148/radiology.189.1.8372182. PMID 8372182.
- ^ Konstantinides SV, Torbicki A, Agnelli G, Danchin N, Fitzmaurice D, Galiè N, et al. (noviembre de 2014). "Guías ESC 2014 sobre el diagnóstico y el tratamiento de la embolia pulmonar aguda". European Heart Journal . 35 (43): 3033–69, 3069a–69k. doi : 10.1093/eurheartj/ehu283 . PMID 25173341.
La angiografía pulmonar ha sido durante décadas el "patrón oro" para el diagnóstico o la exclusión de la EP, pero ahora rara vez se realiza ya que la angiografía por TC menos invasiva ofrece una precisión diagnóstica similar.
- ^ ab Brown G, Hogg K (octubre de 2005). "Informe temático con la mejor evidencia. Utilidad diagnóstica del electrocardiograma para diagnosticar la embolia pulmonar". Emergency Medicine Journal . 22 (10): 729–30. doi :10.1136/emj.2005.029041. PMC 1726554 . PMID 16189038.
- ^ Mattu A, Goyal D, eds. (2007). Medicina de urgencias: cómo evitar los obstáculos y mejorar los resultados. Malden, Mass.: Blackwell Pub./BMJ Books. pág. 9. ISBN 978-0470755174. Archivado desde el original el 8 de septiembre de 2017.
- ^ McGinn S, White PD (1935). "Cor pulmonale agudo resultante de embolia pulmonar". J Am Med Assoc . 104 (17): 1473–80. doi :10.1001/jama.1935.02760170011004.
- ^ Rodger M, Makropoulos D, Turek M, Quevillon J, Raymond F, Rasuli P, Wells PS (octubre de 2000). "Valor diagnóstico del electrocardiograma en caso de sospecha de embolia pulmonar". The American Journal of Cardiology . 86 (7): 807–09, A10. doi :10.1016/S0002-9149(00)01090-0. PMID 11018210.
- ^ Amal Mattu; Deepi Goyal; Barrett, Jeffrey W.; Josué Broder; DeAngelis, Michael; Peter Deblieux; Gus M. Garmel; Richard Harrigan; David Karras; Anita L'Italien; David Manthey (2007). Medicina de emergencia: evitar los peligros y mejorar los resultados . Malden, Mass: Blackwell Pub./BMJ Books. pag. 10.ISBN 978-1-4051-4166-6.
- ^ Shopp JD, Stewart LK, Emmett TW, Kline JA (octubre de 2015). "Hallazgos de la electrocardiografía de 12 derivaciones que predicen el shock circulatorio por embolia pulmonar: revisión sistemática y metanálisis". Medicina de emergencia académica . 22 (10): 1127–37. doi :10.1111/acem.12769. PMC 5306533 . PMID 26394330.
- ^ Kosuge M, Ebina T, Hibi K, Tsukahara K, Iwahashi N, Gohbara M, et al. (diciembre de 2012). "Diferencias en las ondas T negativas entre el síndrome coronario agudo, la embolia pulmonar aguda y la miocardiopatía de Takotsubo". European Heart Journal - Acute Cardiovascular Care . 1 (4): 349–57. doi :10.1177/2048872612466790. PMC 3760560 . PMID 24062927.
- ^ Kucher N, Goldhaber SZ (noviembre de 2003). "Biomarcadores cardíacos para la estratificación del riesgo de pacientes con embolia pulmonar aguda". Circulation . 108 (18): 2191–94. doi : 10.1161/01.CIR.0000100687.99687.CE . PMID 14597581.
- ^ Lankeit M, Jiménez D, Kostrubiec M, Dellas C, Hasenfuss G, Pruszczyk P, Konstantinides S (diciembre de 2011). "Valor predictivo del ensayo de troponina T de alta sensibilidad y el índice de gravedad de la embolia pulmonar simplificado en pacientes hemodinámicamente estables con embolia pulmonar aguda: un estudio de validación prospectivo". Circulation . 124 (24): 2716–24. doi : 10.1161/CIRCULATIONAHA.111.051177 . PMID 22082681.
- ^ McConnell MV, Solomon SD, Rayan ME, Come PC, Goldhaber SZ, Lee RT (agosto de 1996). "Disfunción regional del ventrículo derecho detectada por ecocardiografía en la embolia pulmonar aguda". The American Journal of Cardiology . 78 (4): 469–73. doi :10.1016/S0002-9149(96)00339-6. PMID 8752195.
- ^ ab "UOTW #2 Respuesta - Ultrasonido de la Semana". Ultrasonido de la Semana . 16 de junio de 2014. Archivado desde el original el 12 de enero de 2017. Consultado el 27 de mayo de 2017 .
- ^ Instituto Nacional de Salud y Excelencia Clínica . Guía clínica 92: Tromboembolia venosa: reducción del riesgo: Reducción del riesgo de tromboembolia venosa (trombosis venosa profunda y embolia pulmonar) en pacientes ingresados en el hospital . Londres, enero de 2010.
- ^ Vinson DR, Zehtabchi S, Yealy DM (noviembre de 2012). "¿Se puede tratar de forma segura a pacientes seleccionados con embolia pulmonar recién diagnosticada sin hospitalización? Una revisión sistemática". Anales de Medicina de Emergencia . 60 (5): 651–662.e4. doi :10.1016/j.annemergmed.2012.05.041. PMID 22944455.
- ^ Yoo HH, Queluz TH, El Dib R (enero de 2016). "Tratamiento anticoagulante para la embolia pulmonar subsegmentaria". Base de datos Cochrane de revisiones sistemáticas (1): CD010222. doi :10.1002/14651858.CD010222.pub3. PMC 7004894. PMID 26756331 .
- ^ ab Robertson L, Jones LE (febrero de 2017). "Heparinas subcutáneas de bajo peso molecular en dosis fijas versus heparina no fraccionada en dosis ajustadas para el tratamiento inicial de la tromboembolia venosa". Base de Datos Cochrane de Revisiones Sistemáticas . 2017 (2): CD001100. doi : 10.1002 /14651858.CD001100.pub4. PMC 6464611. PMID 28182249.
- ^ Li M, Li J, Wang X, Hui X, Wang Q, Xie S, et al. (abril de 2023). "Inhibidores directos de la trombina orales o inhibidores del factor Xa orales frente a anticoagulantes convencionales para el tratamiento de la embolia pulmonar". Base de datos Cochrane de revisiones sistemáticas . 2023 (4): CD010957. doi :10.1002/14651858.CD010957.pub3. PMC 10103165. PMID 37057837 .
- ^ abcdef Instituto Nacional de Salud y Excelencia Clínica . Guía clínica 144: Enfermedades tromboembólicas venosas: el tratamiento de las enfermedades tromboembólicas venosas y el papel de las pruebas de trombofilia . Londres, 2012.
- ^ Mai V, Guay CA, Perreault L, Bonnet S, Bertoletti L, Lacasse Y, et al. (junio de 2019). "Anticoagulación prolongada para TEV: una revisión sistemática y un metaanálisis". Chest . 155 (6): 1199–1216. doi :10.1016/j.chest.2019.02.402. PMID 31174635. S2CID 182950850.
- ^ Yoo HH, Nunes-Nogueira VS, Fortes Villas Boas PJ (febrero de 2020). "Tratamiento anticoagulante para la embolia pulmonar subsegmentaria". Base de datos Cochrane de revisiones sistemáticas . 2020 (2): CD010222. doi : 10.1002/14651858.CD010222.pub4. PMC 7004894. PMID 32030721.
- ^ Ucar EY (junio de 2019). "Actualización sobre la terapia trombolítica en la tromboembolia pulmonar aguda". The Eurasian Journal of Medicine . 51 (2): 186–190. doi :10.5152/eurasianjmed.2019.19291. PMC 6592452 . PMID 31258361.
- ^ ab Lavonas EJ, Drennan IR, Gabrielli A, Heffner AC, Hoyte CO, Orkin AM, et al. (noviembre de 2015). "Parte 10: Circunstancias especiales de reanimación: actualización de las pautas de la American Heart Association de 2015 para reanimación cardiopulmonar y atención cardiovascular de emergencia". Circulation . 132 (18 Suppl 2): S501–S518. doi : 10.1161/cir.0000000000000264 . PMID 26472998. S2CID 207614432.
- ^ Kuo WT, Gould MK, Louie JD, Rosenberg JK, Sze DY, Hofmann LV (noviembre de 2009). "Terapia dirigida por catéter para el tratamiento de la embolia pulmonar masiva: revisión sistemática y metaanálisis de técnicas modernas". Revista de radiología vascular e intervencionista . 20 (11): 1431–1440. doi :10.1016/j.jvir.2009.08.002. PMID 19875060.
- ^ Engelberger RP, Kucher N (marzo de 2014). "Trombólisis asistida por ultrasonido para la embolia pulmonar aguda: una revisión sistemática". European Heart Journal . 35 (12): 758–764. doi : 10.1093/eurheartj/ehu029 . PMID 24497337.
- ^ Zuo Z, Yue J, Dong BR, Wu T, Liu GJ, Hao Q (abril de 2021). "Terapia trombolítica para la embolia pulmonar". Base de datos Cochrane de revisiones sistemáticas . 2021 (4): CD004437. doi :10.1002/14651858.CD004437.pub6. PMC 8092433. PMID 33857326 .
- ^ ab Nakamura S, Takano H, Kubota Y, Asai K, Shimizu W (julio de 2014). "Impacto de la eficacia de la terapia trombolítica en la mortalidad de pacientes con embolia pulmonar submasiva aguda: un metanálisis". Journal of Thrombosis and Haemostasis . 12 (7): 1086–1095. doi :10.1111/jth.12608. PMID 24829097. S2CID 21881585.
- ^ Chatterjee S, Chakraborty A, Weinberg I, Kadakia M, Wilensky RL, Sardar P, et al. (junio de 2014). "Trombólisis para la embolia pulmonar y el riesgo de mortalidad por todas las causas, hemorragia grave y hemorragia intracraneal: un metanálisis". JAMA . 311 (23): 2414–2421. doi : 10.1001/jama.2014.5990 . PMID 24938564.
- ^ ab Young T, Sriram KB (octubre de 2020). "Filtros de vena cava para la prevención de la embolia pulmonar". Base de datos Cochrane de revisiones sistemáticas . 10 (12): CD006212. doi :10.1002/14651858.CD006212.pub5. PMC 8971091. PMID 33027844. S2CID 222216149 .
- ^ Augustinos P, Ouriel K (agosto de 2004). "Enfoques invasivos para el tratamiento de la tromboembolia venosa". Circulation . 110 (9 Suppl 1): I27–34. doi : 10.1161/01.CIR.0000140900.64198.f4 . PMID 15339878.
- ^ Madani MM (2016). "50. Tromboendarterectomía pulmonar". En Peacock AJ, Naeije R, Rubin LJ (eds.). Circulación pulmonar: enfermedades y su tratamiento (cuarta edición). CRC Press. pág. 541. ISBN 978-1-4987-1991-9.
- ^ Walker RH, Goodwin J, Jackson JA (octubre de 1970). "Resolución de la embolia pulmonar". British Medical Journal . 4 (5728): 135–39. doi :10.1136/bmj.4.5728.135. PMC 1819885 . PMID 5475816.
- ^ Le Gal G, Righini M, Parent F, van Strijen M, Couturaud F (abril de 2006). "Diagnóstico y tratamiento de la embolia pulmonar subsegmentaria". Revista de trombosis y hemostasia . 4 (4): 724–31. doi :10.1111/j.1538-7836.2006.01819.x. PMID 16634736. S2CID 20515117.
- ^ Perrier A, Bounameaux H (junio de 2006). "Exactitud o resultado en casos de sospecha de embolia pulmonar". The New England Journal of Medicine . 354 (22): 2383–85. doi :10.1056/NEJMe068076. PMID 16738276.
- ^ White RH (octubre de 2008). "El riesgo de embolia pulmonar mortal fue de 0,49 por 100 personas-año tras suspender la terapia anticoagulante para la tromboembolia venosa". Medicina basada en la evidencia . 13 (5): 154. doi :10.1136/ebm.13.5.154. PMID 18836122. S2CID 29062377.
- ^ Barritt DW, Jordan SC (junio de 1960). "Medicamentos anticoagulantes en el tratamiento de la embolia pulmonar. Un ensayo controlado". Lancet . 1 (7138): 1309–1312. doi :10.1016/S0140-6736(60)92299-6. PMID 13797091.
- ^ Cugell DW, Buckingham WB, Webster JR, Kettel LJ (enero de 1967). "Las limitaciones de los métodos de laboratorio en el diagnóstico de la embolia pulmonar". The Medical Clinics of North America . 51 (1): 175–184. doi :10.1016/s0025-7125(16)33092-9. PMID 4869238.
- ^ Jiménez D, Yusen RD, Otero R, Uresandi F, Nauffal D, Laserna E, et al. (julio de 2007). "Modelos pronósticos para la selección de pacientes con embolia pulmonar aguda para tratamiento ambulatorio inicial". Chest . 132 (1): 24–30. doi :10.1378/chest.06-2921. PMID 17625081.
- ^ ab Zhou XY, Ben SQ, Chen HL, Ni SS (diciembre de 2012). "El valor pronóstico del índice de gravedad de la embolia pulmonar en la embolia pulmonar aguda: un metaanálisis". Investigación respiratoria . 13 (1): 111. doi : 10.1186/1465-9921-13-111 . PMC 3571977 . PMID 23210843.
- ^ Kumar V, Abbas AK, Fausto N, Mitchell RN (2010). Patología básica . Nueva Delhi: Elsevier. pág. 98. ISBN 978-81-312-1036-9.
Enlaces externos
- Calculadora en línea de criterios de Wells para embolia pulmonar Archivado el 21 de noviembre de 2016 en Wayback Machine
- Sitio web de predicción clínica: Criterios de Wells para la embolia pulmonar
 Medios relacionados con Embolia pulmonar en Wikimedia Commons
Medios relacionados con Embolia pulmonar en Wikimedia Commons- "Embolia pulmonar". MedlinePlus . Biblioteca Nacional de Medicina de EE. UU.