Resistencia a los antimicrobianos

La resistencia a los antimicrobianos ( RAM o AR ) se produce cuando los microbios desarrollan mecanismos que los protegen de los antimicrobianos , que son medicamentos utilizados para tratar infecciones. [2] Esta resistencia afecta a todas las clases de microbios, incluidas las bacterias ( resistencia a los antibióticos ), los virus ( resistencia a los antivirales ), los protozoos ( resistencia a los antiprotozoarios ) y los hongos ( resistencia a los antifúngicos ). En conjunto, estas adaptaciones se incluyen en el paraguas de la RAM, lo que plantea importantes desafíos para la atención médica en todo el mundo. [3] El mal uso y la gestión inadecuada de los antimicrobianos son los principales impulsores de esta resistencia, aunque también puede ocurrir de forma natural a través de mutaciones genéticas y la propagación de genes resistentes. [4]
Los microbios resistentes a múltiples fármacos se denominan resistentes a múltiples fármacos (MDR) y, a veces, se los llama superbacterias . [5] La resistencia a los antibióticos, un subconjunto significativo de la RAM, permite que las bacterias sobrevivan al tratamiento con antibióticos , lo que complica el manejo de la infección y las opciones de tratamiento. [3] La resistencia surge a través de la mutación espontánea, la transferencia horizontal de genes y el aumento de la presión selectiva por el uso excesivo de antibióticos, tanto en medicina como en la agricultura, lo que acelera el desarrollo de la resistencia. [6]
La carga de la resistencia a los antimicrobianos es inmensa: cerca de 5 millones de muertes anuales están asociadas a infecciones resistentes. [7] Las infecciones causadas por microbios resistentes a los antimicrobianos son más difíciles de tratar y a menudo requieren terapias alternativas costosas que pueden tener efectos secundarios más graves. [8] Las medidas preventivas, como el uso de antibióticos de espectro reducido y la mejora de las prácticas de higiene, tienen como objetivo reducir la propagación de la resistencia. [9]
La OMS y otros organismos internacionales advierten que la resistencia a los antimicrobianos podría provocar hasta 10 millones de muertes anuales en 2050 si no se toman medidas [10] . Las iniciativas mundiales, como los llamamientos a favor de tratados internacionales sobre la resistencia a los antimicrobianos, hacen hincapié en los esfuerzos coordinados para limitar el uso indebido, financiar la investigación y proporcionar acceso a los antimicrobianos necesarios en los países en desarrollo. Sin embargo, la pandemia de COVID-19 desvió los recursos y la atención científica de la resistencia a los antimicrobianos, intensificando el desafío [11] .
Definición
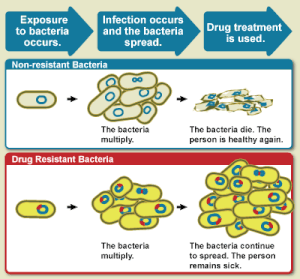
La OMS define la resistencia a los antimicrobianos como la resistencia de un microorganismo a un fármaco antimicrobiano que antes era capaz de tratar una infección causada por ese microorganismo. [3] Una persona no puede volverse resistente a los antibióticos. La resistencia es una propiedad del microbio, no de una persona u otro organismo infectado por un microbio. [13] Todos los tipos de microbios pueden desarrollar resistencia a los fármacos. Así, existen resistencias a los antibióticos, a los antifúngicos, a los antivirales y a los antiparasitarios. [4] [8]
La resistencia a los antibióticos es un subconjunto de la resistencia a los antimicrobianos. Esta resistencia más específica está vinculada a las bacterias y, por lo tanto, se divide en dos subconjuntos más, microbiológica y clínica. La resistencia microbiológica es la más común y se produce a partir de genes, mutados o heredados, que permiten a las bacterias resistir el mecanismo para matar al microbio asociado con ciertos antibióticos. La resistencia clínica se manifiesta a través del fracaso de muchas técnicas terapéuticas donde las bacterias que normalmente son susceptibles a un tratamiento se vuelven resistentes después de sobrevivir al resultado del tratamiento. En ambos casos de resistencia adquirida, las bacterias pueden transmitir el catalizador genético de la resistencia a través de la transferencia horizontal de genes: conjugación, transducción o transformación. Esto permite que la resistencia se propague a través de la misma especie de patógeno o incluso patógenos bacterianos similares. [14]
Descripción general
En un informe de la OMS publicado en abril de 2014 se afirmaba que "esta grave amenaza ya no es una predicción para el futuro, sino que está ocurriendo ahora mismo en todas las regiones del mundo y tiene el potencial de afectar a cualquier persona, de cualquier edad, en cualquier país. La resistencia a los antibióticos (cuando las bacterias cambian de forma que los antibióticos ya no funcionan en las personas que los necesitan para tratar infecciones) es ahora una gran amenaza para la salud pública". [15]
Cada año, casi 5 millones de muertes están asociadas con la RAM a nivel mundial. [7] En 2019, las muertes globales atribuibles a la RAM ascendieron a 1,27 millones. Ese mismo año, la RAM puede haber contribuido a 5 millones de muertes y una de cada cinco personas que murieron debido a la RAM eran niños menores de cinco años. [16]
En 2018, la OMS consideró que la resistencia a los antibióticos era una de las mayores amenazas para la salud mundial, la seguridad alimentaria y el desarrollo. [17] Las muertes atribuibles a la RAM varían según la zona:
| Lugar | Muertes por cada 100.000 atribuibles a RAM [16] |
|---|---|
| África del Norte y Oriente Medio | 11.2 |
| Sudeste asiático y oriental y Oceanía | 11.7 |
| América Latina y el Caribe | 14.4 |
| Europa central y oriental y Asia central | 17.6 |
| Asia del Sur | 21.5 |
| África subsahariana | 23.7 |
El Centro Europeo para la Prevención y el Control de Enfermedades calculó que en 2015 hubo 671.689 infecciones en la UE y el Espacio Económico Europeo causadas por bacterias resistentes a los antibióticos, que provocaron 33.110 muertes. La mayoría se adquirieron en entornos sanitarios. [18] [19] En 2019 hubo 133.000 muertes causadas por RAM. [20]
Causas
La resistencia a los antimicrobianos se debe en gran medida al uso indebido y excesivo de los antimicrobianos. [7] Sin embargo, al mismo tiempo, muchas personas en todo el mundo no tienen acceso a los antimicrobianos esenciales. [7] Esto hace que los microbios desarrollen una defensa contra los medicamentos que se utilizan para tratarlos, o que ciertas cepas de microbios que tienen una resistencia natural a los antimicrobianos se vuelvan mucho más frecuentes que las que se vencen fácilmente con medicamentos. [21] Si bien la resistencia a los antimicrobianos ocurre de manera natural con el tiempo, el uso de agentes antimicrobianos en una variedad de entornos, tanto dentro como fuera de la industria de la salud, ha llevado a que la resistencia a los antimicrobianos se vuelva cada vez más frecuente. [22]
Aunque muchos microbios desarrollan resistencia a los antibióticos con el tiempo a través de mutaciones naturales, la prescripción excesiva y la prescripción inadecuada de antibióticos han acelerado el problema. Es posible que hasta 1 de cada 3 recetas escritas para antibióticos sean innecesarias. [23] Cada año, se escriben aproximadamente 154 millones de recetas de antibióticos. De estas, hasta 46 millones son innecesarias o inadecuadas para la enfermedad que tiene el paciente. [23] Los microbios pueden desarrollar resistencia de forma natural a través de mutaciones genéticas que ocurren durante la división celular y, aunque las mutaciones aleatorias son raras, muchos microbios se reproducen con frecuencia y rapidez, lo que aumenta las posibilidades de que los miembros de la población adquieran una mutación que aumente la resistencia. [24] Muchas personas dejan de tomar antibióticos cuando comienzan a sentirse mejor. Cuando esto ocurre, es posible que los microbios que son menos susceptibles al tratamiento sigan permaneciendo en el cuerpo. Si estos microbios pueden seguir reproduciéndose, esto puede provocar una infección por bacterias que son menos susceptibles o incluso resistentes a un antibiótico. [24]
Ocurrencia natural

La resistencia a los antimicrobianos es un proceso natural. [2] La resistencia a los antimicrobianos puede evolucionar de forma natural debido a la exposición continua a los antimicrobianos. La selección natural implica que los organismos que pueden adaptarse a su entorno sobreviven y siguen produciendo descendencia. [25] Como resultado, los tipos de microorganismos que pueden sobrevivir con el tiempo al ataque continuo de ciertos agentes antimicrobianos se volverán naturalmente más frecuentes en el medio ambiente, y aquellos que no presenten esta resistencia se volverán obsoletos. [22]
Algunas resistencias antimicrobianas contemporáneas también han evolucionado de forma natural antes del uso de antimicrobianos de uso clínico en humanos. Por ejemplo, la resistencia a la meticilina evolucionó como un patógeno de los erizos, posiblemente como una adaptación coevolutiva del patógeno a los erizos que están infectados por un dermatofito que produce antibióticos de forma natural. [26] Además, muchos hongos y bacterias del suelo son competidores naturales y el antibiótico original penicilina descubierto por Alexander Fleming perdió rápidamente su eficacia clínica en el tratamiento de seres humanos y, además, ninguna de las otras penicilinas naturales (F, K, N, X, O, U1 o U6) se encuentra actualmente en uso clínico. [ cita requerida ]
La resistencia a los antimicrobianos puede adquirirse de otros microbios mediante el intercambio de genes en un proceso denominado transferencia horizontal de genes . Esto significa que una vez que un gen de resistencia a un antibiótico aparece en una comunidad microbiana, puede propagarse a otros microbios de la comunidad, pasando potencialmente de un microbio que no causa enfermedades a un microbio que las causa. Este proceso está fuertemente impulsado por los procesos de selección natural que ocurren durante el uso o mal uso de los antibióticos. [27]
Con el tiempo, la mayoría de las cepas bacterianas y las infecciones presentes serán del tipo resistente al agente antimicrobiano que se utiliza para tratarlas, lo que hace que este agente ya no sea eficaz para derrotar a la mayoría de los microbios. Con el aumento del uso de agentes antimicrobianos, se está acelerando este proceso natural. [28]
Automedicación
En el 89% de los países, los antibióticos solo pueden ser recetados por un médico y suministrados por una farmacia. [29] La automedicación por parte de los consumidores se define como "la toma de medicamentos por iniciativa propia o por sugerencia de otra persona, que no es un profesional médico certificado", y se ha identificado como una de las principales razones de la evolución de la resistencia a los antimicrobianos. [30] La automedicación con antibióticos es una forma inadecuada de usarlos, pero una práctica común en países con recursos limitados. La práctica expone a las personas al riesgo de bacterias que han desarrollado resistencia a los antimicrobianos. [31] Muchas personas recurren a esto por necesidad, cuando el acceso a un médico no está disponible debido a los cierres de los consultorios médicos de cabecera o cuando los pacientes tienen una cantidad limitada de tiempo o dinero para ver a un médico que prescribe. [32] Este mayor acceso hace que sea extremadamente fácil obtener antimicrobianos y un ejemplo es la India, donde en el estado de Punjab el 73% de la población recurrió al tratamiento de sus problemas de salud menores y enfermedades crónicas mediante la automedicación. [30]
La automedicación es mayor fuera del entorno hospitalario, y esto está relacionado con un mayor uso de antibióticos, ya que la mayoría de los antibióticos se utilizan en la comunidad en lugar de en los hospitales. La prevalencia de la automedicación en los países de ingresos bajos y medios (LMIC) varía del 8,1% a muy alta, del 93%. La accesibilidad, la asequibilidad y las condiciones de los centros de salud, así como el comportamiento de búsqueda de atención médica, son factores que influyen en la automedicación en los países de ingresos bajos y medios (LMIC). [31] Dos problemas importantes con la automedicación son la falta de conocimiento del público sobre, en primer lugar, los efectos peligrosos de ciertos antimicrobianos (por ejemplo, ciprofloxacino , que puede causar tendinitis , rotura de tendones y disección aórtica ) [33] [34] y, en segundo lugar, la amplia resistencia microbiana y cuándo buscar atención médica si la infección no desaparece. Para determinar el conocimiento y las ideas preconcebidas del público sobre la resistencia a los antibióticos, se realizó una selección de 3.537 artículos publicados en Europa, Asia y América del Norte. De las 55.225 personas encuestadas en los artículos, el 70% había oído hablar de la resistencia a los antibióticos anteriormente, pero el 88% de esas personas pensaba que se refería a algún tipo de cambio físico en el cuerpo humano. [30]
Mal uso clínico
El uso inadecuado de los antibióticos por parte de los profesionales sanitarios es otro factor que contribuye al aumento de la resistencia a los antimicrobianos. Estudios realizados en Estados Unidos muestran que la indicación de tratamiento con antibióticos, la elección del agente utilizado y la duración de la terapia fueron incorrectas en hasta el 50% de los casos estudiados. [35] En 2010 y 2011, aproximadamente un tercio de las prescripciones de antibióticos en ámbitos ambulatorios en Estados Unidos no fueron necesarias. [36] Otro estudio en una unidad de cuidados intensivos de un importante hospital de Francia ha demostrado que entre el 30% y el 60% de los antibióticos prescritos fueron innecesarios. [35] Estos usos inadecuados de los agentes antimicrobianos promueven la evolución de la resistencia a los antimicrobianos al ayudar a las bacterias a desarrollar alteraciones genéticas que conducen a la resistencia. [37]
Según una investigación realizada en los EE. UU. que tuvo como objetivo evaluar las actitudes y el conocimiento de los médicos sobre la resistencia a los antimicrobianos en entornos ambulatorios, solo el 63% de los encuestados informó que la resistencia a los antibióticos era un problema en sus prácticas locales, mientras que el 23% informó que la prescripción agresiva de antibióticos era necesaria para evitar no brindar una atención adecuada. [38] Esto demuestra cómo la mayoría de los médicos subestiman el impacto que sus propios hábitos de prescripción tienen en la resistencia a los antimicrobianos en su conjunto. También confirma que algunos médicos pueden ser demasiado cautelosos y recetar antibióticos por razones médicas o legales, incluso cuando las indicaciones clínicas para el uso de estos medicamentos no siempre están confirmadas. Esto puede conducir a un uso innecesario de antimicrobianos, un patrón que puede haber empeorado durante la pandemia de COVID-19 . [39] [40]
Los estudios han demostrado que los conceptos erróneos comunes sobre la eficacia y la necesidad de los antibióticos para tratar enfermedades leves comunes contribuyen a su uso excesivo. [41] [42]
El sistema médico veterinario es un elemento importante para la discusión sobre el uso de antibióticos. La supervisión veterinaria es obligatoria por ley para todos los antibióticos de importancia médica. [43] Los veterinarios utilizan el modelo farmacocinético/farmacodinámico (PK/PD) para garantizar que se administre la dosis correcta del medicamento en el lugar correcto en el momento correcto. [44]
Pandemias, desinfectantes y sistemas de salud
El aumento del uso de antibióticos durante las primeras olas de la pandemia de COVID-19 puede exacerbar este problema de salud global . [45] [46] Además, las cargas pandémicas en algunos sistemas de atención médica pueden contribuir a las infecciones resistentes a los antibióticos. [47] Por otro lado, "la mayor higiene de manos, la disminución de los viajes internacionales y la disminución de los procedimientos hospitalarios electivos pueden haber reducido la selección y propagación de patógenos RAM en el corto plazo" durante la pandemia de COVID-19. [48] El uso de desinfectantes como los desinfectantes para manos a base de alcohol y el lavado de manos antiséptico también puede tener el potencial de aumentar la resistencia a los antimicrobianos. [49] El uso extensivo de desinfectantes puede conducir a mutaciones que inducen resistencia a los antimicrobianos. [50]
Una Reunión de Alto Nivel de las Naciones Unidas sobre la RAM en 2024 se comprometió a reducir las muertes asociadas con la RAM bacteriana en un 10% durante los próximos seis años. [7] [51] En su primera declaración importante sobre el tema desde 2016, los líderes mundiales también se comprometieron a recaudar 100 millones de dólares para actualizar e implementar planes de acción sobre la RAM. [52] Sin embargo, el borrador final de la declaración omitió un objetivo anterior de reducir el uso de antibióticos en animales en un 30% para 2030, debido a la oposición de los países productores de carne y la industria agrícola. Los críticos argumentan que esta omisión es una debilidad importante, ya que el ganado representa alrededor del 73% de las ventas mundiales de agentes antimicrobianos, incluidos antibióticos , antivirales y antiparasitarios .
Contaminación ambiental
Considerando las complejas interacciones entre humanos, animales y el medio ambiente, también es importante considerar los aspectos ambientales y los contribuyentes a la resistencia a los antimicrobianos. [53] Aunque todavía hay algunas lagunas de conocimiento en la comprensión de los mecanismos y vías de transmisión, [54] la contaminación ambiental se considera un contribuyente significativo a la resistencia a los antimicrobianos. [55] Los factores contribuyentes importantes son a través de "residuos de antibióticos", "efluentes industriales", "escorrentías agrícolas", "metales pesados", "biocidas y pesticidas" y "aguas residuales y residuales" que crean reservorios para genes resistentes y bacterias que facilitan la transferencia de patógenos humanos. [54] [55] Los antibióticos no utilizados o vencidos, si no se eliminan adecuadamente, pueden ingresar a los sistemas de agua y al suelo. [55] La descarga de la fabricación farmacéutica y otras empresas industriales también pueden introducir antibióticos y otros productos químicos en el medio ambiente. [55] Estos factores permiten crear una presión selectiva para las bacterias resistentes. [55] Los antibióticos utilizados en el ganado y la acuicultura pueden contaminar el suelo y el agua, lo que promueve la resistencia en los microbios ambientales. [54] Los metales pesados como el zinc, el cobre y el mercurio, y también los biocidas y pesticidas, pueden co-seleccionar para la resistencia a los antibióticos, [55] aumentando su velocidad. [54] El tratamiento inadecuado de las aguas residuales y cloacales permite que las bacterias y los genes resistentes se propaguen a través de los sistemas de agua. [54] [54]
Producción de alimentos
Ganado

La crisis de resistencia a los antimicrobianos también se extiende a la industria alimentaria, en particular a los animales destinados a la producción de alimentos. Con una población humana en constante aumento, existe una presión constante para intensificar la productividad en muchos sectores agrícolas, incluida la producción de carne como fuente de proteínas. [56] Los antibióticos se administran al ganado para que actúen como suplementos de crecimiento y como medida preventiva para reducir la probabilidad de infecciones. [57]
Los agricultores suelen utilizar antibióticos en la alimentación animal para mejorar las tasas de crecimiento y prevenir infecciones. Sin embargo, esto es ilógico, ya que los antibióticos se utilizan para tratar infecciones y no para prevenirlas. El 80% del uso de antibióticos en los EE. UU. se destina a fines agrícolas y aproximadamente el 70% de ellos son importantes desde el punto de vista médico. [58] El uso excesivo de antibióticos da tiempo a las bacterias para adaptarse, lo que hace que sean necesarias dosis más altas o incluso antibióticos más fuertes para combatir la infección. Aunque los antibióticos para estimular el crecimiento se prohibieron en toda la UE en 2006, 40 países de todo el mundo todavía utilizan antibióticos para promover el crecimiento. [59]
Esto puede provocar la transferencia de cepas bacterianas resistentes a los alimentos que consumen los seres humanos, lo que puede provocar una transmisión de enfermedades potencialmente mortal. Si bien la práctica de utilizar antibióticos como promotores del crecimiento da como resultado mejores rendimientos y productos cárnicos , es un problema importante y debe reducirse para prevenir la resistencia a los antimicrobianos. [60] Aunque la evidencia que vincula el uso de antimicrobianos en el ganado con la resistencia a los antimicrobianos es limitada, el Grupo Asesor de la Organización Mundial de la Salud sobre Vigilancia Integrada de la Resistencia a los Antimicrobianos recomendó enfáticamente la reducción del uso de antimicrobianos de importancia médica en el ganado. Además, el Grupo Asesor declaró que dichos antimicrobianos deberían prohibirse expresamente tanto para la promoción del crecimiento como para la prevención de enfermedades en animales destinados a la producción de alimentos. [61]
Al mapear el consumo de antimicrobianos en el ganado a nivel mundial, se predijo que en 228 países habrá un aumento total del 67% en el consumo de antibióticos por parte del ganado para el año 2030. En algunos países como Brasil, Rusia, India, China y Sudáfrica se predice que ocurrirá un aumento del 99%. [28] Varios países han restringido el uso de antibióticos en el ganado, incluidos Canadá, China, Japón y los EE. UU. Estas restricciones a veces se asocian con una reducción de la prevalencia de resistencia a los antimicrobianos en humanos. [61]
En los Estados Unidos, la Directiva de Alimentos Veterinarios entró en vigor en 2017 y dictamina que todos los antibióticos de importancia médica que se utilicen en alimentos o agua para especies animales destinadas al consumo humano requieren una directiva de alimentos veterinarios (VFD) o una receta médica. [62]
Pesticidas
La mayoría de los pesticidas protegen los cultivos contra insectos y plantas, pero en algunos casos se utilizan pesticidas antimicrobianos para proteger contra diversos microorganismos como bacterias, virus, hongos, algas y protozoos. El uso excesivo de muchos pesticidas en un esfuerzo por obtener un mayor rendimiento de los cultivos ha dado lugar a que muchos de estos microbios desarrollen una tolerancia a estos agentes antimicrobianos. Actualmente hay más de 4000 pesticidas antimicrobianos registrados en la Agencia de Protección Ambiental de los Estados Unidos (EPA) y vendidos en el mercado, lo que demuestra el uso generalizado de estos agentes. [63] Se estima que por cada comida que consume una persona, se utilizan 0,3 g de pesticidas, ya que el 90% de todo el uso de pesticidas se realiza en la agricultura. La mayoría de estos productos se utilizan para ayudar a defenderse contra la propagación de enfermedades infecciosas y, con suerte, proteger la salud pública. Pero de la gran cantidad de pesticidas utilizados, también se estima que menos del 0,1% de esos agentes antimicrobianos realmente alcanzan sus objetivos. Eso deja más del 99% de todos los pesticidas utilizados disponibles para contaminar otros recursos. [64] En el suelo, el aire y el agua, estos agentes antimicrobianos pueden propagarse, entrar en contacto con más microorganismos y hacer que estos microbios desarrollen mecanismos para tolerar y resistir aún más a los pesticidas. El uso de pesticidas azólicos antimicóticos que impulsan la resistencia ambiental a los azólicos se ha relacionado con casos de resistencia a los azólicos en el ámbito clínico. [65] Los mismos problemas enfrentan las nuevas clases de antimicóticos (por ejemplo, orotomidas ) que se están utilizando nuevamente tanto en la clínica como en la agricultura. [66]
Transferencia de genes de microorganismos antiguos

El término permafrost se utiliza para referirse a cualquier suelo que permaneció congelado durante dos años o más, y los ejemplos más antiguos conocidos estuvieron congelados continuamente durante unos 700.000 años. [68] En las últimas décadas, el permafrost se ha ido descongelando rápidamente debido al cambio climático . [69] : 1237 El frío preserva cualquier materia orgánica dentro del permafrost, y es posible que los microorganismos reanuden sus funciones vitales una vez que se descongela. Mientras que algunos patógenos comunes como la gripe , la viruela o las bacterias asociadas con la neumonía no han sobrevivido a los intentos intencionales de revivirlos, [70] microorganismos más adaptados al frío como el ántrax , o varios virus antiguos de plantas y amebas , han sobrevivido con éxito a descongelaciones prolongadas. [71] [72] [73] [74] [75]
Algunos científicos han argumentado que la incapacidad de los agentes causantes conocidos de enfermedades contagiosas para sobrevivir a la congelación y descongelación hace que esta amenaza sea poco probable. En cambio, ha habido sugerencias de que cuando las bacterias patógenas modernas interactúan con las antiguas, pueden, a través de la transferencia horizontal de genes , recoger secuencias genéticas que están asociadas con la resistencia a los antimicrobianos, exacerbando un problema ya difícil. [76] Los antibióticos a los que las bacterias del permafrost han mostrado al menos cierta resistencia incluyen cloranfenicol , estreptomicina , kanamicina , gentamicina , tetraciclina , espectinomicina y neomicina . [77] Sin embargo, otros estudios muestran que los niveles de resistencia en las bacterias antiguas a los antibióticos modernos siguen siendo más bajos que en las bacterias contemporáneas de la capa activa de suelo descongelado sobre ellas, [67] lo que puede significar que este riesgo "no es mayor" que el de cualquier otro suelo. [78]
Prevención

Cada vez hay más llamados públicos a la acción colectiva mundial para hacer frente a esta amenaza, incluida una propuesta de tratado internacional sobre la resistencia a los antimicrobianos. Aún se necesitan más detalles y atención para reconocer y medir las tendencias de la resistencia a nivel internacional; se ha sugerido la idea de un sistema de seguimiento mundial, pero aún no se ha implementado. Un sistema de esta naturaleza proporcionaría información sobre las áreas de alta resistencia, así como la información necesaria para evaluar programas, introducir intervenciones y otros cambios realizados para combatir o revertir la resistencia a los antibióticos. [79] [80]
Duración de los antimicrobianos
Retrasar o minimizar el uso de antibióticos para ciertas afecciones puede ayudar a reducir su uso de manera segura. [81] La duración del tratamiento antimicrobiano debe basarse en la infección y otros problemas de salud que pueda tener una persona. [82] En el caso de muchas infecciones, una vez que una persona ha mejorado, hay poca evidencia de que suspender el tratamiento cause más resistencia. [82] Por lo tanto, algunos creen que suspender el tratamiento antes de tiempo puede ser razonable en algunos casos. [82] Sin embargo, otras infecciones requieren tratamientos más prolongados independientemente de si la persona se siente mejor o no. [82]
Retrasar el uso de antibióticos para afecciones como dolor de garganta y otitis media puede no tener diferencias en la tasa de complicaciones en comparación con el uso inmediato de antibióticos, por ejemplo. [81] Cuando se tratan infecciones del tracto respiratorio, se requiere un criterio clínico en cuanto al tratamiento apropiado (uso tardío o inmediato de antibióticos). [81]
El estudio, "Duraciones más cortas y más largas de los antibióticos para las infecciones respiratorias: para combatir la resistencia a los antimicrobianos: un estudio transversal retrospectivo en un entorno de atención secundaria en el Reino Unido", destaca la urgencia de reevaluar las duraciones del tratamiento con antibióticos en medio del desafío global de la resistencia a los antimicrobianos (RAM). Investiga la eficacia de los regímenes de antibióticos más cortos frente a los más largos para las infecciones de las vías respiratorias (ITR) en un entorno de atención secundaria del Reino Unido, y destaca la necesidad de prácticas de prescripción basadas en la evidencia para optimizar los resultados de los pacientes y combatir la RAM. [83]
Monitoreo y mapeo
Existen múltiples programas nacionales e internacionales de monitoreo de amenazas resistentes a los medicamentos, incluyendo Staphylococcus aureus resistente a la meticilina (MRSA), S. aureus resistente a la vancomicina (VRSA), Enterobacterales productores de betalactamasas de espectro extendido (ESBL) , Enterococcus resistente a la vancomicina (VRE) y Acinetobacter baumannii resistente a múltiples fármacos (MRAB). [84]
ResistanceOpen es un mapa global en línea de la resistencia a los antimicrobianos desarrollado por HealthMap que muestra datos agregados sobre la resistencia a los antimicrobianos a partir de datos disponibles públicamente y enviados por los usuarios. [85] [86] El sitio web puede mostrar datos para un radio de 25 millas (40 km) desde una ubicación. Los usuarios pueden enviar datos de antibiogramas para hospitales o laboratorios individuales. Los datos europeos provienen de EARS-Net (Red Europea de Vigilancia de la Resistencia a los Antimicrobianos), parte del ECDC . ResistanceMap es un sitio web del Centro para la Dinámica de Enfermedades, Economía y Política y proporciona datos sobre la resistencia a los antimicrobianos a nivel mundial. [87]
El plan de acción mundial sobre la resistencia a los antimicrobianos de la OMS también recomienda la vigilancia de la resistencia a los antimicrobianos en los animales. [88] En la UE se han dado los primeros pasos para establecer el sistema veterinario equivalente EARS-Vet (EARS-Net para medicina veterinaria). [89] Los datos sobre la resistencia a los antimicrobianos de las mascotas en particular son escasos, pero son necesarios para apoyar la gestión de los antibióticos en la medicina veterinaria. [90]
En comparación, hay una falta de programas nacionales e internacionales de monitoreo de la resistencia a los antimicóticos. [91]
Limitar el uso de antimicrobianos en humanos
Los programas de gestión de antimicrobianos parecen ser útiles para reducir las tasas de resistencia a los antimicrobianos. [92] El programa de gestión de antimicrobianos también proporcionará a los farmacéuticos el conocimiento necesario para educar a los pacientes sobre el hecho de que los antibióticos no funcionan contra un virus, por ejemplo. [93]
El uso excesivo de antimicrobianos se ha convertido en uno de los principales factores que contribuyen a la evolución de la resistencia a los antimicrobianos. Desde el comienzo de la era de los antimicrobianos, se han utilizado para tratar una amplia gama de enfermedades infecciosas. [94] El uso excesivo de antimicrobianos se ha convertido en la causa principal de los crecientes niveles de resistencia a los antimicrobianos. El principal problema es que los médicos están dispuestos a recetar antimicrobianos a personas mal informadas que creen que los antimicrobianos pueden curar casi todas las enfermedades, incluidas las infecciones virales como el resfriado común. En un análisis de las prescripciones de medicamentos, el 36% de las personas con un resfriado o una infección de las vías respiratorias superiores (ambas generalmente de origen viral) recibieron recetas de antibióticos. [95] Estas prescripciones no lograron nada más que aumentar el riesgo de una mayor evolución de las bacterias resistentes a los antibióticos. [96] El uso de antimicrobianos sin receta es otra fuerza impulsora que conduce al uso excesivo de antibióticos para el autotratamiento de enfermedades como el resfriado común, la tos, la fiebre y la disentería, lo que resulta en una epidemia de resistencia a los antibióticos en países como Bangladesh, con el riesgo de que se propague por todo el mundo. [97] La introducción de una estricta gestión de los antibióticos en el ámbito ambulatorio para reducir la prescripción inadecuada de antibióticos puede reducir la resistencia bacteriana emergente. [98]
Se ha presentado la guía y el libro sobre antibióticos AWaRe (Access, Watch, Reserve) de la OMS para orientar la elección de antibióticos para las 30 infecciones más comunes en adultos y niños, con el fin de reducir la prescripción inadecuada en atención primaria y hospitales. Se prefieren los antibióticos de espectro reducido debido a su menor potencial de resistencia, y los antibióticos de amplio espectro solo se recomiendan para personas con síntomas más graves. Algunos antibióticos tienen más probabilidades de conferir resistencia, por lo que se mantienen como antibióticos de reserva en el libro AWaRe. [99]
Se han empleado diversas estrategias de diagnóstico para prevenir el uso excesivo de la terapia antimicótica en la clínica, demostrando ser una alternativa segura a la terapia antimicótica empírica y, por lo tanto, respaldando los esquemas de administración de antimicóticos. [100]
A nivel hospitalario
Los equipos de gestión de antimicrobianos en los hospitales están fomentando el uso óptimo de los antimicrobianos. [101] Los objetivos de la gestión de antimicrobianos son ayudar a los profesionales a elegir el fármaco adecuado en la dosis y la duración adecuadas del tratamiento, al tiempo que se evita el uso indebido y se minimiza el desarrollo de resistencia. Las intervenciones de gestión pueden reducir la duración de la estancia hospitalaria en un promedio de poco más de un día sin aumentar el riesgo de muerte. [102] La dispensación, a los pacientes hospitalizados dados de alta, de la cantidad exacta de unidades farmacéuticas de antibióticos necesarias para completar un tratamiento en curso puede reducir los restos de antibióticos en la comunidad, ya que las farmacias comunitarias pueden tener ineficiencias en los paquetes de antibióticos. [103]
En el nivel de atención primaria
Dado el volumen de atención que se brinda en la atención primaria (medicina general), las estrategias recientes se han centrado en reducir la prescripción innecesaria de antimicrobianos en este ámbito. Se ha demostrado que intervenciones simples, como la información escrita que explica cuándo no es necesario tomar antibióticos, por ejemplo en infecciones comunes de las vías respiratorias superiores, reducen la prescripción de antibióticos. [104] También existen varias herramientas para ayudar a los profesionales a decidir si es necesario recetar antimicrobianos.
Las expectativas de los padres, impulsadas por la preocupación por la salud de sus hijos, pueden influir en la frecuencia con la que se les prescriben antibióticos a sus hijos. Los padres a menudo confían en su médico para obtener consejos y tranquilidad. Sin embargo, la falta de información en un lenguaje sencillo y la falta de tiempo suficiente para la consulta afectan negativamente a esta relación. En efecto, los padres a menudo confían en experiencias pasadas en sus expectativas en lugar de en la tranquilidad del médico. El tiempo adecuado para la consulta y la información en un lenguaje sencillo pueden ayudar a los padres a tomar decisiones informadas y evitar el uso innecesario de antibióticos. [105]
El médico que prescribe debe respetar estrictamente los cinco principios correctos de la administración de medicamentos: el paciente correcto, el medicamento correcto, la dosis correcta, la vía correcta y el momento correcto. [106] Se deben tomar muestras microbiológicas para realizar cultivos y pruebas de sensibilidad antes del tratamiento cuando esté indicado y se debe modificar el tratamiento en función del informe de sensibilidad. [107] [108]
Los trabajadores de la salud y los farmacéuticos pueden ayudar a combatir la resistencia a los antibióticos mejorando la prevención y el control de las infecciones, prescribiendo y dispensando antibióticos solo cuando sean realmente necesarios y prescribiendo y dispensando los antibióticos adecuados para tratar la enfermedad. [15] Un sistema de dosis unitaria implementado en las farmacias comunitarias también puede reducir los restos de antibióticos en los hogares. [103]
A nivel individual
Las personas pueden ayudar a combatir la resistencia utilizando antibióticos solo cuando están infectadas con una infección bacteriana y prescrita por un médico; completando la receta completa incluso si el usuario se siente mejor, nunca compartiendo antibióticos con otras personas o utilizando recetas sobrantes. [15] Tomar antibióticos cuando no es necesario no ayudará al usuario, sino que dará a las bacterias la opción de adaptarse y dejará al usuario con los efectos secundarios que vienen con cierto tipo de antibiótico. [109] Los CDC recomiendan que sigas estos comportamientos para evitar estos efectos secundarios negativos y mantener a la comunidad a salvo de la propagación de bacterias resistentes a los medicamentos. [109] Practicar cursos básicos de prevención de infecciones bacterianas, como la higiene, también ayuda a prevenir la propagación de bacterias resistentes a los antibióticos. [110]
Ejemplos de países
- Los Países Bajos tienen la tasa más baja de prescripción de antibióticos en la OCDE , con una tasa de 11,4 dosis diarias definidas (DDD) por cada 1.000 personas por día en 2011. La dosis diaria definida (DDD) es una medida estadística del consumo de medicamentos, definida por la Organización Mundial de la Salud (OMS). [111]
- Alemania y Suecia también tienen tasas de prescripción más bajas; en Suecia la tasa ha estado disminuyendo desde 2007.
- Grecia , Francia y Bélgica tienen tasas elevadas de prescripción de antibióticos de más de 28 DDD. [112]
Agua, saneamiento, higiene
El control de las enfermedades infecciosas mediante la mejora de la infraestructura de agua, saneamiento e higiene (WASH) debe incluirse en la agenda de la resistencia a los antimicrobianos (AMR). El "Grupo de coordinación interinstitucional sobre resistencia a los antimicrobianos" afirmó en 2018 que "la propagación de patógenos a través del agua insalubre da lugar a una alta carga de enfermedades gastrointestinales, lo que aumenta aún más la necesidad de tratamiento con antibióticos". [113] Esto es particularmente un problema en los países en desarrollo , donde la propagación de enfermedades infecciosas causada por estándares WASH inadecuados es un importante impulsor de la demanda de antibióticos. [114] El creciente uso de antibióticos junto con los niveles persistentes de enfermedades infecciosas han llevado a un ciclo peligroso en el que la dependencia de los antimicrobianos aumenta mientras que la eficacia de los medicamentos disminuye. [114] El uso adecuado de la infraestructura para agua, saneamiento e higiene (WASH) puede resultar en una disminución del 47 al 72 por ciento de los casos de diarrea tratados con antibióticos, dependiendo del tipo de intervención y su eficacia. [114] Una reducción de la carga de enfermedades diarreicas mediante la mejora de la infraestructura daría lugar a grandes disminuciones en el número de casos de diarrea tratados con antibióticos. Se estima que esta cifra oscilará entre 5 millones en Brasil y hasta 590 millones en la India para el año 2030. [114] El fuerte vínculo entre el aumento del consumo y la resistencia indica que esto mitigará directamente la propagación acelerada de la RAM. [114] El saneamiento y el agua para todos en 2030 es el Objetivo número 6 de los Objetivos de Desarrollo Sostenible . [115]
Un aumento en el cumplimiento del lavado de manos por parte del personal hospitalario da como resultado una disminución de las tasas de organismos resistentes. [116]
La infraestructura de abastecimiento de agua y saneamiento en los centros de salud ofrece importantes beneficios colaterales para combatir la RAM, y se debería aumentar la inversión. [113] Hay mucho margen de mejora: la OMS y el UNICEF estimaron en 2015 que a nivel mundial el 38% de los centros de salud no tenían una fuente de agua, casi el 19% no tenían retretes y el 35% no tenían agua ni jabón o desinfectante a base de alcohol para lavarse las manos. [117]
Tratamiento de aguas residuales industriales
Los fabricantes de antimicrobianos necesitan mejorar el tratamiento de sus aguas residuales (mediante el uso de procesos de tratamiento de aguas residuales industriales ) para reducir la liberación de residuos al medio ambiente. [113]
Limitar el uso de antimicrobianos en los animales y en la agricultura
Se ha comprobado que el uso de antibióticos en la cría de animales puede generar resistencias RAM en las bacterias presentes en los animales destinados al consumo a los antibióticos que se administran (mediante inyecciones o alimentos medicados). [118] Por este motivo, en estas prácticas solo se utilizan antimicrobianos que se consideran "no clínicamente relevantes".
A diferencia de la resistencia a los antibacterianos, la resistencia a los antifúngicos puede ser impulsada por la agricultura ; actualmente no existe ninguna regulación sobre el uso de clases de antifúngicos similares en la agricultura y la clínica. [91] [66]
Estudios recientes han demostrado que el uso profiláctico de antimicrobianos "no prioritarios" o "no clínicamente relevantes" en los alimentos puede potencialmente, bajo ciertas condiciones, conducir a la coselección de bacterias ambientales resistentes a los antimicrobianos con resistencia a antibióticos de importancia médica. [119] La posibilidad de coselección de resistencias a los antimicrobianos en la cadena alimentaria puede tener implicaciones de largo alcance para la salud humana. [119] [120]
Ejemplos de países
Europa
En 1997, los ministros de salud de la Unión Europea votaron para prohibir la avoparcina y cuatro antibióticos adicionales utilizados para promover el crecimiento animal en 1999. [121] En 2006, entró en vigor una prohibición del uso de antibióticos en los piensos europeos, con la excepción de dos antibióticos en los piensos para aves de corral. [122] En Escandinavia, hay evidencia de que la prohibición ha llevado a una menor prevalencia de resistencia a los antibióticos en poblaciones bacterianas animales (no peligrosas). [123] A partir de 2004, varios países europeos establecieron una disminución de la resistencia a los antimicrobianos en humanos mediante la limitación del uso de antimicrobianos en la agricultura y las industrias alimentarias sin poner en peligro la salud animal o el costo económico. [124]
Estados Unidos
El Departamento de Agricultura de los Estados Unidos (USDA) y la Administración de Alimentos y Medicamentos (FDA) recopilan datos sobre el uso de antibióticos en humanos y, de manera más limitada, en animales. [125] Aproximadamente el 80% del uso de antibióticos en los EE. UU. se destina a fines agrícolas, y aproximadamente el 70% de estos son importantes desde el punto de vista médico. [58] Esto da motivos para preocuparse por la crisis de resistencia a los antibióticos en los EE. UU. y más motivos para vigilarla. La FDA determinó por primera vez en 1977 que hay evidencia de la aparición de cepas bacterianas resistentes a los antibióticos en el ganado. No obstante, la práctica establecida desde hace mucho tiempo de permitir la venta sin receta de antibióticos (incluida la penicilina y otros medicamentos) a propietarios de animales para su administración a sus propios animales continuó en todos los estados. En 2000, la FDA anunció su intención de revocar la aprobación del uso de fluoroquinolonas en la producción avícola debido a la evidencia sustancial que lo vincula con la aparición de infecciones por Campylobacter resistentes a las fluoroquinolonas en humanos. Los desafíos legales de las industrias farmacéutica y de alimentos para animales retrasaron la decisión final de hacerlo hasta 2006. [126] Las fluoroquinolonas han estado prohibidas para uso fuera de etiqueta en animales de consumo en los EE. UU. desde 2007. [127] Sin embargo, siguen utilizándose ampliamente en animales de compañía y exóticos. [128]
Planes de acción y concienciación globales
En la 79.ª Reunión de Alto Nivel de la Asamblea General de las Naciones Unidas sobre la RAM, celebrada el 26 de septiembre de 2024, los dirigentes mundiales aprobaron una declaración política en la que se comprometían a cumplir un conjunto claro de objetivos y acciones, entre ellos la reducción de las aproximadamente 4,95 millones de muertes humanas asociadas a la RAM bacteriana al año en un 10 % para 2030. [7] La creciente interconexión del mundo y el hecho de que no se hayan desarrollado ni aprobado nuevas clases de antibióticos durante más de 25 años ponen de relieve hasta qué punto la resistencia a los antimicrobianos es un problema sanitario mundial. [129] En la 68.ª Asamblea Mundial de la Salud, celebrada en mayo de 2015, se aprobó un plan de acción mundial para abordar el creciente problema de la resistencia a los antibióticos y otros medicamentos antimicrobianos. [88] Uno de los objetivos clave del plan es mejorar la concienciación y la comprensión de la resistencia a los antimicrobianos mediante una comunicación, una educación y una formación eficaces. Este plan de acción mundial elaborado por la Organización Mundial de la Salud se creó para combatir el problema de la resistencia a los antimicrobianos y se guió por el asesoramiento de los países y las principales partes interesadas. El plan de acción mundial de la OMS se compone de cinco objetivos clave que pueden alcanzarse por diferentes medios y representa a los países que se unen para resolver un problema importante que puede tener consecuencias futuras para la salud. [28] Estos objetivos son los siguientes:
- Mejorar la conciencia y la comprensión de la resistencia a los antimicrobianos mediante una comunicación, educación y capacitación eficaces.
- Fortalecer la base de conocimientos y evidencia mediante la vigilancia y la investigación.
- Reducir la incidencia de la infección mediante medidas eficaces de saneamiento, higiene y prevención de infecciones.
- Optimizar el uso de medicamentos antimicrobianos en la salud humana y animal.
- Desarrollar argumentos económicos en favor de una inversión sostenible que tenga en cuenta las necesidades de todos los países y aumentar la inversión en nuevos medicamentos, herramientas de diagnóstico, vacunas y otras intervenciones.
Pasos hacia el progreso
- React, con sede en Suecia, ha producido material informativo sobre la resistencia a los antimicrobianos para el público en general. [130]
- Se están produciendo vídeos para el público en general con el fin de generar interés y concienciación. [131] [132]
- El Departamento de Salud irlandés publicó un Plan de acción nacional sobre resistencia a los antimicrobianos en octubre de 2017. [133] La Estrategia para el control de la resistencia a los antimicrobianos en Irlanda (SARI), lanzada en 2001, desarrolló las Directrices para la gestión de los antimicrobianos en los hospitales de Irlanda [134] en colaboración con el Centro de Vigilancia de la Protección de la Salud, que se publicaron en 2009. Tras su publicación, se lanzó una campaña de información pública titulada "Acción sobre los antibióticos " [135] para destacar la necesidad de un cambio en la prescripción de antibióticos. A pesar de ello, la prescripción de antibióticos sigue siendo alta y hay variaciones en el cumplimiento de las directrices. [136]
- El Reino Unido publicó una visión de 20 años para la resistencia a los antimicrobianos que establece el objetivo de contener y controlar la RAM para 2040. [137] La visión se complementa con un plan de acción de cinco años que se extiende desde 2019 hasta 2024, basado en el plan de acción anterior (2013-2018). [138]
- La Organización Mundial de la Salud ha publicado la Lista de Patógenos Bacterianos Prioritarios de 2024, que abarca 15 familias de patógenos bacterianos resistentes a los antibióticos. Entre ellos, destacan las bacterias gramnegativas resistentes a los antibióticos de último recurso, el Mycobacterium tuberculosis resistente a los fármacos y otros patógenos resistentes de alta carga, como Salmonella , Shigella , Neisseria gonorrhoeae , Pseudomonas aeruginosa y Staphylococcus aureus . La inclusión de estos patógenos en la lista subraya su impacto global en términos de carga, así como cuestiones relacionadas con la transmisibilidad, la tratabilidad y las opciones de prevención. También refleja la línea de investigación y desarrollo de nuevos tratamientos y las tendencias emergentes de resistencia. [139]
Semana de concientización sobre los antibióticos
La Organización Mundial de la Salud ha promovido la primera Semana Mundial de Concientización sobre el Uso de los Antibióticos, que se celebrará del 16 al 22 de noviembre de 2015. El objetivo de la semana es aumentar la conciencia mundial sobre la resistencia a los antibióticos y promover el uso correcto de los antibióticos en todos los ámbitos para prevenir nuevos casos de resistencia a los antibióticos. [140]
La Semana Mundial de Concientización sobre los Antibióticos se celebra cada noviembre desde 2015. Para 2017, la Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO), la Organización Mundial de la Salud (OMS) y la Organización Mundial de Sanidad Animal (OIE) están pidiendo conjuntamente un uso responsable de los antibióticos en seres humanos y animales para reducir la aparición de resistencia a los antibióticos. [141]
Naciones Unidas
En 2016, el Secretario General de las Naciones Unidas convocó al Grupo de Coordinación Interinstitucional sobre Resistencia a los Antimicrobianos. [142] El Grupo trabajó con organizaciones internacionales y expertos en salud humana, animal y vegetal para crear un plan para combatir la resistencia a los antimicrobianos. [142] Su informe publicado en abril de 2019 destaca la gravedad de la resistencia a los antimicrobianos y la amenaza que representa para la salud mundial. Sugiere cinco recomendaciones que los Estados miembros deben seguir para enfrentar esta creciente amenaza. Las recomendaciones del Grupo son las siguientes: [143]
- Acelerar el progreso en los países
- Innovar para asegurar el futuro
- Colaborar para una acción más eficaz
- Invertir en una respuesta sostenible
- Fortalecer la rendición de cuentas y la gobernanza global
Mecanismos y organismos
Bacteria

Los cinco mecanismos principales por los cuales las bacterias muestran resistencia a los antibióticos son:
- Inactivación o modificación de fármacos: por ejemplo, la desactivación enzimática de la penicilina G en algunas bacterias resistentes a la penicilina mediante la producción de β-lactamasas . Los fármacos también pueden modificarse químicamente mediante la adición de grupos funcionales por enzimas transferasas ; por ejemplo, la acetilación , la fosforilación o la adenilación son mecanismos de resistencia comunes a los aminoglucósidos . La acetilación es el mecanismo más utilizado y puede afectar a varias clases de fármacos . [144] [145] : 6–8
- Alteración del sitio de unión o diana: por ejemplo, alteración de PBP (el sitio de unión diana de las penicilinas) en MRSA y otras bacterias resistentes a la penicilina. Otro mecanismo de protección encontrado entre las especies bacterianas son las proteínas de protección ribosómica. Estas proteínas protegen a la célula bacteriana de los antibióticos que se dirigen a los ribosomas de la célula para inhibir la síntesis de proteínas. El mecanismo implica la unión de las proteínas de protección ribosómica a los ribosomas de la célula bacteriana, lo que a su vez cambia su forma conformacional. Esto permite que los ribosomas continúen sintetizando proteínas esenciales para la célula mientras evita que los antibióticos se unan al ribosoma para inhibir la síntesis de proteínas. [146]
- Alteración de la vía metabólica: por ejemplo, algunas bacterias resistentes a las sulfonamidas no requieren ácido para-aminobenzoico (PABA), un precursor importante para la síntesis de ácido fólico y ácidos nucleicos en bacterias inhibidas por sulfonamidas, sino que, al igual que las células de mamíferos, recurren al uso de ácido fólico preformado. [147]
- Reducción de la acumulación de fármacos: al disminuir la permeabilidad de los fármacos o aumentar el eflujo activo (bombeo) de los fármacos a través de la superficie celular [148]. Estas bombas dentro de la membrana celular de ciertas especies bacterianas se utilizan para bombear antibióticos fuera de la célula antes de que puedan causar algún daño. A menudo se activan por un sustrato específico asociado con un antibiótico, [149] como en la resistencia a las fluoroquinolonas . [150]
- División y reciclaje de ribosomas: por ejemplo, el bloqueo del ribosoma mediado por fármacos por lincomicina y eritromicina se desbloqueó por una proteína de choque térmico encontrada en Listeria monocytogenes , que es un homólogo de HflX de otras bacterias. La liberación del ribosoma del fármaco permite una mayor traducción y la consiguiente resistencia al fármaco. [151]

Hay varios tipos diferentes de gérmenes que han desarrollado resistencia con el tiempo.
Los seis patógenos que causan la mayoría de las muertes asociadas con la resistencia son Escherichia coli , Staphylococcus aureus, Klebsiella pneumoniae, Streptococcus pneumoniae, Acinetobacter baumannii y Pseudomonas aeruginosa . Fueron responsables de 929.000 muertes atribuibles a la resistencia y 3,57 millones de muertes asociadas con la resistencia en 2019. [16]
La Neisseria gonorrhoeae productora de penicilinasa desarrolló resistencia a la penicilina en 1976. Otro ejemplo es la Neisseria gonorrhoeae resistente a la azitromicina , que desarrolló resistencia a la azitromicina en 2011. [152]
En las bacterias gramnegativas , los genes de resistencia mediados por plásmidos producen proteínas que pueden unirse a la ADN girasa , protegiéndola de la acción de las quinolonas. Finalmente, las mutaciones en sitios clave en la ADN girasa o la topoisomerasa IV pueden disminuir su afinidad de unión a las quinolonas, disminuyendo así la eficacia del fármaco. [153]
Algunas bacterias son naturalmente resistentes a ciertos antibióticos; por ejemplo, las bacterias gramnegativas son resistentes a la mayoría de los antibióticos β-lactámicos debido a la presencia de β-lactamasa . La resistencia a los antibióticos también puede adquirirse como resultado de una mutación genética o de una transferencia horizontal de genes . [154] Aunque las mutaciones son raras, y las mutaciones espontáneas en el genoma del patógeno ocurren a una tasa de aproximadamente 1 en 10 5 a 1 en 10 8 por replicación cromosómica, [155] el hecho de que las bacterias se reproduzcan a una tasa alta permite que el efecto sea significativo. Dado que la esperanza de vida y la producción de nuevas generaciones pueden estar en una escala de tiempo de meras horas, una nueva mutación (de novo) en una célula madre puede convertirse rápidamente en una mutación hereditaria de prevalencia generalizada, lo que resulta en la microevolución de una colonia completamente resistente. Sin embargo, las mutaciones cromosómicas también confieren un costo de aptitud. Por ejemplo, una mutación ribosomal puede proteger una célula bacteriana al cambiar el sitio de unión de un antibiótico, pero puede resultar en una tasa de crecimiento más lenta. [156] Además, algunas mutaciones adaptativas pueden propagarse no solo a través de la herencia sino también a través de la transferencia horizontal de genes . El mecanismo más común de transferencia horizontal de genes es la transferencia de plásmidos que llevan genes de resistencia a antibióticos entre bacterias de la misma especie o de especies diferentes a través de la conjugación . Sin embargo, las bacterias también pueden adquirir resistencia a través de la transformación , como en la captación de fragmentos desnudos de ADN extracelular que contienen genes de resistencia a antibióticos por parte de Streptococcus pneumoniae a la estreptomicina, [157] a través de la transducción , como en la transferencia mediada por bacteriófagos de genes de resistencia a la tetraciclina entre cepas de S. pyogenes , [158] o a través de agentes de transferencia genética , que son partículas producidas por la célula huésped que se asemejan a estructuras de bacteriófagos y son capaces de transferir ADN. [159]
La resistencia a los antibióticos se puede introducir artificialmente en un microorganismo a través de protocolos de laboratorio, a veces se utiliza como un marcador seleccionable para examinar los mecanismos de transferencia genética o para identificar individuos que absorbieron un fragmento de ADN que incluía el gen de resistencia y otro gen de interés. [160]
Los últimos hallazgos muestran que no es necesario que existan grandes poblaciones de bacterias para que aparezca la resistencia a los antibióticos. Poblaciones pequeñas de Escherichia coli en un gradiente de antibióticos pueden volverse resistentes. Cualquier entorno heterogéneo con respecto a los gradientes de nutrientes y antibióticos puede facilitar la resistencia a los antibióticos en poblaciones bacterianas pequeñas. Los investigadores plantean la hipótesis de que el mecanismo de evolución de la resistencia se basa en cuatro mutaciones de SNP en el genoma de E. coli producidas por el gradiente de antibióticos. [161]
En un estudio, que tiene implicaciones para la microbiología espacial, una cepa no patógena E. coli MG1655 fue expuesta a niveles traza del antibiótico de amplio espectro cloranfenicol , bajo microgravedad simulada (LSMMG, o Microgravedad Modelada de Bajo Cizallamiento) durante 1000 generaciones. La cepa adaptada adquirió resistencia no solo al cloranfenicol, sino también resistencia cruzada a otros antibióticos; [162] esto fue en contraste con la observación en la misma cepa, que fue adaptada a más de 1000 generaciones bajo LSMMG, pero sin ninguna exposición a antibióticos; la cepa en este caso no adquirió tal resistencia. [163] Por lo tanto, independientemente de dónde se utilicen, el uso de un antibiótico probablemente daría como resultado una resistencia persistente a ese antibiótico, así como una resistencia cruzada a otros antimicrobianos.
En los últimos años, la aparición y propagación de β-lactamasas llamadas carbapenemasas se ha convertido en una importante crisis de salud. [164] [165] Una de estas carbapenemasas es la metalo-beta-lactamasa 1 de Nueva Delhi (NDM-1), [166] una enzima que hace que las bacterias sean resistentes a una amplia gama de antibióticos betalactámicos . Las bacterias más comunes que producen esta enzima son gramnegativas como E. coli y Klebsiella pneumoniae , pero el gen de NDM-1 puede propagarse de una cepa de bacterias a otra mediante transferencia horizontal de genes . [167]
Virus
Se utilizan medicamentos antivirales específicos para tratar algunas infecciones virales. Estos medicamentos impiden que los virus se reproduzcan al inhibir etapas esenciales del ciclo de replicación del virus en las células infectadas. Los antivirales se utilizan para tratar el VIH , la hepatitis B , la hepatitis C , la gripe , los virus del herpes , incluido el virus de la varicela zóster , el citomegalovirus y el virus de Epstein-Barr . Con cada virus, algunas cepas se han vuelto resistentes a los medicamentos administrados. [168]
Los fármacos antivirales suelen actuar sobre componentes clave de la reproducción viral; por ejemplo, el oseltamivir actúa sobre la neuraminidasa de la gripe , mientras que los análogos de la guanosina inhiben la ADN polimerasa viral. La resistencia a los antivirales se adquiere, por tanto, a través de mutaciones en los genes que codifican las proteínas diana de los fármacos.
La resistencia a los antivirales del VIH es problemática, e incluso han evolucionado cepas resistentes a múltiples fármacos. [169] Una fuente de resistencia es que muchos de los fármacos actuales contra el VIH, incluidos los NRTI y los NNRTI, tienen como objetivo la transcriptasa inversa ; sin embargo, la transcriptasa inversa del VIH-1 es muy propensa a errores y, por lo tanto, surgen rápidamente mutaciones que confieren resistencia. [170] Las cepas resistentes del virus del VIH surgen rápidamente si solo se utiliza un fármaco antiviral. [171] El uso de tres o más fármacos juntos, denominado terapia combinada , ha ayudado a controlar este problema, pero se necesitan nuevos fármacos debido a la continua aparición de cepas del VIH resistentes a los fármacos. [172]
Hongos
Las infecciones por hongos son causa de alta morbilidad y mortalidad en personas inmunodeprimidas , como aquellas con VIH/SIDA, tuberculosis o que reciben quimioterapia . [173] Los hongos Candida , Cryptococcus neoformans y Aspergillus fumigatus causan la mayoría de estas infecciones y la resistencia a los antimicóticos ocurre en todos ellos. [174] La resistencia a múltiples fármacos en hongos está aumentando debido al uso generalizado de medicamentos antimicóticos para tratar infecciones en individuos inmunodeprimidos y el uso de algunos antimicóticos agrícolas. [91] [175] La enfermedad resistente a los antimicóticos se asocia con un aumento de la mortalidad.
Algunos hongos (por ejemplo, Candida krusei y fluconazol ) presentan resistencia intrínseca a ciertos fármacos o clases de antimicóticos, mientras que algunas especies desarrollan resistencia a los antimicóticos a presiones externas. La resistencia a los antimicóticos es un problema de Una Salud , impulsado por múltiples factores extrínsecos, incluido el uso extensivo de fungicidas, el uso excesivo de antimicóticos clínicos, el cambio ambiental y los factores del huésped. [91]
En los EE.UU., las especies de Candida resistentes al fluconazol y la resistencia a los azoles en Aspergillus fumigatus se han destacado como una amenaza creciente. [84]
Más de 20 especies de Candida pueden causar infección por candidiasis , siendo la más común Candida albicans . Las levaduras Candida normalmente habitan en la piel y las membranas mucosas sin causar infección. Sin embargo, el crecimiento excesivo de Candida puede provocar candidiasis. Algunas especies de Candida (p. ej. Candida glabrata ) se están volviendo resistentes a los agentes antimicóticos de primera y segunda línea, como las equinocandinas y los azoles . [84]
La aparición de Candida auris como un posible patógeno humano que a veces muestra resistencia a múltiples fármacos antimicóticos es preocupante y se ha asociado con varios brotes a nivel mundial. La OMS ha publicado una lista prioritaria de patógenos fúngicos, que incluye patógenos con resistencia a los antimicóticos. [176]
La identificación de la resistencia a los antimicóticos se ve socavada por el diagnóstico clásico limitado de la infección, en el que no se dispone de un cultivo, lo que impide realizar pruebas de susceptibilidad. [91] Los esquemas nacionales e internacionales de vigilancia de las enfermedades fúngicas y la resistencia a los antimicóticos son limitados, lo que dificulta la comprensión de la carga de la enfermedad y la resistencia asociada. [91] La aplicación de pruebas moleculares para identificar marcadores genéticos asociados con la resistencia puede mejorar la identificación de la resistencia a los antimicóticos, pero la diversidad de mutaciones asociadas con la resistencia está aumentando en todas las especies de hongos que causan la infección. Además, varios mecanismos de resistencia dependen de la regulación positiva de genes seleccionados (por ejemplo, bombas de reflujo) en lugar de mutaciones definidas que sean susceptibles de detección molecular.
Debido al número limitado de antimicóticos en uso clínico y a la creciente incidencia mundial de resistencia a los antimicóticos, el uso de los antimicóticos existentes en combinación podría ser beneficioso en algunos casos, pero se necesita más investigación. De manera similar, otros enfoques que podrían ayudar a combatir la aparición de resistencia a los antimicóticos podrían depender del desarrollo de terapias dirigidas al huésped, como la inmunoterapia o las vacunas. [91]
Parásitos
Los parásitos protozoarios que causan enfermedades como la malaria , la tripanosomiasis , la toxoplasmosis , la criptosporidiosis y la leishmaniasis son patógenos humanos importantes. [177]
Los parásitos de la malaria que son resistentes a los medicamentos que están disponibles actualmente contra las infecciones son comunes y esto ha llevado a un aumento de los esfuerzos para desarrollar nuevos medicamentos. [178] También se ha informado de resistencia a medicamentos desarrollados recientemente, como la artemisinina . El problema de la resistencia a los medicamentos en la malaria ha impulsado los esfuerzos para desarrollar vacunas. [179]
Los tripanosomas son protozoos parásitos que causan la tripanosomiasis africana y la enfermedad de Chagas (tripanosomiasis americana). [180] [181] No existen vacunas para prevenir estas infecciones, por lo que se utilizan medicamentos como la pentamidina y la suramina , el benznidazol y el nifurtimox para tratar las infecciones. Estos medicamentos son eficaces, pero se han reportado infecciones causadas por parásitos resistentes. [177]
La leishmaniasis es una enfermedad causada por protozoos y constituye un importante problema de salud pública en todo el mundo, especialmente en los países tropicales y subtropicales. La resistencia a los medicamentos se ha convertido en una preocupación importante. [182]
Datos globales y genómicos


En 2022, los epidemiólogos genómicos informaron los resultados de una encuesta mundial sobre la resistencia a los antimicrobianos a través de la epidemiología genómica basada en aguas residuales , encontrando grandes variaciones regionales, proporcionando mapas y sugiriendo que los genes de resistencia también se transmiten entre especies microbianas que no están estrechamente relacionadas. [184] [183] La OMS proporciona los informes del Sistema mundial de vigilancia de la resistencia y el uso de antimicrobianos (GLASS) que resumen los datos anuales (por ejemplo, de 2020) sobre la RAM internacional, incluyendo también un panel interactivo. [185] [186]
Epidemiología
Reino Unido
Public Health England informó que el número total de infecciones resistentes a los antibióticos en Inglaterra aumentó un 9%, de 55.812 en 2017 a 60.788 en 2018, pero el consumo de antibióticos había disminuido un 9%, de 20,0 a 18,2 dosis diarias definidas por cada 1.000 habitantes por día entre 2014 y 2018. [187]
Estados Unidos
Los Centros para el Control y la Prevención de Enfermedades informaron que se han notificado más de 2,8 millones de casos de resistencia a los antibióticos. Sin embargo, en 2019, las muertes generales por infecciones resistentes a los antibióticos disminuyeron un 18% y las muertes en los hospitales disminuyeron un 30%. [188]
La pandemia de COVID provocó una reversión de gran parte del progreso logrado en la atenuación de los efectos de la resistencia a los antibióticos, lo que dio como resultado un mayor uso de antibióticos, infecciones más resistentes y menos datos sobre acciones preventivas. [189] Las infecciones y muertes de inicio hospitalario aumentaron un 15% en 2020, y se informaron tasas de infecciones significativamente más altas para 4 de los 6 tipos de infecciones asociadas a la atención médica. [190]
Historia
Los años 1950 a 1970 representaron la edad de oro del descubrimiento de antibióticos, donde se descubrieron innumerables nuevas clases de antibióticos para tratar enfermedades previamente incurables como la tuberculosis y la sífilis. [191] Sin embargo, desde entonces el descubrimiento de nuevas clases de antibióticos ha sido casi inexistente, y representa una situación que es especialmente problemática considerando la resiliencia de las bacterias [192] demostrada a lo largo del tiempo y el continuo mal uso y uso excesivo de antibióticos en el tratamiento. [193]
El fenómeno de la resistencia antimicrobiana causado por el uso excesivo de antibióticos fue predicho ya en 1945 por Alexander Fleming, quien dijo: "Puede llegar el día en que cualquiera pueda comprar penicilina en las tiendas. Entonces existe el peligro de que el hombre ignorante pueda fácilmente ingerir una dosis menor y, al exponer a sus microbios a cantidades no letales del fármaco, se vuelvan resistentes". [194] [195] Sin la creación de antibióticos nuevos y más fuertes, es muy posible que lleguemos a una era en la que las infecciones comunes y las lesiones menores puedan matar, y en la que procedimientos complejos como la cirugía y la quimioterapia se vuelvan demasiado riesgosos. [196] La resistencia antimicrobiana puede conducir a epidemias de enormes proporciones si no se toman medidas preventivas. En la actualidad, la resistencia antimicrobiana actual conduce a estancias hospitalarias más prolongadas, mayores costes médicos y mayor mortalidad. [193]
Sociedad y cultura
Política de innovación
Desde mediados de los años 1980, las compañías farmacéuticas han invertido en medicamentos contra el cáncer o enfermedades crónicas que tienen un mayor potencial de generar ganancias y han "reducido el énfasis o abandonado el desarrollo de antibióticos". [197] El 20 de enero de 2016, en el Foro Económico Mundial de Davos , Suiza , más de "80 compañías farmacéuticas y de diagnóstico" de todo el mundo pidieron "modelos comerciales transformacionales" a nivel mundial para estimular la investigación y el desarrollo de antibióticos y el "uso mejorado de pruebas de diagnóstico que puedan identificar rápidamente el organismo infectante". [197] Varios países están considerando o implementando modelos de pago desvinculados para nuevos antimicrobianos mediante los cuales el pago se basa en el valor en lugar del volumen de ventas de medicamentos. Esto ofrece la oportunidad de pagar por nuevos medicamentos valiosos incluso si están reservados para su uso en infecciones resistentes a medicamentos relativamente raras. [198]
Marcos legales
Algunos expertos en salud global han sostenido que se necesita un marco legal global para prevenir y controlar la resistencia a los antimicrobianos. [199] [200] [201] [202] Por ejemplo, se podrían utilizar políticas globales vinculantes para crear estándares de uso de antimicrobianos, regular la comercialización de antibióticos y fortalecer los sistemas de vigilancia global. [201] [199] Garantizar el cumplimiento de las partes involucradas es un desafío. [201] Las políticas globales de resistencia a los antimicrobianos podrían aprender lecciones del sector ambiental al adoptar estrategias que han hecho que los acuerdos ambientales internacionales sean exitosos en el pasado, como: sanciones por incumplimiento, asistencia para la implementación, reglas de toma de decisiones por mayoría de votos, un panel científico independiente y compromisos específicos. [203]
Estados Unidos
Esta sección necesita ser actualizada . ( Octubre de 2023 ) |
Para el presupuesto de los Estados Unidos de 2016 , el presidente estadounidense Barack Obama propuso casi duplicar la cantidad de fondos federales para "combatir y prevenir" la resistencia a los antibióticos a más de 1.200 millones de dólares. [204] Muchas agencias de financiación internacionales como USAID, DFID, SIDA y la Fundación Bill y Melinda Gates han prometido dinero para desarrollar estrategias para contrarrestar la resistencia a los antimicrobianos. [ cita requerida ]
El 27 de marzo de 2015, la Casa Blanca publicó un plan integral para abordar la creciente necesidad de que las agencias combatan el aumento de las bacterias resistentes a los antibióticos. El Grupo de Trabajo para Combatir las Bacterias Resistentes a los Antibióticos desarrolló el Plan de Acción Nacional para Combatir las Bacterias Resistentes a los Antibióticos con la intención de proporcionar una hoja de ruta para guiar a los EE. UU. en el desafío de la resistencia a los antibióticos y con la esperanza de salvar muchas vidas. Este plan describe las medidas que debe adoptar el gobierno federal durante los próximos cinco años para prevenir y contener los brotes de infecciones resistentes a los antibióticos, mantener la eficacia de los antibióticos que ya están en el mercado y ayudar a desarrollar diagnósticos, antibióticos y vacunas futuros. [205]
El Plan de Acción se desarrolló en torno a cinco objetivos que se centran en el fortalecimiento de la atención sanitaria, la medicina veterinaria de salud pública, la agricultura, la seguridad alimentaria y la investigación, y la industria. Estos objetivos, según los enumeró la Casa Blanca, son los siguientes:
- Retrasar la aparición de bacterias resistentes y prevenir la propagación de infecciones resistentes
- Fortalecer los esfuerzos nacionales de vigilancia de Una Salud para combatir la resistencia
- Desarrollo y uso avanzados de pruebas diagnósticas rápidas e innovadoras para la identificación y caracterización de bacterias resistentes
- Acelerar la investigación y el desarrollo básicos y aplicados de nuevos antibióticos, otros tratamientos y vacunas
- Mejorar la colaboración y las capacidades internacionales para la prevención, vigilancia y control de la resistencia a los antibióticos y la investigación y el desarrollo de antibióticos
Los siguientes son los objetivos que se han fijado para el año 2020: [205]
- Establecimiento de programas antimicrobianos en entornos hospitalarios de cuidados agudos
- Reducción de la prescripción y el uso inadecuados de antibióticos en al menos un 50% en entornos ambulatorios y un 20% en entornos hospitalarios
- Establecimiento de programas estatales de prevención de la resistencia a los antibióticos en los 50 estados
- Eliminación del uso de antibióticos de importancia médica para promover el crecimiento en animales destinados a la producción de alimentos.
Estado actual de la resistencia a los antimicrobianos en los EE.UU.
A partir de 2023, la resistencia a los antimicrobianos (RAM) sigue siendo una amenaza importante para la salud pública en los Estados Unidos. Según el Informe de 2023 sobre las amenazas de resistencia a los antibióticos de los Centros para el Control y la Prevención de Enfermedades, cada año se producen más de 2,8 millones de infecciones resistentes a los antibióticos en los EE. UU., lo que provoca al menos 35 000 muertes al año. [206] Entre los patógenos resistentes más preocupantes se encuentran las enterobacterias resistentes a los carbapenémicos (CRE), el Staphylococcus aureus resistente a la meticilina (MRSA) y el Clostridioides difficile (C. diff), todos los cuales siguen siendo responsables de infecciones graves asociadas a la atención médica (HAI).
La pandemia de COVID-19 provocó una importante disrupción en la atención médica, con un aumento en el uso de antibióticos durante el tratamiento de infecciones virales. Este aumento en la prescripción de antibióticos, junto con los sistemas de atención médica sobrecargados, contribuyó a un resurgimiento de la RAM durante los años de la pandemia. Un informe de los CDC de 2021 identificó un marcado aumento de las infecciones asociadas a la atención médica causadas por patógenos resistentes en pacientes con COVID-19, una tendencia que ha persistido hasta 2023. [207] Datos recientes sugieren que, aunque el uso de antibióticos ha disminuido después de la pandemia, algunos patógenos resistentes siguen siendo prevalentes en los entornos de atención médica. [206]
Los CDC también han ampliado su campaña Get Ahead of Sepsis en 2023, centrándose en crear conciencia sobre el papel de la RAM en la sepsis y promover el uso juicioso de los antibióticos tanto en entornos sanitarios como comunitarios. [208] Esta iniciativa ha llegado a millones de personas a través de las redes sociales, los centros de atención sanitaria y la divulgación de la salud pública, con el objetivo de educar al público sobre la importancia de prevenir las infecciones y reducir el uso indebido de antibióticos.
Políticas
Según la Organización Mundial de la Salud , los responsables de las políticas pueden ayudar a combatir la resistencia fortaleciendo el seguimiento de la resistencia y la capacidad de laboratorio y regulando y promoviendo el uso apropiado de los medicamentos. [15] Los responsables de las políticas y la industria pueden ayudar a combatir la resistencia fomentando la innovación y la investigación y el desarrollo de nuevas herramientas; y promoviendo la cooperación y el intercambio de información entre todas las partes interesadas. [15]
El gobierno de los Estados Unidos sigue dando prioridad a la mitigación de la RAM a través de políticas y legislación. En 2023, se publicó el Plan de Acción Nacional para Combatir las Bacterias Resistentes a los Antibióticos (CARB) 2023-2028, que describe los objetivos estratégicos para reducir las infecciones resistentes a los antibióticos, promover la prevención de infecciones y acelerar la investigación sobre nuevos antibióticos. [209] El plan también enfatiza la importancia de mejorar la gestión de los antibióticos en los entornos de atención médica, agricultura y veterinaria. Además, la Ley PASTEUR (Suscripciones pioneras a antimicrobianos para acabar con la resistencia creciente) ha ganado impulso en el Congreso. Si se aprueba, el proyecto de ley crearía un modelo de pago basado en suscripciones para incentivar el desarrollo de nuevos medicamentos antimicrobianos, al tiempo que respaldaría los programas de gestión de antimicrobianos para reducir el uso indebido de los antibióticos existentes. [210] Esta legislación se considera un paso fundamental para abordar las barreras económicas para el desarrollo de nuevos antimicrobianos.
Evaluación de políticas
Medir los costos y beneficios de las estrategias para combatir la resistencia a los antimicrobianos es difícil y las políticas pueden tener efectos sólo en un futuro lejano. En otras enfermedades infecciosas, este problema se ha abordado mediante el uso de modelos matemáticos. Se necesita más investigación para entender cómo se desarrolla y se propaga la resistencia a los antimicrobianos, de modo que se puedan utilizar modelos matemáticos para anticipar los efectos probables de diferentes políticas. [211]
Investigaciones adicionales
Pruebas y diagnósticos rápidos

Distinguir las infecciones que requieren antibióticos de las que se curan por sí solas es un desafío clínico. Para orientar el uso adecuado de los antibióticos y prevenir la evolución y propagación de la resistencia a los antimicrobianos, se necesitan pruebas diagnósticas que proporcionen a los médicos resultados oportunos y prácticos.
La enfermedad febril aguda es un motivo frecuente de búsqueda de atención médica en todo el mundo y una de las principales causas de morbilidad y mortalidad. En las zonas donde la incidencia de la malaria está disminuyendo, muchos pacientes febriles reciben un tratamiento inadecuado para la malaria y, en ausencia de una prueba diagnóstica sencilla para identificar causas alternativas de fiebre, los médicos suponen que una enfermedad febril no palúdica es muy probablemente una infección bacteriana, lo que lleva al uso inadecuado de antibióticos. Múltiples estudios han demostrado que el uso de pruebas de diagnóstico rápido de la malaria sin herramientas fiables para distinguir otras causas de fiebre ha dado lugar a un aumento del uso de antibióticos. [212]
Las pruebas de susceptibilidad a los antimicrobianos (AST) pueden facilitar un enfoque de medicina de precisión para el tratamiento al ayudar a los médicos a prescribir una terapia antimicrobiana más efectiva y dirigida. [213] Al mismo tiempo, con las AST fenotípicas tradicionales, puede llevar de 12 a 48 horas obtener un resultado debido al tiempo que tardan los organismos en crecer en/sobre los medios de cultivo. [214] Las pruebas rápidas, posibles gracias a las innovaciones en diagnóstico molecular , se definen como "que sean factibles dentro de un turno de trabajo de 8 horas". [214] Hay varios ensayos comerciales aprobados por la Administración de Alimentos y Medicamentos disponibles que pueden detectar genes de RAM a partir de una variedad de tipos de muestras. El progreso ha sido lento debido a una variedad de razones, incluido el costo y la regulación. [215] Sin embargo, los métodos de caracterización genotípica de RAM se utilizan cada vez más en combinación con algoritmos de aprendizaje automático en la investigación para ayudar a predecir mejor la RAM fenotípica a partir del genotipo del organismo. [216] [217]
Las técnicas ópticas, como la microscopía de contraste de fases, en combinación con el análisis de células individuales son otro método poderoso para monitorear el crecimiento bacteriano. En 2017, científicos de la Universidad de Uppsala en Suecia publicaron un método [218] que aplica principios de microfluídica y rastreo celular para monitorear la respuesta bacteriana a los antibióticos en menos de 30 minutos de tiempo total de manipulación. Esta invención recibió el premio Longitude Prize de 8 millones de libras esterlinas en AMR en 2024. Recientemente, esta plataforma ha avanzado al acoplar un chip microfluídico con pinzas ópticas [219] para aislar bacterias con fenotipo alterado directamente de la matriz analítica.
También se han probado métodos de diagnóstico rápido como intervenciones de administración de antimicrobianos para influir en los factores de la RAM en la atención médica. Se ha demostrado que la medición de procalcitonina sérica reduce la tasa de mortalidad, el consumo de antimicrobianos y los efectos secundarios relacionados con los antimicrobianos en pacientes con infecciones respiratorias, pero aún no se ha demostrado el impacto en la RAM. [220] De manera similar, se ha demostrado que las pruebas séricas en el punto de atención del biomarcador inflamatorio proteína C reactiva influyen en las tasas de prescripción de antimicrobianos en esta cohorte de pacientes, pero se requieren más investigaciones para demostrar un efecto en las tasas de RAM. [221] La investigación clínica para descartar infecciones bacterianas a menudo se realiza para pacientes con infecciones respiratorias agudas pediátricas. Actualmente no está claro si las pruebas virales rápidas afectan el uso de antibióticos en niños. [222]
Vacunas
Las vacunas son una parte esencial de la respuesta para reducir la RAM, ya que previenen infecciones, reducen el uso y el uso excesivo de antimicrobianos y retardan la aparición y propagación de patógenos resistentes a los medicamentos. [7] Los microorganismos generalmente no desarrollan resistencia a las vacunas porque las vacunas reducen la propagación de la infección y atacan al patógeno de múltiples maneras en el mismo huésped y posiblemente de diferentes maneras entre diferentes huéspedes. Además, si aumenta el uso de vacunas, hay evidencia de que las cepas de patógenos resistentes a los antibióticos disminuirán; la necesidad de antibióticos disminuirá naturalmente a medida que las vacunas prevengan la infección antes de que ocurra. [223] Un informe de 2024 de la OMS concluye que las vacunas contra 24 patógenos podrían reducir la cantidad de antibióticos necesarios en un 22% o 2500 millones de dosis diarias definidas a nivel mundial cada año. [7] Si se pudieran implementar vacunas contra todos los patógenos evaluados, podrían ahorrar un tercio de los costos hospitalarios asociados con la RAM. [7] Las personas vacunadas tienen menos infecciones y están protegidas contra posibles complicaciones de infecciones secundarias que pueden requerir medicamentos antimicrobianos o ingreso hospitalario. [7] Sin embargo, hay casos bien documentados de resistencia a las vacunas, aunque estos suelen ser un problema mucho menor que la resistencia a los antimicrobianos. [224] [225]
Aunque teóricamente son prometedoras, las vacunas antiestafilocócicas han demostrado una eficacia limitada debido a la variación inmunológica entre las especies de Staphylococcus y a la duración limitada de la eficacia de los anticuerpos producidos. Se están desarrollando y probando vacunas más eficaces. [226]
Dos ensayos de registro han evaluado las vacunas candidatas en estrategias de inmunización activa contra la infección por S. aureus . En un ensayo de fase II, se probó una vacuna bivalente de las proteínas capsulares 5 y 8 en 1804 pacientes de hemodiálisis con una fístula primaria o un acceso vascular con injerto sintético. Después de 40 semanas tras la vacunación se observó un efecto protector contra la bacteriemia por S. aureus , pero no a las 54 semanas tras la vacunación. [227] Sobre la base de estos resultados, se realizó un segundo ensayo que no logró demostrar eficacia. [228]
Merck probó V710, una vacuna dirigida a IsdB, en un ensayo aleatorizado ciego en pacientes sometidos a esternotomía media. El ensayo se dio por finalizado después de que se detectara una mayor tasa de muertes relacionadas con fallos multiorgánicos en los receptores de V710. Los receptores de la vacuna que desarrollaron infección por S. aureus tenían cinco veces más probabilidades de morir que los receptores del grupo de control que desarrollaron infección por S. aureus . [229]
Numerosos investigadores han sugerido que una vacuna de múltiples antígenos sería más eficaz, pero la falta de biomarcadores que definan la inmunidad protectora humana mantiene estas propuestas en el ámbito lógico, pero estrictamente hipotético. [228]
Terapia con anticuerpos
Los anticuerpos son prometedores contra la resistencia a los antimicrobianos. Los anticuerpos monoclonales (mAbs) se dirigen a los factores de virulencia bacterianos, ayudando a la destrucción bacteriana a través de varios mecanismos. Tres anticuerpos aprobados por la FDA se dirigen a las toxinas de B. anthracis y C. difficile . [230] [231] Las estrategias innovadoras incluyen DSTA4637S, un conjugado anticuerpo-antibiótico, y MEDI13902, un anticuerpo biespecífico dirigido a los componentes de Pseudomonas aeruginosa. [231]
Terapia alternada
La terapia alternada es un método propuesto en el que se toman dos o tres antibióticos en forma rotativa en lugar de tomar solo un antibiótico, de modo que las bacterias resistentes a un antibiótico mueren cuando se toma el siguiente. Los estudios han demostrado que este método reduce la tasa a la que surgen bacterias resistentes a los antibióticos in vitro en relación con un solo fármaco durante toda la duración del tratamiento. [232]
Los estudios han demostrado que las bacterias que desarrollan resistencia a los antibióticos hacia un grupo de antibióticos pueden volverse más sensibles a otros. [233] Este fenómeno se puede utilizar para seleccionar contra bacterias resistentes utilizando un enfoque denominado ciclo de sensibilidad colateral, que recientemente se ha descubierto que es relevante en el desarrollo de estrategias de tratamiento para infecciones crónicas causadas por Pseudomonas aeruginosa . [234] A pesar de su promesa, los estudios clínicos y experimentales a gran escala revelaron evidencia limitada de susceptibilidad al ciclo de antibióticos en varios patógenos. [235] [236]
Desarrollo de nuevos fármacos
Desde el descubrimiento de los antibióticos, los esfuerzos de investigación y desarrollo (I+D) han proporcionado nuevos medicamentos a tiempo para tratar las bacterias que se volvieron resistentes a los antibióticos más antiguos, pero en la década de 2000 ha habido preocupación de que el desarrollo se haya ralentizado lo suficiente como para que las personas gravemente enfermas puedan quedarse sin opciones de tratamiento. [237] [238] Otra preocupación es que los médicos pueden volverse reacios a realizar cirugías de rutina debido al mayor riesgo de infección dañina. [239] Los tratamientos de respaldo pueden tener efectos secundarios graves; por ejemplo, los antibióticos como los aminoglucósidos (como amikacina , gentamicina , kanamicina , estreptomicina , etc.) utilizados para el tratamiento de la tuberculosis resistente a los medicamentos y la fibrosis quística pueden causar trastornos respiratorios, sordera e insuficiencia renal. [240] [241]
La crisis potencial en cuestión es el resultado de una marcada disminución en la investigación y el desarrollo de la industria. [242] [243] La escasa inversión financiera en la investigación de antibióticos ha exacerbado la situación. [244] [242] La industria farmacéutica tiene pocos incentivos para invertir en antibióticos debido al alto riesgo y porque los posibles retornos financieros tienen menos probabilidades de cubrir el costo del desarrollo que para otros productos farmacéuticos. [245] En 2011, Pfizer , una de las últimas grandes compañías farmacéuticas que desarrollaba nuevos antibióticos, cerró su esfuerzo de investigación principal, citando los bajos retornos para los accionistas en relación con los medicamentos para enfermedades crónicas. [246] Sin embargo, las compañías farmacéuticas pequeñas y medianas todavía están activas en la investigación de medicamentos antibióticos. En particular, aparte de las metodologías clásicas de química sintética, los investigadores han desarrollado una plataforma de biología sintética combinatoria a nivel de célula única en una forma de cribado de alto rendimiento para diversificar nuevos lanthipéptidos . [247]
En los 5 a 10 años transcurridos desde 2010, se ha producido un cambio significativo en las formas en que se descubren y desarrollan nuevos agentes antimicrobianos, principalmente a través de la formación de iniciativas de financiación público-privadas. Estas incluyen CARB-X , [248] que se centra en el desarrollo no clínico y en fase temprana de nuevos antibióticos, vacunas y diagnósticos rápidos; Novel Gram Negative Antibiotic (GNA-NOW), [249] que forma parte de la Iniciativa de Medicamentos Innovadores de la UE ; y Replenishing and Enabling the Pipeline for Anti-infective Resistance Impact Fund (REPAIR). [250] El desarrollo clínico en etapas posteriores cuenta con el apoyo del Fondo de Acción contra la RAM, que a su vez cuenta con el apoyo de múltiples inversores con el objetivo de desarrollar entre 2 y 4 nuevos agentes antimicrobianos para 2030. La realización de estos ensayos se ve facilitada por redes nacionales e internacionales apoyadas por la Red de Investigación Clínica del Instituto Nacional de Investigación en Salud y Atención (NIHR), la Alianza Europea de Investigación Clínica en Enfermedades Infecciosas (ECRAID) y la recientemente formada ADVANCE-ID, que es una red de investigación clínica con sede en Asia. [251] La Asociación Mundial de Investigación y Desarrollo de Antimicrobianos (GARDP) está generando nueva evidencia sobre las amenazas globales de la RAM, como la sepsis neonatal, el tratamiento de infecciones bacterianas graves e infecciones de transmisión sexual, además de abordar el acceso global a medicamentos antibacterianos nuevos y estratégicamente importantes. [252]
El descubrimiento y desarrollo de nuevos agentes antimicrobianos se ha visto facilitado por los avances regulatorios, que han sido liderados principalmente por la Agencia Europea de Medicamentos (EMA) y la Administración de Alimentos y Medicamentos (FDA). Estos procesos están cada vez más alineados, aunque siguen existiendo diferencias importantes y los desarrolladores de fármacos deben preparar documentos separados. Se han desarrollado nuevas vías de desarrollo para ayudar con la aprobación de nuevos agentes antimicrobianos que aborden necesidades no satisfechas, como la Vía Poblacional Limitada para Medicamentos Antibacterianos y Antifúngicos (LPAD). Estas nuevas vías son necesarias debido a las dificultades para realizar ensayos clínicos de fase III definitivos a gran escala de manera oportuna.
Algunos de los impedimentos económicos para el desarrollo de nuevos agentes antimicrobianos se han abordado mediante innovadores esquemas de reembolso que desvinculan el pago de los antimicrobianos de las ventas basadas en el volumen. En el Reino Unido, el Instituto Nacional para la Excelencia Clínica (NICE) ha puesto en marcha un esquema de recompensa por el ingreso al mercado mediante el cual se paga una tarifa de suscripción anual por el uso de agentes antimicrobianos estratégicamente valiosos; el cefiderocol y la ceftazidima-aviabactam son los primeros agentes que se utilizan de esta manera y el esquema es un modelo potencial para programas comparables en otros países.
Las clases disponibles de medicamentos antimicóticos aún son limitadas, pero a partir de 2021 se están desarrollando nuevas clases de antimicóticos que están pasando por varias etapas de ensayos clínicos para evaluar su rendimiento. [253]
Los científicos han comenzado a utilizar enfoques computacionales avanzados con supercomputadoras para el desarrollo de nuevos derivados de antibióticos para abordar la resistencia a los antimicrobianos. [243] [254] [255]
Biomateriales
El uso de alternativas sin antibióticos en el tratamiento de infecciones óseas puede ayudar a disminuir el uso de antibióticos y, por lo tanto, la resistencia a los antimicrobianos. [35] Se ha demostrado que el material de regeneración ósea vidrio bioactivo S53P4 inhibe eficazmente el crecimiento bacteriano de hasta 50 bacterias clínicamente relevantes, incluidas MRSA y MRSE. [256] [257] [258]
Nanomateriales
Durante las últimas décadas, los nanomateriales de cobre y plata han demostrado tener características atractivas para el desarrollo de una nueva familia de agentes antimicrobianos. [259] Las nanopartículas (1-100 nm) muestran propiedades únicas y son prometedoras como agentes antimicrobianos contra bacterias resistentes. Las nanopartículas de plata (AgNP) y de oro (AuNP) se han estudiado ampliamente, alterando las membranas celulares bacterianas e interfiriendo con la síntesis de proteínas. Las nanopartículas de óxido de zinc (ZnO NP), cobre (CuNP) y sílice (SiNP) también presentan propiedades antimicrobianas. Sin embargo, los altos costos de síntesis, la posible toxicidad y la inestabilidad plantean desafíos. Para superarlos, se exploran métodos de síntesis biológica y terapias combinadas con otros antimicrobianos. También se están investigando la biocompatibilidad mejorada y la focalización para mejorar la eficacia. [231]
Redescubrimiento de tratamientos antiguos
De manera similar a lo que ocurre en la terapia contra la malaria, donde se han encontrado tratamientos exitosos basados en recetas antiguas, [260] ya se ha logrado cierto éxito en el descubrimiento y prueba de medicamentos antiguos y otros tratamientos que son eficaces contra las bacterias RAM. [261]
Vigilancia de la comunidad computacional
Una de las herramientas clave identificadas por la OMS y otros para la lucha contra la creciente resistencia a los antimicrobianos es una mejor vigilancia de la propagación y el movimiento de los genes de la resistencia a los antimicrobianos a través de diferentes comunidades y regiones. Los recientes avances en la secuenciación de ADN de alto rendimiento como resultado del Proyecto Genoma Humano han dado como resultado la capacidad de determinar los genes microbianos individuales en una muestra. [262] Junto con la disponibilidad de bases de datos de genes de resistencia a los antimicrobianos conocidos, como la Base de Datos Integral de Resistencia a los Antimicrobianos (CARD) [263] [264] y ResFinder , [265] [266] esto permite la identificación de todos los genes de resistencia a los antimicrobianos dentro de la muestra, el llamado " resisoma ". Al hacerlo, se puede determinar un perfil de estos genes dentro de una comunidad o entorno, lo que proporciona información sobre cómo se está propagando la resistencia a los antimicrobianos a través de una población y permite la identificación de la resistencia que es motivo de preocupación. [262]
Terapia con fagos
La terapia con fagos es el uso terapéutico de bacteriófagos para tratar infecciones bacterianas patógenas . [267] La terapia con fagos tiene muchas aplicaciones potenciales en la medicina humana, así como en la odontología, la ciencia veterinaria y la agricultura. [268]
La terapia con fagos se basa en el uso de bacteriófagos naturales para infectar y lisar bacterias en el sitio de la infección en un huésped. Debido a los avances actuales en genética y biotecnología, estos bacteriófagos pueden fabricarse para tratar infecciones específicas. [269] Los fagos pueden ser bioingeniados para atacar infecciones bacterianas resistentes a múltiples fármacos, y su uso implica el beneficio adicional de prevenir la eliminación de bacterias beneficiosas en el cuerpo humano. [30] Los fagos destruyen las paredes celulares bacterianas y la membrana mediante el uso de proteínas líticas que matan las bacterias haciendo muchos agujeros desde adentro hacia afuera. [270] Los bacteriófagos pueden incluso poseer la capacidad de digerir la biopelícula que muchas bacterias desarrollan que las protege de los antibióticos para infectar y matar bacterias de manera efectiva. La bioingeniería puede desempeñar un papel en la creación de bacteriófagos exitosos. [270]
Comprender las interacciones mutuas y las evoluciones de las poblaciones bacterianas y de fagos en el entorno de un cuerpo humano o animal es esencial para una terapia racional con fagos. [271]
Los bacteriófagos se utilizan contra bacterias resistentes a los antibióticos en Georgia ( Instituto George Eliava ) y en un instituto en Wrocław , Polonia. [272] [273] Los cócteles de bacteriófagos son medicamentos comunes que se venden sin receta en las farmacias de los países del este. [274] [275] En Bélgica, cuatro pacientes con infecciones musculoesqueléticas graves recibieron terapia con bacteriófagos con antibióticos concomitantes. Después de un solo ciclo de terapia con fagos, no se produjo ninguna recurrencia de la infección y no se detectaron efectos secundarios graves relacionados con la terapia. [276]
Véase también
- Alianza para el uso prudente de antibióticos
- Resistencia a los antimicrobianos en Australia
- Antibiótico de amplio espectro
- Resistencia a la colonización
- Medicamento de último recurso
- Ingeniería genética
- (KPC) gen de resistencia antibacteriana
- Bacterias gramnegativas resistentes a múltiples fármacos
- Tuberculosis multirresistente
- Metalo-beta-lactamasa 1 de Nueva Delhi
- Células persistentes
- Superfamilia de resistencia-nodulación-división celular (RND)
- Resistoma
Referencias
- ^ Protocolo de prueba de susceptibilidad por difusión en disco de Kirby-Bauer Archivado el 26 de junio de 2011 en Wayback Machine , Jan Hudzicki, ASM
- ^ ab "Acerca de la resistencia a los antimicrobianos". Centros para el Control y la Prevención de Enfermedades de EE. UU . . 22 de abril de 2024 . Consultado el 11 de octubre de 2024 .
- ^ abc «Resistencia a los antimicrobianos, hoja informativa N° 194». who.int . Abril de 2014. Archivado desde el original el 10 de marzo de 2015 . Consultado el 7 de marzo de 2015 .
- ^ ab Tanwar J, Das S, Fatima Z, Hameed S (2014). "Resistencia a múltiples fármacos: una crisis emergente". Perspectivas interdisciplinarias sobre enfermedades infecciosas . 2014 : 541340. doi : 10.1155/2014/541340 . PMC 4124702. PMID 25140175 .
- ^ Magiorakos AP, Srinivasan A, Carey RB, Carmeli Y, Falagas ME, Giske CG, et al. (marzo de 2012). "Bacterias resistentes a múltiples fármacos, ampliamente resistentes a fármacos y panresistentes a fármacos: una propuesta internacional de expertos para definiciones estándar provisionales de resistencia adquirida". Microbiología clínica e infecciones . 18 (3): 268–281. doi : 10.1111/j.1469-0691.2011.03570.x . PMID 21793988.
- ^ Dabour R, Meirson T, Samson AO (diciembre de 2016). "La resistencia global a los antibióticos es en su mayoría periódica". Journal of Global Antimicrobial Resistance . 7 : 132–134. doi :10.1016/j.jgar.2016.09.003. PMID 27788414.
- ^ abcdefghij «Un mejor uso de las vacunas podría reducir el uso de antibióticos en 2.500 millones de dosis al año, afirma la OMS». Organización Mundial de la Salud . 10 de octubre de 2024 . Consultado el 11 de octubre de 2024 .
- ^ ab Saha M, Sarkar A (diciembre de 2021). "Revisión sobre las múltiples facetas de la resistencia a los fármacos: un desafío creciente en el siglo XXI". Revista de xenobióticos . 11 (4): 197–214. doi : 10.3390/jox11040013 . PMC 8708150 . PMID 34940513.
- ^ Trabajo sueco sobre la contención de la resistencia a los antibióticos: herramientas, métodos y experiencias (PDF) . Estocolmo: Agencia de Salud Pública de Suecia. 2014. pp. 16-17, 121-128. ISBN 978-91-7603-011-0. Archivado (PDF) del original el 23 de julio de 2015 . Consultado el 23 de julio de 2015 .
- ^ Chanel S, Doherty B (10 de septiembre de 2020). «Las 'superbacterias' son un riesgo mucho mayor que el Covid en el Pacífico, advierte un científico». The Guardian . ISSN 0261-3077. Archivado desde el original el 5 de diciembre de 2022 . Consultado el 14 de septiembre de 2020 .
- ^ Rodríguez-Baño J, Rossolini GM, Schultsz C, Tacconelli E, Murthy S, Ohmagari N, et al. (marzo de 2021). "Consideraciones clave sobre los posibles impactos de la pandemia de COVID-19 en la investigación y vigilancia de la resistencia a los antimicrobianos". Trans R Soc Trop Med Hyg . 115 (10): 1122–1129. doi :10.1093/trstmh/trab048. PMC 8083707 . PMID 33772597.
- ^ "¿Qué es la resistencia a los medicamentos?". niaid.nih.gov . Archivado desde el original el 27 de julio de 2015. Consultado el 26 de julio de 2015 .
- ^ "CDC: Sea inteligente: sepa cuándo funcionan los antibióticos". Cdc.gov. 29 de mayo de 2018. Archivado desde el original el 29 de abril de 2015. Consultado el 12 de junio de 2013 .
- ^ MacGowan A, Macnaughton E (1 de octubre de 2017). «Resistencia a los antibióticos». Medicina . 45 (10): 622–628. doi :10.1016/j.mpmed.2017.07.006.
- ^ abcde "El primer informe mundial de la OMS sobre la resistencia a los antibióticos revela una amenaza grave y mundial para la salud pública" Archivado el 2 de mayo de 2014 en Wayback Machine. Consultado el 2 de mayo de 2014.
- ^ abc Murray CJ, Ikuta KS, Sharara F, Swetschinski L, Robles Aguilar G, Gray A, et al. (Antimicrobial Resistance Collaborators) (febrero de 2022). "Carga mundial de resistencia bacteriana a los antimicrobianos en 2019: un análisis sistemático". Lancet . 399 (10325): 629–655. doi :10.1016/S0140-6736(21)02724-0. PMC 8841637 . PMID 35065702. S2CID 246077406.
- ^ "Resistencia a los antibióticos". who.int . Archivado desde el original el 21 de mayo de 2021 . Consultado el 16 de marzo de 2020 .
- ^ Cassini A, Högberg LD, Plachouras D, Quattrocchi A, Hoxha A, Simonsen GS, et al. (enero de 2019). "Muertes atribuibles y años de vida ajustados por discapacidad causados por infecciones con bacterias resistentes a los antibióticos en la UE y el Espacio Económico Europeo en 2015: un análisis de modelado a nivel de población". The Lancet. Enfermedades infecciosas . 19 (1): 56–66. doi :10.1016/S1473-3099(18)30605-4. PMC 6300481 . PMID 30409683.
- ^ "Las bacterias resistentes a los antibióticos son responsables de más de 33.000 muertes en Europa en 2015, según un estudio". The Pharmaceutical Journal . 7 de noviembre de 2018. Archivado desde el original el 28 de marzo de 2023 . Consultado el 28 de marzo de 2023 .
- ^ Mestrovic T, Robles Aguilar G, Swetschinski LR, Ikuta KS, Gray AP, Davis Weaver N, et al. (noviembre de 2022). "La carga de resistencia bacteriana a los antimicrobianos en la región europea de la OMS en 2019: un análisis sistemático transnacional". The Lancet. Salud pública . 7 (11): e897–e913. doi :10.1016/S2468-2667(22)00225-0. hdl :10023/26218. PMC 9630253 . PMID 36244350.
- ^ "Resistencia a los antimicrobianos" Cambridge Medicine Journal" . Consultado el 27 de febrero de 2020 .[ enlace muerto permanente ]
- ^ ab Holmes AH, Moore LS, Sundsfjord A, Steinbakk M, Regmi S, Karkey A, et al. (enero de 2016). "Entender los mecanismos y los impulsores de la resistencia a los antimicrobianos". Lancet . 387 (10014): 176–87. doi :10.1016/S0140-6736(15)00473-0. hdl : 10044/1/32225 . PMID 26603922. S2CID 1944665. Archivado desde el original el 14 de abril de 2022 . Consultado el 5 de diciembre de 2021 .
- ^ ab "Sala de prensa de los CDC". CDC . 1 de enero de 2016. Archivado desde el original el 9 de marzo de 2023 . Consultado el 28 de febrero de 2023 .
- ^ ab Michael CA, Dominey-Howes D, Labbate M (2014). "La crisis de resistencia a los antimicrobianos: causas, consecuencias y gestión". Frontiers in Public Health . 2 : 145. doi : 10.3389/fpubh.2014.00145 . PMC 4165128 . PMID 25279369.
- ^ "Selección natural". evolution.berkeley.edu . Archivado desde el original el 30 de octubre de 2019 . Consultado el 10 de marzo de 2020 .
- ^ Larsen J, Raisen CL, Ba X, Sadgrove NJ, Padilla-González GF, Simmonds MS, et al. (febrero de 2022). "La aparición de resistencia a la meticilina es anterior al uso clínico de antibióticos". Nature . 602 (7895): 135–141. Bibcode :2022Natur.602..135L. doi :10.1038/s41586-021-04265-w. PMC 8810379 . PMID 34987223.
- ^ Crits-Christoph A, Hallowell HA, Koutouvalis K, Suez J (31 de diciembre de 2022). "¿Microbios buenos, genes malos? La diseminación de la resistencia a los antimicrobianos en el microbioma humano". Microbios intestinales . 14 (1): 2055944. doi :10.1080/19490976.2022.2055944. PMC 8959533 . PMID 35332832.
- ^ abc Ferri M, Ranucci E, Romagnoli P, Giaccone V (septiembre de 2017). "Resistencia a los antimicrobianos: una amenaza global emergente para los sistemas de salud pública". Critical Reviews in Food Science and Nutrition . 57 (13): 2857–2876. doi :10.1080/10408398.2015.1077192. PMID 26464037. S2CID 24549694.
- ^ "Base de datos mundial para el seguimiento de la resistencia a los antimicrobianos (RAM) Encuesta de autoevaluación de países (TrACSS)". amrcountryprogress.org . Archivado desde el original el 28 de marzo de 2023 . Consultado el 28 de marzo de 2023 .
- ^ abcd Rather IA, Kim BC, Bajpai VK, Park YH (mayo de 2017). "Automedicación y resistencia a los antibióticos: crisis, desafíos actuales y prevención". Revista Saudita de Ciencias Biológicas . 24 (4): 808–812. doi :10.1016/j.sjbs.2017.01.004. PMC 5415144 . PMID 28490950.
- ^ ab Torres NF, Chibi B, Middleton LE, Solomon VP, Mashamba-Thompson TP (marzo de 2019). "Evidencia de factores que influyen en la automedicación con antibióticos en países de ingresos bajos y medios: una revisión sistemática de alcance". Salud pública . 168 : 92–101. doi :10.1016/j.puhe.2018.11.018. PMID 30716570. S2CID 73434085.
- ^ Ayukekbong JA, Ntemgwa M, Atabe AN (15 de mayo de 2017). "La amenaza de la resistencia a los antimicrobianos en los países en desarrollo: causas y estrategias de control". Resistencia a los antimicrobianos y control de infecciones . 6 (1): 47. doi : 10.1186/s13756-017-0208-x . PMC 5433038 . PMID 28515903.
- ^ Chen C, Patterson B, Simpson R, Li Y, Chen Z, Lv Q, et al. (9 de agosto de 2022). "¿Las fluoroquinolonas aumentan la incidencia y la mortalidad por aneurisma o disección aórtica? Una revisión sistemática y un metanálisis". Frontiers in Cardiovascular Medicine . 9 : 949538. doi : 10.3389/fcvm.2022.949538 . PMC 9396038 . PMID 36017083.
- ^ Shu Y, Zhang Q, He X, Liu Y, Wu P, Chen L (6 de septiembre de 2022). "Sospecha de tendinitis y rotura de tendón asociadas a fluoroquinolonas: un análisis de farmacovigilancia de 2016 a 2021 basado en la base de datos FAERS". Frontiers in Pharmacology . 13 : 990241. doi : 10.3389/fphar.2022.990241 . PMC 9486157 . PMID 36147351.
- ^ abc Ventola CL (abril de 2015). "La crisis de resistencia a los antibióticos: parte 1: causas y amenazas". P & T . 40 (4): 277–83. PMC 4378521 . PMID 25859123.
- ^ Fleming-Dutra KE, Hersh AL, Shapiro DJ, Bartoces M, Enns EA, File TM, et al. (mayo de 2016). "Prevalencia de prescripciones de antibióticos inapropiadas entre las visitas de atención ambulatoria en EE. UU., 2010-2011". JAMA . 315 (17): 1864–73. doi : 10.1001/jama.2016.4151 . PMID 27139059.
- ^ Strachan CR, Davies J (febrero de 2017). "Los porqués y los motivos de la resistencia a los antibióticos". Cold Spring Harbor Perspectives in Medicine . 7 (2): a025171. doi :10.1101/cshperspect.a025171. PMC 5287056 . PMID 27793964.
- ^ Harris A, Chandramohan S, Awali RA, Grewal M, Tillotson G, Chopra T (agosto de 2019). "Actitud y conocimiento de los médicos con respecto al uso de antibióticos y la resistencia en entornos ambulatorios". American Journal of Infection Control . 47 (8): 864–868. doi :10.1016/j.ajic.2019.02.009. PMID 30926215. S2CID 88482220.
- ^ Joshi MP (17 de febrero de 2021). "No dejemos que el Covid impulse a otro asesino". Revista Knowable . doi : 10.1146/knowable-021621-1 . Archivado desde el original el 22 de octubre de 2021. Consultado el 10 de agosto de 2022 .
- ^ Rawson TM, Moore LS, Zhu N, Ranganathan N, Skolimowska K, Gilchrist M, et al. (diciembre de 2020). "Coinfección bacteriana y fúngica en individuos con coronavirus: una revisión rápida para respaldar la prescripción de antimicrobianos para COVID-19". Enfermedades infecciosas clínicas . 71 (9): 2459–2468. doi :10.1093/cid/ciaa530. PMC 7197596 . PMID 32358954.
- ^ Barnes S. "Un estudio de Rutgers descubre que el uso excesivo de antibióticos se debe a conceptos erróneos e incentivos financieros". The Daily Targum . Archivado desde el original el 6 de diciembre de 2021. Consultado el 16 de febrero de 2021 .
- ^ Blaser MJ, Melby MK, Lock M, Nichter M (febrero de 2021). "Explicación de la variación y el uso excesivo de antibióticos entre los seres humanos". BioEssays . 43 (2): e2000163. doi :10.1002/bies.202000163. PMID 33410142. S2CID 230811912.
- ^ "Antimicrobianos | Asociación Médica Veterinaria Estadounidense". avma.org . Archivado desde el original el 24 de abril de 2024 . Consultado el 24 de abril de 2024 .
- ^ Caneschi A, Bardhi A, Barbarossa A, Zaghini A (marzo de 2023). "El uso de antibióticos y la resistencia a los antimicrobianos en la medicina veterinaria, un fenómeno complejo: una revisión narrativa". Antibióticos . 12 (3): 487. doi : 10.3390/antibiotics12030487 . PMC 10044628 . PMID 36978354.
- ^ "¿La COVID-19 ha empeorado la crisis de las superbacterias?". Global News . Archivado desde el original el 12 de febrero de 2022 . Consultado el 12 de febrero de 2022 .
- ^ Lucien MA, Canarie MF, Kilgore PE, Jean-Denis G, Fénélon N, Pierre M, et al. (Marzo de 2021). "Antibióticos y resistencia a los antimicrobianos en la era COVID-19: perspectiva desde entornos con recursos limitados". Revista Internacional de Enfermedades Infecciosas . 104 : 250–254. doi :10.1016/j.ijid.2020.12.087. PMC 7796801 . PMID 33434666.
- ^ "COVID-19 y resistencia a los antibióticos". Centros para el Control y la Prevención de Enfermedades . 18 de noviembre de 2021. Archivado desde el original el 21 de febrero de 2022. Consultado el 21 de febrero de 2022 .
- ^ Knight GM, Glover RE, McQuaid CF, Olaru ID, Gallandat K, Leclerc QJ, et al. (febrero de 2021). "Resistencia a los antimicrobianos y COVID-19: intersecciones e implicaciones". eLife . 10 . doi : 10.7554/eLife.64139 . PMC 7886324 . PMID 33588991. S2CID 231936902.
- ^ Lu J, Guo J (enero de 2021). "La desinfección propaga la resistencia a los antimicrobianos". Science . 371 (6528): 474. Bibcode :2021Sci...371..474L. doi : 10.1126/science.abg4380 . PMID 33510019. S2CID 231730007.
- ^ Lobie TA, Roba AA, Booth JA, Kristiansen KI, Aseffa A, Skarstad K, et al. (octubre de 2021). "Resistencia a los antimicrobianos: un desafío que aguarda la era post-COVID-19". Revista Internacional de Enfermedades Infecciosas . 111 : 322–325. doi :10.1016/j.ijid.2021.09.003. PMC 8425743 . PMID 34508864. S2CID 237444117.
- ^ "Los líderes mundiales aprueban un compromiso histórico para reducir las muertes por resistencia a los antibióticos en un 10 % para 2030 - Health Policy Watch". 26 de septiembre de 2024. Consultado el 28 de septiembre de 2024 .
- ^ "Reunión de alto nivel de la Asamblea General de las Naciones Unidas sobre la resistencia a los antimicrobianos 2024". www.who.int . Consultado el 28 de septiembre de 2024 .
- ^ Musoke D, Namata C, Lubega GB, Niyongabo F, Gonza J, Chidziwisano K, et al. (octubre de 2021). "El papel de la salud ambiental en la prevención de la resistencia a los antimicrobianos en países de ingresos bajos y medios". Salud ambiental y medicina preventiva . 26 (1): 100. Bibcode :2021EHPM...26..100M. doi : 10.1186/s12199-021-01023-2 . PMC 8493696 . PMID 34610785.
- ^ abcdef Fletcher S (julio de 2015). "Entender la contribución de los factores ambientales en la propagación de la resistencia a los antimicrobianos". Salud ambiental y medicina preventiva . 20 (4): 243–252. Bibcode :2015EHPM...20..243F. doi : 10.1007 /s12199-015-0468-0. PMC 4491066. PMID 25921603.
- ^ abcdef Ahmad I, Malak HA, Abulreesh HH (diciembre de 2021). «Resistencia antimicrobiana ambiental y sus impulsores: una amenaza potencial para la salud pública». Journal of Global Antimicrobial Resistance . 27 : 101–111. doi :10.1016/j.jgar.2021.08.001. PMID 34454098.
- ^ Monger XC, Gilbert AA, Saucier L, Vincent AT (octubre de 2021). "Resistencia a los antibióticos: del cerdo a la carne". Antibióticos . 10 (10): 1209. doi : 10.3390/antibiotics10101209 . PMC 8532907 . PMID 34680790.
- ^ Torrella K (8 de enero de 2023). «Big Meat simplemente no puede dejar los antibióticos». Vox . Archivado desde el original el 23 de enero de 2023. Consultado el 23 de enero de 2023 .
- ^ ab Martin MJ, Thottathil SE, Newman TB (diciembre de 2015). "Uso excesivo de antibióticos en la ganadería: un llamado a la acción para los proveedores de atención médica". American Journal of Public Health . 105 (12): 2409–2410. doi :10.2105/AJPH.2015.302870. PMC 4638249 . PMID 26469675.
- ^ "Uso de antibióticos en la agricultura". saveourantibiotics.org . Archivado desde el original el 3 de abril de 2024. Consultado el 21 de marzo de 2024 .
- ^ Tang KL, Caffrey NP, Nóbrega DB, Cork SC, Ronksley PE, Barkema HW, et al. (noviembre de 2017). "Restricción del uso de antibióticos en animales productores de alimentos y sus asociaciones con la resistencia a los antibióticos en animales productores de alimentos y seres humanos: una revisión sistemática y metanálisis". The Lancet. Salud planetaria . 1 (8): e316–e327. doi :10.1016/S2542-5196(17)30141-9. PMC 5785333 . PMID 29387833.
- ^ ab Innes GK, Randad PR, Korinek A, Davis MF, Price LB, So AD, et al. (abril de 2020). "Costos sociales externos de la resistencia a los antimicrobianos en humanos atribuibles al uso de antimicrobianos en el ganado". Revisión anual de salud pública . 41 (1): 141–157. doi :10.1146/annurev-publhealth-040218-043954. PMC 7199423 . PMID 31910712.
- ^ "Conceptos básicos de la directiva sobre alimentación veterinaria (VFD) | Asociación Médica Veterinaria Estadounidense". avma.org . Archivado desde el original el 24 de abril de 2024 . Consultado el 24 de abril de 2024 .
- ^ US EPA O (15 de marzo de 2013). "¿Qué son los pesticidas antimicrobianos?". US EPA . Archivado desde el original el 27 de noviembre de 2022. Consultado el 28 de febrero de 2020 .
- ^ Ramakrishnan B, Venkateswarlu K, Sethunathan N, Megharaj M (marzo de 2019). "Aplicaciones locales pero implicaciones globales: ¿pueden los pesticidas impulsar a los microorganismos a desarrollar resistencia a los antimicrobianos?". La ciencia del medio ambiente total . 654 : 177–189. Bibcode :2019ScTEn.654..177R. doi :10.1016/j.scitotenv.2018.11.041. PMID 30445319. S2CID 53568193.
- ^ Rhodes J, Abdolrasouli A, Dunne K, Sewell TR, Zhang Y, Ballard E, et al. (mayo de 2022). "La genómica de poblaciones confirma la adquisición de la infección por Aspergillus fumigatus resistente a fármacos por parte de los humanos a partir del medio ambiente". Nature Microbiology . 7 (5): 663–674. doi :10.1038/s41564-022-01091-2. PMC 9064804 . PMID 35469019.
- ^ ab Verweij PE, Arendrup MC, Alastruey-Izquierdo A, Gold JA, Lockhart SR, Chiller T, et al. (diciembre de 2022). "Uso dual de antifúngicos en medicina y agricultura: ¿Cómo ayudamos a prevenir el desarrollo de resistencia en patógenos humanos?". Actualizaciones sobre resistencia a medicamentos . 65 : 100885. doi : 10.1016/j.drup.2022.100885 . PMC 10693676. PMID 36283187. S2CID 253052170.
- ^ ab Perron GG, Whyte L, Turnbaugh PJ, Goordial J, Hanage WP, Dantas G, et al. (25 de marzo de 2015). "La caracterización funcional de bacterias aisladas de suelo ártico antiguo expone diversos mecanismos de resistencia a los antibióticos modernos". PLOS ONE . 10 (3): e0069533. Bibcode :2015PLoSO..1069533P. doi : 10.1371/journal.pone.0069533 . PMC 4373940 . PMID 25807523.
- ^ McGee D, Gribkoff E (4 de agosto de 2022). «Permafrost». Portal climático del MIT . Archivado desde el original el 27 de septiembre de 2023. Consultado el 27 de septiembre de 2023 .
- ^ Fox-Kemper, B., HT Hewitt, C. Xiao, G. Aðalgeirsdóttir, SS Drijfhout, TL Edwards, NR Golledge, M. Hemer, RE Kopp, G. Krinner, A. Mix, D. Notz, S. Nowicki, IS Nurhati, L. Ruiz, J.-B. Sallée, ABA Slangen e Y. Yu, 2021: Capítulo 9: Cambios en el océano, la criosfera y el nivel del mar Archivado el 24 de octubre de 2022 en Wayback Machine . En Cambio climático 2021: la base científica física. Contribución del Grupo de Trabajo I al Sexto Informe de Evaluación del Grupo Intergubernamental de Expertos sobre el Cambio Climático [Masson-Delmotte, V., P. Zhai, A. Pirani, SL Connors, C. Péan, S. Berger, N. Caud, Y. Chen, L. Goldfarb, MI Gomis, M. Huang, K. Leitzell, E. Lonnoy, JBR Matthews, TK Maycock, T. Waterfield, O. Yelekçi, R. Yu y B. Zhou (eds.)]. Cambridge University Press, Cambridge, Reino Unido y Nueva York, NY, EE.UU., págs. 1211–1362, doi:10.1017/9781009157896.011.
- ^ Michaeleen D. "¿Hay virus zombis, como la gripe de 1918, que se descongelan en el permafrost?". NPR.org . Archivado desde el original el 24 de abril de 2023. Consultado el 4 de abril de 2023 .
- ^ "Se cree que el brote de ántrax en Rusia es resultado del deshielo del permafrost". NPR.org . Archivado desde el original el 22 de septiembre de 2016. Consultado el 24 de septiembre de 2016 .
- ^ Ng TF, Chen LF, Zhou Y, Shapiro B, Stiller M, Heintzman PD, et al. (noviembre de 2014). "Preservación de genomas virales en heces de caribú de 700 años de una placa de hielo subártica". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 111 (47): 16842–16847. Bibcode :2014PNAS..11116842N. doi : 10.1073/pnas.1410429111 . PMC 4250163 . PMID 25349412.
- ^ Legendre M, Lartigue A, Bertaux L, Jeudy S, Bartoli J, Lescot M, et al. (septiembre de 2015). "Estudio en profundidad de Mollivirus sibericum, un nuevo virus gigante de 30.000 años de antigüedad que infecta a Acanthamoeba". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 112 (38): E5327–E5335. Código Bibliográfico :2015PNAS..112E5327L. doi : 10.1073/pnas.1510795112 . JSTOR 26465169. PMC 4586845 . PMID 26351664.
- ^ Alempic JM, Lartigue A, Goncharov AE, Grosse G, Strauss J, Tikhonov AN, et al. (febrero de 2023). "Una actualización sobre los virus eucariotas revividos a partir del permafrost antiguo". Viruses . 15 (2): 564. doi : 10.3390/v15020564 . PMC 9958942 . PMID 36851778.
- ^ Alund NN (9 de marzo de 2023). «Los científicos reviven un 'virus zombi' que estuvo congelado durante casi 50.000 años». USA Today . Archivado desde el original el 24 de abril de 2023. Consultado el 23 de abril de 2023 .
- ^ Sajjad W, Rafiq M, Din G, Hasan F, Iqbal A, Zada S, et al. (septiembre de 2020). "Resurrección de microbios inactivos y resistomas presentes en el mundo congelado natural: ¿realidad o mito?". La ciencia del medio ambiente total . 735 : 139275. Bibcode :2020ScTEn.73539275S. doi :10.1016/j.scitotenv.2020.139275. PMID 32480145. S2CID 219169932.
- ^ Miner KR, D'Andrilli J, Mackelprang R, Edwards A, Malaska MJ, Waldrop MP, et al. (30 de septiembre de 2021). "Riesgos biogeoquímicos emergentes de la degradación del permafrost del Ártico". Nature Climate Change . 11 (1): 809–819. Código Bibliográfico :2021NatCC..11..809M. doi :10.1038/s41558-021-01162-y. S2CID 238234156.
- ^ Wu R, Trubl G, Taş N, Jansson JK (15 de abril de 2022). "El permafrost como reservorio potencial de patógenos". One Earth . 5 (4): 351–360. Bibcode :2022OEart...5..351W. doi : 10.1016/j.oneear.2022.03.010 . S2CID 248208195.
- ^ Rogers Van Katwyk S, Giubilini A, Kirchhelle C, Weldon I, Harrison M, McLean A, et al. (marzo de 2023). "Explorando modelos para un acuerdo legal internacional sobre los bienes comunes antimicrobianos globales: lecciones de los acuerdos climáticos". Análisis de la atención sanitaria . 31 (1): 25–46. doi :10.1007/s10728-019-00389-3. PMC 10042908 . PMID 31965398.
- ^ Wilson LA, Van Katwyk SR, Weldon I, Hoffman SJ (2021). "Un tratado mundial contra la pandemia debe abordar la resistencia a los antimicrobianos". Revista de Derecho, Medicina y Ética . 49 (4): 688–691. doi :10.1017/jme.2021.94. PMC 8749967 . PMID 35006051.
- ^ abc Spurling GK, Dooley L, Clark J, Askew DA, et al. (Grupo Cochrane de Infecciones Respiratorias Agudas) (octubre de 2023). "Antibióticos inmediatos versus tardíos versus ningún antibiótico para infecciones respiratorias". Base de Datos Cochrane de Revisiones Sistemáticas . 2023 (10): CD004417. doi :10.1002/14651858.CD004417.pub6. PMC 10548498. PMID 37791590 .
- ^ abcd "Duración de la terapia con antibióticos y resistencia". NPS Medicinewise . National Prescribing Service Limited trading, Australia. 13 de junio de 2013. Archivado desde el original el 23 de julio de 2015 . Consultado el 22 de julio de 2015 .
- ^ Abdelsalam Elshenawy R, Umaru N, Aslanpour Z (marzo de 2024). "Duraciones más cortas y más largas de antibióticos para infecciones respiratorias: para combatir la resistencia a los antimicrobianos: un estudio transversal retrospectivo en un entorno de atención secundaria en el Reino Unido". Productos farmacéuticos . 17 (3): 339. doi : 10.3390/ph17030339 . PMC 10975983 . PMID 38543125.
- ^ abc «Las mayores amenazas: resistencia a los antibióticos y a los antimicrobianos – CDC». cdc.gov . 10 de septiembre de 2018. Archivado desde el original el 12 de septiembre de 2017 . Consultado el 5 de mayo de 2016 .
- ^ "Resistencia a HealthMap". HealthMap.org Boston Children's Hospital. Archivado desde el original el 15 de noviembre de 2017. Consultado el 15 de noviembre de 2017 .
- ^ Scales D. "Mapping Antibiotic Resistance: Know The Germs in Your Neighborhood" (Mapeo de la resistencia a los antibióticos: conozca los gérmenes en su vecindario). WBUR . National Public Radio. Archivado desde el original el 8 de diciembre de 2015. Consultado el 8 de diciembre de 2015 .
- ^ "ResistanceMap". Centro de Dinámica, Economía y Política de Enfermedades. Archivado desde el original el 14 de noviembre de 2017. Consultado el 14 de noviembre de 2017 .
- ^ ab "Plan de acción mundial sobre la resistencia a los antimicrobianos" (PDF) . OMS. Archivado desde el original (PDF) el 31 de octubre de 2017 . Consultado el 14 de noviembre de 2017 .
- ^ Mader R, Damborg P, Amat JP, Bengtsson B, Bourély C, Broens EM, et al. (enero de 2021). "Construcción de la red europea de vigilancia de la resistencia a los antimicrobianos en medicina veterinaria (EARS-Vet)". Euro Surveillance . 26 (4). doi :10.2807/1560-7917.ES.2021.26.4.2001359. PMC 7848785 . PMID 33509339.
- ^ Feuer L, Frenzer SK, Merle R, Leistner R, Bäumer W, Bethe A, et al. (septiembre de 2024). "Prevalencia de SAMR en muestras clínicas caninas y felinas de un tercio de las prácticas veterinarias en Alemania de 2019 a 2021". The Journal of Antimicrobial Chemotherapy . 79 (9): 2273–2280. doi :10.1093/jac/dkae225. PMID 39007221.
- ^ abcdefg Fisher MC, Alastruey-Izquierdo A, Berman J, Bicanic T, Bignell EM, Bowyer P, et al. (septiembre de 2022). "Abordar la amenaza emergente de la resistencia a los antimicóticos para la salud humana". Nature Reviews. Microbiología . 20 (9): 557–571. doi :10.1038/s41579-022-00720-1. PMC 8962932 . PMID 35352028.
- ^ Baur D, Gladstone BP, Burkert F, Carrara E, Foschi F, Döbele S, et al. (septiembre de 2017). "Efecto de la administración de antibióticos en la incidencia de la infección y la colonización con bacterias resistentes a los antibióticos y la infección por Clostridium difficile: una revisión sistemática y un metanálisis". The Lancet. Enfermedades infecciosas . 17 (9): 990–1001. doi :10.1016/S1473-3099(17)30325-0. PMID 28629876.
- ^ Gallagher JC, Justo JA, Chahine EB, Bookstaver PB, Scheetz M, Suda KJ, et al. (agosto de 2018). "Prevenir la era posantibiótico mediante la capacitación de futuros farmacéuticos como administradores de antimicrobianos". Revista estadounidense de educación farmacéutica . 82 (6): 6770. doi :10.5688/ajpe6770. PMC 6116871 . PMID 30181677.
- ^ Andersson DI, Hughes D (septiembre de 2011). "Persistencia de la resistencia a los antibióticos en poblaciones bacterianas". FEMS Microbiology Reviews . 35 (5): 901–11. doi : 10.1111/j.1574-6976.2011.00289.x . PMID 21707669.
- ^ Gilberg K, Laouri M, Wade S, Isonaka S (2003). "Análisis de los patrones de uso de medicamentos: aparente uso excesivo de antibióticos y uso insuficiente de medicamentos recetados para el asma, la depresión y la insuficiencia cardíaca congestiva". Journal of Managed Care Pharmacy . 9 (3): 232–7. doi :10.18553/jmcp.2003.9.3.232. PMC 10437266 . PMID 14613466. S2CID 25457069.
- ^ Llor C, Bjerrum L (diciembre de 2014). "Resistencia a los antimicrobianos: riesgo asociado con el uso excesivo de antibióticos e iniciativas para reducir el problema". Avances terapéuticos en seguridad de medicamentos . 5 (6): 229–41. doi :10.1177/2042098614554919. PMC 4232501 . PMID 25436105.
- ^ "La pandemia de resistencia a los antibióticos está matando a niños en Bangladesh". Science Trend . 18 de julio de 2021. Archivado desde el original el 29 de noviembre de 2021 . Consultado el 15 de agosto de 2021 .
- ^ Chisti MJ, Harris JB, Carroll RW, Shahunja KM, Shahid AS, Moschovis PP, et al. (julio de 2021). "La bacteriemia resistente a los antibióticos en niños pequeños hospitalizados con neumonía en Bangladesh se asocia con una alta tasa de mortalidad". Foro Abierto de Enfermedades Infecciosas . 8 (7): ofab260. doi :10.1093/ofid/ofab260. PMC 8280371 . PMID 34277885.
- ^ El libro sobre antibióticos de la OMS AWaRe (Access, Watch, Reserve). Ginebra: Organización Mundial de la Salud (OMS). 2022. ISBN 978-92-4-006238-2Archivado desde el original el 13 de agosto de 2023 . Consultado el 28 de marzo de 2023 .
- ^ Talento AF, Qualie M, Cottom L, Backx M, White PL (septiembre de 2021). "Lecciones de una conferencia educativa sobre enfermedades fúngicas invasivas sobre prácticas de gestión de antifúngicos en hospitales en el Reino Unido e Irlanda". Journal of Fungi . 7 (10): 801. doi : 10.3390/jof7100801 . PMC 8538376 . PMID 34682223.
- ^ Doron S, Davidson LE (noviembre de 2011). "Administración de antimicrobianos". Mayo Clinic Proceedings . 86 (11): 1113–23. doi :10.4065/mcp.2011.0358. PMC 3203003 . PMID 22033257.
- ^ Davey P, Marwick CA, Scott CL, Charani E, McNeil K, Brown E, et al. (febrero de 2017). "Intervenciones para mejorar las prácticas de prescripción de antibióticos para pacientes hospitalizados". Base de datos Cochrane de revisiones sistemáticas . 2017 (2): CD003543. doi : 10.1002 /14651858.cd003543.pub4. PMC 6464541. PMID 28178770.
- ^ ab Costa T, Pimentel AC, Mota-Vieira L, Castanha AC (1 de mayo de 2021). "Los beneficios de un sistema de dosis unitaria en la dispensación de antibióticos orales: farmacéuticos de hospitales de las Azores que abordan el problema socioeconómico de las sobras en Portugal". Drugs & Therapy Perspectives . 37 (5): 212–221. doi :10.1007/s40267-021-00825-2. ISSN 1179-1977.
- ^ O'Sullivan JW, Harvey RT, Glasziou PP, McCullough A (noviembre de 2016). "Información escrita para pacientes (o padres de pacientes infantiles) para reducir el uso de antibióticos para infecciones agudas de las vías respiratorias superiores en atención primaria". Base de datos Cochrane de revisiones sistemáticas . 2016 (11): CD011360. doi :10.1002/14651858.CD011360.pub2. PMC 6464519. PMID 27886368 .
- ^ Bosley H, Henshall C, Appleton JV, Jackson D (marzo de 2018). "Una revisión sistemática para explorar las influencias en las actitudes de los padres hacia la prescripción de antibióticos en niños" (PDF) . Revista de enfermería clínica . 27 (5–6): 892–905. doi :10.1111/jocn.14073. PMID 28906047. S2CID 4336064. Archivado (PDF) del original el 14 de octubre de 2023 . Consultado el 6 de mayo de 2023 .
- ^ "Los cinco principios correctos de la administración de medicamentos". ihi.org . Marzo de 2007. Archivado desde el original el 24 de octubre de 2015 . Consultado el 30 de octubre de 2015 .
- ^ "CDC Features – Mission Critical: Preventing Antibiotic Resistance" (Características de los CDC: misión crítica: prevención de la resistencia a los antibióticos). cdc.gov . 4 de abril de 2018. Archivado desde el original el 8 de noviembre de 2017. Consultado el 22 de julio de 2015 .
- ^ Leekha S, Terrell CL, Edson RS (febrero de 2011). «Principios generales de la terapia antimicrobiana». Mayo Clinic Proceedings . 86 (2): 156–67. doi :10.4065/mcp.2010.0639. PMC 3031442. PMID 21282489. Archivado desde el original el 15 de septiembre de 2019. Consultado el 22 de julio de 2015 .
- ^ ab "¿Está utilizando los antibióticos de forma inteligente?". Centros para el Control y la Prevención de Enfermedades . 3 de enero de 2022. Archivado desde el original el 21 de marzo de 2024. Consultado el 21 de marzo de 2024 .
- ^ "Artículos". Cedars-Sinai . Archivado desde el original el 30 de mayo de 2020 . Consultado el 23 de marzo de 2024 .
- ^ "Dosis diaria definida (DDD)". OMS . Archivado desde el original el 10 de mayo de 2023. Consultado el 28 de marzo de 2023 .
- ^ "Indicador: prescripción de antibióticos". QualityWatch . Nuffield Trust & Health Foundation. Archivado desde el original el 14 de enero de 2015 . Consultado el 16 de julio de 2015 .
- ^ abc IACG (2018) Reducir la exposición no intencional y la necesidad de antimicrobianos, y optimizar su uso Documento de debate del IACG Archivado el 6 de julio de 2021 en Wayback Machine , Grupo de coordinación interinstitucional sobre resistencia a los antimicrobianos, proceso de consulta pública en la OMS, Ginebra, Suiza
- ^ abcde Araya P (mayo de 2016). "El impacto del agua y el saneamiento en la carga de enfermedades diarreicas y el consumo excesivo de antibióticos" (PDF) . Archivado (PDF) del original el 1 de octubre de 2017. Consultado el 12 de noviembre de 2017 .
- ^ «Objetivo 6: Garantizar la disponibilidad de agua y su gestión sostenible y el saneamiento para todos». Departamento de Asuntos Económicos y Sociales de las Naciones Unidas . Archivado desde el original el 24 de septiembre de 2020. Consultado el 17 de abril de 2023 .
- ^ Swoboda SM, Earsing K, Strauss K, Lane S, Lipsett PA (febrero de 2004). "El monitoreo electrónico y los mensajes de voz mejoran la higiene de las manos y disminuyen las infecciones nosocomiales en una unidad de cuidados intermedios". Medicina de cuidados críticos . 32 (2): 358–63. doi :10.1097/01.CCM.0000108866.48795.0F. PMID 14758148. S2CID 9817602.(se requiere suscripción)
- ^ OMS, UNICEF (2015). Agua, saneamiento e higiene en los centros de atención de salud: situación en los países de ingresos bajos y medios y camino a seguir Archivado el 12 de septiembre de 2018 en Wayback Machine . Organización Mundial de la Salud (OMS), Ginebra, Suiza, ISBN 978 92 4 150847 6
- ^ Agga GE, Schmidt JW, Arthur TM (diciembre de 2016). "Efectos de la profilaxis con clortetraciclina en el alimento del ganado vacuno sobre la salud animal y la Escherichia coli resistente a los antimicrobianos". Applied and Environmental Microbiology . 82 (24): 7197–7204. Bibcode :2016ApEnM..82.7197A. doi :10.1128/AEM.01928-16. PMC 5118930 . PMID 27736789.
- ^ ab Brown EE, Cooper A, Carrillo C, Blais B (2019). "Selección de bacterias resistentes a múltiples fármacos en alimentos medicados para animales". Frontiers in Microbiology . 10 : 456. doi : 10.3389/fmicb.2019.00456 . PMC 6414793 . PMID 30894847.
- ^ Marshall BM, Levy SB (octubre de 2011). "Animales destinados al consumo humano y antimicrobianos: impactos en la salud humana". Clinical Microbiology Reviews . 24 (4): 718–33. doi :10.1128/CMR.00002-11. PMC 3194830 . PMID 21976606.
- ^ Casewell M, Friis C, Marco E, McMullin P, Phillips I (agosto de 2003). "La prohibición europea de los antibióticos promotores del crecimiento y las consecuencias emergentes para la salud humana y animal". The Journal of Antimicrobial Chemotherapy . 52 (2): 159–61. doi : 10.1093/jac/dkg313 . PMID 12837737.
- ^ Castanon JI (noviembre de 2007). "Historia del uso de antibióticos como promotores del crecimiento en alimentos para aves de corral europeas". Poultry Science . 86 (11): 2466–71. doi : 10.3382/ps.2007-00249 . PMID 17954599.(se requiere suscripción)
- ^ Bengtsson B, Wierup M (2006). "Resistencia a los antimicrobianos en Escandinavia tras la prohibición de los promotores de crecimiento antimicrobianos". Animal Biotechnology . 17 (2): 147–56. doi :10.1080/10495390600956920. PMID 17127526. S2CID 34602891.(se requiere suscripción)
- ^ Angulo FJ, Baker NL, Olsen SJ, Anderson A, Barrett TJ (abril de 2004). "Uso de antimicrobianos en la agricultura: control de la transferencia de resistencia a los antimicrobianos a los seres humanos". Seminarios sobre enfermedades infecciosas pediátricas . 15 (2): 78–85. doi :10.1053/j.spid.2004.01.010. PMID 15185190.
- ^ "GAO-11-801, Resistencia a los antibióticos: los organismos han logrado avances limitados en la lucha contra el uso de antibióticos en animales". gao.gov. Archivado desde el original el 5 de noviembre de 2013. Consultado el 25 de enero de 2014 .
- ^ Nelson JM, Chiller TM, Powers JH, Angulo FJ (abril de 2007). "Especies de Campylobacter resistentes a las fluoroquinolonas y retirada de su uso en aves de corral: una historia de éxito en materia de salud pública". Clinical Infectious Diseases . 44 (7): 977–80. doi : 10.1086/512369 . PMID 17342653.
- ^ "Uso extraetiquetado y antimicrobianos". FDA . 29 de abril de 2022. Archivado desde el original el 19 de abril de 2023 . Consultado el 19 de abril de 2023 .
- ^ Pallo-Zimmerman LM, Byron JK, Graves TK (julio de 2010). «Fluoroquinolonas: entonces y ahora» (PDF) . Compendio . 32 (7): E1-9, cuestionario E9. PMID 20957609. Archivado (PDF) del original el 21 de junio de 2023. Consultado el 19 de abril de 2023 .
- ^ "RAND Europe Focus on Antimicrobial Resistance (AMR)" (El foco de RAND Europa en la resistencia a los antimicrobianos [RAM]). rand.org . Archivado desde el original el 21 de abril de 2018. Consultado el 23 de abril de 2018 .
- ^ "Reacciona". Archivado desde el original el 16 de noviembre de 2017 . Consultado el 16 de noviembre de 2017 .
- ^ "Resistencia a los antibióticos: el tsunami silencioso (video de YouTube)". ReActTube . 6 de marzo de 2017. Archivado desde el original el 11 de noviembre de 2021 . Consultado el 17 de noviembre de 2017 .
- ^ "El apocalipsis de los antibióticos explicado". Kurzgesagt – In a Nutshell . 16 de marzo de 2016. Archivado desde el original el 20 de marzo de 2021 . Consultado el 17 de noviembre de 2017 .
- ^ "Plan de acción nacional de Irlanda sobre resistencia a los antimicrobianos 2017-2020". Octubre de 2017. Archivado desde el original el 10 de agosto de 2022. Consultado el 11 de enero de 2019 – vía Lenus (Irish Health Repository).
- ^ Grupo de trabajo sobre el uso de antimicrobianos en hospitales para pacientes con SARI (2009). Directrices para el uso de antimicrobianos en hospitales de Irlanda. Dublín: Centro de vigilancia de la protección de la salud (HPSC) del HSE. ISBN 978-0-9551236-7-2Archivado del original el 5 de diciembre de 2021 . Consultado el 11 de enero de 2019 .
- ^ "¿Tomar antibióticos para los resfriados y la gripe? No tiene sentido". HSE.ie. Archivado desde el original el 28 de mayo de 2018. Consultado el 11 de enero de 2019 .
- ^ Murphy M, Bradley CP, Byrne S (mayo de 2012). "Prescripción de antibióticos en atención primaria, cumplimiento de las directrices y prescripción innecesaria: una perspectiva irlandesa". BMC Family Practice . 13 (1): 43. doi : 10.1186/1471-2296-13-43 . PMC 3430589 . PMID 22640399.
- ^ "Visión de 20 años del Reino Unido sobre la resistencia a los antimicrobianos". GOV.UK . Archivado desde el original el 28 de marzo de 2023 . Consultado el 28 de marzo de 2023 .
- ^ "Plan de acción quinquenal del Reino Unido para la resistencia a los antimicrobianos de 2019 a 2024". GOV.UK . Archivado desde el original el 28 de marzo de 2023 . Consultado el 28 de marzo de 2023 .
- ^ "Lista de patógenos bacterianos prioritarios de la OMS, 2024: Patógenos bacterianos de importancia para la salud pública para orientar la investigación, el desarrollo y las estrategias de prevención y control de la resistencia a los antimicrobianos". who.int . Archivado desde el original el 20 de mayo de 2024 . Consultado el 20 de mayo de 2024 .
- ^ "Semana Mundial de Concientización sobre los Antibióticos". Organización Mundial de la Salud . Archivado desde el original el 20 de noviembre de 2015. Consultado el 20 de noviembre de 2015 .
- ^ "Semana Mundial de Concientización sobre los Antibióticos". OMS . Archivado desde el original el 13 de noviembre de 2017 . Consultado el 14 de noviembre de 2017 .
- ^ ab «OMS | Grupo de coordinación interinstitucional de las Naciones Unidas (IACG) sobre resistencia a los antimicrobianos». OMS . Archivado desde el original el 20 de marzo de 2017 . Consultado el 7 de agosto de 2019 .
- ^ Grupo de Coordinación Interinstitucional (IACG) (abril de 2019). No hay tiempo para esperar: cómo proteger el futuro de las infecciones resistentes a los medicamentos (PDF) (informe). Archivado (PDF) del original el 19 de abril de 2023. Consultado el 19 de abril de 2023 .
- ^ Reygaert WC (2018). "Una descripción general de los mecanismos de resistencia antimicrobiana de las bacterias". AIMS Microbiology . 4 (3): 482–501. doi :10.3934/microbiol.2018.3.482. PMC 6604941 . PMID 31294229.
- ^ Baylay AJ, Piddock LJ, Webber MA (14 de marzo de 2019). "Mecanismos moleculares de la resistencia a los antibióticos – Parte I". Resistencia bacteriana a los antibióticos: de las moléculas al hombre . Wiley. págs. 1–26. doi :10.1002/9781119593522.ch1. ISBN 978-1-119-94077-7.S2CID202806156 .
- ^ Connell SR, Tracz DM, Nierhaus KH, Taylor DE (diciembre de 2003). "Proteínas de protección ribosómica y su mecanismo de resistencia a la tetraciclina". Agentes antimicrobianos y quimioterapia . 47 (12): 3675–81. doi :10.1128/AAC.47.12.3675-3681.2003. PMC 296194. PMID 14638464 .
- ^ Henry RJ (diciembre de 1943). "El modo de acción de las sulfonamidas". Bacteriological Reviews . 7 (4): 175–262. doi :10.1128/MMBR.7.4.175-262.1943. PMC 440870 . PMID 16350088.
- ^ Li XZ, Nikaido H (agosto de 2009). "Resistencia a fármacos mediada por eflujo en bacterias: una actualización". Drugs . 69 (12): 1555–623. doi :10.2165/11317030-000000000-00000. PMC 2847397 . PMID 19678712.
- ^ Aminov RI, Mackie RI (junio de 2007). "Evolución y ecología de los genes de resistencia a los antibióticos". FEMS Microbiology Letters . 271 (2): 147–61. doi : 10.1111/j.1574-6968.2007.00757.x . PMID 17490428.
- ^ Morita Y, Kodama K, Shiota S, Mine T, Kataoka A, Mizushima T, et al. (julio de 1998). "NorM, una proteína putativa de eflujo de múltiples fármacos, de Vibrio parahaemolyticus y su homólogo en Escherichia coli". Agentes antimicrobianos y quimioterapia . 42 (7): 1778–82. doi :10.1128/AAC.42.7.1778. PMC 105682. PMID 9661020 .
- ^ Duval M, Dar D, Carvalho F, Rocha EP, Sorek R, Cossart P (diciembre de 2018). "HflXr, un homólogo de un factor de división de ribosomas, media la resistencia a los antibióticos". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 115 (52): 13359–13364. Bibcode :2018PNAS..11513359D. doi : 10.1073/pnas.1810555115 . PMC 6310831 . PMID 30545912.
- ^ "Acerca de la resistencia a los antibióticos". CDC . 13 de marzo de 2020. Archivado desde el original el 1 de octubre de 2017 . Consultado el 8 de septiembre de 2017 .
- ^ Robicsek A, Jacoby GA, Hooper DC (octubre de 2006). "La aparición mundial de resistencia a las quinolonas mediada por plásmidos". The Lancet. Enfermedades infecciosas . 6 (10): 629–40. doi :10.1016/S1473-3099(06)70599-0. PMID 17008172.
- ^ Ochiai K, Yamanaka T, Kimura K, Sawada O, O (1959). "Herencia de la resistencia a fármacos (y su transferencia) entre cepas de Shigella y entre cepas de Shigella y E. coli". Hihon Iji Shimpor (en japonés). 34 : 1861.
- ^ Watford S, Warrington SJ (2018). "Mutaciones del ADN bacteriano". StatPearls . StatPearls Publishing. PMID 29083710. Archivado desde el original el 8 de marzo de 2021 . Consultado el 21 de enero de 2019 .
- ^ Levin BR, Perrot V, Walker N (marzo de 2000). «Mutaciones compensatorias, resistencia a los antibióticos y genética de poblaciones de evolución adaptativa en bacterias». Genética . 154 (3): 985–97. doi :10.1093/genetics/154.3.985. PMC 1460977 . PMID 10757748. Archivado desde el original el 18 de enero de 2023 . Consultado el 4 de marzo de 2017 .
- ^ Hotchkiss RD (1951). "Transferencia de resistencia a la penicilina en neumococos por el desoxirribonucleato derivado de cultivos resistentes". Simposios de Cold Spring Harbor sobre biología cuantitativa . 16 : 457–61. doi :10.1101/SQB.1951.016.01.032. PMID 14942755.
- ^ Ubukata K, Konno M, Fujii R (septiembre de 1975). "Transducción de la resistencia a fármacos como la tetraciclina, el cloranfenicol, los macrólidos, la lincomicina y la clindamicina con fagos inducidos por Streptococcus pyogenes". The Journal of Antibiotics . 28 (9): 681–8. doi : 10.7164/antibiotics.28.681 . PMID 1102514.
- ^ von Wintersdorff CJ, Penders J, van Niekerk JM, Mills ND, Majumder S, van Alphen LB, et al. (19 de febrero de 2016). "Difusión de la resistencia a los antimicrobianos en ecosistemas microbianos mediante transferencia horizontal de genes". Frontiers in Microbiology . 7 : 173. doi : 10.3389/fmicb.2016.00173 . PMC 4759269 . PMID 26925045.
- ^ Chan CX, Beiko RG, Ragan MA (agosto de 2011). "La transferencia lateral de genes y fragmentos de genes en Staphylococcus se extiende más allá de los elementos móviles". Journal of Bacteriology . 193 (15): 3964–77. doi :10.1128/JB.01524-10. PMC 3147504 . PMID 21622749.
- ^ Johansen TB, Scheffer L, Jensen VK, Bohlin J, Feruglio SL (junio de 2018). "Secuenciación del genoma completo y resistencia a los antimicrobianos en Brucella melitensis desde una perspectiva noruega". Scientific Reports . 8 (1): 8538. Bibcode :2018NatSR...8.8538J. doi :10.1038/s41598-018-26906-3. PMC 5986768 . PMID 29867163.
- ^ Tirumalai MR, Karouia F, Tran Q, Stepanov VG, Bruce RJ, Ott M, et al. (enero de 2019). "Evaluación de la resistencia adquirida a los antibióticos en Escherichia coli expuesta a microgravedad modelada a bajo cizallamiento a largo plazo y exposición a antibióticos de fondo". mBio . 10 (e02637-18). doi :10.1128/mBio.02637-18. PMC 6336426 . PMID 30647159.
- ^ Tirumalai MR, Karouia F, Tran Q, Stepanov VG, Bruce RJ, Ott M, et al. (mayo de 2017). "La adaptación de células de Escherichia coli cultivadas en microgravedad simulada durante un período prolongado es tanto fenotípica como genómica". npj Microgravity . 3 (15): 15. doi :10.1038/s41526-017-0020-1. PMC 5460176 . PMID 28649637.
- ^ Ghaith DM, Mohamed ZK, Farahat MG, Aboulkasem Shahin W, Mohamed HO (marzo de 2019). "Colonización de la microbiota intestinal con enterobacterias productoras de carbapenemasas en unidades de cuidados intensivos pediátricos en El Cairo, Egipto". Revista Árabe de Gastroenterología . 20 (1): 19–22. doi :10.1016/j.ajg.2019.01.002. PMID 30733176. S2CID 73444389. Archivado desde el original el 27 de noviembre de 2022 . Consultado el 30 de mayo de 2022 .
- ^ Diene SM, Rolain JM (septiembre de 2014). "Genes de carbapenemasas y plataformas genéticas en bacilos gramnegativos: especies de Enterobacteriaceae, Pseudomonas y Acinetobacter". Microbiología clínica e infecciones . 20 (9): 831–8. doi : 10.1111/1469-0691.12655 . PMID 24766097.
- ^ Kumarasamy KK, Toleman MA, Walsh TR, Bagaria J, Butt F, Balakrishnan R, et al. (septiembre de 2010). "Aparición de un nuevo mecanismo de resistencia a los antibióticos en la India, Pakistán y el Reino Unido: un estudio molecular, biológico y epidemiológico". The Lancet. Enfermedades infecciosas . 10 (9): 597–602. doi :10.1016/S1473-3099(10)70143-2. PMC 2933358. PMID 20705517 .
- ^ Hudson CM, Bent ZW, Meagher RJ, Williams KP (7 de junio de 2014). "Determinantes de resistencia y elementos genéticos móviles de una cepa de Klebsiella pneumoniae que codifica NDM-1". PLOS ONE . 9 (6): e99209. Bibcode :2014PLoSO...999209H. doi : 10.1371/journal.pone.0099209 . PMC 4048246 . PMID 24905728.
- ^ Lou Z, Sun Y, Rao Z (febrero de 2014). "Progreso actual en estrategias antivirales". Tendencias en ciencias farmacológicas . 35 (2): 86–102. doi :10.1016/j.tips.2013.11.006. PMC 7112804 . PMID 24439476.
- ^ Pennings PS (junio de 2013). "Resistencia a los fármacos contra el VIH: problemas y perspectivas". Infectious Disease Reports . 5 (Supl 1): e5. doi :10.4081/idr.2013.s1.e5. PMC 3892620 . PMID 24470969.
- ^ Das K, Arnold E (abril de 2013). "Transcriptasa inversa del VIH-1 y resistencia a los fármacos antivirales. Parte 1". Current Opinion in Virology . 3 (2): 111–8. doi :10.1016/j.coviro.2013.03.012. PMC 4097814 . PMID 23602471.
- ^ Ton Q, Frenkel L (marzo de 2013). "Resistencia a los medicamentos contra el VIH en madres y bebés tras el uso de antirretrovirales para prevenir la transmisión de madre a hijo". Current HIV Research . 11 (2): 126–36. doi :10.2174/1570162x11311020005. PMID 23432488.
- ^ Ebrahim O, Mazanderani AH (junio de 2013). "Avances recientes en el tratamiento del VIH y su difusión en países pobres". Infectious Disease Reports . 5 (Supl 1): e2. doi :10.4081/idr.2013.s1.e2. PMC 3892621 . PMID 24470966.
- ^ Xie JL, Polvi EJ, Shekhar-Guturja T, Cowen LE (2014). "Elucidación de la resistencia a fármacos en patógenos fúngicos humanos". Future Microbiology . 9 (4): 523–42. doi :10.2217/fmb.14.18. PMID 24810351.
- ^ Srinivasan A, Lopez-Ribot JL, Ramasubramanian AK (marzo de 2014). "Superar la resistencia a los antimicóticos". Drug Discovery Today: Technologies . 11 : 65–71. doi :10.1016/j.ddtec.2014.02.005. PMC 4031462 . PMID 24847655.
- ^ Costa C, Dias PJ, Sá-Correia I, Teixeira MC (2014). "Transportadores de múltiples fármacos MFS en hongos patógenos: ¿tienen un impacto clínico real?". Frontiers in Physiology . 5 : 197. doi : 10.3389/fphys.2014.00197 . PMC 4035561 . PMID 24904431.
- ^ Organización Mundial de la Salud, ed. (25 de octubre de 2022). Lista de hongos patógenos prioritarios de la OMS para orientar la investigación, el desarrollo y la acción en materia de salud pública. Organización Mundial de la Salud. ISBN 978-92-4-006024-1Archivado desde el original el 26 de octubre de 2022 . Consultado el 27 de octubre de 2022 .
- ^ ab Andrews KT, Fisher G, Skinner-Adams TS (agosto de 2014). "Reutilización de fármacos y enfermedades parasitarias protozoarias humanas". Revista internacional de parasitología: fármacos y resistencia a fármacos . 4 (2): 95–111. doi :10.1016/j.ijpddr.2014.02.002. PMC 4095053 . PMID 25057459.
- ^ Visser BJ, van Vugt M, Grobusch MP (octubre de 2014). "Malaria: una actualización sobre la quimioterapia actual". Opinión de expertos sobre farmacoterapia . 15 (15): 2219–54. doi :10.1517/14656566.2014.944499. PMID 25110058. S2CID 34991324.
- ^ Chia WN, Goh YS, Rénia L (2014). "Nuevos enfoques para identificar candidatos a vacunas protectoras contra la malaria". Frontiers in Microbiology . 5 : 586. doi : 10.3389/fmicb.2014.00586 . PMC 4233905 . PMID 25452745.
- ^ Franco JR, Simarro PP, Diarra A, Jannin JG (2014). "Epidemiología de la tripanosomiasis africana humana". Epidemiología clínica . 6 : 257–75. doi : 10.2147/CLEP.S39728 . PMC 4130665 . PMID 25125985.
- ^ Herrera L (2014). "Trypanosoma cruzi, el agente causal de la enfermedad de Chagas: límites entre los ciclos silvestre y doméstico en Venezuela". Fronteras en Salud Pública . 2 : 259. doi : 10.3389/fpubh.2014.00259 . PMC 4246568 . PMID 25506587.
- ^ Mansueto P, Seidita A, Vitale G, Cascio A (2014). "Leishmaniasis en viajeros: una revisión de la literatura" (PDF) . Medicina del Viajero y Enfermedades Infecciosas . 12 (6 Pt A): 563–81. doi :10.1016/j.tmaid.2014.09.007. hdl : 10447/101959 . PMID 25287721. Archivado (PDF) del original el 12 de octubre de 2022 . Consultado el 23 de octubre de 2017 .
- ^ abc Munk P, Brinch C, Møller FD, Petersen TN, Hendriksen RS, Seyfarth AM, et al. (diciembre de 2022). "El análisis genómico de las aguas residuales de 101 países revela un panorama global de resistencia a los antimicrobianos". Nature Communications . 13 (1): 7251. Bibcode :2022NatCo..13.7251M. doi : 10.1038/s41467-022-34312-7 . PMC 9715550 . PMID 36456547.
- ^ "Antibiotika-Resistenzen verbreiten sich offenbar anders als gedacht". Deutschlandfunk Nova (en alemán). Archivado desde el original el 17 de enero de 2023 . Consultado el 17 de enero de 2023 .
- ^ "Aumento de las superbacterias: un informe de la OMS señala un aumento de la resistencia a los antibióticos". Organización Mundial de la Salud a través de medicalxpress.com . Archivado desde el original el 2 de febrero de 2023. Consultado el 18 de enero de 2023 .
- ^ "Informe sobre el sistema mundial de vigilancia de la resistencia y el uso de los antimicrobianos (GLASS): 2022". who.int . Archivado desde el original el 21 de enero de 2023 . Consultado el 18 de enero de 2023 .
- ^ "Los pacientes contrajeron 165 infecciones resistentes a los antibióticos cada día en 2018, según PHE". Pharmaceutical Journal. 31 de octubre de 2019. Archivado desde el original el 26 de julio de 2020. Consultado el 11 de diciembre de 2019 .
- ^ "Estimaciones nacionales de infecciones y muertes en AR". Centros para el Control y la Prevención de Enfermedades . 6 de julio de 2022. Archivado desde el original el 3 de agosto de 2023. Consultado el 3 de agosto de 2023 .
- ^ "COVID-19 y resistencia a los antibióticos". Centros para el Control y la Prevención de Enfermedades . 11 de agosto de 2022. Archivado desde el original el 21 de febrero de 2022. Consultado el 3 de agosto de 2023 .
- ^ "INFORME ESPECIAL 2022: EL IMPACTO DE LA COVID-19 EN EE. UU. SOBRE LA RESISTENCIA A LOS ANTIMICROBIANOS" (PDF) . Centros para el Control y la Prevención de Enfermedades . 2022. p. 7. Archivado (PDF) del original el 26 de agosto de 2023 . Consultado el 3 de agosto de 2023 .
- ^ Aminov RI (2010). "Una breve historia de la era de los antibióticos: lecciones aprendidas y desafíos para el futuro". Frontiers in Microbiology . 1 : 134. doi : 10.3389/fmicb.2010.00134 . PMC 3109405 . PMID 21687759.
- ^ Carvalho G, Forestier C, Mathias JD (diciembre de 2019). "Resiliencia a los antibióticos: ¿un concepto necesario para complementar la resistencia a los antibióticos?". Actas. Ciencias Biológicas . 286 (1916): 20192408. doi :10.1098/rspb.2019.2408. PMC 6939251. PMID 31795866 .
- ^ ab Resistencia a los antimicrobianos: informe mundial sobre vigilancia . Ginebra, Suiza: Organización Mundial de la Salud. 2014. ISBN 978-92-4-156474-8.OCLC 880847527 .
- ^ Amábile-Cuevas CF, ed. (2007). Resistencia antimicrobiana en bacterias . Horizon Scientific Press.
- ^ Fleming A (11 de diciembre de 1945). «Penicilina» (PDF) . Conferencia Nobel. Archivado (PDF) del original el 31 de marzo de 2018. Consultado el 9 de agosto de 2020 .
- ^ "OMS | Plan de acción mundial sobre la resistencia a los antimicrobianos". OMS . Archivado desde el original el 18 de abril de 2018 . Consultado el 23 de abril de 2018 .
- ^ ab Pollack A (20 de enero de 2016). "Para luchar contra las 'superbacterias', los fabricantes de medicamentos piden incentivos para desarrollar antibióticos". New York Times . Informe especial de Davos 2016. Davos, Suiza. Archivado desde el original el 24 de abril de 2018 . Consultado el 24 de enero de 2016 .
- ^ Leonard C, Crabb N, Glover D, Cooper S, Bouvy J, Wobbe M, et al. (mayo de 2023). "¿Puede el modelo de pago de 'Netflix' del Reino Unido impulsar la producción de antibacterianos?". Applied Health Economics and Health Policy . 21 (3): 365–372. doi :10.1007/s40258-022-00786-1. PMC 9842493 . PMID 36646872.
- ^ ab Behdinan A, Hoffman SJ, Pearcey M (2015). "Algunas políticas globales para la resistencia a los antibióticos dependen de compromisos legalmente vinculantes y exigibles". Revista de Derecho, Medicina y Ética . 43 (2 Suppl 3): 68–73. doi :10.1111/jlme.12277. PMID 26243246. S2CID 7415203.
- ^ Hoffman SJ, Outterson K (2015). "¿Qué se necesita para abordar la amenaza mundial de la resistencia a los antibióticos?". The Journal of Law, Medicine & Ethics . 43 (2): 363–8. doi :10.1111/jlme.12253. PMID 26242959. S2CID 41987305. Archivado desde el original el 12 de octubre de 2022 . Consultado el 11 de noviembre de 2019 .
- ^ abc Hoffman SJ, Outterson K, Røttingen JA, Cars O, Clift C, Rizvi Z, et al. (febrero de 2015). "Un marco legal internacional para abordar la resistencia a los antimicrobianos". Boletín de la Organización Mundial de la Salud . 93 (2): 66. doi :10.2471/BLT.15.152710. PMC 4339972 . PMID 25883395.
- ^ Rizvi Z, Hoffman SJ (2015). "Una acción global eficaz contra la resistencia a los antibióticos requiere una consideración cuidadosa de la convocatoria de foros". Revista de Derecho, Medicina y Ética . 43 (2 Suppl 3): 74–8. doi :10.1111/jlme.12278. PMID 26243247. S2CID 24223063.
- ^ Andresen S, Hoffman SJ (2015). "Se puede aprender mucho sobre cómo abordar la resistencia a los antibióticos a partir de los acuerdos ambientales multilaterales". Revista de Derecho, Medicina y Ética . 43 (2): 46–52.
- ^ El presupuesto del Presidente para 2016 propone una inversión histórica para combatir las bacterias resistentes a los antibióticos y proteger la salud pública Archivado el 22 de enero de 2017 en Wayback Machine La Casa Blanca, Oficina del Secretario de Prensa, 27 de enero de 2015
- ^ ab "HOJA INFORMATIVA: La administración Obama publica un plan de acción nacional para combatir las bacterias resistentes a los antibióticos". whitehouse.gov . 27 de marzo de 2015. Archivado desde el original el 21 de enero de 2017 . Consultado el 30 de octubre de 2015 – vía Archivos Nacionales .
- ^ ab "Amenazas de resistencia a los antibióticos en los Estados Unidos, 2023". Centros para el Control y la Prevención de Enfermedades . Consultado el 20 de octubre de 2023 .
- ^ "El impacto de la pandemia de COVID-19 en la resistencia a los antimicrobianos y el tratamiento de las infecciones del torrente sanguíneo". MDPI . 21 (6): e22–e25. 2023.
- ^ "Adelántese a la sepsis". Centros para el Control y la Prevención de Enfermedades . Consultado el 20 de octubre de 2023 .
- ^ "Plan de acción nacional para combatir las bacterias resistentes a los antibióticos (CARB) 2023-2028". La Casa Blanca . Consultado el 20 de octubre de 2023 .
- ^ "Ley PASTEUR de 2023". Congreso de los Estados Unidos . Consultado el 20 de octubre de 2023 .
- ^ Knight GM, Davies NG, Colijn C, Coll F, Donker T, Gifford DR, et al. (noviembre de 2019). "Modelado matemático para la política de control de la resistencia a los antibióticos: ¿sabemos lo suficiente?". BMC Infectious Diseases . 19 (1): 1011. doi : 10.1186/s12879-019-4630-y . PMC 6884858 . PMID 31783803.
- ^ Hopkins H, Bruxvoort KJ, Cairns ME, Chandler CI, Leurent B, Ansah EK, et al. (marzo de 2017). "Impacto de la introducción de pruebas de diagnóstico rápido para la malaria en la prescripción de antibióticos: análisis de estudios observacionales y aleatorizados en entornos de atención médica públicos y privados". BMJ . 356 : j1054. doi :10.1136/bmj.j1054. PMC 5370398 . PMID 28356302.
- ^ "Los diagnósticos están ayudando a contrarrestar la resistencia a los antimicrobianos, pero es necesario seguir trabajando". MDDI Online . 20 de noviembre de 2018. Archivado desde el original el 2 de diciembre de 2018 . Consultado el 2 de diciembre de 2018 .
- ^ ab van Belkum A, Bachmann TT, Lüdke G, Lisby JG, Kahlmeter G, Mohess A, et al. (enero de 2019). "Hoja de ruta de desarrollo para sistemas de prueba de susceptibilidad a los antimicrobianos". Nature Reviews. Microbiología . 17 (1): 51–62. doi : 10.1038/s41579-018-0098-9 . hdl :2445/132505. PMC 7138758 . PMID 30333569.
- ^ "Progreso en la resistencia a los antibióticos". Nature . 562 (7727): 307. Octubre de 2018. Bibcode :2018Natur.562Q.307.. doi : 10.1038/d41586-018-07031-7 . PMID 30333595.
- ^ Kim JI, Maguire F, Tsang KK, Gouliouris T, Peacock SJ, McAllister TA, et al. (septiembre de 2022). "Aprendizaje automático para la predicción de la resistencia a los antimicrobianos: práctica actual, limitaciones y perspectiva clínica". Clinical Microbiology Reviews . 35 (3): e0017921. doi :10.1128/cmr.00179-21. PMC 9491192 . PMID 35612324.
- ^ Banerjee R, Patel R (febrero de 2023). "Diagnóstico molecular para la detección genotípica de la resistencia a los antibióticos: panorama actual y direcciones futuras". JAC-antimicrobial Resistance . 5 (1): dlad018. doi :10.1093/jacamr/dlad018. PMC 9937039 . PMID 36816746.
- ^ Baltekin Ö, Boucharin A, Tano E, Andersson DI, Elf J (agosto de 2017). "Prueba de susceptibilidad a antibióticos en menos de 30 minutos utilizando imágenes directas de células individuales". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 114 (34): 9170–9175. Bibcode :2017PNAS..114.9170B. doi : 10.1073/pnas.1708558114 . PMC 5576829 . PMID 28790187.
- ^ Luro S, Potvin-Trottier L, Okumus B, Paulsson J (enero de 2020). "Aislamiento de células vivas después de un análisis microscópico de lapso de tiempo a largo plazo y de alto rendimiento". Nature Methods . 17 (1): 93–100. doi :10.1038/s41592-019-0620-7. PMC 7525750 . PMID 31768062.
- ^ Schuetz P, Wirz Y, Sager R, Christ-Crain M, Stolz D, Tamm M, et al. (Grupo Cochrane de Infecciones Respiratorias Agudas) (octubre de 2017). "Procalcitonina para iniciar o discontinuar antibióticos en infecciones agudas del tracto respiratorio". Base de Datos Cochrane de Revisiones Sistemáticas . 10 (10): CD007498. doi :10.1002/14651858.CD007498.pub3. PMC 6485408 . PMID 29025194.
- ^ Smedemark SA, Aabenhus R, Llor C, Fournaise A, Olsen O, Jørgensen KJ, et al. (Grupo Cochrane de Infecciones Respiratorias Agudas) (octubre de 2022). "Biomarcadores como pruebas en el punto de atención para orientar la prescripción de antibióticos en personas con infecciones respiratorias agudas en atención primaria". Base de datos Cochrane de revisiones sistemáticas . 2022 (10): CD010130. doi :10.1002/14651858.CD010130.pub3. PMC 9575154. PMID 36250577 .
- ^ Doan Q, Enarson P, Kissoon N, Klassen TP, Johnson DW (septiembre de 2014). "Diagnóstico viral rápido de enfermedad respiratoria febril aguda en niños en el Departamento de Emergencias". Base de Datos Cochrane de Revisiones Sistemáticas . 2014 (9): CD006452. doi :10.1002/14651858.CD006452.pub4. PMC 6718218. PMID 25222468 .
- ^ Mishra RP, Oviedo-Orta E, Prachi P, Rappuoli R, Bagnoli F (octubre de 2012). "Vacunas y resistencia a los antibióticos". Current Opinion in Microbiology . 15 (5): 596–602. doi :10.1016/j.mib.2012.08.002. PMID 22981392.
- ^ Kennedy DA, Read AF (marzo de 2017). "¿Por qué la resistencia a los medicamentos evoluciona con facilidad, pero la resistencia a las vacunas no?". Actas. Ciencias biológicas . 284 (1851): 20162562. doi :10.1098/rspb.2016.2562. PMC 5378080. PMID 28356449 .
- ^ Kennedy DA, Read AF (diciembre de 2018). «Por qué la evolución de la resistencia a las vacunas es menos preocupante que la evolución de la resistencia a los medicamentos». Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 115 (51): 12878–12886. Bibcode :2018PNAS..11512878K. doi : 10.1073/pnas.1717159115 . PMC 6304978 . PMID 30559199.
- ^ "Inmunidad, enfermedades infecciosas y pandemias: qué puede hacer". HomesteadSchools.com. Archivado desde el original el 3 de diciembre de 2013. Consultado el 12 de junio de 2013 .
- ^ Shinefield H, Black S, Fattom A, Horwith G, Rasgon S, Ordonez J, et al. (febrero de 2002). "Uso de una vacuna conjugada contra Staphylococcus aureus en pacientes que reciben hemodiálisis". The New England Journal of Medicine . 346 (7): 491–6. doi : 10.1056/NEJMoa011297 . PMID 11844850.
- ^ ab Fowler VG, Proctor RA (mayo de 2014). "¿Qué lugar ocupa una vacuna contra el Staphylococcus aureus?". Microbiología clínica e infecciones . 20 (5): 66–75. doi :10.1111/1469-0691.12570. PMC 4067250. PMID 24476315 .
- ^ McNeely TB, Shah NA, Fridman A, Joshi A, Hartzel JS, Keshari RS, et al. (2014). "Mortalidad entre los receptores de la vacuna Merck V710 contra Staphylococcus aureus después de infecciones posoperatorias por S. aureus: un análisis de posibles factores contribuyentes del huésped". Vacunas humanas e inmunoterapias . 10 (12): 3513–6. doi :10.4161/hv.34407. PMC 4514053 . PMID 25483690.
- ^ Lu RM, Hwang YC, Liu IJ, Lee CC, Tsai HZ, Li HJ, et al. (enero de 2020). "Desarrollo de anticuerpos terapéuticos para el tratamiento de enfermedades". Revista de Ciencias Biomédicas . 27 (1): 1. doi : 10.1186/s12929-019-0592-z . PMC 6939334 . PMID 31894001.
- ^ abc Singh G, Rana A (mayo de 2024). "Descifrando la resistencia a los antimicrobianos: desentrañando mecanismos moleculares y estrategias específicas". Archivos de Microbiología . 206 (6): 280. Bibcode :2024ArMic.206..280S. doi :10.1007/s00203-024-03998-2. PMID 38805035.
- ^ Kim S, Lieberman TD, Kishony R (octubre de 2014). "Los tratamientos alternativos con antibióticos limitan las vías evolutivas hacia la resistencia a múltiples fármacos". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 111 (40): 14494–9. Bibcode :2014PNAS..11114494K. doi : 10.1073/pnas.1409800111 . PMC 4210010 . PMID 25246554.
- ^ Pál C, Papp B, Lázár V (julio de 2015). "Sensibilidad colateral de microbios resistentes a antibióticos". Tendencias en microbiología . 23 (7): 401–7. doi :10.1016/j.tim.2015.02.009. PMC 5958998 . PMID 25818802.
- ^ Imamovic L, Ellabaan MM, Dantas Machado AM, Citterio L, Wulff T, Molin S, et al. (enero de 2018). "La convergencia fenotípica impulsada por fármacos respalda las estrategias de tratamiento racional de las infecciones crónicas". Cell . 172 (1–2): 121–134.e14. doi :10.1016/j.cell.2017.12.012. PMC 5766827 . PMID 29307490.
- ^ Beckley AM, Wright ES (octubre de 2021). "Identificación de pares de antibióticos que evaden la resistencia concurrente mediante un análisis retrospectivo de los resultados de las pruebas de susceptibilidad a los antimicrobianos". The Lancet. Microbio . 2 (10): e545–e554. doi :10.1016/S2666-5247(21)00118-X. PMC 8496867 . PMID 34632433.
- ^ Ma Y, Chua SL (15 de noviembre de 2021). "Sin sensibilidad antibiótica colateral al alternar pares de antibióticos". The Lancet Microbe . 3 (1): e7. doi : 10.1016/S2666-5247(21)00270-6 . ISSN 2666-5247. PMID 35544116. S2CID 244147577.
- ^ Liu J, Bedell TA, West JG, Sorensen EJ (junio de 2016). "Diseño y síntesis de estructuras moleculares con actividad antiinfecciosa". Tetrahedron . 72 (25): 3579–3592. doi :10.1016/j.tet.2016.01.044. PMC 4894353 . PMID 27284210.
- ^ "Informe anual del Director Médico - Infecciones y aumento de la resistencia a los antimicrobianos" (PDF) . Servicio Nacional de Salud del Reino Unido. 2011. Archivado desde el original (PDF) el 30 de octubre de 2013.
- ^ "La Administración Obama busca facilitar las aprobaciones de antibióticos". NPR.org . NPR. 4 de junio de 2013. Archivado desde el original el 13 de marzo de 2015 . Consultado el 7 de agosto de 2016 .
- ^ Prayle A, Watson A, Fortnum H, Smyth A (julio de 2010). "Efectos secundarios de los aminoglucósidos en el riñón, el oído y el equilibrio en la fibrosis quística". Thorax . 65 (7): 654–658. doi :10.1136/thx.2009.131532. PMC 2921289 . PMID 20627927.
- ^ Alene KA, Wangdi K, Colquhoun S, Chani K, Islam T, Rahevar K, et al. (septiembre de 2021). "Discapacidad relacionada con la tuberculosis: una revisión sistemática y un metanálisis". BMC Medicine . 19 (1): 203. doi : 10.1186/s12916-021-02063-9 . PMC 8426113 . PMID 34496845.
- ^ ab Walsh F (11 de marzo de 2013). «BBC News – La resistencia a los antibióticos es un riesgo tan grande como el terrorismo», según el director médico. BBC News . Bbc.co.uk. Archivado desde el original el 8 de agosto de 2018 . Consultado el 12 de marzo de 2013 .
- ^ ab Berida T, Adekunle Y, Dada-Adegbola H, Kdimy A, Roy S, Sarker S (mayo de 2024). "Antibacterianos vegetales: desafíos y oportunidades". Heliyon . 10 (10): e31145. Bibcode :2024Heliy..1031145B. doi : 10.1016/j.heliyon.2024.e31145 . PMC 11128932 . PMID 38803958.
- ^ Khor M (18 de mayo de 2014). "¿Por qué los antibióticos se están volviendo inútiles en todo el mundo?". The Real News . Archivado desde el original el 18 de mayo de 2014. Consultado el 18 de mayo de 2014 .
- ^ Nordrum A (2015). "Resistencia a los antibióticos: ¿por qué las compañías farmacéuticas no desarrollan nuevos medicamentos para detener las superbacterias?". International Business Times .
- ^ Gever J (4 de febrero de 2011). "Las medidas de Pfizer pueden reducir las perspectivas de nuevos antibióticos". MedPage Today. Archivado desde el original el 14 de diciembre de 2013. Consultado el 12 de marzo de 2013 .
- ^ Schmitt S, Montalbán-López M, Peterhoff D, Deng J, Wagner R, Held M, et al. (mayo de 2019). "Análisis de lanthipeptides antimicrobianos bioingenierizados modulares a escala nanométrica" (PDF) . Nature Chemical Biology . 15 (5): 437–443. doi :10.1038/s41589-019-0250-5. PMID 30936500. S2CID 91188986. Archivado (PDF) del original el 18 de abril de 2023 . Consultado el 12 de abril de 2023 .
- ^ "Descripción general". Carb-X . Archivado desde el original el 28 de marzo de 2023 . Consultado el 28 de marzo de 2023 .
- ^ "Nuevo antibiótico contra bacterias gramnegativas". CORDIS . doi :10.3030/853979. Archivado desde el original el 28 de marzo de 2023 . Consultado el 28 de marzo de 2023 .
- ^ "Acerca de". Fondo de Impacto REPAIR . Archivado desde el original el 23 de enero de 2019. Consultado el 28 de marzo de 2023 .
- ^ "ADVANcing Clinical Evidence in Infectious Diseases (ADVANCE-ID)" (Avanzando con la evidencia clínica en enfermedades infecciosas [ADVANCE-ID]). sph.nus.edu.sg. Archivado desde el original el 28 de marzo de 2023. Consultado el 28 de marzo de 2023 .
- ^ "Acerca de GARDP". GARDP . 27 de septiembre de 2022. Archivado desde el original el 28 de marzo de 2023 . Consultado el 28 de marzo de 2023 .
- ^ Hoenigl M, Sprute R, Egger M, Arastehfar A, Cornely OA, Krause R, et al. (octubre de 2021). "La línea de productos antimicóticos: fosmanogepix, ibrexafungerp, olorofim, opelconazol y rezafungina". Drugs . 81 (15): 1703–1729. doi :10.1007/s40265-021-01611-0. PMC 8501344 . PMID 34626339.
- ^ "La resistencia a los antibióticos superada por las supercomputadoras". Universidad de Portsmouth . Archivado desde el original el 13 de diciembre de 2021. Consultado el 13 de diciembre de 2021 .
- ^ König G, Sokkar P, Pryk N, Heinrich S, Möller D, Cimicata G, et al. (noviembre de 2021). "La estrategia de priorización racional permite el diseño de derivados de macrólidos que superan la resistencia a los antibióticos". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 118 (46): e2113632118. Bibcode :2021PNAS..11813632K. doi : 10.1073/pnas.2113632118 . PMC 8609559 . PMID 34750269.
- ^ Leppäranta O, Vaahtio M, Peltola T, Zhang D, Hupa L, Hupa M, et al. (febrero de 2008). "Efecto antibacteriano de vidrios bioactivos sobre bacterias anaeróbicas clínicamente importantes in vitro". Revista de ciencia de materiales. Materiales en medicina . 19 (2): 547–51. doi :10.1007/s10856-007-3018-5. PMID 17619981. S2CID 21444777.
- ^ Munukka E, Leppäranta O, Korkeamäki M, Vaahtio M, Peltola T, Zhang D, et al. (enero de 2008). "Efectos bactericidas de los vidrios bioactivos en bacterias aeróbicas clínicamente importantes". Revista de ciencia de materiales. Materiales en medicina . 19 (1): 27–32. doi :10.1007/s10856-007-3143-1. PMID 17569007. S2CID 39643380.
- ^ Drago L, De Vecchi E, Bortolin M, Toscano M, Mattina R, Romanò CL (agosto de 2015). "Actividad antimicrobiana y selección de resistencia de diferentes formulaciones de biovidrio S53P4 contra cepas resistentes a múltiples fármacos". Future Microbiology . 10 (8): 1293–9. doi :10.2217/FMB.15.57. PMID 26228640.
- ^ Ermini ML, Voliani V (abril de 2021). "Nanoagentes antimicrobianos: la era del cobre". ACS Nano . 15 (4): 6008–6029. doi : 10.1021/acsnano.0c10756 . PMC 8155324 . PMID 33792292.
- ^ Connelly E (18 de abril de 2017). «Los libros de medicina medievales podrían contener la receta de nuevos antibióticos». The Conversation . Archivado desde el original el 25 de diciembre de 2022. Consultado el 20 de diciembre de 2019 .
- ^ "AncientBiotics: ¿un remedio medieval para las superbacterias modernas?" (Nota de prensa). Universidad de Nottingham. 30 de marzo de 2015. Archivado desde el original el 21 de octubre de 2022. Consultado el 13 de agosto de 2019 .
- ^ ab Kim DW, Cha CJ (marzo de 2021). "Resistoma a los antibióticos desde la perspectiva de Una Salud: comprensión y control de la transmisión de la resistencia a los antimicrobianos". Medicina experimental y molecular . 53 (3): 301–309. doi :10.1038/s12276-021-00569-z. PMC 8080597 . PMID 33642573.
- ^ Alcock BP, Huynh W, Chalil R, Smith KW, Raphenya AR, Wlodarski MA, et al. (enero de 2023). "CARD 2023: curación expandida, soporte para aprendizaje automático y predicción de resistomas en la Base de datos integral de resistencia a antibióticos". Investigación de ácidos nucleicos . 51 (D1): D690–D699. doi :10.1093/nar/gkac920. PMC 9825576 . PMID 36263822.
- ^ "Base de datos completa sobre resistencia a los antibióticos". card.mcmaster.ca . Archivado desde el original el 28 de marzo de 2023 . Consultado el 28 de marzo de 2023 .
- ^ Florensa AF, Kaas RS, Clausen PT, Aytan-Aktug D, Aarestrup FM (enero de 2022). "ResFinder: un recurso en línea abierto para la identificación de genes de resistencia a los antimicrobianos en datos de secuenciación de próxima generación y la predicción de fenotipos a partir de genotipos". Genómica microbiana . 8 (1). doi : 10.1099/mgen.0.000748 . PMC 8914360 . PMID 35072601.
- ^ "ResFinder 4.1". cge.food.dtu.dk . Archivado desde el original el 28 de marzo de 2023 . Consultado el 28 de marzo de 2023 .
- ^ "Asesinos silenciosos: ¿fagos fantásticos?". CBS News . 19 de septiembre de 2002. Archivado desde el original el 10 de febrero de 2013. Consultado el 14 de noviembre de 2017 .
- ^ McAuliffe O, Ross RP, Fitzgerald GF (2007). "La nueva biología de los fagos: de la genómica a las aplicaciones" (introducción)". En McGrath S, van Sinderen D (eds.). Bacteriófago: genética y biología molecular . Caister Academic Press. ISBN 978-1-904455-14-1Archivado del original el 26 de noviembre de 2020 . Consultado el 11 de agosto de 2021 .
- ^ Lin DM, Koskella B, Lin HC (agosto de 2017). "Terapia con fagos: una alternativa a los antibióticos en la era de la resistencia a múltiples fármacos". Revista mundial de farmacología y terapéutica gastrointestinal . 8 (3): 162–173. doi : 10.4292/wjgpt.v8.i3.162 . PMC 5547374 . PMID 28828194.
- ^ ab Salmond GP, Fineran PC (diciembre de 2015). "Un siglo del fago: pasado, presente y futuro". Nature Reviews. Microbiology . 13 (12): 777–86. doi :10.1038/nrmicro3564. PMID 26548913. S2CID 8635034.
- ^ Letarov AV, Golomidova AK, Tarasyan KK (abril de 2010). "Base ecológica para la terapia racional con fagos". Acta Naturae . 2 (1): 60–72. doi :10.32607/20758251-2010-2-1-60-71. PMC 3347537 . PMID 22649629.
- ^ Parfitt T (junio de 2005). "Georgia: un bastión improbable para la terapia con bacteriófagos". Lancet . 365 (9478): 2166–7. doi :10.1016/S0140-6736(05)66759-1. PMID 15986542. S2CID 28089251.
- ^ Golkar Z, Bagasra O, Pace DG (febrero de 2014). "Terapia con bacteriófagos: una posible solución para la crisis de resistencia a los antibióticos". Journal of Infection in Developing Countries . 8 (2): 129–36. doi : 10.3855/jidc.3573 . PMID 24518621.
- ^ McCallin S, Alam Sarker S, Barretto C, Sultana S, Berger B, Huq S, et al. (septiembre de 2013). "Análisis de seguridad de un cóctel de fagos rusos: desde el análisis metagenómico hasta la aplicación oral en sujetos humanos sanos". Virología . 443 (2): 187–96. doi : 10.1016/j.virol.2013.05.022 . PMID 23755967.
- ^ Abedon ST, Kuhl SJ, Blasdel BG, Kutter EM (marzo de 2011). "Tratamiento de infecciones humanas con fagos". Bacteriófago . 1 (2): 66–85. doi :10.4161/bact.1.2.15845. PMC 3278644 . PMID 22334863.
- ^ Onsea J, Soentjens P, Djebara S, Merabishvili M, Depypere M, Spriet I, et al. (septiembre de 2019). "Aplicación de bacteriófagos para infecciones musculoesqueléticas difíciles de tratar: desarrollo de un protocolo de tratamiento multidisciplinario estandarizado". Viruses . 11 (10): 891. doi : 10.3390/v11100891 . PMC 6832313 . PMID 31548497.
Libros
- Caldwell R, Lindberg D, eds. (2011). "Understanding Evolution" [Las mutaciones son aleatorias]. Museo de Paleontología de la Universidad de California. Archivado desde el original el 8 de febrero de 2012. Consultado el 15 de agosto de 2011 .
- Reynolds LA, Tansey EM, eds. (2008). Superbacterias y superfármacos: una historia del SAMR: transcripción de un seminario de testigos celebrado por el Wellcome Trust Centre for the History of Medicine de la UCL, Londres, el 11 de julio de 2006. Londres: Wellcome Trust Centre for the History of Medicine de la UCL. ISBN 978-0-85484-114-1.
- Detener la oleada de superbacterias: solo unos pocos dólares más . Estudios de políticas sanitarias de la OCDE. París: OECD Publishing. 2018. doi :10.1787/9789264307599-en. ISBN 978-92-64-30758-2. Número de identificación del sujeto 239804815.
Revistas
- Arias CA, Murray BE (enero de 2009). "Microorganismos resistentes a los antibióticos en el siglo XXI: un gran desafío clínico". The New England Journal of Medicine . 360 (5): 439–443. doi : 10.1056/NEJMp0804651 . PMID 19179312. S2CID 205104375.
- "Número especial: Ética y resistencia a los antimicrobianos". Bioética . 365 (33). 2019. Archivado desde el original el 9 de marzo de 2022 . Consultado el 22 de enero de 2020 .
- Goossens H, Ferech M, Vander Stichele R, Elseviers M (2005). "Uso de antibióticos en pacientes ambulatorios en Europa y asociación con la resistencia: un estudio de bases de datos transnacional". Lancet . Proyecto Esac del grupo. 365 (9459). Proyecto Esac: 579–587. doi :10.1016/S0140-6736(05)17907-0. PMID 15708101. S2CID 23782228.
- Hawkey PM, Jones AM (septiembre de 2009). "La cambiante epidemiología de la resistencia" (PDF) . The Journal of Antimicrobial Chemotherapy . 64 (Suppl 1): i3–10. doi : 10.1093/jac/dkp256 . PMID 19675017. Archivado desde el original el 17 de febrero de 2024. Consultado el 20 de abril de 2018 .
- Soulsby EJ (noviembre de 2005). "Resistencia a los antimicrobianos en humanos y animales". BMJ . 331 (7527): 1219–1220. doi :10.1136/bmj.331.7527.1219. PMC 1289307 . PMID 16308360.
- "Las alternativas a los antibióticos reducen las enfermedades animales". Organización de Investigación Científica e Industrial de la Commonwealth . 9 de enero de 2006. Archivado desde el original el 5 de junio de 2011. Consultado el 26 de abril de 2009 .
- Cooke P, Rees-Roberts D (2017). CATCH. Archivado desde el original el 9 de marzo de 2022. Consultado el 23 de febrero de 2017 .Película de 16 minutos sobre un mundo sin antibióticos. Reseña: Sansom C (marzo de 2017). "Media Watch: An cozy family story in a world without antibiotics". Lancet Infect Dis . 17 (3): 274. doi :10.1016/S1473-3099(17)30067-1.
Lectura adicional
- Bancroft, EA (octubre de 2007). "Resistencia a los antimicrobianos: no es sólo para los hospitales". JAMA . 298 (15): 1803–1804. doi :10.1001/jama.298.15.1803. PMC 2536104 . PMID 17940239.
- Larson, E (2007). "Factores comunitarios en el desarrollo de resistencia a los antibióticos". Revista Anual de Salud Pública . 28 (1): 435–447. doi : 10.1146/annurev.publhealth.28.021406.144020 . PMID 17094768.
Enlaces externos
 Citas relacionadas con Resistencia a los antimicrobianos en Wikiquote
Citas relacionadas con Resistencia a los antimicrobianos en Wikiquote- Hoja informativa de la OMS sobre la resistencia a los antimicrobianos
- Animación de la resistencia a los antibióticos Archivado el 28 de septiembre de 2022 en Wayback Machine.
- Preparándose para las superbacterias: fortalecer la acción ambiental en la respuesta de Una Salud a la resistencia a los antimicrobianos PNUMA , 2023.
- Directriz de los CDC sobre el manejo de organismos resistentes a múltiples fármacos en entornos de atención de salud, 2006




