Avibactam
 | |
 | |
| Datos clínicos | |
|---|---|
| Nombres comerciales | Avycaz (formulado con ceftazidima) |
| Vías de administración | Terapia intravenosa |
| Código ATC |
|
| Estatus legal | |
| Estatus legal |
|
| Datos farmacocinéticos | |
| Biodisponibilidad | 100% (intravenoso) |
| Unión de proteínas | 5,7–8,2 % [1] |
| Metabolismo | Nulo |
| Inicio de la acción | Aumenta en proporción a la dosis |
| Excreción | Riñón (97%) |
| Identificadores | |
| |
| Número CAS |
|
| Identificador de centro de PubChem |
|
| Araña química |
|
| UNIVERSIDAD |
|
| BARRIL |
|
| EBICh | |
| Química biológica |
|
| Panel de control CompTox ( EPA ) |
|
| Datos químicos y físicos | |
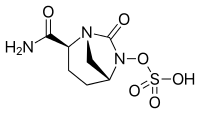
| Fórmula | C7H11N3O6S |
| Masa molar | 265,24 g·mol −1 |
| Modelo 3D ( JSmol ) |
|
| |
| |
Avibactam es un inhibidor de la β-lactamasa no β-lactámica [2] desarrollado por Actavis (ahora Teva ) en conjunto con AstraZeneca . En 2015, la FDA aprobó una nueva solicitud de medicamento para avibactam en combinación con ceftazidima para el tratamiento de infecciones complicadas del tracto urinario (cUTI) e infecciones intraabdominales complicadas (cIAI) causadas por patógenos resistentes a los antibióticos , incluidas las causadas por patógenos bacterianos gramnegativos resistentes a múltiples fármacos . [3] [4] [5]
La creciente resistencia a las cefalosporinas entre los patógenos bacterianos gramnegativos, especialmente entre las infecciones adquiridas en el hospital, se debe en parte a la producción de enzimas β-lactamasas que desactivan estos antibióticos. Si bien la administración conjunta de un inhibidor de la β-lactamasa puede restaurar la actividad antibacteriana de la cefalosporina, los inhibidores de la β-lactamasa aprobados anteriormente, como el tazobactam y el ácido clavulánico , no inhiben clases importantes de β-lactamasas, incluidas las carbapenemasas de Klebsiella pneumoniae (KPC), la metalo-β-lactamasa 1 de Nueva Delhi (NDM-1) y las β-lactamasas de tipo AmpC . Aunque el avibactam inhibe las serina β-lactamasas de clase A (KPC, CTX-M, TEM, SHV), clase C (AmpC) y algunas de clase D (como OXA-23, OXA-48), se ha informado que es un sustrato pobre/inhibidor débil de las metalo- β-lactamasas de clase B , como VIM-2, VIM-4, SPM-1, BcII, NDM-1, Fez-1. [6]
En el caso de infecciones causadas por bacterias productoras de metalo-β-lactamasas, una estrategia terapéutica consiste en administrar avibactam como fármaco acompañante junto con aztreonam . De hecho, aunque en teoría el aztreonam no es hidrolizado por las metalo-β-lactamasas, muchas cepas productoras de metalo-β-lactamasas coproducen enzimas que podrían hidrolizar el aztreonam (p. ej., AmpC, ESBL), por lo que se administra avibactam para proteger al aztreonam aprovechando su potente inhibición de las β-lactamasas . [7] Avibactam está disponible en combinación con aztreonam ( aztreonam/avibactam ).
Referencias
- ^ "Información completa sobre la prescripción: Avycaz (ceftazidima-avibactam) inyectable, para uso intravenoso". ©2015 Actavis. Todos los derechos reservados. Archivado desde el original el 2 de junio de 2015 . Consultado el 1 de junio de 2015 .
- ^ Wang DY, Abboud MI, Markoulides MS, Brem J, Schofield CJ (junio de 2016). "El camino hacia el avibactam: el primer fármaco no β-lactámico clínicamente útil que funciona de forma similar a un β-lactámico". Future Medicinal Chemistry . 8 (10): 1063–1084. doi : 10.4155/fmc-2016-0078 . PMID 27327972.
- ^ Zhanel GG, Lawson CD, Adam H, Schweizer F, Zelenitsky S, Lagacé-Wiens PR, et al. (febrero de 2013). "Ceftazidima-avibactam: una nueva combinación de cefalosporina / inhibidor de β-lactamasa". Drogas . 73 (2): 159-177. doi :10.1007/s40265-013-0013-7. PMID 23371303. S2CID 32700350.
- ^ "Actavis anuncia la aceptación por parte de la FDA de la presentación de la solicitud de NDA para ceftazidima-avibactam, un producto calificado para el tratamiento de enfermedades infecciosas". Actavis, una compañía farmacéutica especializada global e integrada, Actavis . Actavis plc. Archivado desde el original el 27 de mayo de 2015 . Consultado el 1 de junio de 2015 .
- ^ Ehmann DE, Jahic H, Ross PL, Gu RF, Hu J, Durand-Réville TF, et al. (septiembre de 2013). "Cinética de la inhibición de avibactam contra las β-lactamasas de clase A, C y D". The Journal of Biological Chemistry . 288 (39): 27960–27971. doi : 10.1074/jbc.M113.485979 . PMC 3784710 . PMID 23913691.
- ^ Abboud MI, Damblon C, Brem J, Smargiasso N, Mercuri P, Gilbert B, et al. (octubre de 2016). "Interacción de Avibactam con metalo-β-lactamasas de clase B". Agentes antimicrobianos y quimioterapia . 60 (10): 5655–5662. doi :10.1128/AAC.00897-16. PMC 5038302 . PMID 27401561.
- ^ Mauri C, Maraolo AE, Di Bella S, Luzzaro F, Principe L (agosto de 2021). "El resurgimiento de aztreonam en combinación con avibactam contra bacterias gramnegativas productoras de metalo-β-lactamasa: una revisión sistemática de estudios in vitro y casos clínicos". Antibióticos . 10 (8): 1012. doi : 10.3390/antibiotics10081012 . PMC 8388901 . PMID 34439062.
Lectura adicional
- Edeki T, Armstrong J, Li J (septiembre de 2013). Farmacocinética de avibactam (AVI) y ceftazidima (CAZ) tras la administración por separado o combinada en voluntarios sanos. 53.ª Conferencia Intercientífica sobre Agentes Antimicrobianos y Quimioterapia (ICAAC). Vol. 10. pág. 13. Póster A-1019. Archivado desde el original el 3 de marzo de 2016.
