Músculo esquelético
| Músculo esquelético | |
|---|---|
 Representación del músculo esquelético | |
| Detalles | |
| Sinónimos | Músculo estriado esquelético, músculo voluntario estriado |
| Sistema | Sistema muscular |
| Identificadores | |
| latín | muscular esquelética |
| Malla | D018482 |
| TA2 | 1976 |
| EL | H2.00.05.2.00002 |
| Terminología anatómica [editar en Wikidata] | |
El músculo esquelético (comúnmente denominado músculo ) es uno de los tres tipos de tejido muscular de los vertebrados , siendo los otros el músculo cardíaco y el músculo liso . Forman parte del sistema muscular voluntario [1] y normalmente están unidos por tendones a los huesos de un esqueleto . [2] [3] Las células del músculo esquelético son mucho más largas que en los otros tipos de tejido muscular y también se conocen como fibras musculares . [4] El tejido de un músculo esquelético es estriado , con una apariencia rayada debido a la disposición de los sarcómeros .
Un músculo esquelético contiene múltiples fascículos , haces de fibras musculares. Cada fibra individual y cada músculo está rodeado por un tipo de capa de tejido conectivo de fascia . Las fibras musculares se forman a partir de la fusión de mioblastos en desarrollo en un proceso conocido como miogénesis que da como resultado células multinucleadas largas . En estas células, los núcleos , denominados mionúcleos , se encuentran a lo largo del interior de la membrana celular . Las fibras musculares también tienen múltiples mitocondrias para satisfacer las necesidades energéticas.
Las fibras musculares están compuestas a su vez de miofibrillas . Las miofibrillas están compuestas de filamentos de actina y miosina llamados miofilamentos , repetidos en unidades llamadas sarcómeros, que son las unidades funcionales básicas y contráctiles de la fibra muscular necesarias para la contracción muscular . [5] Los músculos se alimentan predominantemente de la oxidación de grasas y carbohidratos , pero también se utilizan reacciones químicas anaeróbicas , particularmente por fibras de contracción rápida. Estas reacciones químicas producen moléculas de trifosfato de adenosina (ATP) que se utilizan para impulsar el movimiento de las cabezas de miosina . [6]
El músculo esquelético comprende aproximadamente el 35% del peso del cuerpo humano. [7] Las funciones del músculo esquelético incluyen producir movimiento, mantener la postura corporal, controlar la temperatura corporal y estabilizar las articulaciones. [8] El músculo esquelético también es un órgano endocrino . [9] [10] [11] En diferentes condiciones fisiológicas, se encuentran subconjuntos de 654 proteínas diferentes, así como lípidos, aminoácidos, metabolitos y ARN pequeños en el secretoma de los músculos esqueléticos. [12]
Los músculos esqueléticos están compuestos sustancialmente de fibras musculares contráctiles multinucleadas (miocitos). Sin embargo, también están presentes en ellos cantidades considerables de células mononucleares residentes e infiltrantes. [13] En términos de volumen, los miocitos constituyen la gran mayoría del músculo esquelético. Los miocitos del músculo esquelético suelen ser muy grandes, de unos 2 a 3 cm de largo y 100 μm de diámetro. [14] En comparación, las células mononucleares de los músculos son mucho más pequeñas. Algunas de las células mononucleares de los músculos [15] son células endoteliales (que miden unos 50 a 70 μm de largo, 10 a 30 μm de ancho y 0,1 a 10 μm de grosor), [16] macrófagos (21 μm de diámetro) y neutrófilos (12 a 15 μm de diámetro). [17] Sin embargo, en términos de núcleos presentes en el músculo esquelético, los núcleos de los miocitos pueden ser solo la mitad de los núcleos presentes, mientras que los núcleos de las células mononucleares residentes e infiltradas constituyen la otra mitad. [13]
Una parte considerable de la investigación sobre el músculo esquelético se centra en las células de las fibras musculares, los miocitos, como se analiza en detalle en las primeras secciones, a continuación. Sin embargo, recientemente, el interés también se ha centrado en los diferentes tipos de células mononucleares del músculo esquelético, así como en las funciones endocrinas del músculo, que se describen a continuación.
Estructura
Anatomía macroscópica
Hay más de 600 músculos esqueléticos en el cuerpo humano, que representan alrededor del 40% del peso corporal en adultos jóvenes sanos. [18] [19] [20] En las poblaciones occidentales, los hombres tienen en promedio alrededor de un 61% más de músculo esquelético que las mujeres. [21] La mayoría de los músculos se presentan en pares colocados bilateralmente para servir a ambos lados del cuerpo. Los músculos a menudo se clasifican como grupos de músculos que trabajan juntos para realizar una acción. En el torso hay varios grupos musculares principales , incluidos los músculos pectorales y abdominales ; los músculos intrínsecos y extrínsecos son subdivisiones de los grupos musculares de la mano , el pie , la lengua y los músculos extraoculares del ojo . Los músculos también se agrupan en compartimentos que incluyen cuatro grupos en el brazo y los cuatro grupos en la pierna .
Además de la parte contráctil de un músculo que consiste en sus fibras, un músculo contiene una parte no contráctil de tejido conectivo fibroso denso que forma el tendón en cada extremo. Los tendones unen los músculos a los huesos para dar movimiento esquelético. La longitud de un músculo incluye los tendones. El tejido conectivo está presente en todos los músculos como fascia profunda . La fascia profunda se especializa dentro de los músculos para encerrar cada fibra muscular como endomisio ; cada fascículo muscular como perimisio y cada músculo individual como epimisio . Juntas, estas capas se denominan misias . La fascia profunda también separa los grupos de músculos en compartimentos musculares.
Los dos tipos de receptores sensoriales que se encuentran en los músculos son los husos musculares y los órganos tendinosos de Golgi . Los husos musculares son receptores de estiramiento ubicados en el vientre muscular. Los órganos tendinosos de Golgi son propioceptores ubicados en la unión miotendinosa que informan sobre la tensión de un músculo .
Células del músculo esquelético
Las células del músculo esquelético son las células contráctiles individuales dentro de un músculo y a menudo se las denomina fibras musculares . [3] Un solo músculo, como el bíceps de un hombre adulto joven, contiene alrededor de 253.000 fibras musculares. [22]
Las fibras musculares esqueléticas son multinucleadas y los núcleos se denominan a menudo mionúcleos . Esto ocurre durante la miogénesis con la fusión de mioblastos, cada uno de los cuales aporta un núcleo. [23] La fusión depende de proteínas específicas del músculo conocidas como fusógenos, llamadas miomarcadores y miomergentes . [24]
La célula muscular esquelética necesita muchos núcleos para producir grandes cantidades de proteínas y enzimas para el funcionamiento normal de la célula. Una sola fibra muscular puede contener de cientos a miles de núcleos. [25] Una fibra muscular, por ejemplo, en el bíceps humano con una longitud de 10 cm puede tener hasta 3000 núcleos. [25] A diferencia de una célula no muscular donde el núcleo está ubicado centralmente, el mionúcleo es alargado y está ubicado cerca del sarcolema . Los mionúcleos están dispuestos de manera bastante uniforme a lo largo de la fibra y cada núcleo tiene su propio dominio mionuclear , donde es responsable de soportar el volumen de citoplasma en esa sección particular de la miofibra. [24] [25]
Un grupo de células madre musculares conocidas como células miosatélites , también llamadas células satélite, se encuentran entre la membrana basal y el sarcolema de las fibras musculares. Estas células normalmente están inactivas, pero pueden activarse mediante el ejercicio o la patología para proporcionar mionúcleos adicionales para el crecimiento o la reparación muscular. [26]
Fijación a los tendones
Los músculos se unen a los tendones en una región de interfaz compleja conocida como unión musculotendinosa , también conocida como unión miotendinosa , un área especializada para la transmisión primaria de fuerza. [27] En la interfaz músculo-tendón, la fuerza se transmite desde los sarcómeros en las células musculares hasta el tendón. [5] Los músculos y los tendones se desarrollan en estrecha asociación y, después de su unión en la unión miotendinosa, constituyen una unidad dinámica para la transmisión de fuerza desde la contracción muscular hasta el sistema esquelético. [27]
Disposición de las fibras musculares

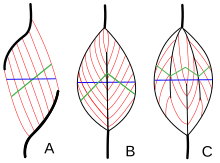
La arquitectura muscular se refiere a la disposición de las fibras musculares en relación con el eje de generación de fuerza , que va desde el origen de un músculo hasta su inserción . Las disposiciones habituales son tipos de músculo paralelo y tipos de músculo pennado . En los músculos paralelos, los fascículos corren paralelos al eje de generación de fuerza, pero los fascículos pueden variar en su relación entre sí y con sus tendones. [28] Estas variaciones se ven en músculos fusiformes , en correa y convergentes . [4] Un músculo convergente tiene una forma triangular o de abanico ya que las fibras convergen en su inserción y se abren en abanico ampliamente en el origen. [28] Un ejemplo menos común de un músculo paralelo es un músculo circular como el orbicular de los ojos , en el que las fibras están dispuestas longitudinalmente, pero crean un círculo desde el origen hasta la inserción. [29] Estas diferentes arquitecturas pueden causar variaciones en la tensión que un músculo puede crear entre sus tendones.
Las fibras de los músculos pennados se extienden en un ángulo con respecto al eje de generación de fuerza. [29] Este ángulo de penación reduce la fuerza efectiva de cualquier fibra individual, ya que está tirando efectivamente fuera del eje. Sin embargo, debido a este ángulo, se pueden empaquetar más fibras en el mismo volumen muscular, lo que aumenta el área de sección transversal fisiológica (PCSA). Este efecto se conoce como empaquetamiento de fibras y, en términos de generación de fuerza, supera con creces la pérdida de eficiencia de la orientación fuera del eje. La compensación se produce en la velocidad general de acortamiento muscular y en la excursión total. La velocidad general de acortamiento muscular se reduce en comparación con la velocidad de acortamiento de la fibra, al igual que la distancia total de acortamiento. [29] Todos estos efectos se escalan con el ángulo de penación; los ángulos mayores conducen a una mayor fuerza debido al mayor empaquetamiento de fibras y PCSA, pero con mayores pérdidas en la velocidad de acortamiento y la excursión. Los tipos de músculo pennado son unipennado , bipennado y multipennado . Un músculo unipennado tiene fibras con ángulos similares que están en un lado de un tendón. Un músculo bipennado tiene fibras en dos lados de un tendón. Los músculos multipennados tienen fibras que están orientadas en múltiples ángulos a lo largo del eje generador de fuerza, y esta es la arquitectura más general y más común. [29]
Crecimiento de la fibra muscular
Las fibras musculares crecen cuando se ejercitan y se encogen cuando no se utilizan. Esto se debe a que el ejercicio estimula el aumento de las miofibrillas, que aumentan el tamaño general de las células musculares. Los músculos bien ejercitados no solo pueden aumentar su tamaño, sino que también pueden desarrollar más mitocondrias , mioglobina , glucógeno y una mayor densidad de capilares . Sin embargo, las células musculares no pueden dividirse para producir nuevas células y, como resultado, hay menos células musculares en un adulto que en un recién nacido. [30]
Denominación de músculos
Hay una serie de términos utilizados para nombrar los músculos, incluidos aquellos relacionados con el tamaño, la forma, la acción, la ubicación, su orientación y su número de cabezas.
- Por tamaño
- brevis significa corto; longus significa largo; longissimus significa más largo; magnus significa grande; major significa más grande; maximus significa más grande; minor significa más pequeño y minimus el más pequeño; latissimus significa más ancho y vastus significa enorme. [31] Estos términos se usan a menudo después del músculo en particular, como glúteo mayor y glúteo menor . [32]
- Por forma relativa
- deltoides significa triangular; cuadrado significa que tiene cuatro lados; romboides significa que tiene forma romboidal ; teres significa redondo o cilíndrico, y trapecio significa que tiene forma trapezoidal ; [32] serrato significa dentado; orbicular significa circular; pectinado significa parecido a un peine; piriforme significa en forma de pera; platys significa plano y gracilis significa delgado. [31] Algunos ejemplos son el pronador redondo y el pronador cuadrado .
- Por acción
- abductor alejándose de la línea media; aductor moviéndose hacia la línea media; depresor moviéndose hacia abajo; elevador moviéndose hacia arriba; flexor moviéndose que disminuye un ángulo; extensor moviéndose que aumenta un ángulo o endereza; pronador moviéndose para mirar hacia abajo ; supinador moviéndose para mirar hacia arriba ; [32] rotador interno rotando hacia el cuerpo; rotador externo rotando alejándose del cuerpo; el esfínter disminuye el tamaño y el tensor da tensión a; los músculos fijadores sirven para fijar una articulación en una posición determinada estabilizando el motor principal mientras otras articulaciones se mueven.
- Por número de cabezas
- bíceps dos; tríceps tres y cuádriceps cuatro. [32]
- Por ubicación
- llamado así por la estructura principal cercana, como el músculo temporal (temporal) cerca del hueso temporal . [31] También supra- arriba; infra- abajo, y sub- debajo. [19]
- Por orientación del fascículo
- En relación con la línea media, recto significa paralelo a la línea media; transversal significa perpendicular a la línea media y oblicuo significa diagonal a la línea media. [31] En relación con el eje de generación de fuerza: tipos de músculos paralelos y tipos de músculos pennados .
Tipos de fibra
En términos generales, existen dos tipos de fibras musculares: el tipo I , que es lento, y el tipo II , que es rápido. El tipo II tiene dos divisiones: el tipo IIA (oxidativo) y el tipo IIX (glucolítico), lo que da lugar a tres tipos principales de fibras. [33] Estas fibras tienen propiedades metabólicas, contráctiles y de unidad motora relativamente distintas . La siguiente tabla diferencia estos tipos de propiedades. Estos tipos de propiedades, si bien dependen en parte de las propiedades de las fibras individuales, tienden a ser relevantes y se miden a nivel de la unidad motora, en lugar de a nivel de la fibra individual. [34]
| Propiedades | Fibras tipo I | Fibras tipo IIA | Fibras tipo IIX |
|---|---|---|---|
| Tipo de unidad motora | Oxidación lenta (SO) | Oxidativo rápido/glucolítico (FOG) | Glicolítico rápido (FG) |
| Velocidad de contracción | Lento | Rápido | Rápido |
| Fuerza de contracción | Pequeño | Medio | Grande |
| Resistencia a la fatiga | Alto | Alto | Bajo |
| Contenido de glucógeno | Bajo | Alto | Alto |
| Suministro capilar | Rico | Rico | Pobre |
| Densidad capilar | Alto | Intermedio | Bajo |
| Mioglobina | Alto | Alto | Bajo |
| Color rojo | Oscuro | Oscuro | Pálido |
| Densidad mitocondrial | Alto | Alto | Bajo |
| Capacidad enzimática oxidativa | Alto | Intermedio-alto | Bajo |
| Ancho de la línea Z | Intermedio | Ancho | Angosto |
| Actividad de la ATPasa alcalina | Bajo | Alto | Alto |
| Actividad de la ATPasa ácida | Alto | Medio-alto | Bajo |
Las fibras oxidativas lentas (tipo I) se contraen con relativa lentitud y utilizan la respiración aeróbica para producir ATP. Las fibras oxidativas rápidas (tipo IIA) tienen contracciones rápidas y utilizan principalmente la respiración aeróbica, pero como pueden cambiar a la respiración anaeróbica (glucólisis), pueden fatigarse más rápidamente que las fibras oxidativas lentas. Las fibras glucolíticas rápidas (tipo IIX) tienen contracciones rápidas y utilizan principalmente la glucólisis anaeróbica. Las fibras FG se fatigan más rápidamente que las demás. La mayoría de los músculos esqueléticos de un ser humano contienen los tres tipos, aunque en proporciones variables. [35]
Color de la fibra
Tradicionalmente, las fibras se clasificaban según su color variable, que es un reflejo del contenido de mioglobina . Las fibras de tipo I aparecen rojas debido a los altos niveles de mioglobina. Las fibras musculares rojas tienden a tener más mitocondrias y una mayor densidad capilar local. Estas fibras son más adecuadas para la resistencia y se fatigan lentamente porque utilizan el metabolismo oxidativo para generar ATP ( trifosfato de adenosina ). Las fibras de tipo II menos oxidativas son blancas debido a la mioglobina relativamente baja y a la dependencia de las enzimas glucolíticas.
Velocidad de contracción
Las fibras también se pueden clasificar según su capacidad de contracción, en contracción rápida y lenta. Estas características se superponen en gran medida, pero no por completo, con las clasificaciones basadas en el color, la ATPasa o la MHC ( cadena pesada de miosina ).
Algunos autores definen una fibra de contracción rápida como aquella en la que la miosina puede dividir el ATP muy rápidamente. Entre ellas se encuentran principalmente las fibras ATPasa tipo II y MHC tipo II. Sin embargo, las fibras de contracción rápida también demuestran una mayor capacidad de transmisión electroquímica de potenciales de acción y un rápido nivel de liberación y captación de calcio por el retículo sarcoplásmico. Las fibras de contracción rápida dependen de un sistema glucolítico anaeróbico de corto plazo bien desarrollado para la transferencia de energía y pueden contraerse y desarrollar tensión a una velocidad entre dos y tres veces superior a la de las fibras de contracción lenta. Los músculos de contracción rápida son mucho mejores para generar breves ráfagas de fuerza o velocidad que los músculos lentos, por lo que se fatigan más rápidamente. [36]
Las fibras de contracción lenta generan energía para la resíntesis de ATP mediante un sistema de transferencia de energía aeróbica a largo plazo . Entre ellas se encuentran principalmente las fibras ATPasa tipo I y MHC tipo I. Suelen tener un nivel bajo de actividad de ATPasa, una velocidad de contracción más lenta y una capacidad glucolítica menos desarrollada. [36] Las fibras que se vuelven de contracción lenta desarrollan un mayor número de mitocondrias y capilares, lo que las hace mejores para el trabajo prolongado. [37]
Distribución de tipos
Los músculos individuales tienden a ser una mezcla de varios tipos de fibras, pero sus proporciones varían según las acciones de ese músculo. Por ejemplo, en los humanos, los músculos cuádriceps contienen aproximadamente un 52 % de fibras de tipo I, mientras que el sóleo contiene aproximadamente un 80 % de tipo I. [38] El músculo orbicular del ojo contiene solo aproximadamente un 15 % de tipo I. [38] Sin embargo, las unidades motoras dentro del músculo tienen una variación mínima entre las fibras de esa unidad. Es este hecho el que hace viable el principio del tamaño del reclutamiento de unidades motoras .
Tradicionalmente se ha pensado que el número total de fibras musculares esqueléticas no cambia. Se cree que no hay diferencias de sexo o edad en la distribución de las fibras; sin embargo, las proporciones de los tipos de fibras varían considerablemente de un músculo a otro y de una persona a otra. [ cita requerida ] Entre las diferentes especies hay mucha variación en las proporciones de los tipos de fibras musculares. [ 39 ]
Los hombres y mujeres sedentarios (así como los niños pequeños) tienen un 45% de fibras de tipo II y un 55% de tipo I. [ cita requerida ] Las personas que se encuentran en el extremo superior de cualquier deporte tienden a demostrar patrones de distribución de fibras, por ejemplo, los atletas de resistencia muestran un nivel más alto de fibras de tipo I. Los atletas de velocidad, por otro lado, requieren una gran cantidad de fibras de tipo IIX. Los atletas de eventos de media distancia muestran una distribución aproximadamente igual de los dos tipos. Este también suele ser el caso de los atletas de potencia, como los lanzadores y saltadores. Se ha sugerido que varios tipos de ejercicio pueden inducir cambios en las fibras de un músculo esquelético. [40]
Se cree que al realizar eventos de tipo resistencia durante un período de tiempo sostenido, algunas de las fibras de tipo IIX se transforman en fibras de tipo IIA. Sin embargo, no hay consenso sobre el tema. [ cita requerida ] Bien podría ser que las fibras de tipo IIX muestren mejoras de la capacidad oxidativa después del entrenamiento de resistencia de alta intensidad, lo que las lleva a un nivel en el que pueden realizar el metabolismo oxidativo con la misma eficacia que las fibras de contracción lenta de sujetos no entrenados. Esto se produciría por un aumento en el tamaño y número de mitocondrias y los cambios relacionados asociados, no por un cambio en el tipo de fibra.
Métodos de tipificación de fibras

Existen numerosos métodos empleados para la tipificación de fibras, y la confusión entre los métodos es común entre los no expertos. Dos métodos comúnmente confundidos son la tinción histoquímica para la actividad ATPasa de miosina y la tinción inmunohistoquímica para el tipo de cadena pesada de miosina (MHC). La actividad ATPasa de miosina se conoce comúnmente, y correctamente, simplemente como "tipo de fibra", y resulta del ensayo directo de la actividad ATPasa en varias condiciones (p. ej., pH ). [34] La tinción de la cadena pesada de miosina se conoce con mayor precisión como "tipo de fibra MHC", p. ej., "fibras MHC IIa", y resulta de la determinación de diferentes isoformas MHC . [34] Estos métodos están estrechamente relacionados fisiológicamente, ya que el tipo MHC es el determinante principal de la actividad ATPasa. Sin embargo, ninguno de estos métodos de tipificación es directamente de naturaleza metabólica; no abordan directamente la capacidad oxidativa o glucolítica de la fibra.
Cuando se hace referencia a fibras "tipo I" o "tipo II" de manera genérica, esto se refiere con mayor precisión a la suma de tipos de fibras numéricas (I vs. II) según se evalúa mediante tinción de actividad de ATPasa de miosina (por ejemplo, fibras "tipo II" se refieren a tipo IIA + tipo IIAX + tipo IIXA... etc.).
A continuación se muestra una tabla que muestra la relación entre estos dos métodos, limitada a los tipos de fibra que se encuentran en los humanos. La capitalización de los subtipos se utiliza en la tipificación de fibras frente a la tipificación de MHC, y algunos tipos de ATPasa en realidad contienen múltiples tipos de MHC. Además, un subtipo B o b no se expresa en humanos por ninguno de los métodos . [41] Los primeros investigadores creían que los humanos expresaban un MHC IIb, lo que llevó a la clasificación de ATPasa de IIB. Sin embargo, investigaciones posteriores mostraron que el MHC IIb humano era de hecho IIx, [41] lo que indica que el IIB se llama mejor IIX. IIb se expresa en otros mamíferos, por lo que todavía se ve con precisión (junto con IIB) en la literatura. Los tipos de fibras no humanas incluyen fibras IIb verdaderas, IIc, IId, etc.
| Tipo de ATPasa | Cadena(s) pesada(s) del MHC |
|---|---|
| Tipo I | MHC Iβ |
| Tipo IC | MHC Iβ > MHC IIa |
| Tipo IIC | MHC IIa > MHC Iβ |
| Tipo IIA | MHC IIa |
| Tipo IIAX | MHC IIa > MHC IIx |
| Tipo IIXA | MHC IIx > MHC IIa |
| Tipo IIX | MHC IIx |
Otros métodos de tipificación de fibras están menos formalmente delineados y existen en un espectro más amplio. Tienden a centrarse más en las capacidades metabólicas y funcionales (es decir, oxidativa vs. glucolítica , tiempo de contracción rápida vs. lenta). Como se señaló anteriormente, la tipificación de fibras por ATPasa o MHC no mide ni dicta directamente estos parámetros. Sin embargo, muchos de los diversos métodos están vinculados mecanísticamente, mientras que otros están correlacionados in vivo . [44] [45] Por ejemplo, el tipo de fibra ATPasa está relacionado con la velocidad de contracción, porque la alta actividad de ATPasa permite un ciclo de puente cruzado más rápido . [34] Si bien la actividad de ATPasa es solo un componente de la velocidad de contracción, las fibras de Tipo I son "lentas", en parte, porque tienen bajas velocidades de actividad de ATPasa en comparación con las fibras de Tipo II. Sin embargo, medir la velocidad de contracción no es lo mismo que la tipificación de fibras ATPasa.
Evolución del tipo de fibra muscular
Casi todos los animales multicelulares dependen de los músculos para moverse. [46] En general, los sistemas musculares de la mayoría de los animales multicelulares comprenden fibras musculares de contracción lenta y rápida, aunque las proporciones de cada tipo de fibra pueden variar entre organismos y entornos. La capacidad de cambiar las proporciones de sus tipos de fibras fenotípicas mediante el entrenamiento y la respuesta al entorno ha sido útil para los organismos cuando se los coloca en entornos cambiantes que requieren movimientos explosivos cortos (mayor proporción de contracción rápida) o una larga duración de movimiento (mayor proporción de contracción lenta) para sobrevivir. [47] El culturismo ha demostrado que los cambios en la masa muscular y la producción de fuerza pueden cambiar en cuestión de meses. [48] A continuación se describen algunos ejemplos de esta variación. [49]
Ejemplos de variación de fibras musculares en diferentes animales
Invertebrados
La langosta americana , Homarus americanus , tiene tres tipos de fibras: fibras de contracción rápida, fibras de contracción lenta y fibras tónicas lentas. [50] Las fibras tónicas lentas son fibras de contracción lenta que pueden sostener contracciones más prolongadas ( tónicas ). [51] [52] En las langostas, los músculos de diferentes partes del cuerpo varían en las proporciones del tipo de fibra muscular según el propósito del grupo muscular. [50]
Vertebrados
En el desarrollo temprano de los embriones de vertebrados, el crecimiento y la formación de músculo se produce en oleadas o fases sucesivas de miogénesis . El isotipo de la cadena pesada de miosina es un determinante principal del tipo específico de fibra. En los embriones de pez cebra , las primeras fibras musculares que se forman son las fibras de contracción lenta. Estas células experimentarán una migración desde su ubicación original para formar una monocapa de fibras musculares de contracción lenta. Estas fibras musculares experimentan una mayor diferenciación a medida que el embrión madura. [53]
Reptiles
En animales más grandes, los diferentes grupos musculares requerirán cada vez más proporciones de tipos de fibras diferentes dentro del músculo para diferentes propósitos. Las tortugas , como Trachemys scripta elegans , tienen músculos complementarios dentro del cuello que muestran una posible tendencia inversa de los porcentajes de tipos de fibras (un músculo tiene un alto porcentaje de fibras de contracción rápida, mientras que el músculo complementario tendrá un mayor porcentaje de fibras de contracción lenta). Los músculos complementarios de las tortugas tenían porcentajes similares de tipos de fibras. [51]
Mamíferos
Los músculos de los chimpancés están compuestos en un 67% por fibras de contracción rápida y tienen una fuerza dinámica máxima y una potencia de salida 1,35 veces mayor que los músculos humanos de tamaño similar. Entre los mamíferos, hay un predominio de fibras de tipo II que utilizan el metabolismo glucolítico. Debido a la discrepancia en las fibras de contracción rápida en comparación con los humanos, los chimpancés superan a los humanos en pruebas relacionadas con la potencia. Los humanos, sin embargo, se desempeñan mejor en ejercicios de rango aeróbico que requieren grandes costos metabólicos, como caminar (bipedalismo). [54]
Conservación genética versus conservación funcional
En las distintas especies, se han conservado ciertas secuencias genéticas, pero no siempre tienen el mismo propósito funcional. Dentro del embrión de pez cebra, el gen Prdm1 regula a la baja la formación de nuevas fibras de contracción lenta a través de mecanismos directos e indirectos como Sox6 (indirecto). En ratones, el gen Prdm1 está presente pero no controla los genes de los músculos lentos en ratones a través de Sox6 . [55]
Plasticidad
Además de tener una base genética, la composición de los tipos de fibras musculares es flexible y puede variar en función de diversos factores ambientales. Esta plasticidad puede ser, sin duda, la mayor ventaja evolutiva entre los organismos con músculos.
En los peces, los diferentes tipos de fibras se expresan a diferentes temperaturas del agua. [53] Las temperaturas frías requieren un metabolismo más eficiente dentro del músculo y la resistencia a la fatiga es importante. Mientras que en ambientes más tropicales, los movimientos rápidos y potentes (de proporciones más altas de contracción rápida) pueden resultar más beneficiosos a largo plazo. [56]
En roedores como las ratas, la naturaleza transitoria de su músculo es muy frecuente. Tienen un alto porcentaje de fibras musculares híbridas y hasta un 60% de músculo de transformación rápida a lenta. [48]
Las influencias ambientales, como la dieta, el ejercicio y el estilo de vida, tienen un papel fundamental en las proporciones de los tipos de fibras en los seres humanos. El ejercicio aeróbico cambiará las proporciones hacia las fibras de contracción lenta, mientras que el levantamiento de pesas explosivo y el sprint harán que las fibras pasen a ser de contracción rápida. [47] En los animales, el "entrenamiento físico" se parecerá más a la necesidad de realizar movimientos de larga duración o breves movimientos explosivos para escapar de los depredadores o atrapar presas. [57]
Microanatomía


El músculo esquelético exhibe un patrón de bandas distintivo cuando se observa bajo el microscopio debido a la disposición de dos proteínas contráctiles, miosina y actina , que son dos de los miofilamentos en las miofibrillas . La miosina forma los filamentos gruesos y la actina forma los filamentos delgados, y están dispuestos en unidades repetidas llamadas sarcómeros . La interacción de ambas proteínas da como resultado la contracción muscular.
El sarcómero se une a otros orgánulos, como las mitocondrias, mediante filamentos intermedios en el citoesqueleto. El costámero une el sarcómero al sarcolema. [5]
Cada uno de los orgánulos y macromoléculas de una fibra muscular está organizado para garantizar que cumpla con las funciones deseadas. La membrana celular se llama sarcolema y el citoplasma se conoce como sarcoplasma . En el sarcoplasma se encuentran las miofibrillas. Las miofibrillas son haces largos de proteínas de aproximadamente un micrómetro de diámetro. Presionados contra el interior del sarcolema se encuentran los inusuales mionúcleos aplanados. Entre las miofibrillas se encuentran las mitocondrias .
Si bien la fibra muscular no tiene cisternas endoplasmáticas lisas, contiene retículo sarcoplásmico . El retículo sarcoplásmico rodea las miofibrillas y contiene una reserva de iones de calcio necesarios para provocar una contracción muscular. Periódicamente, tiene sacos terminales dilatados conocidos como cisternas terminales . Estos cruzan la fibra muscular de un lado al otro. Entre dos cisternas terminales hay un pliegue tubular llamado túbulo transversal (túbulo T). Los túbulos T son las vías por las que los potenciales de acción envían señales al retículo sarcoplásmico para que libere calcio, lo que provoca una contracción muscular. Juntos, dos cisternas terminales y un túbulo transversal forman una tríada . [58]
Desarrollo

Todos los músculos se derivan del mesodermo paraxial . Durante el desarrollo embrionario en el proceso de somitogénesis, el mesodermo paraxial se divide a lo largo de la longitud del embrión para formar somitas , que corresponden a la segmentación del cuerpo que se ve más obviamente en la columna vertebral . [59] Cada somita tiene tres divisiones, esclerotomo (que forma las vértebras ), dermatoma (que forma la piel) y miotoma (que forma el músculo). El miotoma se divide en dos secciones, el epímero y el hipómero, que forman los músculos epaxiales e hipaxiales , respectivamente. Los únicos músculos epaxiales en los humanos son el erector de la columna y los músculos vertebrales pequeños, y están inervados por las ramas dorsales de los nervios espinales . Todos los demás músculos, incluidos los de las extremidades, son hipaxiales y están inervados por las ramas ventrales de los nervios espinales. [59]
Durante el desarrollo, los mioblastos (células progenitoras musculares) permanecen en el somita para formar los músculos asociados con la columna vertebral o migran hacia el exterior del cuerpo para formar todos los demás músculos. La migración de los mioblastos está precedida por la formación de estructuras de tejido conectivo , generalmente formadas a partir del mesodermo de la placa lateral somática . Los mioblastos siguen señales químicas hasta las ubicaciones apropiadas, donde se fusionan en células musculares esqueléticas multinucleadas alargadas. [59]
Entre la décima y la decimoctava semana de gestación, todas las células musculares tienen cadenas pesadas de miosina rápidas; en el feto en desarrollo se distinguen dos tipos de miotubos : ambos expresan cadenas rápidas, pero uno expresa cadenas rápidas y lentas. Entre el 10 y el 40 por ciento de las fibras expresan la cadena de miosina lenta. [60]
Los tipos de fibras se establecen durante el desarrollo embrionario y se remodelan más tarde en el adulto por influencias neuronales y hormonales. [39] La población de células satélite presentes debajo de la lámina basal es necesaria para el desarrollo postnatal de las células musculares. [61]
Función
La función principal del músculo es la contracción . [3] Después de la contracción, el músculo esquelético funciona como un órgano endocrino al secretar mioquinas , una amplia gama de citoquinas y otros péptidos que actúan como moléculas de señalización. [62] Se cree que las mioquinas, a su vez, median los beneficios para la salud del ejercicio . [63] Las mioquinas se secretan en el torrente sanguíneo después de la contracción muscular. La interleucina 6 (IL-6) es la mioquina más estudiada, otras mioquinas inducidas por la contracción muscular incluyen BDNF , FGF21 y SPARC . [64]
Los músculos también funcionan para producir calor corporal. La contracción muscular es responsable de producir el 85% del calor corporal. [65] Este calor producido es un subproducto de la actividad muscular y en su mayor parte se desperdicia. Como respuesta homeostática al frío extremo, los músculos reciben señales para que desencadenen contracciones de escalofríos para generar calor. [66]

Contracción


La contracción se logra mediante la unidad estructural del músculo, la fibra muscular, y mediante su unidad funcional, la unidad motora . [4] Las fibras musculares son células excitables estimuladas por neuronas motoras . La unidad motora consta de una neurona motora y las muchas fibras con las que entra en contacto. Un solo músculo es estimulado por muchas unidades motoras. Las fibras musculares están sujetas a la despolarización por el neurotransmisor acetilcolina , liberado por las neuronas motoras en las uniones neuromusculares . [67]
Además de los miofilamentos de actina y miosina en las miofibrillas que forman los sarcómeros contráctiles , hay otras dos proteínas reguladoras importantes, la troponina y la tropomiosina , que hacen posible la contracción muscular. Estas proteínas están asociadas con la actina y cooperan para evitar su interacción con la miosina. Una vez que una célula está suficientemente estimulada, el retículo sarcoplásmico de la célula libera calcio iónico (Ca 2+ ), que luego interactúa con la proteína reguladora troponina. La troponina unida al calcio sufre un cambio conformacional que conduce al movimiento de la tropomiosina, exponiendo posteriormente los sitios de unión de la miosina en la actina. Esto permite el ciclo de puente cruzado dependiente de ATP de la miosina y la actina y el acortamiento del músculo.
Acoplamiento excitación-contracción
El acoplamiento excitación-contracción es el proceso por el cual un potencial de acción muscular en la fibra muscular hace que las miofibrillas se contraigan. Este proceso se basa en un acoplamiento directo entre el canal de liberación de calcio del retículo sarcoplásmico RYR1 (receptor de rianodina 1) y los canales de calcio de tipo L dependientes del voltaje (identificados como receptores de dihidropiridina, DHPR). Los DHPR se encuentran en el sarcolema (que incluye el sarcolema superficial y los túbulos transversales ), mientras que los RyR residen a través de la membrana del SR. La aposición cercana de un túbulo transversal y dos regiones del SR que contienen RyR se describe como una tríada y es predominantemente donde tiene lugar el acoplamiento excitación-contracción. El acoplamiento excitación-contracción ocurre cuando la despolarización de la célula del músculo esquelético da como resultado un potencial de acción muscular, que se propaga a través de la superficie celular y hacia la red de túbulos T de la fibra muscular , despolarizando así la porción interna de la fibra muscular. La despolarización de las porciones internas activa los receptores de dihidropiridina en las cisternas terminales, que están cerca de los receptores de rianodina en el retículo sarcoplásmico adyacente . Los receptores de dihidropiridina activados interactúan físicamente con los receptores de rianodina para activarlos a través de procesos de pie (que implican cambios conformacionales que activan alostéricamente los receptores de rianodina). A medida que los receptores de rianodina se abren, Ca2+
El calcio se libera del retículo sarcoplásmico al espacio de unión local y se difunde al citoplasma en masa para provocar una chispa de calcio . El retículo sarcoplásmico tiene una gran capacidad de amortiguación del calcio, en parte debido a una proteína de unión al calcio llamada calsecuestrina . La activación casi sincrónica de miles de chispas de calcio por el potencial de acción provoca un aumento de calcio en toda la célula que da lugar al ascenso del transitorio de calcio. El calcio2+
La troponina C liberada en el citosol se une a la troponina C por los filamentos de actina para permitir el ciclo de puente cruzado, lo que produce fuerza y, en algunas situaciones, movimiento. La calcio-ATPasa del retículo sarcoplasmático (SERCA) bombea activamente Ca2+
de nuevo al retículo sarcoplásmico. Como Ca2+
disminuye nuevamente a niveles de reposo, la fuerza disminuye y se produce la relajación. [68]
Movimiento muscular
La rama eferente del sistema nervioso periférico es responsable de transmitir órdenes a los músculos y glándulas, y es en última instancia responsable del movimiento voluntario. Los nervios mueven los músculos en respuesta a señales voluntarias y autónomas (involuntarias) del cerebro . Los músculos profundos, los músculos superficiales, los músculos de la cara y los músculos internos se corresponden con regiones dedicadas en la corteza motora primaria del cerebro , directamente anterior al surco central que divide los lóbulos frontal y parietal.
Además, los músculos reaccionan a estímulos nerviosos reflejos que no siempre envían señales hasta el cerebro. En este caso, la señal de la fibra aferente no llega al cerebro, sino que produce el movimiento reflejo mediante conexiones directas con los nervios eferentes de la columna vertebral . Sin embargo, la mayor parte de la actividad muscular es voluntaria y el resultado de interacciones complejas entre varias áreas del cerebro.
Los nervios que controlan los músculos esqueléticos en los mamíferos se corresponden con grupos de neuronas a lo largo de la corteza motora primaria de la corteza cerebral del cerebro . Las órdenes se envían a través de los ganglios basales y se modifican mediante la entrada del cerebelo antes de ser transmitidas a través del tracto piramidal a la médula espinal y desde allí a la placa motora terminal en los músculos. A lo largo del camino, la retroalimentación, como la del sistema extrapiramidal, contribuye con señales que influyen en el tono y la respuesta muscular.
Los músculos más profundos, como los que intervienen en la postura, a menudo están controlados desde núcleos del tronco encefálico y los ganglios basales.
Propiocepción
En los músculos esqueléticos, los husos musculares transmiten información sobre el grado de longitud y estiramiento muscular al sistema nervioso central para ayudar a mantener la postura y la posición de las articulaciones. La sensación de dónde se encuentra nuestro cuerpo en el espacio se llama propiocepción , la percepción de la conciencia corporal, la conciencia "inconsciente" de dónde se encuentran las distintas regiones del cuerpo en un momento dado. Varias áreas del cerebro coordinan el movimiento y la posición con la información de retroalimentación obtenida de la propiocepción. El cerebelo y el núcleo rojo , en particular, toman muestras de la posición de forma continua en función del movimiento y realizan pequeñas correcciones para garantizar un movimiento suave. [ cita requerida ]
Consumo de energía

La actividad muscular es responsable de gran parte del consumo de energía del cuerpo . Todas las células musculares producen moléculas de trifosfato de adenosina (ATP) que se utilizan para impulsar el movimiento de las cabezas de miosina . Los músculos tienen una reserva de energía a corto plazo en forma de fosfato de creatina que se genera a partir de ATP y puede regenerar ATP cuando sea necesario con la creatina quinasa . Los músculos también mantienen una forma de almacenamiento de glucosa en forma de glucógeno . El glucógeno se puede convertir rápidamente en glucosa cuando se requiere energía para contracciones sostenidas y potentes. Dentro de los músculos esqueléticos voluntarios, la molécula de glucosa se puede metabolizar anaeróbicamente en un proceso llamado glucólisis que produce dos moléculas de ATP y dos de ácido láctico en el proceso (en condiciones aeróbicas, no se forma lactato; en su lugar, se forma piruvato y se transmite a través del ciclo del ácido cítrico ). Las células musculares también contienen glóbulos de grasa, que se utilizan para obtener energía durante el ejercicio aeróbico . Los sistemas de energía aeróbica tardan más en producir ATP y alcanzar su máxima eficiencia, y requieren muchos más pasos bioquímicos, pero producen significativamente más ATP que la glucólisis anaeróbica. El músculo cardíaco, por otro lado, puede consumir fácilmente cualquiera de los tres macronutrientes (proteínas, glucosa y grasas) de forma aeróbica sin un período de "calentamiento" y siempre extrae el máximo rendimiento de ATP de cualquier molécula involucrada. El corazón, el hígado y los glóbulos rojos también consumen ácido láctico producido y excretado por los músculos esqueléticos durante el ejercicio.
El músculo esquelético consume más calorías que otros órganos. [69] En reposo, consume 54,4 kJ/kg (13,0 kcal/kg) por día. Esta cantidad es mayor que la del tejido adiposo (grasa), que consume 18,8 kJ/kg (4,5 kcal/kg), y la del hueso, que consume 9,6 kJ/kg (2,3 kcal/kg). [70]
Eficiencia
La eficiencia del músculo humano se ha medido (en el contexto del remo y el ciclismo ) en un 18% a 26%. La eficiencia se define como la relación entre el trabajo mecánico realizado y el coste metabólico total , tal como se puede calcular a partir del consumo de oxígeno. Esta baja eficiencia es el resultado de una eficiencia de alrededor del 40% en la generación de ATP a partir de la energía de los alimentos , pérdidas en la conversión de energía de ATP en trabajo mecánico dentro del músculo y pérdidas mecánicas dentro del cuerpo. Las dos últimas pérdidas dependen del tipo de ejercicio y del tipo de fibras musculares que se utilicen (de contracción rápida o de contracción lenta). Para una eficiencia general del 20 por ciento, un vatio de potencia mecánica equivale a 4,3 kcal por hora. Por ejemplo, un fabricante de equipos de remo calibra su ergómetro de remo para que cuente las calorías quemadas como equivalentes a cuatro veces el trabajo mecánico real, más 300 kcal por hora, lo que equivale a una eficiencia de alrededor del 20 por ciento a 250 vatios de producción mecánica. La producción de energía mecánica de una contracción cíclica puede depender de muchos factores, entre ellos el momento de activación, la trayectoria de la tensión muscular y las tasas de aumento y disminución de la fuerza. Estos factores se pueden sintetizar experimentalmente mediante el análisis del ciclo de trabajo .
Fuerza muscular
| Grado 0 | Sin contracción |
| Grado 1 | Rastro de contracción, pero sin movimiento en la articulación. |
| Grado 2 | Movimiento en la articulación con gravedad eliminada. |
| Grado 3 | Movimiento contra la gravedad, pero no contra resistencia añadida |
| Grado 4 | Movimiento contra resistencia externa, pero menor de lo normal |
| Grado 5 | Fuerza normal |
La fuerza muscular es el resultado de tres factores superpuestos: fuerza fisiológica (tamaño del músculo, área de la sección transversal, puentes cruzados disponibles, respuestas al entrenamiento), fuerza neurológica (qué tan fuerte o débil es la señal que le dice al músculo que se contraiga) y fuerza mecánica (ángulo de fuerza del músculo en la palanca, longitud del brazo del momento, capacidades de la articulación). [ cita requerida ]
El músculo de los vertebrados produce típicamente aproximadamente 25–33 N (5,6–7,4 lb ·f ) de fuerza por centímetro cuadrado de área transversal muscular cuando es isométrico y tiene una longitud óptima. [71] Algunos músculos de invertebrados , como en las pinzas de cangrejo, tienen sarcómeros mucho más largos que los vertebrados, lo que resulta en muchos más sitios para que la actina y la miosina se unan y, por lo tanto, una fuerza mucho mayor por centímetro cuadrado a costa de una velocidad mucho más lenta. La fuerza generada por una contracción se puede medir de forma no invasiva utilizando mecanomiografía o fonomiografía , se puede medir in vivo utilizando la tensión del tendón (si hay un tendón prominente) o se puede medir directamente utilizando métodos más invasivos.
La fuerza de un músculo determinado, en términos de fuerza ejercida sobre el esqueleto, depende de la longitud, la velocidad de acortamiento , el área de la sección transversal, la penenación , la longitud del sarcómero , las isoformas de miosina y la activación neural de las unidades motoras . Las reducciones significativas en la fuerza muscular pueden indicar una patología subyacente; el gráfico de la derecha se utiliza como guía.
El tiempo máximo de retención de un músculo contraído depende de su suministro de energía y, según la ley de Rohmert, disminuye exponencialmente desde el comienzo del esfuerzo.
El músculo humano "más fuerte"
Esta sección necesita citas adicionales para su verificación . ( Marzo de 2016 ) |
Dado que tres factores afectan la fuerza muscular simultáneamente y los músculos nunca trabajan individualmente, es engañoso comparar la fuerza de músculos individuales y afirmar que uno es el "más fuerte". Pero a continuación se presentan varios músculos cuya fuerza es notable por diferentes razones.
- En el lenguaje corriente, la "fuerza" muscular suele referirse a la capacidad de ejercer una fuerza sobre un objeto externo, por ejemplo, levantar un peso. Según esta definición, el músculo masetero o de la mandíbula es el más fuerte. El Libro Guinness de los Récords de 1992 registra el logro de una fuerza de mordida de 4.337 N (975 lb f ) durante 2 segundos. Lo que distingue al masetero no es nada especial en el músculo en sí, sino su ventaja al trabajar contra un brazo de palanca mucho más corto que otros músculos.
- Si por "fuerza" se entiende la fuerza ejercida por el propio músculo, por ejemplo, en el lugar donde se inserta en un hueso, entonces los músculos más fuertes son aquellos que tienen la mayor área de sección transversal. Esto se debe a que la tensión ejercida por una fibra muscular esquelética individual no varía mucho. Cada fibra puede ejercer una fuerza del orden de 0,3 micronewton. Según esta definición, se suele decir que el músculo más fuerte del cuerpo es el cuádriceps femoral o el glúteo mayor .
- Debido a que la fuerza muscular está determinada por el área de la sección transversal, un músculo más corto será más fuerte "libra por libra" (es decir, por peso ) que un músculo más largo de la misma área de sección transversal. La capa miometrial del útero puede ser el músculo más fuerte por peso en el cuerpo femenino. En el momento del nacimiento de un bebé , el útero entero pesa alrededor de 1,1 kg (40 oz). Durante el parto, el útero ejerce de 100 a 400 N (25 a 100 lbf) de fuerza hacia abajo con cada contracción.
- Los músculos externos del ojo son notablemente grandes y fuertes en relación con el pequeño tamaño y peso del globo ocular . Con frecuencia se dice que son "los músculos más fuertes para la tarea que tienen que hacer" y a veces se afirma que son "100 veces más fuertes de lo que deberían ser". Sin embargo, los movimientos oculares (en particular los movimientos sacádicos utilizados en el escaneo facial y la lectura) requieren movimientos de alta velocidad, y los músculos oculares se ejercitan todas las noches durante el sueño de movimientos oculares rápidos .
- La afirmación de que “la lengua es el músculo más fuerte del cuerpo” aparece con frecuencia en listas de hechos sorprendentes, pero es difícil encontrar una definición de “fuerza” que haga que esta afirmación sea cierta. La lengua consta de ocho músculos, no de uno.
Generación de fuerza
La fuerza muscular es proporcional al área transversal fisiológica (PCSA), y la velocidad muscular es proporcional a la longitud de la fibra muscular. [72] Sin embargo, el torque alrededor de una articulación está determinado por una serie de parámetros biomecánicos, incluyendo la distancia entre las inserciones musculares y los puntos de pivote, el tamaño muscular y la relación de transmisión arquitectónica . Los músculos normalmente están dispuestos en oposición de modo que cuando un grupo de músculos se contrae, otro grupo se relaja o se alarga. [73] El antagonismo en la transmisión de impulsos nerviosos a los músculos significa que es imposible estimular completamente la contracción de dos músculos antagonistas en un momento dado. Durante movimientos balísticos como el lanzamiento, los músculos antagonistas actúan para "frenar" a los músculos agonistas durante toda la contracción, particularmente al final del movimiento. En el ejemplo del lanzamiento, el pecho y la parte delantera del hombro (deltoides anterior) se contraen para tirar del brazo hacia delante, mientras que los músculos de la parte trasera y trasera del hombro (deltoides posterior) también se contraen y experimentan una contracción excéntrica para ralentizar el movimiento y evitar lesiones. Parte del proceso de entrenamiento es aprender a relajar los músculos antagonistas para aumentar la entrada de fuerza del pecho y del hombro anterior.
Los músculos que se contraen producen vibración y sonido. [74] Las fibras de contracción lenta producen de 10 a 30 contracciones por segundo (10 a 30 Hz). Las fibras de contracción rápida producen de 30 a 70 contracciones por segundo (30 a 70 Hz). [75] La vibración se puede observar y sentir al tensar fuertemente los músculos, como al cerrar el puño con fuerza. El sonido se puede escuchar al presionar un músculo muy tenso contra el oído; nuevamente, un puño firme es un buen ejemplo. El sonido generalmente se describe como un sonido retumbante. Algunas personas pueden producir voluntariamente este sonido retumbante al contraer el músculo tensor del tímpano del oído medio. El sonido retumbante también se puede escuchar cuando los músculos del cuello o la mandíbula están muy tensos. [ cita requerida ]
Vías de transducción de señales
El fenotipo de tipo de fibra del músculo esquelético en animales adultos está regulado por varias vías de señalización independientes. Estas incluyen vías involucradas con la vía Ras /proteína quinasa activada por mitógeno ( MAPK ), calcineurina, proteína quinasa IV dependiente de calcio/calmodulina y el coactivador 1 del proliferador de peroxisoma γ (PGC-1). La vía de señalización Ras/MAPK vincula las neuronas motoras y los sistemas de señalización, acoplando la excitación y la regulación de la transcripción para promover la inducción dependiente de los nervios del programa lento en la regeneración muscular. La calcineurina , una fosfatasa activada por Ca 2+ / calmodulina implicada en la especificación del tipo de fibra dependiente de la actividad nerviosa en el músculo esquelético, controla directamente el estado de fosforilación del factor de transcripción NFAT , lo que permite su translocación al núcleo y conduce a la activación de proteínas musculares de tipo lento en cooperación con las proteínas del factor potenciador de miocitos 2 ( MEF2 ) y otras proteínas reguladoras. La actividad de la proteína quinasa dependiente de Ca2+/calmodulina también se regula positivamente por la actividad de la neurona motora lenta, posiblemente porque amplifica las respuestas generadas por la calcineurina de tipo lento al promover las funciones transactivadoras de MEF2 y mejorar la capacidad oxidativa a través de la estimulación de la biogénesis mitocondrial .
Los cambios inducidos por la contracción en el calcio intracelular o en las especies reactivas de oxígeno proporcionan señales a diversas vías que incluyen las MAPK, la calcineurina y la proteína quinasa IV dependiente de calcio/calmodulina para activar factores de transcripción que regulan la expresión genética y la actividad enzimática en el músculo esquelético.

PGC1-α ( PPARGC1A ), un coactivador transcripcional de receptores nucleares importantes para la regulación de una serie de genes mitocondriales implicados en el metabolismo oxidativo, interactúa directamente con MEF2 para activar sinérgicamente genes musculares de contracción lenta (ST) selectivos y también sirve como diana para la señalización de calcineurina. Una vía transcripcional mediada por el receptor activado por el proliferador de peroxisomas δ ( PPARδ ) está implicada en la regulación del fenotipo de la fibra muscular esquelética. Los ratones que albergan una forma activada de PPARδ muestran un fenotipo de "resistencia", con un aumento coordinado de las enzimas oxidativas y la biogénesis mitocondrial y una mayor proporción de fibras ST. Por tanto, a través de la genómica funcional, la calcineurina, la quinasa dependiente de calmodulina, PGC-1α y el PPARδ activado forman la base de una red de señalización que controla la transformación del tipo de fibra muscular esquelética y los perfiles metabólicos que protegen contra la resistencia a la insulina y la obesidad.
La transición del metabolismo aeróbico al anaeróbico durante el trabajo intenso requiere que se activen rápidamente varios sistemas para garantizar un suministro constante de ATP para los músculos que trabajan. Estos incluyen un cambio de combustibles basados en grasas a basados en carbohidratos, una redistribución del flujo sanguíneo de los músculos que no trabajan a los que se ejercitan y la eliminación de varios de los subproductos del metabolismo anaeróbico, como el dióxido de carbono y el ácido láctico. Algunas de estas respuestas están gobernadas por el control transcripcional del fenotipo glucolítico de contracción rápida (FT). Por ejemplo, la reprogramación del músculo esquelético de un fenotipo glucolítico ST a un fenotipo glucolítico FT involucra al complejo Six1/Eya1, compuesto por miembros de la familia de proteínas Six. Además, el factor inducible por hipoxia 1-α ( HIF1A ) ha sido identificado como un regulador maestro para la expresión de genes involucrados en respuestas hipóxicas esenciales que mantienen los niveles de ATP en las células. La ablación de HIF-1α en el músculo esquelético se asoció con un aumento de la actividad de las enzimas limitantes de la velocidad de las mitocondrias, lo que indica que el ciclo del ácido cítrico y el aumento de la oxidación de los ácidos grasos pueden estar compensando la disminución del flujo a través de la vía glucolítica en estos animales. Sin embargo, las respuestas de HIF-1α mediadas por la hipoxia también están vinculadas a la regulación de la disfunción mitocondrial a través de la formación de especies reactivas de oxígeno excesivas en las mitocondrias.
Existen otras vías que también influyen en el carácter muscular adulto. Por ejemplo, la fuerza física ejercida dentro de una fibra muscular puede liberar el factor de transcripción factor de respuesta sérica de la proteína estructural titina, lo que provoca una alteración del crecimiento muscular.
Ejercicio

El ejercicio físico se recomienda a menudo como un medio para mejorar las habilidades motoras , la aptitud física , la fuerza muscular y ósea y la función articular. El ejercicio tiene varios efectos sobre los músculos, el tejido conectivo , los huesos y los nervios que estimulan los músculos. Uno de estos efectos es la hipertrofia muscular , un aumento en el tamaño del músculo debido a un aumento en el número de fibras musculares o área transversal de las miofibrillas. [76] Los cambios musculares dependen del tipo de ejercicio utilizado.
Generalmente, hay dos tipos de regímenes de ejercicio, aeróbico y anaeróbico. El ejercicio aeróbico (por ejemplo, maratones) implica actividades de baja intensidad pero de larga duración, durante las cuales los músculos utilizados están por debajo de su fuerza de contracción máxima. Las actividades aeróbicas dependen de la respiración aeróbica (es decir, el ciclo del ácido cítrico y la cadena de transporte de electrones) para la energía metabólica mediante el consumo de grasa, proteínas, carbohidratos y oxígeno. Los músculos involucrados en ejercicios aeróbicos contienen un mayor porcentaje de fibras musculares de tipo I (o de contracción lenta), que contienen principalmente enzimas mitocondriales y de oxidación asociadas con la respiración aeróbica. [77] [78] Por el contrario, el ejercicio anaeróbico se asocia con actividades de alta intensidad pero de corta duración, como el sprint o el levantamiento de pesas . Las actividades anaeróbicas utilizan predominantemente fibras musculares de tipo II, de contracción rápida. [79] Las fibras musculares de tipo II dependen de la glucogénesis para obtener energía durante el ejercicio anaeróbico. [80] Durante el ejercicio anaeróbico, las fibras de tipo II consumen poco oxígeno, proteínas y grasas, producen grandes cantidades de ácido láctico y son fatigables. Muchos ejercicios son parcialmente aeróbicos y anaeróbicos; por ejemplo, el fútbol y la escalada en roca .
La presencia de ácido láctico tiene un efecto inhibidor sobre la generación de ATP dentro del músculo. Incluso puede detener la producción de ATP si la concentración intracelular se vuelve demasiado alta. Sin embargo, el entrenamiento de resistencia mitiga la acumulación de ácido láctico a través del aumento de la capilarización y la mioglobina. [81] Esto aumenta la capacidad de eliminar productos de desecho, como el ácido láctico, de los músculos para no perjudicar la función muscular. Una vez eliminado de los músculos, el ácido láctico puede ser utilizado por otros músculos o tejidos corporales como fuente de energía, o transportado al hígado donde se convierte nuevamente en piruvato . Además de aumentar el nivel de ácido láctico, el ejercicio extenuante da como resultado la pérdida de iones de potasio en el músculo. Esto puede facilitar la recuperación de la función muscular al proteger contra la fatiga. [82]
El dolor muscular de aparición tardía es un dolor o malestar que puede sentirse uno a tres días después de hacer ejercicio y que generalmente desaparece dos o tres días después. Antes se pensaba que era causado por la acumulación de ácido láctico, pero una teoría más reciente es que se debe a pequeños desgarros en las fibras musculares causados por la contracción excéntrica o niveles de entrenamiento no acostumbrados. Dado que el ácido láctico se dispersa con bastante rapidez, no podría explicar el dolor experimentado días después del ejercicio. [83]
Importancia clínica
Enfermedad muscular
Las enfermedades del músculo esquelético se denominan miopatías , mientras que las enfermedades de los nervios se denominan neuropatías . Ambas pueden afectar la función muscular o causar dolor muscular, y se incluyen en el grupo de enfermedades neuromusculares . La causa de muchas miopatías se atribuye a mutaciones en las diversas proteínas musculares asociadas. [5] [84] Algunas miopatías inflamatorias incluyen polimiositis y miositis por cuerpos de inclusión.

Las enfermedades neuromusculares afectan a los músculos y su control nervioso. En general, los problemas con el control nervioso pueden causar espasticidad o parálisis , dependiendo de la ubicación y la naturaleza del problema. Una serie de trastornos del movimiento son causados por trastornos neurológicos como la enfermedad de Parkinson y la enfermedad de Huntington , donde hay una disfunción del sistema nervioso central. [85]
Los síntomas de las enfermedades musculares pueden incluir debilidad , espasticidad, mioclono y mialgia . Los procedimientos de diagnóstico que pueden revelar trastornos musculares incluyen la prueba de los niveles de creatina quinasa en la sangre y la electromiografía (medición de la actividad eléctrica en los músculos). En algunos casos, se puede realizar una biopsia muscular para identificar una miopatía , así como pruebas genéticas para identificar anomalías del ADN asociadas con miopatías y distrofias específicas .
Se está experimentando una técnica de elastografía no invasiva que mide el ruido muscular para proporcionar una forma de monitorear la enfermedad neuromuscular. El sonido producido por un músculo proviene del acortamiento de los filamentos de actomiosina a lo largo del eje del músculo. Durante la contracción , el músculo se acorta a lo largo y se expande a lo ancho, produciendo vibraciones en la superficie. [86]
Hipertrofia
Independientemente de las medidas de fuerza y rendimiento, los músculos pueden ser inducidos a crecer más grandes por una serie de factores, incluyendo la señalización hormonal, factores de desarrollo, entrenamiento de fuerza y enfermedad. Contrariamente a la creencia popular, la cantidad de fibras musculares no puede aumentarse mediante el ejercicio . En cambio, los músculos crecen más grandes a través de una combinación de crecimiento de células musculares a medida que se agregan nuevos filamentos de proteína junto con masa adicional proporcionada por células satélite indiferenciadas junto con las células musculares existentes. [87]
Los factores biológicos como la edad y los niveles hormonales pueden afectar la hipertrofia muscular. Durante la pubertad en los hombres, la hipertrofia se produce a un ritmo acelerado a medida que aumentan los niveles de hormonas estimulantes del crecimiento producidas por el cuerpo. La hipertrofia natural normalmente se detiene en el crecimiento completo al final de la adolescencia. Como la testosterona es una de las principales hormonas de crecimiento del cuerpo, en promedio, a los hombres les resulta mucho más fácil lograr la hipertrofia que a las mujeres. Tomar testosterona adicional u otros esteroides anabólicos aumentará la hipertrofia muscular.
Los factores musculares, espinales y neurales afectan el desarrollo muscular. A veces, una persona puede notar un aumento de fuerza en un músculo determinado aunque solo se haya ejercitado el opuesto, como cuando un culturista descubre que su bíceps izquierdo está más fuerte después de completar un régimen centrado solo en el bíceps derecho. Este fenómeno se denomina educación cruzada . [ cita requerida ]
Atrofia

Cada día se degrada y reconstruye entre el uno y el dos por ciento del músculo. La inactividad , la desnutrición , las enfermedades y el envejecimiento pueden aumentar la degradación y provocar atrofia muscular o sarcopenia . La sarcopenia es un proceso comúnmente relacionado con la edad que puede causar fragilidad y sus consecuencias. [88] Una disminución de la masa muscular puede ir acompañada de una menor cantidad y tamaño de las células musculares, así como de un menor contenido proteico. [89]
Se sabe que los vuelos espaciales tripulados , que implican períodos prolongados de inmovilización y gravedad cero, provocan debilitamiento y atrofia muscular, lo que resulta en una pérdida de hasta un 30% de masa en algunos músculos. [90] [91] Estas consecuencias también se observan en algunos mamíferos después de la hibernación . [92]
Muchas enfermedades y afecciones, incluido el cáncer , el SIDA y la insuficiencia cardíaca , pueden causar pérdida muscular conocida como caquexia . [93]
Investigación
Las miopatías se han modelado con sistemas de cultivo celular de músculo a partir de biopsias de tejido sano o enfermo . Otra fuente de músculo esquelético y progenitores la proporciona la diferenciación dirigida de células madre pluripotentes . [94]
La investigación sobre las propiedades del músculo esquelético utiliza muchas técnicas. La estimulación muscular eléctrica se utiliza para determinar la fuerza y la velocidad de contracción a diferentes frecuencias relacionadas con la composición y la combinación de tipos de fibras dentro de un grupo muscular individual. Las pruebas musculares in vitro se utilizan para una caracterización más completa de las propiedades musculares.
La actividad eléctrica asociada con la contracción muscular se mide mediante electromiografía (EMG). El músculo esquelético tiene dos respuestas fisiológicas: relajación y contracción. Los mecanismos por los cuales ocurren estas respuestas generan actividad eléctrica medida por EMG. Específicamente, EMG puede medir el potencial de acción de un músculo esquelético, que ocurre a partir de la hiperpolarización de los axones motores de los impulsos nerviosos enviados al músculo. EMG se utiliza en investigación para determinar si el músculo esquelético de interés está siendo activado, la cantidad de fuerza generada y un indicador de fatiga muscular . [95] Los dos tipos de EMG son EMG intramuscular y el más común, EMG de superficie. Las señales EMG son mucho mayores cuando un músculo esquelético se contrae en lugar de relajarse. Sin embargo, para músculos esqueléticos más pequeños y profundos, las señales EMG se reducen y, por lo tanto, se consideran una técnica menos valorada para medir la activación. [96] En las investigaciones que utilizan EMG, normalmente se realiza una contracción voluntaria máxima (MVC) en el músculo esquelético de interés, para tener datos de referencia para el resto de los registros de EMG durante las pruebas experimentales principales para ese mismo músculo esquelético. [97]
La investigación para el desarrollo de músculos artificiales incluye el uso de polímeros electroactivos .

Células mononucleares del músculo esquelético
Los núcleos presentes en el músculo esquelético son aproximadamente 50% núcleos de miocitos y 50% núcleos de células mononucleares. [13] Las células mononucleares encontradas en muestras de tejido del músculo esquelético de ratones y humanos [15] [99] [98] pueden identificarse mediante la transcripción del ARN mensajero de los marcadores del tipo celular. Cameron et al. [98] identificaron nueve tipos de células. Incluyen células endoteliales que recubren los capilares (45% de las células), progenitores fibroadipogénicos (FAP) (20%), [100] pericitos (14%) y pericitos similares al endotelio (4%). Otro 9% de las células mononucleares son células madre musculares , adyacentes a las células de las fibras musculares. Los tipos de células linfoides (como las células B y las células T) (3%) y las células mieloides como los macrófagos (2%) constituyeron la mayoría de las células mononucleares restantes del músculo esquelético. [98] Además, Cameron et al. [98] También se identificaron dos tipos de células miocíticas, tipo I y tipo II. Se descubrió que cada uno de los diferentes tipos de células del músculo esquelético expresaba diferentes conjuntos de genes. La mediana de la cantidad de genes expresados en cada uno de los nueve tipos de células diferentes fue de 1331 genes. Sin embargo, cuando se toma una biopsia de un músculo del muslo, la biopsia contiene todos los diferentes tipos de células. Mezclados entre sí, en una biopsia de músculo esquelético del muslo humano, hay entre 13 026 y 13 108 genes con expresión detectada. [101] [102]
Funciones endocrinas del músculo esquelético
Como se señala en la Introducción de este artículo, en diferentes condiciones fisiológicas, subconjuntos de 654 proteínas diferentes, así como lípidos, aminoácidos, metabolitos y ARN pequeños aparecen en el secretoma de los músculos esqueléticos. [12] Como se describe en el artículo de Wikipedia " Lista de órganos y acciones endocrinos humanos ", el músculo esquelético se identifica como un órgano endocrino debido a su secreción de citocinas y otros péptidos producidos por el músculo esquelético como moléculas de señalización. Iizuka et al., [9] indicaron que el músculo esquelético es un órgano endocrino porque "sintetiza y secreta múltiples factores, y estos factores derivados del músculo ejercen efectos beneficiosos sobre órganos periféricos y remotos". Los secretomas alterados después del entrenamiento de resistencia o entrenamiento de fuerza , así como el secretoma del músculo sedentario, parecen tener muchos efectos sobre los tejidos distantes.
La masa muscular esquelética sedentaria afecta la función mental ejecutiva
Un estudio realizado en Canadá puso a prueba el efecto de la masa muscular en las funciones mentales durante el envejecimiento. Una expectativa del estudio era que los componentes endocrinos del secretoma específico del músculo esquelético pudieran proteger las funciones cognitivas. Se midió la masa muscular esquelética de los brazos y las piernas de 8.279 canadienses mayores de 65 años y con una salud promedio al inicio y después de tres años. [103] De estos individuos, se consideró que 1.605 participantes (19,4%) tenían una masa muscular esquelética baja al inicio, con menos de 7,30 kg/m2 para los hombres y menos de 5,42 kg/m2 para las mujeres (niveles definidos como sarcopenia en Canadá).
La función mental ejecutiva , la memoria y la velocidad psicomotora se midieron al inicio y a los tres años. La función mental ejecutiva se midió con pruebas estándar, incluida la capacidad de decir la secuencia 1-A, 2-B, 3-C…, nombrar varios animales en un minuto y con la prueba de Stroop . [103] El estudio encontró que aquellos individuos con menor masa muscular esquelética al inicio del estudio declinaron en su función mental ejecutiva considerablemente más acentuadamente que aquellos con mayor masa muscular. La memoria, así como la velocidad psicomotora, por otro lado, no se correlacionaron con la masa muscular esquelética. [103] Por lo tanto, una mayor masa muscular, con un secretoma concomitantemente más grande, parecía tener la función endocrina de proteger la función mental ejecutiva de individuos mayores de 65 años.
Caminar, utilizando los músculos esqueléticos, afecta la mortalidad
Paluch et al. [104] compararon el número promedio de pasos caminados por día con el riesgo de mortalidad , tanto para adultos mayores de 60 años como para adultos menores de 60 años. El estudio fue un metaanálisis de 15 estudios que, combinados, evaluaron a 47.471 adultos durante un período de 7 años. Los individuos se dividieron en cuartiles aproximadamente iguales. El cuartil más bajo promedió 3.553 pasos/día, el segundo cuartil 5.801 pasos/día, el tercer cuartil 7.842 pasos/día y el cuarto cuartil 10.901 pasos/día. La rapidez de la caminata, ajustada por el volumen de la caminata, no afectó la mortalidad. Sin embargo, el número de pasos/día estaba claramente relacionado con la mortalidad. Cuando el riesgo de mortalidad para los mayores de 60 años se fijó en 1,0 para el cuartil más bajo de pasos/día, el riesgo relativo de mortalidad para los cuartiles segundo, tercero y cuarto fue de 0,56, 0,45 y 0,35, respectivamente. Para los menores de 60 años, los resultados fueron menos pronunciados. Para los menores de 60 años, con el riesgo de mortalidad del primer cuartil fijado en 1,0, los riesgos relativos de mortalidad del segundo, tercer y cuarto cuartiles fueron de 0,57, 0,42 y 0,53, respectivamente. Por lo tanto, el uso de los músculos esqueléticos al caminar tiene un gran efecto, especialmente entre los individuos de mayor edad, sobre la mortalidad.
El secretoma del músculo esquelético se altera con el ejercicio
Williams et al. [102] obtuvieron biopsias de un músculo esquelético del muslo (músculo vasto lateral) de ocho varones caucásicos de 23 años, originalmente sedentarios. Las biopsias se tomaron antes y después de un programa de entrenamiento de ejercicios de resistencia de seis semanas de duración. El ejercicio consistía en montar una bicicleta estática durante una hora, cinco días a la semana durante seis semanas.
De los 13.108 genes con expresión detectada en las biopsias musculares, 641 genes se regularon al alza después del entrenamiento de resistencia y 176 genes se regularon a la baja. De los 817 genes alterados en total, 531 fueron identificados como estando en el secretoma por uno o ambos de Uniprot o Exocarta , o bien por estudios que investigan el secretoma de las células musculares. Debido a que muchos de los genes regulados por el ejercicio se identifican como secretados, esto indica que gran parte del efecto del ejercicio tiene una función endocrina en lugar de metabólica. [102] Las principales vías que se encontraron afectadas por las proteínas reguladas por el ejercicio secretadas estaban relacionadas con las funciones cardíaca , cognitiva , renal y plaquetaria .
Los efectos del entrenamiento físico están mediados por mecanismos epigenéticos
Entre 2012 y 2019, al menos 25 informes indicaron un papel importante de los mecanismos epigenéticos en las respuestas del músculo esquelético al ejercicio. [105] Las alteraciones epigenéticas a menudo ocurren al agregar grupos metilo a las citosinas en el ADN o al eliminar grupos metilo de las citosinas del ADN , especialmente en los sitios CpG . Las metilaciones de las citosinas pueden hacer que el ADN se compacte en heterocromatina , inhibiendo así el acceso de otras moléculas al ADN. [106] Las alteraciones epigenéticas también ocurren a menudo a través de acetilaciones o desacetilaciones de las colas de histonas dentro de la cromatina . El ADN en el núcleo generalmente consta de segmentos de 146 pares de bases de ADN envueltos alrededor de ocho histonas estrechamente conectadas (y cada histona también tiene una cola suelta) en una estructura llamada nucleosoma y un segmento de ADN está conectado a un segmento de ADN adyacente en un nucleosoma por ADN enlazador . Cuando las colas de histonas se acetilan , generalmente provocan el aflojamiento del ADN alrededor del nucleosoma, lo que aumenta la accesibilidad del ADN.
Regulación de los genes en los músculos inducida por el ejercicio

La expresión génica en el músculo está regulada en gran medida, como en los tejidos en general, por secuencias de ADN reguladoras , especialmente potenciadores . Los potenciadores son secuencias no codificantes en el genoma que activan la expresión de genes diana distantes, [107] al rodear e interactuar con los promotores de sus genes diana [108] (véase la Figura "Regulación de la transcripción en mamíferos"). Como informaron Williams et al., [102] la distancia media en el bucle entre los potenciadores y promotores de genes conectados es de 239.000 bases de nucleótidos.
Alteración de la expresión genética inducida por el ejercicio mediante metilación o desmetilación del ADN
El entrenamiento muscular de resistencia altera la expresión genética muscular mediante la metilación del ADN epigenético o la desmetilación de los sitios CpG dentro de los potenciadores. [109]
En un estudio de Lindholm et al., [109] veintitrés individuos de alrededor de 27 años de edad y sedentarios se ofrecieron como voluntarios para realizar entrenamiento de resistencia en una sola pierna durante 3 meses. La otra pierna se utilizó como pierna de control sin entrenamiento. El entrenamiento consistió en un entrenamiento de extensión de rodilla con una sola pierna durante 3 meses (45 min, 4 sesiones por semana). Se tomaron biopsias de músculo esquelético del vasto lateral (un músculo del muslo) tanto antes de que comenzara el entrenamiento como 24 horas después de la última sesión de entrenamiento de cada una de las piernas. La pierna entrenada en resistencia, en comparación con la pierna sin entrenamiento, tuvo cambios significativos en la metilación del ADN en 4.919 sitios en todo el genoma. Los sitios de metilación del ADN alterada estaban predominantemente en potenciadores . El análisis transcripcional, utilizando secuenciación de ARN , identificó 4.076 genes expresados diferencialmente.
Los genes regulados positivamente a nivel transcripcional se asociaron con potenciadores que tuvieron una disminución significativa en la metilación del ADN , mientras que los genes regulados negativamente a nivel transcripcional se asociaron con potenciadores que tuvieron una metilación del ADN aumentada. La metilación aumentada se asoció principalmente con genes involucrados en la remodelación estructural del músculo y el metabolismo de la glucosa. Los potenciadores con metilación disminuida se asociaron con genes que funcionan en procesos inflamatorios o inmunológicos y en la regulación transcripcional.
Alteración a largo plazo de la expresión genética inducida por el ejercicio mediante acetilación o desacetilación de histonas

Como se indicó anteriormente, después del ejercicio, las alteraciones epigenéticas de los potenciadores alteran la expresión a largo plazo de cientos de genes musculares. [102] Esto incluye genes que producen proteínas secretadas en la circulación sistémica, muchas de las cuales pueden actuar como mensajeros endocrinos. [102] Seis varones caucásicos sedentarios, de unos 23 años de edad, proporcionaron biopsias del vasto lateral (un músculo del muslo) antes de comenzar un programa de ejercicios (seis semanas de sesiones de 60 minutos de montar en una bicicleta estática, cinco días a la semana). Cuatro días después de completar este programa de ejercicios, la expresión de muchos genes se alteró epigenéticamente de manera persistente . Las alteraciones alteraron las acetilaciones y desacetilaciones de las colas de histonas ubicadas en los potenciadores que controlan los genes con expresión alterada. [102]
Los genes regulados al alza se asociaron con acetilaciones epigenéticas añadidas en la lisina 27 de la histona 3 (H3K27ac) de los nucleosomas ubicados en sus potenciadores . Los genes regulados a la baja se asociaron con la eliminación de acetilaciones epigenéticas en H3K27 en los nucleosomas ubicados en sus potenciadores (ver Figura "Un nucleosoma con colas de histonas preparadas para la activación transcripcional"). Las biopsias del músculo vasto lateral mostraron la expresión de 13.108 genes al inicio del programa de entrenamiento físico. Cuatro días después de completar el programa de ejercicio, las biopsias de los mismos músculos mostraron una expresión genética alterada, con 641 genes regulados al alza y 176 genes regulados a la baja. [102] Williams et al. Se identificaron 599 interacciones potenciador-gen, que abarcan 491 potenciadores y 268 genes (se encontraron múltiples potenciadores conectados a algunos genes), donde tanto el potenciador como el gen objetivo conectado se regulaban positiva o negativamente de manera coordinada después del entrenamiento físico. [102]
Véase también
Referencias
- ^ Birbrair, Alexander; Zhang, Tan; Wang, Zhong-Min; Messi, Maria Laura; Enikolopov, Grigori N.; Mintz, Akiva; Delbono, Osvaldo (21 de marzo de 2013). "El papel de los pericitos en la regeneración del músculo esquelético y la acumulación de grasa". Células madre y desarrollo . 22 (16): 2298–2314. doi :10.1089/scd.2012.0647. ISSN 1547-3287. PMC 3730538 . PMID 23517218.
- ^ Betts, J. Gordon; Young, Kelly A.; Wise, James A.; Johnson, Eddie; Poe, Brandon; Kruse, Dean H.; Korol, Oksana; Johnson, Jody E.; Womble, Mark; Desaix, Peter (6 de marzo de 2013). "Interacciones de los músculos esqueléticos, su disposición de fascículos y sus sistemas de palanca". Interacciones de los músculos esqueléticos . OpenStax. Archivado desde el original el 23 de marzo de 2022 . Consultado el 24 de mayo de 2021 .
- ^ abc "Estructura del músculo esquelético | Capacitación SEER". training.seer.cancer.gov .
- ^ abc Moore, Keith L. (2018). Anatomía con orientación clínica (octava edición). Filadelfia: Wolters Kluwer. págs. 30–33. ISBN 9781496347213.
- ^ abcd Henderson, CA; Gomez, CG; Novak, SM; Mi-Mi, L; Gregorio, CC (18 de junio de 2017). "Descripción general del citoesqueleto muscular". Fisiología integral . 7 (3): 891–944. doi :10.1002/cphy.c160033. PMC 5890934 . PMID 28640448.
- ^ Brainard, Jean; Gray-Wilson, Niamh; Harwood, Jessica; Karasov, Corliss; Kraus, Dors; Willan, Jane (2011). CK-12 Life Science Honors for Middle School. CK-12 Foundation. pág. 451. Consultado el 18 de abril de 2015 .
- ^ Janssen I, Heymsfield SB, Wang ZM, Ross R (julio de 2000). "Masa y distribución del músculo esquelético en 468 hombres y mujeres de 18 a 88 años". J Appl Physiol . 89 (1): 81–8. doi :10.1152/jappl.2000.89.1.81. PMID 10904038. S2CID 9232367.
- ^ McCuller C, Jessu R, Callahan AL (enero de 2022) [Actualizado el 25 de marzo de 2022]. Fisiología del músculo esquelético . Treasure Island, FL: StatPearls Publishing. PMID 30725824. NBK537139 – vía StatPearls [Internet].
- ^ ab Iizuka K, Machida T, Hirafuji M (2014). "El músculo esquelético es un órgano endocrino". J Pharmacol Sci . 125 (2): 125–31. doi : 10.1254/jphs.14r02cp . PMID 24859778.
- ^ Hoffmann C, Weigert C (noviembre de 2017). "El músculo esquelético como órgano endocrino: el papel de las mioquinas en las adaptaciones al ejercicio". Cold Spring Harb Perspect Med . 7 (11): a029793. doi :10.1101/cshperspect.a029793. PMC 5666622 . PMID 28389517.
- ^ Severinsen MC, Pedersen BK (agosto de 2020). "Intercomunicación entre músculos y órganos: los roles emergentes de las mioquinas". Endocr Rev . 41 (4): 594–609. doi :10.1210/endrev/bnaa016. PMC 7288608 . PMID 32393961.
- ^ ab Florin A, Lambert C, Sanchez C, Zappia J, Durieux N, Tieppo AM, Mobasheri A, Henrotin Y (marzo de 2020). "El secretoma de las células del músculo esquelético: una revisión sistemática". Osteoarthr Cartil Open . 2 (1): 100019. doi :10.1016/j.ocarto.2019.100019. PMC 9718214 . PMID 36474563.
- ^ abc Von Walden F, Rea M, Mobley CB, Fondufe-Mittendorf Y, McCarthy JJ, Peterson CA, Murach KA (noviembre de 2020). "El metiloma del ADN mionuclear en respuesta a un estímulo hipertrófico agudo". Epigenética . 15 (11): 1151–1162. doi :10.1080/15592294.2020.1755581. PMC 7595631 . PMID 32281477.
- ^ Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter (2002). Génesis, modulación y regeneración del músculo esquelético. Garland Science.
- ^ ab Giordani L, He GJ, Negroni E, Sakai H, Law JY, Siu MM, Wan R, Corneau A, Tajbakhsh S, Cheung TH, Le Grand F (mayo de 2019). "La cartografía unicelular de alta dimensión revela nuevas poblaciones de células residentes en el músculo esquelético". Mol Cell . 74 (3): 609–621.e6. doi : 10.1016/j.molcel.2019.02.026 . PMID 30922843.
- ^ Introducción. Morgan & Claypool Life Sciences. 2011.
- ^ Tigner, A.; Ibrahim, SA; Murray, I. (2022). "Histología, glóbulos blancos". StatPearls. PMID 33085295.
- ^ Ying Ji; Dympna Gallagher (2014). "3. Evaluación de la composición corporal del paciente grave". En Faber, Peter; Siervo, Mario (eds.). Nutrición en cuidados críticos . Nueva York: Cambridge University Press. p. 22. ISBN 978-1-107-66901-7. Recuperado el 17 de febrero de 2023 .
- ^ ab "Grupos musculares | Capacitación SEER". training.seer.cancer.gov . Consultado el 17 de mayo de 2021 .
- ^ "¿Cuál es el músculo más fuerte del cuerpo humano?". Biblioteca del Congreso . Consultado el 17 de mayo de 2021 .
- ^ Muller, Martin N.; Wrangham, Richard W.; Pilbeam, David R., eds. (2017). "11. La evolución del sistema de apareamiento humano". Los chimpancés y la evolución humana . Cambridge, Massachusetts: Harvard University Press. pág. 397. ISBN 9780674967953. Recuperado el 17 de febrero de 2023 .
- ^ Klein, CS; Marsh, GD; Petrella, RJ; Rice, CL (julio de 2003). "Número de fibras musculares en el músculo bíceps braquial de hombres jóvenes y mayores". Muscle & Nerve . 28 (1): 62–8. doi :10.1002/mus.10386. PMID 12811774. S2CID 20508198.
- ^ Cho, CH; Lee, KJ; Lee, EH (agosto de 2018). "Con el mayor cuidado, las proteínas de la molécula de interacción estromal (STIM) verifican lo que está haciendo el músculo esquelético". BMB Reports . 51 (8): 378–387. doi :10.5483/bmbrep.2018.51.8.128. PMC 6130827 . PMID 29898810.
- ^ ab Prasad, V; Millay, DP (8 de mayo de 2021). "Las fibras musculares esqueléticas dependen de la cantidad de núcleos para el crecimiento". Seminarios en biología celular y del desarrollo . 119 : 3–10. doi :10.1016/j.semcdb.2021.04.015. PMC 9070318 . PMID 33972174. S2CID 234362466.
- ^ abc Snijders, T; Aussieker, T; Holwerda, A; Parise, G; van Loon, LJC; Verdijk, LB (julio de 2020). "El concepto de memoria del músculo esquelético: evidencia de estudios en animales y humanos". Acta Physiologica . 229 (3): e13465. doi :10.1111/apha.13465. PMC 7317456 . PMID 32175681.
- ^ Quarta, M; Cromie, M; Chacon, R (20 de junio de 2017). "Las construcciones de bioingeniería combinadas con ejercicio mejoran el tratamiento de la pérdida muscular volumétrica mediado por células madre". Nature Communications . 8 : 15613. Bibcode :2017NatCo...815613Q. doi :10.1038/ncomms15613. PMC 5481841 . PMID 28631758.
- ^ ab Charvet, B; Ruggiero, F; Le Guellec, D (abril de 2012). "El desarrollo de la unión miotendinosa. Una revisión". Revista de músculos, ligamentos y tendones . 2 (2): 53–63. PMC 3666507 . PMID 23738275.
- ^ ab Martini, Frederic H.; Timmons, Michael J.; Tallitsch, Robert B. (2008). Anatomía humana (6.ª ed.). Benjamin Cummings. págs. 251–252. ISBN 978-0-321-50042-7.
- ^ abcd Lieber, Richard L. (2002) Estructura, función y plasticidad del músculo esquelético . Wolters Kluwer Health.
- ^ Ziser, Stephen. "&Muscle Cell Anatomy & Function" (PDF) . www.austincc.edu . Archivado (PDF) del original el 23 de septiembre de 2015 . Consultado el 12 de febrero de 2015 .
- ^ abcd Tortora, Gerard J. (2012). Principios de anatomía y fisiología (13.ª ed.). Hoboken, NJ: Wiley. pág. 372. ISBN 9780470646083.
- ^ abcd Saladin, Kenneth S. (2011). Anatomía humana (3.ª ed.). Nueva York: McGraw-Hill. pág. 265. ISBN 9780071222075.
- ^ Betts, J. Gordon; Young, Kelly A.; Wise, James A.; Johnson, Eddie; Poe, Brandon; Kruse, Dean H.; Korol, Oksana; Johnson, Jody E.; Womble, Mark; Desaix, Peter (6 de marzo de 2013). Tipos de fibras musculares. OpenStax . Consultado el 17 de junio de 2021 .
- ^ abcdef MacIntosh, Brian R.; Gardiner, Phillip F.; McComas, Alan J. (2006). Músculo esquelético: forma y función. Cinética humana. ISBN 978-0-7360-4517-9.
- ^ Este artículo incorpora texto disponible bajo la licencia CC BY 4.0. Betts, J Gordon; Desaix, Peter; Johnson, Eddie; Johnson, Jody E; Korol, Oksana; Kruse, Dean; Poe, Brandon; Wise, James; Womble, Mark D; Young, Kelly A (14 de mayo de 2023). Anatomía y fisiología . Houston: OpenStax CNX. 10.5 Tipos de fibras musculares. ISBN 978-1-947172-04-3.
- ^ ab "Tipo de fibra muscular". About.com . Medicina deportiva. Archivado desde el original el 21 de noviembre de 2007 . Consultado el 27 de noviembre de 2007 .
- ^ MacIntosh, Brian R. (2006). Músculo esquelético: forma y función (2.ª ed.). Champaign, IL: Human Kinetics. pág. 274. ISBN 978-0-7360-4517-9.
- ^ ab Johnson, MA; Polgar, J.; Weightman, D.; Appleton, D. (1973). "Datos sobre la distribución de los tipos de fibras en treinta y seis músculos humanos. Un estudio de autopsia". Revista de las Ciencias Neurológicas . 18 (1): 111–129. doi :10.1016/0022-510x(73)90023-3. PMID 4120482.
- ^ ab Schiaffino, S; Reggiani, C (octubre de 2011). "Tipos de fibras en los músculos esqueléticos de los mamíferos". Physiological Reviews . 91 (4): 1447–531. doi :10.1152/physrev.00031.2010. hdl :11577/2526092. PMID 22013216.
- ^ Michael Yessis (2006). Construye un mejor atleta . Conceptos básicos del atleta. ISBN 978-1-930546-78-3.
- ^ ab Smerdu V, Karsch-Mizrachi I, Campione M, Leinwand L, Schiaffino, S (diciembre de 1994). "Las transcripciones de la cadena pesada de miosina de tipo IIx se expresan en fibras de tipo IIb del músculo esquelético humano". The American Journal of Physiology . 267 (6 Pt 1): C1723–8. doi :10.1152/ajpcell.1994.267.6.C1723. PMID 7545970.
- ^ Pette, D; Staron, RS (15 de septiembre de 2000). "Isoformas de miosina, tipos de fibras musculares y transiciones". Microscopy Research and Technique . 50 (6): 500–9. doi :10.1002/1097-0029(20000915)50:6<500::AID-JEMT7>3.0.CO;2-7. PMID 10998639. S2CID 7820419.
- ^ Staron, Robert S.; Johnson, Peter (noviembre de 1993). "Polimorfismo de miosina y expresión diferencial en músculo esquelético humano adulto". Comparative Biochemistry and Physiology B . 106 (3): 463–475. doi :10.1016/0305-0491(93)90120-T. PMID 8281747.
- ^ Buchthal, F.; Schmalbruch, H. (agosto de 1970). "Tiempos de contracción y tipos de fibras en el músculo humano intacto". Acta Physiologica Scandinavica . 79 (4): 435–452. doi :10.1111/j.1748-1716.1970.tb04744.x. PMID 5472111.
- ^ Garnett, RA; O'Donovan, MJ; Stephens, JA; Taylor, A. (febrero de 1979). "Organización de la unidad motora del gastrocnemio medial humano". The Journal of Physiology . 287 (1): 33–43. doi :10.1113/jphysiol.1979.sp012643. PMC 1281479 . PMID 430414. [ enlace muerto permanente ]
- ^ Revista, Viviane Callier, Quanta. "Demasiado pequeños para músculos grandes, los animales diminutos usan resortes". Scientific American . Consultado el 13 de diciembre de 2022 .
{{cite web}}: CS1 maint: multiple names: authors list (link) - ^ ab Simoneau, Jean-Aimé; Bouchard, Claude (agosto de 1995). "Determinismo genético de la proporción del tipo de fibra en el músculo esquelético humano". The FASEB Journal . 9 (11): 1091–1095. doi : 10.1096/fasebj.9.11.7649409 . ISSN 0892-6638. PMID 7649409. S2CID 9613549.
- ^ ab Sieck, Gary C. (1 de enero de 2001). "Serie de temas destacados: plasticidad en músculo esquelético, cardíaco y liso". Revista de fisiología aplicada . 90 (1): 1. doi :10.1152/jappl.2001.90.1.1. ISSN 8750-7587.
- ^ Hamilton, Marc T.; Booth, Frank W. (1 de enero de 2000). "Adaptación del músculo esquelético al ejercicio: un siglo de progreso". Journal of Applied Physiology . 88 (1): 327–331. doi :10.1152/jappl.2000.88.1.327. ISSN 8750-7587. PMID 10642397. S2CID 7024153.
- ^ ab "Polimorfismo de las fibras en los músculos esqueléticos de la langosta americana, Homarus americanus: continuidad entre fibras de contracción lenta (S1) y fibras de contracción lenta tónica (S2)". journals.biologists.com . Consultado el 13 de diciembre de 2022 .
- ^ ab Callister, Robert J.; Pierce, Patricia A.; McDonagh, Jennifer C.; Stuart, Douglas G. (abril de 2005). "Fibras musculares de tónico lento y su potencial inervación en la tortuga, Pseudemys (Trachemys) scripta elegans". Revista de morfología . 264 (1): 62–74. doi :10.1002/jmor.10318. ISSN 0362-2525. PMID 15732049. S2CID 36961922.
- ^ Sokoloff, Alan J.; Li, Haiyan; Burkholder, Thomas J. (agosto de 2007). "Expresión limitada de la cadena pesada de miosina tónica lenta en los músculos craneales humanos". Muscle & Nerve . 36 (2): 183–189. doi :10.1002/mus.20797. PMC 3816747 . PMID 17486578.
- ^ ab "La expresión de múltiples genes de la cadena pesada de miosina lenta revela una diversidad de fibras musculares de contracción lenta del pez cebra con diferentes requisitos para la actividad de Hedgehog y Prdm1". journals.biologists.com . Consultado el 13 de diciembre de 2022 .
- ^ O'Neill, Matthew C.; Umberger, Brian R.; Holowka, Nicholas B.; Larson, Susan G.; Reiser, Peter J. (11 de julio de 2017). "La superfuerza de los chimpancés y la evolución del músculo esquelético humano". Actas de la Academia Nacional de Ciencias . 114 (28): 7343–7348. Bibcode :2017PNAS..114.7343O. doi : 10.1073/pnas.1619071114 . ISSN 0027-8424. PMC 5514706 . PMID 28652350.
- ^ "No conservación de la función de la proteína Prdm1 conservada evolutivamente en el control del programa miogénico de contracción lenta en el embrión de ratón". academic.oup.com . Consultado el 13 de diciembre de 2022 .
- ^ Ronnestad, HV (2020). "Efectos de la temperatura en los procesos digestivos y de alimentación de los peces". Fisiología médica de la temperatura y más allá . 7 (4): 307–320. doi :10.1080/23328940.2020.1765950. PMC 7678922 . PMID 33251280.
- ^ McDougall, Christopher (2009). Nacidos para correr: una tribu oculta, superatletas y la carrera más grande jamás vista .
- ^ Saladin, Kenneth S. (2010). Anatomía y fisiología (3.ª ed.). Nueva York: Watnick. pp. 405–406. ISBN 9780072943689.
- ^ abc Sweeney, Lauren (1997). Conceptos básicos de embriología: guía de supervivencia para estudiantes (1.ª edición de bolsillo). McGraw-Hill Professional.
- ^ MacIntosh, Brian R. (2006). Músculo esquelético: forma y función (2.ª ed.). Champaign, IL: Human Kinetics. págs. 63-64. ISBN 978-0-7360-4517-9.
- ^ Murach, KA; Fry, CS; Kirby, TJ; Jackson, JR; Lee, JD; White, SH; Dupont-Versteegden, EE; McCarthy, JJ; Peterson, CA (1 de enero de 2018). "¿Papel protagonista o secundario? Células satélite y regulación del tamaño de las fibras musculares esqueléticas". Fisiología . 33 (1): 26–38. doi :10.1152/physiol.00019.2017. PMC 5866409 . PMID 29212890.
- ^ Grube, L; Dellen, R; Kruse, F (2 de febrero de 2018). "Exploración del secretoma de las células musculares C2C12: enfoque experimental dependiente de los datos para analizar la secreción de proteínas mediante cuantificación sin etiquetas y análisis basado en péptidos". Journal of Proteome Research . 17 (2): 879–890. doi :10.1021/acs.jproteome.7b00684. PMID 29322779.
- ^ Pedersen, BK (2013). "El músculo como órgano secretor". Fisiología integral . Vol. 3. págs. 1337–62. doi :10.1002/cphy.c120033. ISBN. 9780470650714. Número de identificación personal 23897689.
- ^ Lee, JH; Jun, HS (2019). "El papel de las mioquinas en la regulación de la masa y la función del músculo esquelético". Frontiers in Physiology . 10 : 42. doi : 10.3389/fphys.2019.00042 . PMC 6363662 . PMID 30761018.
- ^ "Introducción al sistema muscular | Capacitación SEER". training.seer.cancer.gov .
- ^ "1.5 Homeostasis - Anatomía y fisiología | OpenStax". openstax.org . 25 de abril de 2013 . Consultado el 25 de junio de 2021 .
- ^ Costanzo, Linda S. (2002). Fisiología (2ª ed.). Filadelfia: Saunders. pag. 23.ISBN 0-7216-9549-3.
- ^ Calderón, Juan C.; Bolaños, Pura; Caputo, Carlo (24 de enero de 2014). "El mecanismo de acoplamiento excitación-contracción en el músculo esquelético". Biophysical Reviews . 6 (1): 133–160. doi :10.1007/s12551-013-0135-x. ISSN 1867-2450. PMC 5425715 . PMID 28509964.
- ^ Heydemann, A (20 de junio de 2018). "Metabolismo del músculo esquelético en la distrofia muscular de Duchenne y Becker: implicaciones para las terapias". Nutrients . 10 (6): 796. doi : 10.3390/nu10060796 . PMC 6024668 . PMID 29925809.
- ^ Heymsfield, SB; Gallagher, D; Kotler, DP; Wang, Z; Allison, DB; Heshka, S (2002). "La dependencia del tamaño corporal del gasto energético en reposo puede atribuirse a la homogeneidad no energética de la masa libre de grasa". American Journal of Physiology. Endocrinology and Metabolism . 282 (1): E132–E138. doi :10.1152/ajpendo.2002.282.1.e132. PMID 11739093. S2CID 10257328.
- ^ McGinnis, Peter M. (2013). Biomecánica del deporte y el ejercicio (3.ª ed.). Champaign, IL: Human Kinetics. ISBN 978-0-7360-7966-2.
- ^ Citado de National Skeletal Muscle Research Center ; UCSD, Página de inicio de Fisiología muscular – Arquitectura del músculo esquelético Archivado el 18 de julio de 2014 en Wayback Machine , Efecto de la arquitectura muscular en la función muscular
- ^ "9.6 Fuerzas y pares de torsión en músculos y articulaciones - Física universitaria | OpenStax". openstax.org . 21 de junio de 2012 . Consultado el 15 de mayo de 2021 .
- ^ Barry, DT (1992). "Vibraciones y sonidos de espasmos musculares provocados". Electromyogr Clin Neurophysiol . 32 (1–2): 35–40. PMID 1541245.
- ^ [1], Rendimiento máximo: entrenamiento de resistencia: comprender las fibras musculares de contracción lenta mejorará el rendimiento
- ^ Gonyea WJ, Sale DG, Gonyea FB, Mikesky A (1986). "Aumentos inducidos por el ejercicio en el número de fibras musculares". Eur J Appl Physiol Occup Physiol . 55 (2): 137–141. doi :10.1007/BF00714995. PMID 3698999. S2CID 29191826.
- ^ Jansson E, Kaijser L (julio de 1977). "Adaptación muscular al entrenamiento de resistencia extrema en el hombre". Acta Physiol. Scand . 100 (3): 315–24. doi :10.1111/j.1748-1716.1977.tb05956.x. PMID 144412.
- ^ Gollnick PD, Armstrong RB, Saubert CW, Piehl K, Saltin B (septiembre de 1972). "Actividad enzimática y composición de la fibra en el músculo esquelético de hombres entrenados y no entrenados". J Appl Physiol . 33 (3): 312–9. doi :10.1152/jappl.1972.33.3.312. PMID 4403464.
- ^ Schantz P, Henriksson J, Jansson E (abril de 1983). "Adaptación del músculo esquelético humano al entrenamiento de resistencia de larga duración". Fisiología clínica . 3 (2): 141–51. doi :10.1111/j.1475-097x.1983.tb00685.x. PMID 6682735.
- ^ Monster AW, Chan H, O'Connor D (abril de 1978). "Patrones de actividad de los músculos esqueléticos humanos: relación con la composición del tipo de fibra muscular". Science . 200 (4339): 314–7. doi :10.1126/science.635587. PMID 635587.
- ^ Pattengale PK, Holloszy JO (septiembre de 1967). "Aumento de la mioglobina del músculo esquelético mediante un programa de carrera en cinta". Am. J. Physiol . 213 (3): 783–5. doi :10.1152/ajplegacy.1967.213.3.783. PMID 6036801.
- ^ Nielsen, OB; Paoli, F; Overgaard, K (2001). "Efectos protectores del ácido láctico en la producción de fuerza en el músculo esquelético de la rata". Journal of Physiology . 536 (1): 161–166. doi :10.1111/j.1469-7793.2001.t01-1-00161.x. PMC 2278832 . PMID 11579166.
- ^ Robergs, R; Ghiasvand, F; Parker, D (2004). "Bioquímica de la acidosis metabólica inducida por el ejercicio". Am J Physiol Regul Integr Comp Physiol . 287 (3): R502–516. doi :10.1152/ajpregu.00114.2004. PMID 15308499. S2CID 2745168.
- ^ Wang, Y; Jardine, MJ (noviembre de 2011). "Beneficios del entrenamiento físico en pacientes que reciben hemodiálisis: una revisión sistemática y un metanálisis". British Journal of Sports Medicine . 45 (14): 1165–6. doi :10.1136/bjsports-2011-090558. PMID 21989854. S2CID 27583398.
- ^ "Descripción general de los trastornos del movimiento: trastornos del cerebro, la médula espinal y los nervios". Versión para el público general del Manual MSD . Consultado el 24 de junio de 2021 .
- ^ Dumé, Belle (18 de mayo de 2007). «El 'ruido muscular' podría revelar la progresión de las enfermedades». Servicio de noticias NewScientist.com .
- ^ Poole, RM, ed. (1986). La máquina increíble. Washington, DC: National Geographic Society. pp. 307–311. ISBN. 978-0-87044-621-4.
- ^ Cruz-Jentoft, AJ; Sayer, AA (29 de junio de 2019). "Sarcopenia". Lanceta . 393 (10191): 2636–2646. doi :10.1016/S0140-6736(19)31138-9. PMID 31171417. S2CID 208792618.
- ^ Fuster G, Busquets S, Almendro V, López-Soriano FJ, Argilés JM (2007). "Efectos antiproteolíticos del plasma de osos hibernantes: ¿un nuevo enfoque para la terapia del desgaste muscular?". Clin Nutr . 26 (5): 658–661. doi :10.1016/j.clnu.2007.07.003. PMID 17904252.
- ^ Roy RR, Baldwin KM, Edgerton VR (1996). "Respuesta de la unidad neuromuscular al vuelo espacial: lo que se ha aprendido del modelo de rata". Exerc. Sport Sci. Rev. 24 : 399–425. doi : 10.1249/00003677-199600240-00015 . PMID: 8744257. S2CID: 44574997.
- ^ "Sitio web de la NASA sobre investigación de la atrofia muscular (MARES)". Archivado desde el original el 4 de mayo de 2010.
- ^ Lohuis TD, Harlow HJ, Beck TD (2007). "Los osos negros hibernantes ( Ursus americanus ) experimentan un equilibrio de proteínas del músculo esquelético durante la anorexia invernal". Comp. Biochem. Physiol. B . 147 (1): 20–28. doi :10.1016/j.cbpb.2006.12.020. PMID 17307375.
- ^ Ebner N, Springer J, Kalantar-Zadeh K, Lainscak M, Doehner W, Anker SD, von Haehling S (julio de 2013). "Mecanismos y nuevos enfoques terapéuticos para el deterioro cognitivo en enfermedades crónicas". Maturitas . 75 (3): 199–206. doi :10.1016/j.maturitas.2013.03.014. PMID 23664695. S2CID 42148927.[ enlace muerto permanente ]
- ^ Chal J, Oginuma M, Al Tanoury Z, Gobert B, Sumara O, Hick A, Bousson F, Zidouni Y, Mursch C, Moncuquet P, Tassy O, Vincent S, Miyanari A, Bera A, Garnier JM, Guevara G, Hestin M, Kennedy L, Hayashi S, Drayton B, Cherrier T, Gayraud-Morel B, Gussoni E, Relaix F, Tajbakhsh S, Pourquié O (agosto de 2015). "Diferenciación de células madre pluripotentes en fibra muscular para modelar la distrofia muscular de Duchenne". Biotecnología de la Naturaleza . 33 (9): 962–969. doi :10.1038/nbt.3297. PMID 26237517. S2CID 21241434.

- ^ Cè, E; Rampichini, S; Limonta, E; Esposito, F (10 de diciembre de 2013). "Efectos de la fatiga en los componentes de retardo electromecánicos durante la fase de relajación después de la contracción isométrica". Acta Physiologica . 211 (1): 82–96. doi :10.1111/apha.12212. PMID 24319999. S2CID 34744926.
- ^ Xu, Q; Quan, Y; Yang, L; He, J (enero de 2013). "Un algoritmo adaptativo para la determinación del inicio y fin de la contracción muscular mediante el procesamiento de señales EMG". IEEE Transactions on Neural Systems and Rehabilitation Engineering . 21 (1): 65–73. doi :10.1109/TNSRE.2012.2226916. PMID 23193462. S2CID 25169061.
- ^ Milder, DA; Sutherland, EJ; Gandevia, SC; McNulty, PA (2014). "La contracción voluntaria máxima sostenida produce cambios independientes en los axones motores humanos y en el músculo que inervan". PLOS ONE . 9 (3): e91754. Bibcode :2014PLoSO...991754M. doi : 10.1371/journal.pone.0091754 . PMC 3951451 . PMID 24622330.
- ^ abcde Cameron A, Wakelin G, Gaulton N, Young LV, Wotherspoon S, Hodson N, Lees MJ, Moore DR, Johnston AP (diciembre de 2022). "Identificación de poblaciones de células mesenquimales y relacionadas con los vasos sanguíneos poco exploradas en el músculo esquelético humano". Am J Physiol Cell Physiol . 323 (6): C1586–C1600. doi :10.1152/ajpcell.00364.2022. PMID 36342160. S2CID 253383236.
- ^ Rubenstein AB, Smith GR, Raue U, Begue G, Minchev K, Ruf-Zamojski F, Nair VD, Wang X, Zhou L, Zaslavsky E, Trappe TA, Trappe S, Sealfon SC (enero de 2020). "Perfiles transcripcionales unicelulares en músculo esquelético humano". Representante de ciencia . 10 (1): 229. Código bibliográfico : 2020NatSR..10..229R. doi :10.1038/s41598-019-57110-6. PMC 6959232 . PMID 31937892.
- ^ Biferali B, Proietti D, Mozzetta C, Madaro L (2019). "Intercomunicación entre progenitores fibroadipogénicos en el músculo esquelético: la red social". Front Physiol . 10 : 1074. doi : 10.3389/fphys.2019.01074 . PMC 6713247 . PMID 31496956.
- ^ "El proteoma específico del músculo esquelético". Atlas de proteínas humanas .
- ^ abcdefghi Williams K, Carrasquilla GD, Ingerslev LR, Hochreuter MY, Hansson S, Pillon NJ, Donkin I, Versteyhe S, Zierath JR, Kilpeläinen TO, Barrès R (noviembre de 2021). "El recableado epigenético de los potenciadores del músculo esquelético después del entrenamiento físico respalda un papel en la función de todo el cuerpo y la salud humana". Mol Metab . 53 : 101290. doi :10.1016/j.molmet.2021.101290. PMC 8355925 . PMID 34252634.
- ^ abc Tessier AJ, Wing SS, Rahme E, Morais JA, Chevalier S (julio de 2022). "Asociación de la baja masa muscular con la función cognitiva durante un seguimiento de 3 años entre adultos de 65 a 86 años en el estudio longitudinal canadiense sobre el envejecimiento". JAMA Netw Open . 5 (7): e2219926. doi :10.1001/jamanetworkopen.2022.19926. PMC 9250053 . PMID 35796211.
- ^ Paluch AE, Bajpai S, Bassett DR, Carnethon MR, Ekelund U, Evenson KR, Galuska DA, Jefferis BJ, Kraus WE, Lee IM, Matthews CE, Omura JD, Patel AV, Pieper CF, Rees-Punia E, Dallmeier D , Klenk J, Whincup PH, Dooley EE, Pettee Gabriel K, Palta P, Pompeii LA, Chernofsky A, Larson MG, Vasan RS, Spartano N, Ballin M, Nordström P, Nordström A, Anderssen SA, Hansen BH, Cochrane JA, Dwyer T, Wang J, Ferrucci L, Liu F, Schrack J, Urbanek J, Saint-Maurice PF, Yamamoto N, Yoshitake Y, Newton RL Jr, Yang S, Shiroma EJ, Fulton JE, et al. (Steps for Health Collaborative) (marzo de 2022). «Pasos diarios y mortalidad por todas las causas: un metanálisis de 15 cohortes internacionales». Lancet Public Health . 7 (3): e219–e228. doi :10.1016/S2468-2667 (21)00302-9. Número de serie PMC 9289978. Número de serie PMID 35247352.
- ^ Widmann M, Nieß AM, Munz B (abril de 2019). "Ejercicio físico y modificaciones epigenéticas en el músculo esquelético". Sports Med . 49 (4): 509–523. doi :10.1007/s40279-019-01070-4. PMID 30778851. S2CID 73481438.
- ^ Rose NR, Klose RJ (diciembre de 2014). "Entender la relación entre la metilación del ADN y la metilación de la lisina de la histona". Biochimica et Biophysica Acta (BBA) - Mecanismos reguladores de los genes . 1839 (12): 1362–1372. doi :10.1016/j.bbagrm.2014.02.007. PMC 4316174. PMID 24560929 .
- ^ Panigrahi A, O'Malley BW (abril de 2021). "Mecanismos de acción potenciadora: lo conocido y lo desconocido". Genome Biol . 22 (1): 108. doi : 10.1186 /s13059-021-02322-1 . PMC 8051032. PMID 33858480.
- ^ Marsman J, Horsfield JA (2012). "Relaciones a larga distancia: comunicación potenciador-promotor y transcripción génica dinámica". Biochim Biophys Acta . 1819 (11–12): 1217–27. doi :10.1016/j.bbagrm.2012.10.008. PMID 23124110.
- ^ ab Lindholm ME, Marabita F, Gomez-Cabrero D, Rundqvist H, Ekström TJ, Tegnér J, Sundberg CJ (diciembre de 2014). "Un análisis integrador revela una reprogramación coordinada del epigenoma y el transcriptoma en el músculo esquelético humano después del entrenamiento". Epigenética . 9 (12): 1557–69. doi :10.4161/15592294.2014.982445. PMC 4622000 . PMID 25484259.


