Uranio
El uranio es un elemento químico de símbolo U y número atómico 92. Es un metal de color gris plateado de la serie de los actínidos de la tabla periódica . Un átomo de uranio tiene 92 protones y 92 electrones , de los cuales 6 son electrones de valencia . El uranio se desintegra radiactivamente , generalmente emitiendo una partícula alfa . La vida media de esta desintegración varía entre 159.200 y 4.500 millones de años para los diferentes isótopos , lo que los hace útiles para datar la edad de la Tierra . Los isótopos más comunes en el uranio natural son el uranio-238 (que tiene 146 neutrones y representa más del 99% del uranio en la Tierra) y el uranio-235 (que tiene 143 neutrones). El uranio tiene el mayor peso atómico de los elementos primordiales . Su densidad es aproximadamente un 70% mayor que la del plomo y ligeramente menor que la del oro o el tungsteno . Se encuentra de forma natural en bajas concentraciones de unas pocas partes por millón en el suelo, las rocas y el agua, y se extrae comercialmente de minerales que contienen uranio, como la uraninita . [9]
Muchos usos contemporáneos del uranio explotan sus propiedades nucleares únicas. El uranio-235 es el único isótopo fisible natural , lo que hace que se use ampliamente en plantas de energía nuclear y armas nucleares . Sin embargo, debido a la baja abundancia de uranio-235 en el uranio natural (que es, abrumadoramente, principalmente uranio-238), el uranio necesita sufrir enriquecimiento para que esté presente suficiente uranio-235. El uranio-238 es fisionable por neutrones rápidos y es fértil , lo que significa que puede transmutarse en plutonio-239 fisible en un reactor nuclear . Otro isótopo fisible, el uranio-233 , puede producirse a partir del torio natural y se estudia para su uso industrial futuro en tecnología nuclear. El uranio-238 tiene una pequeña probabilidad de fisión espontánea o incluso de fisión inducida con neutrones rápidos; El uranio-235 y, en menor medida, el uranio-233 tienen una sección transversal de fisión mucho mayor para los neutrones lentos. En una concentración suficiente, estos isótopos mantienen una reacción nuclear en cadena sostenida . Esto genera el calor en los reactores nucleares y produce el material fisible para las armas nucleares. El principal uso civil del uranio aprovecha la energía térmica para producir electricidad. El uranio empobrecido ( 238 U) se utiliza en penetradores de energía cinética y en blindajes . [10]
El descubrimiento de uranio en el mineral pechblenda en 1789 se atribuye a Martin Heinrich Klaproth , quien nombró al nuevo elemento en honor al planeta Urano , recientemente descubierto . Eugène-Melchior Péligot fue la primera persona en aislar el metal, y sus propiedades radiactivas fueron descubiertas en 1896 por Henri Becquerel . Las investigaciones de Otto Hahn , Lise Meitner , Enrico Fermi y otros, como J. Robert Oppenheimer, a partir de 1934 condujeron a su uso como combustible en la industria de la energía nuclear y en Little Boy , la primera arma nuclear utilizada en la guerra . Una carrera armamentista subsiguiente durante la Guerra Fría entre Estados Unidos y la Unión Soviética produjo decenas de miles de armas nucleares que usaban uranio metálico y plutonio-239 derivado del uranio . El desmantelamiento de estas armas y las instalaciones nucleares relacionadas se lleva a cabo dentro de varios programas de desarme nuclear y cuesta miles de millones de dólares. El uranio apto para armas obtenido a partir de armas nucleares se diluye con uranio-238 y se reutiliza como combustible para reactores nucleares. El combustible nuclear gastado forma residuos radiactivos , que en su mayoría consisten en uranio-238 y plantean una amenaza significativa para la salud y el medio ambiente .
Características

El uranio es un metal blanco plateado, débilmente radiactivo . Tiene una dureza de Mohs de 6, suficiente para rayar el vidrio y aproximadamente igual a la del titanio , rodio , manganeso y niobio . Es maleable , dúctil , ligeramente paramagnético , fuertemente electropositivo y un mal conductor eléctrico . [11] [12] El uranio metálico tiene una densidad muy alta de 19,1 g/cm 3 , [13] más denso que el plomo (11,3 g/cm 3 ), [14] pero ligeramente menos denso que el tungsteno y el oro (19,3 g/cm 3 ). [15] [16]
El uranio metálico reacciona con casi todos los elementos no metálicos (excepto los gases nobles ) y sus compuestos , y su reactividad aumenta con la temperatura. [17] Los ácidos clorhídrico y nítrico disuelven el uranio, pero los ácidos no oxidantes distintos del ácido clorhídrico atacan al elemento muy lentamente. [11] Cuando está finamente dividido, puede reaccionar con agua fría; en el aire, el uranio metálico se recubre con una capa oscura de óxido de uranio . [12] El uranio de los minerales se extrae químicamente y se convierte en dióxido de uranio u otras formas químicas utilizables en la industria.
El uranio-235 fue el primer isótopo que se descubrió que era fisible . Otros isótopos naturales son fisionables, pero no fisibles. Al ser bombardeado con neutrones lentos, el uranio-235 la mayoría de las veces se divide en dos núcleos más pequeños , liberando energía de enlace nuclear y más neutrones. Si otros núcleos de uranio-235 absorben demasiados de estos neutrones, se produce una reacción nuclear en cadena que da como resultado una explosión de calor o (en algunas circunstancias) una explosión. En un reactor nuclear, dicha reacción en cadena se ralentiza y se controla mediante un veneno de neutrones , que absorbe algunos de los neutrones libres. Dichos materiales absorbentes de neutrones suelen formar parte de las barras de control del reactor (consulte la física del reactor nuclear para obtener una descripción de este proceso de control del reactor).
Se pueden utilizar tan sólo 6,8 kg (15 lb) de uranio-235 para fabricar una bomba atómica. [18] El arma nuclear detonada sobre Hiroshima , llamada Little Boy , dependía de la fisión del uranio. Sin embargo, la primera bomba nuclear (la Gadget utilizada en Trinity ) y la bomba que se detonó sobre Nagasaki ( Fat Man ) eran ambas bombas de plutonio.
El uranio metálico tiene tres formas alotrópicas : [19]
- α ( ortorrómbico ) estable hasta 668 °C (1234 °F). Ortorrómbico, grupo espacial n.° 63, Cmcm , parámetros reticulares a = 285,4 pm, b = 587 pm, c = 495,5 pm. [20]
- β ( tetragonal ) estable de 668 a 775 °C (1234 a 1427 °F). Tetragonal, grupo espacial P 4 2 / mnm , P 4 2 nm o P 4 n 2, parámetros reticulares a = 565,6 pm, b = c = 1075,9 pm. [20]
- γ ( cúbica centrada en el cuerpo ) desde 775 °C (1427 °F) hasta el punto de fusión: este es el estado más maleable y dúctil. Cúbica centrada en el cuerpo, parámetro reticular a = 352,4 pm. [20]
Aplicaciones
Militar

La principal aplicación del uranio en el sector militar es en los penetradores de alta densidad. Esta munición consiste en uranio empobrecido (DU) aleado con un 1-2% de otros elementos, como titanio o molibdeno . [21] A alta velocidad de impacto, la densidad, dureza y piroforicidad del proyectil permiten la destrucción de objetivos fuertemente blindados. El blindaje de tanques y otros vehículos removibles también se puede endurecer con placas de uranio empobrecido. El uso de uranio empobrecido se volvió política y ambientalmente polémico después de que el uso de tales municiones por parte de los EE. UU., el Reino Unido y otros países durante las guerras en el Golfo Pérsico y los Balcanes planteara preguntas sobre los compuestos de uranio que quedan en el suelo (véase el síndrome de la Guerra del Golfo ). [18]
El uranio empobrecido también se utiliza como material de protección en algunos contenedores utilizados para almacenar y transportar materiales radiactivos. Aunque el metal en sí es radiactivo, su alta densidad lo hace más eficaz que el plomo a la hora de detener la radiación de fuentes potentes como el radio . [11] Otros usos del uranio empobrecido incluyen contrapesos para superficies de control de aeronaves, como lastre para vehículos de reentrada de misiles y como material de protección. [12] Debido a su alta densidad, este material se encuentra en sistemas de guía inercial y en brújulas giroscópicas . [12] El uranio empobrecido se prefiere a otros metales de densidad similar debido a su capacidad de mecanizarse y fundirse fácilmente, así como a su coste relativamente bajo. [22] El principal riesgo de exposición al uranio empobrecido es el envenenamiento químico por óxido de uranio en lugar de la radiactividad (el uranio es sólo un emisor alfa débil ).
Durante las últimas etapas de la Segunda Guerra Mundial , toda la Guerra Fría y, en menor medida, después, el uranio-235 se ha utilizado como material explosivo fisible para producir armas nucleares. Inicialmente, se construyeron dos tipos principales de bombas de fisión: un dispositivo relativamente simple que utiliza uranio-235 y un mecanismo más complicado que utiliza plutonio-239 derivado del uranio-238. Más tarde, se construyó un tipo de bomba de fisión/fusión ( arma termonuclear ) mucho más complicada y mucho más potente, que utiliza un dispositivo basado en plutonio para hacer que una mezcla de tritio y deuterio experimente una fusión nuclear . Estas bombas están revestidas de una carcasa de uranio no fisible (no enriquecido) y derivan más de la mitad de su potencia de la fisión de este material por neutrones rápidos del proceso de fusión nuclear. [23]
Civil
El principal uso del uranio en el sector civil es el de alimentar centrales nucleares . Un kilogramo de uranio-235 puede producir teóricamente unos 20 terajulios de energía (2 × 1013 julios ), suponiendo una fisión completa; tanta energía como 1,5 millones de kilogramos (1.500 toneladas ) de carbón . [10]
Las centrales nucleares comerciales utilizan combustible que normalmente está enriquecido hasta aproximadamente un 3% de uranio-235. [10] Los diseños CANDU y Magnox son los únicos reactores comerciales capaces de utilizar combustible de uranio no enriquecido. El combustible utilizado para los reactores de la Armada de los Estados Unidos suele estar altamente enriquecido en uranio-235 (los valores exactos están clasificados ). En un reactor reproductor , el uranio-238 también se puede convertir en plutonio-239 a través de la siguiente reacción: [12]
- 238
92tú
+ n → 239
92tú
+ γβ −→ 239
93Notario público
β −→ 239
94Pu

Antes (y, ocasionalmente, después) del descubrimiento de la radiactividad, el uranio se utilizaba principalmente en pequeñas cantidades para vidrio amarillo y esmaltes de cerámica, como el vidrio de uranio y en Fiestaware . [24]
El descubrimiento y aislamiento del radio en el mineral de uranio (pechblenda) por Marie Curie desencadenó el desarrollo de la minería de uranio para extraer el radio, que se utilizó para hacer pinturas que brillan en la oscuridad para las esferas de los relojes y los aviones. [25] [26] Esto dejó una cantidad prodigiosa de uranio como producto de desecho, ya que se necesitan tres toneladas de uranio para extraer un gramo de radio. Este producto de desecho se desvió a la industria del esmaltado, lo que hizo que los esmaltes de uranio fueran muy baratos y abundantes. Además de los esmaltes de cerámica, los esmaltes de uranio para baldosas representaron la mayor parte del uso, incluidas las baldosas comunes de baño y cocina que pueden producirse en verde, amarillo, malva , negro, azul, rojo y otros colores.


El uranio también se utilizó en productos químicos fotográficos (especialmente nitrato de uranio como tóner ), [12] en filamentos de lámparas para bombillas de iluminación de escenarios , [27] para mejorar la apariencia de las dentaduras postizas , [28] y en las industrias del cuero y la madera para tintes y colorantes. Las sales de uranio son mordientes de seda o lana. El acetato de uranilo y el formato de uranilo se utilizan como "tinciones" densos en electrones en microscopía electrónica de transmisión , para aumentar el contraste de muestras biológicas en secciones ultrafinas y en tinción negativa de virus , orgánulos celulares aislados y macromoléculas .
El descubrimiento de la radiactividad del uranio dio lugar a nuevos usos científicos y prácticos del elemento. La larga vida media del uranio-238 (4,47 × 109 años) lo hace muy adecuado para su uso en la estimación de la edad de las rocas ígneas más antiguas y para otros tipos de datación radiométrica , incluida la datación uranio-torio , la datación uranio-plomo y la datación uranio-uranio . El uranio metálico se utiliza para objetivos de rayos X en la fabricación de rayos X de alta energía. [12]
Historia
Uso previo al descubrimiento
El uso de la pechblenda , uranio en su forma de óxido natural , se remonta al menos al año 79 d. C., cuando se utilizaba en el Imperio romano para añadir un color amarillo a los esmaltes cerámicos . [12] RT Gunther, de la Universidad de Oxford, encontró vidrio amarillo con un 1% de óxido de uranio en una villa romana en el cabo Posillipo , en la bahía de Nápoles , Italia, en 1912. [29] A partir de finales de la Edad Media , la pechblenda se extraía de las minas de plata de los Habsburgo en Joachimsthal , Bohemia (ahora Jáchymov en la República Checa) en los Montes Metálicos , y se utilizaba como colorante en la industria local de fabricación de vidrio . [30] A principios del siglo XIX, las únicas fuentes conocidas de mineral de uranio del mundo eran estas minas.
Descubrimiento

El descubrimiento del elemento se atribuye al químico alemán Martin Heinrich Klaproth . Mientras trabajaba en su laboratorio experimental en Berlín en 1789, Klaproth fue capaz de precipitar un compuesto amarillo (probablemente diuranato de sodio ) disolviendo pechblenda en ácido nítrico y neutralizando la solución con hidróxido de sodio . [30] Klaproth asumió que la sustancia amarilla era el óxido de un elemento aún no descubierto y lo calentó con carbón para obtener un polvo negro, que pensó que era el metal recién descubierto en sí (de hecho, ese polvo era un óxido de uranio ). [30] [31] Nombró al elemento recién descubierto en honor al planeta Urano (nombrado en honor al dios griego primordial del cielo ), que había sido descubierto ocho años antes por William Herschel . [32]
En 1841, Eugène-Melchior Péligot , profesor de química analítica en el Conservatorio Nacional de Artes y Oficios de París , aisló la primera muestra de uranio metálico calentando tetracloruro de uranio con potasio . [30] [33]

Henri Becquerel descubrió la radiactividad utilizando uranio en 1896. [17] Becquerel hizo el descubrimiento en París al dejar una muestra de una sal de uranio, K 2 UO 2 (SO 4 ) 2 (sulfato de uranilo y potasio), sobre una placa fotográfica sin exponer en un cajón y notando que la placa se había "empañado". [34] Determinó que una forma de luz invisible o rayos emitidos por el uranio habían expuesto la placa.
Durante la Primera Guerra Mundial, cuando las Potencias Centrales sufrieron una escasez de molibdeno para fabricar cañones de artillería y aceros para herramientas de alta velocidad, utilizaron rutinariamente una aleación de ferrouranio como sustituto, ya que presenta muchas de las mismas características físicas que el molibdeno. Cuando esta práctica se hizo conocida en 1916, el gobierno de los EE. UU. solicitó a varias universidades importantes que investigaran el uso del uranio en la fabricación y la metalistería. Las herramientas fabricadas con estas fórmulas se siguieron utilizando durante varias décadas, [35] [36] hasta que el Proyecto Manhattan y la Guerra Fría generaron una gran demanda de uranio para la investigación de la fisión y el desarrollo de armas.
Investigación sobre la fisión

Un equipo dirigido por Enrico Fermi en 1934 descubrió que bombardear uranio con neutrones produce rayos beta ( electrones o positrones de los elementos producidos; ver partícula beta ). [37] Los productos de fisión fueron confundidos al principio con nuevos elementos con números atómicos 93 y 94, que el decano de la Universidad La Sapienza de Roma , Orso Mario Corbino , llamó ausenio y hesperio , respectivamente. [38] [39] [40] [41] Los experimentos que llevaron al descubrimiento de la capacidad del uranio para fisionarse (descomponerse) en elementos más ligeros y liberar energía de enlace fueron realizados por Otto Hahn y Fritz Strassmann [37] en el laboratorio de Hahn en Berlín. Lise Meitner y su sobrino, el físico Otto Robert Frisch , publicaron la explicación física en febrero de 1939 y llamaron al proceso " fisión nuclear ". [42] Poco después, Fermi planteó la hipótesis de que la fisión del uranio podría liberar suficientes neutrones para sostener una reacción de fisión. La confirmación de esta hipótesis llegó en 1939, y trabajos posteriores descubrieron que, en promedio, se liberan alrededor de 2,5 neutrones por cada fisión de uranio-235. [37] Fermi instó a Alfred OC Nier a separar los isótopos de uranio para la determinación del componente fisible, y el 29 de febrero de 1940, Nier utilizó un instrumento que construyó en la Universidad de Minnesota para separar la primera muestra de uranio-235 del mundo en el Laboratorio Tate. Utilizando el ciclotrón de la Universidad de Columbia , John Dunning confirmó que la muestra era el material fisible aislado el 1 de marzo. [43] Trabajos posteriores descubrieron que el isótopo uranio-238, mucho más común, puede transmutarse en plutonio, que, como el uranio-235, también es fisible por neutrones térmicos. Estos descubrimientos llevaron a numerosos países a comenzar a trabajar en el desarrollo de armas nucleares y energía nuclear . A pesar de que la fisión se había descubierto en Alemania, el proyecto de la Uranverein ("club del uranio") de Alemania para investigar la energía nuclear y/o las armas se vio obstaculizado por recursos limitados, luchas internas, el exilio o la no participación de varios científicos destacados en el campo y varios errores cruciales, como no tener en cuenta las impurezas en las muestras de grafito disponibles, lo que lo hacía parecer menos adecuado como moderador de neutrones.de lo que es en realidad. Los intentos de Alemania de construir un reactor de uranio natural / agua pesada no habían llegado ni cerca de alcanzar la criticidad cuando los estadounidenses llegaron a Haigerloch , el sitio del último experimento alemán con un reactor en tiempos de guerra. [44]
El 2 de diciembre de 1942, como parte del Proyecto Manhattan , otro equipo dirigido por Enrico Fermi fue capaz de iniciar la primera reacción nuclear en cadena autosostenida artificial , Chicago Pile-1 . Un plan inicial que utilizaba uranio-235 enriquecido fue abandonado porque aún no estaba disponible en cantidades suficientes. [45] Trabajando en un laboratorio debajo de las gradas del Stagg Field en la Universidad de Chicago , el equipo creó las condiciones necesarias para tal reacción apilando 360 toneladas de grafito , 53 toneladas de óxido de uranio y 5,5 toneladas de uranio metálico, la mayoría de los cuales fueron suministrados por Westinghouse Lamp Plant en un proceso de producción improvisado. [37] [46]
Armamento nuclear

Dos tipos de bomba atómica fueron desarrollados por los Estados Unidos durante la Segunda Guerra Mundial : un dispositivo basado en uranio (nombre en código " Little Boy ") cuyo material fisible era uranio altamente enriquecido , y un dispositivo basado en plutonio (ver prueba Trinity y " Fat Man ") cuyo plutonio se derivaba del uranio-238. Little Boy se convirtió en la primera arma nuclear utilizada en la guerra cuando fue detonada sobre Hiroshima , Japón , el 6 de agosto de 1945. Explotando con un rendimiento equivalente a 12.500 toneladas de TNT , la explosión y la onda térmica de la bomba destruyeron casi 50.000 edificios y mataron a unas 75.000 personas (ver Bombardeos atómicos de Hiroshima y Nagasaki ). [34] Inicialmente se creyó que el uranio era relativamente raro, y que la proliferación nuclear podría evitarse simplemente comprando todas las reservas conocidas de uranio, pero en una década se descubrieron grandes depósitos de este metal en muchos lugares alrededor del mundo. [47]
Reactores

El reactor de grafito X-10 del Laboratorio Nacional de Oak Ridge (ORNL) en Oak Ridge, Tennessee, anteriormente conocido como Clinton Pile y X-10 Pile, fue el segundo reactor nuclear artificial del mundo (después de la pila de Chicago de Enrico Fermi) y fue el primer reactor diseñado y construido para operación continua. El reactor reproductor experimental I del Laboratorio Nacional Argonne , ubicado en la Estación Nacional de Pruebas de Reactores de la Comisión de Energía Atómica cerca de Arco, Idaho , se convirtió en el primer reactor nuclear en crear electricidad el 20 de diciembre de 1951. [48] Inicialmente, el reactor encendía cuatro bombillas de 150 vatios, pero las mejoras finalmente le permitieron alimentar toda la instalación (más tarde, la ciudad de Arco se convirtió en la primera en el mundo en tener toda su electricidad proveniente de energía nuclear generada por BORAX-III , otro reactor diseñado y operado por el Laboratorio Nacional Argonne ). [49] [50] La primera central nuclear a escala comercial del mundo, Obninsk en la Unión Soviética , comenzó la generación con su reactor AM-1 el 27 de junio de 1954. Otras plantas de energía nuclear tempranas fueron Calder Hall en Inglaterra, que comenzó la generación el 17 de octubre de 1956, [51] y la Central Atómica de Shippingport en Pensilvania , que comenzó el 26 de mayo de 1958. La energía nuclear se utilizó por primera vez para la propulsión de un submarino , el USS Nautilus , en 1954. [37] [52]
Fisión natural prehistórica
En 1972, el físico francés Francis Perrin descubrió quince reactores nucleares de fisión naturales antiguos y ya no activos en tres depósitos de mineral separados en la mina Oklo en Gabón , África, conocidos colectivamente como los Reactores Fósiles de Oklo . El depósito de mineral tiene 1.700 millones de años; entonces, el uranio-235 constituía aproximadamente el 3% del uranio en la Tierra. [53] Esta es una cantidad lo suficientemente alta como para permitir una reacción en cadena sostenida, si existen otras condiciones de apoyo. La capacidad del sedimento circundante para contener los productos de desechos nucleares amenazantes para la salud ha sido citada por el gobierno federal de los EE. UU. como evidencia de la viabilidad de almacenar combustible nuclear gastado en el depósito de desechos nucleares de Yucca Mountain . [53]
La contaminación y el legado de la Guerra Fría
Las pruebas nucleares sobre la superficie realizadas por la Unión Soviética y los Estados Unidos en los años 1950 y principios de los 1960, y por Francia en los años 1970 y 1980 [22] esparcieron una cantidad significativa de isótopos hijos del uranio por todo el mundo. [54] Se produjeron más radiaciones y contaminación a raíz de varios accidentes nucleares . [55]
Los mineros de uranio tienen una mayor incidencia de cáncer . Por ejemplo, se ha documentado un riesgo excesivo de cáncer de pulmón entre los mineros de uranio navajos y se ha vinculado a su ocupación. [56] La Ley de Compensación por Exposición a la Radiación , una ley de 1990 en los EE. UU., exigía 100.000 dólares en "pagos de compasión" a los mineros de uranio a los que se les diagnosticara cáncer u otras enfermedades respiratorias. [57]
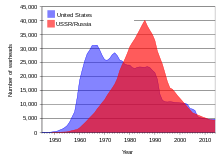
Durante la Guerra Fría entre la Unión Soviética y los Estados Unidos, se acumularon enormes reservas de uranio y se crearon decenas de miles de armas nucleares utilizando uranio enriquecido y plutonio elaborado a partir de uranio. Después de la desintegración de la Unión Soviética en 1991, se estima que unas 600 toneladas cortas (540 toneladas métricas) de uranio altamente enriquecido apto para armas (suficiente para fabricar 40.000 ojivas nucleares) habían estado almacenadas en instalaciones a menudo inadecuadamente vigiladas en la Federación Rusa y varios otros ex estados soviéticos. [18] La policía en Asia , Europa y Sudamérica en al menos 16 ocasiones entre 1993 y 2005 ha interceptado envíos de uranio o plutonio apto para bombas de contrabando, la mayoría de los cuales provenían de fuentes ex soviéticas. [18] Entre 1993 y 2005, el Programa de Protección, Control y Contabilidad de Materiales , administrado por el gobierno federal de los Estados Unidos , gastó alrededor de 550 millones de dólares para ayudar a salvaguardar las reservas de uranio y plutonio en Rusia. Este dinero se utilizó para mejoras y mejoras de seguridad en las instalaciones de investigación y almacenamiento. [18]
La seguridad de las instalaciones nucleares en Rusia ha mejorado significativamente desde la estabilización de la agitación política y económica de principios de los años 1990. Por ejemplo, en 1993 hubo 29 incidentes clasificados por encima del nivel 1 en la Escala Internacional de Eventos Nucleares , y este número cayó por debajo de cuatro por año en 1995-2003. El número de empleados que reciben dosis de radiación anuales superiores a 20 mSv , lo que equivale a una sola tomografía computarizada de cuerpo completo , [58] experimentó un fuerte descenso alrededor del año 2000. En noviembre de 2015, el gobierno ruso aprobó un programa federal para la seguridad nuclear y radiológica para 2016 a 2030 con un presupuesto de 562 mil millones de rublos (aproximadamente 8 mil millones de dólares ). Su cuestión clave son "los pasivos diferidos acumulados durante los 70 años de la industria nuclear, particularmente durante la época de la Unión Soviética". Alrededor del 73% del presupuesto se destinará al desmantelamiento de reactores nucleares e instalaciones nucleares antiguos y obsoletos, especialmente los relacionados con programas de defensa estatales; el 20% se destinará al procesamiento y eliminación de combustible nuclear y desechos radiactivos, y el 5% al monitoreo y garantía de la seguridad nuclear y radiológica. [59]
Aparición
El uranio es un elemento natural que se encuentra en niveles bajos en todas las rocas, el suelo y el agua. Es el elemento de mayor número que se encuentra de forma natural en cantidades significativas en la Tierra y casi siempre se encuentra combinado con otros elementos. [12] El uranio es el 48.º elemento más abundante en la corteza terrestre. [60] Se cree que la desintegración del uranio, el torio y el potasio-40 en el manto terrestre es la principal fuente de calor [61] [62] que mantiene el núcleo externo de la Tierra en estado líquido e impulsa la convección del manto , que a su vez impulsa la tectónica de placas .
La concentración de uranio en la corteza terrestre es (dependiendo de la referencia) de 2 a 4 partes por millón, [11] [22] o aproximadamente 40 veces más abundante que la plata . [17] Se calcula que la corteza terrestre desde la superficie hasta 25 km (15 mi) hacia abajo contiene 10 17 kg (2 × 1017 lb) de uranio, mientras que los océanos pueden contener 10 13 kg (2 × 1013 lb). [11] La concentración de uranio en el suelo varía de 0,7 a 11 partes por millón (hasta 15 partes por millón en suelos agrícolas debido al uso de fertilizantes fosfatados ), [63] y su concentración en el agua de mar es de 3 partes por mil millones. [22]
El uranio es más abundante que el antimonio , el estaño , el cadmio , el mercurio o la plata, y es casi tan abundante como el arsénico o el molibdeno . [12] [22] El uranio se encuentra en cientos de minerales, incluyendo la uraninita (el mineral de uranio más común ), la carnotita , la autunita , la uranofanía , la torbernita y la coffinita . [12] Se producen concentraciones significativas de uranio en algunas sustancias como los depósitos de roca fosfórica y minerales como el lignito y las arenas de monacita en minerales ricos en uranio [12] (se recupera comercialmente de fuentes con tan solo un 0,1% de uranio [17] ).
Origen
Como todos los elementos con pesos atómicos superiores al del hierro , el uranio solo se forma de forma natural mediante el proceso r (captura rápida de neutrones) en supernovas y fusiones de estrellas de neutrones . [64] El torio y el uranio primordiales solo se producen en el proceso r, porque el proceso s (captura lenta de neutrones) es demasiado lento y no puede pasar la brecha de inestabilidad después del bismuto. [65] [66] Además de los dos isótopos de uranio primordiales existentes, 235 U y 238 U, el proceso r también produjo cantidades significativas de 236 U , que tiene una vida media más corta y, por lo tanto, es un radionúclido extinto , que se ha desintegrado por completo hace mucho tiempo a 232 Th. Además, el uranio-236 se produjo por la desintegración de 244 Pu , lo que explica la abundancia observada de torio mayor a la esperada y la abundancia de uranio menor a la esperada. [67] Si bien la abundancia natural de uranio se ha complementado con la desintegración de los extintos 242 Pu (vida media de 375.000 años) y 247 Cm (vida media de 16 millones de años), produciendo 238 U y 235 U respectivamente, esto ocurrió en una medida casi insignificante debido a las vidas medias más cortas de estos progenitores y su menor producción que 236 U y 244 Pu, los progenitores del torio: la relación 247 Cm/ 235 U en la formación del Sistema Solar era(7,0 ± 1,6) × 10 −5 . [68]
Biótico y abiótico


Algunas bacterias, como Shewanella putrefaciens , Geobacter metallireducens y algunas cepas de Burkholderia fungorum , utilizan uranio para su crecimiento y convierten U(VI) en U(IV). [69] [70] Investigaciones recientes sugieren que esta vía incluye la reducción del U(VI) soluble a través de un estado pentavalente intermedio U(V). [71] [72] Otros organismos, como el liquen Trapelia involuta o microorganismos como la bacteria Citrobacter , pueden absorber concentraciones de uranio que son hasta 300 veces el nivel de su entorno. [73] Las especies de Citrobacter absorben iones de uranilo cuando se les administra fosfato de glicerol (u otros fosfatos orgánicos similares). Después de un día, un gramo de bacteria puede incrustarse con nueve gramos de cristales de fosfato de uranilo; esto crea la posibilidad de que estos organismos puedan usarse en biorremediación para descontaminar agua contaminada con uranio. [30] [74] También se ha demostrado que la proteobacteria Geobacter biorremedia el uranio en las aguas subterráneas. [75] El hongo micorrízico Glomus intraradices aumenta el contenido de uranio en las raíces de su planta simbiótica. [76]
En la naturaleza, el uranio (VI) forma complejos de carbonato altamente solubles a pH alcalino. Esto conduce a un aumento en la movilidad y disponibilidad de uranio para las aguas subterráneas y el suelo a partir de desechos nucleares, lo que genera riesgos para la salud. Sin embargo, es difícil precipitar uranio como fosfato en presencia de exceso de carbonato a pH alcalino. Se ha descubierto que una cepa BSAR-1 de Sphingomonas sp. expresa una fosfatasa alcalina (PhoK) de alta actividad que se ha aplicado para la bioprecipitación de uranio como especie de fosfato de uranilo a partir de soluciones alcalinas. La capacidad de precipitación se mejoró al sobreexpresar la proteína PhoK en E. coli . [77]
Las plantas absorben parte del uranio del suelo. Las concentraciones de uranio en peso seco en las plantas varían de 5 a 60 partes por mil millones, y la ceniza de la madera quemada puede tener concentraciones de hasta 4 partes por millón. [30] Las concentraciones de uranio en peso seco en las plantas alimenticias son típicamente más bajas, de uno a dos microgramos por día ingeridos a través de los alimentos que comemos las personas. [30]
Producción y minería
La producción mundial de uranio en 2021 fue de 48.332 toneladas , de las cuales 21.819 t (45%) se extrajeron en Kazajstán . Otros países importantes en la extracción de uranio son Namibia (5.753 t), Canadá (4.693 t), Australia (4.192 t), Uzbekistán (3.500 t) y Rusia (2.635 t). [78]
El mineral de uranio se extrae de varias maneras: a cielo abierto , bajo tierra , lixiviación in situ y minería de pozos . [10] El mineral de uranio de baja calidad extraído normalmente contiene entre un 0,01 y un 0,25 % de óxidos de uranio. Se deben emplear medidas extensivas para extraer el metal de su mineral. [79] Los minerales de alta calidad que se encuentran en los depósitos de la cuenca de Athabasca en Saskatchewan , Canadá, pueden contener hasta un 23 % de óxidos de uranio en promedio. [80] El mineral de uranio se tritura y se convierte en un polvo fino y luego se lixivia con un ácido o un álcali . El lixiviado se somete a una de varias secuencias de precipitación, extracción con disolventes e intercambio iónico. La mezcla resultante, llamada torta amarilla , contiene al menos un 75 % de óxidos de uranio U 3 O 8 . Luego, la torta amarilla se calcina para eliminar las impurezas del proceso de molienda antes de la refinación y la conversión. [81]
El uranio de calidad comercial se puede producir mediante la reducción de haluros de uranio con metales alcalinos o alcalinotérreos . [12] El uranio metálico también se puede preparar mediante electrólisis de KUF.
5o UF
4, disuelto en cloruro de calcio fundido ( CaCl
2) y solución de cloruro de sodio ( NaCl ). [12] El uranio muy puro se produce a través de la descomposición térmica de haluros de uranio en un filamento caliente. [12]
- Producción (minas) y demanda mundial de uranio [78]
- La torta amarilla es una mezcla concentrada de óxidos de uranio que se refina aún más para extraer uranio puro.
- Producción de uranio en 2015, en toneladas [82]
Recursos y reservas

Se estima que existen 6,1 millones de toneladas de uranio en minerales que son económicamente viables a 130 dólares por kg de uranio, [83] mientras que 35 millones de toneladas se clasifican como recursos minerales (perspectivas razonables para una eventual extracción económica). [84]
Australia posee el 28% de las reservas conocidas de mineral de uranio del mundo [83] y el depósito de uranio más grande del mundo se encuentra en la mina Olympic Dam en el sur de Australia . [85] Hay una reserva significativa de uranio en Bakouma , una subprefectura en la prefectura de Mbomou en la República Centroafricana . [86]
Parte del uranio también procede de armas nucleares desmanteladas. [87] Por ejemplo, entre 1993 y 2013 Rusia suministró a los Estados Unidos 15.000 toneladas de uranio poco enriquecido en el marco del Programa de Megatones a Megavatios . [88]
Se estima que hay disueltas en el agua de mar otras 4.600 millones de toneladas de uranio ( científicos japoneses demostraron en la década de 1980 que la extracción de uranio del agua de mar mediante intercambiadores de iones era técnicamente factible). [89] [90] Se han realizado experimentos para extraer uranio del agua de mar, [91] pero el rendimiento ha sido bajo debido al carbonato presente en el agua. En 2012, los investigadores del ORNL anunciaron el desarrollo exitoso de un nuevo material absorbente denominado HiCap que realiza la retención superficial de moléculas sólidas o gaseosas, átomos o iones y también elimina eficazmente los metales tóxicos del agua, según los resultados verificados por investigadores del Laboratorio Nacional del Pacífico Noroeste . [92] [93]
Suministros

En 2005, diez países representaban la mayoría de los óxidos de uranio concentrados del mundo: Canadá (27,9%), Australia (22,8%), Kazajstán (10,5%), Rusia (8,0%), Namibia (7,5%), Níger (7,4%), Uzbekistán (5,5%), Estados Unidos (2,5%), Argentina (2,1%) y Ucrania (1,9%). [95] En 2008, se pronosticó que Kazajstán aumentaría la producción y se convertiría en el mayor proveedor mundial de uranio en 2009; [96] [97] Kazajstán ha dominado el mercado mundial de uranio desde 2010. En 2021, su participación fue del 45,1%, seguido de Namibia (11,9%), Canadá (9,7%), Australia (8,7%), Uzbekistán (7,2%), Níger (4,7%), Rusia (5,5%), China (3,9%), India (1,3%), Ucrania (0,9%) y Sudáfrica (0,8%), con una producción total mundial de 48.332 toneladas. [78] La mayor parte del uranio no se produjo mediante la minería subterránea convencional de minerales (29% de la producción), sino mediante lixiviación in situ (66%). [78] [98]
A finales de los años 1960, los geólogos de las Naciones Unidas descubrieron importantes depósitos de uranio y otras reservas minerales raras en Somalia . El hallazgo fue el más grande de su tipo y los expertos del sector estimaron que los depósitos representaban más del 25% de las reservas de uranio conocidas en el mundo en ese momento, de 800.000 toneladas. [99]
Se cree que el suministro final disponible es suficiente al menos para los próximos 85 años, [84] aunque algunos estudios indican que la falta de inversión a fines del siglo XX puede producir problemas de suministro en el siglo XXI. [100] Los depósitos de uranio parecen tener una distribución log-normal. Hay un aumento de 300 veces en la cantidad de uranio recuperable por cada disminución de diez veces en la ley del mineral. [101] En otras palabras, hay poco mineral de alta ley y proporcionalmente mucho más mineral de baja ley disponible.
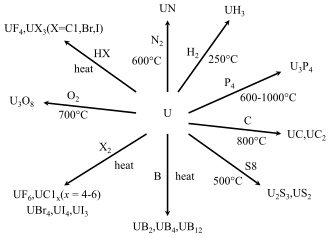
Compuestos
Estados de oxidación y óxidos
Óxidos
El uranio calcinado, que se produce en muchas plantas grandes, contiene una distribución de especies de oxidación de uranio en diversas formas que van desde las más oxidadas a las menos oxidadas. Las partículas con tiempos de residencia cortos en un calcinador generalmente estarán menos oxidadas que aquellas con tiempos de retención largos o partículas recuperadas en el depurador de chimenea. El contenido de uranio generalmente se refiere a U
3Oh
8, que data de los días del Proyecto Manhattan, cuando EE. UU.
3Oh
8Se utilizó como estándar de informes de química analítica. [102]
Las relaciones de fases en el sistema uranio-oxígeno son complejas. Los estados de oxidación más importantes del uranio son el uranio (IV) y el uranio (VI), y sus dos óxidos correspondientes son, respectivamente, el dióxido de uranio ( UO
2) y trióxido de uranio ( UO
3). [103] Otros óxidos de uranio como el monóxido de uranio (UO), el pentóxido de diuranio ( U
2Oh
5) y peróxido de uranio ( UO
4·2 horas
2O ) también existen.
Las formas más comunes de óxido de uranio son el octóxido de triuranio ( U
3Oh
8) y UO
2. [104] Ambas formas de óxido son sólidos que tienen baja solubilidad en agua y son relativamente estables en un amplio rango de condiciones ambientales. El octóxido de triuranio es (dependiendo de las condiciones) el compuesto más estable de uranio y es la forma que se encuentra más comúnmente en la naturaleza. El dióxido de uranio es la forma en la que el uranio se usa más comúnmente como combustible para reactores nucleares. [104] A temperaturas ambiente, el UO
2se convertirá gradualmente en U
3Oh
8Debido a su estabilidad, los óxidos de uranio se consideran generalmente la forma química preferida para el almacenamiento o la eliminación. [104]
Química acuosa

Las sales de muchos estados de oxidación del uranio son solubles en agua y pueden estudiarse en soluciones acuosas . Las formas iónicas más comunes son U3+
(marrón rojizo), U4+
(verde), UO+
2(inestable) y UO2+
2(amarillo), para U(III), U(IV), U(V) y U(VI), respectivamente. [105] Existen algunos compuestos sólidos y semimetálicos como UO y US para el estado de oxidación formal uranio(II), pero no se sabe que existan iones simples en solución para ese estado. Los iones de U3+
liberan hidrógeno del agua y, por lo tanto, se consideran altamente inestables. El UO2+
2El ion representa el estado del uranio (VI) y se sabe que forma compuestos como carbonato de uranilo , cloruro de uranilo y sulfato de uranilo . UO2+
2También forma complejos con varios agentes quelantes orgánicos , el más común de los cuales es el acetato de uranilo . [105]
A diferencia de las sales de uranilo de uranio y las formas catiónicas de óxido de uranio poliatómico , los uranatos , sales que contienen un anión de óxido de uranio poliatómico, generalmente no son solubles en agua.
Carbonatos
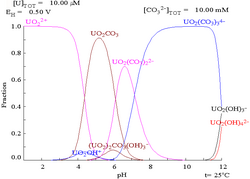
Las interacciones de los aniones carbonato con el uranio(VI) hacen que el diagrama de Pourbaix cambie considerablemente cuando el medio cambia de agua a una solución que contiene carbonato. Si bien la gran mayoría de los carbonatos son insolubles en agua (a menudo se les enseña a los estudiantes que todos los carbonatos, excepto los de metales alcalinos, son insolubles en agua), los carbonatos de uranio suelen ser solubles en agua. Esto se debe a que un catión U(VI) puede unirse a dos óxidos terminales y tres o más carbonatos para formar complejos aniónicos.
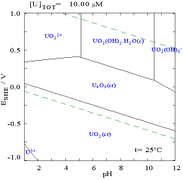 | 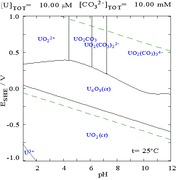 |
| Uranio en un medio acuoso no complejante (por ejemplo, ácido perclórico /hidróxido de sodio). [106] | Uranio en solución de carbonato |
 |  |
| Concentraciones relativas de las diferentes formas químicas del uranio en un medio acuoso no complejante (por ejemplo, ácido perclórico /hidróxido de sodio). [106] | Concentraciones relativas de las diferentes formas químicas del uranio en una solución acuosa de carbonato. [106] |
Efectos del pH
Los diagramas de fracciones de uranio en presencia de carbonato ilustran esto aún más: cuando el pH de una solución de uranio (VI) aumenta, el uranio se convierte en un hidróxido de óxido de uranio hidratado y a pH altos se convierte en un complejo de hidróxido aniónico.
Cuando se añade carbonato, el uranio se convierte en una serie de complejos de carbonato si se aumenta el pH. Un efecto de estas reacciones es el aumento de la solubilidad del uranio en el rango de pH de 6 a 8, un hecho que tiene una relación directa con la estabilidad a largo plazo de los combustibles nucleares de dióxido de uranio gastado.
Hidruros, carburos y nitruros
El metal de uranio calentado a 250 a 300 °C (482 a 572 °F) reacciona con hidrógeno para formar hidruro de uranio . Incluso temperaturas más altas eliminarán reversiblemente el hidrógeno. Esta propiedad hace que los hidruros de uranio sean materiales de partida convenientes para crear polvo de uranio reactivo junto con varios compuestos de carburo , nitruro y haluro de uranio. [107] Existen dos modificaciones cristalinas del hidruro de uranio: una forma α que se obtiene a bajas temperaturas y una forma β que se crea cuando la temperatura de formación es superior a 250 °C. [107]
Los carburos de uranio y los nitruros de uranio son compuestos semimetálicos relativamente inertes que son mínimamente solubles en ácidos , reaccionan con el agua y pueden encenderse en el aire para formar U
3Oh
8. [107] Los carburos de uranio incluyen monocarburo de uranio (U C ), dicarburo de uranio ( UC
2) y tricarburo de diuranio ( U
2do
3). Tanto UC como UC
2Se forman añadiendo carbono al uranio fundido o exponiendo el metal al monóxido de carbono a altas temperaturas. Estable por debajo de los 1800 °C, U
2do
3Se prepara sometiendo una mezcla calentada de UC y UC
2al estrés mecánico. [108] Los nitruros de uranio obtenidos por exposición directa del metal al nitrógeno incluyen el mononitruro de uranio (UN), el dinitruro de uranio ( UN
2), y trinitruro de diuranio ( U
2norte
3). [108]
Haluros

Todos los fluoruros de uranio se crean utilizando tetrafluoruro de uranio ( UF
4); UF
4El UF se prepara por hidrofluoración del dióxido de uranio. [107] Reducción de UF
4con hidrógeno a 1000 °C produce trifluoruro de uranio ( UF
3). En las condiciones adecuadas de temperatura y presión, la reacción del UF sólido
4con hexafluoruro de uranio gaseoso ( UF
6) pueden formar los fluoruros intermedios de U
2F
9, tú
4F
17, y UF
5. [107]
A temperatura ambiente, UF
6Tiene una alta presión de vapor , lo que lo hace útil en el proceso de difusión gaseosa para separar el raro uranio-235 del isótopo común uranio-238. Este compuesto se puede preparar a partir de dióxido de uranio e hidruro de uranio mediante el siguiente proceso: [107]
- OU
2+ 4 AF → UF
4+ 2 horas
2O (500 °C, endotérmico) - UF
4+ F
2→ UF
6(350 °C, endotérmico)
La UF resultante
6, un sólido blanco, es altamente reactivo (por fluoración), se sublima fácilmente (emite un vapor que se comporta como un gas casi ideal ) y es el compuesto de uranio más volátil que se conoce que existe. [107]
Un método para preparar tetracloruro de uranio ( UCl
4) consiste en combinar directamente el cloro con uranio metálico o hidruro de uranio. La reducción de UCl
4por hidrógeno se produce tricloruro de uranio ( UCl
3) mientras que los cloruros superiores de uranio se preparan por reacción con cloro adicional. [107] Todos los cloruros de uranio reaccionan con agua y aire.
Los bromuros y yoduros de uranio se forman por reacción directa, respectivamente, de bromo y yodo con uranio o añadiendo UH
3a los ácidos de esos elementos. [107] Los ejemplos conocidos incluyen: UBr
3, Universidad de Bronce
4, interfaz de usuario
3, y la interfaz de usuario
4. IU
5Nunca se ha preparado. Los oxihaluros de uranio son solubles en agua e incluyen UO
2F
2, UOCl
2, UO
2Cl
2, y UO2Br2. La estabilidad de los oxihaluros disminuye a medida que aumenta el peso atómico del haluro componente. [107]
Isótopos
El uranio, como todos los elementos con un número atómico mayor que 82, no tiene isótopos estables . Todos los isótopos del uranio son radiactivos porque la fuerza nuclear fuerte no prevalece sobre la repulsión electromagnética en los nucleidos que contienen más de 82 protones. [109] Sin embargo, los dos isótopos más estables, 238 U y 235 U, tienen vidas medias lo suficientemente largas como para existir en la naturaleza como radionucleidos primordiales , y han sobrevivido cantidades mensurables desde la formación de la Tierra. [110] Estos dos nucleidos , junto con el torio-232 , son los únicos nucleidos primordiales confirmados más pesados que el casi estable bismuto-209 . [7] [111]
El uranio natural consta de tres isótopos principales: uranio-238 (99,28% de abundancia natural), uranio-235 (0,71%) y uranio-234 (0,0054%). También hay otros cinco isótopos traza: uranio-240, un producto de desintegración del plutonio-244 ; [111] uranio-239, que se forma cuando el 238 U sufre fisión espontánea, liberando neutrones que son capturados por otro átomo de 238 U; uranio-237, que se forma cuando el 238 U captura un neutrón pero emite dos más, que luego se desintegran en neptunio-237 ; uranio-236 , que se presenta en cantidades traza debido a la captura de neutrones en el 235 U y como producto de desintegración del plutonio-244; [111] y, por último, el uranio-233 , que se forma en la cadena de desintegración del neptunio-237. Además, el uranio-232 se produciría mediante la doble desintegración beta del torio-232 natural , aunque este proceso energéticamente posible nunca se ha observado. [114]
El uranio-238 es el isótopo más estable del uranio, con una vida media de aproximadamente4,463 × 10 9 años, [7] aproximadamente la edad de la Tierra . El uranio-238 es predominantemente un emisor alfa, que se desintegra en torio-234. Finalmente se desintegra a través de la serie del uranio , que tiene 18 miembros, en plomo-206 . [17] El uranio-238 no es fisible, pero es un isótopo fértil, porque después de la activación neutrónica puede convertirse en plutonio-239, otro isótopo fisible. De hecho, el núcleo de 238 U puede absorber un neutrón para producir el isótopo radiactivo uranio-239 . El 239 U se desintegra por emisión beta en neptunio -239, también un emisor beta, que se desintegra a su vez, en unos pocos días, en plutonio-239. El 239 Pu se utilizó como material fisible en la primera bomba atómica detonada en la « prueba Trinity » el 16 de julio de 1945 en Nuevo México . [37]
El uranio-235 tiene una vida media de aproximadamente7,04 × 10 8 años; es el siguiente isótopo de uranio más estable después del 238 U y también es predominantemente un emisor alfa, decayendo al torio-231. [7] El uranio-235 es importante tanto para los reactores nucleares como para las armas nucleares , porque es el único isótopo de uranio existente en la naturaleza en la Tierra en cantidades significativas que es fisible. Esto significa que puede dividirse en dos o tres fragmentos ( productos de fisión ) por neutrones térmicos. [17] La cadena de desintegración del 235 U, que se llama serie del actinio , tiene 15 miembros y finalmente se desintegra en plomo-207. [17] Las tasas constantes de desintegración en estas series de desintegración hacen que la comparación de las proporciones de elementos padre e hijo sea útil en la datación radiométrica.
El uranio-236 tiene una vida media de2,342 × 10 7 años [7] y no se encuentra en cantidades significativas en la naturaleza. La vida media del uranio-236 es demasiado corta para que sea primordial, aunque se lo ha identificado como un progenitor extinto de su hija de desintegración alfa, el torio-232. [67] El uranio-236 se encuentra en el combustible nuclear gastado cuando la captura de neutrones en 235 U no induce la fisión, o como un producto de desintegración del plutonio-240 . El uranio-236 no es fértil, ya que se requieren tres capturas de neutrones más para producir 239 Pu fisible, y no es fisible en sí mismo; como tal, se considera un residuo radiactivo de larga duración. [115]
El uranio-234 es un miembro de la serie del uranio y se encuentra en equilibrio con su progenitor, el 238 U; sufre una desintegración alfa con una vida media de 245.500 años [7] y se desintegra en plomo-206 a través de una serie de isótopos de vida relativamente corta.
El uranio-233 sufre una desintegración alfa con una vida media de 160.000 años y, al igual que el 235 U, es fisible. [12] Se puede generar a partir del torio-232 mediante bombardeo de neutrones, normalmente en un reactor nuclear; este proceso se conoce como ciclo del combustible del torio . Debido a la fisibilidad del 233 U y a la mayor abundancia natural de torio (tres veces la del uranio), [116] se ha investigado el 233 U para su uso como combustible nuclear como posible alternativa al 235 U y al 239 Pu, [117] aunque no se utiliza ampliamente en 2022. [actualizar][ 116] La cadena de desintegración del uranio-233 forma parte de la serie del neptunio y termina en el casi estable bismuto-209 (vida media2,01 × 10 19 años ) [7] y talio -205 estable .
El uranio-232 es un emisor alfa con una vida media de 68,9 años. [7] Este isótopo se produce como subproducto en la producción de 233 U y se considera una molestia, ya que no es fisible y se desintegra a través de emisores alfa y gamma de vida corta, como el 208 Tl . [117] También se espera que el torio-232 pueda sufrir una doble desintegración beta , lo que produciría uranio-232, pero esto aún no se ha observado experimentalmente. [7]
Todos los isótopos desde 232 U hasta 236 U inclusive tienen ramas de desintegración de grupos menores (menos de10 −10 %), y todos estos, excepto el 233 U, además del 238 U, tienen ramas de fisión espontánea menores; [7] la mayor relación de ramificación para la fisión espontánea es de aproximadamente5 × 10 −5 % para 238 U, o aproximadamente una de cada dos millones de desintegraciones. [118] Los isótopos traza de vida más corta 237 U y 239 U experimentan exclusivamente desintegración beta , con vidas medias respectivas de 6,752 días y 23,45 minutos. [7]
En total, se han identificado 28 isótopos de uranio, cuyo número de masa varía de 214 [119] a 242, con la excepción del 220. [7] [120] Entre los isótopos de uranio que no se encuentran en muestras naturales o combustible nuclear, el de vida más larga es el 230 U, un emisor alfa con una vida media de 20,23 días. [7] Este isótopo se ha considerado para su uso en la terapia de partículas alfa dirigida (TAT). [121] Todos los demás isótopos tienen vidas medias inferiores a una hora, excepto el 231 U (vida media de 4,2 días) y el 240 U (vida media de 14,1 horas). [7] El isótopo conocido de vida más corta es el 221 U, con una vida media de 660 nanosegundos, y se espera que el hasta ahora desconocido 220 U tenga una vida media aún más corta. [122] Los isótopos ricos en protones más ligeros que el 232 U sufren principalmente desintegración alfa, excepto el 229 U y el 231 U, que se desintegran en isótopos de protactinio mediante emisión de positrones y captura de electrones , respectivamente; los 240 U, 241 U y 242 U ricos en neutrones sufren desintegración beta para formar isótopos de neptunio . [7] [120]
Enriquecimiento

En la naturaleza, el uranio se encuentra como uranio-238 (99,2742%) y uranio-235 (0,7204%). La separación de isótopos concentra (enriquece) el uranio-235 fisible para armas nucleares y la mayoría de las plantas de energía nuclear, excepto los reactores refrigerados por gas y los reactores de agua pesada presurizada . La mayoría de los neutrones liberados por un átomo de uranio-235 en fisión deben impactar con otros átomos de uranio-235 para mantener la reacción nuclear en cadena . La concentración y la cantidad de uranio-235 necesarias para lograr esto se denominan " masa crítica ".
Para que se considere "enriquecido", la fracción de uranio-235 debe estar entre el 3% y el 5%. [123] Este proceso produce enormes cantidades de uranio empobrecido en uranio-235 y con una fracción correspondientemente mayor de uranio-238, llamada uranio empobrecido o "DU". Para que se considere "empobrecido", la concentración de 235 U no debe ser superior al 0,3%. [124] El precio del uranio ha aumentado desde 2001, por lo que se está considerando la posibilidad de reenriquecer los relaves de enriquecimiento que contienen más del 0,35% de uranio-235, lo que ha hecho que el precio del hexafluoruro de uranio empobrecido supere los 130 dólares por kilogramo en julio de 2007, frente a los 5 dólares de 2001. [124]
El proceso de centrifugación de gas , donde el hexafluoruro de uranio gaseoso ( UF
6) se separa por la diferencia de peso molecular entre 235 UF 6 y 238 UF 6 utilizando centrífugas de alta velocidad , es el proceso de enriquecimiento más barato y líder. [34] El proceso de difusión gaseosa había sido el método líder para el enriquecimiento y se utilizó en el Proyecto Manhattan . En este proceso, el hexafluoruro de uranio se difunde repetidamente a través de una membrana de plata y zinc , y los diferentes isótopos de uranio se separan por velocidad de difusión (como el uranio-238 es más pesado, se difunde ligeramente más lento que el uranio-235). [34] El método de separación de isótopos por láser molecular emplea un rayo láser de energía precisa para cortar el enlace entre el uranio-235 y el flúor. Esto deja el uranio-238 unido al flúor y permite que el metal uranio-235 precipite de la solución. [10] Un método alternativo de enriquecimiento por láser se conoce como separación de isótopos por láser de vapor atómico (AVLIS) y emplea láseres sintonizables visibles como los láseres de colorante . [125] Otro método utilizado es la difusión térmica líquida. [11]
La única desviación significativa de la proporción de 235 U a 238 U en cualquier muestra natural conocida se produce en Oklo , Gabón , donde los reactores de fisión nuclear naturales consumieron parte del 235 U hace unos dos mil millones de años, cuando la proporción de 235 U a 238 U era más parecida a la del uranio poco enriquecido, lo que permitía que el agua normal ("ligera") actuara como moderador de neutrones, de forma similar al proceso de los reactores de agua ligera artificiales . La existencia de tales reactores de fisión naturales, que se habían predicho teóricamente de antemano, se demostró cuando se descubrió la ligera desviación de la concentración de 235 U con respecto a los valores esperados durante el enriquecimiento de uranio en Francia. Investigaciones posteriores para descartar cualquier acción humana nefasta (como el robo de 235 U) confirmaron la teoría al encontrar proporciones de isótopos de productos de fisión comunes (o más bien sus nucleidos hijos estables) en línea con los valores esperados para la fisión, pero que se desviaban de los valores esperados para muestras de esos elementos no derivadas de la fisión.
Exposición humana
Una persona puede estar expuesta al uranio (o sus descendientes radiactivos , como el radón ) al inhalar polvo en el aire o al ingerir agua y alimentos contaminados. La cantidad de uranio en el aire suele ser muy pequeña; sin embargo, las personas que trabajan en fábricas que procesan fertilizantes de fosfato , viven cerca de instalaciones gubernamentales que fabricaron o probaron armas nucleares, viven o trabajan cerca de un campo de batalla moderno donde se han utilizado armas de uranio empobrecido, o viven o trabajan cerca de una planta de energía a carbón , instalaciones que extraen o procesan mineral de uranio, o enriquecen uranio para combustible de reactor, pueden tener una mayor exposición al uranio. [126] [127] Las casas o estructuras que están sobre depósitos de uranio (ya sean depósitos de escoria naturales o artificiales) pueden tener una mayor incidencia de exposición al gas radón. La Administración de Seguridad y Salud Ocupacional (OSHA) ha establecido el límite de exposición permisible para la exposición al uranio en el lugar de trabajo en 0,25 mg/m 3 durante una jornada laboral de 8 horas. El Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH) ha establecido un límite de exposición recomendado (REL) de 0,2 mg/m 3 durante una jornada laboral de 8 horas y un límite a corto plazo de 0,6 mg/m 3 . A 10 mg/m 3 , el uranio es inmediatamente peligroso para la vida y la salud . [128]
La mayor parte del uranio ingerido se excreta durante la digestión . Solo el 0,5% se absorbe cuando se ingieren formas insolubles de uranio, como su óxido, mientras que la absorción del ion uranilo más soluble puede ser de hasta el 5%. [30] Sin embargo, los compuestos solubles de uranio tienden a pasar rápidamente a través del cuerpo, mientras que los compuestos insolubles de uranio, especialmente cuando se inhalan a través del polvo hacia los pulmones , plantean un peligro de exposición más grave. Después de entrar en el torrente sanguíneo, el uranio absorbido tiende a bioacumularse y permanecer durante muchos años en el tejido óseo debido a la afinidad del uranio por los fosfatos. [30] El uranio incorporado se convierte en iones de uranilo , que se acumulan en los huesos, el hígado, los riñones y los tejidos reproductivos. [129]
La toxicidad radiológica y química del uranio se combina con el hecho de que los elementos de alto número atómico Z como el uranio exhiben radiotoxicidad fantasma o secundaria a través de la absorción de rayos gamma y X de fondo natural y la reemisión de fotoelectrones, que en combinación con la alta afinidad del uranio con la fracción de fosfato del ADN causan un aumento de las roturas de cadena simple y doble del ADN. [130]
El uranio no se absorbe a través de la piel y las partículas alfa liberadas por el uranio no pueden penetrar la piel. [27]
El uranio se puede descontaminar de superficies de acero [131] y de acuíferos . [132] [133]
Efectos y precauciones
El funcionamiento normal de los riñones , cerebro , hígado , corazón y otros sistemas puede verse afectado por la exposición al uranio, porque, además de ser débilmente radiactivo, el uranio es un metal tóxico . [30] [134] [135] El uranio también es un tóxico reproductivo . [136] [137] Los efectos radiológicos son generalmente locales porque la radiación alfa, la forma primaria de desintegración del 238 U, tiene un alcance muy corto y no penetra la piel. Se ha demostrado que la radiación alfa del uranio inhalado causa cáncer de pulmón en trabajadores nucleares expuestos. [138] Si bien el CDC ha publicado un estudio en el que se afirma que no se ha observado ningún cáncer humano como resultado de la exposición al uranio natural o empobrecido, [139] la exposición al uranio y sus productos de desintegración, especialmente el radón , es una amenaza importante para la salud. [140] La exposición al estroncio-90 , al yodo-131 y a otros productos de fisión no está relacionada con la exposición al uranio, pero puede ser resultado de procedimientos médicos o de la exposición al combustible gastado del reactor o a la lluvia radiactiva de armas nucleares. [141]
Aunque la exposición accidental por inhalación a una alta concentración de hexafluoruro de uranio ha causado muertes humanas, esas muertes estuvieron asociadas con la generación de ácido fluorhídrico y fluoruro de uranilo altamente tóxicos, más que con el uranio en sí. [142] El uranio metálico finamente dividido presenta un peligro de incendio porque el uranio es pirofórico ; los granos pequeños se encenderán espontáneamente en el aire a temperatura ambiente. [12]
El uranio metálico se suele manipular con guantes como medida de precaución suficiente. [143] El concentrado de uranio se manipula y se contiene de forma que se garantice que las personas no lo inhalen ni lo ingieran. [143]
Véase también
- Residuos K-65
- Lista de países según producción de uranio
- Lista de países según reservas de uranio
- Lista de proyectos de uranio
- Listas de desastres nucleares e incidentes radiactivos
- Accidentes e incidentes nucleares y radiológicos
- Ingeniería nuclear
- Ciclo del combustible nuclear
- Física nuclear
- Enlace quíntuple (antes se pensaba que era un enlace phi ), en la molécula U 2
- Ciclo del combustible del torio
- Audiencia mundial sobre el uranio
Notas
- ^ La expansión térmica es anisotrópica : los coeficientes para cada eje del cristal (a 20 °C) son α a = 25,27 × 10 −6 /K, α b = 0,76 × 10 −6 /K, α c = 20,35 × 10 −6 /K, y α promedio = α volumen /3 = 15,46 × 10 −6 /K.
Referencias
- ^ "Pesos atómicos estándar: uranio". CIAAW . 1999.
- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip JH; Gröning, Manfred; Holden, Norman E.; Meijer, Harro AJ (4 de mayo de 2022). "Pesos atómicos estándar de los elementos 2021 (Informe técnico de la IUPAC)". Química pura y aplicada . doi :10.1515/pac-2019-0603. ISSN 1365-3075.
- ^ de Arblaster, John W. (2018). Valores seleccionados de las propiedades cristalográficas de los elementos . Materials Park, Ohio: ASM International. ISBN 978-1-62708-155-9.
- ^ Se han detectado Th(-I) y U(-I) en fase gaseosa como aniones octacarbonilo; véase Chaoxian, Chi; Sudip, Pan; Jiaye, Jin; Luyan, Meng; Mingbiao, Luo; Lili, Zhao; Mingfei, Zhou; Gernot, Frenking (2019). "Complejos de iones octacarbonilo de actínidos [An(CO)8]+/− (An=Th, U) y el papel de los orbitales f en la unión metal-ligando". Química (Weinheim an der Bergstrasse, Alemania). 25 (50): 11772–11784 . 25 (50): 11772–11784. doi :10.1002/chem.201902625. ISSN 0947-6539. PMC 6772027 . Número de modelo: PMID31276242.
- ^ Morss, LR; Edelstein, NM; Fuger, J., eds. (2006). La química de los elementos actínidos y transactínidos (3.ª ed.). Países Bajos: Springer. ISBN 978-9048131464.
- ^ ab Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . pág. 28. ISBN 978-0-08-037941-8.
- ^ abcdefghijklmno Kondev, FG; Wang, M.; Huang, WJ; Naimi, S.; Audi, G. (2021). "La evaluación NUBASE2020 de las propiedades nucleares" (PDF) . Chinese Physics C . 45 (3): 030001. doi :10.1088/1674-1137/abddae.
- ^ Magurno, Licenciado en Letras; Pearlstein, S, eds. (1981). Actas de la conferencia sobre métodos y procedimientos de evaluación de datos nucleares. BNL-NCS 51363, vol. II (PDF) . Upton, Nueva York (EE.UU.): Laboratorio Nacional Brookhaven. págs. 835 y siguientes . Consultado el 6 de agosto de 2014 .
- ^ "Uranio". Enciclopedia Británica . Consultado el 22 de abril de 2017 .
- ^ abcde Emsley 2001, pág. 479.
- ^ abcdef "Uranio" . Enciclopedia de ciencia y tecnología de McGraw-Hill (quinta edición). The McGraw-Hill Companies, Inc. 2005. ISBN 978-0-07-142957-3.
- ^ abcdefghijklmnopq Hammond, CR (2000). Los elementos, en Manual de química y física (PDF) (81.ª ed.). CRC press. ISBN 978-0-8493-0481-1.
- ^ "Uranio". Real Sociedad de Química.
- ^ "Plomo". Real Sociedad de Química.
- ^ "Tungsteno". Real Sociedad de Química.
- ^ "Oro". Real Sociedad de Química.
- ^ abcdefg "uranio". Enciclopedia electrónica de Columbia (6.ª ed.). Columbia University Press. Archivado desde el original el 27 de julio de 2011. Consultado el 27 de septiembre de 2008 .
- ^ abcde "uranio". Enciclopedia de espionaje, inteligencia y seguridad . The Gale Group, Inc. Archivado desde el original el 27 de julio de 2011. Consultado el 27 de septiembre de 2008 .
- ^ Rollett, AD (2008). Aplicaciones del análisis de texturas. John Wiley and Sons. pág. 108. ISBN 978-0-470-40835-3.
- ^ abc Grenthe, Ingmar; Drożdżyński, Janusz; Fujino, Takeo; Buck, Edgar C.; Albrecht-Schmitt, Thomas E .; Wolf, Stephen F. (2006). "Uranio". En Morss, Lester R.; Edelstein, Norman M.; Fuger, Jean (eds.). La química de los elementos actínidos y transactínidos (PDF) . Vol. 5 (3.ª ed.). Dordrecht, Países Bajos: Springer. págs. 52–160. doi :10.1007/1-4020-3598-5_5. ISBN 978-1-4020-3555-5. Archivado desde el original (PDF) el 7 de marzo de 2016.
- ^ "Desarrollo de municiones de uranio empobrecido". Uranio empobrecido en el Golfo (II) . Gulflink, sitio web oficial de Force Health Protection & Readiness. 2000.
- ^ abcde Emsley 2001, pág. 480.
- ^ "Diseño de armas nucleares". Federación de Científicos Estadounidenses. 1998. Archivado desde el original el 26 de diciembre de 2008. Consultado el 19 de febrero de 2007 .
- ^ "Declaración sobre la emisión de Good Morning America", The Homer Laughlin China Co. Archivado el 1 de abril de 2012 en Wayback Machine , 16 de marzo de 2011, consultado el 25 de marzo de 2012.
- ^ "Dial R for radioactive – 12 de julio de 1997 – New Scientist". Newscientist.com . Consultado el 12 de septiembre de 2008 .
- ^ "Minería de uranio". Atomic Heritage Foundation . Consultado el 23 de diciembre de 2020 .
- ^ ab "Datos de la EPA sobre el uranio" (PDF) . Agencia de Protección Ambiental de Estados Unidos. Archivado desde el original (PDF) el 29 de noviembre de 2014. Consultado el 20 de septiembre de 2014 .
- ^ "Dentaduras postizas que contienen uranio (aproximadamente en los años 1960 y 1970)". Museo de Radiación y Radiactividad de ORAU . Universidades Asociadas de Oak Ridge . 1999. Consultado el 11 de octubre de 2021 .
- ^ Emsley 2001, pág. 482.
- ^ abcdefghij Emsley 2001, pág. 477.
- ^ Klaproth, MH (1789). "Chemische Untersuchung des Uranits, einer neuentdeckten metallischen Substanz". Chemische Annalen . 2 : 387–403.
- ^ "Uranio". Diccionario American Heritage de la lengua inglesa (4.ª ed.). Houghton Mifflin Company. Archivado desde el original el 27 de julio de 2011. Consultado el 15 de enero de 2007 .
- ^ Péligot, E.-M. (1842). "Recherches Sur L'Uranium". Annales de chimie et de physique . 5 (5): 5–47.
- ^ abcd Emsley 2001, pág. 478.
- ^ "The Electric Journal". Westinghouse Club. 10 de abril de 1920 – vía Google Books.
- ^ Gillett, Horace Wadsworth; Mack, Edward Lawrence (10 de abril de 1917). Preparación de ferrouranio. Documento técnico 177 – Oficina de Minas de los EE. UU. Impresión del gobierno de los EE. UU. – a través de Google Books.
- ^ abcdef Seaborg 1968, pág. 773.
- ↑ Fermi, Enrico (12 de diciembre de 1938). «Radiactividad artificial producida por bombardeo de neutrones: conferencia Nobel» (PDF) . Real Academia Sueca de Ciencias. Archivado desde el original (PDF) el 9 de agosto de 2018. Consultado el 14 de junio de 2017 .
- ^ De Gregorio, A. (2003). "Una nota histórica sobre cómo se descubrió la propiedad de que las sustancias hidrogenadas aumentan la radiactividad inducida por neutrones". Nuovo Saggiatore . 19 : 41–47. arXiv : physics/0309046 . Bibcode :2003physics...9046D.
- ^ Nigro, M. (2004). "Hahn, Meitner y la teoría della fissione" (PDF) . Archivado desde el original (PDF) el 25 de marzo de 2009 . Consultado el 5 de mayo de 2009 .
- ^ van der Krogt, Peter. "Elementymology & Elements Multidict" (Elementimología y multidictado de elementos) . Consultado el 5 de mayo de 2009 .
- ^ Meitner, L. ; Frisch, O. (1939). "Desintegración del uranio por neutrones: un nuevo tipo de reacción nuclear". Nature . 143 (5218): 239–240. Código Bibliográfico :1969Natur.224..466M. doi :10.1038/224466a0. S2CID 4188874.
- ^ "Alfred OC Nier". www.aps.org . Consultado el 4 de diciembre de 2016 .
- ^ Manfred Popp (21 de septiembre de 2016). "Wissenschaftsgeschichte: Hitlers Atombombe - warum es sie nicht gab - Spektrum der Wissenschaft". Spektrum.de . Consultado el 25 de febrero de 2022 .
- ^ "Chicago Pile One". large.stanford.edu . Consultado el 4 de diciembre de 2016 .
- ^ Walsh, John (19 de junio de 1981). "A Manhattan Project Postscript" (PDF) . Science . 212 (4501). AAAS: 1369–1371. Bibcode :1981Sci...212.1369W. doi :10.1126/science.212.4501.1369. PMID 17746246 . Consultado el 23 de marzo de 2013 .
- ^ Helmreich, JE Recolección de minerales raros: la diplomacia de la adquisición de uranio, 1943-1954 , Princeton UP, 1986: cap. 10 ISBN 0-7837-9349-9
- ^ "Reactores diseñados por el Laboratorio Nacional Argonne: tecnología de reactores rápidos". Departamento de Energía de Estados Unidos, Laboratorio Nacional Argonne. 2012. Consultado el 25 de julio de 2012 .
- ^ "Historia y éxito del Laboratorio Nacional Argonne: Parte 1". Departamento de Energía de los Estados Unidos, Laboratorio Nacional Argonne. 1998. Archivado desde el original el 26 de septiembre de 2006. Consultado el 28 de enero de 2007 .
- ^ "Reactores diseñados por el Laboratorio Nacional Argonne: desarrollo de tecnología de reactores de agua ligera". Departamento de Energía de Estados Unidos, Laboratorio Nacional Argonne. 2012. Consultado el 25 de julio de 2012 .
- ^ "1956: Queen enciende la energía nuclear". BBC News . 17 de octubre de 1956 . Consultado el 28 de junio de 2006 .
- ^ "STR (Reactor térmico submarino) en "Reactores diseñados por el Laboratorio Nacional Argonne: desarrollo de tecnología de reactores de agua ligera"". Departamento de Energía de Estados Unidos, Laboratorio Nacional Argonne. 2012. Consultado el 25 de julio de 2012 .
- ^ ab "Oklo: Reactores nucleares naturales". Oficina de Gestión de Residuos Radiactivos Civiles . Archivado desde el original el 3 de junio de 2004. Consultado el 28 de junio de 2006 .
- ^ Warneke, T.; Croudace, I. W.; Warwick, PE y Taylor, RN (2002). "Un nuevo registro de la precipitación a nivel del suelo de isótopos de uranio y plutonio en latitudes templadas del norte". Earth and Planetary Science Letters . 203 (3–4): 1047–1057. Bibcode :2002E&PSL.203.1047W. doi :10.1016/S0012-821X(02)00930-5.
- ^ "Los peores desastres nucleares". Time . 25 de marzo de 2009. Archivado desde el original el 28 de marzo de 2009 . Consultado el 24 de mayo de 2010 .
- ^ Gilliland, Frank D.; Hunt, William C.; Pardilla, Marla; Key, Charles R. (marzo de 2000). "Minería de uranio y cáncer de pulmón entre hombres navajos en Nuevo México y Arizona, de 1969 a 1993". Revista de medicina ocupacional y ambiental . 42 (3): 278–283. doi :10.1097/00043764-200003000-00008. PMID 10738707.
- ^ Brugge, Doug; Goble, Rob (2002). "La historia de la minería de uranio y el pueblo navajo". Revista estadounidense de salud pública . 92 (9). Ajph.org: 1410–1419. doi :10.2105/AJPH.92.9.1410. PMC 3222290 . PMID 12197966.
- ^ Van Unnik, JG; Broerse, JJ; Geleijns, J.; Jansen, JT; Zoetelief, J.; Zweers, D. (1997). "Estudio de técnicas de TC y dosis absorbida en varios hospitales holandeses". La revista británica de radiología . 70 (832): 367–371. doi :10.1259/bjr.70.832.9166072. PMID 9166072.(3000 exámenes de 18 hospitales)
- ^ Ciclo del combustible nuclear de Rusia. Asociación Nuclear Mundial. Actualizado en diciembre de 2021.
- ^ Emsley, John (2003). Los elementos básicos de la naturaleza: una guía de la A a la Z de los elementos. Oxford University Press. ISBN 978-0-19-850340-8.
- ^ Biever, Celeste (27 de julio de 2005). «First measures of Earth's core radiactivity» (Primeras mediciones de la radiactividad del núcleo de la Tierra). New Scientist . Consultado el 7 de julio de 2022 .
- ^ "El potasio-40 calienta el núcleo de la Tierra". physicsworld.com . 7 de mayo de 2003 . Consultado el 14 de enero de 2007 .
- ^ Schnug, E., Sun, Y., Zhang, L., Windmann, H., Lottermoser, BG, Ulrich, AE, Bol, R., Makeawa, M. y Haneklaus, SH (2023) "Cargas elementales con fertilizantes fosfatados: ¿una limitación para la productividad del suelo?" En: Bolan, NS y Kirkham, MB (eds.) Managing Soil Constraints for Sustaining Productivity . CRC Press.
- ^ "Historia/Origen de los productos químicos". NASA . Consultado el 1 de enero de 2013 .
- ^ Burbidge, EM; Burbidge, GR; Fowler, WA; Hoyle, F. (1957). "Síntesis de los elementos en las estrellas". Reseñas de Física Moderna . 29 (4): 547. Bibcode :1957RvMP...29..547B. doi : 10.1103/RevModPhys.29.547 .
- ^ Clayton, Donald D. (1968). Principios de evolución estelar y nucleosíntesis . Nueva York: Mc-Graw-Hill. pp. 577–91. ISBN 978-0226109534.
- ^ ab Trenn, Thaddeus J. (1978). "El torio (U-236) como el progenitor natural extinto del torio: la falsificación prematura de una teoría esencialmente correcta". Anales de la ciencia . 35 (6): 581–97. doi :10.1080/00033797800200441.
- ^ Tissot, François LH; Dauphas, Nicolas; Grossmann, Lawrence (4 de marzo de 2016). "Origen de las variaciones de isótopos de uranio en los condensados de las nebulosas solares tempranas". Science Advances . 2 (3): e1501400. arXiv : 1603.01780 . Bibcode :2016SciA....2E1400T. doi :10.1126/sciadv.1501400. PMC 4783122 . PMID 26973874.
- ^ Min, M.; Xu, H.; Chen, J.; Fayek, M. (2005). "Evidencia de biomineralización de uranio en depósitos de uranio de frente rodante alojados en arenisca, noroeste de China". Ore Geology Reviews . 26 (3–4): 198. Bibcode :2005OGRv...26..198M. doi :10.1016/j.oregeorev.2004.10.003.
- ^ Koribanics, NM; Tuorto, SJ; Lopez-Chiaffarelli, N.; McGuinness, LR; Häggblom, MM; Williams, KH; Long, PE; Kerkhof, LJ (2015). "Distribución espacial de una betaproteobacteria que respira uranio en el sitio de investigación de campo de Rifle, CO". PLOS ONE . 10 (4): e0123378. Bibcode :2015PLoSO..1023378K. doi : 10.1371/journal.pone.0123378 . PMC 4395306 . PMID 25874721.
- ^ Renshaw, JC; Butchins, LJC; Livens, FR; et al. (junio de 2005). "Biorreducción del uranio: implicaciones ambientales de un intermedio pentavalente". Environmental Science & Technology . 39 (15): 5657–5660. Bibcode :2005EnST...39.5657R. doi :10.1021/es048232b. PMID 16124300.
- ^ Vitesse, GF; Morris, K; Natrajan, LS; Shaw, S (enero de 2020). "Varias líneas de evidencia identifican a U(V) como un intermediario clave durante la reducción de U(VI) por Shewanella oneidensis MR1". Environmental Science & Technology . 54 (4): 2268–2276. Bibcode :2020EnST...54.2268V. doi : 10.1021/acs.est.9b05285 . PMID 31934763.
- ^ Emsley 2001, págs. 476 y 482.
- ^ Macaskie, LE; Empson, RM; Cheetham, AK; Grey, CP y Skarnulis, AJ (1992). "Bioacumulación de uranio por una especie de Citrobacter como resultado del crecimiento mediado enzimáticamente de HUO policristalino
2correos
4". Science . 257 (5071): 782–784. Código Bibliográfico :1992Sci...257..782M. doi :10.1126/science.1496397. PMID 1496397. - ^ Anderson, RT; Vrionis, HA; Ortiz-Bernad, I.; Resch, CT; Long, PE; Dayvault, R.; Karp, K.; Marutzky, S.; Metzler, DR; Peacock, A.; White, DC; Lowe, M.; Lovley, DR (2003). "Estimulación de la actividad in situ de especies de Geobacter para eliminar uranio de las aguas subterráneas de un acuífero contaminado con uranio". Microbiología Aplicada y Ambiental . 69 (10): 5884–5891. Bibcode :2003ApEnM..69.5884A. doi :10.1128/AEM.69.10.5884-5891.2003. PMC 201226 . PMID 14532040.
- ^ Gadd, GM (marzo de 2010). "Metales, minerales y microbios: geomicrobiología y biorremediación". Microbiología . 156 (Pt 3): 609–643. doi : 10.1099/mic.0.037143-0 . PMID 20019082.
- ^ Nilgiriwala, KS; Alahari, A.; Rao, AS y Apte, SK (2008). "Clonación y sobreexpresión de la fosfatasa alcalina PhoK de la cepa BSAR-1 de Sphingomonas sp. para la bioprecipitación de uranio a partir de soluciones alcalinas". Microbiología aplicada y ambiental . 74 (17): 5516–5523. Bibcode :2008ApEnM..74.5516N. doi :10.1128/AEM.00107-08. PMC 2546639 . PMID 18641147.
- ^ abcd «Minería mundial de uranio». Asociación Nuclear Mundial . Consultado el 31 de enero de 2023 .
- ^ Seaborg 1968, pág. 774.
- ^ "Cuenca de Athabasca, Saskatchewan" . Consultado el 4 de septiembre de 2009 .
- ^ Gupta, CK y Mukherjee, TK (1990). Hidrometalurgia en procesos de extracción. Vol. 1. CRC Press. págs. 74-75. ISBN 978-0-8493-6804-2.
- ^ "Producción de uranio". Our World in Data . Consultado el 6 de marzo de 2020 .
- ^ ab "Suministros de uranio: Suministro de uranio – Asociación Nuclear Mundial". www.world-nuclear.org .
- ^ ab "Recursos mundiales de uranio para satisfacer la demanda proyectada". Organismo Internacional de Energía Atómica. 2006. Consultado el 29 de marzo de 2007 .
- ^ "Minería y procesamiento de uranio en Australia del Sur". Cámara de Minas y Energía de Australia del Sur. 2002. Archivado desde el original el 6 de enero de 2012. Consultado el 14 de enero de 2007 .
- ^ Ngoupana, P.-M.; Felix, B. (2011). Barker, A. (ed.). "Areva suspende proyecto de mina de uranio en la República Centroafricana". Noticias de la República Centroafricana . Consultado el 7 de marzo de 2020 .
- ^ "Ojivas militares como fuente de combustible nuclear". World-nuclear.org . Consultado el 24 de mayo de 2010 .
- ^ "De megatones a megavatios". US Enrichment Corp. Archivado desde el original el 16 de julio de 2008.
- ^ "Recuperación de uranio a partir de agua de mar". Instituto de Investigación de Energía Atómica de Japón. 23 de agosto de 1999. Archivado desde el original el 17 de octubre de 2009. Consultado el 3 de septiembre de 2008 .
- ^ "¿Cuánto durará la energía nuclear?". 12 de febrero de 1996. Archivado desde el original el 10 de abril de 2007. Consultado el 29 de marzo de 2007 .
- ^ Tsezos, M.; Noh, SH (1984). "Extracción de uranio del agua de mar utilizando adsorbentes de origen biológico". Revista Canadiense de Ingeniería Química . 62 (4): 559–561. doi :10.1002/cjce.5450620416.
- ^ "La tecnología ORNL acerca a los científicos a la extracción de uranio del agua de mar". Oak Ridge National Laboratory, Estados Unidos. 21 de agosto de 2012. Archivado desde el original el 25 de agosto de 2012 . Consultado el 22 de febrero de 2013 .
- ^ "Alimentación de energía nuclear con agua de mar". Pnnl.gov. 21 de agosto de 2012. Consultado el 22 de febrero de 2013 .
- ^ "Valor de intercambio de NUEXCO (precio spot mensual de uranio)". Archivado desde el original el 12 de diciembre de 2007.
- ^ "Producción mundial de uranio". UxC Consulting Company, LLC. Archivado desde el original el 27 de febrero de 2007. Consultado el 11 de febrero de 2007 .
- ^ Mitrídates (24 de julio de 2008). «Página F30: Kazajstán superará a Canadá como el mayor productor mundial de uranio el año pasado (2009)». Mithridates.blogspot.com . Consultado el 12 de septiembre de 2008 .
- ^ "Kazakistán uranyum üretimini artıracak". Zaman.com.tr (en turco). Zaman Gazetesi. 28 de julio de 2008. Archivado desde el original el 13 de enero de 2009 . Consultado el 12 de septiembre de 2008 .
- ^ "Extracción de uranio por lixiviación in situ (ISL) – Asociación Nuclear Mundial" www.world-nuclear.org . Consultado el 6 de mayo de 2021 .
- ^ "Anuncian gran hallazgo de uranio en Somalia". The New York Times . 16 de marzo de 1968 . Consultado el 16 de mayo de 2014 .
- ^ "La falta de combustible puede limitar la expansión de la energía nuclear en Estados Unidos". Instituto Tecnológico de Massachusetts . 21 de marzo de 2007. Consultado el 29 de marzo de 2007 .
- ^ Deffeyes, Kenneth S. y MacGregor, Ian D. (enero de 1980). "Recursos mundiales de uranio". Scientific American . 242 (1): 66. Bibcode :1980SciAm.242a..66D. doi :10.1038/scientificamerican0180-66. OSTI 6665051.
- ^ Kloprogge, J. Theo; Ponce, Concepcion P.; Loomis, Tom A. (2021). La tabla periódica: los componentes básicos de la naturaleza: una introducción a los elementos naturales, sus orígenes y sus usos . Ámsterdam: Elsevier. págs. 861–862. ISBN 978-0-12-821538-8.OCLC 1223058470 .
- ^ Seaborg 1968, pág. 779.
- ^ abc "Formas químicas del uranio". Laboratorio Nacional Argonne. Archivado desde el original el 22 de septiembre de 2006. Consultado el 18 de febrero de 2007 .
- ^ desde Seaborg 1968, pág. 778.
- ^ abcd Puigdomenech, Ignasi (2004) Software de trazado y base de datos de equilibrio químico de Hydra/Medusa. Real Instituto de Tecnología KTH
- ^ abcdefghij Seaborg 1968, pág. 782.
- ^ desde Seaborg 1968, pág. 780.
- ^ Beiser, A. (2003). "Transformaciones nucleares" (PDF) . Conceptos de física moderna (6.ª ed.). McGraw-Hill Education . pp. 432–434. ISBN. 978-0-07-244848-1. Archivado desde el original (PDF) el 4 de octubre de 2016 . Consultado el 4 de julio de 2016 .
- ^ Roederer, IU; Kratz, K.; Frebel, A.; Christlieb, N.; Pfeiffer, B.; Cowan, JJ; Sneden, C. (2009). "El fin de la nucleosíntesis: producción de plomo y torio en la galaxia temprana". The Astrophysical Journal . 698 (2): 1963–1980. arXiv : 0904.3105 . Bibcode :2009ApJ...698.1963R. doi :10.1088/0004-637X/698/2/1963. hdl :2152/35050. S2CID 14814446.
- ^ abc La existencia del plutonio-244 como nucleido primordial es objeto de controversia, aunque algunos informes de su detección también se han atribuido a la caída desde el medio interestelar . [112] [113]
- ^ Lachner, J.; et al. (2012). "Intento de detectar 244 Pu primordial en la Tierra". Physical Review C . 85 (1): 015801. Bibcode :2012PhRvC..85a5801L. doi :10.1103/PhysRevC.85.015801.
- ^ Wallner, A.; Faestermann, T.; Feige, J.; Feldstein, C.; Knie, K.; Korschinek, G.; Kutschera, W.; Ofán, A.; Pablo, M.; Quinto, F.; Rugel, G.; Steier, P. (2015). "La abundancia de 244Pu vivo en reservorios de aguas profundas en la Tierra apunta a la rareza de la nucleosíntesis de actínidos". Comunicaciones de la naturaleza . 6 : 5956. arXiv : 1509.08054 . Código Bib : 2015NatCo...6.5956W. doi : 10.1038/ncomms6956. ISSN 2041-1723. PMC 4309418 . PMID 25601158.
- ^ Tretyak, VI; Zdesenko, Yu.G. (2002). "Tablas de datos de desintegración beta doble: una actualización". En. Data Nucl. Data Tables . 80 (1): 83–116. Bibcode :2002ADNDT..80...83T. doi :10.1006/adnd.2001.0873.
- ^ Marouli, M.; Pommé, S.; Jobbágy, V.; Van Ammel, R.; Paepen, J.; Stroh, H.; Benedik, L. (2014). "Probabilidades de emisión de partículas alfa de 236 U obtenidas por espectrometría alfa". Applied Radiation and Isotopes . 87 : 292–296. doi :10.1016/j.apradiso.2013.11.020. ISSN 0969-8043. PMID 24309010.
- ^ ab Opciones a corto plazo y prometedoras a largo plazo para el despliegue de energía nuclear basada en torio (PDF) (Informe). Viena: Organismo Internacional de Energía Atómica. 2022.
- ^ ab Forsburg, CW; Lewis, LC (24 de septiembre de 1999). "Usos del uranio-233: ¿Qué se debe conservar para futuras necesidades?" (PDF) . Ornl-6952 . Laboratorio Nacional de Oak Ridge.
- ^ Goffer, Zvi (2006). Química Arqueológica (2ª ed.). Wiley . pag. 106.ISBN 978-0-471-91515-7.
- ^ Zhang, ZY; et al. (2021). "Nuevo isótopo emisor de α 214 U y mejora anormal de la agrupación de partículas α en los isótopos de uranio más ligeros". Physical Review Letters . 126 (15): 152502. arXiv : 2101.06023 . Código Bibliográfico :2021PhRvL.126o2502Z. doi :10.1103/PhysRevLett.126.152502. PMID 33929212. S2CID 231627674 . Consultado el 15 de mayo de 2021 .
- ^ ab Niwase, T.; Watanabe, YX; Hirayama, Y.; et al. (2023). "Descubrimiento del nuevo isótopo 241U y mediciones sistemáticas de alta precisión de la masa atómica de núcleos Pa-Pu ricos en neutrones producidos mediante reacciones de transferencia multinucleónica" (PDF) . Physical Review Letters . 130 (13): 132502-1–132502-6. Bibcode :2023PhRvL.130m2502N. doi :10.1103/PhysRevLett.130.132502. PMID 37067317. S2CID 257976576.
- ^ Mastren, T.; Stein, B. W.; Parker, TG; Radchenko, V.; Copping, R.; Owens, A.; Wyant, LE; Brugh, M.; Kozimor, SA; Noriter, FM; Birnbaum, ER; John, KD; Fassbender, ME (2018). "Separación de protactinio empleando resinas cromatográficas de extracción basadas en azufre". Química analítica . 90 (11): 7012–7017. doi :10.1021/acs.analchem.8b01380. ISSN 0003-2700. OSTI 1440455. PMID 29757620.
- ^ Khuyagbaatar, J.; et al. (11 de diciembre de 2015). "Nuevo isótopo de vida corta 221U y la superficie de masa cerca de N = 126". Physical Review Letters . 115 (24): 242502. Bibcode :2015PhRvL.115x2502K. doi :10.1103/PhysRevLett.115.242502. PMID 26705628. S2CID 12184696.
- ^ "Enriquecimiento de uranio". Laboratorio Nacional de Argonne. Archivado desde el original el 24 de enero de 2007. Consultado el 11 de febrero de 2007 .
- ^ ab Diehl, Peter. "Uranio empobrecido: un subproducto de la cadena nuclear". Fundación Laka. Archivado desde el original el 13 de enero de 2013. Consultado el 31 de julio de 2009 .
- ^ Duarte, FJ ; Hillman, LW, eds. (1990). Principios del láser de colorante. Académico. p. 413. ISBN 978-0-12-222700-4Archivado desde el original el 17 de septiembre de 2010.
- ^ "Conceptos básicos sobre radionúclidos: uranio". Agencia de Protección Ambiental de Estados Unidos. 16 de febrero de 2023. Consultado el 19 de abril de 2023 .
- ^ "ToxFAQ sobre el uranio". Agencia para Sustancias Tóxicas y Registro de Enfermedades. 18 de marzo de 2014. Consultado el 19 de abril de 2023 .
- ^ "CDC – NIOSH Pocket Guide to Chemical Hazards – Uranium (insoluble Compounds, as U)" (Guía de bolsillo de los CDC y NIOSH sobre los peligros químicos: uranio (compuestos insolubles, como U)). Instituto Nacional de Seguridad y Salud Ocupacional . 30 de octubre de 2019 . Consultado el 19 de abril de 2023 .
- ^ Permyakov, Eugene (2009). Metaloproteómica . Hoboken: John Wiley & Sons. pág. 564. ISBN 978-0-470-44774-1.OCLC 609844907 .
- ^ Busby, C. y Schnug, E. (2008). "Aspectos bioquímicos y biofísicos avanzados de la contaminación por uranio". En: De Kok, LJ y Schnug, E. (Eds) Cargas y destino del uranio derivado de fertilizantes . Backhuys Publishers, Leiden, Países Bajos. ISBN 978-90-5782-193-6
- ^ Francis, AJ; Dodge, CJ; McDonald, JA; Halada, GP (2005). "Descontaminación de superficies de acero contaminadas con uranio mediante ácido hidroxicarboxílico con recuperación de uranio". Environmental Science & Technology . 39 (13): 5015–21. Bibcode :2005EnST...39.5015F. doi :10.1021/es048887c. PMID 16053105.
- ^ Gandhi, T. Pushparaj; Sampath, Prasanna Venkatesh; Maliyekkal, Shihabudheen M. (15 de junio de 2022). "Una revisión crítica de la contaminación por uranio en aguas subterráneas: tratamiento y eliminación de lodos". La ciencia del medio ambiente total . 825 : 153947. Bibcode :2022ScTEn.82553947G. doi :10.1016/j.scitotenv.2022.153947. ISSN 1879-1026. PMID 35189244. S2CID 246988421.
- ^ Prusty, Sourav; Somu, Prathap; Sahoo, Jitendra Kumar; Panda, Debasish; Sahoo, Sunil Kumar; Sahoo, Shraban Kumar; Lee, Yong Rok; Jarin, T.; Sundar, L. Syam; Rao, Koppula Srinivas (diciembre de 2022). "Secuestro por adsorción de uranio (VI) nocivo de los recursos hídricos: una revisión exhaustiva". Chemosphere . 308 (Pt 1): 136278. Bibcode :2022Chmsp.30836278P. doi :10.1016/j.chemosphere.2022.136278. ISSN 1879-1298. PMID 36057349. S2CID 251999162.
- ^ Craft, ES; Abu-Qare, AW; Flaherty, MM; Garofolo, MC; Rincavage, HL y Abou-Donia, MB (2004). "Uranio empobrecido y natural: química y efectos toxicológicos" (PDF) . Revista de toxicología y salud ambiental, parte B: revisiones críticas . 7 (4): 297–317. Bibcode :2004JTEHB...7..297C. CiteSeerX 10.1.1.535.5247 . doi :10.1080/10937400490452714. PMID 15205046. S2CID 9357795.
- ^ Agencia para Sustancias Tóxicas y el Registro de Enfermedades (ATSDR) (febrero de 2013). "2. Relevancia para la salud pública" (PDF) . Perfil toxicológico del uranio (informe). Atlanta, GA: Departamento de Salud y Servicios Humanos de los EE. UU., Servicio de Salud Pública. págs. 11–38. CAS# 7440-61-1.
- ^ Hindin, Rita; Brugge, D.; Panikkar, B. (2005). "Teratogenicidad de los aerosoles de uranio empobrecido: una revisión desde una perspectiva epidemiológica". Environ Health . 4 (1): 17. Bibcode :2005EnvHe...4...17H. doi : 10.1186/1476-069X-4-17 . PMC 1242351 . PMID 16124873.
- ^ Arfsten, DP; Still, KR; Ritchie, GD (2001). "Una revisión de los efectos de la exposición al uranio y al uranio empobrecido en la reproducción y el desarrollo fetal". Toxicología y salud industrial . 17 (5–10): 180–91. Bibcode :2001ToxIH..17..180A. doi :10.1191/0748233701th111oa. PMID 12539863. S2CID 25310165.
- ^ Grellier, James; Atkinson, Will; Bérard, Philippe; Bingham, Derek; Birchall, Alan; Blanchardon, Eric; Bull, Richard; Guseva Canu, Irina; Challeton-de Vathaire, Cécile; Cockerill, Rupert; Do, Minh T; Engels, Hilde; Figuerola, Jordi; Foster, Adrian; Holmstock, Luc; Hurtgen, Christian; Laurier, Dominique; Puncher, Matthew; Riddell, Tony; Samson, Eric; Thierry-Chef, Isabelle; Tirmarche, Margot; Vrijheid, Martine; Cardis, Elisabeth (2017). "Riesgo de mortalidad por cáncer de pulmón en trabajadores nucleares por exposición interna a radionucleidos emisores de partículas alfa". Epidemiología . 28 (5): 675–684. doi :10.1097/EDE.0000000000000684. PMC 5540354 . PMID 28520643.
- ^ "Declaración de salud pública sobre el uranio" (PDF) . CDC . Consultado el 5 de mayo de 2023 .
- ^ Exposición al radón de los trabajadores del centro de producción de materias primas para piensos de Fernald. Página revisada: 8 de abril de 2020. Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH) de EE. UU.
- ^ Diagrama de los nucleidos, Comisión de Energía Atómica de Estados Unidos, 1968
- ^ Dart, Richard C. (2004). Toxicología médica. Lippincott Williams & Wilkins. pág. 1468. ISBN 978-0-7817-2845-4.
- ^ ab "Hojas informativas sobre radiación n.º 27, uranio (U)". Departamento de Salud del Estado de Washington, Oficina de Protección Radiológica. 2010. Archivado desde el original el 28 de septiembre de 2011. Consultado el 23 de agosto de 2011 .
Fuentes citadas
- Emsley, John (2001). "Uranio". Los elementos básicos de la naturaleza: una guía de la A a la Z de los elementos. Oxford : Oxford University Press . pp. 476–482. ISBN 978-0-19-850340-8.
- Seaborg, Glenn T. (1968). "Uranio". La enciclopedia de los elementos químicos . Skokie, Illinois : Reinhold Book Corporation. págs. 773–786. LCCN 68029938.
Enlaces externos
- Datos y análisis sobre combustible nuclear de la Administración de Información Energética de Estados Unidos
- Mapas de los yacimientos de uranio en el mundo
- Dittmar, William (1888). . Enciclopedia Británica . vol. XXIV (9ª ed.). pag. 7.
- Bibliografía comentada sobre el uranio de la Biblioteca Digital Alsos
- Banco de datos de sustancias peligrosas de la NLM: uranio radiactivo
- CDC – Guía de bolsillo de NIOSH sobre peligros químicos
- Estudios de casos de la ATSDR en medicina ambiental: toxicidad del uranio Departamento de Salud y Servicios Humanos de EE. UU.
- El uranio en la tabla periódica de vídeos (Universidad de Nottingham)




![Producción mundial de uranio (minas) y demanda[78]](http://upload.wikimedia.org/wikipedia/commons/thumb/7/75/U_production-demand.png/431px-U_production-demand.png)

![Producción de uranio en 2015, en toneladas[82]](http://upload.wikimedia.org/wikipedia/commons/thumb/9/9a/Uranium_production%2C_OWID.svg/425px-Uranium_production%2C_OWID.svg.png)

