Dicloruro de titanoceno
 | |
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC Diclorurobis(η 5 -ciclopentadienil)titanio | |
| Otros nombres dicloruro de titanoceno, diclorobis(ciclopentadienil)titanio(IV) | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| Araña química | |
| Tarjeta informativa de la ECHA | 100.013.669 |
| Número CE |
|
Identificador de centro de PubChem |
|
| Número RTECS |
|
| UNIVERSIDAD | |
| Número de la ONU | 3261 |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C10H10Cl2Ti | |
| Masa molar | 248,96 g/mol |
| Apariencia | sólido rojo brillante |
| Densidad | 1,60 g/cm3 , sólido |
| Punto de fusión | 289 °C (552 °F; 562 K) |
| sl. sol. con hidrólisis | |
| Estructura | |
| Triclínica | |
| Dist. tetraédrica | |
| Peligros [1] | |
| Etiquetado SGA : | |
 | |
| Advertencia | |
| H315 , H335 | |
| P201 , P202 , P261 , P264 , P270 , P271 , P280 , P281 , P301+P310 , P301+P312 , P302+P352 , P304+P340 , P305+P351+P338 , P308+P313 , P312 , P330 , P332+P313 , P337+P313 , P362 , P403+P233 , P405 , P501 | |
| NFPA 704 (rombo cortafuegos) | |
| Compuestos relacionados | |
Compuestos relacionados | Ferroceno Dicloruro de zirconoceno Dicloruro de hafnoceno Dicloruro de vanadoceno Dicloruro de nioboceno Dicloruro de tantaloceno Dicloruro de molibdoceno Dicloruro de tungsteno TiCl 4 |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El dicloruro de titanoceno es un compuesto de organotitanio con la fórmula ( η5 - C5H5 ) 2TiCl2 , comúnmente abreviado como Cp2TiCl2 . Este metaloceno es un reactivo común en la síntesis organometálica y orgánica . Existe como un sólido rojo brillante que se hidroliza lentamente en el aire . [ 2] Muestra actividad antitumoral y fue el primer complejo sin platino en someterse a ensayos clínicos como fármaco de quimioterapia . [3]
Preparación y estructura
Las preparaciones estándar de Cp2TiCl2 comienzan con tetracloruro de titanio . La síntesis original de Wilkinson y Birmingham, utilizando ciclopentadienuro de sodio , [4] todavía se utiliza comúnmente: [5]
- 2 NaC 5 H 5 + TiCl 4 → (C 5 H 5 ) 2 TiCl 2 + 2 NaCl
También se puede preparar utilizando ciclopentadieno recién destilado en lugar de su derivado de sodio: [6]
- 2 C 5 H 6 + TiCl 4 → (C 5 H 5 ) 2 TiCl 2 + 2 HCl
Centrándose en la geometría del centro de Ti, Cp 2 TiCl 2 adopta una geometría tetraédrica distorsionada (considerando a Cp como un ligando monodentado). La distancia Ti-Cl es de 2,37 Å y el ángulo Cl-Ti-Cl es de 95°. [7]
Reacciones
Reacciones de sustitución de haluros
El Cp2TiCl2 sirve como fuente de Cp2Ti2 + . Una amplia gama de nucleófilos desplazará al cloruro. Con NaSH y con sales de polisulfuro , se obtienen los derivados sulfúricos Cp2Ti ( SH ) 2 y Cp2TiS5 . [ 8 ]
El reactivo de Petasis , Cp 2 Ti(CH 3 ) 2 , se prepara a partir de la acción del cloruro de metilmagnesio [9] o metillitio [10] sobre Cp 2 TiCl 2 . Este reactivo es útil para la conversión de ésteres en éteres vinílicos.
El reactivo de Tebbe Cp 2 TiCl(CH 2 )Al(CH 3 ) 2 , surge por la acción de 2 equivalentes Al(CH 3 ) 3 sobre Cp 2 TiCl 2 . [11] [12]
Reacciones que afectan a los ligandos Cp
Se puede eliminar un ligando Cp de Cp 2 TiCl 2 para dar CpTiCl 3 tetraédrico . Esta conversión se puede efectuar con TiCl 4 o por reacción con SOCl 2 . [13]
El complejo sándwich (cicloheptatrienil)(ciclopentadienil)titanio se prepara mediante el tratamiento de dicloruro de titanoceno con cicloheptatrienil de litio. [14]
El titanoceno en sí, TiCp 2 , es tan altamente reactivo que se reorganiza en un dímero de hidruro de Ti III y ha sido objeto de mucha investigación. [15] [16] Este dímero puede atraparse llevando a cabo la reducción de dicloruro de titanoceno en presencia de ligandos; en presencia de benceno , se puede preparar un complejo de fulvaleno , μ(η 5 :η 5 -fulvaleno)-di-(μ-hidrido)-bis(η 5 -ciclopentadieniltitanio), y el solvato resultante se puede caracterizar estructuralmente mediante cristalografía de rayos X. [ 17] El mismo compuesto se había informado anteriormente mediante una reducción de hidruro de litio y aluminio [18] y una reducción de amalgama de sodio [19] de dicloruro de titanoceno, y se estudió mediante RMN 1 H [20] antes de su caracterización definitiva. [15] [16]

Redox
La reducción con zinc produce el dímero de cloruro de bis(ciclopentadienil)titanio(III) en un equilibrio químico mediado por disolvente : [21] [22]

El Cp2TiCl2 es un precursor de los derivados de Ti II . Se han investigado reducciones utilizando reactivo de Grignard y compuestos de alquil litio. Entre los reductores más fáciles de manejar se incluyen Mg, Al o Zn. Las siguientes síntesis demuestran algunos de los compuestos que se pueden generar mediante la reducción de dicloruro de titanoceno en presencia de ligandos aceptores π: [23]
- Cp 2 TiCl 2 + 2 CO + Mg → Cp 2 Ti(CO) 2 + MgCl 2
- Cp2TiCl2 + 2PR3 + Mg → Cp2Ti ( PR3 ) 2 + MgCl2
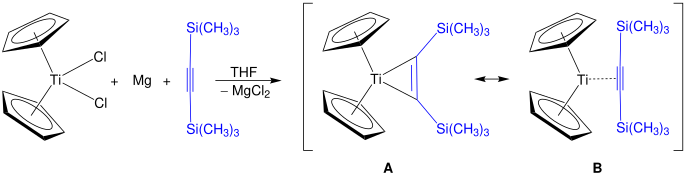
Los derivados alquinos del titanoceno tienen la fórmula (C 5 H 5 ) 2 Ti(C 2 R 2 ) y se conocen los complejos de bencino correspondientes. [24] Una familia de derivados son los titanociclopentadienos. [25] El reactivo de Rosenthal , Cp 2 Ti(η 2 -Me 3 SiC≡CSiMe 3 ), se puede preparar mediante este método. Se muestran dos estructuras, A y B , que son ambas contribuyentes de resonancia a la estructura real del reactivo de Rosenthal. [26]
Los equivalentes de titanoceno reaccionan con alquenil alquinos seguido de carbonilación e hidrólisis para formar ciclopentadienonas bicíclicas, relacionadas con la reacción de Pauson-Khand . [27] Una reacción similar es la ciclización reductiva de enonas para formar el alcohol correspondiente de manera estereoselectiva. [28]
La reducción del dicloruro de titanoceno en presencia de dienos conjugados como el 1,3-butadieno produce complejos de η3 -alil- titanio . [29] Se producen reacciones relacionadas con los diinos. Además, el titanoceno puede catalizar la metátesis de enlaces C–C para formar diinos asimétricos. [25]
Dicloruro de titanoceno como catalizador fotorredox para abrir epóxidos en luz verde. [30]
Derivadas de (C5A mí5)2TiCl2
Se conocen muchos análogos de Cp2TiCl2 . Ejemplos destacados son los derivados metilados en anillo ( C5H4Me ) 2TiCl2 y ( C5Me5 ) 2TiCl2 .
Investigación médica
El dicloruro de titanoceno se investigó como fármaco anticancerígeno. De hecho, fue el primer complejo de coordinación no platino y el primer metaloceno en someterse a un ensayo clínico. [3] [31]
Referencias
- ^ "Resumen de clasificación y etiquetado" . Consultado el 5 de diciembre de 2021 .
- ^ Budaver, S., ed. (1989). El índice Merck (11.ª ed.). Merck & Co., Inc.
- ^ ab Roat-Malone, RM (2007). Química bioinorgánica: un curso breve (2.ª ed.). John Wiley & Sons . págs. 19-20. ISBN 978-0-471-76113-6.
- ^ Wilkinson, G. ; Birmingham, JG (1954). "Compuestos de bis-ciclopentadienilo de Ti, Zr, V, Nb y Ta". J. Am. Chem. Soc. 76 (17): 4281–4284. doi :10.1021/ja01646a008.
- ^ Sara E. Johnson; Taylor A. Bell; Joseph K. West (2022). "Cp 2 TiCl 2 : Síntesis, caracterización, modelado y catálisis". Revista de educación química . 99 (5): 2121–2128. Código Bibliográfico :2022JChEd..99.2121J. doi :10.1021/acs.jchemed.1c01272. S2CID 248287682.
- ^ Birmingham, JM (1965). "Síntesis de compuestos metálicos de ciclopentadienilo". Adv. Organometal. Chem. Avances en química organometálica. 2 : 365–413. doi :10.1016/S0065-3055(08)60082-9. ISBN 9780120311026.
- ^ Clearfield, Abraham; Warner, David Keith; Saldarriaga Molina, Carlos Hermán; Ropal, Ramanathan; Bernal, Ivan; et al. (1975). "Estudios estructurales de complejos (π-C 5 H 5 ) 2 MX 2 y sus derivados. La estructura del dicloruro de bis(π-ciclopentadienil)titanio". Can. J. Chem . 53 (11): 1621–1629. doi :10.1139/v75-228.
- ^ Shaver, Alan; McCall, James M.; Marmolejo, Gabriela (1990). "Ciclometalapolisulfanos (y selanos) de bis(η5-ciclopentadienil) titanio(IV), circonio(IV), molibdeno(IV) y tungsteno(IV)". Ciclometalapolisulfanos (y selanos) de bis( η5 - ciclopentadienil) titanio(IV), circonio(IV), molibdeno(IV) y tungsteno(IV) . Inorganic Syntheses. Vol. 27. págs. 59–65. doi :10.1002/9780470132586.ch11. ISBN 9780470132586.
- ^ Payack, JF; Hughes, DL; Cai, D.; Cottrell, IF; Verhoeven, TR (2002). "Dimetiltitanoceno". Síntesis orgánicas . 79 : 19.
- ^ Claus, K.; Bestian, H. (1962). "Über die Einwirkung von Wasserstoff auf einige metallorganische Verbindungen und Komplexe". Justus Liebigs Ann. Química. 654 : 8-19. doi :10.1002/jlac.19626540103.
- ^ Herrmann, WA (1982). "El puente de metileno". Adv. Organomet. Chem . Avances en química organometálica. 20 : 159–263. doi :10.1016/s0065-3055(08)60522-5. ISBN 9780120311200.
- ^ Straus, DA (2000). " μ- clorobis(ciclopentadienil)(dimetilaluminio) -μ -metilentitanio". Enciclopedia de reactivos para síntesis orgánica . Londres: John Wiley.
- ^ Chandra, K.; Sharma, RK; Kumar, N.; Garg, BS (1980). "Preparación de tricloruro de η 5 -ciclopentadieniltitanio y tricloruro de η 5 -metilciclopentadieniltitanio". Chem. Ind. - Londres . 44 : 288–289.
- ^ Camargo, Luana C.; Briganti, Mateo; Santana, Francielli S.; Stinghen, Danilo; Ribeiro, Ronny R.; Nunes, Giovana G.; Soares, Jaisa F.; Salvadori, Enrico; Chiesa, Mario; Benci, Stefano; Torre, Renato; Sorace, Lorenzo; Totti, Federico; Sessoli, Roberta (2021). "Explorando la ruta organometálica hacia los qubits de espín molecular: el caso [Cp Ti (cot)]". Edición internacional Angewandte Chemie . 60 (5): 2588–2593. doi :10.1002/anie.202009634. hdl : 2318/1765157 . PMID 33051985. S2CID 222351619.
- ^ ab Wailes, PC; Coutts, RSP; Weigold, H. (1974). "Titanoceno". Química organometálica del titanio, el circonio y el hafnio . Academic Press . págs. 229–237. ISBN 9780323156479.
- ^ abc Mehrotra, RC; Singh, A. (2000). "4.3.6 Complejos metálicos del bloque d de η5-ciclopentadienilo". Química organometálica: un enfoque unificado (2.ª ed.). Nueva Delhi: New Age International Publishers. págs. 243–268. ISBN 9788122412581.
- ^ ab Troyanov, Sergei I.; Antropiusová, Helena; Mach, Karel (1992). "Prueba directa de la estructura molecular del titanoceno dimérico; La estructura de rayos X de μ(η 5 :η 5 -fulvaleno)-di-(μ-hidrido)-bis(η 5 -ciclopentadieniltitanio)·1,5 benceno". J. Organomet. Chem. 427 (1): 49–55. doi :10.1016/0022-328X(92)83204-U.
- ^ Antropiusová, Helena; Dosedlová, Alena; Hanus, Vladimir; Karel, Mach (1981). "Preparación de μ-(η 5 :η 5 -Fulvaleno)-di-μ-hidrido-bis(η 5 -ciclopentadieniltitanio) mediante la reducción de Cp 2 TiCl 2 con LiAlH 4 en disolventes aromáticos". Transición cumplida. Química. 6 (2): 90–93. doi :10.1007/BF00626113. S2CID 101189483.
- ^ Cuenca, Tomas; Herrmann, Wolfgang A.; Ashworth, Terence V. (1986). "Química de metales de transición oxófilos. 2. Nuevos derivados del titanoceno y el zirconoceno". Organometallics . 5 (12): 2514–2517. doi :10.1021/om00143a019.
- ^ Lemenovskii, DA; Urazowski, IF; Grishin, Yu K.; Roznyatovsky, VA (1985). " Espectros de RMN de 1 H y estructura electrónica de ligandos de fulvaleno que contienen nioboceno y titanoceno binucleares". J. Organomet. Chem. 290 (3): 301–305. doi :10.1016/0022-328X(85)87293-4.
- ^ Manzer, LE; Mintz, EA; Marks, TJ (1982). "18. Complejos de ciclopentadienilo de titanio (III) y vanadio (III)". Síntesis inorgánica . Vol. 21. págs. 84–86. doi :10.1002/9780470132524.ch18. ISBN. 9780470132524.
{{cite book}}:|journal=ignorado ( ayuda ) - ^ Nugent, William A.; RajanBabu, TV (1988). "Radicales centrados en metales de transición en síntesis orgánica. Ciclización de olefinas epóxicas inducida por titanio(III)". J. Am. Chem. Soc. 110 (25): 8561–8562. doi :10.1021/ja00233a051.
- ^ Kuester, Erik (2002). "Bis(η5-2,4-ciclopentadienil)bis(trimetilfosfina)titanio". Bis(5-2,4-ciclopentadienil)bis(trimetilfosfina)titanio . Enciclopedia de reactivos para síntesis orgánica . John Wiley. doi :10.1002/047084289X.rn00022. ISBN . 0471936235.
- ^ Buchwald, SL; Nielsen, RB (1988). "Complejos metálicos del grupo 4 de bencinas, cicloalquinos, alquinos acíclicos y alquenos". Chem. Rev. 88 (7): 1047–1058. doi :10.1021/cr00089a004.
- ^ ab Rosenthal, Uwe; Pellny, Paul-Michael; Kirchbauer, Frank G.; Burlakov, Vladimir V. (2000). "¿Qué hacen los titanocenos y zirconocenos con diinas y poliinas?". Chem. Rev. 33 (2): 119–129. doi :10.1021/ar9900109. PMID 10673320.
- ^ Rosenthal, Uwe; Burlakov, Vladimir V.; Arndt, Perdita; Baumann, Wolfgang; Spannenberg, Anke (2003). "El complejo titanoceno de bis(trimetilsilil)acetileno: síntesis, estructura y química". Organometallics . 22 (5): 884–900. doi :10.1021/om0208570.
- ^ Hicks, FA; et al. (1999). "Alcance de la reacción intramolecular de tipo Pauson-Khand catalizada por el titanoceno". J. Am. Chem. Soc. 121 (25): 5881–5898. doi :10.1021/ja990682u.
- ^ Kablaoui, NM; Buchwald, SL (1998). "Desarrollo de un método para la ciclización reductiva de enonas mediante un catalizador de titanio". J. Am. Chem. Soc. 118 (13): 3182–3191. doi :10.1021/ja954192n.
- ^ Sato, F.; Urabe, Hirokazu; Okamoto, Sentaro (2000). "Síntesis de complejos de organotitanio a partir de alquenos y alquinos y sus aplicaciones sintéticas". Chem. Rev. 100 (8): 2835–2886. doi :10.1021/cr990277l. PMID 11749307.
- ^ Zhang, Zhenhua; Hilche, Tobías; Slak, Daniel; Rietdijk, Niels R.; Oloyede, Ugochinyere N.; Flores, Robert A.; Gansäuer, Andreas (8 de junio de 2020). "Titanocenos como catalizadores fotoredox mediante irradiación con luz verde". Edición internacional Angewandte Chemie . 59 (24): 9355–9359. doi :10.1002/anie.202001508. ISSN 1433-7851. PMC 7317808 . PMID 32216162.
- ^ Cini, M.; Bradshaw, TD; Woodward, S. (2017). "Uso de complejos de titanio para derrotar al cáncer: la visión desde los hombros de los titanes" (PDF) . Chem. Soc. Rev . 46 (4): 1040–1051. doi :10.1039/C6CS00860G. PMID 28124046. Archivado desde el original (PDF) el 2018-07-19 . Consultado el 2019-07-13 .
Lectura adicional
- Payack, JF; Hughes, DL; Cai, D.; Cottrell, IF; Verhoeven, TR "Titanio dimetiltitanoceno, bis(η5-2,4-ciclopentadien-1-il)dimetil-". Síntesis orgánicas . 79 : 19; Volúmenes recopilados , vol. 10..
- Gambarotta, S.; Floriani, C.; Chiesi-Villa, A.; Guastini, C. (1983). "Ciclopentadienildiclorotitanio(III): un reactivo similar a los radicales libres para reducir los enlaces múltiples azo (N:N) en compuestos azo y diazo". J. Am. Chem. Soc. 105 (25): 7295–7301. doi :10.1021/ja00363a015.
- Chirik, PJ (2010). "Complejos sándwich de metales de transición del grupo 4: todavía frescos después de casi 60 años". Organometallics . 29 (7): 1500–1517. doi :10.1021/om100016p.



