Ácido benzoico
| |||
 | |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido Ácido benzoico [1] | |||
| Nombre sistemático de la IUPAC Ácido bencenocarboxílico | |||
Otros nombres
| |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| 3DMet |
| ||
| 636131 | |||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Banco de medicamentos | |||
| Tarjeta informativa de la ECHA | 100.000.562 | ||
| Número CE |
| ||
| Número E | E210 (conservantes) | ||
| 2946 | |||
| BARRIL | |||
| Malla | ácido benzoico | ||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| C7H6O2 | |||
| Masa molar | 122,123 g/mol | ||
| Apariencia | Sólido cristalino incoloro | ||
| Olor | Olor leve y agradable | ||
| Densidad | 1,2659 g/cm3 ( 15 °C) 1,0749 g/cm3 ( 130 °C) [2] | ||
| Punto de fusión | 122 °C (252 °F; 395 K) [7] | ||
| Punto de ebullición | 250 °C (482 °F; 523 K) [7] | ||
| 1,7 g/l (0 °C) 2,7 g/l (18 °C) 3,44 g/l (25 °C) 5,51 g/l (40 °C) 21,45 g/l (75 °C) 56,31 g/l (100 °C) [2] [3] | |||
| Solubilidad | Soluble en acetona , benceno , CCl4 , CHCl3 , alcohol , éter etílico , hexano , fenilos , amoniaco líquido , acetatos . | ||
| Solubilidad en metanol | 30 g/100 g (−18 °C) 32,1 g/100 g (−13 °C) 71,5 g/100 g (23 °C) [2] | ||
| Solubilidad en etanol | 25,4 g/100 g (−18 °C) 47,1 g/100 g (15 °C) 52,4 g/100 g (19,2 °C) 55,9 g/100 g (23 °C) [2] | ||
| Solubilidad en acetona | 54,2 g/100 g (20 °C) [2] | ||
| Solubilidad en aceite de oliva | 4,22 g/100 g (25 °C) [2] | ||
| Solubilidad en 1,4-dioxano | 55,3 g/100 g (25 °C) [2] | ||
| registro P | 1.87 | ||
| Presión de vapor | 0,16 Pa (25 °C) 0,19 kPa (100 °C) 22,6 kPa (200 °C) [4] | ||
| Acidez (p K a ) |
| ||
| −70,28·10 −6 cm3 / mol | |||
Índice de refracción ( n D ) | 1,5397 (20 °C) 1,504 (132 °C) [2] | ||
| Viscosidad | 1,26 mPa (130 °C) | ||
| Estructura | |||
| Monoclínico | |||
| Planar | |||
| 1,72 D en dioxano | |||
| Termoquímica | |||
Capacidad calorífica ( C ) | 146,7 J/mol·K [4] | ||
Entropía molar estándar ( S ⦵ 298 ) | 167,6 J/mol·K [2] | ||
Entalpía estándar de formación (Δ f H ⦵ 298 ) | −385,2 kJ/mol [2] | ||
Entalpía estándar de combustión (Δ c H ⦵ 298 ) | −3228 kJ/mol [4] | ||
| Peligros | |||
| Seguridad y salud en el trabajo (SST/OHS): | |||
Principales peligros | Irritante | ||
| Etiquetado SGA : | |||
  [8] [8] | |||
| Peligro | |||
| H318 , H335 [8] | |||
| P261 , P280 , P305+P351+P338 [8] | |||
| NFPA 704 (rombo cortafuegos) | |||
| punto de inflamabilidad | 121,5 °C (250,7 °F; 394,6 K) [7] | ||
| 571 °C (1060 °F; 844 K) [7] | |||
| Dosis o concentración letal (LD, LC): | |||
LD 50 ( dosis media ) | 1700 mg/kg (rata, oral) | ||
| Ficha de datos de seguridad (FDS) | J. T. Baker | ||
| Compuestos relacionados | |||
Otros cationes | Benzoato de sodio , Benzoato de potasio | ||
Ácidos carboxílicos relacionados | Ácidos hidroxibenzoicos Ácidos aminobenzoicos Ácidos nitrobenzoicos Ácido fenilacético | ||
Compuestos relacionados | Benzaldehído , alcohol bencílico , cloruro de benzoilo , bencilamina , benzamida , benzonitrilo | ||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El ácido benzoico ( / b ɛ n ˈ z oʊ . ɪ k / ) es un compuesto orgánico sólido blanco (o incoloro) con la fórmula C 6 H 5 COOH , cuya estructura consiste en un anillo de benceno ( C 6 H 6 ) con un sustituyente carboxilo ( −C(=O)OH ) . El grupo benzoilo a menudo se abrevia "Bz" (no debe confundirse con "Bn", que se usa para bencilo ), por lo que el ácido benzoico también se denota como BzOH, ya que el grupo benzoilo tiene la fórmula – C 6 H 5 CO . Es el ácido carboxílico aromático más simple . El nombre se deriva de la goma benzoína , que fue durante mucho tiempo su única fuente.
El ácido benzoico se encuentra de forma natural en muchas plantas [9] y sirve como intermediario en la biosíntesis de muchos metabolitos secundarios . Las sales de ácido benzoico se utilizan como conservantes de alimentos . El ácido benzoico es un precursor importante para la síntesis industrial de muchas otras sustancias orgánicas. Las sales y ésteres del ácido benzoico se conocen como benzoatos ( /ˈbɛnzoʊ.eɪt/ ) .
Historia
El ácido benzoico fue descubierto en el siglo XVI. La destilación en seco de la goma benjuí fue descrita por primera vez por Nostradamus (1556) y luego por Alexius Pedemontanus (1560) y Blaise de Vigenère (1596). [10]
Justus von Liebig y Friedrich Wöhler determinaron la composición del ácido benzoico. [11] Estos últimos también investigaron cómo se relaciona el ácido hipúrico con el ácido benzoico.
En 1875 Salkowski descubrió las propiedades antifúngicas del ácido benzoico, que se utilizó durante mucho tiempo en la conservación de frutos de mora de los pantanos que contenían benzoato . [12] [ disputado – discutir ]
Producción
Preparaciones industriales
El ácido benzoico se produce comercialmente mediante la oxidación parcial del tolueno con oxígeno . El proceso está catalizado por naftenatos de cobalto o manganeso . El proceso utiliza materiales abundantes y se lleva a cabo con un alto rendimiento. [13]
El primer proceso industrial implicó la reacción del benzotricloruro (triclorometilbenceno) con hidróxido de calcio en agua, utilizando hierro o sales de hierro como catalizador . El benzoato de calcio resultante se convierte en ácido benzoico con ácido clorhídrico . El producto contiene cantidades significativas de derivados clorados del ácido benzoico. Por esta razón, el ácido benzoico para consumo humano se obtuvo por destilación en seco de la goma de benzoína . En la actualidad, el ácido benzoico de calidad alimentaria se produce de forma sintética.
Síntesis de laboratorio
El ácido benzoico es barato y se consigue fácilmente, por lo que su síntesis en laboratorio se practica principalmente por su valor pedagógico. Es una preparación habitual en los estudiantes universitarios.
El ácido benzoico se puede purificar mediante recristalización en agua debido a su alta solubilidad en agua caliente y su baja solubilidad en agua fría. La evitación de disolventes orgánicos para la recristalización hace que este experimento sea particularmente seguro. Este proceso suele dar un rendimiento de alrededor del 65 %. [14]
Por hidrólisis
Al igual que otros nitrilos y amidas , el benzonitrilo y la benzamida pueden hidrolizarse a ácido benzoico o su base conjugada en condiciones ácidas o básicas.
Del reactivo de Grignard
El bromobenceno se puede convertir en ácido benzoico mediante la "carboxilación" del intermediario bromuro de fenilmagnesio . [15] Esta síntesis ofrece un ejercicio conveniente para que los estudiantes realicen una reacción de Grignard , una clase importante de reacción de formación de enlaces carbono-carbono en la química orgánica. [16] [17] [18] [19] [20]
Oxidación de compuestos bencílicos
El alcohol bencílico [21] , el cloruro de bencilo y prácticamente todos los derivados del bencilo se oxidan fácilmente a ácido benzoico.
Usos
El ácido benzoico se consume principalmente en la producción de fenol por descarboxilación oxidativa a 300−400 °C: [22]
La temperatura requerida se puede reducir a 200 °C mediante la adición de cantidades catalíticas de sales de cobre (II). El fenol se puede convertir en ciclohexanol , que es un material de partida para la síntesis de nailon .
Precursor de los plastificantes
Los plastificantes de benzoato , como los ésteres de glicol, dietilenglicol y trietilenglicol, se obtienen por transesterificación del benzoato de metilo con el diol correspondiente . [22] Estos plastificantes, que se utilizan de forma similar a los derivados del éster de ácido tereftálico , representan alternativas a los ftalatos . [22]
Precursor del benzoato de sodio y conservantes relacionados
El ácido benzoico y sus sales se utilizan como conservantes de alimentos , representados por los números E E210 , E211 , E212 y E213 . El ácido benzoico inhibe el crecimiento de moho , levadura [23] y algunas bacterias . Se añade directamente o se crea a partir de reacciones con su sal de sodio , potasio o calcio . El mecanismo comienza con la absorción de ácido benzoico en la célula. Si el pH intracelular cambia a 5 o menos, la fermentación anaeróbica de la glucosa a través de la fosfofructoquinasa disminuye en un 95%. La eficacia del ácido benzoico y el benzoato depende, por tanto, del pH del alimento. [24] El ácido benzoico, los benzoatos y sus derivados se utilizan como conservantes de alimentos y bebidas ácidas como zumos de frutas cítricas ( ácido cítrico ), bebidas gaseosas ( dióxido de carbono ), refrescos ( ácido fosfórico ), encurtidos ( vinagre ) y otros alimentos acidificados.
Las concentraciones típicas de ácido benzoico como conservante en los alimentos oscilan entre el 0,05 y el 0,1 %. Los alimentos en los que se puede utilizar ácido benzoico y los niveles máximos para su aplicación están controlados por las leyes alimentarias locales. [25] [26]
Se ha expresado preocupación por la posibilidad de que el ácido benzoico y sus sales puedan reaccionar con el ácido ascórbico (vitamina C) presente en algunos refrescos, formando pequeñas cantidades de benceno cancerígeno . [27]
Medicinal
El ácido benzoico es un componente de la pomada de Whitfield que se utiliza para el tratamiento de enfermedades fúngicas de la piel como la tiña y el pie de atleta . [28] [29] Como componente principal de la goma de benjuí , el ácido benzoico también es un ingrediente importante tanto en la tintura de benjuí como en el bálsamo de Friar. Estos productos tienen una larga historia de uso como antisépticos tópicos y descongestionantes inhalatorios .
El ácido benzoico se utilizó como expectorante , analgésico y antiséptico a principios del siglo XX. [30]
Usos de nicho y de laboratorio
En los laboratorios de enseñanza, el ácido benzoico es un estándar común para calibrar un calorímetro de bomba . [31]
Biología y efectos sobre la salud
El ácido benzoico se encuentra de forma natural, al igual que sus ésteres, en muchas especies de plantas y animales. Se encuentran cantidades apreciables en la mayoría de las bayas (alrededor del 0,05%). Las frutas maduras de varias especies de Vaccinium (p. ej., arándano rojo , V. vitis macrocarpon ; arándano azul , V. myrtillus ) contienen hasta un 0,03-0,13 % de ácido benzoico libre. El ácido benzoico también se forma en las manzanas después de la infección con el hongo Nectria galligena . Entre los animales, el ácido benzoico se ha identificado principalmente en especies omnívoras o fitófagas, p. ej., en las vísceras y músculos del perdiz nival ( Lagopus muta ), así como en las secreciones glandulares de los bueyes almizcleros machos ( Ovibos moschatus ) o de los elefantes asiáticos ( Elephas maximus ). [32] La goma de benjuí contiene hasta un 20 % de ácido benzoico y un 40 % de ésteres de ácido benzoico. [33]
En términos de su biosíntesis , el benzoato se produce en plantas a partir del ácido cinámico . [34] Se ha identificado una vía a partir del fenol a través del 4-hidroxibenzoato . [35]
Reacciones
Las reacciones del ácido benzoico pueden ocurrir en el anillo aromático o en el grupo carboxilo .
Anillo aromático
La reacción de sustitución aromática electrofílica se llevará a cabo principalmente en la posición 3 debido al grupo carboxílico que atrae electrones ; es decir, el ácido benzoico es metadirector . [ 36]
Grupo carboxilo
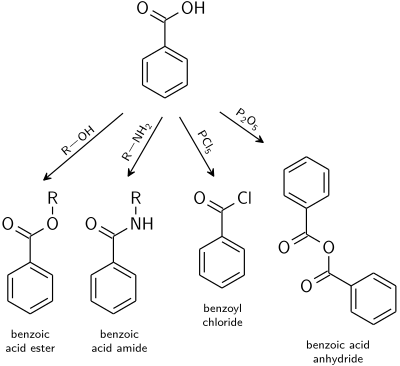
Las reacciones típicas de los ácidos carboxílicos se aplican también al ácido benzoico. [22]
- Los ésteres de benzoato son el producto de la reacción catalizada por ácido con alcoholes .
- Las amidas de ácido benzoico generalmente se preparan a partir de cloruro de benzoilo .
- La deshidratación a anhídrido benzoico se induce con anhídrido acético o pentóxido de fósforo .
- Los derivados de ácido altamente reactivos, como los haluros de ácido, se obtienen fácilmente mezclándolos con agentes de halogenación como cloruros de fósforo o cloruro de tionilo .
- Los ortoésteres se pueden obtener mediante la reacción de alcoholes en condiciones ácidas libres de agua con benzonitrilo .
- La reducción a benzaldehído y alcohol bencílico es posible utilizando DIBAL-H , LiAlH 4 o borohidruro de sodio .
- La descarboxilación a benceno se puede realizar calentando en quinolina en presencia de sales de cobre. La descarboxilación de Hunsdiecker se puede lograr calentando la sal de plata.
Seguridad y metabolismo de los mamíferos
Se excreta como ácido hipúrico . [37] El ácido benzoico es metabolizado por la butirato-CoA ligasa en un producto intermedio, benzoil-CoA , [38] que luego es metabolizado por la glicina N -aciltransferasa en ácido hipúrico. [39] Los humanos metabolizan el tolueno que también se excreta como ácido hipúrico. [40]
Para los seres humanos, el Programa Internacional de Seguridad Química (IPCS) de la Organización Mundial de la Salud sugiere que una ingesta tolerable provisional sería de 5 mg/kg de peso corporal por día. [32] Los gatos tienen una tolerancia significativamente menor al ácido benzoico y sus sales que las ratas y los ratones . La dosis letal para los gatos puede ser tan baja como 300 mg/kg de peso corporal. [41] La DL50 oral para ratas es de 3040 mg/kg, para ratones es de 1940–2263 mg/kg. [ 32]
En Taipei , Taiwán, una encuesta de salud urbana realizada en 2010 encontró que el 30% de los productos alimenticios secos y encurtidos tenían ácido benzoico. [42]
Véase también
- Niacina : compuesto orgánico y una forma de vitamina B3
Referencias
- ^ Nomenclatura de la química orgánica: recomendaciones de la IUPAC y nombres preferidos 2013 (Libro azul) . Cambridge: The Royal Society of Chemistry . 2014. pág. 745. doi :10.1039/9781849733069-00648. ISBN . 978-0-85404-182-4.
- ^ abcdefghij "ácido benzoico". chemister.ru . Consultado el 24 de octubre de 2018 .
- ^ Seidell, Atherton; Linke, William F. (1952). Solubilidades de compuestos inorgánicos y orgánicos. Van Nostrand.
- ^ abc Ácido benzoico en Linstrom, Peter J.; Mallard, William G. (eds.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69 , Instituto Nacional de Estándares y Tecnología, Gaithersburg (MD) (consultado el 23 de mayo de 2014)
- ^ Harris, Daniel (2010). Análisis químico cuantitativo (8.ª ed.). Nueva York: WH Freeman and Company. pp. AP12. ISBN 9781429254366.
- ^ Olmstead, William N.; Bordwell, Frederick G. (1980). "Constantes de asociación de pares iónicos en dimetilsulfóxido". The Journal of Organic Chemistry . 45 (16): 3299–3305. doi :10.1021/jo01304a033.
- ^ abcd Registro en la base de datos de sustancias GESTIS del Instituto de Seguridad y Salud Ocupacional
- ^ abc Sigma-Aldrich Co. , Ácido benzoico. Consultado el 23 de mayo de 2014.
- ^ "Los científicos descubren los últimos pasos para la creación de ácido benzoico en plantas". Purdue Agriculture News.
- ^ Neumüller OA (1988). Römpps Chemie-Lexikon (6 ed.). Stuttgart: Frankh'sche Verlagshandlung. ISBN 978-3-440-04516-9.OCLC 50969944 .
- ^ Liebig J ; Wöhler F (1832). "Untersuchungen über das Radikal der Benzoesäure". Annalen der Chemie . 3 (3): 249–282. doi :10.1002/jlac.18320030302. hdl : 2027/hvd.hxdg3f .
- ^ SalkowskiE (1875). Berl Klin Wochenschr . 12 : 297–298.
{{cite journal}}: Falta o está vacío|title=( ayuda ) - ^ Wade, Leroy G. (2014). Química orgánica (Nueva edición internacional de Pearson). Harlow: Pearson Education Limited. pág. 985. ISBN 978-1-292-02165-2.
- ^ DD Perrin; WLF Armarego (1988). Purificación de productos químicos de laboratorio (3.ª ed.). Pergamon Press. pp. 94. ISBN 978-0-08-034715-8.
- ^ Donald L. Pavia (2004). Introducción a las técnicas orgánicas de laboratorio: un enfoque a pequeña escala . Thomson Brooks/Cole. págs. 312–314. ISBN 978-0-534-40833-6.
- ^ Shirley, DA (1954). "La síntesis de cetonas a partir de haluros de ácido y compuestos organometálicos de magnesio, zinc y cadmio". Org. React. 8 : 28–58.
- ^ Huryn, DM (1991). "Carbaniones de cationes alcalinos y alcalinotérreos: (ii) Selectividad de las reacciones de adición de carbonilo". En Trost, BM ; Fleming, I. (eds.). Síntesis orgánica integral, volumen 1: Adiciones a enlaces π C—X, parte 1 . Elsevier Science . págs. 49–75. doi :10.1016/B978-0-08-052349-1.00002-0. ISBN 978-0-08-052349-1.
- ^ "La reacción de Grignard. Preparación del ácido benzoico" (PDF) . Portland Community College. Archivado desde el original (PDF) el 26 de febrero de 2015. Consultado el 12 de marzo de 2015 .>
- ^ "Experimento 9: Síntesis de ácido benzoico mediante carbonilación de un reactivo de Grignard" (PDF) . Universidad de Wisconsin-Madison. Archivado desde el original (PDF) el 23 de septiembre de 2015 . Consultado el 12 de marzo de 2015 .
- ^ "Experimento 3: Preparación de ácido benzoico" (PDF) . Universidad de Towson. Archivado desde el original (PDF) el 13 de abril de 2015. Consultado el 12 de marzo de 2015 .>
- ^ Santonastaso, Marco; Freakley, Simon J.; Miedziak, Peter J.; Brett, Gemma L.; Edwards, Jennifer K.; Hutchings, Graham J. (21 de noviembre de 2014). "Oxidación de alcohol bencílico utilizando peróxido de hidrógeno generado in situ". Investigación y desarrollo de procesos orgánicos . 18 (11): 1455–1460. doi :10.1021/op500195e. ISSN 1083-6160.
- ^ abcd Maki, Takao; Takeda, Kazuo (2000). "Ácido benzoico y derivados". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a03_555. ISBN . 978-3527306732..
- ^ AD Warth (1 de diciembre de 1991). "Mecanismo de acción del ácido benzoico sobre Zygosaccharomyces bailii: efectos sobre los niveles de metabolitos glucolíticos, producción de energía y pH intracelular". Appl Environ Microbiol . 57 (12): 3410–4. Bibcode :1991ApEnM..57.3410W. doi :10.1128/AEM.57.12.3410-3414.1991. PMC 183988 . PMID 1785916.
- ^ Pastrorova I, de Koster CG, Boom JJ (1997). "Estudio analítico de ácidos benzoico y cinámico libres y unidos a ésteres de resinas de goma benzoína mediante cromatografía de gases-espectrometría de masas (GC-MS) HPLC-frit FAB-MS". Phytochem Anal . 8 (2): 63–73. doi :10.1002/(SICI)1099-1565(199703)8:2<63::AID-PCA337>3.0.CO;2-Y.
- ^ Detalles del grupo de aditivos alimentarios en línea de la GSFA: Benzoatos (2006) Archivado el 26 de septiembre de 2007 en Wayback Machine
- ^ DIRECTIVA 95/2/CE DEL PARLAMENTO EUROPEO Y DEL CONSEJO de 20 de febrero de 1995 relativa a aditivos alimentarios distintos de los colorantes y edulcorantes (Las versiones Consleg no contienen los últimos cambios en una ley) Archivado el 19 de abril de 2003 en Wayback Machine.
- ^ "Indicaciones de la posible formación de benceno a partir de ácido benzoico en alimentos, dictamen pericial del BfR n.º 013/2006" (PDF) . Instituto Federal Alemán de Evaluación de Riesgos. 1 de diciembre de 2005. Archivado (PDF) desde el original el 26 de abril de 2006. Consultado el 30 de marzo de 2022 .
- ^ "Ungüento Whitfield". Archivado desde el original el 9 de octubre de 2007. Consultado el 15 de octubre de 2007 .
- ^ Charles Owens Wilson; Ole Gisvold; John H. Block (2004). Wilson y Gisvold's Textbook of Organic Medicinal and Pharmaceutical . Lippincott Williams & Wilkins. págs. 234. ISBN 978-0-7817-3481-3.
- ^ Lillard, Benjamin (1919). "Troches de ácido benzoico". Revista farmacéutica y de farmacia práctica .
- ^ Experimento 2: Uso de calorimetría de bombas para determinar la energía de resonancia del benceno Archivado el 9 de marzo de 2012 en Wayback Machine
- ^ abc "Documento de evaluación química internacional conciso 26: ÁCIDO BENZOICO Y BENZOATO DE SODIO".
- ^ Tomokuni K, Ogata M (1972). "Determinación colorimétrica directa de ácido hipúrico en orina". Clin Chem . 18 (4): 349–351. doi : 10.1093/clinchem/18.4.349 . PMID 5012256.
- ^ Vogt, T. (2010). "Biosíntesis de fenilpropanoides". Molecular Plant . 3 : 2–20. doi : 10.1093/mp/ssp106 . PMID 20035037.
- ^ Juteau, Pierre; Valérie Côté; Marie-Francia Duckett; Réjean Beaudet; François Lépine; Ricardo Villemur; Jean-Guy Bisaillon (enero de 2005). "Cryptanaerobacter phenolicus gen. nov., sp. nov., un anaerobio que transforma el fenol en benzoato mediante 4-hidroxibenzoato". Revista Internacional de Microbiología Sistemática y Evolutiva . 55 (1): 245–250. doi : 10.1099/ijs.0.02914-0 . PMID 15653882.
- ^ Brewster, RQ; Williams, B.; Phillips, R. (1955). "Ácido 3,5-dinitrobenzoico". Síntesis orgánicas; Volúmenes recopilados , vol. 3, pág. 337.
- ^ Panel de expertos en revisión de ingredientes cosméticos Bindu Nair (2001). "Informe final sobre la evaluación de seguridad del alcohol bencílico, el ácido benzoico y el benzoato de sodio". Int J Tox . 20 (Supl. 3): 23–50. doi :10.1080/10915810152630729. PMID 11766131. S2CID 13639993.
- ^ "butirato-CoA ligasa". BRENDA . Universidad Técnica de Braunschweig . Consultado el 7 de mayo de 2014 .Sustrato/Producto
- ^ "glicina N-aciltransferasa". BRENDA . Universidad Técnica de Braunschweig . Consultado el 7 de mayo de 2014 .Sustrato/Producto
- ^ Krebs HA, Wiggins D, Stubbs M (1983). "Estudios sobre el mecanismo de la acción antifúngica del benzoato". Biochem J . 214 (3): 657–663. doi :10.1042/bj2140657. PMC 1152300 . PMID 6226283.
- ^ Bedford PG, Clarke EG (1972). "Intoxicación experimental con ácido benzoico en gatos". Vet Rec . 90 (3): 53–58. doi :10.1136/vr.90.3.53 (inactivo el 11 de septiembre de 2024). PMID 4672555. S2CID 2553612.
{{cite journal}}: CS1 maint: DOI inactivo a partir de septiembre de 2024 ( enlace ) - ^ Chen, Jian; YL Kao (18 de enero de 2010). "Casi el 30% de los alimentos secos y encurtidos no superan las inspecciones de seguridad". The China Post .
Enlaces externos
- Ficha internacional de seguridad química 0103
- Informe de evaluación inicial de los pequeños Estados insulares en desarrollo sobre el ácido benzoico de la Organización para la Cooperación y el Desarrollo Económicos (OCDE)
- Tierra química