Melanopsina
| OPN4 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Alias | OPN4 , MOP, opsina 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificaciones externas | OMIM : 606665; MGI : 1353425; HomoloGene : 69152; Tarjetas genéticas : OPN4; OMA :OPN4 - ortólogos | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wikidatos | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
La melanopsina es un tipo de fotopigmento que pertenece a una familia más grande de proteínas retinianas sensibles a la luz llamadas opsinas y codificadas por el gen Opn4 . [5] En la retina de los mamíferos , hay dos categorías adicionales de opsinas, ambas involucradas en la formación de imágenes visuales: rodopsina y fotopsina (tipos I, II y III) en las células fotorreceptoras de bastones y conos , respectivamente.
En los seres humanos, la melanopsina se encuentra en las células ganglionares de la retina intrínsecamente fotosensibles (ipRGC). [6] También se encuentra en el iris de ratones y primates. [7] La melanopsina también se encuentra en ratas, anfioxos y otros cordados. [8] Las ipRGC son células fotorreceptoras que son particularmente sensibles a la absorción de luz visible de longitud de onda corta (azul) y comunican información directamente al área del cerebro llamada núcleo supraquiasmático (SCN), también conocido como el "reloj corporal" central, en los mamíferos. [9] La melanopsina desempeña un papel importante no formador de imágenes en el establecimiento de ritmos circadianos, así como otras funciones. Las mutaciones en el gen Opn4 pueden provocar trastornos clínicos, como el trastorno afectivo estacional (TAE). [10] Según un estudio, se ha encontrado melanopsina en dieciocho sitios en el cerebro humano (fuera del tracto retinohipotalámico), intracelularmente, en un patrón granular, en la corteza cerebral, la corteza cerebelosa y varias regiones filogenéticamente antiguas, principalmente en el soma neuronal, no en los núcleos. [11] La melanopsina también se expresa en los conos humanos. Sin embargo, solo entre el 0,11% y el 0,55% de los conos humanos expresan melanopsina y se encuentran exclusivamente en las regiones periféricas de la retina. [12] La retina periférica humana detecta la luz a altas intensidades, lo que se explica mejor por cuatro clases diferentes de fotopigmentos. [13]
Descubrimiento

La melanopsina fue descubierta por Ignacio Provencio como una nueva opsina en los melanóforos , o células cutáneas sensibles a la luz, de la rana africana de uñas en 1998. [14] Un año después, los investigadores descubrieron que los ratones sin bastones ni conos , las células implicadas en la visión formadora de imágenes, todavía se sincronizaban con un ciclo de luz-oscuridad. [15] Esta observación llevó a la conclusión de que ni los bastones ni los conos, ubicados en la retina externa , son necesarios para el sincronización circadiana y que existe una tercera clase de fotorreceptores en el ojo de los mamíferos. [5] Provencio y sus colegas descubrieron en 2000 que la melanopsina también está presente en la retina del ratón, específicamente en las células ganglionares , y que media en tareas fotorreceptivas no visuales. [16] La melanopsina está codificada por el gen Opn4 con ortólogos en una variedad de organismos. [5]
Se descubrió que estas células ganglionares de la retina eran fotosensibles de forma innata, ya que respondían a la luz incluso cuando estaban aisladas, y por eso se las denominó células ganglionares de la retina intrínsecamente fotosensibles (ipRGC) . [17] Constituyen una tercera clase de células fotorreceptoras en la retina de los mamíferos, además de los conos y bastones ya conocidos, y se demostró que eran el principal conducto de entrada de luz para el fotoentrenamiento circadiano . [16] De hecho, más tarde Satchidananda Panda y sus colegas demostraron que el pigmento melanopsina puede estar involucrado en el arrastre de un oscilador circadiano a los ciclos de luz en los mamíferos, ya que la melanopsina era necesaria para que los ratones ciegos respondieran a la luz. [18]
Distribución de especies
Los mamíferos tienen genes de melanopsina ortólogos llamados Opn4m , que se derivan de una rama de la familia Opn4 , y están conservados aproximadamente en un 50-55%. [19] Sin embargo, los vertebrados no mamíferos, incluidos los pollos y el pez cebra, tienen otra versión del gen de melanopsina, Opn4x , que parece tener un linaje distinto que divergió de Opn4m hace unos 360 millones de años. [20] Los mamíferos perdieron el gen Opn4x relativamente temprano en su evolución, lo que llevó a una reducción general en la capacidad fotosensorial. Se cree que este evento puede explicarse por el hecho de que esto ocurrió durante la época en la que los mamíferos nocturnos estaban evolucionando. [19]
Estructura
El gen de la melanopsina humana, opn4 , se expresa en ipRGC , que comprende solo el 1-2% de las RGC en la retina interna de los mamíferos, como estudiaron Samer Hattar y colegas. [9] El gen abarca aproximadamente 11,8 kb y está mapeado en el brazo largo del cromosoma 10. El gen incluye nueve intrones y diez exones en comparación con los cuatro a siete exones que se encuentran típicamente en otras opsinas humanas. [16] En vertebrados no mamíferos, la melanopsina se encuentra en un subconjunto más amplio de células de la retina, así como en estructuras fotosensibles fuera de la retina, como el músculo del iris del ojo, las regiones cerebrales profundas, la glándula pineal y la piel. [19] Los parálogos de Opn4 incluyen OPN1LW , OPN1MW , rodopsina y encefalopsina . [21]
La melanopsina, como todas las demás opsinas animales (por ejemplo, la rodopsina ), es un receptor acoplado a proteína G (GPCR) . La proteína melanopsina tiene un dominio N-terminal extracelular , un dominio C-terminal intracelular y siete hélices alfa que se extienden a través de la membrana plasmática. [14] La séptima hélice tiene una lisina que corresponde a Lys296 7.43 en la rodopsina bovina [14] y que se conserva en casi todas las opsinas. [22] Esta lisina se une covalentemente al retinal a través de una base de Schiff , [23] [24] que hace que la melanopsina sea sensible a la luz. De hecho, esto se elimina si la lisina se reemplaza por una alanina . [25]
La melanopsina está más estrechamente relacionada con las opsinas visuales de invertebrados , que son opsinas rabdoméricas, que con las opsinas visuales de vertebrados , que son opsinas clarias. [14] [26] [27] Esto también se refleja en la cascada de señalización descendente , la melanopsina se acopla en ipRGC a las proteínas G G(q) , G(11) y G(14) , que son todas del tipo G(q) . [28] De hecho, pueden reemplazarse funcionalmente entre sí, ya que la eliminación de solo dos de ellas no tiene efecto fenotípico . [29] Las proteínas G activan la fosfolipasa C PLCB4 , [7] que hace que los canales TRP TRPC6 y TRPC7 medien para abrirse de manera que la célula se despolarice . [17] [7] Esto es como en las células fotorreceptoras del ojo de Drosophila , y en contraste con las células de conos y bastones de vertebrados , donde la fototransducción eventualmente hace que las células se hiperpolaricen . [30] Al igual que otras opsinas rabdoméricas, la melanopsina tiene actividad fotoisomerasa intrínseca . [31]
Función
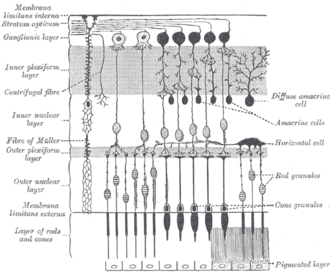
Las células ganglionares que contienen melanopsina, [32] al igual que los bastones y los conos, exhiben adaptación tanto a la luz como a la oscuridad ; ajustan su sensibilidad de acuerdo con la historia reciente de exposición a la luz. [33] Sin embargo, mientras que los bastones y los conos son responsables de la recepción de imágenes, patrones, movimiento y color, las ipRGC que contienen melanopsina contribuyen a varias respuestas reflejas del cerebro y el cuerpo a la presencia de luz. [17]
Se han probado en ratones pruebas de la capacidad de detección de luz fisiológica de la melanopsina. Una línea celular de ratón que normalmente no es fotosensible, Neuro-2a , se vuelve fotosensible mediante la adición de melanopsina humana. La fotorrespuesta es selectivamente sensible a la luz de longitud de onda corta (absorción máxima de ~479 nm), [34] [35] y tiene una función intrínseca de regeneración de la fotoisomerasa que se desplaza cromáticamente a longitudes de onda más largas. [36]
Los fotorreceptores de melanopsina son sensibles a una variedad de longitudes de onda y alcanzan una absorción máxima de luz en longitudes de onda de luz azul de alrededor de 480 nanómetros. [37] Otras longitudes de onda de luz activan el sistema de señalización de melanopsina con una eficiencia decreciente a medida que se alejan de los 480 nm óptimos. Por ejemplo, las longitudes de onda más cortas de alrededor de 445 nm (más cercanas al violeta en el espectro visible ) son la mitad de efectivas para la estimulación de los fotorreceptores de melanopsina que la luz a 480 nm. [37]
La melanopsina presente en el iris de algunos mamíferos, principalmente nocturnos, cierra el iris cuando se expone a la luz. Este reflejo pupilar local a la luz (PLR) no se encuentra presente en los primates, aunque sus iris expresan melanopsina. [7]
Mecanismo
Cuando la luz con una frecuencia apropiada entra en el ojo, activa la melanopsina contenida en las células ganglionares de la retina intrínsecamente fotosensibles (ipRGC), lo que desencadena un potencial de acción . Estas señales eléctricas neuronales viajan a través de los axones neuronales hasta objetivos cerebrales específicos, como el centro de control pupilar llamado núcleo pretectal olivar (OPN) del mesencéfalo. En consecuencia, la estimulación de la melanopsina en las ipRGC media las respuestas conductuales y fisiológicas a la luz, como la constricción de la pupila y la inhibición de la liberación de melatonina de la glándula pineal . [38] [39] Las ipRGC en la retina de los mamíferos son un extremo del tracto retinohipotalámico que se proyecta al núcleo supraquiasmático (SCN) del hipotálamo . El núcleo supraquiasmático se describe a veces como el "reloj maestro" del cerebro, [40] ya que mantiene el ritmo circadiano y las señales nerviosas de las ipRGC al SCN sincronizan el ritmo circadiano interno con la salida y la puesta del sol. [9] El SCN también recibe información de bastones y conos a través del tracto retinohipotalámico, por lo que la información de los tres tipos de células fotosensibles (bastones, conos e ipRGC) en la retina de los mamíferos se transmite al (SCN) SCN. [41]
Se cree que las células ganglionares que contienen melanopsina influyen en estos objetivos al liberar los neurotransmisores glutamato y polipéptido activador de la adenilato ciclasa pituitaria (PACAP) desde sus terminales axónicas. [42] Las células ganglionares que contienen melanopsina también reciben información de bastones y conos que pueden aumentar la información de estas vías.
Efectos sobre el ritmo circadiano
La melanopsina cumple una función importante en el fotoentrenamiento de los ritmos circadianos en los mamíferos. Un organismo fotoentrenado ha alineado su actividad con un ciclo de aproximadamente 24 horas, el ciclo solar en la Tierra. [43] En los mamíferos, los axones que expresan melanopsina se dirigen al núcleo supraquiasmático (NSQ) a través del tracto retinohipotalámico (RTH). [9]
En los mamíferos, el ojo es el principal órgano fotosensible para la transmisión de señales luminosas al cerebro. Sin embargo, los humanos ciegos aún pueden adaptarse al ciclo de luz-oscuridad ambiental, a pesar de no tener una percepción consciente de la luz. Un estudio expuso a sujetos a una luz brillante durante un período prolongado de tiempo y midió sus concentraciones de melatonina . La melatonina no solo se suprimió en humanos sin discapacidad visual, sino también en participantes ciegos, lo que sugiere que la vía fótica utilizada por el sistema circadiano está funcionalmente intacta a pesar de la ceguera. [44] Por lo tanto, los médicos ya no practican la enucleación de pacientes ciegos, o la extirpación de los ojos al nacer, ya que los ojos juegan un papel crítico en el fotoentrenamiento del marcapasos circadiano.
En razas mutantes de ratones que carecían solo de bastones, solo de conos o de ambos, todas las razas de ratones todavía se adaptaron a los estímulos de luz cambiantes en el entorno, pero con una respuesta limitada, lo que sugiere que los bastones y los conos no son necesarios para el fotoentrenamiento circadiano y que el ojo de los mamíferos debe tener otro fotopigmento necesario para la regulación del reloj circadiano . [15]
Los ratones deficientes en melanopsina muestran un fotoentrenamiento reducido. En comparación con los ratones de tipo salvaje que expresaban melanopsina normalmente, se observaron déficits en los cambios de fase inducidos por la luz en la actividad de locomoción en ratones sin melanopsina ( Opn4 -/- ). [18] Estos ratones deficientes en melanopsina no perdieron completamente sus ritmos circadianos, ya que aún podían sincronizarse con estímulos ambientales cambiantes, aunque más lentamente de lo normal. [45] Esto indicó que, aunque la melanopsina es suficiente para el entrenamiento, debe trabajar en conjunto con otros fotopigmentos para una actividad de fotoentrenamiento normal. Los ratones triple mutantes que no tenían bastones, conos ni melanopsina muestran una pérdida completa de los ritmos circadianos, por lo que los tres fotopigmentos en estos fotorreceptores, rodopsina , fotopsina y melanopsina, son necesarios para el fotoentrenamiento. [46] Por lo tanto, existe una redundancia funcional entre los tres fotopigmentos en la vía de fotoentrenamiento de los mamíferos. La eliminación de un solo fotopigmento no elimina la capacidad del organismo de adaptarse a los ciclos de luz-oscuridad ambientales, pero sí reduce la intensidad de la respuesta.
Regulación
La melanopsina sufre una fosforilación en su cola carboxicelular intracelular como una forma de desactivar su función. En comparación con otras opsinas, la melanopsina tiene una cola carboxi inusualmente larga que contiene 37 sitios de aminoácidos de serina y treonina que podrían sufrir fosforilación. [47] Sin embargo, un grupo de siete aminoácidos es suficiente para desactivar la melanopsina del pez cebra. Estos sitios se desfosforilan cuando la melanopsina se expone a la luz y son únicos de los que regulan la rodopsina. [48] Son importantes para la respuesta adecuada a los iones de calcio en las ipRGC; la falta de sitios de fosforilación funcionales, particularmente en la serina-381 y la serina-398, reduce la respuesta de la célula al influjo de iones de calcio inducido por la luz cuando se abren los canales de iones de calcio dependientes del voltaje. [49]
En términos del gen Opn4, la dopamina (DA) es un factor en la regulación del ARNm de la melanopsina en las ipRGC. [50]
Importancia clínica
El descubrimiento del papel de la melanopsina en la visión sin formación de imágenes ha dado lugar a un crecimiento de la optogenética . Este campo ha demostrado ser prometedor en aplicaciones clínicas, incluido el tratamiento de enfermedades oculares humanas como la retinitis pigmentosa y la diabetes . [51] Una mutación sin sentido en Opn4, P10L, se ha relacionado con el 5% de los pacientes con trastorno afectivo estacional (TAE). [10] Se trata de una afección en la que las personas experimentan pensamientos depresivos en invierno debido a la disminución de la luz disponible. Además, un receptor basado en melanopsina se ha relacionado con el dolor de migraña . [52]
Restauración de la visión
Recientemente se han realizado investigaciones sobre el papel de la melanopsina en la terapia optogenética para pacientes con retinitis pigmentosa (RP), una enfermedad ocular degenerativa . [53] La reintroducción de melanopsina funcional en los ojos de ratones con degeneración de la retina restablece el reflejo pupilar a la luz (PLR) . Estos mismos ratones también podían distinguir los estímulos luminosos de los oscuros y mostraron una mayor sensibilidad a la luz ambiental. La mayor sensibilidad demostrada por estos ratones es prometedora para la restauración de la visión, que puede ser aplicable a los seres humanos y a las enfermedades oculares humanas. [51] [54]
Control de los patrones de sueño/vigilia
La melanopsina puede ayudar a controlar los ciclos de sueño y vigilia. Tsunematsu y sus colegas crearon ratones transgénicos que expresaban melanopsina en neuronas orexínicas hipotalámicas . Con un pulso corto de 4 segundos de luz azul (guiado por fibras ópticas ), los ratones transgénicos podían pasar con éxito del sueño de ondas lentas (SWS), que se conoce comúnmente como "sueño profundo", a la vigilia duradera. Después de apagar la luz azul, las neuronas orexínicas hipotalámicas mostraron actividad durante varias decenas de segundos. [51] [55] Se ha demostrado que los bastones y los conos no desempeñan ningún papel en el inicio del sueño por la luz, lo que los distingue de las ipRGC y la melanopsina. Esto proporciona una fuerte evidencia de que existe un vínculo entre las ipRGC en humanos y el estado de alerta, particularmente con luz de alta frecuencia (por ejemplo, luz azul). Por lo tanto, la melanopsina se puede utilizar como un objetivo terapéutico para controlar el ciclo sueño-vigilia. [56]
Regulación de los niveles de glucosa en sangre
En un artículo publicado por Ye y colegas en 2011, se utilizó melanopsina para crear un dispositivo de transcripción sintética optogenética que se probó en un entorno terapéutico para producir péptido similar al glucagón Fc 1 (Fc-GLP-1), una proteína de fusión que ayuda a controlar los niveles de glucosa en sangre en mamíferos con diabetes tipo II . Los investigadores implantaron subcutáneamente ratones con células HEK 293 transgénicas microencapsuladas que fueron cotransfectadas con dos vectores que incluían el gen de la melanopsina y el gen de interés bajo un promotor NFAT ( factor nuclear de células T activadas ), respectivamente. Es a través de esta vía diseñada que controlaron con éxito la expresión de Fc-GLP-1 en ratones diabéticos doblemente recesivos y redujeron la hiperglucemia , o niveles altos de glucosa en sangre, en estos ratones. Esto muestra promesa para el uso de melanopsina como una herramienta optogenética para el tratamiento de la diabetes tipo II. [51] [57]
Véase también
- Efectos de la luz sobre el ritmo circadiano
- Opsinas
- Células ganglionares de la retina intrínsecamente fotosensibles (ipRGC)
- Núcleo supraquiasmático (NSQ)
- Tracto retinohipotalámico
Referencias
- ^ abc GRCh38: Lanzamiento de Ensembl 89: ENSG00000122375 – Ensembl , mayo de 2017
- ^ abc GRCm38: Lanzamiento de Ensembl 89: ENSMUSG00000021799 – Ensembl , mayo de 2017
- ^ "Referencia de PubMed humana:". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU .
- ^ "Referencia PubMed de ratón:". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU . .
- ^ abc Hankins MW, Peirson SN, Foster RG (enero de 2008). "Melanopsina: un fotopigmento fascinante". Tendencias en neurociencias . 31 (1): 27–36. doi :10.1016/j.tins.2007.11.002. PMID 18054803. S2CID 1645433.
- ^ Provencio I, Warthen DM (2012). "Melanopsina, el fotopigmento de las células ganglionares de la retina intrínsecamente fotosensibles". Wiley Interdisciplinary Reviews: Membrane Transport and Signaling . 1 (2): 228–237. doi :10.1002/wmts.29.
- ^ abcd Xue T, Do MT, Riccio A, Jiang Z, Hsieh J, Wang HC, et al. (noviembre de 2011). "Señalización de melanopsina en el iris y la retina de los mamíferos". Nature . 479 (7371): 67–73. Bibcode :2011Natur.479...67X. doi :10.1038/nature10567. PMC 3270891 . PMID 22051675.
- ^ Angueyra JM, Pulido C, Malagón G, Nasi E, Gómez M (2012). "Los fotorreceptores anfioxos que expresan melanopsina transducen luz a través de una cascada de señalización de fosfolipasa C". MÁS UNO . 7 (1): e29813. Código Bib : 2012PLoSO...729813A. doi : 10.1371/journal.pone.0029813 . PMC 3250494 . PMID 22235344.
- ^ abcd Hattar S, Liao HW, Takao M, Berson DM, Yau KW (febrero de 2002). "Células ganglionares de la retina que contienen melanopsina: arquitectura, proyecciones y fotosensibilidad intrínseca". Science . 295 (5557): 1065–1070. Bibcode :2002Sci...295.1065H. doi :10.1126/science.1069609. PMC 2885915 . PMID 11834834.
- ^ ab Roecklein KA, Rohan KJ, Duncan WC, Rollag MD, Rosenthal NE, Lipsky RH, et al. (abril de 2009). "Una variante sin sentido (P10L) del gen de la melanopsina (OPN4) en el trastorno afectivo estacional". Journal of Affective Disorders . 114 (1–3): 279–285. doi :10.1016/j.jad.2008.08.005. PMC 2647333 . PMID 18804284.
- ^ Nissilä J, Mänttäri S, Tuominen H, Särkioja T, Takala T, Saarela S, et al. (2012). "P-780: la abundancia y distribución de la proteína melanopsina (OPN4) en el cerebro humano". Psiquiatría europea . 27 : 1–8. doi :10.1016/S0924-9338(12)74947-7. S2CID 82045589.
- ^ Dkhissi-Benyahya O, Rieux C, Hut RA, Cooper HM (abril de 2006). "Evidencia inmunohistoquímica de un cono de melanopsina en la retina humana". Oftalmología investigativa y ciencia visual . 47 (4): 1636–1641. doi : 10.1167/iovs.05-1459 . PMID 16565403.
- ^ Horiguchi H, Winawer J, Dougherty RF, Wandell BA (enero de 2013). "Revisión de la tricromacia humana". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 110 (3): E260–E269. Código Bibliográfico :2013PNAS..110E.260H. doi : 10.1073/pnas.1214240110 . PMC 3549098 . PMID 23256158.
- ^ abcd Provencio I, Jiang G, De Grip WJ, Hayes WP, Rollag MD (enero de 1998). "Melanopsina: una opsina en melanóforos, cerebro y ojos". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 95 (1): 340–345. Bibcode :1998PNAS...95..340P. doi : 10.1073/pnas.95.1.340 . PMC 18217 . PMID 9419377.
- ^ ab Freedman MS, Lucas RJ, Soni B, von Schantz M, Muñoz M, David-Gray Z, et al. (abril de 1999). "Regulación del comportamiento circadiano de los mamíferos por fotorreceptores oculares que no son bastones ni conos". Science . 284 (5413): 502–504. Bibcode :1999Sci...284..502F. doi :10.1126/science.284.5413.502. PMID 10205061.
- ^ abc Provencio I, Rodríguez IR, Jiang G, Hayes WP, Moreira EF, Rollag MD (enero de 2000). "Una nueva opsina humana en la retina interna". La Revista de Neurociencia . 20 (2): 600–605. doi :10.1523/JNEUROSCI.20-02-00600.2000. PMC 6772411 . PMID 10632589.
- ^ abc Berson DM, Dunn FA, Takao M (febrero de 2002). "Fototransducción por células ganglionares de la retina que fijan el reloj circadiano". Science . 295 (5557): 1070–1073. Bibcode :2002Sci...295.1070B. doi :10.1126/science.1067262. PMID 11834835. S2CID 30745140.
- ^ ab Panda S, Sato TK, Castrucci AM, Rollag MD, DeGrip WJ, Hogenesch JB, et al. (diciembre de 2002). "Requisitos de melanopsina (Opn4) para el cambio de fase circadiano inducido por la luz normal". Science . 298 (5601): 2213–2216. Bibcode :2002Sci...298.2213P. doi :10.1126/science.1076848. PMID 12481141. S2CID 20602808.
- ^ abc Bellingham J, Chaurasia SS, Melyan Z, Liu C, Cameron MA, Tarttelin EE, et al. (julio de 2006). "Evolución de los fotorreceptores de melanopsina: descubrimiento y caracterización de una nueva melanopsina en vertebrados no mamíferos". PLOS Biology . 4 (8): e254. doi : 10.1371/journal.pbio.0040254 . PMC 1514791 . PMID 16856781.

- ^ Benton MJ (mayo de 1990). "Filogenia de los principales grupos de tetrápodos: datos morfológicos y fechas de divergencia". Journal of Molecular Evolution . 30 (5): 409–424. Bibcode :1990JMolE..30..409B. doi :10.1007/BF02101113. PMID 2111854. S2CID 35082873.
- ^ Terakita A (1 de marzo de 2005). "Las opsinas". Genome Biology . 6 (3): 213. doi : 10.1186/gb-2005-6-3-213 . PMC 1088937 . PMID 15774036.
- ^ Gühmann M, Porter ML, Bok MJ (agosto de 2022). "Las gluopsinas: opsinas sin la lisina de unión a la retina". Cells . 11 (15): 2441. doi : 10.3390/cells11152441 . PMC 9368030 . PMID 35954284.
- ^ Collins FD (marzo de 1953). "Rodopsina y amarillo indicador". Nature . 171 (4350): 469–471. Código Bibliográfico :1953Natur.171..469C. doi :10.1038/171469a0. PMID 13046517. S2CID 4152360.
- ^ Pitt GA, Collins FD, Morton RA, Stok P (enero de 1955). "Estudios sobre rodopsina. VIII. Retinilidenmetilamina, un análogo indicador del amarillo". La revista bioquímica . 59 (1): 122-128. doi :10.1042/bj0590122. PMC 1216098 . PMID 14351151.
- ^ Kumbalasiri T, Rollag MD, Isoldi MC, Castrucci AM, Provencio I (marzo de 2007). "La melanopsina desencadena la liberación de depósitos internos de calcio en respuesta a la luz". Fotoquímica y fotobiología . 83 (2): 273–279. doi :10.1562/2006-07-11-RA-964. PMID 16961436. S2CID 23060331.
- ^ Porter ML, Blasic JR, Bok MJ, Cameron EG, Pringle T, Cronin TW, et al. (enero de 2012). "Arrojando nueva luz sobre la evolución de la opsina". Actas. Ciencias biológicas . 279 (1726): 3–14. doi :10.1098/rspb.2011.1819. PMC 3223661. PMID 22012981 .
- ^ Ramirez MD, Pairett AN, Pankey MS, Serb JM, Speiser DI, Swafford AJ, et al. (26 de octubre de 2016). "El último ancestro común de la mayoría de los animales bilaterales poseía al menos 9 opsinas". Genome Biology and Evolution : evw248. doi : 10.1093/gbe/evw248 . PMC 5521729 . PMID 27797948.
- ^ Hughes S, Jagannath A, Hickey D, Gatti S, Wood M, Peirson SN, et al. (enero de 2015). "Uso de ARNip para definir interacciones funcionales entre la melanopsina y múltiples proteínas G asociadas". Ciencias de la vida celular y molecular . 72 (1): 165–179. doi :10.1007/s00018-014-1664-6. PMC 4282707 . PMID 24958088.
- ^ Chew KS, Schmidt TM, Rupp AC, Kofuji P, Trimarchi JM (28 de mayo de 2014). "La pérdida de genes gq/11 no elimina la fototransducción de melanopsina". PLOS ONE . 9 (5): e98356. Bibcode :2014PLoSO...998356C. doi : 10.1371/journal.pone.0098356 . PMC 4037210 . PMID 24870805.
- ^ Sexton T, Buhr E, Van Gelder RN (enero de 2012). "Melanopsina y mecanismos de fotorrecepción ocular no visual". The Journal of Biological Chemistry . 287 (3): 1649–1656. doi : 10.1074/jbc.r111.301226 . PMC 3265846 . PMID 22074930.
- ^ Panda S, Nayak SK, Campo B, Walker JR, Hogenesch JB, Jegla T (enero de 2005). "Iluminación de la vía de señalización de la melanopsina". Science . 307 (5709): 600–604. Bibcode :2005Sci...307..600P. doi :10.1126/science.1105121. PMID 15681390. S2CID 22713904.
- ^ Feigl B, Zele AJ (agosto de 2014). "Células ganglionares de la retina intrínsecamente fotosensibles que expresan melanopsina en enfermedades de la retina" (PDF) . Optometría y ciencia de la visión . 91 (8): 894–903. doi :10.1097/OPX.0000000000000284. PMID 24879087. S2CID 34057255.
- ^ Wong KY, Dunn FA, Berson DM (diciembre de 2005). "Adaptación de fotorreceptores en células ganglionares de la retina intrínsecamente fotosensibles". Neuron . 48 (6): 1001–1010. doi : 10.1016/j.neuron.2005.11.016 . PMID 16364903.
- ^ Bailes HJ, Lucas RJ (mayo de 2013). "La melanopsina humana forma un pigmento con máxima sensibilidad a la luz azul (λmax ≈ 479 nm) que favorece la activación de las cascadas de señalización G(q/11) y G(i/o)". Actas. Ciencias biológicas . 280 (1759): 20122987. doi :10.1098/rspb.2012.2987. PMC 3619500. PMID 23554393 .
- ^ Berson DM (agosto de 2007). "Fototransducción en fotorreceptores de células ganglionares". Archivo Pflügers . 454 (5): 849–855. doi : 10.1007/s00424-007-0242-2 . PMID 17351786.
- ^ Melyan Z, Tarttelin EE, Bellingham J, Lucas RJ, Hankins MW (febrero de 2005). "La adición de melanopsina humana hace que las células de los mamíferos sean fotorresponsivas". Nature . 433 (7027): 741–745. Bibcode :2005Natur.433..741M. doi :10.1038/nature03344. PMID 15674244. S2CID 4426682.
- ^ ab Enezi J, Revell V, Brown T, Wynne J, Schlangen L, Lucas R (agosto de 2011). "Una función de eficiencia espectral "melanopica" predice la sensibilidad de los fotorreceptores de melanopsina a las luces policromáticas". Journal of Biological Rhythms . 26 (4): 314–323. doi : 10.1177/0748730411409719 . PMID 21775290. S2CID 22369861.
- ^ Markwell EL, Feigl B, Zele AJ (mayo de 2010). "Contribuciones de las células ganglionares de la retina de melanopsina intrínsecamente fotosensibles al reflejo pupilar a la luz y al ritmo circadiano". Optometría clínica y experimental . 93 (3): 137–149. doi : 10.1111/j.1444-0938.2010.00479.x . PMID 20557555. S2CID 21778407.
- ^ Zaidi FH, Hull JT, Peirson SN, Wulff K, Aeschbach D, Gooley JJ, et al. (diciembre de 2007). "Sensibilidad a la luz de longitud de onda corta de la conciencia circadiana, pupilar y visual en humanos que carecen de retina externa". Current Biology . 17 (24): 2122–2128. Bibcode :2007CBio...17.2122Z. doi :10.1016/j.cub.2007.11.034. PMC 2151130 . PMID 18082405.
- ^ Evans JA (julio de 2016). "Registro colectivo del tiempo entre las células del reloj circadiano maestro". The Journal of Endocrinology . 230 (1): R27–R49. doi :10.1530/JOE-16-0054. PMC 4938744 . PMID 27154335.
- ^ Reppert SM, Weaver DR (agosto de 2002). "Coordinación del ritmo circadiano en mamíferos". Nature . 418 (6901): 935–941. Bibcode :2002Natur.418..935R. doi :10.1038/nature00965. PMID 12198538. S2CID 4430366.
- ^ Hannibal J, Fahrenkrug J (abril de 2004). "Áreas diana inervadas por células ganglionares de la retina inmunorreactivas a PACAP". Investigación celular y tisular . 316 (1): 99–113. doi :10.1007/s00441-004-0858-x. PMID 14991397. S2CID 24148323.
- ^ Allada R, Emery P, Takahashi JS, Rosbash M (2001). "Detener el tiempo: la genética de los relojes circadianos de moscas y ratones". Revisión anual de neurociencia . 24 (1): 1091–1119. doi :10.1146/annurev.neuro.24.1.1091. PMID 11520929.
- ^ Czeisler CA, Shanahan TL, Klerman EB, Martens H, Brotman DJ, Emens JS, et al. (enero de 1995). "Supresión de la secreción de melatonina en algunos pacientes ciegos por exposición a luz brillante". The New England Journal of Medicine . 332 (1): 6–11. doi : 10.1056/NEJM199501053320102 . PMID 7990870.
- ^ Rollag MD, Berson DM, Provencio I (junio de 2003). "Melanopsina, fotorreceptores de células ganglionares y fotoentrenamiento en mamíferos". Journal of Biological Rhythms . 18 (3): 227–234. doi : 10.1177/0748730403018003005 . PMID 12828280. S2CID 9034442.
- ^ Panda S, Provencio I, Tu DC, Pires SS, Rollag MD, Castrucci AM, et al. (julio de 2003). "La melanopsina es necesaria para las respuestas fóticas que no forman imágenes en ratones ciegos". Science . 301 (5632): 525–527. Bibcode :2003Sci...301..525P. doi :10.1126/science.1086179. PMID 12829787. S2CID 37600812.
- ^ Blasic JR, Lane Brown R, Robinson PR (mayo de 2012). "Fosforilación dependiente de la luz de la cola carboxi de la melanopsina de ratón". Ciencias de la vida celular y molecular . 69 (9): 1551–1562. doi :10.1007/s00018-011-0891-3. PMC 4045631 . PMID 22159583.
- ^ Blasic JR, Matos-Cruz V, Ujla D, Cameron EG, Hattar S, Halpern ME, et al. (abril de 2014). "Identificación de sitios críticos de fosforilación en la cola carboxi de la melanopsina". Bioquímica . 53 (16): 2644–2649. doi :10.1021/bi401724r. PMC 4010260 . PMID 24678795.
- ^ Fahrenkrug J, Falktoft B, Georg B, Hannibal J, Kristiansen SB, Klausen TK (diciembre de 2014). "Fosforilación de la melanopsina de rata en Ser-381 y Ser-398 por luz/oscuridad y su importancia para la señalización celular de Ca2+ de las células ganglionares intrínsecamente fotosensibles (ipRGC)". The Journal of Biological Chemistry . 289 (51): 35482–35493. doi : 10.1074/jbc.M114.586529 . PMC 4271233 . PMID 25378407.
- ^ Sakamoto K, Liu C, Kasamatsu M, Pozdeyev NV, Iuvone PM, Tosini G (diciembre de 2005). "La dopamina regula la expresión del ARNm de la melanopsina en células ganglionares de la retina intrínsecamente fotosensibles". The European Journal of Neuroscience . 22 (12): 3129–3136. doi :10.1111/j.1460-9568.2005.04512.x. PMID 16367779. S2CID 21517576.
- ^ abcd Koizumi A, Tanaka KF, Yamanaka A (enero de 2013). "La manipulación de las actividades neuronales y celulares mediante la expresión ectópica de la melanopsina". Investigación en neurociencia . 75 (1): 3–5. doi :10.1016/j.neures.2012.07.010. PMID 22982474. S2CID 21771987.
- ^ Jennifer Couzin-Frankel (2010). «Por qué la luz empeora las migrañas – ScienceNOW». Archivado desde el original el 31 de julio de 2016. Consultado el 3 de abril de 2011 .
- ^ Busskamp V, Picaud S, Sahel JA, Roska B (febrero de 2012). "Terapia optogenética para la retinitis pigmentosa". Terapia génica . 19 (2): 169–175. doi : 10.1038/gt.2011.155 . PMID 21993174.
- ^ Lin B, Koizumi A, Tanaka N, Panda S, Masland RH (octubre de 2008). "Restauración de la función visual en ratones con degeneración de la retina mediante expresión ectópica de melanopsina". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 105 (41): 16009–16014. Bibcode :2008PNAS..10516009L. doi : 10.1073/pnas.0806114105 . PMC 2572922 . PMID 18836071.
- ^ Tsunematsu T, Tanaka KF, Yamanaka A, Koizumi A (enero de 2013). "La expresión ectópica de melanopsina en neuronas de orexina/hipocretina permite el control de la vigilia de ratones in vivo mediante luz azul". Investigación en neurociencia . 75 (1): 23–28. doi :10.1016/j.neures.2012.07.005. PMID 22868039. S2CID 207152803.
- ^ Lupi D, Oster H, Thompson S, Foster RG (septiembre de 2008). "La inducción aguda del sueño por la luz está mediada por la fotorrecepción basada en OPN4". Nature Neuroscience . 11 (9): 1068–1073. doi :10.1038/nn.2179. hdl : 11858/00-001M-0000-0012-DD96-A . PMID 19160505. S2CID 15941500.
- ^ Ye H, Daoud-El Baba M, Peng RW, Fussenegger M (junio de 2011). "Un dispositivo de transcripción optogenético sintético mejora la homeostasis de la glucosa en sangre en ratones". Science . 332 (6037): 1565–1568. Bibcode :2011Sci...332.1565Y. doi :10.1126/science.1203535. PMID 21700876. S2CID 6166189.
Lectura adicional
- Rovere G, Nadal-Nicolás FM, Wang J, Bernal-Garro JM, García-Carrillo N, Villegas-Pérez MP, et al. (diciembre de 2016). "Respuesta de las células ganglionares de la retina que contienen melanopsina o que no contienen melanopsina a la hipertensión ocular aguda con o sin neuroprotección del factor neurotrófico derivado del cerebro". Oftalmología de investigación y ciencia visual . 57 (15): 6652–6661. doi : 10.1167/iovs.16-20146 . PMID 27930778.






