Reparación del ADN

La reparación del ADN es un conjunto de procesos mediante los cuales una célula identifica y corrige los daños en las moléculas de ADN que codifican su genoma . [1] En las células humanas, tanto las actividades metabólicas normales como los factores ambientales como la radiación pueden causar daños en el ADN, lo que da como resultado decenas de miles de lesiones moleculares individuales por célula por día. [2] Muchas de estas lesiones causan daño estructural a la molécula de ADN y pueden alterar o eliminar la capacidad de la célula para transcribir el gen que codifica el ADN afectado. Otras lesiones inducen mutaciones potencialmente dañinas en el genoma de la célula, que afectan la supervivencia de sus células hijas después de que experimenta mitosis . Como consecuencia, el proceso de reparación del ADN está constantemente activo ya que responde al daño en la estructura del ADN. Cuando los procesos de reparación normales fallan, y cuando no se produce la apoptosis celular , puede producirse un daño irreparable en el ADN. Esto puede eventualmente conducir a tumores malignos o cáncer según la hipótesis de los dos golpes .
La velocidad de reparación del ADN depende de varios factores, entre ellos el tipo de célula, la edad de la célula y el entorno extracelular. Una célula que ha acumulado una gran cantidad de daño en el ADN o que ya no puede repararlo de manera eficaz puede entrar en uno de tres estados posibles:
- un estado irreversible de latencia, conocido como senescencia
- suicidio celular, también conocido como apoptosis o muerte celular programada
- División celular no regulada, que puede conducir a la formación de un tumor canceroso .
La capacidad de reparación del ADN de una célula es vital para la integridad de su genoma y, por lo tanto, para el funcionamiento normal de ese organismo. Muchos genes que inicialmente se demostró que influían en la longevidad han resultado estar involucrados en la reparación y protección del ADN dañado. [3]
El Premio Nobel de Química de 2015 fue otorgado a Tomas Lindahl , Paul Modrich y Aziz Sancar por su trabajo sobre los mecanismos moleculares de los procesos de reparación del ADN. [4] [5]
Daño del ADN
El daño del ADN, debido a factores ambientales y procesos metabólicos normales dentro de la célula, ocurre a una tasa de 10.000 a 1.000.000 de lesiones moleculares por célula por día. [2] Si bien esto constituye como máximo solo el 0,0003125% de los aproximadamente 3.2 mil millones de bases del genoma humano, las lesiones no reparadas en genes críticos (como los genes supresores de tumores ) pueden impedir la capacidad de una célula para llevar a cabo su función y aumentar apreciablemente la probabilidad de formación de tumores y contribuir a la heterogeneidad tumoral .
La gran mayoría de los daños en el ADN afectan a la estructura primaria de la doble hélice, es decir, las propias bases se modifican químicamente. Estas modificaciones pueden, a su vez, alterar la estructura helicoidal regular de las moléculas al introducir enlaces químicos no nativos o aductos voluminosos que no encajan en la doble hélice estándar. A diferencia de las proteínas y el ARN , el ADN normalmente carece de estructura terciaria y, por lo tanto, no se producen daños o alteraciones a ese nivel. Sin embargo, el ADN está superenrollado y enrollado alrededor de proteínas de "empaquetamiento" llamadas histonas (en eucariotas), y ambas superestructuras son vulnerables a los efectos del daño en el ADN.
Fuentes
El daño del ADN se puede subdividir en dos tipos principales:
- Daño endógeno , como el ataque de especies reactivas de oxígeno producidas a partir de subproductos metabólicos normales (mutación espontánea), especialmente el proceso de desaminación oxidativa
- También incluye errores de replicación.
- Daños exógenos causados por agentes externos como
- Radiación ultravioleta (UV) (200–400 nm ) del sol u otras fuentes de luz artificial
- Otras frecuencias de radiación, incluidos rayos X y rayos gamma
- hidrólisis o disrupción térmica
- ciertas toxinas vegetales
- Productos químicos mutagénicos fabricados por el hombre , especialmente compuestos aromáticos que actúan como agentes intercalantes del ADN.
- virus [6]
La replicación del ADN dañado antes de la división celular puede dar lugar a la incorporación de bases erróneas en el lado opuesto de las dañadas. Las células hijas que heredan estas bases erróneas son portadoras de mutaciones de las cuales la secuencia original del ADN es irrecuperable (excepto en el raro caso de una mutación inversa , por ejemplo, a través de una conversión génica ).
Tipos
Existen varios tipos de daños al ADN debido a procesos celulares endógenos:
- oxidación de bases [por ejemplo, 8-oxo-7,8-dihidroguanina (8-oxoG)] y generación de interrupciones de la cadena de ADN a partir de especies reactivas de oxígeno,
- alquilación de bases (generalmente metilación ), como la formación de 7-metilguanosina , 1-metiladenina, 6-O-metilguanina
- hidrólisis de bases, como desaminación , despurinación y despirimidinación.
- "formación de aductos voluminosos" (por ejemplo, aducto de epóxido de benzo[a]pirenodiol-dG, aducto de aristolactama I-dA)
- desajuste de bases, debido a errores en la replicación del ADN , en el que se coloca una base de ADN incorrecta en una cadena de ADN recién formada, o se omite o se inserta por error una base de ADN.
- Daño en el monoaducto causado por cambio en una única base nitrogenada del ADN
- Daño por diducto
Los daños causados por agentes exógenos se presentan de muchas formas. Algunos ejemplos son:
- La luz UV-B provoca la reticulación entre bases de citosina y timina adyacentes, creando dímeros de pirimidina . Esto se denomina daño directo del ADN .
- La luz UV-A crea principalmente radicales libres . El daño causado por los radicales libres se denomina daño indirecto al ADN .
- La radiación ionizante, como la que se crea por la desintegración radiactiva o en los rayos cósmicos, causa roturas en las cadenas de ADN. La radiación ionizante de nivel intermedio puede inducir daños irreparables en el ADN (que conducen a errores de replicación y transcripción necesarios para la neoplasia o pueden desencadenar interacciones virales) que conducen al envejecimiento prematuro y al cáncer.
- La alteración térmica a temperaturas elevadas aumenta la tasa de despurinización (pérdida de bases de purina de la cadena principal del ADN) y las roturas de cadenas simples. Por ejemplo, la despurinización hidrolítica se observa en las bacterias termófilas , que crecen en aguas termales a 40–80 °C. [7] [8] La tasa de despurinización (300 residuos de purina por genoma por generación) es demasiado alta en estas especies para ser reparada por la maquinaria de reparación normal, por lo que no se puede descartar la posibilidad de una respuesta adaptativa .
- Los productos químicos industriales como el cloruro de vinilo y el peróxido de hidrógeno , y los productos químicos ambientales como los hidrocarburos aromáticos policíclicos que se encuentran en el humo, el hollín y el alquitrán crean una enorme diversidad de aductos de ADN (etanoatos, bases oxidadas, fosfodiésteres alquilados y reticulación del ADN) , por nombrar solo algunos.
El daño por rayos UV, la alquilación/metilación, el daño por rayos X y el daño oxidativo son ejemplos de daño inducido. El daño espontáneo puede incluir la pérdida de una base, la desaminación, el fruncimiento del anillo de azúcar y el desplazamiento tautomérico. El daño constitutivo (espontáneo) del ADN causado por oxidantes endógenos se puede detectar como un nivel bajo de fosforilación de la histona H2AX en células no tratadas. [9]
Nuclear versus mitocondrial
En las células humanas, y en las células eucariotas en general, el ADN se encuentra en dos ubicaciones celulares: dentro del núcleo y dentro de las mitocondrias . El ADN nuclear (n-ADN) existe como cromatina durante las etapas no replicativas del ciclo celular y se condensa en estructuras agregadas conocidas como cromosomas durante la división celular . En cualquiera de los dos estados, el ADN está muy compactado y enrollado alrededor de proteínas con forma de cuentas llamadas histonas . Siempre que una célula necesita expresar la información genética codificada en su n-ADN, se desenreda la región cromosómica requerida, se expresan los genes ubicados allí y luego la región se condensa nuevamente a su conformación en reposo. El ADN mitocondrial (mtADN) se encuentra dentro de los orgánulos de las mitocondrias , existe en múltiples copias y también está estrechamente asociado con varias proteínas para formar un complejo conocido como nucleoide. Dentro de las mitocondrias, las especies reactivas de oxígeno (ROS), o radicales libres , subproductos de la producción constante de trifosfato de adenosina (ATP) a través de la fosforilación oxidativa , crean un ambiente altamente oxidativo que se sabe que daña el ADNmt. Una enzima fundamental para contrarrestar la toxicidad de estas especies es la superóxido dismutasa , que está presente tanto en las mitocondrias como en el citoplasma de las células eucariotas.
Senescencia y apoptosis
La senescencia, un proceso irreversible en el que la célula ya no se divide , es una respuesta protectora al acortamiento de los extremos de los cromosomas, llamados telómeros . Los telómeros son largas regiones de ADN no codificante repetitivo que tapan los cromosomas y sufren una degradación parcial cada vez que una célula sufre una división (véase el límite de Hayflick ). [10] En contraste, la quiescencia es un estado reversible de latencia celular que no está relacionado con el daño del genoma (véase el ciclo celular ). La senescencia en las células puede servir como una alternativa funcional a la apoptosis en los casos en que el organismo requiere la presencia física de una célula por razones espaciales, [11] lo que sirve como un mecanismo de "último recurso" para evitar que una célula con ADN dañado se replique de forma inapropiada en ausencia de señalización celular pro-crecimiento . La división celular no regulada puede conducir a la formación de un tumor (véase cáncer ), que es potencialmente letal para un organismo. Por lo tanto, la inducción de la senescencia y la apoptosis se considera parte de una estrategia de protección contra el cáncer. [12]
Mutación
Es importante distinguir entre daño y mutación del ADN, los dos tipos principales de error en el ADN. El daño y la mutación del ADN son fundamentalmente diferentes. El daño produce anomalías físicas en el ADN, como roturas de cadena simple y doble, residuos de 8-hidroxidesoxiguanosina y aductos de hidrocarburos aromáticos policíclicos. El daño del ADN puede ser reconocido por enzimas y, por lo tanto, puede repararse correctamente si hay información redundante, como la secuencia intacta en la cadena de ADN complementaria o en un cromosoma homólogo, disponible para copiar. Si una célula conserva el daño del ADN, se puede prevenir la transcripción de un gen y, por lo tanto, también se bloqueará la traducción a una proteína. También se puede bloquear la replicación o la célula puede morir.
A diferencia de los daños en el ADN, una mutación es un cambio en la secuencia de bases del ADN. Una mutación no puede ser reconocida por las enzimas una vez que el cambio de base está presente en ambas cadenas de ADN, y por lo tanto, no puede ser reparada. A nivel celular, las mutaciones pueden causar alteraciones en la función y regulación de las proteínas. Las mutaciones se replican cuando la célula se replica. En una población de células, la frecuencia de las células mutantes aumentará o disminuirá según los efectos de la mutación en la capacidad de la célula para sobrevivir y reproducirse.
Aunque son claramente diferentes entre sí, el daño y la mutación del ADN están relacionados porque el daño del ADN a menudo causa errores en la síntesis del ADN durante la replicación o reparación; estos errores son una fuente importante de mutación.
Dadas estas propiedades del daño y la mutación del ADN, se puede ver que el daño del ADN es un problema especial en las células que no se dividen o que se dividen lentamente, donde el daño no reparado tenderá a acumularse con el tiempo. Por otro lado, en las células que se dividen rápidamente, el daño del ADN no reparado que no mata a la célula al bloquear la replicación tenderá a causar errores de replicación y, por lo tanto, mutación. La gran mayoría de las mutaciones que no son neutrales en su efecto son perjudiciales para la supervivencia de una célula. Por lo tanto, en una población de células que componen un tejido con células replicantes, las células mutantes tenderán a perderse. Sin embargo, las mutaciones infrecuentes que proporcionan una ventaja de supervivencia tenderán a expandirse clonalmente a expensas de las células vecinas en el tejido. Esta ventaja para la célula es desventajosa para todo el organismo porque dichas células mutantes pueden dar lugar al cáncer. Por lo tanto, el daño del ADN en las células que se dividen con frecuencia, debido a que da lugar a mutaciones, es una causa importante de cáncer. En contraste, el daño del ADN en las células que se dividen con poca frecuencia es probablemente una causa importante de envejecimiento. [13]
Mecanismos
Las células no pueden funcionar si el daño del ADN corrompe la integridad y la accesibilidad de la información esencial del genoma (pero las células siguen siendo superficialmente funcionales cuando faltan o están dañados genes no esenciales). Según el tipo de daño infligido a la estructura de doble hélice del ADN, se han desarrollado diversas estrategias de reparación para restaurar la información perdida. Si es posible, las células utilizan la cadena complementaria no modificada del ADN o la cromátida hermana como plantilla para recuperar la información original. Sin acceso a una plantilla, las células utilizan un mecanismo de recuperación propenso a errores conocido como síntesis por translesión como último recurso.
Los daños en el ADN alteran la configuración espacial de la hélice, y la célula puede detectar dichas alteraciones. Una vez localizado el daño, las moléculas reparadoras del ADN específicas se unen en el lugar del daño o cerca de él, lo que induce a otras moléculas a unirse y formar un complejo que permite que se lleve a cabo la reparación.
Inversión directa
Se sabe que las células eliminan tres tipos de daño a su ADN revirtiéndolo químicamente. Estos mecanismos no requieren una plantilla, ya que los tipos de daño que contrarrestan pueden ocurrir en solo una de las cuatro bases. Estos mecanismos de reversión directa son específicos del tipo de daño incurrido y no implican la rotura de la cadena principal de fosfodiéster. La formación de dímeros de pirimidina tras la irradiación con luz UV da como resultado un enlace covalente anormal entre bases de pirimidina adyacentes. El proceso de fotorreactivación revierte directamente este daño mediante la acción de la enzima fotoliasa , cuya activación depende obligatoriamente de la energía absorbida de la luz azul/UV ( longitud de onda de 300-500 nm ) para promover la catálisis. [14] La fotoliasa, una antigua enzima presente en bacterias , hongos y la mayoría de los animales , ya no funciona en los humanos, [15] quienes, en cambio, utilizan la reparación por escisión de nucleótidos para reparar el daño causado por la irradiación UV. Otro tipo de daño, la metilación de las bases de guanina, es revertido directamente por la enzima metil guanina metil transferasa (MGMT), cuyo equivalente bacteriano se llama ogt . Este es un proceso costoso porque cada molécula de MGMT puede usarse solo una vez; es decir, la reacción es estequiométrica en lugar de catalítica . [16] Una respuesta generalizada a los agentes metilantes en bacterias se conoce como respuesta adaptativa y confiere un nivel de resistencia a los agentes alquilantes tras una exposición sostenida mediante la regulación positiva de las enzimas de reparación de la alquilación. [17] El tercer tipo de daño del ADN revertido por las células es cierta metilación de las bases citosina y adenina.
Daño en una sola hebra

Cuando sólo una de las dos cadenas de una doble hélice presenta un defecto, la otra cadena puede utilizarse como plantilla para guiar la corrección de la cadena dañada. Para reparar el daño en una de las dos moléculas pareadas de ADN, existen varios mecanismos de reparación por escisión que eliminan el nucleótido dañado y lo reemplazan por un nucleótido intacto complementario al que se encuentra en la cadena de ADN intacta. [16]
- Reparación por escisión de bases (BER): las bases o nucleótidos dañados se reparan más comúnmente eliminando la base o el nucleótido involucrado y luego insertando la base o el nucleótido correcto. En la reparación por escisión de bases, una enzima glicosilasa [18] elimina la base dañada del ADN cortando el enlace entre la base y la desoxirribosa. Estas enzimas eliminan una sola base para crear un sitio apurínico o apirimidínico ( sitio AP ). [18] Las enzimas llamadas endonucleasas AP cortan la cadena principal del ADN dañado en el sitio AP. Luego, la ADN polimerasa elimina la región dañada utilizando su actividad exonucleasa 5' a 3' y sintetiza correctamente la nueva hebra utilizando la hebra complementaria como plantilla. [18] Luego, la enzima ADN ligasa sella el espacio. [19]
- Reparación por escisión de nucleótidos (NER): los daños voluminosos que distorsionan la hélice, como la dimerización de pirimidinas causada por la luz ultravioleta, suelen repararse mediante un proceso de tres pasos. Primero se reconoce el daño, luego las endonucleasas eliminan cadenas de ADN de 12 a 24 nucleótidos de longitud tanto aguas arriba como aguas abajo del sitio del daño , y luego se resintetiza la región de ADN eliminada. [20] NER es un mecanismo de reparación altamente conservado evolutivamente y se utiliza en casi todas las células eucariotas y procariotas. [20] En los procariotas, NER está mediada por proteínas Uvr . [20] En los eucariotas, participan muchas más proteínas, aunque la estrategia general es la misma. [20]
- Los sistemas de reparación de errores de emparejamiento están presentes en prácticamente todas las células para corregir errores que no se corrigen mediante la corrección de errores . Estos sistemas constan de al menos dos proteínas. Una detecta el desajuste y la otra recluta una endonucleasa que corta la cadena de ADN recién sintetizada cerca de la región dañada. En E. coli , las proteínas involucradas son las proteínas de la clase Mut: MutS, MutL y MutH. En la mayoría de los eucariotas, el análogo de MutS es MSH y el análogo de MutL es MLH. MutH solo está presente en bacterias. A esto le sigue la eliminación de la región dañada por una exonucleasa, la resíntesis por la ADN polimerasa y el sellado de la mella por la ADN ligasa. [21]
Roturas de doble hebra
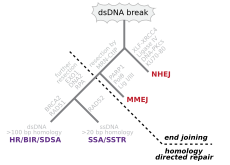
Las roturas de doble cadena, en las que se cortan ambas hebras de la doble hélice, son particularmente peligrosas para la célula porque pueden conducir a reordenamientos del genoma . De hecho, cuando una rotura de doble cadena va acompañada de un enlace cruzado que une las dos hebras en el mismo punto, ninguna de las dos cadenas puede utilizarse como plantilla para los mecanismos de reparación, de modo que la célula no podrá completar la mitosis cuando se divida a continuación y morirá o, en casos raros, sufrirá una mutación. [22] [23] Existen tres mecanismos para reparar las roturas de doble cadena (DSB): unión de extremos no homólogos (NHEJ), unión de extremos mediada por microhomología (MMEJ) y recombinación homóloga (HR): [16] [24]

- En NHEJ, la ADN Ligasa IV , una ADN ligasa especializada que forma un complejo con el cofactor XRCC4 , une directamente los dos extremos. [25] Para guiar una reparación precisa, NHEJ se basa en secuencias homólogas cortas llamadas microhomologías presentes en las colas monocatenarias de los extremos del ADN que se van a unir. Si estos salientes son compatibles, la reparación suele ser precisa. [26] [27] [28] [29] La NHEJ también puede introducir mutaciones durante la reparación. La pérdida de nucleótidos dañados en el sitio de ruptura puede provocar deleciones, y la unión de extremos no coincidentes forma inserciones o translocaciones. La NHEJ es especialmente importante antes de que la célula haya replicado su ADN, ya que no hay una plantilla disponible para la reparación por recombinación homóloga. Hay vías NHEJ de "respaldo" en eucariotas superiores . [30] Además de su función como cuidador del genoma, NHEJ es necesario para unir las roturas de doble cadena con protección en horquilla inducidas durante la recombinación V(D)J , el proceso que genera diversidad en los receptores de células B y células T en el sistema inmunológico de los vertebrados . [31]
- La MMEJ comienza con una resección de corto alcance de los extremos por la nucleasa MRE11 a cada lado de una rotura de doble cadena para revelar regiones de microhomología. [32] En pasos posteriores, [33] se requiere la poli (ADP-ribosa) polimerasa 1 (PARP1) y puede ser un paso temprano en la MMEJ. Hay un emparejamiento de regiones de microhomología seguido del reclutamiento de la endonucleasa 1 específica de la estructura del colgajo (FEN1) para eliminar los colgajos que sobresalen. A esto le sigue el reclutamiento de XRCC1 – LIG3 al sitio para ligar los extremos del ADN, lo que conduce a un ADN intacto. La MMEJ siempre va acompañada de una deleción, de modo que la MMEJ es una vía mutagénica para la reparación del ADN. [34]
- La HR requiere la presencia de una secuencia idéntica o casi idéntica que se utilice como plantilla para reparar la rotura. La maquinaria enzimática responsable de este proceso de reparación es casi idéntica a la maquinaria responsable del entrecruzamiento cromosómico durante la meiosis. Esta vía permite reparar un cromosoma dañado utilizando una cromátida hermana (disponible en G2 después de la replicación del ADN) o un cromosoma homólogo como plantilla. Las roturas de cadena simple causadas por la maquinaria de replicación que intenta sintetizar a través de una rotura de cadena simple o una lesión no reparada provocan el colapso de la horquilla de replicación y normalmente se reparan mediante recombinación.
En un sistema in vitro , la MMEJ se produjo en células de mamíferos en niveles de 10 a 20 % de HR cuando también estaban disponibles los mecanismos de HR y NHEJ. [32]
El extremófilo Deinococcus radiodurans tiene una notable capacidad para sobrevivir al daño del ADN causado por la radiación ionizante y otras fuentes. Al menos dos copias del genoma, con roturas aleatorias del ADN, pueden formar fragmentos de ADN mediante el annealing . Los fragmentos parcialmente superpuestos se utilizan luego para la síntesis de regiones homólogas a través de un D-loop móvil que puede continuar la extensión hasta que se encuentran cadenas complementarias. En el paso final, hay un entrecruzamiento mediante recombinación homóloga dependiente de RecA . [35]
Las topoisomerasas introducen roturas tanto de cadena simple como de cadena doble en el curso del cambio del estado de superenrollamiento del ADN , lo que es especialmente común en regiones cercanas a una horquilla de replicación abierta. Estas roturas no se consideran daños en el ADN porque son un intermediario natural en el mecanismo bioquímico de la topoisomerasa y son reparadas inmediatamente por las enzimas que las crearon.
Otro tipo de rotura de doble cadena de ADN se origina en los sitios termosensibles o termolábiles del ADN. Estos sitios de ADN no son roturas de doble cadena iniciales. Sin embargo, se convierten en roturas de doble cadena después de tratarlos con temperaturas elevadas. La irradiación ionizante puede inducir una forma altamente compleja de daño del ADN, como daño agrupado. Consiste en diferentes tipos de lesiones del ADN en varias ubicaciones de la hélice del ADN. Algunas de estas lesiones ubicadas cerca probablemente puedan convertirse en roturas de doble cadena mediante la exposición a altas temperaturas. Pero la naturaleza exacta de estas lesiones y sus interacciones aún no se conoce [36].
Síntesis de translesión
La síntesis por translesión (TLS) es un proceso de tolerancia al daño del ADN que permite que la maquinaria de replicación del ADN replique lesiones pasadas del ADN, como dímeros de timina o sitios AP . [37] Implica cambiar las polimerasas de ADN regulares por polimerasas de translesión especializadas (es decir, la ADN polimerasa IV o V, de la familia de la polimerasa Y), a menudo con sitios activos más grandes que pueden facilitar la inserción de bases opuestas a los nucleótidos dañados. Se cree que el cambio de polimerasa está mediado, entre otros factores, por la modificación postraduccional del factor de procesividad de replicación PCNA . Las polimerasas de síntesis por translesión a menudo tienen baja fidelidad (alta propensión a insertar bases incorrectas) en plantillas no dañadas en relación con las polimerasas regulares. Sin embargo, muchas son extremadamente eficientes para insertar bases correctas opuestas a tipos específicos de daño. Por ejemplo, Pol η media la omisión sin errores de las lesiones inducidas por la irradiación UV , mientras que Pol ι introduce mutaciones en estos sitios. Se sabe que la pol η agrega la primera adenina a través del fotodímero T^T usando el apareamiento de bases Watson-Crick y la segunda adenina se agregará en su conformación syn usando el apareamiento de bases Hoogsteen . Desde una perspectiva celular, correr el riesgo de la introducción de mutaciones puntuales durante la síntesis de translesión puede ser preferible a recurrir a mecanismos más drásticos de reparación del ADN, que pueden causar aberraciones cromosómicas graves o muerte celular. En resumen, el proceso involucra polimerasas especializadas que evitan o reparan lesiones en lugares donde la replicación del ADN se detiene. Por ejemplo, la ADN polimerasa humana eta puede evitar lesiones complejas del ADN como el entrecruzamiento intracatenario de guanina-timina, G[8,5-Me]T, aunque puede causar mutaciones dirigidas y semidirigidas. [38] Paromita Raychaudhury y Ashis Basu [39] estudiaron la toxicidad y mutagénesis de la misma lesión en Escherichia coli replicando un plásmido modificado con G[8,5-Me]T en E. coli con knockouts específicos de la ADN polimerasa. La viabilidad fue muy baja en una cepa que carecía de pol II, pol IV y pol V, las tres ADN polimerasas inducibles por SOS, lo que indica que la síntesis de translesión se lleva a cabo principalmente por estas ADN polimerasas especializadas. El antígeno nuclear de células en proliferación (PCNA) proporciona una plataforma de derivación a estas polimerasas. En circunstancias normales, el PCNA unido a las polimerasas replica el ADN. En un sitio de lesión , el PCNA es ubiquitinado o modificado por las proteínas RAD6/ RAD18. para proporcionar una plataforma para que las polimerasas especializadas eviten la lesión y reanuden la replicación del ADN. [40] [41] Después de la síntesis de translesión, se requiere extensión. Esta extensión puede ser realizada por una polimerasa replicativa si el TLS está libre de errores, como en el caso de Pol η, pero si el TLS da como resultado un desajuste, se necesita una polimerasa especializada para extenderlo; Pol ζ . Pol ζ es única en el sentido de que puede extender desajustes terminales, mientras que las polimerasas más procesivas no pueden. Entonces, cuando se encuentra una lesión, la horquilla de replicación se detendrá, PCNA cambiará de una polimerasa procesiva a una polimerasa TLS como Pol ι para arreglar la lesión, luego PCNA puede cambiar a Pol ζ para extender el desajuste, y por último PCNA cambiará a la polimerasa procesiva para continuar la replicación.
Respuesta global al daño del ADN
Las células expuestas a la radiación ionizante , la luz ultravioleta o los productos químicos son propensas a adquirir múltiples sitios de lesiones voluminosas del ADN y roturas de doble cadena. Además, los agentes que dañan el ADN pueden dañar otras biomoléculas como las proteínas , los carbohidratos , los lípidos y el ARN . La acumulación de daño, para ser específicos, las roturas de doble cadena o los aductos que bloquean las horquillas de replicación , se encuentran entre las señales de estimulación conocidas para una respuesta global al daño del ADN. [42] La respuesta global al daño es un acto dirigido hacia la propia preservación de las células y desencadena múltiples vías de reparación macromolecular, derivación de lesiones, tolerancia o apoptosis . Las características comunes de la respuesta global son la inducción de múltiples genes , la detención del ciclo celular y la inhibición de la división celular .
Pasos iniciales
El empaquetamiento del ADN eucariota en cromatina presenta una barrera para todos los procesos basados en ADN que requieren el reclutamiento de enzimas a sus sitios de acción. Para permitir la reparación del ADN, la cromatina debe ser remodelada . En eucariotas, los complejos de remodelación de cromatina dependientes de ATP y las enzimas modificadoras de histonas son dos factores predominantes empleados para lograr este proceso de remodelación. [43]
La relajación de la cromatina ocurre rápidamente en el sitio de un daño del ADN. [44] [45] En uno de los primeros pasos, la proteína quinasa activada por estrés, c-Jun N-terminal kinase (JNK) , fosforila SIRT6 en la serina 10 en respuesta a roturas de doble cadena u otro daño del ADN. [46] Esta modificación postraduccional facilita la movilización de SIRT6 a los sitios de daño del ADN, y es necesaria para el reclutamiento eficiente de la poli (ADP-ribosa) polimerasa 1 (PARP1) a los sitios de rotura del ADN y para la reparación eficiente de DSB. [46] La proteína PARP1 comienza a aparecer en los sitios de daño del ADN en menos de un segundo, con la mitad de la acumulación máxima dentro de los 1,6 segundos después de que ocurre el daño. [47] PARP1 sintetiza cadenas poliméricas de adenosina difosfato ribosa (poli (ADP-ribosa) o PAR) sobre sí misma. A continuación, el remodelador de cromatina ALC1 se une rápidamente al producto de la acción de PARP1, una cadena de poli-ADP ribosa, y ALC1 completa la llegada al daño del ADN dentro de los 10 segundos posteriores a la ocurrencia del daño. [45] Aproximadamente la mitad de la relajación máxima de la cromatina, presumiblemente debido a la acción de ALC1, ocurre a los 10 segundos. [45] Esto luego permite el reclutamiento de la enzima reparadora de ADN MRE11 , para iniciar la reparación del ADN, dentro de los 13 segundos. [47]
γH2AX, la forma fosforilada de H2AX también está involucrada en los primeros pasos que conducen a la descondensación de la cromatina después de las roturas de doble cadena de ADN. La variante de histona H2AX constituye aproximadamente el 10% de las histonas H2A en la cromatina humana. [48] γH2AX (H2AX fosforilada en la serina 139) puede detectarse tan pronto como 20 segundos después de la irradiación de las células (con formación de rotura de doble cadena de ADN), y la mitad de la acumulación máxima de γH2AX ocurre en un minuto. [48] La extensión de la cromatina con γH2AX fosforilada es de aproximadamente dos millones de pares de bases en el sitio de una rotura de doble cadena de ADN. [48] γH2AX no causa, por sí misma, la descondensación de la cromatina, pero dentro de los 30 segundos posteriores a la irradiación, la proteína RNF8 puede detectarse en asociación con γH2AX. [49] RNF8 media la descondensación extensa de la cromatina, a través de su interacción posterior con CHD4 , [50] un componente del complejo de remodelación de nucleosomas y desacetilasa NuRD .
DDB2 se presenta en un complejo heterodimérico con DDB1 . Este complejo se une a su vez a la proteína ubiquitina ligasa CUL4A [51] y a PARP1 . [52] Este complejo más grande se asocia rápidamente con el daño inducido por UV dentro de la cromatina, y la asociación máxima se completa en 40 segundos. [51] La proteína PARP1, unida tanto a DDB1 como a DDB2, se PARila (crea una cadena de poli-ADP ribosa) en DDB2 que atrae a la proteína remodeladora de ADN ALC1 . [52] La acción de ALC1 relaja la cromatina en el sitio del daño UV al ADN. Esta relajación permite que otras proteínas en la vía de reparación por escisión de nucleótidos ingresen a la cromatina y reparen los daños del dímero de pirimidina de ciclobutano inducidos por UV .
Después de una rápida remodelación de la cromatina , se activan los puntos de control del ciclo celular para permitir que se produzca la reparación del ADN antes de que progrese el ciclo celular. En primer lugar, se activan dos quinasas , ATM y ATR , dentro de los 5 o 6 minutos posteriores al daño del ADN. A esto le sigue la fosforilación de la proteína del punto de control del ciclo celular Chk1 , que inicia su función, aproximadamente 10 minutos después del daño del ADN. [53]
Puntos de control de daños en el ADN
Después del daño del ADN, se activan los puntos de control del ciclo celular . La activación del punto de control detiene el ciclo celular y le da tiempo a la célula para reparar el daño antes de continuar dividiéndose. Los puntos de control del daño del ADN ocurren en los límites G1 / S y G2 / M. También existe un punto de control intra- S . La activación del punto de control está controlada por dos quinasas maestras , ATM y ATR . ATM responde a las roturas de doble cadena de ADN y las interrupciones en la estructura de la cromatina, [54] mientras que ATR responde principalmente a las horquillas de replicación estancadas . Estas quinasas fosforilan objetivos corriente abajo en una cascada de transducción de señales , que finalmente conduce a la detención del ciclo celular. También se ha identificado una clase de proteínas mediadoras de puntos de control que incluyen BRCA1 , MDC1 y 53BP1 . [55] Estas proteínas parecen ser necesarias para transmitir la señal de activación del punto de control a las proteínas corriente abajo.
El punto de control de daño del ADN es una vía de transducción de señales que bloquea la progresión del ciclo celular en G1, G2 y metafase y reduce la velocidad de progresión de la fase S cuando el ADN está dañado. Provoca una pausa en el ciclo celular que permite que la célula tenga tiempo de reparar el daño antes de continuar dividiéndose.
Las proteínas de punto de control se pueden separar en cuatro grupos: proteína quinasa similar a la fosfatidilinositol 3-quinasa (PI3K) , grupo similar al antígeno nuclear de células proliferantes (PCNA), dos quinasas de serina/treonina (S/T) y sus adaptadores. En el centro de todas las respuestas de puntos de control inducidas por daño del ADN se encuentra un par de grandes quinasas de proteína que pertenecen al primer grupo de quinasas de proteína similares a PI3K: las quinasas ATM ( Ataxia telangiectasia mutada ) y ATR (Ataxia- y Rad-relacionadas), cuya secuencia y funciones se han conservado bien en la evolución. Toda respuesta al daño del ADN requiere ATM o ATR porque tienen la capacidad de unirse a los cromosomas en el sitio del daño del ADN, junto con proteínas accesorias que son plataformas en las que se pueden ensamblar los componentes de respuesta al daño del ADN y los complejos de reparación del ADN.
Un objetivo importante de ATM y ATR es p53 , ya que es necesario para inducir la apoptosis después del daño del ADN. [56] El inhibidor de la quinasa dependiente de ciclina p21 es inducido por mecanismos dependientes e independientes de p53 y puede detener el ciclo celular en los puntos de control G1/S y G2/M desactivando los complejos ciclina / quinasa dependiente de ciclina . [57]
La respuesta SOS procariota
La respuesta SOS son los cambios en la expresión génica en Escherichia coli y otras bacterias en respuesta a un daño extenso del ADN. El sistema SOS procariota está regulado por dos proteínas clave: LexA y RecA . El homodímero LexA es un represor transcripcional que se une a secuencias operadoras comúnmente conocidas como cajas SOS. En Escherichia coli se sabe que LexA regula la transcripción de aproximadamente 48 genes, incluidos los genes lexA y recA. [58] Se sabe que la respuesta SOS está muy extendida en el dominio Bacteria, pero está mayormente ausente en algunos filos bacterianos, como las espiroquetas . [59] Las señales celulares más comunes que activan la respuesta SOS son regiones de ADN monocatenario (ssDNA), que surgen de horquillas de replicación estancadas o roturas de doble cadena, que son procesadas por la helicasa del ADN para separar las dos cadenas de ADN. [42] En la etapa de iniciación, la proteína RecA se une al ssDNA en una reacción impulsada por hidrólisis de ATP que crea filamentos RecA–ssDNA. Los filamentos RecA–ssDNA activan la actividad de la autoproteasa LexA , que finalmente conduce a la escisión del dímero LexA y la posterior degradación de LexA. La pérdida del represor LexA induce la transcripción de los genes SOS y permite una mayor inducción de señales, inhibición de la división celular y un aumento en los niveles de proteínas responsables del procesamiento del daño.
En Escherichia coli , las cajas SOS son secuencias de 20 nucleótidos de longitud cerca de promotores con estructura palindrómica y un alto grado de conservación de secuencia. En otras clases y filos, la secuencia de las cajas SOS varía considerablemente, con diferente longitud y composición, pero siempre está altamente conservada y es una de las señales cortas más fuertes del genoma. [59] El alto contenido de información de las cajas SOS permite la unión diferencial de LexA a diferentes promotores y permite la sincronización de la respuesta SOS. Los genes de reparación de lesiones se inducen al comienzo de la respuesta SOS. Las polimerasas de translesión propensas a errores, por ejemplo, UmuCD'2 (también llamada ADN polimerasa V), se inducen más tarde como último recurso. [60] Una vez que el daño del ADN se repara o se evita mediante polimerasas o mediante recombinación, la cantidad de ADN monocatenario en las células disminuye; al reducir la cantidad de filamentos de RecA, disminuye la actividad de escisión del homodímero LexA, que luego se une a las cajas SOS cerca de los promotores y restaura la expresión genética normal.
Respuestas transcripcionales eucariotas al daño del ADN
Las células eucariotas expuestas a agentes que dañan el ADN también activan vías defensivas importantes al inducir múltiples proteínas involucradas en la reparación del ADN, el control de los puntos de control del ciclo celular , el tráfico de proteínas y la degradación. Esta respuesta transcripcional de todo el genoma es muy compleja y está estrechamente regulada, lo que permite una respuesta global coordinada al daño. La exposición de la levadura Saccharomyces cerevisiae a agentes que dañan el ADN da como resultado perfiles transcripcionales superpuestos pero distintos. Las similitudes con la respuesta al choque ambiental indican que existe una vía general de respuesta al estrés global a nivel de activación transcripcional. En contraste, diferentes tipos de células humanas responden al daño de manera diferente, lo que indica la ausencia de una respuesta global común. La explicación probable para esta diferencia entre las células de levadura y humanas puede estar en la heterogeneidad de las células de mamíferos . En un animal, diferentes tipos de células se distribuyen entre diferentes órganos que han desarrollado diferentes sensibilidades al daño del ADN. [61]
En general, la respuesta global al daño del ADN implica la expresión de múltiples genes responsables de la reparación posreplicación , la recombinación homóloga, la reparación por escisión de nucleótidos, el punto de control del daño del ADN , la activación transcripcional global, los genes que controlan la descomposición del ARNm y muchos otros. Una gran cantidad de daño a una célula la deja con una decisión importante: sufrir apoptosis y morir, o sobrevivir a costa de vivir con un genoma modificado. Un aumento en la tolerancia al daño puede conducir a una mayor tasa de supervivencia que permitirá una mayor acumulación de mutaciones. La levadura Rev1 y la polimerasa humana η son miembros de la familia Y de polimerasas de ADN de translesión presentes durante la respuesta global al daño del ADN y son responsables de la mutagénesis mejorada durante una respuesta global al daño del ADN en eucariotas. [42]
Envejecimiento
Efectos patológicos de una mala reparación del ADN

Los animales de experimentación con deficiencias genéticas en la reparación del ADN a menudo muestran una disminución de la esperanza de vida y una mayor incidencia de cáncer. [13] Por ejemplo, los ratones deficientes en la vía dominante NHEJ y en los mecanismos de mantenimiento de los telómeros contraen linfoma e infecciones con mayor frecuencia y, como consecuencia, tienen una esperanza de vida más corta que los ratones de tipo salvaje. [62] De manera similar, los ratones deficientes en una proteína clave de reparación y transcripción que desenrolla las hélices de ADN tienen una aparición prematura de enfermedades relacionadas con el envejecimiento y el consiguiente acortamiento de la esperanza de vida. [63] Sin embargo, no todas las deficiencias de reparación del ADN crean exactamente los efectos previstos; los ratones deficientes en la vía NER mostraron una esperanza de vida más corta sin tasas de mutación correspondientemente más altas. [64]
La esperanza de vida máxima de los ratones , las ratas topo desnudas y los humanos son, respectivamente, ~3, ~30 y ~129 años. [65] De estos, la especie de vida más corta, el ratón, expresa genes de reparación del ADN, incluidos genes centrales en varias vías de reparación del ADN, a un nivel inferior al de los humanos y las ratas topo desnudas. [65] Además, varias vías de reparación del ADN en los humanos y las ratas topo desnudas están reguladas al alza en comparación con el ratón. Estas observaciones sugieren que la reparación elevada del ADN facilita una mayor longevidad . [65]
Si la tasa de daño del ADN excede la capacidad de la célula para repararlo, la acumulación de errores puede abrumar a la célula y dar como resultado senescencia temprana, apoptosis o cáncer. Las enfermedades hereditarias asociadas con un funcionamiento defectuoso de la reparación del ADN dan como resultado un envejecimiento prematuro, [13] mayor sensibilidad a los carcinógenos y, en consecuencia, mayor riesgo de cáncer (ver más abajo). Por otro lado, los organismos con sistemas mejorados de reparación del ADN, como Deinococcus radiodurans , el organismo conocido más resistente a la radiación, exhiben una resistencia notable a los efectos inductores de rotura de doble cadena de la radiactividad , probablemente debido a una mayor eficiencia de la reparación del ADN y especialmente de la NHEJ. [66]
Longevidad y restricción calórica

Se han identificado varios genes individuales que influyen en las variaciones en la expectativa de vida dentro de una población de organismos. Los efectos de estos genes dependen en gran medida del medio ambiente, en particular, de la dieta del organismo. La restricción calórica produce reproduciblemente una expectativa de vida prolongada en una variedad de organismos, probablemente a través de vías de detección de nutrientes y una tasa metabólica reducida . Los mecanismos moleculares por los cuales dicha restricción produce una expectativa de vida prolongada aún no están claros (ver [67] para una discusión); sin embargo, el comportamiento de muchos genes que se sabe que están involucrados en la reparación del ADN se altera en condiciones de restricción calórica. Se ha demostrado que varios agentes que se ha informado que tienen propiedades antienvejecimiento atenúan el nivel constitutivo de señalización mTOR , una evidencia de reducción de la actividad metabólica , y al mismo tiempo reducen el nivel constitutivo de daño al ADN inducido por especies reactivas de oxígeno generadas endógenamente. [68]
Por ejemplo, aumentar la dosis génica del gen SIR-2, que regula el empaquetamiento del ADN en el gusano nematodo Caenorhabditis elegans , puede extender significativamente la esperanza de vida. [69] Se sabe que el homólogo mamífero de SIR-2 induce factores de reparación del ADN implicados en la NHEJ, una actividad que se promueve especialmente en condiciones de restricción calórica. [70] La restricción calórica se ha relacionado estrechamente con la tasa de reparación por escisión de bases en el ADN nuclear de roedores, [71] aunque no se han observado efectos similares en el ADN mitocondrial. [72]
El gen AGE-1 de C. elegans , un efector ascendente de las vías de reparación del ADN, confiere una esperanza de vida considerablemente más larga en condiciones de alimentación libre, pero conduce a una disminución de la aptitud reproductiva en condiciones de restricción calórica. [73] Esta observación apoya la teoría de la pleiotropía de los orígenes biológicos del envejecimiento , que sugiere que los genes que confieren una gran ventaja de supervivencia en etapas tempranas de la vida serán seleccionados incluso si conllevan una desventaja correspondiente en etapas posteriores de la vida.
Medicina y modulación de la reparación del ADN
Trastornos hereditarios de reparación del ADN
Los defectos en el mecanismo NER son responsables de varios trastornos genéticos, entre ellos:
- Xeroderma pigmentoso : hipersensibilidad a la luz solar/UV, que provoca un aumento de la incidencia de cáncer de piel y envejecimiento prematuro.
- Síndrome de Cockayne : hipersensibilidad a los rayos UV y a los agentes químicos
- Tricotiodistrofia : piel sensible, cabello y uñas quebradizos.
El retraso mental a menudo acompaña a los dos últimos trastornos, lo que sugiere una mayor vulnerabilidad de las neuronas del desarrollo.
Otros trastornos de reparación del ADN incluyen:
- Síndrome de Werner : envejecimiento prematuro y retraso del crecimiento
- Síndrome de Bloom : hipersensibilidad a la luz solar, alta incidencia de neoplasias malignas (especialmente leucemias ).
- Ataxia telangiectasia : sensibilidad a la radiación ionizante y a algunos agentes químicos
Todas las enfermedades mencionadas anteriormente se denominan a menudo " progerias segmentarias " (" enfermedades de envejecimiento acelerado ") porque los afectados parecen mayores y experimentan enfermedades relacionadas con el envejecimiento a una edad anormalmente joven, sin manifestar todos los síntomas de la vejez.
Otras enfermedades asociadas con una función reducida de reparación del ADN incluyen la anemia de Fanconi , el cáncer de mama hereditario y el cáncer de colon hereditario .
Cáncer
Debido a las limitaciones inherentes de los mecanismos de reparación del ADN, si los humanos vivieran lo suficiente, todos acabarían desarrollando cáncer. [74] [75] Hay al menos 34 mutaciones genéticas hereditarias de reparación del ADN humano que aumentan el riesgo de cáncer . Muchas de estas mutaciones hacen que la reparación del ADN sea menos eficaz de lo normal. En particular, el cáncer colorrectal hereditario no asociado a poliposis (HNPCC) está fuertemente asociado con mutaciones específicas en la vía de reparación de desajustes del ADN. BRCA1 y BRCA2 , dos genes importantes cuyas mutaciones confieren un riesgo enormemente mayor de cáncer de mama a los portadores, [76] están asociados con una gran cantidad de vías de reparación del ADN, especialmente NHEJ y recombinación homóloga.
Los procedimientos de tratamiento del cáncer, como la quimioterapia y la radioterapia, actúan sobrepasando la capacidad de la célula para reparar los daños en el ADN, lo que provoca la muerte celular. Las células que se dividen más rápidamente (normalmente las cancerosas) son las más afectadas. El efecto secundario es que también se ven afectadas otras células no cancerosas pero que se dividen rápidamente, como las células progenitoras del intestino, la piel y el sistema hematopoyético. Los tratamientos modernos contra el cáncer intentan localizar el daño en el ADN en las células y los tejidos asociados únicamente con el cáncer, ya sea por medios físicos (concentrando el agente terapéutico en la región del tumor) o por medios bioquímicos (explotando una característica exclusiva de las células cancerosas en el cuerpo). En el contexto de las terapias dirigidas a los genes de respuesta al daño en el ADN, este último enfoque se ha denominado "letalidad sintética". [77]
Tal vez el más conocido de estos fármacos de "letalidad sintética" es el inhibidor de la poli(ADP-ribosa) polimerasa 1 ( PARP1 ) , olaparib , que fue aprobado por la Administración de Alimentos y Medicamentos en 2015 para el tratamiento de cáncer de ovario con defectos en BRCA en mujeres. Las células tumorales con pérdida parcial de la respuesta al daño del ADN (específicamente, la reparación por recombinación homóloga ) dependen de otro mecanismo, la reparación de rotura de cadena sencilla, que es un mecanismo que consiste, en parte, en el producto del gen PARP1. [78] El olaparib se combina con quimioterapéuticos para inhibir la reparación de rotura de cadena sencilla inducida por el daño del ADN causado por la quimioterapia coadministrada. Las células tumorales que dependen de este mecanismo residual de reparación del ADN no pueden reparar el daño y, por lo tanto, no pueden sobrevivir y proliferar, mientras que las células normales pueden reparar el daño con el mecanismo de recombinación homóloga en funcionamiento.
Actualmente se están investigando muchos otros fármacos para su uso contra otros mecanismos residuales de reparación del ADN que se encuentran comúnmente en el cáncer. Sin embargo, los enfoques terapéuticos de letalidad sintética han sido cuestionados debido a la evidencia emergente de resistencia adquirida, lograda a través de la reconfiguración de las vías de respuesta al daño del ADN y la reversión de defectos previamente inhibidos. [79]
Defectos en la reparación del ADN en el cáncer
En los últimos años se ha hecho evidente que la respuesta al daño del ADN actúa como una barrera para la transformación maligna de las células preneoplásicas. [80] Estudios previos han demostrado una respuesta elevada al daño del ADN en modelos de cultivo celular con activación de oncogenes [81] y adenomas de colon preneoplásicos. [82] Los mecanismos de respuesta al daño del ADN desencadenan la detención del ciclo celular e intentan reparar las lesiones del ADN o promover la muerte celular/senescencia si la reparación no es posible. El estrés de replicación se observa en células preneoplásicas debido al aumento de las señales de proliferación de las mutaciones oncogénicas. El estrés de replicación se caracteriza por: aumento de la activación del origen/inicio de replicación; aumento de la transcripción y colisiones de complejos de transcripción-replicación; deficiencia de nucleótidos; aumento de las especies reactivas de oxígeno (ROS). [83]
El estrés de replicación, junto con la selección de mutaciones inactivadoras en genes de respuesta al daño del ADN en la evolución del tumor, [84] conduce a la regulación negativa y/o pérdida de algunos mecanismos de respuesta al daño del ADN y, por lo tanto, a la pérdida de la reparación del ADN y/o senescencia/muerte celular programada. En modelos experimentales de ratón, se observó la pérdida de la senescencia celular mediada por la respuesta al daño del ADN después de utilizar un ARN de horquilla corta (shRNA) para inhibir la quinasa de respuesta a la rotura de doble cadena de la ataxia telangiectasia ( ATM ), lo que conduce a un aumento del tamaño del tumor y de la invasividad. [82] Los humanos nacidos con defectos hereditarios en los mecanismos de reparación del ADN (por ejemplo, el síndrome de Li-Fraumeni ) tienen un mayor riesgo de cáncer. [85]
La prevalencia de mutaciones en la respuesta al daño del ADN difiere entre los distintos tipos de cáncer; por ejemplo, el 30% de los carcinomas invasivos de mama tienen mutaciones en genes implicados en la recombinación homóloga. [80] En el cáncer, se observa una regulación negativa en todos los mecanismos de respuesta al daño del ADN (reparación por escisión de bases [BER], reparación por escisión de nucleótidos [NER], reparación de desajustes del ADN [MMR], reparación por recombinación homóloga [HR], unión de extremos no homólogos [NHEJ] y síntesis de ADN por translesión [TLS]). [86] Además de las mutaciones en los genes de reparación del daño del ADN, también surgen mutaciones en los genes responsables de detener el ciclo celular para permitir que se produzca el tiempo suficiente para la reparación del ADN, y algunos genes están implicados tanto en la reparación del daño del ADN como en el control del punto de control del ciclo celular, por ejemplo, ATM y la quinasa del punto de control 2 (CHEK2), un supresor tumoral que a menudo está ausente o regulado negativamente en el cáncer de pulmón de células no pequeñas. [87]
| HORA | Nueva Jersey | SSA | FA | BER | NER | vacuna triple vírica | |
|---|---|---|---|---|---|---|---|
| cajero automático |  |  |  | ||||
| ATR |  |  |  | ||||
| PAXIP |  |  | |||||
| APR |  |  |  | ||||
| BRCA1 |  |  | |||||
| BRCA2 |  |  | |||||
| RAD51 |  |  | |||||
| Solicitud de cotización |  |  |  | ||||
| XRCC1 |  |  | |||||
| PCNA |  |  |  | ||||
| PARP1 |  |  | |||||
| ERCC1 |  |  |  |  | |||
| MSH3 |  |  |  |
Defectos en la reparación epigenética del ADN en el cáncer
Clásicamente, el cáncer se ha considerado como un conjunto de enfermedades que son impulsadas por anomalías genéticas progresivas que incluyen mutaciones en genes supresores de tumores y oncogenes, y aberraciones cromosómicas. Sin embargo, se ha hecho evidente que el cáncer también es impulsado por alteraciones epigenéticas . [88]
Las alteraciones epigenéticas se refieren a modificaciones funcionalmente relevantes del genoma que no implican un cambio en la secuencia de nucleótidos. Ejemplos de tales modificaciones son los cambios en la metilación del ADN (hipermetilación e hipometilación) y la modificación de histonas , [89] los cambios en la arquitectura cromosómica (causados por la expresión inapropiada de proteínas como HMGA2 o HMGA1 ) [90] y los cambios causados por microARN . Cada una de estas alteraciones epigenéticas sirve para regular la expresión génica sin alterar la secuencia de ADN subyacente . Estos cambios generalmente permanecen a través de las divisiones celulares , duran varias generaciones de células y pueden considerarse epimutaciones (equivalentes a mutaciones).
Si bien se encuentran grandes cantidades de alteraciones epigenéticas en los cánceres, las alteraciones epigenéticas en los genes de reparación del ADN, que causan una expresión reducida de las proteínas de reparación del ADN, parecen ser particularmente importantes. Se cree que dichas alteraciones ocurren en las primeras etapas de la progresión hacia el cáncer y que son una causa probable de la inestabilidad genética característica de los cánceres. [91] [92] [93]
La expresión reducida de los genes de reparación del ADN provoca una reparación deficiente del ADN. Cuando la reparación del ADN es deficiente, los daños en el ADN permanecen en las células a un nivel más alto de lo habitual y estos daños excesivos provocan un aumento de las frecuencias de mutación o epimutación. Las tasas de mutación aumentan sustancialmente en células defectuosas en la reparación de desajustes del ADN [94] [95] o en la reparación recombinatoria homóloga (HRR). [96] Los reordenamientos cromosómicos y la aneuploidía también aumentan en las células defectuosas en HRR. [97]
Los niveles más elevados de daño del ADN no solo provocan un aumento de la mutación, sino también de la epimutación. Durante la reparación de roturas de doble cadena de ADN o la reparación de otros daños del ADN, los sitios de reparación que no se han limpiado por completo pueden provocar el silenciamiento de genes epigenéticos. [98] [99]
La expresión deficiente de las proteínas reparadoras del ADN debido a una mutación hereditaria puede provocar un mayor riesgo de cáncer. Las personas con un deterioro hereditario en cualquiera de los 34 genes de reparación del ADN (véase el artículo Trastorno por deficiencia en la reparación del ADN ) tienen un mayor riesgo de cáncer, y algunos defectos provocan hasta un 100 % de probabilidades de padecer cáncer a lo largo de la vida (por ejemplo, las mutaciones del gen p53). [100] Sin embargo, estas mutaciones de la línea germinal (que causan síndromes de cáncer de alta penetración) son la causa de solo alrededor del 1 por ciento de los cánceres. [101]
Frecuencias de epimutaciones en genes de reparación del ADN

En ocasiones, las deficiencias en las enzimas de reparación del ADN son causadas por una mutación somática de reciente aparición en un gen de reparación del ADN, pero con mucha más frecuencia son causadas por alteraciones epigenéticas que reducen o silencian la expresión de los genes de reparación del ADN. Por ejemplo, cuando se examinaron 113 cánceres colorrectales en secuencia, solo cuatro tenían una mutación sin sentido en el gen de reparación del ADN MGMT , mientras que la mayoría tenía una expresión reducida de MGMT debido a la metilación de la región promotora de MGMT (una alteración epigenética). [102] Cinco estudios diferentes encontraron que entre el 40% y el 90% de los cánceres colorrectales tienen una expresión reducida de MGMT debido a la metilación de la región promotora de MGMT. [103] [104] [105] [106] [107]
De manera similar, de 119 casos de cáncer colorrectal deficiente en reparación de desajustes que carecían de expresión del gen de reparación de ADN PMS2 , PMS2 fue deficiente en 6 debido a mutaciones en el gen PMS2, mientras que en 103 casos la expresión de PMS2 fue deficiente porque su pareja de emparejamiento MLH1 fue reprimida debido a la metilación del promotor (la proteína PMS2 es inestable en ausencia de MLH1). [108] En los otros 10 casos, la pérdida de la expresión de PMS2 probablemente se debió a la sobreexpresión epigenética del microARN , miR-155 , que regula negativamente MLH1. [109]
En otro ejemplo, se encontraron defectos epigenéticos en varios tipos de cáncer (por ejemplo, de mama, de ovario, colorrectal y de cabeza y cuello). Dos o tres deficiencias en la expresión de ERCC1 , XPF o PMS2 ocurren simultáneamente en la mayoría de los 49 cánceres de colon evaluados por Facista et al. [110]
El gráfico de esta sección muestra algunos agentes que dañan el ADN con frecuencia, ejemplos de lesiones que causan y las vías que se ocupan de estos daños. Al menos 169 enzimas se emplean directamente en la reparación del ADN o influyen en los procesos de reparación del ADN. [111] De ellas, 83 se emplean directamente en la reparación de los 5 tipos de daños del ADN ilustrados en el gráfico. [ cita requerida ]
En el gráfico se muestran algunos de los genes más estudiados que son fundamentales para estos procesos de reparación. Las designaciones de genes que se muestran en rojo, gris o cian indican genes que se alteran epigenéticamente con frecuencia en varios tipos de cáncer. Los artículos de Wikipedia sobre cada uno de los genes resaltados en rojo, gris o cian describen la(s) alteración(es) epigenética(s) y el(los) cáncer(es) en el que se encuentran estas epimutaciones. Los artículos de revisión [112] y los artículos de encuestas experimentales amplias [113] [114] también documentan la mayoría de estas deficiencias de reparación epigenética del ADN en los cánceres.
Los genes resaltados en rojo se reducen o silencian con frecuencia por mecanismos epigenéticos en varios tipos de cáncer. Cuando estos genes tienen una expresión baja o ausente, los daños en el ADN pueden acumularse. Los errores de replicación más allá de estos daños (ver síntesis translesional) pueden conducir a un aumento de mutaciones y, en última instancia, al cáncer. La represión epigenética de los genes de reparación del ADN en vías precisas de reparación del ADN parece ser fundamental para la carcinogénesis .
Los dos genes resaltados en gris , RAD51 y BRCA2 , son necesarios para la reparación recombinatoria homóloga . A veces se expresan en exceso y a veces en defecto en ciertos tipos de cáncer. Como se indica en los artículos de Wikipedia sobre RAD51 y BRCA2 , estos tipos de cáncer suelen tener deficiencias epigenéticas en otros genes de reparación del ADN. Estas deficiencias de reparación probablemente causarían un aumento de los daños no reparados en el ADN. La sobreexpresión de RAD51 y BRCA2 observada en estos tipos de cáncer puede reflejar presiones selectivas para la sobreexpresión compensatoria de RAD51 o BRCA2 y el aumento de la reparación recombinatoria homóloga para abordar al menos parcialmente estos daños excesivos en el ADN. En aquellos casos en los que RAD51 o BRCA2 están subexpresados, esto en sí mismo conduciría a un aumento de los daños no reparados en el ADN. Los errores de replicación más allá de estos daños (ver síntesis de translesión) podrían causar un aumento de mutaciones y cáncer, por lo que la subexpresión de RAD51 o BRCA2 sería cancerígena en sí misma.
Los genes resaltados en cian se encuentran en la vía de unión de extremos mediada por microhomología (MMEJ) y están regulados positivamente en el cáncer. MMEJ es una vía adicional de reparación imprecisa propensa a errores para roturas de doble cadena. En la reparación MMEJ de una rotura de doble cadena, una homología de 5 a 25 pares de bases complementarios entre ambas cadenas emparejadas es suficiente para alinear las cadenas, pero generalmente hay extremos desapareados (flaps). MMEJ elimina los nucleótidos adicionales (flaps) donde se unen las cadenas y luego liga las cadenas para crear una doble hélice de ADN intacta. MMEJ casi siempre implica al menos una pequeña deleción, por lo que es una vía mutagénica. [24] FEN1 , la endonucleasa del colgajo en MMEJ, aumenta epigenéticamente por la hipometilación del promotor y se sobreexpresa en la mayoría de los cánceres de mama, [115] próstata, [116] estómago, [117] [118] neuroblastomas, [119] páncreas, [120] y pulmón. [121] PARP1 también se sobreexpresa cuando su sitio ETS de la región promotora está hipometilado epigenéticamente , y esto contribuye a la progresión al cáncer de endometrio [122] y al cáncer de ovario seroso con mutación BRCA. [123] Otros genes en la vía MMEJ también se sobreexpresan en varios cánceres (ver MMEJ para el resumen), y también se muestran en cian.
Distribución de la reparación del ADN en todo el genoma de las células somáticas humanas
La actividad diferencial de las vías de reparación del ADN en varias regiones del genoma humano hace que las mutaciones se distribuyan de forma muy desigual en los genomas tumorales. [124] [125] En particular, las regiones del genoma humano ricas en genes y de replicación temprana exhiben frecuencias de mutación más bajas que la heterocromatina pobre en genes y de replicación tardía . Un mecanismo subyacente a esto implica la modificación de histona H3K36me3 , que puede reclutar proteínas de reparación de desajustes , [126] reduciendo así las tasas de mutación en las regiones marcadas por H3K36me3 . [127] Otro mecanismo importante se refiere a la reparación por escisión de nucleótidos , que puede ser reclutada por la maquinaria de transcripción, reduciendo las tasas de mutación somática en genes activos [125] y otras regiones de cromatina abiertas. [128]
Alteraciones epigenéticas debidas a la reparación del ADN
Los daños en el ADN son muy comunes y se reparan constantemente. Las alteraciones epigenéticas pueden acompañar la reparación del ADN de daños oxidativos o roturas de doble cadena. En las células humanas, el daño oxidativo del ADN ocurre unas 10.000 veces al día y las roturas de doble cadena del ADN ocurren unas 10 a 50 veces por ciclo celular en las células somáticas que se replican (véase daño del ADN (de origen natural) ). La ventaja selectiva de la reparación del ADN es permitir que la célula sobreviva frente al daño del ADN. La ventaja selectiva de las alteraciones epigenéticas que ocurren con la reparación del ADN no está clara. [ cita requerida ]
La reparación del daño oxidativo del ADN puede alterar los marcadores epigenéticos
En el estado estable (con daños endógenos que ocurren y se reparan), hay alrededor de 2400 guaninas dañadas oxidativamente que forman 8-oxo-2'-desoxiguanosina (8-OHdG) en el ADN de la célula de mamífero promedio. [129] 8-OHdG constituye alrededor del 5% de los daños oxidativos comúnmente presentes en el ADN. [130] Las guaninas oxidadas no ocurren aleatoriamente entre todas las guaninas en el ADN. Existe una preferencia de secuencia para la guanina en un sitio CpG metilado (una citosina seguida de guanina a lo largo de su dirección 5' → 3' y donde la citosina está metilada (5-mCpG)). [131] Un sitio 5-mCpG tiene el potencial de ionización más bajo para la oxidación de guanina.

La guanina oxidada tiene potencial de producir errores de apareamiento y es mutagénica. [133] La oxoguanina glicosilasa (OGG1) es la enzima principal responsable de la escisión de la guanina oxidada durante la reparación del ADN. La OGG1 encuentra y se une a una 8-OHdG en unos pocos segundos. [134] Sin embargo, la OGG1 no escinde inmediatamente la 8-OHdG. En las células HeLa, la eliminación máxima de la mitad de la 8-OHdG ocurre en 30 minutos, [135] y en ratones irradiados, las 8-OHdG inducidas en el hígado del ratón se eliminan con una vida media de 11 minutos. [130]
Cuando OGG1 está presente en una guanina oxidada dentro de un sitio CpG metilado , recluta a TET1 a la lesión de 8-OHdG (ver Figura). Esto permite que TET1 desmetile una citosina metilada adyacente. [136] La desmetilación de la citosina es una alteración epigenética. [137]
Como ejemplo, cuando las células epiteliales mamarias humanas fueron tratadas con H 2 O 2 durante seis horas, el 8-OHdG aumentó aproximadamente 3,5 veces en el ADN y esto causó aproximadamente un 80% de desmetilación de las 5-metilcitosinas en el genoma. [132] La desmetilación de CpG en un promotor génico por la actividad de la enzima TET aumenta la transcripción del gen en ARN mensajero. [138] En células tratadas con H 2 O 2 , se examinó un gen en particular, BACE1 . [132] El nivel de metilación de la isla CpG BACE1 se redujo (una alteración epigenética) y esto permitió un aumento de aproximadamente 6,5 veces en la expresión del ARN mensajero BACE1 . [ cita requerida ]
Si bien la incubación de seis horas con H2O2 causa una desmetilación considerable de los sitios 5-mCpG, tiempos más cortos de incubación con H2O2 parecen promover otras alteraciones epigenéticas. El tratamiento de células con H2O2 durante 30 minutos hace que el heterodímero de la proteína de reparación de desajustes MSH2-MSH6 reclute a la ADN metiltransferasa 1 (DNMT1) a los sitios de algunos tipos de daño oxidativo del ADN. [139] Esto podría causar un aumento de la metilación de citosinas (alteraciones epigenéticas) en estas ubicaciones.
Jiang et al. [140] trataron células HEK 293 con agentes que causaban daño oxidativo al ADN ( bromato de potasio (KBrO3) o cromato de potasio (K2CrO4)). La reparación por escisión de bases (BER) del daño oxidativo ocurrió con la enzima de reparación del ADN polimerasa beta localizándose en guaninas oxidadas. La polimerasa beta es la principal polimerasa humana en la BER de parche corto del daño oxidativo al ADN. Jiang et al. [140] también encontraron que la polimerasa beta reclutaba la proteína metiltransferasa del ADN DNMT3b a los sitios de reparación de la BER. Luego evaluaron el patrón de metilación a nivel de nucleótido único en una pequeña región del ADN que incluía la región promotora y la región de transcripción temprana del gen BRCA1 . El daño oxidativo al ADN del bromato moduló el patrón de metilación del ADN (causó alteraciones epigenéticas) en los sitios CpG dentro de la región del ADN estudiada. En las células no tratadas, los CpG ubicados en −189, −134, −29, −19, +16 y +19 del gen BRCA1 tenían citosinas metiladas (la numeración corresponde al sitio de inicio de la transcripción del ARN mensajero y los números negativos indican nucleótidos en la región promotora anterior ). La oxidación inducida por el tratamiento con bromato resultó en la pérdida de la metilación de citosinas en −189, −134, +16 y +19, al tiempo que también condujo a la formación de nueva metilación en los CpG ubicados en −80, −55, −21 y +8 después de que se permitió la reparación del ADN. [ cita requerida ]
La reparación recombinacional homóloga altera los marcadores epigenéticos
Al menos cuatro artículos informan sobre el reclutamiento de la ADN metiltransferasa 1 (DNMT1) a los sitios de roturas de doble cadena de ADN. [141] [142] [98] [143] Durante la reparación recombinatoria homóloga (HR) de la rotura de doble cadena, la participación de DNMT1 hace que las dos cadenas reparadas de ADN tengan diferentes niveles de citosinas metiladas. Una cadena se metila con frecuencia en aproximadamente 21 sitios CpG aguas abajo de la rotura de doble cadena reparada. La otra cadena de ADN pierde la metilación en aproximadamente seis sitios CpG que previamente estaban metilados aguas abajo de la rotura de doble cadena, así como también pierde la metilación en aproximadamente cinco sitios CpG que previamente estaban metilados aguas arriba de la rotura de doble cadena. Cuando el cromosoma se replica, esto da lugar a un cromosoma hijo que está muy metilado aguas abajo del sitio de rotura anterior y uno que no está metilado en la región tanto aguas arriba como aguas abajo del sitio de rotura anterior. En lo que respecta al gen que se rompió por la rotura de doble cadena, la mitad de las células de la progenie expresan ese gen en un nivel alto y en la otra mitad de las células de la progenie la expresión de ese gen está reprimida. Cuando los clones de estas células se mantuvieron durante tres años, los nuevos patrones de metilación se mantuvieron durante ese período de tiempo. [144]
En ratones con una inserción de recombinación dirigida por homología mediada por CRISPR en su genoma, hubo una gran cantidad de metilaciones aumentadas de sitios CpG dentro de la inserción asociada a la ruptura de doble cadena. [145]
La unión de extremos no homólogos puede provocar algunas alteraciones de los marcadores epigenéticos
La reparación de una rotura de doble cadena mediante unión de extremos no homólogos (NHEJ) puede provocar una pequeña cantidad de desmetilaciones de metilaciones de ADN de citosina preexistentes después de la rotura de doble cadena reparada. [142] Un trabajo posterior de Allen et al. [146] mostró que la NHEJ de una rotura de doble cadena de ADN en una célula podría dar lugar a que algunas células de la progenie tengan una expresión reprimida del gen que alberga la rotura de doble cadena inicial y a que algunas células de la progenie tengan una expresión alta de ese gen debido a alteraciones epigenéticas asociadas con la reparación mediante NHEJ. La frecuencia de alteraciones epigenéticas que causan la represión de un gen después de una reparación mediante NHEJ de una rotura de doble cadena de ADN en ese gen puede ser de aproximadamente el 0,9 %. [98]
Evolución
Los procesos básicos de reparación del ADN están altamente conservados tanto entre procariotas como eucariotas e incluso entre bacteriófagos ( virus que infectan bacterias ); sin embargo, los organismos más complejos con genomas más complejos tienen correspondientemente mecanismos de reparación más complejos. [147] La capacidad de un gran número de motivos estructurales de proteínas para catalizar reacciones químicas relevantes ha jugado un papel significativo en la elaboración de mecanismos de reparación durante la evolución. Para una revisión extremadamente detallada de las hipótesis relacionadas con la evolución de la reparación del ADN, véase. [148]
El registro fósil indica que la vida unicelular comenzó a proliferar en el planeta en algún momento durante el período Precámbrico , aunque no está claro exactamente cuándo surgió la vida moderna reconocible. Los ácidos nucleicos se convirtieron en el único y universal medio de codificar la información genética, lo que requirió mecanismos de reparación del ADN que, en su forma básica, han sido heredados por todas las formas de vida existentes de su ancestro común. La aparición de la atmósfera rica en oxígeno de la Tierra (conocida como la " catástrofe del oxígeno ") debido a los organismos fotosintéticos , así como la presencia de radicales libres potencialmente dañinos en la célula debido a la fosforilación oxidativa , requirió la evolución de mecanismos de reparación del ADN que actúan específicamente para contrarrestar los tipos de daño inducidos por el estrés oxidativo . Sin embargo, el mecanismo por el cual esto sucedió no está claro. [ cita requerida ]
Tasa de cambio evolutivo
En algunas ocasiones, el daño del ADN no se repara o se repara mediante un mecanismo propenso a errores que da como resultado un cambio de la secuencia original. Cuando esto ocurre, las mutaciones pueden propagarse a los genomas de la progenie de la célula. Si tal evento ocurre en una célula de la línea germinal que eventualmente producirá un gameto , la mutación tiene el potencial de transmitirse a la descendencia del organismo. La tasa de evolución en una especie particular (o, en un gen particular) es una función de la tasa de mutación. Como consecuencia, la velocidad y la precisión de los mecanismos de reparación del ADN tienen una influencia sobre el proceso de cambio evolutivo. [149] La protección y reparación del daño del ADN no influye en la tasa de adaptación por regulación genética y por recombinación y selección de alelos. Por otro lado, la reparación y protección del daño del ADN sí influye en la tasa de acumulación de mutaciones irreparables, ventajosas, que expanden el código y son heredables, y ralentiza el mecanismo evolutivo para la expansión del genoma de organismos con nuevas funcionalidades. La tensión entre la capacidad de evolución y la reparación y protección de la mutación necesita más investigación. [ cita requerida ]
Tecnología
En 2012 se descubrió una tecnología denominada repetición palindrómica corta agrupada y regularmente interespaciada (abreviada como CRISPR -Cas9). La nueva tecnología permite a cualquier persona con formación en biología molecular alterar los genes de cualquier especie con precisión, induciendo daño al ADN en un punto específico y luego alterando los mecanismos de reparación del ADN para insertar nuevos genes. [150] Es más barata, más eficiente y más precisa que otras tecnologías. Con la ayuda de CRISPR–Cas9, los científicos pueden editar partes de un genoma eliminando, agregando o alterando partes en una secuencia de ADN. [ cita requerida ]
Véase también
- Enfermedad del envejecimiento acelerado
- Envejecimiento del ADN
- Ciclo celular
- Daño del ADN (que ocurre de forma natural)
- Teoría del envejecimiento basada en el daño del ADN
- Replicación del ADN
- Daño directo al ADN
- Detección y corrección de errores
- Terapia génica
- Genética mitocondrial humana
- Daño indirecto al ADN
- Prolongación de la vida
- Progeria
- REPARACION
- Senectud
- ADNi
- La revista científica DNA Repair bajo el título Mutation Research
Referencias
- ^ "Serie Nature Reviews: daño en el ADN". Nature Reviews Molecular Cell Biology . 5 de julio de 2017. Consultado el 7 de noviembre de 2018 .
- ^ ab Lodish H, Berk A, Matsudaira P, Kaiser CA, Krieger M, Scott MP, et al. (2004). Biología celular molecular (5.ª ed.). WH Freeman. pág. 963. ISBN 978-0-7167-4366-8.OCLC 53798180 .
- ^ Browner WS, Kahn AJ, Ziv E, Reiner AP, Oshima J, Cawthon RM, et al. (diciembre de 2004). "La genética de la longevidad humana". The American Journal of Medicine . 117 (11): 851–60. CiteSeerX 10.1.1.556.6874 . doi :10.1016/j.amjmed.2004.06.033. PMID 15589490.
- ^ Broad WJ (7 de octubre de 2015). «Premio Nobel de Química otorgado a Tomas Lindahl, Paul Modrich y Aziz Sancar por estudios sobre el ADN». The New York Times . Consultado el 7 de octubre de 2015 .
- ^ Staff (7 de octubre de 2015). «El Premio Nobel de Química 2015: la reparación del ADN: una estabilidad química para la vida» (PDF) . Premio Nobel . Consultado el 7 de octubre de 2015 .
- ^ Roulston A, Marcellus RC, Branton PE (1999). "Virus y apoptosis". Revisión anual de microbiología . 53 : 577–628. doi :10.1146/annurev.micro.53.1.577. PMID 10547702.
- ^ Madigan MT, Martino JM (2006). Brock Biología de los microorganismos (11.ª ed.). Pearson. pág. 136. ISBN 978-0-13-196893-6.
- ^ Ohta T, Tokishita SI, Mochizuki K, Kawase J, Sakahira M, Yamagata H (2006). "Sensibilidad UV y mutagénesis del Eubacterium extremadamente termófilo Thermus thermophilus HB27". Genes and Environment . 28 (2): 56–61. Bibcode :2006GeneE..28...56O. doi : 10.3123/jemsge.28.56 .
- ^ Tanaka T, Halicka HD, Huang X, Traganos F, Darzynkiewicz Z (septiembre de 2006). "Fosforilación constitutiva de la histona H2AX y activación de ATM, los indicadores del daño del ADN por oxidantes endógenos". Cell Cycle . 5 (17): 1940–45. doi :10.4161/cc.5.17.3191. PMC 3488278 . PMID 16940754.
- ^ Braig M, Schmitt CA (marzo de 2006). "Senescencia inducida por oncogenes: frenando el desarrollo de tumores". Cancer Research . 66 (6): 2881–4. doi : 10.1158/0008-5472.CAN-05-4006 . PMID 16540631.
- ^ Lynch MD (febrero de 2006). "¿Cómo previene el cáncer la senescencia celular?". ADN y biología celular . 25 (2): 69–78. doi :10.1089/dna.2006.25.69. PMID 16460230.
- ^ Campisi J, d'Adda di Fagagna F (septiembre de 2007). "Senescencia celular: cuando a las células buenas les pasan cosas malas". Nature Reviews. Molecular Cell Biology . 8 (9): 729–40. doi :10.1038/nrm2233. PMID 17667954. S2CID 15664931.
- ^ abc Best BP (junio de 2009). «El daño del ADN nuclear como causa directa del envejecimiento» (PDF) . Rejuvenation Research . 12 (3): 199–208. CiteSeerX 10.1.1.318.738 . doi :10.1089/rej.2009.0847. PMID 19594328. Archivado desde el original (PDF) el 15 de noviembre de 2017. Consultado el 29 de septiembre de 2009 .
- ^ Sancar A (junio de 2003). "Estructura y función de la ADN fotoliasa y los fotorreceptores de luz azul criptocromo". Chemical Reviews . 103 (6): 2203–37. doi :10.1021/cr0204348. PMID 12797829.
- ^ Lucas-Lledó JI, Lynch M (mayo de 2009). "Evolución de las tasas de mutación: análisis filogenómico de la familia fotoliasa/criptocromo". Biología molecular y evolución . 26 (5): 1143–53. doi :10.1093/molbev/msp029. PMC 2668831 . PMID 19228922.
- ^ abc Watson JD, Baker TA, Bell SP, Gann A, Levine M, Losick R (2004). Biología molecular del gen (5.ª ed.). Pearson Benjamin Cummings; CSHL Press. Cap. 9, 10. OCLC 936762772.
- ^ Volkert MR (1988). "Respuesta adaptativa de Escherichia coli al daño por alquilación". Mutagénesis ambiental y molecular . 11 (2): 241–55. Bibcode :1988EnvMM..11..241V. doi :10.1002/em.2850110210. PMID 3278898. S2CID 24722637.
- ^ abc Willey J, Sherwood L, Woolverton C (2014). Microbiología de Prescott . Nueva York: McGraw Hill. pág. 381. ISBN 978-0-07-340240-6.
- ^ Russell P (2018). i Genética . Chennai: Pearson. pág. 186. ISBN. 978-93-325-7162-4.
- ^ abcd Reardon JT, Sancar A (2006). "Purificación y caracterización de sistemas enzimáticos de reparación por escisión de nucleótidos humanos y de Escherichia coli". Reparación de ADN, Parte A. Métodos en enzimología. Vol. 408. págs. 189–213. doi :10.1016/S0076-6879(06)08012-8. ISBN 978-0-12-182813-4. Número de identificación personal 16793370.
- ^ Berg M, Tymoczko J, Stryer L (2012). Bioquímica 7.ª edición . Nueva York: WH Freeman and Company. pág. 840. ISBN 978-1-4292-2936-4.
- ^ Acharya PV (1971). "El aislamiento y caracterización parcial de oligo-desoxirribo-ribonucleótidos correlacionados con la edad con polipéptidos de aspartil-glutamil unidos covalentemente". Revista Médica Johns Hopkins. Suplemento (1): 254–60. PMID 5055816.
- ^ Bjorksten J, Acharya PV, Ashman S, Wetlaufer DB (julio de 1971). "Fracciones gerogénicas en la rata tritiada". Revista de la Sociedad Estadounidense de Geriatría . 19 (7): 561–74. doi :10.1111/j.1532-5415.1971.tb02577.x. PMID 5106728. S2CID 33154242.
- ^ ab Liang L, Deng L, Chen Y, Li GC, Shao C, Tischfield JA (septiembre de 2005). "Modulación de la unión de extremos de ADN por proteínas nucleares". The Journal of Biological Chemistry . 280 (36): 31442–49. doi : 10.1074/jbc.M503776200 . PMID 16012167.
- ^ Wilson TE, Grawunder U, Lieber MR (julio de 1997). "La ADN ligasa IV de levadura media la unión de extremos de ADN no homólogos". Nature . 388 (6641): 495–8. Bibcode :1997Natur.388..495W. doi : 10.1038/41365 . PMID 9242411. S2CID 4422938.
- ^ Moore JK, Haber JE (mayo de 1996). "Ciclo celular y requisitos genéticos de dos vías de reparación de roturas de doble cadena mediante unión de extremos no homólogos en Saccharomyces cerevisiae". Biología molecular y celular . 16 (5): 2164–73. doi :10.1128/mcb.16.5.2164. PMC 231204 . PMID 8628283.
- ^ Boulton SJ, Jackson SP (septiembre de 1996). "Saccharomyces cerevisiae Ku70 potencia la reparación ilegítima de roturas de doble cadena de ADN y actúa como barrera para las vías de reparación de ADN propensas a errores". The EMBO Journal . 15 (18): 5093–103. doi :10.1002/j.1460-2075.1996.tb00890.x. PMC 452249 . PMID 8890183.
- ^ Wilson TE, Lieber MR (agosto de 1999). "Procesamiento eficiente de los extremos del ADN durante la unión de extremos no homólogos en levaduras. Evidencia de una vía dependiente de la ADN polimerasa beta (Pol4)". The Journal of Biological Chemistry . 274 (33): 23599–609. doi : 10.1074/jbc.274.33.23599 . PMID 10438542.
- ^ Budman J, Chu G (febrero de 2005). "Procesamiento de ADN para unión de extremos no homólogos mediante extracto libre de células". The EMBO Journal . 24 (4): 849–60. doi :10.1038/sj.emboj.7600563. PMC 549622 . PMID 15692565.
- ^ Wang H, Perrault AR, Takeda Y, Qin W, Wang H, Iliakis G (septiembre de 2003). "Evidencia bioquímica de vías de respaldo independientes de Ku de NHEJ". Nucleic Acids Research . 31 (18): 5377–88. doi :10.1093/nar/gkg728. PMC 203313 . PMID 12954774. (Este artículo actualmente tiene una expresión de preocupación , consulte doi : 10.1093/nar/gkaa228, PMID 32239214. )
- ^ Jung D, Alt FW (enero de 2004). "Descifrando la recombinación V(D)J; perspectivas sobre la regulación génica". Cell . 116 (2): 299–311. doi : 10.1016/S0092-8674(04)00039-X . PMID 14744439. S2CID 16890458.
- ^ ab Truong LN, Li Y, Shi LZ, Hwang PY, He J, Wang H, et al. (mayo de 2013). "La unión de extremos mediada por microhomología y la recombinación homóloga comparten el paso inicial de resección de extremos para reparar roturas de doble cadena de ADN en células de mamíferos". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 110 (19): 7720–5. Bibcode :2013PNAS..110.7720T. doi : 10.1073/pnas.1213431110 . PMC 3651503 . PMID 23610439.
- ^ Sharma S, Javadekar SM, Pandey M, Srivastava M, Kumari R, Raghavan SC (marzo de 2015). "Homología y requisitos enzimáticos de la unión de extremos alternativos dependiente de la microhomología". Muerte celular y enfermedad . 6 (3): e1697. doi :10.1038/cddis.2015.58. PMC 4385936 . PMID 25789972.
- ^ Decottignies A (2013). "Mecanismos alternativos de unión de extremos: una perspectiva histórica". Frontiers in Genetics . 4 : 48. doi : 10.3389/fgene.2013.00048 . PMC 3613618 . PMID 23565119.
- ^ Zahradka K, Slade D, Bailone A, Sommer S, Averbeck D, Petranovic M, et al. (octubre de 2006). "Reensamblaje de cromosomas destrozados en Deinococcus radiodurans". Nature . 443 (7111): 569–73. Bibcode :2006Natur.443..569Z. doi :10.1038/nature05160. PMID 17006450. S2CID 4412830.
- ^ Stenerlöw B, Karlsson KH, Cooper B, Rydberg B. "Medición de roturas rápidas de doble cadena de ADN en células de mamíferos sin incluir sitios termolábiles: resultados para células deficientes en unión de extremos no homólogos". Radiat Res. 2003 Abr;159(4):502–10. doi :10.1667/0033-7587(2003)159[0502:mopdds2.0.co;2] PMID 12643795.
- ^ Waters LS, Minesinger BK, Wiltrout ME, D'Souza S, Woodruff RV, Walker GC (marzo de 2009). "Polimerasas translesionales eucariotas y sus funciones y regulación en la tolerancia al daño del ADN". Microbiology and Molecular Biology Reviews . 73 (1): 134–54. doi :10.1128/MMBR.00034-08. PMC 2650891 . PMID 19258535.
- ^ Colis LC, Raychaudhury P, Basu AK (agosto de 2008). "Especificidad mutacional de los enlaces cruzados intracatenarios de guanina-timina y timina-guanina inducidos por radiación gamma en células de mamíferos y síntesis translesional más allá de la lesión de guanina-timina por la ADN polimerasa humana eta". Bioquímica . 47 (31): 8070–9. doi :10.1021/bi800529f. PMC 2646719 . PMID 18616294.
- ^ Raychaudhury P, Basu AK (marzo de 2011). "Requisito genético para la mutagénesis del enlace cruzado G[8,5-Me]T en Escherichia coli: las ADN polimerasas IV y V compiten por la derivación propensa a errores". Bioquímica . 50 (12): 2330–8. doi :10.1021/bi102064z. PMC 3062377 . PMID 21302943.
- ^ "Síntesis de translesión". Research.chem.psu.edu. Archivado desde el original el 10 de marzo de 2012. Consultado el 14 de agosto de 2012 .
- ^ Wang Z (julio de 2001). "Síntesis de translesión por la familia UmuC de polimerasas de ADN". Mutation Research . 486 (2): 59–70. doi :10.1016/S0921-8777(01)00089-1. PMID 11425512.
- ^ abc Friedberg EC, Walker GC, Siede W, Wood RD, Schultz RA, Ellenberger T. (2006). Reparación y mutagénesis del ADN, parte 3. ASM Press. 2.ª ed.
- ^ Liu B, Yip RK, Zhou Z (noviembre de 2012). "Remodelación de la cromatina, reparación del daño del ADN y envejecimiento". Current Genomics . 13 (7): 533–47. doi :10.2174/138920212803251373. PMC 3468886 . PMID 23633913.
- ^ Halicka HD, Zhao H, Podhorecka M, Traganos F, Darzynkiewicz Z (julio de 2009). "Detección citométrica de la relajación de la cromatina, un indicador temprano de la respuesta al daño del ADN". Cell Cycle . 8 (14): 2233–7. doi :10.4161/cc.8.14.8984. PMC 3856216 . PMID 19502789.
- ^ abc Sellou H, Lebeaupin T, Chapuis C, Smith R, Hegele A, Singh HR, et al. (diciembre de 2016). "El remodelador de cromatina dependiente de poli(ADP-ribosa) Alc1 induce relajación local de la cromatina tras daño del ADN". Biología molecular de la célula . 27 (24): 3791–9. doi :10.1091/mbc.E16-05-0269. PMC 5170603 . PMID 27733626.
- ^ ab Van Meter M, Simon M, Tombline G, May A, Morello TD, Hubbard BP, et al. (septiembre de 2016). "JNK fosforila SIRT6 para estimular la reparación de roturas de doble cadena del ADN en respuesta al estrés oxidativo mediante el reclutamiento de PARP1 en las roturas del ADN". Cell Reports . 16 (10): 2641–50. doi :10.1016/j.celrep.2016.08.006. PMC 5089070 . PMID 27568560.
- ^ ab Haince JF, McDonald D, Rodrigue A, Déry U, Masson JY, Hendzel MJ, et al. (enero de 2008). "Cinética dependiente de PARP1 del reclutamiento de las proteínas MRE11 y NBS1 a múltiples sitios de daño del ADN". The Journal of Biological Chemistry . 283 (2): 1197–208. doi : 10.1074/jbc.M706734200 . PMID 18025084.
- ^ abc Rogakou EP, Pilch DR, Orr AH, Ivanova VS, Bonner WM (marzo de 1998). "Las roturas de doble cadena del ADN inducen la fosforilación de la histona H2AX en la serina 139". The Journal of Biological Chemistry . 273 (10): 5858–68. doi : 10.1074/jbc.273.10.5858 . PMID 9488723.
- ^ Mailand N, Bekker-Jensen S, Faustrup H, Melander F, Bartek J, Lukas C, et al. (noviembre de 2007). "RNF8 ubiquitina histonas en roturas de doble cadena de ADN y promueve el ensamblaje de proteínas de reparación". Cell . 131 (5): 887–900. doi : 10.1016/j.cell.2007.09.040 . PMID 18001824. S2CID 14232192.
- ^ Luijsterburg MS, Acs K, Ackermann L, Wiegant WW, Bekker-Jensen S, Larsen DH, et al. (mayo de 2012). "Un nuevo papel no catalítico para la ubiquitina ligasa RNF8 en el despliegue de la estructura de la cromatina de orden superior". The EMBO Journal . 31 (11): 2511–27. doi :10.1038/emboj.2012.104. PMC 3365417 . PMID 22531782.
- ^ ab Luijsterburg MS, Goedhart J, Moser J, Kool H, Geverts B, Houtsmuller AB, et al. (Agosto de 2007). "La interacción dinámica in vivo de la ubiquitina ligasa DDB2 E3 con el ADN dañado por los rayos UV es independiente de la proteína de reconocimiento de daños XPC". Revista de ciencia celular . 120 (parte 15): 2706–16. doi : 10.1242/jcs.008367 . PMID 17635991.
- ^ ab Pines A, Vrouwe MG, Marteijn JA, Typas D, Luijsterburg MS, Cansoy M, et al. (octubre de 2012). "PARP1 promueve la reparación por escisión de nucleótidos a través de la estabilización de DDB2 y el reclutamiento de ALC1". The Journal of Cell Biology . 199 (2): 235–49. doi :10.1083/jcb.201112132. PMC 3471223 . PMID 23045548.
- ^ Jazayeri A, Falck J, Lukas C, Bartek J, Smith GC, Lukas J, et al. (enero de 2006). "Regulación de ATR dependiente de ATM y del ciclo celular en respuesta a roturas de doble cadena de ADN". Nature Cell Biology . 8 (1): 37–45. doi :10.1038/ncb1337. PMID 16327781. S2CID 9797133.
- ^ Bakkenist CJ, Kastan MB (enero de 2003). "El daño del ADN activa la ATM a través de la autofosforilación intermolecular y la disociación del dímero". Nature . 421 (6922): 499–506. Bibcode :2003Natur.421..499B. doi :10.1038/nature01368. PMID 12556884. S2CID 4403303.
- ^ Wei Q, Li L, Chen D (2007). Reparación del ADN, inestabilidad genética y cáncer . World Scientific. ISBN 978-981-270-014-8.[ página necesaria ]
- ^ Schonthal AH (2004). Controles de puestos de control y cáncer . Humana Press. ISBN 978-1-58829-500-2.[ página necesaria ]
- ^ Gartel AL, Tyner AL (junio de 2002). "El papel del inhibidor de la quinasa dependiente de ciclina p21 en la apoptosis". Molecular Cancer Therapeutics . 1 (8): 639–49. PMID 12479224.
- ^ Janion C (2001). "Algunos aspectos del sistema de respuesta SOS: un estudio crítico". Acta Biochimica Polonica . 48 (3): 599–610. doi : 10.18388/abp.2001_3894 . PMID 11833768.
- ^ ab Erill I, Campoy S, Barbé J (noviembre de 2007). "Eones de angustia: una perspectiva evolutiva sobre la respuesta SOS bacteriana". FEMS Microbiology Reviews . 31 (6): 637–56. doi : 10.1111/j.1574-6976.2007.00082.x . PMID 17883408.
- ^ Schlacher K, Pham P, Cox MM, Goodman MF (febrero de 2006). "Funciones de la ADN polimerasa V y la proteína RecA en la mutación inducida por daño SOS". Chemical Reviews . 106 (2): 406–19. doi :10.1021/cr0404951. PMID 16464012.
- ^ Fry RC, Begley TJ, Samson LD (2004). "Respuestas de todo el genoma a agentes que dañan el ADN". Revisión anual de microbiología . 59 : 357–77. doi :10.1146/annurev.micro.59.031805.133658. PMID 16153173.
- ^ Espejel S, Martín M, Klatt P, Martín-Caballero J, Flores JM, Blasco MA (mayo de 2004). "Telomeros más cortos, envejecimiento acelerado y aumento de linfoma en ratones con deficiencia de ADN-PKcs". Informes EMBO . 5 (5): 503–09. doi :10.1038/sj.embor.7400127. PMC 1299048 . PMID 15105825.
- ^ de Boer J, Andressoo JO, de Wit J, Huijmans J, Beems RB, van Steeg H, et al. (mayo de 2002). "Envejecimiento prematuro en ratones deficientes en la reparación y transcripción del ADN". Science . 296 (5571): 1276–79. Bibcode :2002Sci...296.1276D. doi : 10.1126/science.1070174 . PMID 11950998. S2CID 41930529.
- ^ Dollé ME, Busuttil RA, Garcia AM, Wijnhoven S, van Drunen E, Niedernhofer LJ, et al. (abril de 2006). "El aumento de la inestabilidad genómica no es un requisito previo para la reducción de la esperanza de vida en ratones deficientes en la reparación del ADN". Mutation Research . 596 (1–2): 22–35. Bibcode :2006MRFMM.596...22D. doi :10.1016/j.mrfmmm.2005.11.008. PMID 16472827.
- ^ abc MacRae SL, Croken MM, Calder RB, Aliper A, Milholland B, White RR, Zhavoronkov A, Gladyshev VN, Seluanov A, Gorbunova V, Zhang ZD, Vijg J (2015). "Reparación del ADN en especies con diferencias extremas en la esperanza de vida". Aging. 7 (12): 1171–84. doi:10.18632/aging.100866. PMC 4712340. PMID 26729707
- ^ Kobayashi Y, Narumi I, Satoh K, Funayama T, Kikuchi M, Kitayama S, et al. (noviembre de 2004). "Mecanismos de respuesta a la radiación de la bacteria extremadamente radiorresistente Deinococcus radiodurans". Uchu Seibutsu Kagaku . 18 (3): 134–35. PMID 15858357.
- ^ Spindler SR (septiembre de 2005). "Inducción rápida y reversible de los efectos de longevidad, anticancerígenos y genómicos de la restricción calórica". Mecanismos de envejecimiento y desarrollo . 126 (9): 960–66. doi :10.1016/j.mad.2005.03.016. PMID 15927235. S2CID 7067036.
- ^ Halicka HD, Zhao H, Li J, Lee YS, Hsieh TC, Wu JM, et al. (diciembre de 2012). "Potenciales agentes antienvejecimiento suprimen el nivel de señalización constitutiva de mTOR y daño del ADN". Envejecimiento . 4 (12): 952–65. doi :10.18632/aging.100521. PMC 3615161 . PMID 23363784.
- ^ Tissenbaum HA, Guarente L (marzo de 2001). "Una dosis mayor de un gen sir-2 extiende la longevidad en Caenorhabditis elegans". Nature . 410 (6825): 227–30. Bibcode :2001Natur.410..227T. doi :10.1038/35065638. PMID 11242085. S2CID 4356885.
- ^ Cohen HY, Miller C, Bitterman KJ, Wall NR, Hekking B, Kessler B, et al. (julio de 2004). "La restricción calórica promueve la supervivencia de células mamíferas mediante la inducción de la desacetilasa SIRT1". Science . 305 (5682): 390–92. Bibcode :2004Sci...305..390C. doi :10.1126/science.1099196. PMID 15205477. S2CID 33503081.
- ^ Cabelof DC, Yanamadala S, Raffoul JJ, Guo Z, Soofi A, Heydari AR (marzo de 2003). "La restricción calórica promueve la estabilidad genómica mediante la inducción de la reparación por escisión de bases y la reversión de su declive relacionado con la edad". Reparación del ADN . 2 (3): 295–307. doi :10.1016/S1568-7864(02)00219-7. PMID 12547392.
- ^ Stuart JA, Karahalil B, Hogue BA, Souza-Pinto NC, Bohr VA (marzo de 2004). "La reparación por escisión de bases del ADN mitocondrial y nuclear se ve afectada de forma diferente por la restricción calórica". FASEB Journal . 18 (3): 595–97. doi : 10.1096/fj.03-0890fje . PMID 14734635. S2CID 43118901.
- ^ Walker DW, McColl G, Jenkins NL, Harris J, Lithgow GJ (mayo de 2000). "Evolución de la longevidad en C. elegans". Nature . 405 (6784): 296–97. doi :10.1038/35012693. PMID 10830948. S2CID 4402039.
- ^ Johnson G (28 de diciembre de 2010). "Desenterrando tumores prehistóricos y debate". The New York Times .
Si viviéramos lo suficiente, tarde o temprano todos tendríamos cáncer.
- ^ Alberts B, Johnson A, Lewis J, et al. (2002). "Las causas prevenibles del cáncer". Biología molecular de la célula (4.ª ed.). Nueva York: Garland Science. ISBN 978-0-8153-4072-0Es de esperar una cierta incidencia de fondo irreducible del cáncer
independientemente de las circunstancias: las mutaciones nunca se pueden evitar por completo, porque son una consecuencia ineludible de las limitaciones fundamentales en la precisión de la replicación del ADN, como se analiza en el Capítulo 5. Si un ser humano pudiera vivir lo suficiente, es inevitable que al menos una de sus células eventualmente acumulara un conjunto de mutaciones suficientes para que se desarrollara el cáncer.
- ^ Friedenson B (agosto de 2007). "La vía BRCA1/2 previene los cánceres hematológicos además de los cánceres de mama y de ovario". BMC Cancer . 7 : 152. doi : 10.1186/1471-2407-7-152 . PMC 1959234 . PMID 17683622.
- ^ Gavande NS, VanderVere-Carozza PS, Hinshaw HD, Jalal SI, Sears CR, Pawelczak KS, et al. (abril de 2016). "Terapia dirigida a la reparación del ADN: ¿pasado o futuro del tratamiento del cáncer?". Farmacología y terapéutica . 160 : 65–83. doi :10.1016/j.pharmthera.2016.02.003. PMC 4811676. PMID 26896565 .
- ^ Bryant HE, Schultz N, Thomas HD, Parker KM, Flower D, Lopez E, et al. (abril de 2005). "Eliminación específica de tumores deficientes en BRCA2 con inhibidores de la poli(ADP-ribosa) polimerasa". Nature . 434 (7035): 913–17. Bibcode :2005Natur.434..913B. doi :10.1038/nature03443. PMID 15829966. S2CID 4391043.
- ^ Goldstein M, Kastan MB (2015). "La respuesta al daño del ADN: implicaciones para las respuestas tumorales a la radiación y la quimioterapia". Revista Anual de Medicina . 66 : 129–43. doi :10.1146/annurev-med-081313-121208. PMID 25423595.
- ^ ab Jeggo PA, Pearl LH, Carr AM (enero de 2016). "Reparación del ADN, estabilidad del genoma y cáncer: una perspectiva histórica" (PDF) . Nature Reviews. Cáncer . 16 (1): 35–42. doi :10.1038/nrc.2015.4. PMID 26667849. S2CID 14941857.
- ^ Bartkova J, Horejsí Z, Koed K, Krämer A, Tort F, Zieger K, et al. (abril de 2005). "Respuesta al daño del ADN como una posible barrera anticancerígena en la tumorigénesis humana temprana". Nature . 434 (7035): 864–70. Bibcode :2005Natur.434..864B. doi :10.1038/nature03482. PMID 15829956. S2CID 4398393.
- ^ ab Bartkova J, Rezaei N, Liontos M, Karakaidos P, Kletsas D, Issaeva N, et al. (noviembre de 2006). "La senescencia inducida por oncogenes es parte de la barrera tumorogénica impuesta por los puntos de control del daño del ADN". Nature . 444 (7119): 633–37. Bibcode :2006Natur.444..633B. doi :10.1038/nature05268. PMID 17136093. S2CID 4406956.
- ^ Gaillard H, García-Muse T, Aguilera A (mayo de 2015). "Estrés de replicación y cáncer". Nature Reviews. Cáncer . 15 (5): 276–89. doi :10.1038/nrc3916. hdl :10261/123721. PMID 25907220. S2CID 11342123.
- ^ Halazonetis TD, Gorgoulis VG, Bartek J (marzo de 2008). "Un modelo de daño del ADN inducido por oncogenes para el desarrollo del cáncer". Science . 319 (5868): 1352–55. Bibcode :2008Sci...319.1352H. doi :10.1126/science.1140735. PMID 18323444. S2CID 16426080.
- ^ de Boer J, Hoeijmakers JH (marzo de 2000). "Reparación por escisión de nucleótidos y síndromes humanos" (PDF) . Carcinogenesis . 21 (3): 453–60. doi : 10.1093/carcin/21.3.453 . PMID 10688865.
- ^ Broustas CG, Lieberman HB (febrero de 2014). "Genes de respuesta al daño del ADN y el desarrollo de la metástasis del cáncer". Radiation Research . 181 (2): 111–30. Bibcode :2014RadR..181..111B. doi :10.1667/RR13515.1. PMC 4064942 . PMID 24397478.
- ^ Zhang P, Wang J, Gao W, Yuan BZ, Rogers J, Reed E (mayo de 2004). "La expresión de la quinasa CHK2 se regula a la baja debido a la metilación del promotor en el cáncer de pulmón de células no pequeñas". Molecular Cancer . 3 (4): 14. doi : 10.1186/1476-4598-3-14 . PMC 419366 . PMID 15125777.
- ^ Baylin SB , Ohm JE (febrero de 2006). "Silenciamiento de genes epigenéticos en el cáncer: ¿un mecanismo para la adicción temprana a la vía oncogénica?". Nature Reviews. Cancer . 6 (2): 107–16. doi :10.1038/nrc1799. PMID 16491070. S2CID 2514545.
- ^ Kanwal R, Gupta S (abril de 2012). "Modificaciones epigenéticas en el cáncer". Genetics Clinical . 81 (4): 303–11. doi :10.1111/j.1399-0004.2011.01809.x. PMC 3590802. PMID 22082348 .
- ^ Baldassarre G, Battista S, Belletti B, Thakur S, Pentimalli F, Trapasso F, et al. (abril de 2003). "La regulación negativa de la expresión del gen BRCA1 por las proteínas HMGA1 explica los niveles reducidos de proteína BRCA1 en el carcinoma de mama esporádico". Biología molecular y celular . 23 (7): 2225–38. doi :10.1128/MCB.23.7.2225-2238.2003. PMC 150734 . PMID 12640109.
- ^ Jacinto FV, Esteller M (julio de 2007). "Vías de mutación desencadenadas por el silenciamiento epigenético en el cáncer humano". Mutagénesis . 22 (4): 247–53. doi : 10.1093/mutage/gem009 . PMID 17412712.
- ^ Lahtz C, Pfeifer GP (febrero de 2011). "Cambios epigenéticos de los genes de reparación del ADN en el cáncer". Journal of Molecular Cell Biology . 3 (1): 51–58. doi :10.1093/jmcb/mjq053. PMC 3030973 . PMID 21278452. Cambios epigenéticos en los genes de reparación del ADN en el cáncer
- ^ Bernstein C, Nfonsam V, Prasad AR, Bernstein H (marzo de 2013). "Defectos del campo epigenético en la progresión al cáncer". Revista mundial de oncología gastrointestinal . 5 (3): 43–49. doi : 10.4251/wjgo.v5.i3.43 . PMC 3648662 . PMID 23671730.
- ^ Narayanan L, Fritzell JA, Baker SM, Liskay RM, Glazer PM (abril de 1997). "Niveles elevados de mutación en múltiples tejidos de ratones deficientes en el gen de reparación de desajustes de ADN Pms2". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 94 (7): 3122–27. Bibcode :1997PNAS...94.3122N. doi : 10.1073/pnas.94.7.3122 . PMC 20332 . PMID 9096356.
- ^ Hegan DC, Narayanan L, Jirik FR, Edelmann W, Liskay RM, Glazer PM (diciembre de 2006). "Diferentes patrones de inestabilidad genética en ratones deficientes en los genes de reparación de desajustes Pms2, Mlh1, Msh2, Msh3 y Msh6". Carcinogenesis . 27 (12): 2402–08. doi :10.1093/carcin/bgl079. PMC 2612936 . PMID 16728433.
- ^ Tutt AN, van Oostrom CT, Ross GM, van Steeg H, Ashworth A (marzo de 2002). "La alteración de Brca2 aumenta la tasa de mutación espontánea in vivo: sinergismo con radiación ionizante". EMBO Reports . 3 (3): 255–60. doi :10.1093/embo-reports/kvf037. PMC 1084010 . PMID 11850397.
- ^ German J (marzo de 1969). "Síndrome de Bloom. I. Observaciones genéticas y clínicas en los primeros veintisiete pacientes". American Journal of Human Genetics . 21 (2): 196–227. PMC 1706430 . PMID 5770175.
- ^ abc O'Hagan HM, Mohammad HP, Baylin SB (agosto de 2008). "Las roturas de doble cadena pueden iniciar el silenciamiento génico y el inicio de la metilación del ADN dependiente de SIRT1 en una isla CpG del promotor exógeno". PLOS Genetics . 4 (8): e1000155. doi : 10.1371/journal.pgen.1000155 . PMC 2491723 . PMID 18704159.
- ^ Cuozzo C, Porcellini A, Angrisano T, Morano A, Lee B, Di Pardo A, et al. (julio de 2007). "Daños en el ADN, reparación dirigida por homología y metilación del ADN". PLOS Genetics . 3 (7): e110. doi : 10.1371/journal.pgen.0030110 . PMC 1913100 . PMID 17616978.
- ^ Malkin D (abril de 2011). "Síndrome de Li-Fraumeni". Genes & Cancer . 2 (4): 475–84. doi :10.1177/1947601911413466. PMC 3135649 . PMID 21779515.
- ^ Fearon ER (noviembre de 1997). "Síndromes de cáncer humano: pistas sobre el origen y la naturaleza del cáncer". Science . 278 (5340): 1043–50. Bibcode :1997Sci...278.1043F. doi :10.1126/science.278.5340.1043. PMID 9353177.
- ^ Halford S, Rowan A, Sawyer E, Talbot I, Tomlinson I (junio de 2005). "O(6)-metilguanina metiltransferasa en cánceres colorrectales: detección de mutaciones, pérdida de expresión y asociación débil con transiciones G:C>A:T". Gut . 54 (6): 797–802. doi :10.1136/gut.2004.059535. PMC 1774551 . PMID 15888787.
- ^ Shen L, Kondo Y, Rosner GL, Xiao L, Hernandez NS, Vilaythong J, et al. (septiembre de 2005). "Metilación del promotor MGMT y defecto de campo en el cáncer colorrectal esporádico". Revista del Instituto Nacional del Cáncer . 97 (18): 1330–38. doi : 10.1093/jnci/dji275 . PMID 16174854.
- ^ Psofaki V, Kalogera C, Tzambouras N, Stephanou D, Tsianos E, Seferiadis K, et al. (julio de 2010). "Estado de metilación del promotor de hMLH1, MGMT y CDKN2A/p16 en adenomas colorrectales". Revista Mundial de Gastroenterología . 16 (28): 3553–60. doi : 10.3748/wjg.v16.i28.3553 . PMC 2909555 . PMID 20653064.
- ^ Lee KH, Lee JS, Nam JH, Choi C, Lee MC, Park CS, et al. (octubre de 2011). "Estado de metilación del promotor de los genes hMLH1, hMSH2 y MGMT en el cáncer colorrectal asociado con la secuencia adenoma-carcinoma". Archivos de cirugía de Langenbeck . 396 (7): 1017–26. doi :10.1007/s00423-011-0812-9. PMID 21706233. S2CID 8069716.
- ^ Amatu A, Sartore-Bianchi A, Moutinho C, Belotti A, Bencardino K, Chirico G, et al. (abril de 2013). "La hipermetilación de la isla CpG del promotor de la enzima reparadora del ADN MGMT predice la respuesta clínica a la dacarbazina en un estudio de fase II para el cáncer colorrectal metastásico". Clinical Cancer Research . 19 (8): 2265–72. doi : 10.1158/1078-0432.CCR-12-3518 . PMID 23422094.
- ^ Mokarram P, Zamani M, Kavousipour S, Naghibalhossaini F, Irajie C, Moradi Sarabi M, et al. (mayo de 2013). "Diferentes patrones de metilación del ADN de las dos regiones promotoras distintas de la O6-metilguanina-ADN metiltransferasa (O6-MGMT) en el cáncer colorrectal". Molecular Biology Reports . 40 (5): 3851–57. doi :10.1007/s11033-012-2465-3. PMID 23271133. S2CID 18733871.
- ^ Truninger K, Menigatti M, Luz J, Russell A, Haider R, Gebbers JO, et al. (mayo de 2005). "El análisis inmunohistoquímico revela una alta frecuencia de defectos de PMS2 en el cáncer colorrectal". Gastroenterología . 128 (5): 1160–71. doi : 10.1053/j.gastro.2005.01.056 . PMID 15887099.
- ^ Valeri N, Gasparini P, Fabbri M, Braconi C, Veronese A, Lovat F, et al. (abril de 2010). "Modulación de la reparación de errores de emparejamiento y estabilidad genómica por miR-155". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 107 (15): 6982–87. Bibcode :2010PNAS..107.6982V. doi : 10.1073/pnas.1002472107 . PMC 2872463 . PMID 20351277.
- ^ Facista A, Nguyen H, Lewis C, Prasad AR, Ramsey L, Zaitlin B, et al. (abril de 2012). "Expresión deficiente de enzimas reparadoras del ADN en la progresión temprana del cáncer de colon esporádico". Integridad del genoma . 3 (1): 3. doi : 10.1186/2041-9414-3-3 . PMC 3351028 . PMID 22494821.
- ^ Genes de reparación del ADN humano, 15 de abril de 2014, MD Anderson Cancer Center, Universidad de Texas
- ^ Jin B, Robertson KD (2013). "Metiltransferasas del ADN, reparación del daño del ADN y cáncer". Alteraciones epigenéticas en la oncogénesis . Avances en medicina y biología experimental. Vol. 754. págs. 3–29. doi :10.1007/978-1-4419-9967-2_1. ISBN 978-1-4419-9966-5. PMC 3707278 . PMID 22956494.
- ^ Krishnan K, Steptoe AL, Martin HC, Wani S, Nones K, Waddell N, et al. (febrero de 2013). "El microARN-182-5p se dirige a una red de genes implicados en la reparación del ADN". ARN . 19 (2): 230–42. doi :10.1261/rna.034926.112. PMC 3543090 . PMID 23249749.
- ^ Chaisaingmongkol J, Popanda O, Warta R, Dyckhoff G, Herpel E, Geiselhart L, et al. (diciembre de 2012). "El análisis epigenético de genes de reparación del ADN humano identifica la metilación aberrante del promotor de NEIL1 en el carcinoma de células escamosas de cabeza y cuello". Oncogene . 31 (49): 5108–16. doi : 10.1038/onc.2011.660 . PMID 22286769.
- ^ Singh P, Yang M, Dai H, Yu D, Huang Q, Tan W, et al. (noviembre de 2008). "Sobreexpresión e hipometilación del gen de la endonucleasa 1 del colgajo en cánceres de mama y otros cánceres". Molecular Cancer Research . 6 (11): 1710–17. doi :10.1158/1541-7786.MCR-08-0269. PMC 2948671 . PMID 19010819.
- ^ Lam JS, Seligson DB, Yu H, Li A, Eeva M, Pantuck AJ, et al. (agosto de 2006). "La endonucleasa 1 del colgajo se sobreexpresa en el cáncer de próstata y se asocia con una puntuación alta en la escala de Gleason". BJU International . 98 (2): 445–51. doi :10.1111/j.1464-410X.2006.06224.x. PMID 16879693. S2CID 22165252.
- ^ Kim JM, Sohn HY, Yoon SY, Oh JH, Yang JO, Kim JH, et al. (enero de 2005). "Identificación de genes relacionados con el cáncer gástrico utilizando una micromatriz de ADNc que contiene nuevas etiquetas de secuencia expresadas en células de cáncer gástrico". Investigación clínica del cáncer . 11 (2 Pt 1): 473–82. doi : 10.1158/1078-0432.473.11.2 . PMID 15701830.
- ^ Wang K, Xie C, Chen D (mayo de 2014). "La endonucleasa 1 de colgajo es un biomarcador candidato prometedor en el cáncer gástrico y está involucrada en la proliferación celular y la apoptosis". Revista Internacional de Medicina Molecular . 33 (5): 1268–74. doi : 10.3892/ijmm.2014.1682 . PMID 24590400.
- ^ Krause A, Combaret V, Iacono I, Lacroix B, Compagnon C, Bergeron C, et al. (julio de 2005). "Análisis de todo el genoma de la expresión génica en neuroblastomas detectados mediante cribado masivo" (PDF) . Cancer Letters . 225 (1): 111–20. doi :10.1016/j.canlet.2004.10.035. PMID 15922863. S2CID 44644467.
- ^ Iacobuzio-Donahue CA, Maitra A, Olsen M, Lowe AW, van Heek NT, Rosty C, et al. (Abril de 2003). "Exploración de patrones globales de expresión génica en adenocarcinoma de páncreas utilizando micromatrices de ADNc". La Revista Estadounidense de Patología . 162 (4): 1151–62. doi :10.1016/S0002-9440(10)63911-9. PMC 1851213 . PMID 12651607.
- ^ Sato M, Girard L, Sekine I, Sunaga N, Ramirez RD, Kamibayashi C, et al. (octubre de 2003). "Expresión aumentada y ausencia de mutación del gen de la endonucleasa Flap (FEN1) en el cáncer de pulmón humano". Oncogene . 22 (46): 7243–46. doi : 10.1038/sj.onc.1206977 . PMID 14562054.
- ^ Bi FF, Li D, Yang Q (2013). "Hipometilación de los sitios de unión del factor de transcripción ETS y regulación positiva de la expresión de PARP1 en el cáncer de endometrio". BioMed Research International . 2013 : 946268. doi : 10.1155/2013/946268 . PMC 3666359. PMID 23762867 .
- ^ Bi FF, Li D, Yang Q (febrero de 2013). "Hipometilación del promotor, especialmente alrededor del motivo específico de transformación E26, y aumento de la expresión de la poli (ADP-ribosa) polimerasa 1 en el cáncer de ovario seroso con mutación BRCA". BMC Cancer . 13 : 90. doi : 10.1186/1471-2407-13-90 . PMC 3599366 . PMID 23442605.
- ^ Supek F, Lehner B (mayo de 2015). "La reparación diferencial de los desajustes del ADN subyace a la variación de la tasa de mutación en el genoma humano". Nature . 521 (7550): 81–84. Bibcode :2015Natur.521...81S. doi :10.1038/nature14173. PMC 4425546 . PMID 25707793.
- ^ ab Zheng CL, Wang NJ, Chung J, Moslehi H, Sanborn JZ, Hur JS, et al. (noviembre de 2014). "La transcripción restaura la reparación del ADN a la heterocromatina, lo que determina las tasas de mutación regional en los genomas del cáncer". Cell Reports . 9 (4): 1228–34. doi :10.1016/j.celrep.2014.10.031. PMC 4254608 . PMID 25456125.
- ^ Li F, Mao G, Tong D, Huang J, Gu L, Yang W, et al. (abril de 2013). "La marca de histona H3K36me3 regula la reparación de errores de apareamiento del ADN humano a través de su interacción con MutSα". Cell . 153 (3): 590–600. doi :10.1016/j.cell.2013.03.025. PMC 3641580 . PMID 23622243.
- ^ Supek F, Lehner B (julio de 2017). "Las firmas de mutaciones agrupadas revelan que la reparación del ADN propensa a errores dirige las mutaciones a los genes activos". Cell . 170 (3): 534–547.e23. doi : 10.1016/j.cell.2017.07.003 . hdl : 10230/35343 . PMID 28753428.
- ^ Polak P, Lawrence MS, Haugen E, Stoletzki N, Stojanov P, Thurman RE, et al. (enero de 2014). "La densidad de mutación local reducida en el ADN regulador de los genomas del cáncer está vinculada a la reparación del ADN". Nature Biotechnology . 32 (1): 71–75. doi :10.1038/nbt.2778. PMC 4116484 . PMID 24336318.
- ^ Swenberg JA, Lu K, Moeller BC, Gao L, Upton PB, Nakamura J, et al. (marzo de 2011). "Aductos de ADN endógenos versus exógenos: su papel en la carcinogénesis, la epidemiología y la evaluación de riesgos". Toxicol Sci . 120 (Supl 1): S130–45. doi :10.1093/toxsci/kfq371. PMC 3043087 . PMID 21163908.
- ^ ab Hamilton ML, Guo Z, Fuller CD, Van Remmen H, Ward WF, Austad SN, et al. (mayo de 2001). "Una evaluación confiable de los niveles de 8-oxo-2-desoxiguanosina en el ADN nuclear y mitocondrial utilizando el método del yoduro de sodio para aislar el ADN". Nucleic Acids Res . 29 (10): 2117–26. doi :10.1093/nar/29.10.2117. PMC 55450 . PMID 11353081.
- ^ Ming X, Matter B, Song M, Veliath E, Shanley R, Jones R, et al. (marzo de 2014). "Mapeo de productos de oxidación de guanina definidos estructuralmente a lo largo de dúplex de ADN: influencia del contexto de secuencia local y metilación de citosina endógena". J Am Chem Soc . 136 (11): 4223–35. doi :10.1021/ja411636j. PMC 3985951 . PMID 24571128.
- ^ abc Zhou X, Zhuang Z, Wang W, He L, Wu H, Cao Y, et al. (septiembre de 2016). "OGG1 es esencial en la desmetilación del ADN inducida por estrés oxidativo". Cell Signal . 28 (9): 1163–1171. doi :10.1016/j.cellsig.2016.05.021. PMID 27251462.
- ^ Poetsch AR (2020). "La genómica del daño oxidativo del ADN, la reparación y la mutagénesis resultante". Comput Struct Biotechnol J. 18 : 207–219. doi :10.1016/j.csbj.2019.12.013. PMC 6974700. PMID 31993111 .
- ^ D'Augustin O, Huet S, Campalans A, Radicella JP (noviembre de 2020). "Perdidos entre la multitud: ¿cómo encuentra la ADN glicosilasa 1 de 8-oxoguanina humana (OGG1) 8-oxoguanina en el genoma?". Int J Mol Sci . 21 (21): 8360. doi : 10.3390/ijms21218360 . PMC 7664663 . PMID 33171795.
- ^ Lan L, Nakajima S, Oohata Y, Takao M, Okano S, Masutani M, et al. (septiembre de 2004). "Análisis in situ de los procesos de reparación del daño oxidativo del ADN en células de mamíferos". Proc Natl Acad Sci USA . 101 (38): 13738–43. Bibcode :2004PNAS..10113738L. doi : 10.1073/pnas.0406048101 . PMC 518826 . PMID 15365186.
- ^ Zhou X, Zhuang Z, Wang W, He L, Wu H, Cao Y, et al. (septiembre de 2016). "OGG1 es esencial en la desmetilación del ADN inducida por estrés oxidativo". Cell Signal . 28 (9): 1163–1171. doi :10.1016/j.cellsig.2016.05.021. PMID 27251462.
- ^ Moore LD, Le T, Fan G (enero de 2013). "Metilación del ADN y su función básica". Neuropsicofarmacología . 38 (1): 23–38. doi :10.1038/npp.2012.112. PMC 3521964 . PMID 22781841.
- ^ Maeder ML, Angstman JF, Richardson ME, Linder SJ, Cascio VM, Tsai SQ, et al. (diciembre de 2013). "Desmetilación de ADN dirigida y activación de genes endógenos utilizando proteínas de fusión TALE-TET1 programables". Nat. Biotechnol . 31 (12): 1137–42. doi :10.1038/nbt.2726. PMC 3858462. PMID 24108092 .
- ^ Ding N, Bonham EM, Hannon BE, Amick TR, Baylin SB, O'Hagan HM (junio de 2016). "Las proteínas reparadoras de desajustes reclutan la ADN metiltransferasa 1 a sitios de daño oxidativo del ADN". J Mol Cell Biol . 8 (3): 244–54. doi :10.1093/jmcb/mjv050. PMC 4937888 . PMID 26186941.
- ^ ab Jiang Z, Lai Y, Beaver JM, Tsegay PS, Zhao ML, Horton JK, et al. (enero de 2020). "El daño oxidativo del ADN modula el patrón de metilación del ADN en el gen del cáncer de mama humano 1 (BRCA1) a través de la interacción entre la ADN polimerasa β y una ADN metiltransferasa de novo". Cells . 9 (1): 225. doi : 10.3390/cells9010225 . PMC 7016758 . PMID 31963223.
- ^ Mortusewicz O, Schermelleh L, Walter J, Cardoso MC, Leonhardt H (junio de 2005). "Reclutamiento de la ADN metiltransferasa I a los sitios de reparación del ADN". Proc Natl Acad Sci USA . 102 (25): 8905–9. Bibcode :2005PNAS..102.8905M. doi : 10.1073/pnas.0501034102 . PMC 1157029 . PMID 15956212.
- ^ ab Cuozzo C, Porcellini A, Angrisano T, Morano A, Lee B, Di Pardo A, et al. (julio de 2007). "Daños en el ADN, reparación dirigida por homología y metilación del ADN". PLOS Genet . 3 (7): e110. doi : 10.1371/journal.pgen.0030110 . PMC 1913100 . PMID 17616978.
- ^ Ha K, Lee GE, Palii SS, Brown KD, Takeda Y, Liu K, et al. (enero de 2011). "El reclutamiento rápido y transitorio de DNMT1 a las roturas de doble cadena de ADN está mediado por su interacción con múltiples componentes de la maquinaria de respuesta al daño del ADN". Hum Mol Genet . 20 (1): 126–40. doi :10.1093/hmg/ddq451. PMC 3000680 . PMID 20940144.
- ^ Russo G, Landi R, Pezone A, Morano A, Zuchegna C, Romano A, et al. (septiembre de 2016). "El daño y la reparación del ADN modifican la metilación del ADN y el dominio de cromatina del locus objetivo: mecanismo del polimorfismo de metilación de alelos". Sci Rep . 6 : 33222. Bibcode :2016NatSR...633222R. doi :10.1038/srep33222. PMC 5024116 . PMID 27629060.
- ^ Farris MH, Texter PA, Mora AA, Wiles MV, Mac Garrigle EF, Klaus SA, et al. (diciembre de 2020). "Detección de modificaciones genómicas mediadas por CRISPR a través de patrones de metilación alterados de islas CpG". BMC Genomics . 21 (1): 856. doi : 10.1186/s12864-020-07233-2 . PMC 7709351 . PMID 33267773.
- ^ Allen B, Pezone A, Porcellini A, Muller MT, Masternak MM (junio de 2017). "Alteraciones inducidas por uniones de extremos no homólogos en la metilación del ADN: una fuente de cambio epigenético permanente". Oncotarget . 8 (25): 40359–40372. doi :10.18632/oncotarget.16122. PMC 5522286 . PMID 28423717.
- ^ Cromie GA, Connelly JC, Leach DR (diciembre de 2001). "Recombinación en roturas de doble cadena y extremos de ADN: mecanismos conservados desde el fago hasta los humanos". Molecular Cell . 8 (6): 1163–74. doi : 10.1016/S1097-2765(01)00419-1 . PMID 11779493.
- ^ O'Brien PJ (febrero de 2006). "Promiscuidad catalítica y evolución divergente de las enzimas reparadoras del ADN". Chemical Reviews . 106 (2): 720–52. doi :10.1021/cr040481v. PMID 16464022.
- ^ Maresca B, Schwartz JH (enero de 2006). "Orígenes repentinos: un mecanismo general de evolución basado en la concentración de proteínas de estrés y el cambio ambiental rápido". The Anatomical Record Part B: The New Anatomist . 289 (1): 38–46. doi : 10.1002/ar.b.20089 . PMID 16437551.
- ^ "La herramienta de edición genética CRISPR entusiasma a los científicos, pero también los pone nerviosos", CBC News. Autor: Kelly Crowe. 30 de noviembre de 2015.
Enlaces externos
 Medios relacionados con la reparación del ADN en Wikimedia Commons
Medios relacionados con la reparación del ADN en Wikimedia Commons- Conferencias sobre reparación del ADN en el Instituto del Cáncer de Roswell Park
- Una lista completa de genes de reparación del ADN humano
- Estructuras 3D de algunas enzimas reparadoras del ADN
- Machado CR, Menck CF (diciembre de 1997). "Enfermedades que requieren reparación del ADN humano: desde la inestabilidad del genoma hasta el cáncer". Braz. J. Genet . 20 (4): 755–762. doi : 10.1590/S0100-84551997000400032 .
- Grupo de interés especial en reparación del ADN
- Reparación del ADN Archivado el 12 de febrero de 2018 en Wayback Machine.
- Daño del ADN y reparación del ADN
- Progeria segmentaria
- Hakem R (febrero de 2008). "Reparación de daños en el ADN: lo bueno, lo malo y lo feo". EMBO J . 27 (4): 589–605. doi :10.1038/emboj.2008.15. PMC 2262034 . PMID 18285820.
- Morales ME, Derbes RS, Ade CM, Ortego JC, Stark J, Deininger PL, et al. (2016). "La exposición a metales pesados influye en los resultados de la reparación de la rotura de doble cadena del ADN". PLOS ONE . 11 (3): e0151367. Bibcode :2016PLoSO..1151367M. doi : 10.1371/journal.pone.0151367 . PMC 4788447 . PMID 26966913.

