MLH1
| MLH1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificadores | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Alias | MLH1 , homólogo 1 de mutL, COCA2, FCC2, HNPCC, HNPCC2, hMLH1 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificaciones externas | OMIM : 120436; MGI : 101938; HomoloGene : 208; Tarjetas genéticas : MLH1; OMA :MLH1 - ortólogos | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wikidatos | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
La proteína de reparación de desajustes de ADN Mlh1 u homóloga 1 de la proteína MutL es una proteína que en los seres humanos está codificada por el gen MLH1 ubicado en el cromosoma 3. El gen se asocia comúnmente con el cáncer colorrectal hereditario no asociado a poliposis . Los ortólogos de la MLH1 humana también se han estudiado en otros organismos, incluidos el ratón y la levadura en ciernes Saccharomyces cerevisiae .
Función
Las variantes de este gen pueden causar cáncer de colon hereditario no asociado a poliposis (síndrome de Lynch). Es un homólogo humano del gen de reparación de errores de emparejamiento de ADN de E. coli , mutL, que media las interacciones proteína-proteína durante el reconocimiento de errores de emparejamiento, la discriminación de hebras y la eliminación de hebras. Los defectos en MLH1 están asociados con la inestabilidad de microsatélites observada en el cáncer de colon hereditario no asociado a poliposis. Se han descrito variantes de transcripción empalmadas alternativamente que codifican diferentes isoformas, pero no se ha determinado su naturaleza completa. [4]
Papel en la reparación de errores de apareamiento del ADN
La proteína MLH1 es un componente de un sistema de siete proteínas de reparación de desajustes de ADN que trabajan coordinadamente en pasos secuenciales para iniciar la reparación de desajustes de ADN en humanos. [5] Los defectos en la reparación de desajustes, encontrados en aproximadamente el 13% de los cánceres colorrectales, se deben con mucha más frecuencia a la deficiencia de MLH1 que a las deficiencias de otras proteínas de reparación de desajustes de ADN. [6] Las siete proteínas de reparación de desajustes de ADN en humanos son MLH1, MLH3 , MSH2 , MSH3 , MSH6 , PMS1 y PMS2 . [5] Además, existen subvías de reparación de desajustes de ADN dependientes e independientes de Exo1. [ 7]
Los desajustes de ADN se producen cuando una base se empareja incorrectamente con otra base, o cuando hay una pequeña adición o eliminación en una cadena de ADN que no coincide con la otra cadena. Los desajustes ocurren comúnmente como resultado de errores de replicación de ADN o durante la recombinación genética. Reconocer esos desajustes y repararlos es importante para las células porque no hacerlo da como resultado inestabilidad de microsatélites] y una tasa elevada de mutación espontánea (fenotipo mutador). Entre los 20 cánceres evaluados, el cáncer de colon con inestabilidad de microsatélites (deficiente en la reparación de desajustes) tuvo la segunda frecuencia más alta de mutaciones (después del melanoma).
Un heterodímero entre MSH2 y MSH6 es el primero en reconocer el desajuste, aunque un heterodímero entre MSH2 y MSH3 también puede iniciar el proceso. La formación del heterodímero MSH2-MSH6 da cabida a un segundo heterodímero de MLH1 y PMS2, aunque un heterodímero entre MLH1 y PMS3 o MLH3 puede sustituir a PMS2. Este complejo proteico formado entre los dos conjuntos de heterodímeros permite iniciar la reparación del defecto de desajuste. [5]
Otros productos genéticos involucrados en la reparación de desajustes (posterior al inicio por los genes de reparación de desajustes de ADN) incluyen la ADN polimerasa delta , PCNA , RPA , HMGB1 , RFC y la ADN ligasa I , además de factores modificadores de histonas y cromatina . [8] [9]
Expresión deficiente en el cáncer
| Tipo de cáncer | Frecuencia de deficiencia en el cáncer | Frecuencia de deficiencia en defecto de campo adyacente |
|---|---|---|
| Estómago | 32% [10] [11] | 24–28% |
| Estómago (tumores de tipo foveolar) | 74% [12] | 71% |
| Estómago en el valle de Cachemira, donde hay una alta incidencia | 73% [13] | 20% |
| Esofágico | 73% [14] | 27% |
| Carcinoma de células escamosas de cabeza y cuello (HNSCC) | 31–33% [15] [16] | 20–25% |
| Cáncer de pulmón de células no pequeñas (CPCNP) | 69% [17] | 72% |
| Colorrectal | 10% [6] |
Represión epigenética
Solo una minoría de los cánceres esporádicos con deficiencia en la reparación del ADN tienen una mutación en un gen de reparación del ADN. Sin embargo, la mayoría de los cánceres esporádicos con deficiencia en la reparación del ADN tienen una o más alteraciones epigenéticas que reducen o silencian la expresión del gen de reparación del ADN. [18] En la tabla anterior, la mayoría de las deficiencias de MLH1 se debieron a la metilación de la región promotora del gen MLH1 . Otro mecanismo epigenético que reduce la expresión de MLH1 es la sobreexpresión de miR-155 . [19] El miR-155 se dirige a MLH1 y MSH2 y se encontró una correlación inversa entre la expresión de miR-155 y la expresión de las proteínas MLH1 o MSH2 en el cáncer colorrectal humano. [19]
Deficiencia en defectos de campo
Un defecto de campo es un área o "campo" de epitelio que ha sido preacondicionado por cambios epigenéticos y/o mutaciones de modo que lo predispone al desarrollo de cáncer. Como señala Rubin, "La gran mayoría de los estudios en investigación del cáncer se han realizado en tumores bien definidos in vivo, o en focos neoplásicos discretos in vitro. [20] Sin embargo, hay evidencia de que más del 80% de las mutaciones somáticas encontradas en tumores colorrectales humanos de fenotipo mutador ocurren antes del inicio de la expansión clonal terminal". [21] De manera similar, Vogelstein et al. [22] señalan que más de la mitad de las mutaciones somáticas identificadas en tumores ocurrieron en una fase preneoplásica (en un defecto de campo), durante el crecimiento de células aparentemente normales.
En la tabla anterior, se observaron deficiencias de MLH1 en los defectos de campo (tejidos histológicamente normales) que rodean la mayoría de los cánceres. Si MLH1 se reduce o silencia epigenéticamente, no es probable que confiera una ventaja selectiva a una célula madre. Sin embargo, la expresión reducida o ausente de MLH1 causaría mayores tasas de mutación, y uno o más de los genes mutados pueden proporcionar a la célula una ventaja selectiva. El gen MLH1 deficiente en expresión podría entonces ser transportado como un gen pasajero selectivamente neutral o solo ligeramente perjudicial (polizón) cuando la célula madre mutada genere un clon expandido. La presencia continua de un clon con un MLH1 reprimido epigenéticamente continuaría generando más mutaciones, algunas de las cuales podrían producir un tumor.
Represión en coordinación con otros genes de reparación del ADN
En un cáncer, a menudo se encuentra que múltiples genes de reparación del ADN se reprimen simultáneamente. [18] En un ejemplo, que involucra MLH1 , Jiang et al. [23] realizaron un estudio en el que evaluaron la expresión de ARNm de 27 genes de reparación del ADN en 40 astrocitomas en comparación con tejidos cerebrales normales de individuos sin astrocitomas. Entre los 27 genes de reparación del ADN evaluados, 13 genes de reparación del ADN, MLH1 , MLH3 , MGMT , NTHL1 , OGG1 , SMUG1 , ERCC1 , ERCC2 , ERCC3 , ERCC4 , RAD50 , XRCC4 y XRCC5 fueron significativamente regulados a la baja en los tres grados (II, III y IV) de astrocitomas. La represión de estos 13 genes en astrocitomas de grado inferior y de grado superior sugirió que pueden ser importantes tanto en etapas tempranas como posteriores del astrocitoma. En otro ejemplo, Kitajima et al. [24] encontraron que la inmunorreactividad para la expresión de MLH1 y MGMT estaba estrechamente correlacionada en 135 muestras de cáncer gástrico y la pérdida de MLH1 y MGMT parecía acelerarse sincrónicamente durante la progresión del tumor.
La expresión deficiente de múltiples genes de reparación del ADN se encuentra a menudo en los cánceres, [18] y puede contribuir a las miles de mutaciones que suelen encontrarse en los cánceres (ver Frecuencias de mutación en cánceres ).
Mitosis
Además de su papel en la reparación de desajustes de ADN, la proteína MLH1 también está involucrada en el entrecruzamiento meiótico . [25] MLH1 forma un heterodímero con MLH3 que parece ser necesario para que los ovocitos progresen a través de la metafase II de la meiosis . [26] Los ratones mutantes MLH1 (-/-) hembras y machos son infértiles, y la esterilidad está asociada con un nivel reducido de quiasmas . [25] [27] Durante la espermatogénesis en ratones mutantes MLH1 (-/-) los cromosomas a menudo se separan prematuramente y hay un arresto frecuente en la primera división de la meiosis. [25] En humanos, una variante común del gen MLH1 está asociada con un mayor riesgo de daño en los espermatozoides e infertilidad masculina. [28]
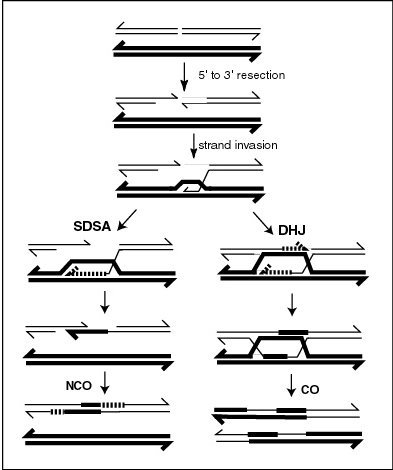
La proteína MLH1 parece localizarse en los sitios de entrecruzamiento en los cromosomas meióticos. [25] La recombinación durante la meiosis a menudo se inicia mediante una rotura de doble cadena de ADN (DSB), como se ilustra en el diagrama adjunto. Durante la recombinación, las secciones de ADN en los extremos 5' de la rotura se cortan en un proceso llamado resección . En el paso de invasión de la cadena que sigue, un extremo 3' sobresaliente de la molécula de ADN rota "invade" el ADN de un cromosoma homólogo que no está roto formando un bucle de desplazamiento ( bucle D ). Después de la invasión de la cadena, la secuencia posterior de eventos puede seguir cualquiera de las dos vías principales que conducen a un recombinante de entrecruzamiento (CO) o no entrecruzamiento (NCO) (ver Recombinación genética ). La vía que conduce a un CO implica un intermedio de doble unión de Holliday (DHJ). Las uniones de Holliday deben resolverse para que se complete la recombinación de CO.
En la levadura en ciernes Saccharomyces cerevisiae , al igual que en el ratón, MLH1 forma un heterodímero con MLH3. La CO meiótica requiere la resolución de las uniones de Holliday a través de acciones del heterodímero MLH1-MLH3 . El heterodímero MLH1-MLH3 es una endonucleasa que realiza roturas de cadena simple en el ADN bicatenario superenrollado . [29] [30] MLH1-MLH3 se une específicamente a las uniones de Holliday y puede actuar como parte de un complejo más grande para procesar las uniones de Holliday durante la meiosis . [29] El heterodímero MLH1-MLH3 (MutL gamma) junto con EXO1 y Sgs1 (ortólogo de la helicasa del síndrome de Bloom ) definen una vía de resolución de moléculas conjuntas que produce la mayoría de los entrecruzamientos en la levadura en ciernes y, por inferencia, en los mamíferos. [31]
Importancia clínica
También puede asociarse con el síndrome de Turcot . [32]
Interacciones
Se ha demostrado que MLH1 interactúa con:
- Proteína del síndrome de Bloom [33] [34] [35] [36]
- Exonucleasa 1 , [37]
- MBD4 , [38]
- MSH4 , [39]
- Myc , [40] y
- PMS2 . [40] [41] [42]
Véase también
Referencias
- ^ abc GRCm38: Lanzamiento de Ensembl 89: ENSMUSG00000032498 – Ensembl , mayo de 2017
- ^ "Referencia de PubMed humana:". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU .
- ^ "Referencia PubMed de ratón:". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU . .
- ^ "Gen Entrez: homólogo 1 de MLH1 mutL, cáncer de colon, no poliposis tipo 2 (E. coli)".
- ^ abc Pal T, Permuth-Wey J, Sellers TA (2008). "Una revisión de la relevancia clínica de la deficiencia de reparación de desajustes en el cáncer de ovario". Cáncer . 113 (4): 733–42. doi :10.1002/cncr.23601. PMC 2644411 . PMID 18543306.
- ^ ab Truninger K, Menigatti M, Luz J, Russell A, Haider R, Gebbers JO, Bannwart F, Yurtsever H, Neuweiler J, Riehle HM, Cattaruzza MS, Heinimann K, Schär P, Jiricny J, Marra G (2005). "El análisis inmunohistoquímico revela una alta frecuencia de defectos de PMS2 en el cáncer colorrectal". Gastroenterología . 128 (5): 1160–71. doi : 10.1053/j.gastro.2005.01.056 . PMID 15887099.
- ^ Goellner EM, Putnam CD, Kolodner RD (2015). "Reparación de desajustes dependiente e independiente de la exonucleasa 1". Reparación de ADN (Amst.) . 32 : 24–32. doi :10.1016/j.dnarep.2015.04.010. PMC 4522362. PMID 25956862 .
- ^ Li GM (2008). "Mecanismos y funciones de la reparación de errores de apareamiento del ADN". Cell Res . 18 (1): 85–98. doi : 10.1038/cr.2007.115 . PMID 18157157.
- ^ Li GM (2014). "Nuevos conocimientos y desafíos en la reparación de errores de emparejamiento: superando el obstáculo de la cromatina". Reparación de ADN (Amst.) . 19 : 48–54. doi :10.1016/j.dnarep.2014.03.027. PMC 4127414. PMID 24767944 .
- ^ Kupčinskaitė-Noreikienė R, Skiecevičienė J, Jonaitis L, Ugenskienė R, Kupčinskas J, Markelis R, Baltrėnas V, Sakavičius L, Semakina I, Grižas S, Juozaitytė E (2013). "Metilación de la isla CpG de los genes MLH1, MGMT, DAPK y CASP8 en tejidos estomacales cancerosos y no cancerosos adyacentes". Medicina (Kaunas) . 49 (8): 361–6. PMID 24509146.
- ^ Waki T, Tamura G, Tsuchiya T, Sato K, Nishizuka S, Motoyama T (2002). "Estado de metilación del promotor de los genes E-cadherina, hMLH1 y p16 en epitelios gástricos no neoplásicos". Am. J. Pathol . 161 (2): 399–403. doi :10.1016/S0002-9440(10)64195-8. PMC 1850716. PMID 12163364 .
- ^ Endoh Y, Tamura G, Ajioka Y, Watanabe H, Motoyama T (2000). "Hipermetilación frecuente del promotor del gen hMLH1 en tumores de tipo diferenciado del estómago con el fenotipo foveolar gástrico". Am. J. Pathol . 157 (3): 717–22. doi :10.1016/S0002-9440(10)64584-1. PMC 1949419. PMID 10980110 .
- ^ Wani M, Afroze D, Makhdoomi M, Hamid I, Wani B, Bhat G, Wani R, Wani K (2012). "Estado de metilación del promotor del gen de reparación del ADN (hMLH1) en pacientes con carcinoma gástrico del valle de Cachemira". Asian Pac. J. Cancer Prev . 13 (8): 4177–81. doi : 10.7314/apjcp.2012.13.8.4177 . PMID 23098428.
- ^ Chang Z, Zhang W, Chang Z, Song M, Qin Y, Chang F, Guo H, Wei Q (2015). "Características de expresión de FHIT, p53, BRCA2 y MLH1 en familias con antecedentes de cáncer de esófago en una región con una alta incidencia de cáncer de esófago". Oncol Lett . 9 (1): 430–436. doi :10.3892/ol.2014.2682. PMC 4246613 . PMID 25436004.
- ^ Tawfik HM, El-Maqsoud NM, Hak BH, El-Sherbiny YM (2011). "Carcinoma de células escamosas de cabeza y cuello: inmunohistoquímica de reparación de desajustes e hipermetilación del promotor del gen hMLH1". Am J Otolaryngol . 32 (6): 528–36. doi :10.1016/j.amjoto.2010.11.005. PMID 21353335.
- ^ Zuo C, Zhang H, Spencer HJ, Vural E, Suen JY, Schichman SA, Smoller BR, Kokoska MS, Fan CY (2009). "Aumento de la inestabilidad de microsatélites e inactivación epigenética del gen hMLH1 en el carcinoma de células escamosas de cabeza y cuello". Otolaryngol Head Neck Surg . 141 (4): 484–90. doi :10.1016/j.otohns.2009.07.007. PMID 19786217. S2CID 8357370.
- ^ Safar AM, Spencer H, Su X, Coffey M, Cooney CA, Ratnasinghe LD, Hutchins LF, Fan CY (2005). "Perfiles de metilación del cáncer de pulmón de células no pequeñas archivado: un sistema de pronóstico prometedor". Clin. Cancer Res . 11 (12): 4400–5. doi : 10.1158/1078-0432.CCR-04-2378 . PMID 15958624.
- ^ abc Bernstein C, Bernstein H (2015). "Reducción epigenética de la reparación del ADN en la progresión del cáncer gastrointestinal". World J Gastrointest Oncol . 7 (5): 30–46. doi : 10.4251/wjgo.v7.i5.30 . PMC 4434036 . PMID 25987950.
- ^ ab Valeri N, Gasparini P, Fabbri M, Braconi C, Veronese A, Lovat F, Adair B, Vannini I, Fanini F, Bottoni A, Costinean S, Sandhu SK, Nuovo GJ, Alder H, Gafa R, Calore F, Ferracin M, Lanza G, Volinia S, Negrini M, McIlhatton MA, Amadori D, Fishel R, Croce CM (2010). "Modulación de la reparación de desajustes y estabilidad genómica por miR-155". Proc. Nacional. Acad. Ciencia. EE.UU . 107 (15): 6982–7. Código Bib : 2010PNAS..107.6982V. doi : 10.1073/pnas.1002472107 . PMC 2872463 . Número de modelo: PMID20351277.
- ^ Rubin H (marzo de 2011). "Campos y cancerización de campos: los orígenes preneoplásicos del cáncer: los campos hiperplásicos asintomáticos son precursores de la neoplasia y su progresión a tumores se puede rastrear mediante la densidad de saturación en el cultivo". BioEssays . 33 (3): 224–31. doi :10.1002/bies.201000067. PMID 21254148. S2CID 44981539.
- ^ Tsao JL, Yatabe Y, Salovaara R, Järvinen HJ, Mecklin JP, Aaltonen LA, Tavaré S, Shibata D (febrero de 2000). "Reconstrucción genética de historias individuales de tumores colorrectales". Proc. Natl. Sci. EE. UU . . 97 (3): 1236–41. Bibcode :2000PNAS...97.1236T. doi : 10.1073/pnas.97.3.1236 . PMC 15581 . PMID 10655514.
- ^ Vogelstein B, Papadopoulos N, Velculescu VE, Zhou S, Diaz LA, Kinzler KW (marzo de 2013). "Paisajes del genoma del cáncer". Science . 339 (6127): 1546–58. Bibcode :2013Sci...339.1546V. doi :10.1126/science.1235122. PMC 3749880 . PMID 23539594.
- ^ Jiang Z, Hu J, Li X, Jiang Y, Zhou W, Lu D (2006). "Análisis de expresión de 27 genes de reparación de ADN en astrocitomas mediante matriz de baja densidad TaqMan". Neurosci. Lett . 409 (2): 112–7. doi :10.1016/j.neulet.2006.09.038. PMID 17034947. S2CID 54278905.
- ^ Kitajima Y, Miyazaki K, Matsukura S, Tanaka M, Sekiguchi M (2003). "Pérdida de expresión de las enzimas reparadoras del ADN MGMT, hMLH1 y hMSH2 durante la progresión tumoral en el cáncer gástrico". Cáncer gástrico . 6 (2): 86–95. doi : 10.1007/s10120-003-0213-z . PMID 12861399.
- ^ abcd Baker SM, Plug AW, Prolla TA, Bronner CE, Harris AC, Yao X, Christie DM, Monell C, Arnheim N, Bradley A, Ashley T, Liskay RM (1996). "Participación de Mlh1 de ratón en la reparación de errores de apareamiento del ADN y el entrecruzamiento meiótico". Nat. Genet . 13 (3): 336–42. doi :10.1038/ng0796-336. PMID 8673133. S2CID 37096830.
- ^ Kan R, Sun X, Kolas NK, Avdievich E, Kneitz B, Edelmann W, Cohen PE (2008). "Análisis comparativo de la progresión meiótica en ratones hembra que presentan mutaciones en genes de la vía de reparación de errores de apareamiento del ADN". Biol. Reprod . 78 (3): 462–71. doi : 10.1095/biolreprod.107.065771 . PMID 18057311.
- ^ Wei K, Kucherlapati R, Edelmann W (2002). "Modelos de ratón para defectos genéticos de reparación de desajustes del ADN humano". Trends Mol Med . 8 (7): 346–53. doi :10.1016/s1471-4914(02)02359-6. PMID 12114115.
- ^ Ji G, Long Y, Zhou Y, Huang C, Gu A, Wang X (2012). "Variantes comunes en genes de reparación de desajustes asociados con un mayor riesgo de daño del ADN del esperma e infertilidad masculina". BMC Med . 10 : 49. doi : 10.1186/1741-7015-10-49 . PMC 3378460 . PMID 22594646.
- ^ ab Ranjha L, Anand R, Cejka P (2014). "El heterodímero Mlh1-Mlh3 de Saccharomyces cerevisiae es una endonucleasa que se une preferentemente a las uniones de Holliday". J. Biol. Chem . 289 (9): 5674–86. doi : 10.1074/jbc.M113.533810 . PMC 3937642. PMID 24443562 .
- ^ Rogacheva MV, Manhart CM, Chen C, Guarne A, Surtees J, Alani E (2014). "Mlh1-Mlh3, un factor de reparación de errores de emparejamiento y cruce meiótico de ADN, es una endonucleasa estimulada por Msh2-Msh3". J. Biol. Chem . 289 (9): 5664–73. doi : 10.1074/jbc.M113.534644 . PMC 3937641. PMID 24403070 .
- ^ Zakharyevich K, Tang S, Ma Y, Hunter N (2012). "La delineación de las vías de resolución de moléculas conjuntas en la meiosis identifica una resolvasa específica de cruce". Cell . 149 (2): 334–47. doi :10.1016/j.cell.2012.03.023. PMC 3377385 . PMID 22500800.
- ^ Lebrun C, Olschwang S, Jeannin S, Vandenbos F, Sobol H, Frenay M (2007). "Síndrome de Turcot confirmado con análisis molecular". Eur. J. Neurol . 14 (4): 470–2. doi :10.1111/j.1468-1331.2006.01669.x. PMID 17389002. S2CID 21591979.
- ^ Wang Y, Cortez D, Yazdi P, Neff N, Elledge SJ, Qin J (abril de 2000). "BASC, un supercomplejo de proteínas asociadas a BRCA1 implicadas en el reconocimiento y reparación de estructuras de ADN aberrantes". Genes Dev . 14 (8): 927–39. doi :10.1101/gad.14.8.927. PMC 316544 . PMID 10783165.
- ^ Langland G, Kordich J, Creaney J, Goss KH, Lillard-Wetherell K, Bebenek K, Kunkel TA, Groden J (agosto de 2001). "La proteína del síndrome de Bloom (BLM) interactúa con MLH1 pero no es necesaria para la reparación de errores de apareamiento del ADN". J. Biol. Chem . 276 (32): 30031–5. doi : 10.1074/jbc.M009664200 . PMID 11325959.
- ^ Freire R, d'Adda Di Fagagna F, Wu L, Pedrazzi G, Stagljar I, Hickson ID, Jackson SP (agosto de 2001). "La escisión del producto del gen del síndrome de Bloom durante la apoptosis por la caspasa-3 da como resultado una interacción alterada con la topoisomerasa IIIalfa". Nucleic Acids Res . 29 (15): 3172–80. doi :10.1093/nar/29.15.3172. PMC 55826 . PMID 11470874.
- ^ Pedrazzi G, Perrera C, Blaser H, Kuster P, Marra G, Davies SL, Ryu GH, Freire R, Hickson ID, Jiricny J, Stagljar I (noviembre de 2001). "Asociación directa del producto del gen del síndrome de Bloom con la proteína de reparación de desajustes humanos MLH1". Nucleic Acids Res . 29 (21): 4378–86. doi :10.1093/nar/29.21.4378. PMC 60193 . PMID 11691925.
- ^ Schmutte C, Sadoff MM, Shim KS, Acharya S, Fishel R (agosto de 2001). "La interacción de las proteínas de reparación de desajustes de ADN con la exonucleasa I humana". J. Biol. Chem . 276 (35): 33011–8. doi : 10.1074/jbc.M102670200 . PMID 11427529.
- ^ Bellacosa A, Cicchillitti L, Schepis F, Riccio A, Yeung AT, Matsumoto Y, Golemis EA, Genuardi M, Neri G (marzo de 1999). "MED1, una nueva endonucleasa humana que se une a metil-CpG, interactúa con la proteína de reparación de errores de apareamiento del ADN MLH1". Proc. Natl. Sci. EE. UU . . 96 (7): 3969–74. Bibcode :1999PNAS...96.3969B. doi : 10.1073/pnas.96.7.3969 . PMC 22404 . PMID 10097147.
- ^ Santucci-Darmanin S, Walpita D, Lespinasse F, Desnuelle C, Ashley T, Paquis-Flucklinger V (agosto de 2000). "MSH4 actúa en conjunción con MLH1 durante la meiosis de los mamíferos". FASEB J . 14 (11): 1539–47. doi : 10.1096/fj.14.11.1539 . PMID 10928988.
- ^ ab Mac Partlin M, Homer E, Robinson H, McCormick CJ, Crouch DH, Durant ST, Matheson EC, Hall AG, Gillespie DA, Brown R (febrero de 2003). "Interacciones de las proteínas de reparación de errores de apareamiento del ADN MLH1 y MSH2 con c-MYC y MAX". Oncogene . 22 (6): 819–25. doi : 10.1038/sj.onc.1206252 . PMID 12584560.
- ^ Kondo E, Horii A, Fukushige S (abril de 2001). "Los dominios interactuantes de tres heterodímeros MutL en el hombre: hMLH1 interactúa con 36 residuos de aminoácidos homólogos dentro de hMLH3, hPMS1 y hPMS2". Nucleic Acids Res . 29 (8): 1695–702. doi :10.1093/nar/29.8.1695. PMC 31313 . PMID 11292842.
- ^ Guerrette S, Acharya S, Fishel R (marzo de 1999). "La interacción de los homólogos humanos de MutL en el cáncer de colon hereditario no asociado a poliposis". J. Biol. Chem . 274 (10): 6336–41. doi : 10.1074/jbc.274.10.6336 . PMID 10037723.
Lectura adicional
- Paraf F, Sasseville D, Watters AK, Narod S, Ginsburg O, Shibata H, Jothy S (1995). "Relevancia clínico-patológica de la asociación entre neoplasias gastrointestinales y sebáceas: el síndrome de Muir-Torre". Hum. Pathol . 26 (4): 422–7. doi :10.1016/0046-8177(95)90144-2. PMID 7705822.
- Kolodner RD (1996). "Reparación de errores de emparejamiento: mecanismos y relación con la susceptibilidad al cáncer". Trends Biochem. Sci . 20 (10): 397–401. doi :10.1016/S0968-0004(00)89087-8. PMID 8533151.
- Peltomäki P, de la Chapelle A (1997). Mutaciones que predisponen al cáncer colorrectal hereditario no asociado a poliposis . Avances en la investigación del cáncer. Vol. 71. págs. 93-119. doi :10.1016/S0065-230X(08)60097-4. ISBN 9780120066711. Número de identificación personal 9111864.
{{cite book}}:|journal=ignorado ( ayuda ) - Papadopoulos N, Lindblom A (1997). "Base molecular del HNPCC: mutaciones de los genes MMR". Hum. Mutat . 10 (2): 89–99. doi :10.1002/(SICI)1098-1004(1997)10:2<89::AID-HUMU1>3.0.CO;2-H. PMID 9259192. S2CID 6799575.
- Kauh J, Umbreit J (2004). "Prevención del cáncer colorrectal". Problemas actuales en el cáncer . 28 (5): 240–64. doi :10.1016/j.currproblcancer.2004.05.004. PMID 15375803.
- Warusavitarne J, Schnitzler M (2007). "El papel de la quimioterapia en el cáncer colorrectal con microsatélites inestables (MSI-H)". Revista internacional de enfermedades colorrectales . 22 (7): 739–48. doi :10.1007/s00384-006-0228-0. PMID 17109103. S2CID 6460105.
- Niv Y (2007). "Inestabilidad de microsatélites e hipermetilación del promotor MLH1 en el cáncer colorrectal". World J. Gastroenterol . 13 (12): 1767–9. doi : 10.3748/wjg.v13.i12.1767 . PMC 4149951 . PMID 17465465.
Enlaces externos
- Información sobre HNPCC del Instituto Nacional de Salud
- Entrada de GeneReviews/NCBI/NIH/UW sobre el síndrome de Lynch
- MLH1+protein,+human en los Encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
- Resumen de toda la información estructural disponible en el PDB para UniProt : P40692 (proteína reparadora de desajustes de ADN Mlh1) en PDBe-KB .




