Cianuro
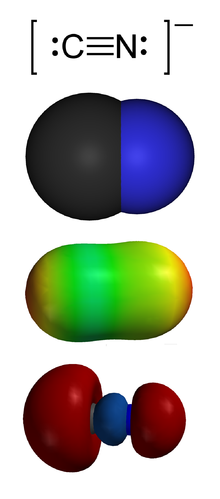 | |
| Nombres | |
|---|---|
| Nombre sistemático de la IUPAC Nitridocarbonato(II) | |
| Identificadores | |
| |
Modelo 3D ( JSmol ) |
|
| EBICh |
|
| Araña química |
|
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
| |
| |
| Propiedades | |
| CN − | |
| Masa molar | 26,018 g·mol −1 |
| Ácido conjugado | Cianuro de hidrógeno |
| Peligros | |
| Seguridad y salud en el trabajo (SST/OHS): | |
Principales peligros | El ion cianuro CN − es una de las sustancias químicas más venenosas. Puede causar la muerte en cuestión de minutos. |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
En química , el cianuro (del griego kyanos, « azul oscuro ») es un compuesto químico que contiene un grupo funcional C≡N . Este grupo, conocido como grupo ciano , está formado por un átomo de carbono unido mediante un triple enlace a un átomo de nitrógeno . [1]
En los cianuros inorgánicos , el grupo cianuro está presente como el anión cianuro − C≡N . Este anión es extremadamente venenoso . Las sales solubles como el cianuro de sodio (NaCN) y el cianuro de potasio (KCN) son altamente tóxicas. [2] El ácido cianhídrico , también conocido como cianuro de hidrógeno o HCN, es un líquido altamente volátil que se produce a gran escala industrialmente. Se obtiene por acidificación de sales de cianuro.
Los cianuros orgánicos se denominan habitualmente nitrilos . En los nitrilos, el grupo −C≡N está unido al carbono mediante un enlace covalente simple. Por ejemplo, en el acetonitrilo ( CH 3 −C≡N ), el grupo cianuro está unido al metilo ( −CH 3 ). Aunque los nitrilos no suelen liberar iones cianuro, las cianhidrinas sí lo hacen y, por tanto, son tóxicas.
Vinculación
El ion cianuro − C≡N es isoelectrónico con el monóxido de carbono − C≡O + y con el nitrógeno molecular N≡N. Existe un triple enlace entre C y N. La carga negativa se concentra en el carbono C. [3] [4]
Aparición
En la naturaleza

Los cianuros son producidos por ciertas bacterias , hongos y algas . Es un antialimentario en varias plantas. Los cianuros se encuentran en cantidades sustanciales en ciertas semillas y huesos de frutas, por ejemplo, los de almendras amargas , albaricoques , manzanas y melocotones . [5] Los compuestos químicos que pueden liberar cianuro se conocen como compuestos cianogénicos. En las plantas, los cianuros suelen estar unidos a moléculas de azúcar en forma de glucósidos cianogénicos y defienden a la planta contra los herbívoros . Las raíces de yuca (también llamada mandioca), un importante alimento parecido a la papa que se cultiva en países tropicales (y la base de la que se elabora la tapioca ), también contienen glucósidos cianogénicos. [6] [7]
El bambú de Madagascar , Cathariostachys madagascariensis, produce cianuro como elemento disuasorio para el pastoreo. En respuesta, el lémur dorado del bambú , que se alimenta de bambú, ha desarrollado una alta tolerancia al cianuro.
Las enzimas hidrogenasas contienen ligandos de cianuro unidos al hierro en sus sitios activos. La biosíntesis de cianuro en las hidrogenasas NiFe procede del fosfato de carbamoilo , que se convierte en tiocianato de cisteinilo , el donador de CN − . [8]
Medio interestelar
El radical cianuro • CN se ha identificado en el espacio interestelar . [9] El cianógeno , (CN) 2 , se utiliza para medir la temperatura de las nubes de gas interestelar . [10]
Producto de pirólisis y combustión.
El cianuro de hidrógeno se produce por la combustión o pirólisis de ciertos materiales en condiciones de deficiencia de oxígeno. Por ejemplo, se puede detectar en los gases de escape de los motores de combustión interna y en el humo del tabaco . Algunos plásticos , especialmente los derivados del acrilonitrilo , liberan cianuro de hidrógeno cuando se calientan o se queman. [11]
Derivados orgánicos
En la nomenclatura IUPAC , los compuestos orgánicos que tienen un grupo funcional −C≡N se denominan nitrilos . [12] [13] Un ejemplo de nitrilo es el acetonitrilo , CH 3 −C≡N . Los nitrilos normalmente no liberan iones cianuro. Un grupo funcional con un hidroxilo −OH y cianuro −CN unido al mismo átomo de carbono se denomina cianhidrina ( R 2 C(OH)CN ). A diferencia de los nitrilos, las cianhidrinas liberan cianuro de hidrógeno venenoso .
Reacciones
Protonación
El cianuro es básico. El p K a del cianuro de hidrógeno es 9,21. Por lo tanto, la adición de ácidos más fuertes que el cianuro de hidrógeno a soluciones de sales de cianuro libera cianuro de hidrógeno .
Hidrólisis
El cianuro es inestable en agua, pero la reacción es lenta hasta aproximadamente 170 °C. Sufre hidrólisis para dar amoníaco y formiato , que son mucho menos tóxicos que el cianuro: [14]
- CN − + 2 H 2 O → HCO−2+ NH3
La cianuro hidrolasa es una enzima que cataliza esta reacción.
Alquilación
Debido a la alta nucleofilia del anión cianuro , los grupos ciano se introducen fácilmente en las moléculas orgánicas mediante el desplazamiento de un grupo haluro (por ejemplo, el cloruro en el cloruro de metilo ). En general, los cianuros orgánicos se denominan nitrilos. En la síntesis orgánica, el cianuro es un sintón C-1 ; es decir, se puede utilizar para alargar una cadena de carbono en uno, al tiempo que conserva la capacidad de ser funcionalizado. [15]
- RX + CN − → RCN + X −
Redox
El ion cianuro es un reductor y se oxida con agentes oxidantes fuertes como el cloro molecular ( Cl2 ) , el hipoclorito ( ClO− ) y el peróxido de hidrógeno ( H2O2 ). Estos oxidantes se utilizan para destruir los cianuros en los efluentes de la minería de oro . [16] [17] [18]
Complejación de metales
El anión cianuro reacciona con metales de transición para formar enlaces M-CN . Esta reacción es la base de la toxicidad del cianuro. [19] Las altas afinidades de los metales por este anión se pueden atribuir a su carga negativa, compacidad y capacidad para participar en enlaces π.
Entre los compuestos de coordinación de cianuro más importantes se encuentran el ferrocianuro de potasio y el pigmento azul de Prusia , que son esencialmente no tóxicos debido a la fuerte unión de los cianuros a un átomo central de hierro. [20] El azul de Prusia se fabricó por primera vez accidentalmente alrededor de 1706, al calentar sustancias que contenían hierro, carbono y nitrógeno, y otros cianuros fabricados posteriormente (y nombrados en su honor). Entre sus muchos usos, el azul de Prusia da el color azul a los planos , al pavonado y a los cianotipos .
Fabricar
El principal proceso utilizado para fabricar cianuros es el proceso Andrussow, en el que se produce cianuro de hidrógeno gaseoso a partir de metano y amoníaco en presencia de oxígeno y un catalizador de platino . [21] [22]
- 2 CH 4 + 2 NH 3 + 3 O 2 → 2 HCN + 6 H 2 O
El cianuro de sodio, precursor de la mayoría de los cianuros, se produce tratando el cianuro de hidrógeno con hidróxido de sodio : [14]
- HCN + NaOH → NaCN + H2O
Toxicidad
Entre los cianuros más tóxicos se encuentran el cianuro de hidrógeno (HCN), el cianuro de sodio (NaCN), el cianuro de potasio (KCN) y el cianuro de calcio (Ca(CN)₂). Estos compuestos son extremadamente venenosos y requieren un manejo cuidadoso para evitar graves riesgos para la salud. El anión cianuro es un inhibidor de la enzima citocromo c oxidasa (también conocida como aa3 ) , el cuarto complejo de la cadena de transporte de electrones que se encuentra en la membrana interna de las mitocondrias de las células eucariotas . Se une al hierro dentro de esta proteína. La unión del cianuro a esta enzima impide el transporte de electrones desde el citocromo c al oxígeno. Como resultado, la cadena de transporte de electrones se interrumpe, lo que significa que la célula ya no puede producir ATP aeróbicamente para obtener energía. [23] Los tejidos que dependen en gran medida de la respiración aeróbica , como el sistema nervioso central y el corazón , se ven particularmente afectados. Este es un ejemplo de hipoxia histotóxica . [24]
El compuesto más peligroso es el cianuro de hidrógeno , que es un gas y mata por inhalación. Por esta razón, se debe usar un respirador de aire provisto de una fuente de oxígeno externa cuando se trabaja con cianuro de hidrógeno. [11] El cianuro de hidrógeno se produce agregando ácido a una solución que contiene una sal de cianuro. Las soluciones alcalinas de cianuro son más seguras de usar porque no desprenden gas de cianuro de hidrógeno. El cianuro de hidrógeno puede producirse en la combustión de poliuretanos ; por esta razón, no se recomienda el uso de poliuretanos en muebles domésticos y de aeronaves. La ingestión oral de una pequeña cantidad de cianuro sólido o una solución de cianuro de tan solo 200 mg, o la exposición a cianuro en el aire de 270 ppm , es suficiente para causar la muerte en minutos. [24]
Los nitrilos orgánicos no liberan fácilmente iones cianuro, por lo que tienen baja toxicidad. Por el contrario, compuestos como el cianuro de trimetilsililo (CH3 ) 3SiCN liberan fácilmente HCN o el ion cianuro al entrar en contacto con el agua. [25]
Antídoto
La hidroxocobalamina reacciona con el cianuro para formar cianocobalamina , que puede eliminarse sin problemas por los riñones. Este método tiene la ventaja de evitar la formación de metahemoglobina (véase más adelante). Este kit de antídoto se vende bajo la marca Cyanokit y fue aprobado por la FDA de EE. UU. en 2006. [26]
Un kit de antídoto más antiguo contra el cianuro incluía la administración de tres sustancias: perlas de nitrito de amilo (administradas por inhalación), nitrito de sodio y tiosulfato de sodio . El objetivo del antídoto era generar una gran cantidad de hierro férrico ( Fe 3+ ) para competir por el cianuro con el citocromo a 3 (de modo que el cianuro se uniera al antídoto en lugar de a la enzima). Los nitritos oxidan la hemoglobina a metahemoglobina , que compite con la citocromo oxidasa por el ion cianuro. Se forma cianmetahemoglobina y se restaura la enzima citocromo oxidasa . El principal mecanismo para eliminar el cianuro del cuerpo es mediante la conversión enzimática a tiocianato por la enzima mitocondrial rodanasa . El tiocianato es una molécula relativamente no tóxica y se excreta por los riñones. Para acelerar esta desintoxicación, se administra tiosulfato de sodio para proporcionar un donante de azufre para la rodanasa , necesario para producir tiocianato. [27]
Sensibilidad
Los niveles mínimos de riesgo (LMR) pueden no proteger contra efectos retardados en la salud o efectos en la salud adquiridos después de una exposición subletal repetida, como hipersensibilidad, asma o bronquitis . Los LMR pueden revisarse después de que se acumulen datos suficientes. [28]
Aplicaciones
Minería
El cianuro se produce principalmente para la minería de plata y oro : ayuda a disolver estos metales, lo que permite separarlos de los demás sólidos. En el proceso de cianuro , el mineral de alta calidad finamente molido se mezcla con el cianuro (en una proporción de aproximadamente 1:500 partes de NaCN por mineral); los minerales de baja calidad se apilan en montones y se rocían con una solución de cianuro (en una proporción de aproximadamente 1:1000 partes de NaCN por mineral). Los metales preciosos se complejan con los aniones de cianuro para formar derivados solubles, por ejemplo, [Ag(CN) 2 ] − (dicianoargentato(I)) y [Au(CN) 2 ] − (dicianoaurato(I)). [14] La plata es menos "noble" que el oro y a menudo se presenta como sulfuro, en cuyo caso no se invoca la oxidación-reducción (no se requiere O 2 ). En cambio, se produce una reacción de desplazamiento:
El "licor preñado" que contiene estos iones se separa de los sólidos, que se desechan en un estanque de relaves o en un montón de desechos, una vez eliminado el oro recuperable. El metal se recupera de la "solución preñada" mediante reducción con polvo de cinc o mediante adsorción sobre carbón activado . Este proceso puede dar lugar a problemas ambientales y de salud. Una serie de desastres ambientales han seguido al desbordamiento de los estanques de relaves en las minas de oro. La contaminación de las vías fluviales con cianuro ha dado lugar a numerosos casos de mortalidad humana y de especies acuáticas. [29]
El cianuro acuoso se hidroliza rápidamente, especialmente a la luz del sol. Puede movilizar algunos metales pesados como el mercurio si está presente. El oro también puede estar asociado con la arsenopirita (FeAsS), que es similar a la pirita de hierro (oro de los tontos), en la que la mitad de los átomos de azufre están reemplazados por arsénico . Los minerales de arsenopirita que contienen oro son igualmente reactivos con el cianuro inorgánico. [30] [31]
Química orgánica industrial
La segunda aplicación importante de los cianuros de metales alcalinos (después de la minería) es la producción de compuestos que contienen CN, generalmente nitrilos. Los cianuros de acilo se producen a partir de cloruros de acilo y cianuro. El cianógeno , el cloruro de cianógeno y el trímero cloruro cianúrico se derivan de los cianuros de metales alcalinos.
Usos médicos
El compuesto de cianuro nitroprusiato de sodio se utiliza principalmente en química clínica para medir los cuerpos cetónicos en la orina, principalmente como seguimiento de pacientes diabéticos . En ocasiones, se utiliza en situaciones médicas de emergencia para producir una rápida disminución de la presión arterial en humanos; también se utiliza como vasodilatador en la investigación vascular. El cobalto en la vitamina B 12 artificial contiene un ligando de cianuro como un artefacto del proceso de purificación; este debe ser eliminado por el cuerpo antes de que la molécula de vitamina pueda activarse para su uso bioquímico. Durante la Primera Guerra Mundial , los médicos japoneses utilizaron brevemente un compuesto de cianuro de cobre para el tratamiento de la tuberculosis y la lepra . [32]
Pesca ilegal y caza furtiva
Los cianuros se utilizan ilegalmente para capturar peces vivos cerca de los arrecifes de coral para su consumo en acuarios y mercados de mariscos. La práctica es controvertida, peligrosa y dañina, pero está impulsada por el lucrativo mercado de peces exóticos. [33]
Se sabe que los cazadores furtivos en África utilizan cianuro para envenenar los pozos de agua y matar elefantes para obtener su marfil. [34]
Control de plagas
Los dispositivos de cianuro M44 se utilizan en los Estados Unidos para matar coyotes y otros cánidos. [35] El cianuro también se utiliza para el control de plagas en Nueva Zelanda , en particular para las zarigüeyas , un marsupial introducido que amenaza la conservación de las especies nativas y propaga la tuberculosis entre el ganado. Las zarigüeyas pueden volverse tímidas ante el cebo, pero el uso de pellets que contienen cianuro reduce la timidez ante el cebo. Se sabe que el cianuro mata aves nativas, incluido el kiwi en peligro de extinción . [36] El cianuro también es eficaz para controlar el ualabí dama , otra plaga marsupial introducida en Nueva Zelanda. [37] Se requiere una licencia para almacenar, manipular y utilizar cianuro en Nueva Zelanda.
Los cianuros se utilizan como insecticidas para fumigar barcos. [38] Las sales de cianuro se utilizan para matar hormigas, [39] y en algunos lugares se han utilizado como veneno para ratas [40] (el arsénico, un veneno menos tóxico , es el más común). [41]
Usos de nicho
El ferrocianuro de potasio se utiliza para lograr un color azul en las esculturas de bronce fundido durante la etapa de acabado final de la escultura. Por sí solo, producirá un tono de azul muy oscuro y a menudo se mezcla con otros productos químicos para lograr el tono y el matiz deseados. Se aplica utilizando un soplete y un pincel mientras se usa el equipo de seguridad estándar que se usa para cualquier aplicación de pátina: guantes de goma, gafas de seguridad y un respirador. La cantidad real de cianuro en la mezcla varía según las recetas utilizadas por cada fundición.
El cianuro también se utiliza en la fabricación de joyas y en ciertos tipos de fotografía, como el tono sepia .
Aunque generalmente se piensa que son tóxicos, el cianuro y las cianhidrinas aumentan la germinación en varias especies de plantas. [42] [43]
Envenenamiento humano
A lo largo de la historia se han producido muchas intoxicaciones deliberadas de seres humanos con cianuro. [44] Las sales comunes, como el cianuro de sodio , no son volátiles pero son solubles en agua, por lo que son venenosas si se ingieren. El cianuro de hidrógeno es un gas, lo que lo hace más peligroso de forma indiscriminada; sin embargo, es más ligero que el aire y se dispersa rápidamente en la atmósfera, lo que lo hace ineficaz como arma química .
Aditivo alimentario
Debido a la alta estabilidad de su complexación con el hierro , los ferrocianuros ( ferrocianuro de sodio E535, ferrocianuro de potasio E536 y ferrocianuro de calcio E538 [45] ) no se descomponen a niveles letales en el cuerpo humano y se utilizan en la industria alimentaria, por ejemplo, como agente antiaglomerante en la sal de mesa . [46]
Pruebas químicas para cianuro
El cianuro se cuantifica mediante titulación potenciométrica , un método ampliamente utilizado en la minería de oro. También se puede determinar mediante titulación con iones de plata. Algunos análisis comienzan con una purga de aire de una solución hirviente acidificada, barriendo los vapores hacia una solución absorbente básica. Luego se analiza la sal de cianuro absorbida en la solución básica. [47]
Pruebas cualitativas
Debido a la notoria toxicidad del cianuro, se han investigado muchos métodos. La bencidina da una coloración azul en presencia de ferricianuro . [48] El sulfato de hierro (II) agregado a una solución de cianuro, como el filtrado de la prueba de fusión de sodio , da azul de Prusia . Una solución de para -benzoquinona en DMSO reacciona con cianuro inorgánico para formar un cianofenol , que es fluorescente . La iluminación con una luz ultravioleta da un brillo verde/azul si la prueba es positiva. [49]
Referencias
- ^ "cianuros". Libro de Oro de la IUPAC . 2014. doi : 10.1351/goldbook.C01486 .
- ^ "Efectos del cianuro en la salud y el medio ambiente". Instituto Internacional de Gestión del Cianuro. 2006. Archivado desde el original el 30 de noviembre de 2012. Consultado el 4 de agosto de 2009 .
- ^ Greenwood, NN; y Earnshaw, A. (1997). Química de los elementos (2.ª ed.), Oxford: Butterworth-Heinemann. ISBN 0-7506-3365-4 . [ página necesaria ]
- ^ GL Miessler y DA Tarr "Química inorgánica", 3.ª edición, editorial Pearson/Prentice Hall, ISBN 0-13-035471-6 . [ página necesaria ]
- ^ "ToxFAQs for Cyanide" (Preguntas frecuentes sobre toxicidad del cianuro). Agencia para Sustancias Tóxicas y Registro de Enfermedades . Julio de 2006. Consultado el 28 de junio de 2008 .
- ^ Vetter, J. (2000). "Glicósidos cianogénicos de plantas". Toxicon . 38 (1): 11–36. doi :10.1016/S0041-0101(99)00128-2. PMID 10669009.
- ^ Jones, DA (1998). "¿Por qué tantas plantas alimenticias son cianogénicas?". Fitoquímica . 47 (2): 155–162. Bibcode :1998PChem..47..155J. doi :10.1016/S0031-9422(97)00425-1. PMID 9431670.
- ^ Reissmann, Stefanie; Hochleitner, Elisabeth; Wang, Haofan; Paschos, Athanasios; Lottspeich, Friedrich; Glass, Richard S.; Böck, August (2003). "Doma de un veneno: biosíntesis de los ligandos de cianuro de NiFe-hidrogenasa" (PDF) . Science . 299 (5609): 1067–1070. Bibcode :2003Sci...299.1067R. doi :10.1126/science.1080972. PMID 12586941. S2CID 20488694. Archivado (PDF) desde el original el 23 de noviembre de 2020.
- ^ Pieniazek, Piotr A.; Bradforth, Stephen E.; Krylov, Anna I. (7 de diciembre de 2005). "Espectroscopia del radical ciano en un entorno acuoso" (PDF) . The Journal of Physical Chemistry A . 110 (14): 4854–4865. Bibcode :2006JPCA..110.4854P. doi :10.1021/jp0545952. PMID 16599455. Archivado desde el original (PDF) el 11 de septiembre de 2008 . Consultado el 23 de agosto de 2008 .
- ^ Roth, KC; Meyer, DM; Hawkins, I. (1993). "Cianógeno interestelar y temperatura de la radiación de fondo de microondas cósmica" (PDF) . The Astrophysical Journal . 413 (2): L67–L71. Bibcode :1993ApJ...413L..67R. doi :10.1086/186961.
- ^ ab Anon (27 de junio de 2013). "Datos sobre el cianuro: dónde se encuentra y cómo se utiliza". Preparación y respuesta ante emergencias de los CDC . Centros para el Control y la Prevención de Enfermedades . Consultado el 10 de diciembre de 2016 .
- ^ Libro de Oro de la IUPAC sobre nitrilos
- ^ Nitrilos NCBI-MeSH
- ^ abc Rubo, Andreas; Kellens, Raf; Reddy, Jay; Steier, Norberto; Hasenpusch, Wolfgang (2006). "Cianuros de metales alcalinos". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.i01_i01. ISBN 978-3527306732.
- ^ Pollak, Peter; Romeder, Gerard; Hagedorn, Fernando; Gelbke, Heinz-Peter (2000). "Nitrilos". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a17_363. ISBN 3-527-30673-0.
- ^ Young, CA y Jordan, TS (mayo de 1995). Remediación del cianuro: tecnologías actuales y pasadas. En: Actas de la 10.ª Conferencia Anual sobre Investigación de Residuos Peligrosos (págs. 104-129). Universidad Estatal de Kansas: Manhattan, KS. https://engg.ksu.edu/HSRC/95Proceed/young.pdf
- ^ Dmitry Yermakov. «Destrucción con cianuro | SRK Consulting». srk.com . Consultado el 2 de marzo de 2021 .
- ^ Botz Michael M. Descripción general de los métodos de tratamiento con cianuro. Elbow Creek Engineering, Inc. http://www.botz.com/MEMCyanideTreatment.pdf
- ^ Sharpe, AG La química de los complejos ciano de los metales de transición; Academic Press: Londres, 1976 [ página necesaria ]
- ^ Holleman, AF; Wiberg, E. (2001). Química inorgánica . San Diego: Academic Press. ISBN 978-0-12-352651-9.
- ^ Andrussow, Leonid (1927). "Über die schnell verlaufenden katalytischen Prozesse in strömenden Gasen und die Ammoniak-Oxydation (V)" [Acerca de los procesos catalíticos rápidos en gases que fluyen y la oxidación del amoníaco (V)]. Berichte der Deutschen Chemischen Gesellschaft (en alemán). 60 (8): 2005-2018. doi :10.1002/cber.19270600857.
- ^ Andrussow, L. (1935). "Über die katalytische Oxydation von Ammoniak-Methan-Gemischen zu Blausäure" [Acerca de la oxidación catalítica de mezclas de amoníaco y metano a cianuro]. Angewandte Chemie (en alemán). 48 (37): 593–595. Código bibliográfico : 1935AngCh..48..593A. doi : 10.1002/ange.19350483702.
- ^ Nelson, David L.; Cox, Michael M. (2000). Principios de bioquímica de Lehniger (3.ª ed.). Nueva York: Worth Publishers . pp. 668, 670–71, 676. ISBN 978-1-57259-153-0.
- ^ ab Biller, José (2007). "163". Interfase de la neurología y la medicina interna (edición ilustrada). Lippincott Williams & Wilkins. pág. 939. ISBN 978-0-7817-7906-7.
- ^ "Ficha de datos de seguridad del cianuro de trimetilsililo" (PDF) . Gelest Inc. 2008. Archivado (PDF) desde el original el 10 de octubre de 2022 . Consultado el 16 de agosto de 2022 .
- ^ Toxicidad por cianuro: tratamiento en eMedicine
- ^ Chaudhary, M.; Gupta, R. (2012). "Enzima desintoxicante de cianuro: rodanesa". Biotecnología actual . 1 (4): 327–335. doi :10.2174/2211550111201040327.
- ^ Perfil toxicológico del cianuro (PDF) (Informe). Departamento de Salud y Servicios Humanos de los Estados Unidos. 2006. págs. 18-19. Archivado (PDF) desde el original el 31 de marzo de 2004.
- ^ Kumar, Rahul; Saha, Shouvik; Sarita, Dhaka; Mayur B., Kurade; Kang, Chan Ung; Baek, Seung Han; Jeong, Byong-Hun (2016). "Remediación de entornos contaminados con cianuro a través de microbios y plantas: una revisión del conocimiento actual y perspectivas futuras". Ingeniería de geosistemas . 70 (1): 28–40. doi :10.1080/12269328.2016.1218303. S2CID 132571397 . Consultado el 24 de abril de 2022 .
- ^ Konyratbekova, Saltanat Sabitovna; Baikonurova, Aliya; Akcil, Ata (4 de mayo de 2015). "Procesos de lixiviación sin cianuro en la hidrometalurgia del oro y aplicaciones de yodo-yoduro: una revisión". Revisión de procesamiento de minerales y metalurgia extractiva . 36 (3): 198–212. doi :10.1080/08827508.2014.942813. ISSN 0882-7508.
- ^ Zhang, Yan; Cui, Mingyao; Wang, Jianguo; Liu, Xiaoliang; Lyu, Xianjun (2022). "Una revisión de la extracción de oro utilizando alternativas al cianuro: enfoque en el estado actual y las perspectivas futuras de los nuevos lixiviantes sintéticos ecológicos para el oro". Ingeniería de minerales . 176 : 107336. doi :10.1016/j.mineng.2021.107336.
- ^ Takano, R. (agosto de 1916). "El tratamiento de la lepra con cianocuprol". The Journal of Experimental Medicine . 24 (2): 207–211. doi :10.1084/jem.24.2.207. PMC 2125457 . PMID 19868035 . Consultado el 28 de junio de 2008 .
- ^ Dzombak, David A; Ghosh, Rajat S; Wong-Chong, George M. Cianuro en el agua y el suelo . CRC Press , 2006, Capítulo 11.2: "Uso de cianuro para capturar peces vivos de arrecife".
- ^ Cazadores furtivos matan a 80 elefantes con cianuro en Zimbabwe ABC News , 25 de septiembre de 2013. Consultado el 30 de octubre de 2015.
- ^ Shivik, John A.; Mastro, Lauren; Young, Julie K. (2014). "Asistencia de animales a los sitios de eyección de cianuro de sodio M-44 para coyotes". Wildlife Society Bulletin . 38 (1): 217–220. Bibcode :2014WSBu...38..217S. doi :10.1002/wsb.361.
- ^ Green, Wren (julio de 2004). "El uso de 1080 para el control de plagas" (PDF) . Departamento de Conservación de Nueva Zelanda . Consultado el 8 de junio de 2011 .
- ^ Shapiro, Lee; et al. (21 de marzo de 2011). "Eficacia de los gránulos de cianuro para el control de los ualabíes dama (Macropus eugenii)" (PDF) . New Zealand Journal of Ecology . 35 (3). Archivado (PDF) desde el original el 3 de febrero de 2015.
- ^ "Cianuro de sodio". PubChem . Centro Nacional de Información Biotecnológica. 2016 . Consultado el 2 de septiembre de 2016 .
El cianuro y el cianuro de hidrógeno se utilizan en la galvanoplastia, la metalurgia, la producción de productos químicos orgánicos, el revelado fotográfico, la fabricación de plásticos, la fumigación de barcos y algunos procesos mineros.
- ^ "Decisión de elegibilidad para la reinscripción (RED) Cianuro de sodio" (PDF) . EPA.gov . 1 de septiembre de 1994. pág. 7. Archivado (PDF) desde el original el 10 de octubre de 2022 . Consultado el 2 de septiembre de 2016 .
El cianuro de sodio se registró inicialmente como pesticida el 23 de diciembre de 1947 para controlar las hormigas en áreas agrícolas y no agrícolas no cultivadas.
- ^ "Información arancelaria, 1921: Audiencias sobre la revisión general de aranceles ante el Comité de Medios y Arbitrios, Cámara de Representantes". IberLibro.com . Congreso de los Estados Unidos, Comité de Medios y Arbitrios de la Cámara de Representantes, Imprenta del Gobierno de los Estados Unidos. 1921. p. 3987 . Consultado el 2 de septiembre de 2016 .
Otro campo en el que el cianuro se utiliza en cantidades cada vez mayores es la erradicación de ratas y otras alimañas, especialmente en la lucha contra el tifus.
- ^ "Los venenos más letales utilizados por el hombre". PlanetDeadly.com . 18 de noviembre de 2013. Archivado desde el original el 11 de mayo de 2016. Consultado el 2 de septiembre de 2016 .
- ^ Taylorson, R.; Hendricks, SB (1973). "Promoción de la germinación de semillas mediante cianuro". Plant Physiol . 52 (1): 23–27. doi :10.1104/pp.52.1.23. PMC 366431 . PMID 16658492.
- ^ Mullick, P.; Chatterji, UN (1967). "Efecto del cianuro de sodio en la germinación de dos semillas de leguminosas". Plant Systematics and Evolution . 114 : 88–91. doi :10.1007/BF01373937. S2CID 2533762.
- ^ Bernan (2008). Manual de gestión médica de víctimas de accidentes químicos (4.ª ed.). Imprenta del Gobierno, pág. 41. ISBN 978-0-16-081320-7.Extracto pág. 41
- ^ Bender, David A.; Bender, Arnold Eric (1997). Diccionario de nutrición y tecnología alimentaria de Bender (7.ª ed.). Woodhead Publishing. pág. 459. ISBN 978-1-85573-475-3.Extracto de la página 459
- ^ Schulz, Horst D.; Hadeler, Astrid; Deutsche Forschungsgemeinschaft (2003). Procesos geoquímicos en suelos y aguas subterráneas: medición – modelado – ampliación de escala. Wiley-VCH. pag. 67. doi : 10.1002/9783527609703. ISBN 978-3-527-27766-7.
- ^ Gail, Ernst; Vaya, Stephen; Kulzer, Rupprecht; Lorösch, Jürgen; Rubo, Andrés; Sauer, Manfred (2004). "Compuestos de ciano inorgánicos". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a08_159.pub2. ISBN 978-3527306732.
- ^ Schwenecke, H.; Mayer, D. (2005). "Bencidina y derivados de bencidina". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a03_539. ISBN 978-3527306732.
- ^ Ganjeloo, A; Isom, GE; Morgan, RL; Way, JL (1980). "Determinación fluorométrica de cianuro en fluidos biológicos con p-benzoquinona*1". Toxicología y farmacología aplicada . 55 (1): 103–107. doi :10.1016/0041-008X(80)90225-2. PMID 7423496.
Enlaces externos
- Directrices de la ATSDR para el tratamiento médico de la intoxicación por cianuro (EE. UU.)
- Recomendaciones de HSE para el tratamiento de primeros auxilios en caso de intoxicación por cianuro (Reino Unido)
- Cianuro de hidrógeno y cianuros ( CICAD 61)
- Evaluación del IPCS/CEC de antídotos para el envenenamiento por cianuros
- Inventario Nacional de Contaminantes – Hoja informativa sobre compuestos de cianuro
- Comer semillas de manzana es seguro a pesar de la pequeña cantidad de cianuro
- Perfil toxicológico del cianuro, Departamento de Salud y Servicios Humanos de los Estados Unidos, julio de 2006
- Datos de seguridad (en francés)
- Instituto Nacional de Investigación y Seguridad (1997). "Cianuro de hidrógeno y soluciones acuosas". Fiche toxicológica n° 4 , París: INRS, 5 págs. (archivo PDF, (en francés) )
- Instituto Nacional de Investigación y Seguridad (1997). "Cianuro de sodio. Cianuro de potasio". Fiche toxicológica n° 111 , París: INRS, 6 págs. (archivo PDF, (en francés) )

![{\displaystyle {\ce {Ag2S + 4 NaCN + H2O -> 2 Na[Ag(CN)2] + NaSH + NaOH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fdb057d86c43d8885c7802a16b185d6927372a71)
![{\displaystyle {\ce {4 Au + 8 NaCN + O2 + 2 H2O -> 4 Na[Au(CN)2] + 4 NaOH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/52060e78e1dcc4a241c0759c4d733887e658ce3b)

