Oxibato de sodio
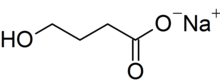 | |
| Datos clínicos | |
|---|---|
| Nombres comerciales | Xyrem, Lumryz, otros [1] |
| Otros nombres | NSC-84223, WY-3478 |
| AHFS / Drogas.com | Monografía |
| MedlinePlus | a605032 |
| Datos de licencia |
|
Responsabilidad por adicción | Alto [2] [3] |
| Vías de administración | Por vía oral , intravenosa [4] |
| Código ATC |
|
| Estatus legal | |
| Estatus legal |
|
| Datos farmacocinéticos | |
| Biodisponibilidad | 88% [3] |
| Unión de proteínas | <1% [3] |
| Vida media de eliminación | 0,5 a 1 hora. |
| Excreción | Casi en su totalidad por biotransformación a dióxido de carbono , que luego se elimina por espiración. |
| Identificadores | |
| |
| Número CAS | |
| Identificador de centro de PubChem |
|
| Unión Internacional para la Investigación y el Desarrollo (IUPHAR)/BPS |
|
| Banco de medicamentos | |
| Araña química | |
| UNIVERSIDAD |
|
| BARRIL | |
| Química biológica | |
| Panel de control CompTox ( EPA ) |
|
| Tarjeta informativa de la ECHA | 100.007.231 |
| Datos químicos y físicos | |
| Fórmula | C4H7NaO3 |
| Masa molar | 126,087 g·mol −1 |
| Modelo 3D ( JSmol ) |
|
| |
 norte norte Y (¿que es esto?) (verificar) Y (¿que es esto?) (verificar) | |
El oxibato de sodio , que se vende bajo la marca Xyrem entre otras, es un medicamento utilizado para tratar los síntomas de la narcolepsia : debilidad muscular repentina y somnolencia diurna excesiva . [3] [7] [8] Se utiliza a veces en Francia e Italia como anestésico administrado por vía intravenosa; [9] : 15, 27–28 también está aprobado y se utiliza en Italia y en Austria para tratar la dependencia del alcohol y el síndrome de abstinencia alcohólica. [10]
El oxibato de sodio es la sal sódica del ácido γ-hidroxibutírico (GHB). Los ensayos clínicos para la narcolepsia se llevaron a cabo justo cuando el abuso del GHB como droga de club y droga para violación en citas se convirtió en un asunto de preocupación pública. En 2000, el GHB se convirtió en una sustancia controlada de la Lista I en los Estados Unidos, mientras que el oxibato de sodio, cuando se utilizaba bajo una solicitud de NDA o IND de la FDA , se clasificaba como una sustancia controlada de la Lista III para uso medicinal bajo la Ley de Sustancias Controladas , y el uso ilícito estaba sujeto a sanciones de la Lista I. [11]
El oxibato de sodio fue aprobado para su uso por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) para tratar los síntomas de la narcolepsia en 2002, [3] con un estricto programa de evaluación de riesgos y estrategia de mitigación (REMS) ordenado por la FDA. [3] La etiqueta estadounidense para el oxibato de sodio también tiene una advertencia de recuadro negro porque es un depresor del sistema nervioso central y puede causar depresión respiratoria , convulsiones, coma o muerte, especialmente si se usa en combinación con otros depresores del sistema nervioso central, como el alcohol y su uso puede causar dependencia . [3] En Canadá y la Unión Europea fue clasificado como una sustancia controlada de la Lista III y Lista IV , respectivamente. [12]
Fue aprobado para el tratamiento de los síntomas de la narcolepsia en la Unión Europea en 2005. [7]
Orphan Medical lo desarrolló y fue adquirido por Jazz Pharmaceuticals en 2005. El medicamento lo comercializa en Europa UCB . Jazz Pharmaceuticals aumentó drásticamente el precio del medicamento después de adquirir Orphan [13] y pagó una multa de 20 millones de dólares por la comercialización no autorizada del medicamento en 2007 [14].
Uso médico
El uso clínico del oxibato de sodio se introdujo en Europa en 1964 como anestésico administrado por vía intravenosa, pero no se utilizó ampliamente porque a veces causaba convulsiones. En 2006, todavía estaba autorizado para este uso en Francia e Italia, pero su uso no estaba muy extendido. [9] : 15, 27–28
El oxibato de sodio se utiliza principalmente para tratar dos de los síntomas de la narcolepsia : la cataplejía (debilidad muscular repentina) y la somnolencia diurna excesiva . [3] Las revisiones del oxibato de sodio concluyeron que es bien tolerado y se asocia con "reducciones significativas de la cataplejía y la somnolencia diurna", [15] y que se ha establecido su eficacia "en el tratamiento de los síntomas de narcolepsia importantes y clínicamente relevantes y las anomalías de la arquitectura del sueño". [16] Sin embargo, debido a los riesgos de abuso asociados con este medicamento, está disponible en los EE. UU. solo a través de un programa REMS ordenado por la FDA. El programa requiere que los proveedores que lo prescriben estén certificados para hacerlo, que se dispense solo desde una farmacia central que esté certificada para hacerlo y que las personas a quienes se les prescribe deben estar inscritas en un programa para el medicamento y deben documentar que están usando el medicamento de manera segura. [3]
Las investigaciones sobre su uso para tratar el síndrome de abstinencia alcohólica y para el mantenimiento de la abstinencia comenzaron en 1989 en Italia, donde fue aprobado para estas indicaciones en 1991. También ha sido aprobado para su uso en Austria. [17] A lo largo de los años, se realizaron varios estudios para corroborar aún más la eficacia del oxibato de sodio en estas indicaciones. Los resultados de pequeños estudios sugieren que puede ser "mejor que la naltrexona y el disulfiram en lo que respecta al mantenimiento de la abstinencia y la prevención del antojo a medio plazo, es decir, de 3 a 12 meses". [18] En una revisión de 2014, Gillian Keating describió el oxibato de sodio como una "opción útil para el tratamiento del síndrome de abstinencia alcohólica y para el mantenimiento de la abstinencia en la dependencia del alcohol". [17] Sin embargo, una revisión de 2018 reconoció la evidencia de su eficacia, pero señaló preocupaciones de seguridad y concluyó que "los estudios aún son limitados y se necesitan investigaciones que incluyan un mayor número de pacientes". [19]
En este contexto, un estudio publicado en 2019 analizó datos de seguridad de 40 ensayos clínicos y de una base de datos de farmacovigilancia que cubría alrededor de 260.000 pacientes dependientes del alcohol tratados con oxibato de sodio en Italia y Austria. [20] Los resultados mostraron que el oxibato de sodio fue bien tolerado, los riesgos estaban controlados y no se informaron problemas de seguridad. [20] El régimen de dosis de oxibato de sodio aprobado para el tratamiento de la dependencia del alcohol (es decir, alrededor de 3,2 g/día) es menor que el utilizado para el tratamiento de la narcolepsia (4,5-9 g/noche). [20] En 2023, una tesis doctoral realizada en la Universidad de Ámsterdam presentó los resultados de grandes ensayos clínicos, incluido un ensayo de fase 3, y de metanálisis que confirmaron la eficacia, la buena tolerancia y la seguridad del oxibato de sodio en el mantenimiento de la abstinencia, particularmente en pacientes con dependencia grave del alcohol. [21] Un grupo de investigadores internacionales también ha considerado en 2018 que “el oxibato de sodio tiene una excelente relación riesgo-beneficio para esta indicación” y que es “una opción terapéutica muy prometedora para los pacientes con dependencia alcohólica más grave y puede aportar importantes beneficios clínicos y de salud pública y costes”. [22]
Múltiples ensayos han demostrado que el oxibato de sodio es eficaz en el tratamiento de síntomas importantes de la fibromialgia, como el dolor y la mala estructura del sueño. [23] Sin embargo, en 2010, la FDA votó unánimemente en contra de esta indicación, y los comentaristas citaron su potencial de abuso como droga callejera.
Las mujeres embarazadas no deben tomarlo y las mujeres no deben quedar embarazadas mientras lo toman. Se excreta en la leche materna y no debe ser utilizado por madres que estén amamantando. [7]
Efectos adversos
La etiqueta estadounidense del oxibato de sodio tiene una advertencia de recuadro negro porque es un depresor del sistema nervioso central (depresor del SNC) y por su potencial de abuso . Otros posibles efectos secundarios adversos incluyen depresión respiratoria , convulsiones, coma y muerte, especialmente cuando se toma en combinación con otros depresores del SNC como el alcohol . [3] [24] [25] Se han reportado casos de dependencia severa y antojos con el uso excesivo e ilícito de este medicamento. [3] [24] [26] El GHB , la forma protonada (ácida) de esta sal , se ha utilizado para cometer agresiones sexuales facilitadas por drogas y violaciones en citas , [24] [25] [27] [28] aunque la forma ilícita del GHB generalmente tiene características diferentes del oxibato de sodio de grado farmacéutico. [29]
El oxibato de sodio causa mareos, náuseas y dolor de cabeza en el 10% al 20% de las personas que lo toman; las náuseas son más comunes en mujeres que en hombres. [7] [30] Entre el 1% y el 10% de las personas experimentan congestión nasal, secreción nasal o dolor de garganta, pérdida de apetito, sentido del gusto distorsionado, cataplejía , debilidad, nerviosismo o ansiedad, estado de ánimo deprimido, pesadillas o sueños anormales, parálisis del sueño, sonambulismo u otros trastornos del sueño que incluyen insomnio, somnolencia o sedación, caídas, vértigo, temblor, trastorno del equilibrio, problemas cognitivos que incluyen alteración de la atención, confusión o desorientación, adormecimiento del sentido del tacto , hormigueo, visión borrosa, palpitaciones del corazón, presión arterial alta, dificultad para respirar, ronquidos, vómitos, diarrea, dolor de estómago, sudoración excesiva, erupciones cutáneas, dolor en las articulaciones, dolor muscular, dolor de espalda, espasmos musculares, enuresis, incontinencia urinaria e hinchazón de las extremidades. [7]
Sobredosis
Los informes de sobredosis en la literatura médica generalmente se deben al abuso y, a menudo, también involucran otras drogas. Los síntomas incluyen vómitos, sudoración excesiva, períodos de interrupción de la respiración, convulsiones, agitación, pérdida de habilidades psicomotoras y coma. La sobredosis puede provocar la muerte debido a depresión respiratoria. Las personas que sufren una sobredosis pueden morir por asfixia como resultado de atragantarse con el vómito o por aspiración. Es posible que sea necesario hacer vomitar, intubar o conectar a un respirador a las personas que han sufrido una sobredosis o que se sospecha que han sufrido una sobredosis. [3] [7]
Interacciones
El oxibato de sodio no debe utilizarse con otros medicamentos que sean depresores del sistema nervioso central, como el alcohol o los sedantes. [3] El uso con divalproex produce un aumento de aproximadamente el 25 % en la disponibilidad del oxibato de sodio. [3]
Farmacología
Farmacodinamia
El mecanismo de acción completo del oxibato de sodio no se conoce bien. [3] [7] El GHB es un metabolito normal del GABA que interactúa con el receptor GABA B y el receptor GHB . [3]
Farmacocinética
El oxibato de sodio se absorbe rápidamente y tiene una biodisponibilidad elevada; sin embargo, debido a su alto índice de metabolismo de primer paso, la biodisponibilidad efectiva es de solo un 25 % aproximadamente. [31] Menos del 1 % se une a las proteínas plasmáticas. El tiempo promedio hasta alcanzar la concentración plasmática máxima varía de 0,5 a 1,25 horas. [31] Tiene una vida media muy corta, de entre 20 y 40 minutos. Una comida rica en grasas puede aumentar la vida media a 60 minutos. [31] Debido a su corta vida media, algunos pacientes toman el fármaco dos veces por noche. [31]
Solo una pequeña porción (1-5%) de la dosis administrada de GHB se excreta sin cambios en la orina. En cambio, la gran mayoría (95-98%) sufre un metabolismo extenso en el hígado en dióxido de carbono y agua. [3] [4] La ruta principal implica la conversión de GHB a semialdehído succínico (SSA) por la GHB deshidrogenasa o la GHB transhidrogenasa. El SSA se oxida aún más por la semialdehído succínico deshidrogenasa (SSADH) a ácido succínico , que ingresa al ciclo de Krebs y finalmente se convierte en dióxido de carbono y agua. [4] [32] [33] [34] No inhibe las enzimas del citocromo P450 en el hígado en concentraciones terapéuticas. [31]
Química
El oxibato de sodio es la sal sódica del ácido γ-hidroxibutírico (GHB). Su nombre químico sistemático es 4-hidroxibutanoato de sodio, aunque se utilizan comúnmente sinónimos como γ-hidroxibutirato de sodio. Su fórmula estructural condensada es HOCH
2es
2es
2CO
2Na ( fórmula molecular : C
4yo
7Na2O
3) y su masa molar es 126,09 g mol −1 . Es altamente hidrófilo. [3] El tratamiento de la sal con ácido permite recuperar la forma de ácido carboxílico del compuesto, que es GHB.
Historia
Alexander Zaytsev trabajó en esta familia química y publicó trabajos sobre ella en 1874. [35] : 79 [36] La primera investigación extensa sobre el oxibato de sodio y su uso en humanos fue realizada a principios de la década de 1960 por Henri Laborit para estudiar el neurotransmisor GABA. [9] : 11–12 [37] Se estudió para una variedad de usos, incluida la cirugía obstétrica, durante el parto y como ansiolítico; hubo informes anecdóticos de que también tenía efectos antidepresivos y afrodisíacos. [9] : 27 También se estudió como agente anestésico intravenoso y se comercializó para ese propósito a partir de 1964 en Europa, pero no fue ampliamente adoptado porque causaba convulsiones; a partir de 2006, ese uso todavía estaba autorizado en Francia e Italia, pero no se usaba ampliamente. [9] : 27–28 El oxibato de sodio también se estudió para tratar la adicción al alcohol [9] : 28–29 y para su uso en la narcolepsia desde la década de 1960 en adelante. [9] : 28
En mayo de 1990, el GHB se introdujo como un suplemento dietético y se comercializó a los culturistas para ayudar a controlar el peso, como una ayuda para dormir y como un "reemplazo" del L -triptófano , que se retiró del mercado en noviembre de 1989 cuando se descubrió que algunos lotes del mismo causaban el síndrome de eosinofilia-mialgia . Para noviembre de ese año, se habían informado 57 casos de enfermedad causada por los suplementos de GHB a los Centros para el Control y la Prevención de Enfermedades , con personas que habían tomado hasta tres cucharaditas de GHB; no hubo muertes, pero nueve personas necesitaron atención en una unidad de cuidados intensivos . [38] [39] La FDA emitió una advertencia en noviembre de 1990 de que la venta de GHB era ilegal. [38] El GHB continuó fabricándose y vendiéndose ilegalmente, y él y sus análogos fueron adoptados como una droga de club y llegaron a usarse como una droga para la violación en citas . La DEA realizó incautaciones y la FDA volvió a emitir advertencias varias veces a lo largo de la década de 1990. [40] [41] [42]
Al mismo tiempo, la investigación sobre el uso de oxibato de sodio se había formalizado, ya que una empresa llamada Orphan Medical Inc. había presentado una solicitud de nuevo fármaco en investigación y estaba realizando ensayos clínicos con la intención de obtener la aprobación regulatoria para su uso en el tratamiento de la narcolepsia. [9] : 18–25, 28 [43] : 10 En 1996, Orphan contrató a Lonza Group , un fabricante por contrato para el suministro del fármaco. [44]
En 2000, se promulgó en los EE. UU. la Ley de Prevención de Violaciones en Citas Hillory J. Farias y Samantha Reid de 2000 , que colocó al GHB en la Lista I de la Ley de Sustancias Controladas , pero el oxibato de sodio, cuando se usaba bajo una IND o NDA de la FDA de los EE. UU., se consideraba una sustancia de la Lista III, pero con sanciones de tráfico de la Lista I. [45] [46]
El oxibato de sodio fue aprobado por la FDA en 2002 bajo la marca Xyrem con una estricta estrategia de control de riesgos para prevenir el desvío del fármaco y controlar el riesgo de abuso por parte de las personas a quienes fue recetado. [47]
En 2003, Orphan Medical otorgó a Celltech la licencia para comercializar el medicamento en Europa. [48] [49] En 2004, Celltech fue adquirida por UCB [50] y en 2005 Jazz Pharmaceuticals adquirió Orphan Medical. [51]
En enero de 2007, Valeant anunció que Jazz Pharmaceuticals había cedido a Valeant los derechos para comercializar Xyrem en Canadá. [52] Jazz Pharmaceuticals y Valeant rescindieron el acuerdo en 2017. [53]
En julio de 2007, Jazz Pharmaceuticals y su filial, Orphan Medical, se declararon culpables de un cargo penal por falsificación de información en la comercialización de oxibato de sodio; al mismo tiempo, también llegaron a un acuerdo en una demanda civil. Jazz Pharmaceuticals pagó 20 millones de dólares en total y aceptó un acuerdo de integridad corporativa y la implementación de reformas internas. [14] [54] [55] La FDA envió a Jazz Pharmaceuticals una carta de advertencia sobre violaciones de seguridad en septiembre de 2007. [56]
En 2010, la FDA rechazó la solicitud de nuevo fármaco de Jazz Pharmaceuticals para el uso de oxibato de sodio en la fibromialgia . [57]
En octubre de 2011, la FDA envió a Jazz Pharmaceuticals otra carta de advertencia por no recopilar, evaluar e informar rápidamente a la FDA sobre los efectos adversos después de que comenzó a comercializar el medicamento. [56] Envió otra carta en 2013 diciendo que los problemas descritos en la carta de 2011 parecían estar resueltos. [58]
En enero de 2017, la FDA aprobó el primer producto genérico de oxibato de sodio para los síntomas de la narcolepsia, que también está sujeto a las mismas condiciones del programa REMS que el original. [59] Para abril de 2017, siete compañías habían presentado solicitudes abreviadas de nuevos medicamentos (ANDA) ante la FDA para comercializar versiones genéricas de Xyrem, lo que resultó en que Jazz Pharmaceuticals presentara casos de infracción de patentes en su contra. Hikma Pharmaceuticals había sido la primera compañía en presentar una ANDA y Jazz Pharmaceuticals llegó a un acuerdo con ellos en abril de 2017; según el acuerdo, Hikma podría comenzar a vender un genérico autorizado en 2023 bajo el REMS de Jazz Pharmaceuticals, y tendría cinco años de exclusividad, sin embargo, esas condiciones podrían cambiar si las patentes de Jazz Pharmaceuticals fueran invalidadas. [60] [61] En 2023, Jazz Pharmaceuticals licenció el derecho a producir un genérico autorizado de Xyrem a Hikma Pharmaceuticals , comercializado como "Solución oral de oxibato de sodio". [62]
En mayo de 2023, la FDA aprobó Lumryz, una suspensión oral de liberación prolongada de oxibato de sodio. [6] [63]
Sociedad y cultura
Regulación
En los Estados Unidos, el GHB es una sustancia controlada de la Lista I , mientras que el oxibato de sodio, cuando se utiliza bajo una solicitud de NDA o IND de la FDA , se clasifica como una sustancia controlada de la Lista III para uso medicinal según la Ley de Sustancias Controladas , y su uso ilícito está sujeto a sanciones de la Lista I. [11]
En Canadá y la Unión Europea, a partir de 2009, está clasificada como sustancia controlada de la Lista III y de la Lista IV , respectivamente. [12]
Costo
En los EE. UU., el costo en el tercer trimestre de 2015 de Xyrem fue de $5,468.09 por botella de 180 mL a 500 mg/mL, un suministro de 10 a 15 días cuando se prescribe en la dosis típica de 6 a 9 g por día. En 2017, el costo del oxibato de sodio en el Reino Unido fue de £540.00 a £1,080.00 por un suministro de treinta días, [64] que en dosis típicas es de £6,500 a £13,100 por año. [65]
Jazz Pharmaceuticals aumentó el precio de Xyrem en un 841%, lo que le permitió obtener un total de 569 millones de dólares en 2013 y representar más del 50% de los ingresos de Jazz Pharmaceutical. [13] En 2007 costaba 2,04 dólares; en 2014, costaba 19,40 dólares por dosis de 1 mililitro. [13] Jazz ofrece asistencia para el copago para ayudar a los pacientes a acceder a este costoso medicamento. [13] Según DRX, un informe de datos sobre medicamentos publicado por Bloomberg, el aumento de precio de Xyrem por parte de Jazz Pharmaceuticals encabezó la lista de aumentos de precios en 2014. [13]
Históricamente, los medicamentos huérfanos cuestan más que otros medicamentos y han recibido un tratamiento especial desde la promulgación de la Ley de Medicamentos Huérfanos de los Estados Unidos de 1983. Sin embargo, estos pronunciados aumentos de precios de los medicamentos huérfanos y otros medicamentos especializados han sido objeto de escrutinio. [13] El costo promedio de un medicamento especializado en los Estados Unidos era de $65.000 anuales en junio de 2013 (alrededor de $5.416 al mes). El precio de Xyrem en los Estados Unidos se ha inflado en un promedio del 40% anual desde que comenzó a estar disponible como receta. [66]
El primer oxibato de sodio genérico autorizado, producido por Hikma Pharmaceuticals , estuvo disponible en enero de 2023. [62]
En los países de la Unión Europea, el gobierno proporciona un seguro de salud nacional (como en el Reino Unido e Italia ) o regula estrictamente los fondos de seguro social cuasiprivados (como en Alemania , Francia y los Países Bajos ). Estos organismos gubernamentales son los únicos compradores (o reguladores) de los bienes y servicios médicos y tienen el poder de fijar los precios. [67] El costo de los productos farmacéuticos, incluido el oxibato de sodio, tiende a ser menor en estos países. [67]
El Servicio Nacional de Salud de Inglaterra autoriza y paga el oxibato de sodio mediante solicitudes de financiación individuales en función de circunstancias excepcionales. El Departamento de Salud británico paga el medicamento a 80 pacientes que están emprendiendo acciones legales por problemas relacionados con el uso de la vacuna contra la gripe porcina Pandemrix a un coste de 12.000 libras al año. En 2016, había muchas zonas del Reino Unido en las que el Servicio Nacional de Salud no pagaba el oxibato de sodio. [68] [69] En mayo de 2016, el Tribunal Supremo les ordenó que proporcionaran financiación para tratar a una adolescente con narcolepsia grave. El juez criticó su "decisión totalmente mala" y su política "absurda" de discriminación contra la niña cuando cientos de otros pacientes del Servicio Nacional de Salud ya reciben el medicamento. [70]
Nombres
El nombre común de esta sustancia química es oxibato de sodio; no tiene denominación común internacional (DCI). [71]
A partir de abril de 2018, el oxibato de sodio se comercializa bajo las siguientes marcas: Alcover (Italia), Gamma-OH (Francia), Natrii oxybutyras Kalceks (Letonia), Somsanit (Alemania), Xyrem (en muchos países por Jazz Pharmaceuticals y UCB). [1]
En 2023, el primer genérico autorizado de Xyrem estuvo disponible en los EE. UU. [62]
Investigación
Jazz Pharmaceuticals ha estado desarrollando JZP-386, un análogo deuterado del oxibato de sodio. La empresa presentó los resultados de la Fase I en 2015, afirmando que los efectos relacionados con el deuterio hacían necesario realizar más trabajos de formulación como parte del desarrollo del fármaco. [72]
Referencias
- ^ ab "Marcas internacionales de oxibato de sodio -". Drugs.com . Consultado el 16 de abril de 2018 .
- ^ Tay E, Lo WK, Murnion B (2022). "Perspectivas actuales sobre el impacto del abuso de gamma-hidroxibutirato (GHB)". Abuso de sustancias y rehabilitación . 13 : 13–23. doi : 10.2147/SAR.S315720 . PMC 8843350. PMID 35173515 .
- ^ abcdefghijklmnopqrs «Xyrem-solución de oxibato de sodio». DailyMed . Consultado el 14 de noviembre de 2020 .
- ^ abc Busardò FP, Jones AW (enero de 2015). "Farmacología y toxicología del GHB: intoxicación aguda, concentraciones en sangre y orina en casos forenses y tratamiento del síndrome de abstinencia". Neurofarmacología actual . 13 (1): 47–70. doi :10.2174/1570159X13666141210215423. PMC 4462042. PMID 26074743 .
- ^ "Lista de todos los medicamentos con advertencias de recuadro negro obtenida por la FDA (use los enlaces Descargar resultados completos y Ver consulta)". nctr-crs.fda.gov . FDA . Consultado el 22 de octubre de 2023 .
- ^ ab "Lumryz- oxibato de sodio para suspensión, liberación prolongada". DailyMed . 7 de junio de 2023 . Consultado el 23 de marzo de 2024 .
- ^ abcdefg «Resumen de las características del producto de la etiqueta del Reino Unido». Compendio electrónico de medicamentos. 8 de septiembre de 2015. Consultado el 14 de abril de 2018 .
- ^ "Información sobre Xyrem (oxibato de sodio)". Centro de Evaluación e Investigación de Medicamentos . Administración de Alimentos y Medicamentos de los Estados Unidos. 25 de enero de 2017.
- ^ abcdefgh "Revisión crítica del ácido gamma-hidroxibutírico (GHB)" (PDF) . 2012.
- ^ "Alcover: Riassunto delle Caratteristiche del Prodotto". Agencia Italiana del Farmaco. 31 de marzo de 2017.Página de índice
- ^ ab "Hoja informativa sobre el GHB" (PDF) . DEA. Archivado desde el original (PDF) el 16 de abril de 2018 . Consultado el 16 de abril de 2018 .
- ^ ab Wang YG, Swick TJ, Carter LP, Thorpy MJ, Benowitz NL (agosto de 2009). "Resumen de seguridad de la experiencia clínica y posterior a la comercialización del oxibato de sodio (Xyrem): abuso, uso indebido, dependencia y desviación". Revista de medicina clínica del sueño . 5 (4): 365–371. doi :10.5664/jcsm.27549. PMC 2725257 . PMID 19968016.
- ^ abcdef Staton T (7 de mayo de 2014). "10 grandes marcas siguen generando grandes ingresos, con un poco de ayuda de los aumentos de precios". Fierce Pharma . Consultado el 13 de noviembre de 2015 .
- ^ ab "Comunicado de prensa: Fiscalía de Estados Unidos - Distrito Este de Nueva York". Departamento de Justicia de Estados Unidos . 13 de julio de 2007.
- ^ Alshaikh MK, Tricco AC, Tashkandi M, Mamdani M, Straus SE, BaHammam AS (agosto de 2012). "Oxibato de sodio para la narcolepsia con cataplejía: revisión sistemática y metanálisis". Revista de medicina clínica del sueño . 8 (4): 451–458. doi : 10.5664/jcsm.2048 . PMC 3407266 . PMID 22893778.
- ^ Boscolo-Berto R, Viel G, Montagnese S, Raduazzo DI, Ferrara SD, Dauvilliers Y (octubre de 2012). "Narcolepsia y eficacia del gamma-hidroxibutirato (GHB): una revisión sistemática y metaanálisis de ensayos controlados aleatorizados". Sleep Medicine Reviews . 16 (5): 431–443. doi :10.1016/j.smrv.2011.09.001. PMID 22055895.
- ^ ab Keating GM (enero de 2014). "Oxibato de sodio: una revisión de su uso en el síndrome de abstinencia alcohólica y en el mantenimiento de la abstinencia en la dependencia del alcohol". Clinical Drug Investigation . 34 (1): 63–80. doi :10.1007/s40261-013-0158-x. PMID 24307430. S2CID 2056246.
- ^ Busardò FP, Kyriakou C, Napoletano S, Marinelli E, Zaami S (diciembre de 2015). "Aplicaciones clínicas del oxibato de sodio (GHB): de la narcolepsia al síndrome de abstinencia alcohólica" (PDF) . Revista Europea de Ciencias Médicas y Farmacológicas . 19 (23): 4654–4663. PMID 26698265.
- ^ Mannucci C, Pichini S, Spagnolo EV, Calapai F, Gangemi S, Navarra M, et al. (2018). "Terapia con oxibato de sodio para el síndrome de abstinencia alcohólica y el mantenimiento de la abstinencia alcohólica". Current Drug Metabolism . 19 (13): 1056–1064. doi :10.2174/1389200219666171207122227. PMID 29219048. S2CID 2166038.
- ^ abc Addolorato G, Lesch OM, Maremmani I, Walter H, Nava F, Raffaillac Q, et al. (febrero de 2020). "Experiencia poscomercialización y seguridad clínica con oxibato de sodio para el tratamiento del síndrome de abstinencia alcohólica y el mantenimiento de la abstinencia en sujetos dependientes del alcohol". Opinión de expertos sobre seguridad de medicamentos . 19 (2): 159–166. doi :10.1080/14740338.2020.1709821. PMID 31876433. S2CID 209482660.
- ^ van den Brink W, Goudriaan A (11 de mayo de 2023). Oxibato de sodio para el tratamiento de la dependencia del alcohol. Universidad de Ámsterdam . hdl :11245.1/ad0b0a9e-e28c-432d-81a9-ccdf39b190f8. ISBN 9789464730739. Consultado el 11 de agosto de 2023 .
- ^ van den Brink W, Addolorato G, Aubin HJ, Benyamina A, Caputo F, Dematteis M, et al. (julio de 2018). "Eficacia y seguridad del oxibato de sodio en pacientes dependientes del alcohol con un nivel de riesgo de consumo muy alto". Addiction Biology . 23 (4): 969–986. doi :10.1111/adb.12645. PMID 30043457. S2CID 51716274.
- ^ Swick T (2011). "Oxibato de sodio: una posible nueva opción farmacológica para el tratamiento del síndrome de fibromialgia". Ther Adv Musculoskelet Dis . 3 (4): 167–178. doi :10.1177/1759720X11411599. PMC 3382678 . PMID 29219048.
- ^ abc Miller RL (2002). "GHB". La enciclopedia de las drogas adictivas . Greenwood Publishing Group . págs. 182–185. ISBN 9780313318078.
- ^ ab Abadinsky H (2010). "GHB y GBL". Uso y abuso de drogas: una introducción completa (7.ª ed.). Cengage Learning . págs. 197–198. ISBN 9780495809913.
- ^ Galloway GP, Frederick SL, Staggers FE, Gonzales M, Stalcup SA, Smith DE (enero de 1997). "Gamma-hidroxibutirato: una droga emergente de abuso que causa dependencia física". Adicción . 92 (1): 89–96. doi :10.1111/j.1360-0443.1997.tb03640.x. PMID 9060200.
- ^ "La FDA aprueba un fármaco contra la violación en citas para tratar los trastornos del sueño". The Washington Post . 18 de julio de 2002 . Consultado el 23 de junio de 2018 .
- ^ Wedin GP, Hornfeldt CS, Ylitalo LM (enero de 2006). "El desarrollo clínico del gamma-hidroxibutirato (GHB)". Current Drug Safety . 1 (1): 99–106. doi :10.2174/157488606775252647. PMID 18690919.
- ^ Carter LP, Pardi D, Gorsline J, Griffiths RR (septiembre de 2009). "Gamma-hidroxibutirato (GHB) ilícito y oxibato de sodio farmacéutico (Xyrem): diferencias en las características y uso indebido". Dependencia de drogas y alcohol . 104 (1–2): 1–10. doi :10.1016/j.drugalcdep.2009.04.012. PMC 2713368. PMID 19493637 .
- ^ Wise MS, Arand DL, Auger RR, Brooks SN, Watson NF (diciembre de 2007). "Tratamiento de la narcolepsia y otras hipersomnias de origen central". Sleep . 30 (12): 1712–1727. doi : 10.1093/sleep/30.12.1712 . PMC 2276130 . PMID 18246981.
- ^ abcde Robinson DM, Keating GM (2007). "Oxibato de sodio: una revisión de su uso en el tratamiento de la narcolepsia". Fármacos para el sistema nervioso central . 21 (4): 337–354. doi :10.2165/00023210-200721040-00007. PMID 17381187.
- ^ Felmlee MA, Morse BL, Morris ME (enero de 2021). "Ácido γ-hidroxibutírico: farmacocinética, farmacodinámica y toxicología". The AAPS Journal . 23 (1): 22. doi :10.1208/s12248-020-00543-z. PMC 8098080 . PMID 33417072.
- ^ Taxon ES, Halbers LP, Parsons SM (mayo de 2020). "Aspectos cinéticos de la gamma-hidroxibutirato deshidrogenasa". Biochimica et Biophysica Acta (BBA) - Proteínas y proteómica . 1868 (5): 140376. doi : 10.1016/j.bbapap.2020.140376 . PMID 31981617.
- ^ Kamal RM, van Noorden MS, Franzek E, Dijkstra BA, Loonen AJ, De Jong CA (marzo de 2016). "Los mecanismos neurobiológicos de la dependencia y la abstinencia del gamma-hidroxibutirato y su relevancia clínica: una revisión". Neuropsicobiología . 73 (2): 65–80. doi :10.1159/000443173. hdl : 2066/158441 . PMID 27003176.
- ^ Lewis DE (2012). "Sección 4.4.3 Aleksandr Mikhailovich Zaitsev". Los primeros químicos orgánicos rusos y su legado . Springer. ISBN 9783642282195.
- ^ Saytzeff A (1874). "Über die Reduction des Succinylchlorids". Liebigs Annalen der Chemie (en alemán). 171 (2): 258–290. doi :10.1002/jlac.18741710216.
- ^ Laborit H, Jouany JM, Gerard J, Fabiani F (octubre de 1960). «[Generalidades sobre el estudio experimental y el uso clínico del gammahidroxibutirato de Na]». Agressologie (en francés). 1 : 397–406. PMID 13758011.
- ^ ab Centros para el Control y Prevención de Enfermedades (CDC) (noviembre de 1990). "Brote multiestatal de intoxicaciones asociadas con el uso ilícito de gamma hidroxibutirato". MMWR. Informe semanal de morbilidad y mortalidad . 39 (47): 861–863. PMID 2122223.
- ^ Dyer JE (julio de 1991). "Gamma-hidroxibutirato: un producto alimenticio saludable que produce coma y actividad similar a las convulsiones". The American Journal of Emergency Medicine . 9 (4): 321–324. doi :10.1016/0735-6757(91)90050-T. PMID 2054002.
- ^ Instituto de Medicina, Comité del Consejo Nacional de Investigación (EE. UU.) sobre el marco para evaluar la seguridad de los suplementos dietéticos (2002). "Apéndice D: Tabla de acciones de la Administración de Alimentos y Medicamentos sobre suplementos dietéticos". Marco propuesto para evaluar la seguridad de los suplementos dietéticos: para comentarios . National Academies Press (EE. UU.).
- ^ "GHB: una droga de club a tener en cuenta" (PDF) . Asesoramiento sobre tratamiento de abuso de sustancias . 2 (1). Noviembre de 2002. Archivado desde el original (PDF) el 1 de agosto de 2017 . Consultado el 16 de abril de 2018 .
- ^ Mason PE, Kerns WP (julio de 2002). "Intoxicación por ácido gammahidroxibutírico (GHB)". Medicina de emergencia académica . 9 (7): 730–739. doi : 10.1197/aemj.9.7.730 . PMID 12093716.
- ^ "Transcripción: Reunión del Comité Asesor de Medicamentos para el Sistema Nervioso Central y Periférico de la FDA". FDA. 6 de junio de 2001.
- ^ "Jazz Pharma (JAZZ) anuncia que Lonza ha rescindido su contrato de suministro de oxibato de sodio". Street Insider . 25 de marzo de 2010.
- ^ "2000 - Adición de ácido gamma-hidroxibutírico a la Lista I". Departamento de Justicia de Estados Unidos a través del Registro Federal. 13 de marzo de 2000. Archivado desde el original el 1 de mayo de 2021. Consultado el 16 de abril de 2018 .
- ^ "William J. Clinton: Declaración sobre la firma de la Ley de Prohibición de Drogas para Violaciones en Citas de Hillory J. Farias y Samantha Reid de 2000". 18 de febrero de 2000.
- ^ "La FDA aprueba un fármaco contra las violaciones en citas para tratar los trastornos del sueño". Washington Post . 18 de julio de 2002.
- ^ "Celltech adquiere los derechos de Xyrem de Orphan Medical - Pharmaceutical". The Pharma Letter . 3 de noviembre de 2003.
- ^ "Formulario S-1/A EX-10.41 Acuerdo de licencia y distribución de Xyrem modificado y reformulado". www.sec.gov . Jazz Pharmaceuticals ante la SEC Edgar. 27 de marzo de 2007.Página de índice del formulario S-1/A
- ^ "Celltech se vende a una empresa belga por 1.500 millones de libras esterlinas". The Guardian . 18 de mayo de 2004.
- ^ "Jazz completa la compra de Orphan Medical - Noticias de la industria farmacéutica". The Pharma Letter . 4 de julio de 2005.
- ^ "Comunicado de prensa: Valeant Pharmaceuticals firma un acuerdo de licencia para los derechos canadienses de (C)Xyrem(R) (oxibato de sodio) de Jazz Pharmaceuticals. - Biblioteca gratuita en línea". Valeant vía Business Wire . 12 de enero de 2007. Archivado desde el original el 18 de junio de 2018. Consultado el 16 de abril de 2018 .
- ^ "10-K para el año fiscal que finalizó el 31 de diciembre de 2017". Jazz vía SEC Edgar . Consultado el 16 de abril de 2018 .
- ^ Berenson A (22 de julio de 2006). "Acusación de un médico que pone a prueba las normas de comercialización de medicamentos". The New York Times .
- ^ Berenson A (14 de julio de 2007). "El fabricante de un fármaco contra la narcolepsia se declara culpable en un caso en Estados Unidos". The New York Times .
- ^ ab "Carta de advertencia de la FDA, Jazz Pharmaceuticals, Inc. 11/10/11". Administración de Alimentos y Medicamentos .
- ^ "La FDA dice no al fármaco Jazz Pharma contra la fibromialgia". The New York Times . Associated Press. 12 de octubre de 2010 . Consultado el 12 de octubre de 2010 .[ enlace muerto ]
- ^ "2013 - Jazz Pharmaceuticals, Inc. - Carta de cierre". FDA. 2 de agosto de 2013.
- ^ "Comunicado de prensa: La FDA aprueba un genérico de Xyrem con un programa REMS". Centro de Evaluación e Investigación de Medicamentos de la FDA . 17 de enero de 2017.
- ^ "Este rival podría quedarse con el 20% del negocio de sueño de Jazz, pero las acciones se recuperan | Investor's Business Daily". Investor's Business Daily . 6 de abril de 2017.
- ^ "8-K". www.sec.gov . Jazz vía SEC Edgar. 5 de abril de 2017.
- ^ abc «Hikma lanza un genérico autorizado de Xyrem (oxibato de sodio) en EE. UU.». Hikma . Archivado desde el original el 3 de febrero de 2023 . Consultado el 3 de febrero de 2023 .
- ^ Brooks M. "La FDA aprueba el uso de oxibato de sodio una vez por la noche para la narcolepsia". Medscape . Consultado el 14 de julio de 2023 .
- ^ "Narcolepsia con o sin cataplejía en adultos: pitolisant | Guías y pautas: otros tratamientos". NICE. Marzo de 2017. Consultado el 14 de abril de 2018 .
- ^ Kane N (mayo de 2017). "Oxibato de sodio para el tratamiento de la narcolepsia con cataplejía en adultos" (PDF) . NHS Regional Drug & Therapeutics Centre (Newcastle). Archivado desde el original (PDF) el 21 de octubre de 2020. Consultado el 14 de abril de 2018 .
- ^ Rattner S (30 de junio de 2013). "Un premio gordo huérfano". The New York Times .
- ^ ab Danzon PM (primavera de 2000). «Making sense of drug prices» (PDF) . Regulación . 23 (1): 56–63. Archivado desde el original (PDF) el 11 de octubre de 2012. Consultado el 5 de octubre de 2010 .
- ^ "Narcolepsia". NHS Choices. 29 de mayo de 2016. Consultado el 14 de abril de 2018 .
- ^ "El Departamento de Salud financia recetas privadas de medicamentos que se niegan a los pacientes del NHS". Health Service Journal. 20 de julio de 2015. Consultado el 20 de julio de 2015 .
- ^ "Un juez critica al NHS de Inglaterra por una decisión 'totalmente irracional' sobre medicamentos". Health Service Journal. 4 de mayo de 2016. Consultado el 4 de mayo de 2016 .
- ^ "Oxibato de sodio: debate científico del CHMP" (PDF) . EMA. 9 de agosto de 2006. Archivado desde el original (PDF) el 18 de marzo de 2018 . Consultado el 16 de abril de 2018 .Vinculado desde la página de índice de la EMA para EMEA 000593 Archivado el 20 de junio de 2018 en Wayback Machine .
- ^ de Biase S, Nilo A, Gigli GL, Valente M (agosto de 2017). "Terapias en investigación para el tratamiento de la narcolepsia". Opinión de expertos sobre fármacos en investigación . 26 (8): 953–963. doi :10.1080/13543784.2017.1356819. PMID 28726523. S2CID 25638377.
