Éter

En química orgánica , los éteres son una clase de compuestos que contienen un grupo éter —un solo átomo de oxígeno unido a dos átomos de carbono separados, cada uno parte de un grupo organilo (p. ej., alquilo o arilo— ). Tienen la fórmula general R−O−R′ , donde R y R′ representan los grupos organilo. Los éteres pueden clasificarse nuevamente en dos variedades: si los grupos organilo son los mismos en ambos lados del átomo de oxígeno, entonces es un éter simple o simétrico, mientras que si son diferentes, los éteres se denominan éteres mixtos o asimétricos. [1] Un ejemplo típico del primer grupo es el éter dietílico , disolvente y anestésico , comúnmente denominado simplemente "éter" ( CH 3 −CH 2 −O−CH 2 −CH 3 ). Los éteres son comunes en química orgánica e incluso más frecuentes en bioquímica , ya que son enlaces comunes en carbohidratos y lignina . [2]
Estructura y unión
Los éteres presentan enlaces C−O−C doblados . En el éter dimetílico , el ángulo de enlace es de 111° y las distancias C–O son de 141 pm . [3] La barrera a la rotación alrededor de los enlaces C–O es baja. El enlace del oxígeno en éteres, alcoholes y agua es similar. En el lenguaje de la teoría del enlace de valencia , la hibridación en el oxígeno es sp 3 .
El oxígeno es más electronegativo que el carbono, por lo que los hidrógenos alfa de los éteres son más ácidos que los de los hidrocarburos simples. Sin embargo, son mucho menos ácidos que los hidrógenos alfa de los grupos carbonilo (como en las cetonas o los aldehídos ).
Los éteres pueden ser simétricos del tipo ROR o asimétricos del tipo ROR'. Ejemplos de los primeros son el éter dimetílico , el éter dietílico , el éter dipropílico , etc. Algunos éteres asimétricos ilustrativos son el anisol (metoxibenceno) y el dimetoxietano .
Éteres vinílicos y acetilénicos
Los éteres vinílicos y acetilénicos son mucho menos comunes que los éteres alquílicos o arílicos. Los éteres vinílicos, a menudo llamados éteres enólicos , son intermediarios importantes en la síntesis orgánica . Los éteres acetilénicos son especialmente raros. El di-terc-butoxiacetileno es el ejemplo más común de esta rara clase de compuestos.
Nomenclatura
En el sistema de nomenclatura de la IUPAC , los éteres se nombran utilizando la fórmula general "alcoxialcano" , por ejemplo, CH 3 –CH 2 –O–CH 3 es metoxietano . Si el éter es parte de una molécula más compleja, se describe como un sustituyente alcoxi, por lo que –OCH 3 se consideraría un grupo " metoxi -" . El radical alquilo más simple se escribe al frente, por lo que CH 3 –O–CH 2 CH 3 se daría como metoxi (CH 3 O) etano (CH 2 CH 3 ).
Nombre trivial
Las reglas de la IUPAC a menudo no se siguen para los éteres simples. Los nombres triviales para los éteres simples (es decir, aquellos con ninguno o pocos otros grupos funcionales) son un compuesto de los dos sustituyentes seguidos de "éter". Por ejemplo, etil metil éter (CH 3 OC 2 H 5 ), difenil éter (C 6 H 5 OC 6 H 5 ). Al igual que para otros compuestos orgánicos, los éteres muy comunes adquirieron nombres antes de que se formalizasen las reglas de nomenclatura. El éter dietílico se llama simplemente éter, pero alguna vez se llamó aceite dulce de vitriolo . El metil fenil éter es anisol , porque originalmente se encontró en el anís . Los éteres aromáticos incluyen furanos . Los acetales (éteres α-alcoxi R–CH(–OR)–O–R) son otra clase de éteres con propiedades características.
Poliéteres
Los poliéteres son generalmente polímeros que contienen enlaces éter en su cadena principal. El término poliol generalmente se refiere a polioles de poliéter con uno o más grupos terminales funcionales , como un grupo hidroxilo . El término "óxido" u otros términos se utilizan para polímeros de masa molar alta cuando los grupos terminales ya no afectan las propiedades del polímero.
Los éteres corona son poliéteres cíclicos. Algunas toxinas producidas por dinoflagelados, como la brevetoxina y la ciguatoxina, son extremadamente grandes y se conocen como poliéteres cíclicos o en escalera .
| Nombre de los polímeros con masa molar baja a media | Nombre de los polímeros con alta masa molar | Preparación | Unidad repetitiva | Ejemplos de nombres comerciales |
|---|---|---|---|---|
| Paraformaldehído | Polioximetileno (POM) o poliacetal o poliformaldehído | Polimerización por crecimiento escalonado de formaldehído | –CH2O– | Delrin de DuPont |
| Polietilenglicol (PEG) | Óxido de polietileno (PEO) o polioxietileno (POE) | Polimerización por apertura de anillo de óxido de etileno | –CH2CH2O– | Carbowax de Dow |
| Polipropilenglicol (PPG) | Óxido de polipropileno (PPOX) o polioxipropileno (POP) | Polimerización aniónica por apertura de anillo de óxido de propileno | –CH2CH ( CH3 ) O– | Arcol de Covestro |
| Politetrametilenglicol (PTMG) o politetrametilenglicol éter (PTMEG) | Politetrahidrofurano (PTHF) | Polimerización de tetrahidrofurano por apertura de anillo catalizada por ácido | −CH2CH2CH2CH2O− | Terathane de Invista y PolyTHF de BASF |
Los polímeros de feniléter son una clase de poliéteres aromáticos que contienen ciclos aromáticos en su cadena principal: polifeniléter (PPE) y poli( óxido de p -fenileno) (PPO).
Compuestos relacionados
Muchas clases de compuestos con enlaces C–O–C no se consideran éteres: ésteres (R–C(=O)–O–R′), hemiacetales (R–CH(–OH)–O–R′), anhídridos de ácidos carboxílicos (RC(=O)–O–C(=O)R′).
Existen compuestos que, en lugar de C en el enlace C−O−C , contienen elementos químicos más pesados del grupo 14 (p. ej., Si , Ge , Sn , Pb ). Dichos compuestos también se consideran éteres. Ejemplos de dichos éteres son los éteres de sililo enol R 3 Si−O−CR=CR 2 (que contienen el enlace Si−O−C ), el disiloxano H 3 Si−O−SiH 3 (el otro nombre de este compuesto es éter de disililo, que contiene el enlace Si−O−Si ) y los estannoxanos R 3 Sn−O−SnR 3 (que contienen el enlace Sn−O−Sn ).
Propiedades físicas
Los éteres tienen puntos de ebullición similares a los de los alcanos análogos . Los éteres simples son generalmente incoloros.
| Datos seleccionados sobre algunos éteres alquílicos | |||||
|---|---|---|---|---|---|
| Éter | Estructura | punto de fusión (°C) | punto de ebullición (°C) | Solubilidad en 1 litro de H 2 O | Momento dipolar ( D ) |
| Éter dimetílico | CH3 - O- CH3 | −138,5 | -23,0 | 70 gramos | 1.30 |
| Éter dietílico | CH3CH2 – O – CH2CH3 | −116,3 | 34.4 | 69 gramos | 1.14 |
| Tetrahidrofurano | O( CH2 ) 4 | −108,4 | 66.0 | Miscible | 1,74 |
| Dioxano | O ( C2H4 ) 2O | 11.8 | 101.3 | Miscible | 0,45 |
Reacciones
Los enlaces de CO que forman los éteres simples son fuertes. No reaccionan con ninguna base, salvo con las más fuertes. Aunque por lo general tienen una reactividad química baja , son más reactivos que los alcanos .
Los éteres especializados, como los epóxidos , los cetales y los acetales , son clases no representativas de éteres y se analizan en artículos separados. A continuación se enumeran las reacciones importantes. [4]
Escisión
Aunque los éteres resisten la hidrólisis, se escinden con ácido bromhídrico y ácido yodhídrico . El cloruro de hidrógeno escinde los éteres sólo lentamente. Los éteres de metilo suelen producir haluros de metilo :
- ROCH3 +HBr → CH3Br + ROH
Estas reacciones proceden a través de intermediarios de onio , es decir, [RO(H)CH 3 ] + Br − .
Algunos éteres experimentan una escisión rápida con tribromuro de boro (incluso se utiliza cloruro de aluminio en algunos casos) para dar el bromuro de alquilo. [5] Dependiendo de los sustituyentes, algunos éteres se pueden escindir con una variedad de reactivos, por ejemplo, una base fuerte.
A pesar de estas dificultades, los procesos de fabricación de pulpa química de papel se basan en la escisión de los enlaces de éter en la lignina .
Formación de peróxido
Cuando se almacenan en presencia de aire u oxígeno, los éteres tienden a formar peróxidos explosivos , como el hidroperóxido de éter dietílico . La reacción se acelera con luz, catalizadores metálicos y aldehídos . Además de evitar las condiciones de almacenamiento que puedan formar peróxidos, se recomienda, cuando se utiliza un éter como disolvente, no destilarlo hasta sequedad, ya que los peróxidos que se puedan haber formado, al ser menos volátiles que el éter original, se concentrarán en las últimas gotas de líquido. La presencia de peróxido en muestras antiguas de éteres se puede detectar agitándolas con una solución recién preparada de sulfato ferroso seguida de la adición de KSCN. La aparición de un color rojo sangre indica la presencia de peróxidos. Las propiedades peligrosas de los peróxidos de éter son la razón por la que se evita el éter dietílico y otros éteres formadores de peróxido como el tetrahidrofurano (THF) o el dimetiléter de etilenglicol (1,2-dimetoxietano) en los procesos industriales.
Bases de Lewis
Los éteres sirven como bases de Lewis . Por ejemplo, el éter dietílico forma un complejo con trifluoruro de boro , es decir, eterato dietílico de borano ( BF3O ( CH2CH3 ) 2 ). Los éteres también se coordinan con el centro Mg en los reactivos de Grignard . El tetrahidrofurano es más básico que los éteres acíclicos . Forma muchos complejos .
Alfa-halogenación
Esta reactividad es similar a la tendencia de los éteres con átomos de hidrógeno alfa a formar peróxidos. La reacción con cloro produce alfa-cloroéteres.
Síntesis
Deshidratación de alcoholes
La deshidratación de alcoholes produce éteres: [7]
- 2 R–OH → R–O–R + H 2 O a alta temperatura

Esta reacción de sustitución nucleofílica directa requiere temperaturas elevadas (alrededor de 125 °C). La reacción es catalizada por ácidos, generalmente ácido sulfúrico. El método es eficaz para generar éteres simétricos, pero no éteres asimétricos, ya que cualquiera de los OH puede protonarse, lo que daría una mezcla de productos. El éter dietílico se produce a partir de etanol mediante este método. Los éteres cíclicos se generan fácilmente mediante este enfoque. Las reacciones de eliminación compiten con la deshidratación del alcohol:
- R–CH2 – CH2 ( OH ) → R–CH= CH2 + H2O
La vía de deshidratación a menudo requiere condiciones incompatibles con moléculas delicadas. Existen varios métodos más suaves para producir éteres.
Adición electrofílica de alcoholes a alquenos
Los alcoholes se añaden a los alquenos activados electrofílicamente . El método es económico en términos de átomos:
- R2C =CR2 + R–OH → R2CH – C (–O–R) –R2
Para esta reacción se requiere catálisis ácida . Los éteres comercialmente importantes preparados de esta manera se derivan del isobuteno o isoamileno , que se protonan para dar carbocationes relativamente estables . Utilizando etanol y metanol con estos dos alquenos, se producen cuatro éteres de calidad combustible: metil tert-butil éter (MTBE), metil tert-amílico éter (TAME), etil tert-butílico éter (ETBE) y etil tert-amílico éter (TAEE). [4]
Normalmente se utilizan catalizadores ácidos sólidos para promover esta reacción.
Epóxidos
Los epóxidos se preparan normalmente por oxidación de alquenos. El epóxido más importante en términos de escala industrial es el óxido de etileno, que se produce por oxidación del etileno con oxígeno. Otros epóxidos se producen por una de dos vías:
- Por la oxidación de alquenos con un peroxiácido como el m -CPBA .
- Por la sustitución nucleofílica intramolecular de una base de una halohidrina .
Muchos éteres, etoxilatos y éteres corona , se producen a partir de epóxidos.
Síntesis de éter de Williamson y Ullmann
Desplazamiento nucleofílico de haluros de alquilo por alcóxidos
- R–ONa + R′–X → R–O–R′ + Na X
Esta reacción, la síntesis del éter de Williamson , implica el tratamiento de un alcohol original con una base fuerte para formar el alcóxido, seguido de la adición de un compuesto alifático apropiado que tenga un grupo saliente adecuado (R–X). Aunque es popular en los libros de texto, el método suele ser poco práctico a gran escala porque cogenera una cantidad significativa de desechos.
Los grupos salientes adecuados (X) incluyen yoduro , bromuro o sulfonatos . Este método normalmente no funciona bien para haluros de arilo (por ejemplo, bromobenceno , véase la condensación de Ullmann a continuación). Asimismo, este método solo da los mejores rendimientos para haluros primarios. Los haluros secundarios y terciarios son propensos a sufrir eliminación E2 al exponerse al anión alcóxido básico utilizado en la reacción debido al impedimento estérico de los grandes grupos alquilo.
En una reacción relacionada, los haluros de alquilo sufren un desplazamiento nucleofílico por fenóxidos . El R–X no se puede utilizar para reaccionar con el alcohol. Sin embargo, los fenoles se pueden utilizar para reemplazar el alcohol mientras se mantiene el haluro de alquilo. Dado que los fenoles son ácidos, reaccionan fácilmente con una base fuerte como el hidróxido de sodio para formar iones fenóxido. El ion fenóxido sustituirá entonces al grupo –X en el haluro de alquilo, formando un éter con un grupo arilo unido a él en una reacción con un mecanismo S N 2 .
- C6H5OH + OH − → C6H5 –O − + H2O
- C6H5 - O − + R – X → C6H5 O
La condensación de Ullmann es similar al método de Williamson, excepto que el sustrato es un haluro de arilo. Estas reacciones generalmente requieren un catalizador, como el cobre. [8]
Éteres importantes
 | Óxido de etileno | Un éter cíclico. También es el epóxido más simple . |
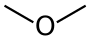 | Éter dimetílico | Un gas incoloro que se utiliza como propulsor de aerosoles . Un posible combustible alternativo renovable para motores diésel con un índice de cetano de hasta 56-57. |
 | Éter dietílico | Líquido incoloro de olor dulce. Disolvente común de bajo punto de ebullición (punto de ebullición 34,6 °C) y anestésico primitivo . Se utiliza como fluido de arranque para motores diésel. También se utiliza como refrigerante y en la fabricación de pólvora sin humo , además de utilizarse en perfumería . |
 | Dimetoxietano (DME) | Un disolvente miscible en agua que se encuentra a menudo en las baterías de litio (punto de ebullición 85 °C): |
 | Dioxano | Un éter cíclico y un disolvente de alto punto de ebullición (punto de ebullición 101,1 °C). |
 | Tetrahidrofurano (THF) | Un éter cíclico, uno de los éteres simples más polares que se utiliza como disolvente. |
 | Anisol (metoxibenceno) | Un éter arílico y un componente principal del aceite esencial de semilla de anís . |
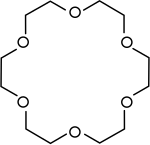 | Éteres corona | Poliéteres cíclicos que se utilizan como catalizadores de transferencia de fase . |
 | Polietilenglicol (PEG) | Un poliéter lineal, utilizado, por ejemplo, en cosméticos y productos farmacéuticos . |
| Polipropilenglicol | Un poliéter lineal, utilizado, por ejemplo, en poliuretanos . | |
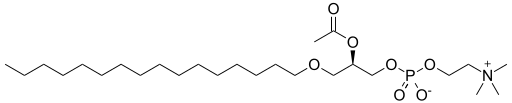 | Factor activador de plaquetas | Un lípido de éter , un ejemplo con un éter en sn-1, un éster en sn-2 y un éter inorgánico en sn-3 del armazón de glicerilo. |
Véase también
- Ester
- Éter lipídico
- Adicción al éter
- Ether (canción)
- Historia de la anestesia general
- Inhalador
- Procesos de pulpa química de papel: proceso Kraft (y pulpa de soda ), proceso de pulpa Organosolv y proceso de sulfito
Referencias
- ^ IUPAC , Compendio de terminología química , 2.ª edición (el "Libro de oro") (1997). Versión corregida en línea: (2006–) "éteres". doi :10.1351/goldbook.E02221
- ^ Saul Patai, ed. (1967). El enlace éter . Química de grupos funcionales de PATAI. John Wiley & Sons. doi :10.1002/9780470771075. ISBN 978-0-470-77107-5.
- ^ Vojinović, Krunoslav; Losehand, Udo; Mitzel, Norbert W. (2004). "Agregación de diclorosilano-dimetiléter: un nuevo motivo en la formación de aductos de halosilano". Dalton Trans. (16): 2578–2581. doi :10.1039/b405684a. PMID 15303175.
- ^ ab Wilhelm Heitmann, Günther Strehlke, Dieter Mayer "Éteres alifáticos" en la Enciclopedia de química industrial de Ullmann Wiley-VCH, Weinheim, 2002. doi :10.1002/14356007.a10_023
- ^ JFW McOmie y DE West (1973). "3,3′-Dihidroxilbifenilo". Síntesis orgánicas; Volúmenes recopilados , vol. 5, pág. 412.
- ^ FACotton; SADuraj; GLPowell; WJRoth (1986). "Estudios estructurales comparativos de los solvatos de tetrahidrofurano de cloruro de metal de transición temprana (III) de primera fila". Inorg. Chim. Acta . 113 : 81. doi :10.1016/S0020-1693(00)86863-2.
- ^ Clayden; Greeves; Warren (2001). Química orgánica . Oxford University Press. pág. 129. ISBN 978-0-19-850346-0.
- ^ Frlan, Rok; Kikelj, Danijel (29 de junio de 2006). "Progresos recientes en la síntesis de éter diarílico". Síntesis . 2006 (14): 2271–2285. doi :10.1055/s-2006-942440.