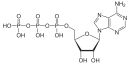Anhídrido de ácido orgánico
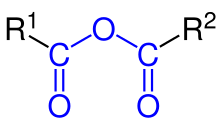
Un anhídrido de ácido orgánico es un anhídrido de ácido que también es un compuesto orgánico . Un anhídrido de ácido es un compuesto que tiene dos grupos acilo unidos al mismo átomo de oxígeno . [1] Un tipo común de anhídrido de ácido orgánico es un anhídrido carboxílico , donde el ácido original es un ácido carboxílico , siendo la fórmula del anhídrido (RC(O)) 2O . Los anhídridos de ácido simétricos de este tipo se nombran reemplazando la palabra ácido en el nombre del ácido carboxílico original por la palabra anhídrido . [2] Por lo tanto, (CH3CO ) 2O se llama anhídrido acético. Se conocen anhídridos de ácido mixtos (o asimétricos ), como el anhídrido fórmico acético (ver más abajo), por el cual ocurre una reacción entre dos ácidos carboxílicos diferentes. La nomenclatura de anhídridos de ácido asimétricos enumera los nombres de ambos ácidos carboxílicos reaccionados antes de la palabra "anhídrido" (por ejemplo, la reacción de deshidratación entre el ácido benzoico y el ácido propanoico produciría "anhídrido benzoico propanoico"). [3]
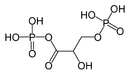
Uno o ambos grupos acilo de un anhídrido de ácido también pueden derivarse de otro tipo de ácido orgánico , como ácido sulfónico o ácido fosfónico . Uno de los grupos acilo de un anhídrido de ácido puede derivarse de un ácido inorgánico como ácido fosfórico . El anhídrido mixto ácido 1,3-bisfosfoglicérico , un intermediario en la formación de ATP a través de la glucólisis , [4] es el anhídrido mixto de ácido 3-fosfoglicérico y ácido fosfórico . Los óxidos ácidos también se clasifican como anhídridos de ácido.
Nomenclatura
La nomenclatura de los anhídridos de ácidos orgánicos se deriva de los nombres de los ácidos carboxílicos constituyentes. En los anhídridos de ácidos simétricos, solo se utiliza el prefijo del ácido carboxílico original y se agrega el sufijo "anhídrido". Para la mayoría de los anhídridos de ácidos asimétricos, también llamados anhídridos mixtos, los prefijos de ambos ácidos reaccionados se enumeran antes del sufijo, por ejemplo, anhídrido benzoico propanoico. [5]
Preparación
Los anhídridos de ácidos orgánicos se preparan en la industria por diversos medios. El anhídrido acético se produce principalmente por la carbonilación del acetato de metilo . [6] El anhídrido maleico se produce por la oxidación del benceno o el butano . Las vías de laboratorio enfatizan la deshidratación de los ácidos correspondientes. Las condiciones varían de un ácido a otro, pero el pentóxido de fósforo es un agente deshidratante común :
Además de los anhídridos acíclicos simétricos, se reconocen otras clases como se analiza en las siguientes secciones.
Anhídridos mixtos
Los anhídridos mixtos tienen la fórmula RC(O)OC(O)R'. Tienden a redistribuirse al calentarse, aunque el anhídrido fórmico acético se puede destilar a una atmósfera. [7] Los que contienen el grupo acetilo se pueden preparar utilizando cetena como agente acetilante:
- RCO2H +H2C = C=O → RCO2C ( O ) CH3
Los cloruros de ácido también son precursores eficaces como lo ilustra la reacción con formiato de sodio : [8]
- CH 3 C (O) Cl + HCO 2 Na → HCO 2 COCH 3 + NaCl
Anhídridos cíclicos
Los ejemplos incluyen anhídrido maleico y anhídrido succínico . Aunque estos anillos de cinco miembros se forman fácilmente. [9] [10] [11]
Dianhídridos y trianhídridos
Los ejemplos más comunes son anhídridos cíclicos:
- Dianhídrido 1,2,3,4-butanotetracarboxílico producido por deshidratación del ácido 1,2,3,4-butanotetracarboxílico .
- dianhídrido naftalenotetracarboxílico
- dianhídrido 1,2,4,5-bencenotetracarboxílico y dianhídrido 1,2,3,4-bencenotetracarboxílico
- Anhídrido melítico , un trianhídrido
Estos compuestos a veces son agentes de reticulación útiles .
Reacciones
Los anhídridos de ácido son una fuente de grupos acilo reactivos, y sus reacciones y usos se parecen a los de los haluros de acilo . Los anhídridos de ácido tienden a ser menos electrofílicos que los cloruros de acilo , y solo se transfiere un grupo acilo por molécula de anhídrido de ácido, lo que conduce a una menor eficiencia atómica . Sin embargo, el bajo costo del anhídrido acético lo convierte en una opción común para las reacciones de acetilación .
En reacciones con alcoholes y aminas, las reacciones producen cantidades iguales del producto acilado y del ácido carboxílico:
- RC(O)OC(O)R+R'OH → RC(O)OR' + RCO2H
- RC(O)OC(O)R+R'2NH → RC(O ) NR'2 + RCO2H
De manera similar, en la acilación de arenos de Friedel-Crafts (ArH):
- RC(O)OC(O)R+ArH → RC(O)Ar + RCO2H
Al igual que los haluros de ácido, los anhídridos también pueden reaccionar con nucleófilos de carbono para formar cetonas y/o alcoholes terciarios, y pueden participar tanto en la acilación de Friedel-Crafts como en la síntesis de cetonas de Weinreb. Sin embargo, a diferencia de los haluros de ácido, los anhídridos no reaccionan con los reactivos de Gilman. [ cita requerida ]
La reactividad de los anhídridos se puede aumentar utilizando una cantidad catalítica de N,N-dimetilaminopiridina ("DMAP") o incluso piridina . [12]
Primero, DMAP ( 2 ) ataca al anhídrido ( 1 ) para formar un intermedio tetraédrico, que colapsa para eliminar un ion carboxilato para dar la amida 3 . Esta amida intermedia está más activada hacia el ataque nucleofílico que el anhídrido original, porque la dimetilaminopiridina es un mejor grupo saliente que un carboxilato. En el conjunto final de pasos, un nucleófilo (Nuc) ataca a 3 para dar otro intermedio tetraédrico. Cuando este intermedio colapsa para dar el producto 4 , el grupo piridina se elimina y su aromaticidad se restaura, una poderosa fuerza impulsora y la razón por la que el compuesto de piridina es un mejor grupo saliente que un ion carboxilato.
En el caso de los anhídridos cíclicos proquirales , la reacción de alcohólisis puede llevarse a cabo de forma asimétrica. [13]
Aplicaciones y aparición de los anhídridos de ácido
- Anhídridos de ácido ilustrativos
- El anhídrido acético se produce a gran escala para muchas aplicaciones.
- El dianhídrido naftalenotetracarboxílico , un componente básico de compuestos orgánicos complejos, es un ejemplo de dianhídrido.
- El anhídrido maleico es un anhídrido cíclico, ampliamente utilizado para fabricar recubrimientos industriales.
- El ATP en su forma protonada es un anhídrido derivado del ácido fosfórico .
- El ácido 1,3-bisfosfoglicérico, "anhídrido mixto", se encuentra ampliamente presente en las vías metabólicas.
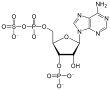
- El 3'-fosfoadenosina-5'-fosfosulfato (PAPS) es un anhídrido mixto de ácidos sulfúrico y fosfórico y es la coenzima más común en las reacciones biológicas de transferencia de sulfato.
El anhídrido acético es un importante producto químico industrial que se utiliza ampliamente para preparar ésteres de acetato, por ejemplo, acetato de celulosa . El anhídrido maleico es el precursor de varias resinas por copolimerización con estireno . El anhídrido maleico es un dienófilo en la reacción de Diels-Alder . [7]
Los dianhídridos, moléculas que contienen dos funciones de anhídrido de ácido, se utilizan para sintetizar poliimidas y, a veces, poliésteres [14] y poliamidas . [15] Ejemplos de dianhídridos: dianhídrido piromelítico (PMDA), dianhídrido 3,3', 4,4' - oxidiftálico (ODPA), dianhídrido 3,3', 4,4'-benzofenona tetracarboxílico (BTDA) , anhídrido 4,4'-diftálico (hexafluoroisopropilideno) (6FDA), dianhídrido benzoquinonatetracarboxílico , dianhídrido etilentetracarboxílico . Los polianhídridos son una clase de polímeros caracterizados por enlaces anhídrido que conectan unidades repetidas de la cadena principal del polímero .
Ocurrencia biológica
Se han aislado productos naturales que contienen anhídridos de ácido de animales, bacterias y hongos. [16] [17] [18] Los ejemplos incluyen cantaridina de especies de escarabajo ampolla, incluida la mosca española , Lytta vesicatoria , y tautomicina , de la bacteria Streptomyces spiroverticillatus . La familia maleidrida de metabolitos secundarios fúngicos, que poseen una amplia gama de actividad antibiótica y antifúngica, son compuestos alicíclicos con grupos funcionales de anhídrido maleico. [19] Varias proteínas en procariotas [20] y eucariotas [21] experimentan una escisión espontánea entre los residuos de aminoácidos ácido aspártico y prolina a través de un intermedio de anhídrido ácido. En algunos casos, el anhídrido puede reaccionar con nucleófilos de otros componentes celulares, como en la superficie de la bacteria Neisseria meningitidis o en proteínas localizadas cerca. [22]
Análogos
Nitrógeno

Las imidas son análogos estructuralmente relacionados, en los que el oxígeno puente se reemplaza por nitrógeno. Se forman de manera similar mediante la condensación de ácidos dicarboxílicos con amoníaco. La sustitución de todos los átomos de oxígeno por nitrógeno da lugar a las imidinas , un grupo funcional poco común que es muy propenso a la hidrólisis.
Azufre
El azufre puede reemplazar al oxígeno, ya sea en el grupo carbonilo o en el puente. En el primer caso, el nombre del grupo acilo se encierra entre paréntesis para evitar ambigüedad en el nombre, [2] p. ej., anhídrido (tioacético) (CH 3 C(S)OC(S)CH 3 ). Cuando dos grupos acilo están unidos al mismo átomo de azufre, el compuesto resultante se denomina tioanhídrido, [2] p. ej., tioanhídrido acético ((CH 3 C(O)) 2 S).
Véase también
- Anhídrido de base
- Peróxido de benzoilo : estructuralmente similar pero químicamente muy diferente
Referencias
- ^ IUPAC , Compendio de terminología química , 2.ª edición (el "Libro de oro") (1997). Versión corregida en línea: (2006–) "anhídridos de ácido". doi :10.1351/goldbook.A00072
- ^ abc Panico, R.; Powell, WH; Richer, JC, eds. (1993). "Recomendación R-5.7.7". Una guía para la nomenclatura de compuestos orgánicos de la IUPAC . IUPAC / Blackwell Science . págs. 123–25. ISBN 0-632-03488-2.
- ^ "Nomenclatura de los anhídridos". 8 de noviembre de 2013.
- ^ Nelson, DL; Cox, MM "Lehninger, Principios de bioquímica" 3.ª ed. Worth Publishing: Nueva York, 2000. ISBN 1-57259-153-6 .
- ^ "Nomenclatura de los anhídridos". 8 de noviembre de 2013.
- ^ Zoeller, JR; Agreda, VH; Cook, SL; Lafferty, NL; Polichnowski, SW; Pond, DM "Proceso de anhídrido acético de Eastman Chemical Company" Catalysis Today (1992), volumen 13, págs. 73-91. doi :10.1016/0920-5861(92)80188-S
- ^ por Heimo Held, Alfred Rengstl, Dieter Mayer "Anhídrido acético y anhídridos de ácidos grasos mixtos" Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. doi :10.1002/14356007.a01_065
- ^ Lewis I. Krimen (1970). "Anhídrido fórmico acético". Organic Syntheses . 50 : 1. doi :10.15227/orgsyn.050.0001.
- ^ Spanedda, Maria Vittoria; Bourel-Bonnet, Line (2021). "Anhídridos cíclicos como herramientas poderosas para la bioconjugación y la administración inteligente" (PDF) . Química de bioconjugados . 32 (3): 482–496. doi :10.1021/acs.bioconjchem.1c00023. PMID 33662203.
- ^ Chen, Yonggang; McDaid, Paul; Deng, Li (2003). "Alcohólisis asimétrica de anhídridos cíclicos". Chemical Reviews . 103 (8): 2965–2984. doi :10.1021/cr020037x. PMID 12914488.
- ^ González-López, Marcos; Shaw, Jared T. (2009). "Anhídridos cíclicos en cicloadiciones formales y reacciones multicomponentes". Chemical Reviews . 109 (1): 164–189. doi :10.1021/cr8002714. PMID 19140773.
- ^ Kürti, László; Bárbara Czakó (2005). Aplicaciones estratégicas de reacciones nombradas en síntesis orgánica . Londres: Elsevier Academic Press. pag. 398.ISBN 0124297854.
- ^ Carsten Bolm, Iuliana Atodiresei e Ingo Schiffers (2005). "Alcohólisis asimétrica de mesoanhídridos mediada por alcaloides". Organic Syntheses . 82 : 120. doi :10.15227/orgsyn.082.0120.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Chiang, Wen-Yen; Chiang, Wen-Chang (5 de mayo de 1988). "Polimerización por condensación de monómeros multifuncionales y propiedades de resinas de poliéster relacionadas. II. Propiedades térmicas de barnices de poliéster-imida". Journal of Applied Polymer Science . 35 (6): 1433–1439. doi :10.1002/app.1988.070350603.
- ^ Faghihi, Khalil; Ashouri, Mostafa; Hajibeygi, Mohsen (25 de octubre de 2013). "Poli(amida-imida)s organosolubles y de alta temperatura basadas en 1,4-bis[4-aminofenoxi]butano y diácidos aromáticos por policondensación directa: síntesis y propiedades". Materiales y procesos de alta temperatura . 32 (5): 451–458. doi : 10.1515/htmp-2012-0164 . ISSN 2191-0324.
- ^ Saleem, Mahoma; Hussain, Hidayat; Ahmed, Ishtiaq; Draeger, Siegfried; Schulz, Bárbara; Meier, Kathrin; Steinert, Michael; Pescitelli, Gennaro; Kurtán, Tibor; Flörke, Ulrich; Krohn, Karsten (febrero de 2011). "Viburspiran, un miembro antifúngico de la clase octadrida de productos naturales de anhídrido maleico". Revista europea de química orgánica . 2011 (4): 808–812. doi :10.1002/ejoc.201001324.
- ^ Han, Chunguang; Furukawa, Hiroyuki; Tomura, Tomohiko; Fudou, Ryosuke; Kaida, Kenichi; Choi, Bong-Keun; Imokawa, Genji; Ojika, Makoto (24 de abril de 2015). "Anhídridos maleicos bioactivos y diácidos relacionados del hifomiceto acuático Tricladium castaneicola". Revista de productos naturales . 78 (4): 639–644. doi :10.1021/np500773s. PMID 25875311.
- ^ Heard, David M.; Tayler, Emyr R.; Cox, Russell J.; Simpson, Thomas J.; Willis, Christine L. (3 de enero de 2020). "Estudios estructurales y sintéticos sobre anhídrido maleico y productos naturales diácidos relacionados" (PDF) . Tetrahedron . 76 (1): 130717. doi :10.1016/j.tet.2019.130717. hdl :1983/53998d06-9017-4cfb-822b-c6453348000a. S2CID 209714625.
- ^ Chen, Xiaolong; Zheng, Yuguo; Shen, Yinchu (mayo de 2007). "Productos naturales con estructura de anhídrido maleico: nonádridos, tautomicina, anhídrido quetomélico y otros compuestos". Chemical Reviews . 107 (5): 1777–1830. doi :10.1021/cr050029r. PMID 17439289.
- ^ Kuban, Vojtech (2020). "Base estructural de la actividad de autoprocesamiento dependiente de Ca 2+ de las proteínas repetidas en toxinas". mBio . 11 (2): e00226-20. doi :10.1128/mBio.00226-20. PMC 7078468 . PMID 32184239.
- ^ Bell, Christian (2013). "Estructura del centro de señalización de la molécula de guía repulsiva (RGM)-neogenina". Science . 341 (6141): 77–80. Bibcode :2013Sci...341...77B. doi :10.1126/science.1232322. PMC 4730555 . PMID 23744777.
- ^ Scheu, Arne (2021). "NeissLock proporciona un anhídrido proteico inducible para la orientación covalente de proteínas endógenas". Nature Communications . 12 (1): 717. Bibcode :2021NatCo..12..717S. doi :10.1038/s41467-021-20963-5. PMC 7846742 . PMID 33514717.
Enlaces externos
- Introducción de anhídridos de ácido