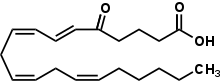
Ácido 5-oxo-eicosatetraenoico
 | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido Ácido (6 E , 8 Z , 11 Z , 14 Z ) -5-Oxoicosa-6,8,11,14-tetraenoico | |
Otros nombres
| |
| Identificadores | |
| |
Modelo 3D ( JSmol ) |
|
| EBICh |
|
| Química biológica |
|
| Araña química |
|
| BARRIL |
|
Identificador de centro de PubChem |
|
| |
| |
| Propiedades | |
| C20H30O3 | |
| Masa molar | 318,457 g·mol −1 |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El ácido 5-oxo-eicosatetraenoico (es decir, ácido 5-oxo-6 E ,8 Z ,11 Z ,14 Z -eicosatetraenoico; también denominado 5-oxo-ETE y 5-oxoETE ) es un metabolito eicosanoide no clásico del ácido araquidónico y el miembro natural más potente de la familia 5-HETE de agentes de señalización celular . Al igual que otros agentes de señalización celular, el 5-oxo-ETE es producido por una célula y luego se retroalimenta para estimular a su célula madre (ver Señalización autocrina ) y/o sale de esta célula para estimular las células cercanas (ver Señalización paracrina ). El 5-oxo-ETE puede estimular varios tipos de células, particularmente los leucocitos humanos, pero posee su mayor potencia y poder en la estimulación del tipo de leucocito eosinófilo humano . Por lo tanto, se sugiere que se forma durante y es un contribuyente importante a la formación y progresión de las reacciones alérgicas basadas en eosinófilos; [1] [2] También se sugiere que el 5-oxo-ETE contribuye al desarrollo de la inflamación , el crecimiento de células cancerosas y otros eventos patológicos y fisiológicos. [1] [3]
Bioquímica y producción
En el medio más común para su producción, las células producen 5-oxo-ETE en una vía de cuatro pasos que implica la activación inducida por estímulos de la siguiente vía: a) la liberación de ácido araquidónico (es decir, ácido 5Z,8Z,11Z,14Z-eicosatetraenoico) de sus sitios de almacenamiento en los fosfolípidos de membrana debido a la activación de las enzimas fosfolipasa A2 ; b) la oxigenación de este ácido araquidónico por la araquidonato 5-lipoxigenasa activada (ALOX5) para formar 5( S )-hidroperoxi-6 E ,8 Z ,11 Z ,14 Z -ácido eicosatetraenoico (5( S )-HpETE); c) la reducción de este 5( S )-HpETE por peroxidasas celulares ubicuas para formar ácido 5( S )-hidroxi-6 E ,8 Z ,11 Z ,14 Z -eicosatetraenoico (5( S )-HETE); y ( d ) la oxidación de 5( S )-HETE por una enzima deshidrogenasa dependiente de nicotinamida adenina dinucleótido fosfato (NADP + ) unida a microsomas , a saber, la 5-hidroxieicosanoide deshidrogenasa (5-HEDH), para formar 5-oxo-ETE: [1]
El 5-HEDH tiene poca o ninguna capacidad para metabolizar el estereoisómero R del 5( S )-HETE, es decir, el 5( R )-HETE, a 5-oxo-ETE. Además, actúa de manera totalmente reversible, convirtiendo fácilmente el 5-oxo-ETE de nuevo en 5( S )-HETE. Dado que las células suelen mantener niveles muy altos de NADPH en comparación con sus niveles de NADP + , generalmente tienen poca o ninguna capacidad para convertir el 5( S )-HEE en 5-oxo-ETE, y cuando se enfrentan al 5-oxo-ETE lo metabolizan rápidamente a 5( S )-HETE. [1] Sin embargo, las células que experimentan envejecimiento, senescencia, apoptosis , estrés oxidativo u otras condiciones que aumentan sus niveles de especies reactivas de oxígeno (por ejemplo, anión superóxido , radicales de oxígeno y peróxidos ) ya sea fisiológicamente (por ejemplo, fagocitos humanos que engullen bacterias) o patológicamente (por ejemplo, linfocitos B desafiados por la oxidación ) utilizan NADP + , tienen proporciones bajas de NADPH/NADP + y, por lo tanto, convierten fácilmente 5( S )-HETE en 5-oxo-ETE. [1] Por lo tanto, muchas condiciones patológicas que involucran estrés oxidativo, como ocurre en cánceres de rápido crecimiento, pueden ser promotores importantes de la acumulación de 5-oxo-ETE in vivo .
5-Oxo-ETE también se puede formar a partir de 5( S )-HpETE (y posiblemente 5( R )-HpEPE) por la acción de las enzimas del citocromo P450 (CYP) como CYP1A1 , CYP1A2 , CYP1B1 y CYP2S1 . [4] a partir de 5( S )-HETE (y probablemente 5( R )-HETE) por el ataque no enzimático con hemo o varios otros agentes deshidratantes; [1] También se puede formar por la conversión de 5-( S )-HpETE o 5( R )-HpETE a 5-oxo-ETE debido a la acción de una proteína citosólica de macrófago de ratón de 50–60 kilodalton . [5] La contribución de las últimas tres vías a la producción fisiológica de 5-oxo-ETE no se ha evaluado completamente.
Un isómero del 5-oxo-ETE, el ácido 5-oxo-(7 E ,9 E ,11 Z ,14 Z )-eicosatetraenoico, se forma de manera no enzimática como subproducto de la hidrólisis del metabolito de la 5-lipoxgenasa, el leucotrieno A4 . Este subproducto difiere del 5-oxo-ETE no solo en la posición y geometría de sus enlaces dobles, sino también en su actividad: estimula los neutrófilos humanos aparentemente al actuar sobre uno o más receptores LTB4 en lugar de OXER1. [1] [6]
Fuentes de tejido
Producción celular
Se ha descubierto y/o sugerido que los neutrófilos humanos , monocitos , eosinófilos , linfocitos B , células dendríticas , plaquetas , células epiteliales de las vías respiratorias y células musculares lisas , células endoteliales vasculares y queratinocitos de la piel producen 5-oxo-ETE a partir de 5-HETE endógeno o exógeno, particularmente en condiciones de estrés oxidativo; también se ha demostrado que las líneas celulares derivadas de cánceres humanos, como los de mama, próstata, pulmón, colon y varios tipos de leucemia, son productores de 5-oxo-ETE. [3]
Producción transcelular
Las células de un tipo pueden liberar el 5( S )-HETE que producen a células cercanas de un segundo tipo que luego oxidan el 5( S )-HETE a 5-oxo-ETE. Esta producción transcelular generalmente involucra la variedad limitada de tipos de células que expresan 5-lipoxigenasa activa, carecen de actividad HEDH debido a sus altos niveles de NADPH en comparación con los niveles de NADP + y, por lo tanto, acumulan 5( S )-HETE, no 5-oxo-ETE, tras la estimulación. Este 5( S )-ETE puede salir de estas células, ingresar a varios tipos de células que poseen actividad 5-HEDH junto con niveles más bajos de NADPH a NADP + y, por lo tanto, convertirse en 5-oxo-ETE. La producción transcelular de 5-oxo-eicosatetraenoatos se ha demostrado in vitro con neutrófilos humanos como células productoras de 5( S )-HETE y células de cáncer de próstata PC-3 humanas, plaquetas y células dendríticas derivadas de monocitos como células oxidantes. [3] [7] Se teoriza que este metabolismo transcelular ocurre in vivo y proporciona un mecanismo para controlar la producción de 5-oxo-ETE al permitir que ocurra o aumente en sitios donde las células que contienen 5-lipoxigenasa se congregan con tipos de células que poseen 5-HEDH y proporciones NADPH/NADP + favorables ; dichos sitios, se teoriza, podrían incluir aquellos que involucran alergia, inflamación, estrés oxidativo y cánceres de rápido crecimiento. [1] [3]
Metabolismo
Como se indicó en la sección anterior, el 5-oxo-ETE se convierte fácilmente en 5( S )-HETE por 5-HEDH en células que contienen proporciones NADPH/NADP + muy bajas . Los neutrófilos humanos , una célula modelo importante para investigar la producción de 5-oxo-ETE, absorben 5-oxo-ETE y lo reducen a 5( S )-HETE; también forman cantidades apreciables de 5( S )-20-dihidroxi-ETE y pequeñas cantidades de 5-oxo,20-hidroxi-ETE probablemente por la acción de la enzima ω-hidroxilasa del citocromo P450 , CYP453A sobre 5( S )-HETE y 5-oxo-ETE, respectivamente. [3] [8] Las células también incorporan el producto 5( S )-HETE del 5-oxo-ETE pero poco o nada del propio 5-oxo-ETE como éster en varios depósitos de fosfolípidos y glicerolípidos ; sin embargo, las membranas plasmáticas de neutrófilos aisladas , que carecen de una actividad apreciable de 5-HEDH, esterifican el 5-oxo-ETE en estos depósitos de lípidos. [1] [8]
Varias otras vías pueden metabolizar el 5-oxo-ETE. En primer lugar, los eosinófilos humanos utilizan la araquidonato 15-lipoxigenasa -1 (o posiblemente la araquidonato 15-lipoxigenasa-2 para metabolizar el 5-oxo-ETE a 5-oxo-15-( S )-hidroperoxi-ETE que se reduce rápidamente a 5-oxo-15( S )-hidroxi-ETE; el 5-oxo-15( S )-hidroxil-ETE es aproximadamente un tercio tan potente como el 5-oxo-ETE en la estimulación de las células. [1] [3] En segundo lugar, las plaquetas humanas utilizan la 12-lipoxigenasa para metabolizar el 5-oxo-ETE a 5-oxo-12( S )-hidroperoxi-eicosatetraenoato, que se convierte rápidamente en 5-oxo-12( S )-hidroxi-eicosatetraenoato (5-oxo-12( S )-hidroxi-ETE); 5-oxo-12( S )-hidroxil-ETE es un antagonista débil de 5-oxo-ETE. [3] En tercer lugar, los macrófagos de ratón utilizan a) una enzima del citocromo P450 para metabolizar 5-oxo-ETE a 5-oxo-18-hidroxi-ETE (5-oxo-18-HETE) que es atacado por una 5-ceto-reductasa (posiblemente 5-HEDH) para formar ácido 5,18-dihidroxi-eicosatetraenoico (5,18-diHETE) o por una Δ6-reductasa para formar ácido 5-oxo-18-hidroxi-eicosatrienoico (5-oxo-18-HETrE) que luego es reducido por una 5-ceto-reductasa (posiblemente 5-HEDH) a ácido 5,18-dihidroxi-eicosatrienoico (5,18-diHETrE); b) una enzima del citocromo P450 convierte el 5-oxo-ETE en ácido 5-oxo-19-hidroxi-eicosatetraenoico (5-oxo-19-HETE), que luego es reducido por una ceto reductasa (posiblemente 5-HEDH) en ácido 5,19-dihidroxi-eicosatetraenoico (5,19-diHETE) o por una Δ6 reductasa en ácido 5-oxo-19-hidroxi-eicosatrienoico (5-oxo-19-HETrE); [9] o c) la leucotrieno C4 sintasa para metabolizar el 5-oxo-ETE en ácido 5-oxo-7-glutatiónil-8,11,14-eicosatrienoico (FOG7). FOG7 simula las células mediante un mecanismo diferente al del 5-oxo-ETE; no se ha informado de la actividad biológica de los otros metabolitos derivados del ratón. [10] [11]
Mecanismo de acción
El receptor OXER1
Estudios en neutrófilos humanos detectaron por primera vez un sitio localizado en la membrana plasmática que se unía reversiblemente al 5-oxo-ETE y tenía los atributos de un receptor acoplado a proteína G vinculado a la subunidad alfa de Gi basado en la capacidad del 5-oxo-ETE para activar esta clase de proteínas G de membrana por un mecanismo sensible a la toxina pertussis . [3] [8] Posteriormente, este receptor fue clonado por varios grupos que lo denominaron receptor oxoeicosanoide 1 (OXER1), OXE, OXE-R, hGPCR48, HGPCR48 o R527 (su gen se denomina OXE1 u OXER1 ), y encontraron que se acoplaba y activaba el complejo de proteína G compuesto por la subunidad alfa de Gi (Gαi) y el complejo beta-gamma G (Gβγ). [1] [3] [12] Cuando se une a 5-oxo-ETE, el OXER1 hace que este complejo de proteína G se disocie en sus componentes Gαi y Gβγ; el Gβγ disociado es responsable de activar muchas de las vías de señalización que conducen a las respuestas funcionales celulares provocadas por 5-oxo-ETE. [13] Estas vías de señalización incluyen aquellas que provocan aumentos en los niveles de iones de calcio , así como otras que activan MAPK/ERK , las proteínas quinasas activadas por mitógeno p38 , la fosfolipasa A2 citosólica , PI3K / Akt , la proteína quinasa C beta (PKCβ) y/o (PKCε). [1] [3] [12] [14] La mayoría de las acciones del 5-oxo-ETE parecen mediadas por OXER1; sin embargo, algunas de sus acciones estimulantes de células parecen ser independientes de OXER1, como se indica en la siguiente sección. Otros compuestos también pueden estimular las células a través de OXER1. Muchos de estos compuestos difieren ligeramente de la 5-oxo-ETE en su estructura por la sustitución de un átomo por un átomo de un elemento diferente, por la pérdida de uno o más átomos y/o por la presencia de un grupo funcional que no se encuentra en la 5-oxo-ETE. Estos compuestos se denominan análogos de la 5-oxo-ETE o miembros de la familia de agonistas de la 5-oxo-ETE. El 5-HETE y el ácido 5-hidroxi-15( S )-hidroxieicosatetraenoico son ejemplos de dichos análogos. La 5-oxo-ETE y muchos de sus análogos son producidos por células humanas, otras células de mamíferos como las de gatos y zarigüeyas, y las células de varias especies de peces. [2] [3] Basándose en la presencia de su ARNm , se supone que el receptor OXER1 está altamente expresado en eosinófilos , neutrófilos, bazo, pulmón, hígado y riñón de sangre humana y en niveles más bajos en basófilos, monocitos y macrófagos pulmonares humanos., y varias líneas celulares de cáncer humano, y una línea celular derivada de la corteza suprarrenal humana ; sin embargo, las células de ratones y ratas parecen carecer de un OXER1 claro. [1]
Otros receptores GPCR
Las células MA-10 de ratón responden a 5-oxo-ETE pero carecen de OXER1. Se ha sugerido que las respuestas de estas células a 5-oxo-ETE están mediadas por un ortólogo de OXER1, el receptor de niacina de ratón 1 , Niacr1, que es un receptor acoplado a proteína G para niacina , o, alternativamente, por uno o más de la familia de ácidos hidroxicarboxílicos (HCA) de ratón de los receptores acoplados a proteína G, HCA1 ( GPR81 ), HCA2 ( GPR109A ) y HCA3 ( GPR109B ), que son receptores acoplados a proteína G para ácidos grasos. [3] [15]
PPARγ
El 5-oxo-ETE y el 5-oxo-15( S )-hidroxi-ETE, pero no los miembros 5-hidroxi de la familia 5-HETE, como el 5-( S )-HETE, activan el receptor activado por el proliferador de peroxisomas gamma (PPARγ). Esta activación no se produce a través de OXER1, sino que implica la unión directa del análogo oxo al PPARγ, siendo el 5-oxo-15-( S )-hidroxi-ETE más potente que el 5-oxo-ETE para unirse y activar el PPARγ. [16] La activación del receptor OXER1 y del PPARγ por los análogos oxo puede tener efectos opuestos en la función celular. Por ejemplo, el OXER1 unido al 5-oxo-ETE estimula, mientras que el PPARγ unido al 5-oxo-ETE inhibe, la proliferación de varios tipos de líneas celulares de cáncer humano; Esto da como resultado que el 5-oxo-ETE y el 5-oxo-15-( S )-HETE tengan una potencia considerablemente menor de lo previsto para estimular la proliferación de estas células cancerosas en relación con la potencia del 5-( S )-HETE, una relación que no sigue de cerca las potencias de estos tres compuestos para activar OXER1. [3] [16]
Otros mecanismos
El 5-oxo-ETE relaja los bronquios humanos precontraídos mediante un mecanismo que no parece involucrar a OXER1, pero que no está definido. [3] [17]
Células objetivo
Células inflamatorias
5-Oxo-ETE es un potente estimulador in vitro y/o potenciador de la quimiotaxis (es decir, migración direccional) y, dependiendo del tipo de célula, de varias otras respuestas como la desgranulación (es decir, la liberación de enzimas unidas a gránulos), el metabolismo oxidativo (es decir, la generación de especies reactivas de oxígeno ) y la producción de mediadores como varios metabolitos del ácido araquidónico y el factor activador de plaquetas en eosinófilos, basófilos , neutrófilos y monocitos humanos . [3] [18] Además, la inyección de 5-oxo-ETE en la piel de humanos provoca la acumulación local de células sanguíneas circulantes, particularmente eosinófilos, pero también en menor medida neutrófilos y macrófagos derivados de monocitos . [19] La actividad de 5-oxo-ETE en los dos tipos de células que se sabe que están implicadas en la inflamación basada en alergias, eosinófilos y basófilos, sugiere que puede estar implicada en la promoción de reacciones alérgicas posiblemente atrayendo a través de quimiotaxis estas células a sitios nacientes de alergia y/o mediante la estimulación de estas células para liberar enzimas unidas a gránulos, especies reactivas de oxígeno u otros promotores de reacciones alérgicas. [3] [12] La actividad de 5-oxo-ETE en células humanas implicadas en enfermedades inflamatorias no alérgicas, a saber, neutrófilos y monocitos, así como su capacidad para atraer estos tipos de células a la piel de los humanos sugieren que 5-oxo-ETE también puede estar implicado en la amplia categoría de enfermedades inflamatorias no alérgicas, incluidas aquellas que involucran la defensa del huésped contra patógenos. [12]
Células musculares lisas de las vías respiratorias pulmonares
El 5-oxo-ETE contrae el músculo liso y los bronquios cultivados en órganos aislados de cobayos, pero relaja los bronquios aislados de pulmón humano; la relajación de los bronquios humanos causada por el 5-oxo-ETE puede no involucrar a su OXER1. [3] [20] Estos resultados sugieren que el 5-oxo-ETE no está directamente involucrado en la broncoconstricción que ocurre en las reacciones alérgicas de asma basadas en eosinófilos en humanos.
Células cancerosas
El 5-oxo-ETE (u otro miembro de la familia 5-HETE) estimula el crecimiento y/o la supervivencia de líneas celulares humanas derivadas de cánceres de próstata, mama, pulmón, ovario, colon y páncreas [1] [3] [16] [21] Estos estudios preclínicos sugieren que el 5-oxo-ETE (u otro miembro de la familia 5-HETE) puede contribuir a la progresión de los cánceres citados en humanos.
Células esteroidogénicas
El 5-oxo-ETE estimula las células adrenocorticales humanas H295R para aumentar la transcripción del ARN mensajero de la proteína reguladora aguda esteroidogénica y producir aldosterona y progesterona mediante una vía aparentemente dependiente de OXER1. [15]
Otros tipos de células
El 5-oxo-ETE induce una reducción isotónica del volumen en las células epiteliales de las criptas intestinales de cobayas. [22]
Interacción con otros estímulos
5-Oxo-ETE y otro mediador potencial de las reacciones alérgicas humanas, el factor activador de plaquetas , actúan en sinergia para estimular los eosinófilos y neutrófilos humanos: los agentes combinados provocan respuestas que son mayores que la simple suma de sus acciones individuales y lo hacen a niveles relativamente bajos. [23] [24] 5-Oxo-ETE también aumenta en gran medida las potencias del componente del complemento 5a , LTB4 y FMLP para estimular la desgranulación de los eosinófilos humanos y su actividad desgranulante aumenta en gran medida al pretratar los eosinófilos humanos con el factor estimulante de colonias de granulocitos y macrófagos o los neutrófilos humanos con esta última citocina o con el factor estimulante de colonias de granulocitos , el factor de necrosis tumoral α o varios nucleótidos , incluido el ATP . [23] [24] [25] [26] El pretratamiento de eosinófilos con interleucina 5 (un mediador clave en la activación de eosinófilos) también aumenta su respuesta quimiotáctica in vitro a 5-oxo-ETE. [27] 5-oxo-ETE también actúa en sinergia con dos quimiocinas , CCL2 y CCL8 , en la estimulación de la quimiotaxis de monocitos. [18] Las interacciones de 5-oxo-ETE con estos mediadores de alergia (por ejemplo, factor activador de plaquetas, interleucina 5) en eosinófilos sugieren además que desempeña un papel en enfermedades alérgicas, mientras que sus interacciones con mediadores de reacciones inflamatorias (por ejemplo, factor de necrosis tumoral α, los factores estimulantes de colonias y las dos quimiocinas CCL) en neutrófilos y monocitos sugieren además que desempeña un papel en las respuestas inflamatorias y los mecanismos de defensa del huésped.
Importancia clínica
Básicamente, todos los estudios sobre las actividades y las células diana del 5-oxo-ETE, similares a los de otros miembros de la familia de agonistas del 5( S )-HETE, se clasifican mejor como estudios de desarrollo preclínico : aún no se ha determinado que sean importantes en la fisiopatología humana. Se necesitan estudios de traducción para saber si los estudios preclínicos que implican al 5-oxo-ETE y a otros miembros de la familia del 5( S )-HETE en enfermedades alérgicas, enfermedades inflamatorias, cáncer, producción de esteroides, remodelación ósea, parto y otros eventos fisiopatológicos, como se describe aquí y en la página del 5-HETE , son relevantes para los humanos y, por lo tanto, tienen importancia clínica.
Posible implicación en la alergia
La importancia clínica del 5-oxo-ETE se ha estudiado con mayor frecuencia como un posible mediador de las reacciones alérgicas basadas en eosinófilos. Cuando se administra como una inyección intradérmica , provoca la infiltración de eosinófilos en el lugar de la inyección en monos. En humanos, induce la infiltración de eosinófilos que se acompaña de niveles significativos de infiltraciones de neutrófilos y macrófagos. Estas inyecciones de 5-oxo-ETE causaron un infiltrado de eosinófilos significativamente mayor en asmáticos en comparación con humanos sanos. Estudios en monos rhesus que fueron sensibilizados a un alérgeno, mostraron que la inyección intradérmica del alérgeno original causó una acumulación localizada de eosinófilos; esta infiltración fue bloqueada en aproximadamente el 50% en animales pretratados con un antagonista del receptor OXER1 tomado por vía oral. Este mismo antagonista del receptor también bloqueó la infiltración de eosinófilos en el pulmón en monos rhesus que fueron sensibilizados y luego desafiados con el alérgeno original. Se han detectado niveles aumentados de 5-oxo-ETE en el condensado del aliento exhalado de humanos que desarrollaron una respuesta de broncoconstricción similar al asma a la inhalación del alérgeno del ácaro del polvo doméstico : los niveles de estos aumentos fueron mayores en individuos que desarrollaron una respuesta asmática tardía más grave . De manera similar, se han detectado niveles aumentados de 5-oxo-ETE en el líquido de lavado broncoalveolar después de la inhalación del alérgeno del ácaro del polvo doméstico a ratones sensibilizados al ácaro del polvo doméstico. Finalmente, las células epiteliales obtenidas de los pólipos nasales de humanos producen 5-oxo-ETE y, cuando se aplica a cultivos de tejido de pólipos nasales, el 5-oxo-ETE estimula la producción de proteína catiónica eosinófila , una proteína asociada con la inflamación basada en eosinófilos y el asma. Estos resultados indican que: 1) el 5-oxo-ETE causa reacciones cutáneas similares a las alérgicas basadas en eosinófilos; 2) sus acciones, al menos en monos, implican la estimulación de OXER1; 3) El 5-oxo-ETE (o un análogo de 5-oxo-ETE que actúe de manera similar) puede contribuir a las reacciones alérgicas en la piel (por ejemplo, dermatitis atópica ), los pulmones (por ejemplo, asma) y la nariz (por ejemplo, rinitis alérgica ) en humanos; y 4) Los antagonistas de OXER1 pueden ser útiles para tratar estas reacciones en la piel, los pulmones y, posiblemente, la nariz en humanos. [28]
Véase también
Referencias
- ^ abcdefghijklmn Powell WS, Rokach J (abril de 2015). "Biosíntesis, efectos biológicos y receptores de ácidos hidroxieicosatetraenoicos (HETE) y ácidos oxoeicosatetraenoicos (oxo-ETEs) derivados del ácido araquidónico". Biochimica et Biophysica Acta (BBA) - Biología molecular y celular de los lípidos . 1851 (4): 340–55. doi :10.1016/j.bbalip.2014.10.008. PMC 5710736. PMID 25449650 .
- ^ ab Cossette C, Gravel S, Reddy CN, Gore V, Chourey S, Ye Q, Snyder NW, Mesaros CA, Blair IA, Lavoie JP, Reinero CR, Rokach J, Powell WS (agosto de 2015). "Biosíntesis y acciones del ácido 5-oxoeicosatetraenoico (5-oxo-ETE) sobre granulocitos felinos". Farmacología Bioquímica . 96 (3): 247–55. doi :10.1016/j.bcp.2015.05.009. PMC 4830392 . PMID 26032638.
- ^ abcdefghijklmnopqr Powell WS, Rokach J (octubre de 2013). "El quimioatrayente de eosinófilos 5-oxo-ETE y el receptor OXE". Progreso en la investigación de lípidos . 52 (4): 651–65. doi :10.1016/j.plipres.2013.09.001. PMC 5710732. PMID 24056189 .
- ^ Bui P, Imaizumi S, Beedanagari SR, Reddy ST, Hankinson O (febrero de 2011). "El CYP2S1 humano metaboliza eicosanoides derivados de ciclooxigenasa y lipoxigenasa". Metabolismo y disposición de fármacos . 39 (2): 180–90. doi :10.1124/dmd.110.035121. PMC 3033693 . PMID 21068195.
- ^ Zarini S, Murphy RC (marzo de 2003). "Biosíntesis del ácido 5-oxo-6,8,11,14-eicosatetraenoico a partir del ácido 5-hidroperoxieicosatetraenoico en el macrófago murino". The Journal of Biological Chemistry . 278 (13): 11190–6. doi : 10.1074/jbc.M208496200 . PMID 12547823.
- ^ Falgueyret J, Riendeau D (febrero de 2000). "Ácido 5-oxo-eicosatetraenoico derivado de LTA(4): formación dependiente del pH e interacción con el receptor LTB(4) de leucocitos polimorfonucleares humanos". Biochimica et Biophysica Acta (BBA) - Biología molecular y celular de los lípidos . 1484 (1): 51–8. doi :10.1016/s1388-1981(99)00198-5. PMID 10685030.
- ^ Zimpfer U, Dichmann S, Termeer CC, Simon JC, Schröder JM, Norgauer J (noviembre de 2000). "Las células dendríticas humanas son una fuente fisiológica del metabolito quimiotáctico del ácido araquidónico, el ácido 5-oxo-eicosatetraenoico". Investigación sobre la inflamación . 49 (11): 633–8. doi :10.1007/s000110050641. PMID 11131304. S2CID 21430700.
- ^ abc O'Flaherty JT, Taylor JS, Thomas MJ (diciembre de 1998). "Receptores de la clase 5-oxo de eicosanoides en neutrófilos". The Journal of Biological Chemistry . 273 (49): 32535–41. doi : 10.1074/jbc.273.49.32535 . PMID 9829988.
- ^ Hevko JM, Bowers RC, Murphy RC (febrero de 2001). "Síntesis de ácido 5-oxo-6,8,11,14-eicosatetraenoico e identificación de nuevos metabolitos omega-oxidados en el macrófago de ratón". The Journal of Pharmacology and Experimental Therapeutics . 296 (2): 293–305. PMID 11160610.
- ^ Murphy RC, Zarini S (2002). "Aductos de glutatión de oxieicosanoides". Prostaglandinas y otros mediadores lipídicos . 68–69: 471–82. doi :10.1016/s0090-6980(02)00049-7. PMID 12432937.
- ^ Hevko JM, Bowers RC, Murphy RC (febrero de 2001). "Síntesis de ácido 5-oxo-6,8,11,14-eicosatetraenoico e identificación de nuevos metabolitos omega-oxidados en el macrófago de ratón". J Pharmacol Exp Ther . 296 (2): 293–305. PMID 11160610.
- ^ abcd Brink C, Dahlén SE, Drazen J, Evans JF, Hay DW, Rovati GE, Serhan CN, Shimizu T, Yokomizo T (marzo de 2004). "Unión Internacional de Farmacología XLIV. Nomenclatura para el receptor oxoeicosanoide". Pharmacological Reviews . 56 (1): 149–57. doi :10.1124/pr.56.1.4. PMID 15001665. S2CID 7229884.Yo
- ^ Konya V, Blättermann S, Jandl K, Platzer W, Ottersbach PA, Marsche G, Gütschow M, Kostenis E, Heinemann A (mayo de 2014). "Un antagonista de OXE-R no Gαi sesgado demuestra que la subunidad proteica Gαi no está directamente involucrada en la activación de neutrófilos, eosinófilos y monocitos por 5-oxo-ETE". Journal of Immunology . 192 (10): 4774–82. doi : 10.4049/jimmunol.1302013 . PMID 24733850.
- ^ Rossi AG, O'Flaherty JT (1991). "Bioacciones del 5-hidroxiicosatetraenoato y su interacción con el factor activador de plaquetas". Lípidos . 26 (12): 1184–8. doi :10.1007/bf02536528. PMID 1668115. S2CID 3964822.
- ^ ab Cooke M, Di Cónsoli H, Maloberti P, Cornejo Maciel F (mayo de 2013). "Expresión y función del receptor OXE, un receptor de eicosanoide, en células esteroidogénicas". Endocrinología molecular y celular . 371 (1–2): 71–8. doi :10.1016/j.mce.2012.11.003. hdl : 11336/8381 . PMID 23159987. S2CID 8520991.
- ^ abc O'Flaherty JT, Rogers LC, Paumi CM, Hantgan RR, Thomas LR, Clay CE, High K, Chen YQ, Willingham MC, Smitherman PK, Kute TE, Rao A, Cramer SD, Morrow CS (octubre de 2005). "Análogos de 5-oxo-ETE y la proliferación de células cancerosas". Biochimica et Biophysica Acta (BBA) - Biología molecular y celular de los lípidos . 1736 (3): 228–236. doi :10.1016/j.bbalip.2005.08.009. PMID 16154383.
- ^ Morin C, Sirois M, Echave V, Gomes MM, Rousseau E (junio de 2007). "Los efectos relajantes del 5-oxo-ETE en los bronquios humanos implican la activación del canal de calcio BK". Prostaglandinas y otros mediadores lipídicos . 83 (4): 311–9. doi :10.1016/j.prostaglandins.2007.03.001. PMID 17499751.
- ^ ab Sozzani S, Zhou D, Locati M, Bernasconi S, Luini W, Mantovani A, O'Flaherty JT (noviembre de 1996). "Propiedades estimulantes de los 5-oxo-eicosanoides para los monocitos humanos: sinergismo con la proteína quimiotáctica de monocitos-1 y -3". Journal of Immunology . 157 (10): 4664–71. doi : 10.4049/jimmunol.157.10.4664 . PMID 8906847. S2CID 23499393.
- ^ Muro S, Hamid Q, Olivenstein R, Taha R, Rokach J, Powell WS (octubre de 2003). "El ácido 5-oxo-6,8,11,14-eicosatetraenoico induce la infiltración de granulocitos en la piel humana". The Journal of Allergy and Clinical Immunology . 112 (4): 768–74. doi : 10.1016/S0091-6749(03)01888-8 . PMID 14564360.
- ^ Morin C, Sirois M, Echave V, Gomes MM, Rousseau E (2007). "Los efectos relajantes del 5-oxo-ETE en los bronquios humanos implican la activación del canal de Ca BK". Prostaglandinas y otros mediadores lipídicos . 83 (4): 311–9. doi :10.1016/j.prostaglandins.2007.03.001. PMID 17499751.
- ^ Grant GE, Rubino S, Gravel S, Wang X, Patel P, Rokach J, Powell WS (junio de 2011). "Formación mejorada de ácido 5-oxo-6,8,11,14-eicosatetraenoico por células cancerosas en respuesta al estrés oxidativo, ácido docosahexaenoico y ácido 5-hidroxi-6,8,11,14-eicosatetraenoico derivado de neutrófilos". Carcinogénesis . 32 (6): 822–8. doi :10.1093/carcin/bgr044. PMC 3146358 . PMID 21393477.
- ^ MacLeod RJ, Lembessis P, Hamilton JR, Powell WS (noviembre de 1999). "El ácido 5-oxo-6,8,11,14-eicosatetraenoico estimula la reducción isotónica del volumen de las células epiteliales de la cripta yeyunal de cobayo". Revista de farmacología y terapéutica experimental . 291 (2): 511–6. PMID 10525065.
- ^ ab O'Flaherty JT, Kuroki M, Nixon AB, Wijkander J, Yee E, Lee SL, Smitherman PK, Wykle RL, Daniel LW (julio de 1996). "El 5-oxo-eicosatetraenoato es un estímulo selectivo de eosinófilos y ampliamente activo para los granulocitos humanos". Journal of Immunology . 157 (1): 336–42. doi : 10.4049/jimmunol.157.1.336 . PMID 8683135. S2CID 35264541.
- ^ ab O'Flaherty JT, Cordes JF, Lee SL, Samuel M, Thomas MJ (diciembre de 1994). "Caracterización química y biológica de los ácidos oxo-eicosatetraenoicos". Biochimica et Biophysica Acta (BBA) - Temas generales . 1201 (3): 505–15. doi :10.1016/0304-4165(94)90083-3. PMID 7803484.
- ^ O'Flaherty JT, Kuroki M, Nixon AB, Wijkander J, Yee E, Lee SL, Smitherman PK, Wykle RL, Daniel LW (julio de 1996). "Los 5-oxo-eicosanoides y las citocinas hematopoyéticas cooperan en la estimulación de la función de los neutrófilos y la vía de la proteína quinasa activada por mitógenos". The Journal of Biological Chemistry . 271 (30): 17821–8. doi : 10.1074/jbc.271.30.17821 . PMID 8663432.
- ^ O'Flaherty JT, Cordes JF (junio de 1994). "Respuestas de desgranulación de neutrófilos humanos a nucleótidos". Laboratory Investigation; A Journal of Technical Methods and Pathology . 70 (6): 816–21. PMID 8015286.
- ^ Guilbert M, Ferland C, Bossé M, Flamand N, Lavigne S, Laviolette M (julio de 1999). "El ácido 5-oxo-6,8,11,14-eicosatetraenoico induce una importante transmigración de eosinófilos a través de componentes de la membrana basal: comparación de eosinófilos normales y asmáticos". American Journal of Respiratory Cell and Molecular Biology . 21 (1): 97–104. CiteSeerX 10.1.1.326.2636 . doi :10.1165/ajrcmb.21.1.3517. PMID 10385597.
- ^ Powell WS, Rokach J (marzo de 2020). "Apuntar al receptor OXE como una posible nueva terapia para el asma". Farmacología bioquímica . 179 : 113930. doi :10.1016/j.bcp.2020.113930. PMC 10656995. PMID 32240653. S2CID 214768793 .
