Proteína G
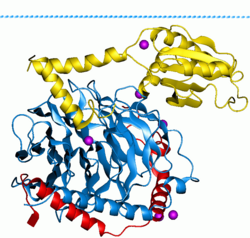
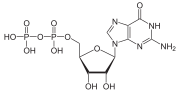

Las proteínas G , también conocidas como proteínas de unión al nucleótido de guanina , son una familia de proteínas que actúan como interruptores moleculares dentro de las células y están involucradas en la transmisión de señales desde una variedad de estímulos fuera de una célula a su interior. Su actividad está regulada por factores que controlan su capacidad para unirse e hidrolizar el trifosfato de guanosina (GTP) a difosfato de guanosina (GDP). Cuando están unidas al GTP, están "activadas" y, cuando están unidas al GDP, están "desactivadas". Las proteínas G pertenecen al grupo más grande de enzimas llamadas GTPasas .
Existen dos clases de proteínas G. Las primeras funcionan como pequeñas GTPasas monoméricas (proteínas G pequeñas), mientras que las segundas funcionan como complejos de proteína G heterotriméricos . La última clase de complejos está formada por subunidades alfa (G α ), beta (G β ) y gamma (G γ ) . [1] Además, las subunidades beta y gamma pueden formar un complejo dimérico estable denominado complejo beta-gamma . [2]
Las proteínas G heterotriméricas ubicadas dentro de la célula son activadas por receptores acoplados a proteína G (GPCR) que abarcan la membrana celular . [3] Las moléculas de señalización se unen a un dominio del GPCR ubicado fuera de la célula, y un dominio GPCR intracelular activa a su vez una proteína G particular. También se ha demostrado que algunos GPCR en estado activo están "preacoplados" con proteínas G, mientras que en otros casos se cree que ocurre un mecanismo de acoplamiento por colisión. [4] [5] [6] La proteína G desencadena una cascada de eventos de señalización adicionales que finalmente resultan en un cambio en la función celular. Los receptores acoplados a proteína G y las proteínas G que trabajan juntos transmiten señales de muchas hormonas , neurotransmisores y otros factores de señalización. [7] Las proteínas G regulan las enzimas metabólicas , los canales iónicos , las proteínas transportadoras y otras partes de la maquinaria celular, controlando la transcripción , la motilidad , la contractilidad y la secreción , que a su vez regulan diversas funciones sistémicas como el desarrollo embrionario , el aprendizaje y la memoria, y la homeostasis . [8]
Historia
Las proteínas G se descubrieron en 1980 cuando Alfred G. Gilman y Martin Rodbell investigaron la estimulación de las células por la adrenalina . Descubrieron que cuando la adrenalina se une a un receptor, el receptor no estimula las enzimas (dentro de la célula) directamente. En cambio, el receptor estimula una proteína G, que a su vez estimula una enzima. Un ejemplo es la adenilato ciclasa , que produce el segundo mensajero AMP cíclico . [9] Por este descubrimiento, ganaron el Premio Nobel de Fisiología o Medicina en 1994. [10]
Se han otorgado premios Nobel por muchos aspectos de la señalización de las proteínas G y GPCR. Estos incluyen antagonistas de receptores , neurotransmisores , recaptación de neurotransmisores , receptores acoplados a proteína G , proteínas G, segundos mensajeros , las enzimas que desencadenan la fosforilación de proteínas en respuesta al AMPc y los procesos metabólicos consecuentes como la glucogenólisis .
Algunos ejemplos destacados incluyen (en orden cronológico de concesión):
- Premio Nobel de Fisiología o Medicina de 1947 a Carl Cori , Gerty Cori y Bernardo Houssay , por su descubrimiento de cómo el glucógeno se descompone en glucosa y se resintetiza en el cuerpo, para su uso como reserva y fuente de energía. La glucogenólisis es estimulada por numerosas hormonas y neurotransmisores, entre ellos la adrenalina .
- Premio Nobel de Fisiología o Medicina de 1970 a Julius Axelrod , Bernard Katz y Ulf von Euler por su trabajo sobre la liberación y recaptación de neurotransmisores .
- El Premio Nobel de Fisiología o Medicina de 1971 se otorgó a Earl Sutherland por descubrir el papel clave de la adenilato ciclasa , que produce el segundo mensajero AMP cíclico . [9]
- El Premio Nobel de Fisiología o Medicina de 1988 a George H. Hitchings , Sir James Black y Gertrude Elion "por sus descubrimientos de principios importantes para el tratamiento farmacológico" dirigidos a los GPCR.
- El Premio Nobel de Fisiología o Medicina de 1992 a Edwin G. Krebs y Edmond H. Fischer por describir cómo la fosforilación reversible funciona como un interruptor para activar proteínas y regular varios procesos celulares, incluida la glucogenólisis . [11]
- El Premio Nobel de Fisiología o Medicina de 1994 se otorgó a Alfred G. Gilman y Martin Rodbell por su descubrimiento de las «proteínas G y el papel de estas proteínas en la transducción de señales en las células». [12]
- El Premio Nobel de Fisiología o Medicina de 2000 fue otorgado a Eric Kandel , Arvid Carlsson y Paul Greengard , por sus investigaciones sobre neurotransmisores como la dopamina , que actúa a través de GPCR.
- El Premio Nobel de Fisiología o Medicina de 2004 se otorgó a Richard Axel y Linda B. Buck por su trabajo sobre los receptores olfativos acoplados a la proteína G. [ 13]
- El Premio Nobel de Química de 2012 a Brian Kobilka y Robert Lefkowitz por su trabajo sobre la función GPCR. [14]
Función
Las proteínas G son moléculas transductoras de señales importantes en las células. "El mal funcionamiento de las vías de señalización de GPCR [G Protein-Coupled Receptor] está involucrado en muchas enfermedades, como diabetes , ceguera, alergias, depresión, defectos cardiovasculares y ciertas formas de cáncer . Se estima que alrededor del 30% de los objetivos celulares de los medicamentos modernos son GPCR". [15] El genoma humano codifica aproximadamente 800 [16] receptores acoplados a proteína G , que detectan fotones de luz, hormonas, factores de crecimiento, medicamentos y otros ligandos endógenos . Aproximadamente 150 de los GPCR encontrados en el genoma humano aún tienen funciones desconocidas.
Mientras que las proteínas G son activadas por receptores acoplados a proteínas G , son inactivadas por proteínas RGS (por "Regulador de la señalización de la proteína G"). Los receptores estimulan la unión de GTP (activando la proteína G). Las proteínas RGS estimulan la hidrólisis de GTP (creando GDP, desactivando así la proteína G).
Diversidad
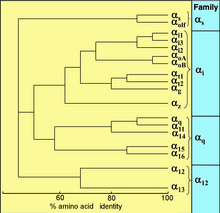
Todos los eucariotas utilizan proteínas G para la señalización y han desarrollado una gran diversidad de proteínas G. Por ejemplo, los humanos codifican 18 proteínas G α diferentes , 5 proteínas G β y 12 proteínas G γ . [17]
Señalización
La proteína G puede referirse a dos familias distintas de proteínas. Las proteínas G heterotriméricas , a veces denominadas proteínas G "grandes", son activadas por receptores acoplados a proteínas G y están formadas por subunidades alfa (α), beta (β) y gamma (γ) . Las proteínas G "pequeñas" (20-25 kDa) pertenecen a la superfamilia Ras de GTPasas pequeñas . Estas proteínas son homólogas a la subunidad alfa (α) que se encuentra en los heterotrímeros, pero de hecho son monoméricas, constan de una sola unidad. Sin embargo, al igual que sus parientes más grandes, también se unen a GTP y GDP y están involucradas en la transducción de señales .
Heterotrimérico
Los distintos tipos de proteínas G heterotriméricas comparten un mecanismo común. Se activan en respuesta a un cambio conformacional en el GPCR, intercambiando GDP por GTP y disociándose para activar otras proteínas en una vía de transducción de señales particular . [18] Sin embargo, los mecanismos específicos difieren entre los tipos de proteínas.
Mecanismo

Las proteínas G activadas por receptores están unidas a la superficie interna de la membrana celular . Consisten en las subunidades G α y G βγ estrechamente asociadas . Hay cuatro familias principales de subunidades G α : Gα s (G estimuladora), Gα i (G inhibidora), Gα q/11 y Gα 12/13 . [20] [21] Se comportan de manera diferente en el reconocimiento de la molécula efectora, pero comparten un mecanismo de activación similar.
Activación
Cuando un ligando activa el receptor acoplado a proteína G , induce un cambio conformacional en el receptor que le permite funcionar como un factor de intercambio de nucleótidos de guanina (GEF) que intercambia GDP por GTP. El GTP (o GDP) está unido a la subunidad G α en la visión tradicional de la activación del GPCR heterotrimérico. Este intercambio desencadena la disociación de la subunidad G α (que está unida a GTP) del dímero G βγ y del receptor en su conjunto. Sin embargo, los modelos que sugieren reordenamiento molecular, reorganización y precomplejación de moléculas efectoras están empezando a ser aceptados. [4] [22] [23] Tanto G α -GTP como G βγ pueden activar diferentes cascadas de señalización (o vías de segundo mensajero ) y proteínas efectoras, mientras que el receptor puede activar la siguiente proteína G. [24]
Terminación
La subunidad G α eventualmente hidrolizará el GTP unido a GDP por su actividad enzimática inherente , lo que le permitirá volver a asociarse con G βγ y comenzar un nuevo ciclo. Un grupo de proteínas llamadas Reguladores de la señalización de la proteína G (RGS), actúan como proteínas activadoras de GTPasa (GAP), son específicas para las subunidades G α . Estas proteínas aceleran la hidrólisis de GTP a GDP, terminando así la señal transducida. En algunos casos, el propio efector puede poseer actividad GAP intrínseca, que luego puede ayudar a desactivar la vía. Esto es cierto en el caso de la fosfolipasa C -beta, que posee actividad GAP dentro de su región C-terminal . Esta es una forma alternativa de regulación para la subunidad G α . Tales GAP G α no tienen residuos catalíticos (secuencias de aminoácidos específicas) para activar la proteína G α . En cambio, funcionan reduciendo la energía de activación requerida para que se lleve a cabo la reacción. [25]
Mecanismos específicos
GRAMOalfa
La G αs activa la vía dependiente del AMPc al estimular la producción de AMP cíclico (AMPc) a partir de ATP . Esto se logra mediante la estimulación directa de la enzima asociada a la membrana adenilato ciclasa . El AMPc puede entonces actuar como un segundo mensajero que interactúa con la proteína quinasa A (PKA) y la activa. La PKA puede fosforilar una gran cantidad de dianas posteriores.
La vía dependiente de AMPc se utiliza como vía de transducción de señales para muchas hormonas, entre ellas:
- ADH – Promueve la retención de agua por los riñones (creada por las células neurosecretoras magnocelulares de la hipófisis posterior )
- GHRH – Estimula la síntesis y liberación de GH ( células somatotrópicas de la hipófisis anterior )
- GHIH – Inhibe la síntesis y liberación de GH (células somatotrópicas de la hipófisis anterior)
- CRH – Estimula la síntesis y liberación de ACTH (hipófisis anterior)
- ACTH – Estimula la síntesis y liberación de cortisol ( zona fasciculada de la corteza suprarrenal en las glándulas suprarrenales)
- TSH – Estimula la síntesis y liberación de la mayoría de T4 (glándula tiroides)
- LH – Estimula la maduración folicular y la ovulación en las mujeres; o la producción de testosterona y la espermatogénesis en los hombres.
- FSH – Estimula el desarrollo folicular en las mujeres; o la espermatogénesis en los hombres
- PTH : aumenta los niveles de calcio en sangre . Esto se logra a través del receptor de la hormona paratiroidea 1 (PTH1) en los riñones y los huesos, o a través del receptor de la hormona paratiroidea 2 (PTH2) en el sistema nervioso central y el cerebro, así como en los huesos y los riñones.
- Calcitonina : disminuye los niveles de calcio en sangre (a través del receptor de calcitonina en los intestinos, los huesos, los riñones y el cerebro)
- Glucagón : estimula la descomposición del glucógeno en el hígado.
- hCG – Promueve la diferenciación celular y está potencialmente involucrada en la apoptosis . [26]
- Epinefrina : liberada por la médula suprarrenal durante el estado de ayuno, cuando el cuerpo se encuentra bajo presión metabólica. Estimula la glucogenólisis , además de las acciones del glucagón .
GRAMOalfa
G αi inhibe la producción de AMPc a partir de ATP, por ejemplo, somatostatina, prostaglandinas.
GRAMOαq/11
La G αq/11 estimula la fosfolipasa C beta unida a la membrana, que luego escinde el fosfatidilinositol 4,5-bisfosfato (PIP 2 ) en dos segundos mensajeros, el trifosfato de inositol (IP 3 ) y el diacilglicerol (DAG). El IP 3 induce la liberación de calcio del retículo endoplásmico . El DAG activa la proteína quinasa C . La vía dependiente de fosfolípidos de inositol se utiliza como vía de transducción de señales para muchas hormonas, entre ellas:
- Epinefrina
- ADH ( vasopresina /AVP): induce la síntesis y liberación de glucocorticoides ( zona fasciculada de la corteza suprarrenal ); induce vasoconstricción (células V1 de la hipófisis posterior )
- TRH – Induce la síntesis y liberación de TSH ( Glándula pituitaria anterior )
- TSH – Induce la síntesis y liberación de una pequeña cantidad de T4 ( Glándula Tiroides )
- Angiotensina II : induce la síntesis y liberación de aldosterona ( zona glomerulosa de la corteza suprarrenal en el riñón)
- GnRH – Induce la síntesis y liberación de FSH y LH (hipófisis anterior)
GRAMOα12/13
- Las G α12/13 están implicadas en la señalización de las GTPasas de la familia Rho (véase Familia Rho de GTPasas ). Esto se produce a través de la superfamilia RhoGEF, que involucra el dominio RhoGEF de las estructuras de las proteínas. Estas están implicadas en el control de la remodelación del citoesqueleto celular y, por lo tanto, en la regulación de la migración celular.
GRAMOβ, Solgamma
- Los complejos G βγ a veces también tienen funciones activas. Algunos ejemplos incluyen el acoplamiento y la activación de canales de potasio rectificadores internos acoplados a proteína G.
GTPasas pequeñas
Las GTPasas pequeñas, también conocidas como proteínas G pequeñas, se unen a GTP y GDP de la misma manera, y están involucradas en la transducción de señales . Estas proteínas son homólogas a la subunidad alfa (α) que se encuentra en los heterotrímeros, pero existen como monómeros. Son proteínas pequeñas (de 20 kDa a 25 kDa) que se unen al trifosfato de guanosina ( GTP ). Esta familia de proteínas es homóloga a las GTPasas Ras y también se denomina GTPasas de la superfamilia Ras .
Lipidación
Para asociarse con la capa interna de la membrana plasmática, muchas proteínas G y GTPasas pequeñas se lipidan [ cita requerida ] , es decir, se modifican covalentemente con extensiones lipídicas. Pueden ser miristoiladas , palmitoiladas o preniladas .
Referencias
- ^ Hurowitz EH, Melnyk JM, Chen YJ, Kouros-Mehr H, Simon MI, Shizuya H (abril de 2000). "Caracterización genómica de los genes de las subunidades alfa, beta y gamma de la proteína G heterotrimérica humana". DNA Research . 7 (2): 111–20. doi : 10.1093/dnares/7.2.111 . PMID 10819326.
- ^ Clapham DE, Neer EJ (1997). "Subunidades beta gamma de la proteína G". Revisión anual de farmacología y toxicología . 37 : 167–203. doi :10.1146/annurev.pharmtox.37.1.167. PMID 9131251.
- ^ "Siete receptores transmembrana: Robert Lefkowitz". 9 de septiembre de 2012. Consultado el 11 de julio de 2016 .
- ^ ab Qin K, Dong C, Wu G, Lambert NA (agosto de 2011). "Preensamblaje en estado inactivo de receptores acoplados a G(q) y heterotrímeros G(q)". Nature Chemical Biology . 7 (10): 740–7. doi :10.1038/nchembio.642. PMC 3177959 . PMID 21873996.
- ^ Tolkovsky AM, Levitzki A (1978). "Modo de acoplamiento entre el receptor beta-adrenérgico y la adenilato ciclasa en eritrocitos de pavo". Bioquímica . 17 (18): 3795–3810. doi :10.1021/bi00611a020. PMID 212105.
- ^ Boltz HH, Sirbu A, Stelzer N, de Lanerolle P, Winkelmann S, Annibale P (2022). "El impacto de la difusión de proteínas de membrana en la señalización de GPCR". Cells . 11 (10): 1660. doi : 10.3390/cells11101660 . PMC 9139411 . PMID 35626696.
- ^ Reece J, CN (2002). Biología . San Francisco: Benjamin Cummings. ISBN 0-8053-6624-5.
- ^ Neves SR, Ram PT, Iyengar R (mayo de 2002). "Vías de la proteína G". Science . 296 (5573): 1636–9. Bibcode :2002Sci...296.1636N. doi :10.1126/science.1071550. PMID 12040175. S2CID 20136388.
- ^ ab El Premio Nobel de Fisiología o Medicina 1994, Conferencia Ilustrada.
- ^ Nota de prensa: La Asamblea Nobel del Instituto Karolinska decidió otorgar el Premio Nobel de Fisiología o Medicina de 1994 de manera conjunta a Alfred G. Gilman y Martin Rodbell por su descubrimiento de las "proteínas G y el papel de estas proteínas en la transducción de señales en las células". 10 de octubre de 1994
- ^ "Comunicado de prensa del Premio Nobel de Fisiología o Medicina 1992". Asamblea Nobel en el Instituto Karolinska . Consultado el 21 de agosto de 2013 .
- ^ Nota de prensa
- ^ "Comunicado de prensa: Premio Nobel de Fisiología o Medicina 2004". Nobelprize.org . Consultado el 8 de noviembre de 2012 .
- ^ Real Academia Sueca de Ciencias (10 de octubre de 2012). «El Premio Nobel de Química 2012 Robert J. Lefkowitz, Brian K. Kobilka» . Consultado el 10 de octubre de 2012 .
- ^ Bosch DE, Siderovski DP (marzo de 2013). "Señalización de la proteína G en el parásito Entamoeba histolytica". Medicina experimental y molecular . 45 (1038): e15. doi :10.1038/emm.2013.30. PMC 3641396. PMID 23519208 .
- ^ Baltoumas FA, Theodoropoulou MC, Hamodrakas SJ (junio de 2013). "Interacciones de las subunidades α de las proteínas G heterotriméricas con GPCR, efectores y proteínas RGS: una revisión crítica y análisis de superficies interactuantes, cambios conformacionales, diversidad estructural y potenciales electrostáticos". Journal of Structural Biology . 182 (3): 209–18. doi :10.1016/j.jsb.2013.03.004. PMID 23523730.
- ^ ab Syrovatkina V, Alegre KO, Dey R, Huang XY (septiembre de 2016). "Regulación, señalización y funciones fisiológicas de las proteínas G". Revista de biología molecular . 428 (19): 3850–68. doi :10.1016/j.jmb.2016.08.002. PMC 5023507 . PMID 27515397.
- ^ Lim, Wendell (2015). Señalización celular: principios y mecanismos. Bruce Mayer, T. Pawson. Nueva York. ISBN 978-0-8153-4244-1.OCLC 868641565 .
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ) - ^ Stewart, Adele; Fisher, Rory A. (2015). Progreso en biología molecular y ciencia traslacional . Vol. 133. Elsevier. págs. 1–11. doi :10.1016/bs.pmbts.2015.03.002. ISBN . 9780128029381. Número de identificación personal 26123299.
- ^ Syrovatkina, Viktoriya; Alegre, Kamela O.; Dey, Raja; Huang, Xin-Yun (25 de septiembre de 2016). "Regulación, señalización y funciones fisiológicas de las proteínas G". Revista de biología molecular . 428 (19): 3850–3868. doi :10.1016/j.jmb.2016.08.002. ISSN 0022-2836. PMC 5023507 . PMID 27515397.
- ^ "InterPro". www.ebi.ac.uk . Consultado el 25 de mayo de 2023 .
- ^ Digby GJ, Lober RM, Sethi PR, Lambert NA (noviembre de 2006). "Algunos heterotrímeros de proteína G se disocian físicamente en células vivas". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 103 (47): 17789–94. Bibcode :2006PNAS..10317789D. doi : 10.1073/pnas.0607116103 . PMC 1693825 . PMID 17095603.
- ^ Khafizov K, Lattanzi G, Carloni P (junio de 2009). "Formas activas e inactivas de la proteína G investigadas mediante métodos de simulación". Proteins . 75 (4): 919–30. doi :10.1002/prot.22303. PMID 19089952. S2CID 23909821.
- ^ Yuen JW, Poon LS, Chan AS, Yu FW, Lo RK, Wong YH (junio de 2010). "Activación de STAT3 por subunidades específicas de Galpha y múltiples dímeros de Gbetagamma". Revista internacional de bioquímica y biología celular . 42 (6): 1052–9. doi :10.1016/j.biocel.2010.03.017. PMID 20348012.
- ^ Sprang SR, Chen Z, Du X (2007). "Base estructural de la regulación efectora y terminación de señales en proteínas Gα heterotriméricas". Base estructural de la regulación efectora y terminación de señales en proteínas Galpha heterotriméricas . Avances en química de proteínas. Vol. 74. págs. 1–65. doi :10.1016/S0065-3233(07)74001-9. ISBN 978-0-12-034288-4. Número de identificación personal 17854654.
- ^ Cole LA (agosto de 2010). "Funciones biológicas de la hCG y las moléculas relacionadas con la hCG". Biología reproductiva y endocrinología . 8 (1): 102. doi : 10.1186/1477-7827-8-102 . PMC 2936313 . PMID 20735820.
Enlaces externos
- Proteínas de unión a GTP en los encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.

