Beta amiloide
| Péptido beta amiloide (beta-APP) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
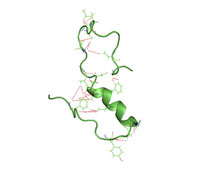 Una estructura parcialmente plegada de beta amiloide (1 40) en un ambiente acuoso (pdb 2lfm) [1] | |||||||||
| Identificadores | |||||||||
| Símbolo | APLICACIÓN | ||||||||
| Pfam | PF03494 | ||||||||
| Interprofesional | IPR013803 | ||||||||
| SCOP2 | 2lfm / ALCANCE / SUPFAM | ||||||||
| Base de datos de datos termodinámica | 1.C.50 | ||||||||
| Superfamilia OPM | 304 | ||||||||
| Proteína OPM | 2 años y 3 mil | ||||||||
| Membranoma | 45 | ||||||||
| |||||||||
| Proteína precursora de beta amiloide (A4) (peptidasa nexina-II, enfermedad de Alzheimer) | |||||||
|---|---|---|---|---|---|---|---|
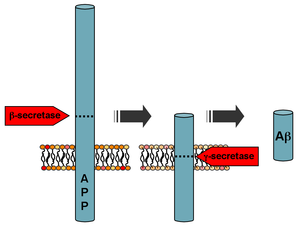 Procesamiento de la proteína precursora amiloide | |||||||
| Identificadores | |||||||
| Símbolo | APLICACIÓN | ||||||
| Símbolos alternativos | AD1 | ||||||
| Gen NCBI | 351 | ||||||
| HGNC | 620 | ||||||
| OMI | 104760 | ||||||
| Secuencia de referencia | Número de modelo_000484 | ||||||
| Protección unificada | P05067 | ||||||
| Otros datos | |||||||
| Lugar | Crónica 21 q21.2 | ||||||
| |||||||
La beta amiloide ( Aβ o Abeta ) denota péptidos de 36 a 43 aminoácidos que son el componente principal de las placas amiloides que se encuentran en los cerebros de las personas con enfermedad de Alzheimer . [2] Los péptidos derivan de la proteína precursora beta amiloide (APP), que es escindida por la beta secretasa y la gamma secretasa para producir Aβ en un proceso dependiente del colesterol y la presentación del sustrato . [3] Tanto las neuronas como los oligodendrocitos producen y liberan Aβ en el cerebro, lo que contribuye a la formación de placas amiloides. [4] Las moléculas de Aβ pueden agregarse para formar oligómeros solubles flexibles que pueden existir en varias formas. Ahora se cree que ciertos oligómeros mal plegados (conocidos como "semillas") pueden inducir a otras moléculas de Aβ a adoptar también la forma oligomérica mal plegada, lo que lleva a una reacción en cadena similar a una infección priónica . Los oligómeros son tóxicos para las células nerviosas . [5] La otra proteína implicada en la enfermedad de Alzheimer, la proteína tau , también forma oligómeros mal plegados similares a priones, y hay cierta evidencia de que el Aβ mal plegado puede inducir el mal pliegue de la tau. [6] [7]
Un estudio ha sugerido que la APP y su potencial amiloide tienen orígenes antiguos, que se remontan a los primeros deuteróstomos . [8]
Función normal
La función normal de Aβ aún no se conoce. [9] Aunque algunos estudios en animales han demostrado que la ausencia de Aβ no conduce a ninguna pérdida obvia de la función fisiológica, [10] [11] se han descubierto varias actividades potenciales para Aβ, incluida la activación de enzimas quinasas , [12] [13] protección contra el estrés oxidativo , [14] [15] regulación del transporte de colesterol , [16] [17] funcionamiento como factor de transcripción , [18] [19] y actividad antimicrobiana (potencialmente asociada con la actividad proinflamatoria de Aβ ) . [20] [21] [22]
El sistema glinfático elimina los desechos metabólicos del cerebro de los mamíferos, y en particular la beta amiloide. [23] Estudios genéticos y bioquímicos han implicado a varias proteasas como responsables del reconocimiento y la degradación de la beta amiloide; estas incluyen la enzima que degrada la insulina [24] y la proteasa de presecuencia. [25] La tasa de eliminación aumenta significativamente durante el sueño. [26] Sin embargo, se desconoce la importancia del sistema glinfático en la eliminación de Aβ en la enfermedad de Alzheimer. [27]
Asociaciones de enfermedades
Aβ es el componente principal de las placas amiloides , depósitos extracelulares que se encuentran en los cerebros de las personas con enfermedad de Alzheimer. [28] Aβ también puede formar los depósitos que recubren los vasos sanguíneos cerebrales en la angiopatía amiloide cerebral . Las placas están compuestas por una maraña de oligómeros Aβ [29] y agregados ordenados regularmente llamados fibrillas amiloides , [30] un pliegue proteico compartido por otros péptidos como los priones asociados con la enfermedad de mal plegamiento de proteínas, también conocida como proteinopatía .
Enfermedad de Alzheimer
Las investigaciones sugieren que las formas oligoméricas solubles de la beta amiloide pueden ser agentes causales en el desarrollo de la enfermedad de Alzheimer . [31] En general, se cree que los oligómeros de Aβ son los más tóxicos. [32] Varios estudios genéticos, de biología celular, bioquímicos y animales que utilizan modelos experimentales respaldan el concepto de que Aβ juega un papel central en el desarrollo de la patología de la enfermedad de Alzheimer. [33] [34]
El Aβ cerebral está elevado en personas con enfermedad de Alzheimer esporádica. El Aβ es el principal componente del amiloide parenquimatoso y vascular cerebral; contribuye a las lesiones cerebrovasculares y es neurotóxico. [33] [34] [35] No se ha resuelto cómo el Aβ se acumula en el sistema nervioso central y posteriormente inicia la enfermedad de las células. Se han centrado importantes esfuerzos en los mecanismos responsables de la producción de Aβ, incluidas las enzimas proteolíticas gamma- y β-secretasas que generan Aβ a partir de su proteína precursora, APP (proteína precursora amiloide). [36] [37] El Aβ circula en el plasma, el líquido cefalorraquídeo (LCR) y el líquido intersticial cerebral (ISF) principalmente como Aβ40 soluble. [33] [38] Las placas amiloide contienen tanto Aβ40 como Aβ42, [39] mientras que el amiloide vascular es predominantemente el Aβ40 más corto. Se encontraron varias secuencias de Aβ en ambas lesiones. [40] [41]
El aumento de los niveles totales de Aβ o de la concentración relativa tanto de Aβ40 como de Aβ42 (donde el primero está más concentrado en las placas cerebrovasculares y el segundo en las placas neuríticas ) [42] se ha relacionado con la patogénesis de la enfermedad de Alzheimer tanto familiar como esporádica. Debido a su naturaleza más hidrofóbica, el Aβ42 es la forma más amiloidogénica del péptido. Sin embargo, se sabe que la secuencia central KLVFFAE forma amiloide por sí sola y probablemente forma el núcleo de la fibrilla. [ cita requerida ] Un estudio correlacionó además los niveles de Aβ42 en el cerebro no solo con la aparición de la enfermedad de Alzheimer, sino también con la reducción de la presión del líquido cefalorraquídeo, lo que sugiere que una acumulación o incapacidad para eliminar fragmentos de Aβ42 puede desempeñar un papel en la patología. [ 43 ]
La " hipótesis amiloide ", según la cual las placas son las responsables de la patología de la enfermedad de Alzheimer, es aceptada por la mayoría de los investigadores, pero no está establecida de manera concluyente. Una hipótesis alternativa es que los oligómeros amiloideos , y no las placas, son los responsables de la enfermedad. [32] [44]
Cáncer
Aunque se ha implicado al Aβ en el desarrollo del cáncer , lo que ha motivado estudios sobre una variedad de cánceres para dilucidar la naturaleza de sus posibles efectos, los resultados son en gran medida no concluyentes. Se han evaluado los niveles de Aβ en relación con una serie de cánceres, incluidos el de esófago , colorrectal , pulmón y hígado , en respuesta a las reducciones observadas en el riesgo de desarrollar la enfermedad de Alzheimer en los sobrevivientes de estos cánceres. Se demostró que todos los cánceres estaban asociados positivamente con mayores niveles de Aβ, particularmente los cánceres hepáticos. [45] Sin embargo, esta dirección de asociación aún no se ha establecido. Los estudios centrados en líneas celulares de cáncer de mama humano han demostrado además que estas células cancerosas muestran un mayor nivel de expresión de la proteína precursora amiloide. [46]
Síndrome de Down
Los adultos con síndrome de Down presentaron acumulación de amiloide asociada con evidencia de enfermedad de Alzheimer, incluyendo deterioro en el funcionamiento cognitivo, la memoria, los movimientos motores finos, el funcionamiento ejecutivo y las habilidades visoespaciales. [47]
Formación
La Aβ se forma después de la escisión secuencial de la proteína precursora amiloide (APP), una glicoproteína transmembrana de función indeterminada. La APP puede ser escindida por las enzimas proteolíticas α- , β- y γ-secretasa ; la proteína Aβ se genera por la acción sucesiva de las secretasas β y γ. La γ secretasa, que produce el extremo C-terminal del péptido Aβ, escinde dentro de la región transmembrana de la APP y puede generar varias isoformas de 30 a 51 residuos de aminoácidos de longitud. [48] Las isoformas más comunes son Aβ 40 y Aβ 42 ; la forma más larga se produce típicamente por escisión que ocurre en el retículo endoplásmico , mientras que la forma más corta se produce por escisión en la red trans- Golgi . [49]
Genética
Las mutaciones autosómicas dominantes en la APP causan la enfermedad de Alzheimer hereditaria de aparición temprana (EA familiar, fAD). Esta forma de EA representa no más del 10% de todos los casos, y la gran mayoría de la EA no está acompañada por tales mutaciones. [50] Sin embargo, es probable que la enfermedad de Alzheimer familiar sea resultado de un procesamiento proteolítico alterado . Esto se evidencia por el hecho de que muchas mutaciones que conducen a fAD ocurren cerca de los sitios de escisión de la γ-secretasa en la APP. [51] Una de las mutaciones más comunes que causan fAD, la mutación de London , ocurre en el codón 717 del gen APP, [52] [53] y da como resultado una sustitución del aminoácido valina por isoleucina. El análisis histoquímico de la mutación V717I de la APP ha revelado una patología extensa de Aβ en todo el neuroeje, así como una angiopatía amiloide cerebral generalizada (CAA). [54]
El gen de la proteína precursora amiloide se encuentra en el cromosoma 21 y, en consecuencia, las personas con síndrome de Down tienen una incidencia muy alta de enfermedad de Alzheimer. [55]
Estructura y toxicidad
Se piensa comúnmente que la beta amiloide es intrínsecamente no estructurada , lo que significa que en solución no adquiere un pliegue terciario único sino que puebla un conjunto de estructuras. Como tal, no se puede cristalizar y la mayor parte del conocimiento estructural sobre la beta amiloide proviene de la RMN y la dinámica molecular . Los primeros modelos derivados de RMN de un polipéptido de 26 aminoácidos de beta amiloide (Aβ 10–35) muestran una estructura de espiral colapsada desprovista de contenido significativo de estructura secundaria . [56] Sin embargo, la estructura de RMN más reciente (2012) de (Aβ 1-40) tiene una estructura secundaria y terciaria significativa. [1] Los estudios de dinámica molecular de intercambio de réplicas sugirieron que la beta amiloide puede de hecho poblar múltiples estados estructurales discretos; [57] estudios más recientes identificaron una multiplicidad de grupos conformacionales discretos mediante análisis estadístico. [58] Mediante simulaciones guiadas por RMN, el amiloide beta 1-40 y el amiloide beta 1-42 también parecen presentar estados conformacionales muy diferentes, [59] siendo el extremo C del amiloide beta 1-42 más estructurado que el del fragmento 1-40.
Las condiciones de baja temperatura y baja salinidad permitieron aislar oligómeros pentaméricos en forma de disco desprovistos de estructura beta. [60] Por el contrario, los oligómeros solubles preparados en presencia de detergentes parecen presentar un contenido sustancial de láminas beta con un carácter mixto paralelo y antiparalelo, diferente de las fibrillas; [61] Los estudios computacionales sugieren un motivo beta-giro-beta antiparalelo en cambio para los oligómeros incrustados en la membrana. [62]
Investigación en inmunoterapia
La inmunoterapia puede estimular el sistema inmunológico del huésped para que reconozca y ataque al Aβ, o proporcionar anticuerpos que eviten la deposición de placa o mejoren la eliminación de placas u oligómeros de Aβ. La oligomerización es un proceso químico que convierte moléculas individuales en una cadena que consta de un número finito de moléculas. La prevención de la oligomerización de Aβ se ha ejemplificado mediante la inmunización activa o pasiva con Aβ. En este proceso, se utilizan anticuerpos contra Aβ para disminuir los niveles de placa cerebral. Esto se logra promoviendo la eliminación microglial y/o redistribuyendo el péptido desde el cerebro a la circulación sistémica. Los anticuerpos que se dirigen al Aβ y que se probaron en ensayos clínicos incluyeron aducanumab , bapineuzumab , crenezumab , gantenerumab , lecanemab y solanezumab . [63] [64]
Medición de beta amiloide
Los compuestos de imagen, en particular el compuesto B de Pittsburgh (6-OH-BTA-1, una tioflavina ), pueden unirse selectivamente a la beta amiloide in vitro e in vivo. Esta técnica, combinada con la tomografía por emisión de positrones , se utiliza para obtener imágenes de áreas con depósitos de placa en personas con Alzheimer. [65]
Autopsias post mortem o en biopsias de tejido
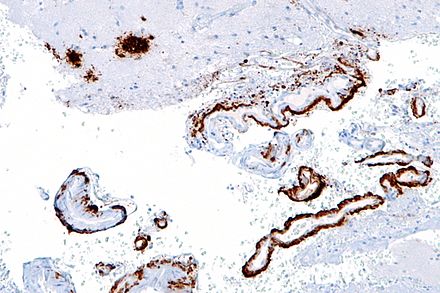
La beta amiloide se puede medir de forma semicuantitativa mediante inmunotinción , que también permite determinar su ubicación. La beta amiloide puede ser principalmente vascular, como en la angiopatía amiloide cerebral , o en las placas amiloides de la sustancia blanca . [66]
Un método sensible es el ELISA , que es un ensayo inmunoabsorbente que utiliza un par de anticuerpos que reconocen la beta amiloide. [67] [68]
La microscopía de fuerza atómica , que puede visualizar superficies moleculares a escala nanométrica, se puede utilizar para determinar el estado de agregación de la beta amiloide in vitro. [69]
La microespectroscopia vibracional es un método sin etiquetas que mide la vibración de las moléculas en muestras de tejido. [70] Las proteínas amiloides como Aβ se pueden detectar con esta técnica debido a su alto contenido de estructuras de láminas β. [71] Recientemente, se resolvió la formación de fibrillas de Aβ en diferentes tipos de placa en la enfermedad de Alzheimer , lo que indica que las placas transitan diferentes etapas en su desarrollo. [29]
La interferometría de polarización dual es una técnica óptica que puede medir las primeras etapas de agregación midiendo el tamaño molecular y las densidades a medida que las fibrillas se alargan. [72] [73] Estos procesos de agregación también se pueden estudiar en construcciones de bicapa lipídica. [74]
Véase también
- TPM21
- Sylvain Lesné – Aβ*56
Referencias
- ^ ab Vivekanandan S, Brender JR, Lee SY, Ramamoorthy A (julio de 2011). "Una estructura parcialmente plegada de amiloide-beta(1-40) en un entorno acuoso". Comunicaciones de investigación bioquímica y biofísica . 411 (2): 312–316. doi :10.1016/j.bbrc.2011.06.133. PMC 3148408. PMID 21726530 .
- ^ Hamley IW (octubre de 2012). "El péptido beta amiloide: la perspectiva de un químico. Función en el Alzheimer y la fibrilación" (PDF) . Chemical Reviews . 112 (10): 5147–5192. doi :10.1021/cr3000994. PMID 22813427.
- ^ Wang H, Kulas JA, Wang C, Holtzman DM, Ferris HA, Hansen SB (agosto de 2021). "Regulación de la producción de beta-amiloide en neuronas por colesterol derivado de astrocitos". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 118 (33): e2102191118. Bibcode :2021PNAS..11802191W. doi : 10.1073/pnas.2102191118 . PMC 8379952 . PMID 34385305.
- ^ Rajani RM, Ellingford R, Hellmuth M, Harris SS, Taso OS, Graykowski D, et al. (julio de 2024). "La supresión selectiva de la beta amiloide derivada de oligodendrocitos rescata la disfunción neuronal en la enfermedad de Alzheimer". PLOS Biology . 22 (7): e3002727. doi : 10.1371/journal.pbio.3002727 . PMC 11265669 . PMID 39042667.
- ^ Haass C, Selkoe DJ (febrero de 2007). "Oligómeros proteicos solubles en la neurodegeneración: lecciones del péptido beta amiloide del Alzheimer". Nature Reviews. Molecular Cell Biology . 8 (2): 101–112. doi :10.1038/nrm2101. PMID 17245412. S2CID 32991755.
- ^ Nussbaum JM, Seward ME, Bloom GS (enero-febrero de 2013). "Enfermedad de Alzheimer: una historia de dos priones". Prion . 7 (1): 14–19. doi :10.4161/pri.22118. PMC 3609044 . PMID 22965142.
- ^ Pulawski W, Ghoshdastider U, Andrisano V, Filipek S (abril de 2012). "Amiloides ubicuos". Applied Biochemistry and Biotechnology . 166 (7): 1626–1643. doi :10.1007/s12010-012-9549-3. PMC 3324686 . PMID 22350870.
- ^ Tharp WG, Sarkar IN (abril de 2013). "Orígenes de la amiloide-β". BMC Genomics . 14 (1): 290. doi : 10.1186/1471-2164-14-290 . PMC 3660159 . PMID 23627794.
- ^ Hiltunen M, van Groen T, Jolkkonen J (2009). "Funciones del precursor de la proteína beta amiloide y de los péptidos beta amiloide: evidencia de estudios experimentales". Journal of Alzheimer's Disease . 18 (2): 401–412. doi :10.3233/JAD-2009-1154. PMID 19584429.
- ^ Sadigh-Eteghad S, Talebi M, Farhoudi M, EJ Golzari S, Sabermarouf B, Mahmoudi J (2014). "El beta-amiloide exhibe efectos antagónicos sobre los receptores nicotínicos de acetilcolina alfa 7 de manera orquestada". Revista de hipótesis e ideas médicas . 8 (2): 48–52. doi : 10.1016/j.jmhi.2014.01.001 .
- ^ Luo Y, Bolon B, Damore MA, Fitzpatrick D, Liu H, Zhang J, et al. (octubre de 2003). "Los ratones knock-out de BACE1 (beta-secretasa) no adquieren cambios compensatorios en la expresión génica ni desarrollan lesiones neuronales con el tiempo". Neurobiología de la enfermedad . 14 (1): 81–88. doi :10.1016/S0969-9961(03)00104-9. PMID 13678669. S2CID 8367440.
- ^ Bogoyevitch MA, Boehm I, Oakley A, Ketterman AJ, Barr RK (marzo de 2004). "Inhibición de la cascada JNK MAPK: ciencia básica y potencial terapéutico". Biochimica et Biophysica Acta (BBA) - Proteínas y proteómica . 1697 (1–2): 89–101. doi :10.1016/j.bbapap.2003.11.016. PMID 15023353.
- ^ Tabaton M, Zhu X, Perry G, Smith MA, Giliberto L (enero de 2010). "Efecto de señalización de amiloide-beta(42) en el procesamiento de AbetaPP". Neurología experimental . 221 (1): 18–25. doi :10.1016/j.expneurol.2009.09.002. PMC 2812589 . PMID 19747481.
- ^ Zou K, Gong JS, Yanagisawa K, Michikawa M (junio de 2002). "Una nueva función de la proteína beta amiloide monomérica que actúa como molécula antioxidante contra el daño oxidativo inducido por metales". The Journal of Neuroscience . 22 (12): 4833–4841. doi :10.1523/JNEUROSCI.22-12-04833.2002. PMC 6757724 . PMID 12077180.
- ^ Baruch-Suchodolsky R, Fischer B (mayo de 2009). "Abeta40, soluble o agregado, es un antioxidante notablemente potente en sistemas oxidativos libres de células". Bioquímica . 48 (20): 4354–4370. doi :10.1021/bi802361k. PMID 19320465.
- ^ Yao ZX, Papadopoulos V (octubre de 2002). "Función de la beta-amiloide en el transporte de colesterol: una causa de neurotoxicidad". FASEB Journal . 16 (12): 1677–1679. doi : 10.1096/fj.02-0285fje . PMID 12206998. S2CID 17813857.
- ^ Igbavboa U, Sun GY, Weisman GA, He Y, Wood WG (agosto de 2009). "La proteína beta amiloide estimula el tráfico de colesterol y caveolina-1 desde la membrana plasmática hasta el complejo de Golgi en astrocitos primarios de ratón". Neurociencia . 162 (2): 328–338. doi :10.1016/j.neuroscience.2009.04.049. PMC 3083247 . PMID 19401218.
- ^ Maloney B, Lahiri DK (noviembre de 2011). "El péptido β amiloide (Aβ) de la enfermedad de Alzheimer se une a un dominio de interacción específico con el ADN Aβ (AβID) en los promotores APP, BACE1 y APOE de una manera específica de secuencia: caracterización de un nuevo motivo regulador". Gene . 488 (1–2): 1–12. doi :10.1016/j.gene.2011.06.004. PMC 3381326 . PMID 21699964.
- ^ Bailey JA, Maloney B, Ge YW, Lahiri DK (noviembre de 2011). "Actividad funcional del nuevo dominio de interacción del péptido β amiloide (AβID) de Alzheimer en las secuencias promotoras APP y BACE1 e implicaciones en la activación de genes apoptóticos y en la amiloidogénesis". Gene . 488 (1–2): 13–22. doi :10.1016/j.gene.2011.06.017. PMC 3372404 . PMID 21708232.
- ^ Kagan BL, Jang H, Capone R, Teran Arce F, Ramachandran S, Lal R, et al. (abril de 2012). "Propiedades antimicrobianas de los péptidos amiloides". Molecular Pharmaceutics . 9 (4): 708–717. doi :10.1021/mp200419b. PMC 3297685 . PMID 22081976.
- ^ Schluesener HJ, Su Y, Ebrahimi A, Pouladsaz D (junio de 2012). "Péptidos antimicrobianos en el cerebro: neuropéptidos y amiloide". Frontiers in Bioscience . 4 (4): 1375–1380. doi :10.2741/S339. PMID 22652879.
- ^ Li H, Liu CC, Zheng H, Huang TY (2018). "Infección por amiloide, tau, patógenos y protección antimicrobiana en la enfermedad de Alzheimer: perspectivas conformistas, no conformistas y realistas para la patogénesis de la EA". Neurodegeneración Traslacional . 7 : 34. doi : 10.1186/s40035-018-0139-3 . PMC 6306008 . PMID 30603085.
- ^ Iliff JJ, Wang M, Liao Y, Plogg BA, Peng W, Gundersen GA, et al. (agosto de 2012). "Una vía paravascular facilita el flujo de LCR a través del parénquima cerebral y la depuración de solutos intersticiales, incluido el amiloide β". Science Translational Medicine . 4 (147): 147ra111. doi :10.1126/scitranslmed.3003748. PMC 3551275 . PMID 22896675.
- ^ Shen Y, Joachimiak A, Rosner MR, Tang WJ (octubre de 2006). "Las estructuras de la enzima degradante de insulina humana revelan un nuevo mecanismo de reconocimiento de sustrato". Nature . 443 (7113): 870–874. Bibcode :2006Natur.443..870S. doi :10.1038/nature05143. PMC 3366509 . PMID 17051221.
- ^ King JV, Liang WG, Scherpelz KP, Schilling AB, Meredith SC, Tang WJ (julio de 2014). "Base molecular del reconocimiento y degradación del sustrato por la proteasa de presecuencia humana". Structure . 22 (7): 996–1007. doi :10.1016/j.str.2014.05.003. PMC 4128088 . PMID 24931469.
- ^ Xie L, Kang H, Xu Q, Chen MJ, Liao Y, Thiyagarajan M, et al. (octubre de 2013). "El sueño impulsa la depuración de metabolitos del cerebro adulto". Science . 342 (6156): 373–377. Bibcode :2013Sci...342..373X. doi :10.1126/science.1241224. PMC 3880190 . PMID 24136970.
- ^ Tarasoff-Conway JM, Carare RO, Osorio RS, Glodzik L, Butler T, Fieremans E, et al. (agosto de 2015). "Sistemas de depuración en el cerebro: implicaciones para la enfermedad de Alzheimer". Nature Reviews. Neurology . 11 (8): 457–470. doi :10.1038/nrneurol.2015.119. PMC 4694579 . PMID 26195256.
- ^ Sadigh-Eteghad S, Sabermarouf B, Majdi A, Talebi M, Farhoudi M, Mahmoudi J (2014). "Amiloides beta: un factor crucial en la enfermedad de Alzheimer". Principios y práctica médica . 24 (1): 1–10. doi :10.1159/000369101. PMC 5588216 . PMID 25471398.
- ^ ab Röhr D, Boon BD, Schuler M, Kremer K, Hoozemans JJ, Bouwman FH, et al. (diciembre de 2020). "La obtención de imágenes vibracionales sin etiquetas de diferentes tipos de placa Aβ en la enfermedad de Alzheimer revela eventos secuenciales en el desarrollo de la placa". Acta Neuropathologica Communications . 8 (1): 222. doi : 10.1186/s40478-020-01091-5 . PMC 7733282 . PMID 33308303.
- ^ Parker MH, Reitz AB (2000). "Ensamblaje de agregados de β-amiloide a nivel molecular". Chemtracts-Química orgánica . 13 (1): 51–56.
- ^ Shankar GM, Li S, Mehta TH, Garcia-Munoz A, Shepardson NE, Smith I, et al. (agosto de 2008). "Los dímeros de proteína amiloide-beta aislados directamente de cerebros de pacientes con Alzheimer perjudican la plasticidad sináptica y la memoria". Nature Medicine . 14 (8): 837–842. doi :10.1038/nm1782. PMC 2772133 . PMID 18568035.
- ^ ab Zhao LN, Long HW, Mu Y, Chew LY (2012). "La toxicidad de los oligómeros de amiloide β". Revista Internacional de Ciencias Moleculares . 13 (6): 7303–7327. doi : 10.3390/ijms13067303 . PMC 3397527 . PMID 22837695.
- ^ abc Ghiso J, Frangione B (diciembre de 2002). "Amiloidosis y enfermedad de Alzheimer". Advanced Drug Delivery Reviews . 54 (12): 1539–1551. doi :10.1016/S0169-409X(02)00149-7. PMID 12453671.
- ^ ab Selkoe DJ (octubre de 2001). "Limpiando las telarañas amiloides del cerebro". Neuron . 32 (2): 177–180. doi : 10.1016/S0896-6273(01)00475-5 . PMID 11683988. S2CID 17860343.
- ^ Hardy J, Duff K, Hardy KG, Perez-Tur J, Hutton M (septiembre de 1998). "Disección genética de la enfermedad de Alzheimer y demencias relacionadas: amiloide y su relación con tau". Nature Neuroscience . 1 (5): 355–358. doi :10.1038/1565. PMID 10196523. S2CID 52807658.
- ^ Vassar R, Bennett BD, Babu-Khan S, Kahn S, Mendiaz EA, Denis P, et al. (octubre de 1999). "Escisión beta-secretasa de la proteína precursora amiloide de Alzheimer por la proteasa aspártica transmembrana BACE". Ciencia . 286 (5440): 735–741. doi : 10.1126/ciencia.286.5440.735. PMID 10531052. S2CID 42481897.
- ^ Vassar R (diciembre de 2002). "Beta-secretasa (BACE) como diana farmacológica para la enfermedad de Alzheimer". Advanced Drug Delivery Reviews . 54 (12): 1589–1602. doi :10.1016/S0169-409X(02)00157-6. PMID 12453676.
- ^ Zlokovic BV, Frangione B (2003). Hipótesis de transporte y depuración para la enfermedad de Alzheimer y posibles implicaciones terapéuticas. Landes Bioscience. págs. 114-122.
- ^ Masters CL, Simms G, Weinman NA, Multhaup G, McDonald BL, Beyreuther K (junio de 1985). "Proteína del núcleo de la placa amiloide en la enfermedad de Alzheimer y el síndrome de Down". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 82 (12): 4245–4249. Bibcode :1985PNAS...82.4245M. doi : 10.1073/pnas.82.12.4245 . PMC 397973 . PMID 3159021.
- ^ Castaño EM, Prelli F, Soto C, Beavis R, Matsubara E, Shoji M, et al. (diciembre de 1996). "La longitud de la beta amiloide en la hemorragia cerebral hereditaria con amiloidosis, tipo holandés. Implicaciones para el papel de la beta amiloide 1-42 en la enfermedad de Alzheimer". The Journal of Biological Chemistry . 271 (50): 32185–32191. doi : 10.1074/jbc.271.50.32185 . PMID 8943274.
- ^ Roher AE, Lowenson JD, Clarke S, Woods AS, Cotter RJ, Gowing E, et al. (noviembre de 1993). "El beta-amiloide-(1-42) es un componente principal de los depósitos amiloides cerebrovasculares: implicaciones para la patología de la enfermedad de Alzheimer". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 90 (22): 10836–10840. Bibcode :1993PNAS...9010836R. doi : 10.1073/pnas.90.22.10836 . PMC 47873 . PMID 8248178.
- ^ Lue LF, Kuo YM, Roher AE, Brachova L, Shen Y, Sue L, et al. (septiembre de 1999). "Concentración de péptido beta amiloide soluble como predictor del cambio sináptico en la enfermedad de Alzheimer". The American Journal of Pathology . 155 (3): 853–862. doi :10.1016/S0002-9440(10)65184-X. PMC 1866907 . PMID 10487842.
- ^ Schirinzi T, Di Lazzaro G, Sancesario GM, Colona VL, Scaricamazza E, Mercuri NB, et al. (diciembre de 2017). "Los niveles de amiloide-beta-42 y la presión del LCR están directamente relacionados en pacientes con enfermedad de Alzheimer". Journal of Neural Transmission . 124 (12): 1621–1625. doi :10.1007/s00702-017-1786-8. PMID 28866757. S2CID 22267507.
- ^ Kayed R, Head E, Thompson JL, McIntire TM, Milton SC, Cotman CW, et al. (abril de 2003). "La estructura común de los oligómeros amiloides solubles implica un mecanismo común de patogénesis". Science . 300 (5618): 486–489. Bibcode :2003Sci...300..486K. doi :10.1126/science.1079469. hdl : 2027.42/150615 . PMID 12702875. S2CID 29614957.
- ^ Jin WS, Bu XL, Liu YH, Shen LL, Zhuang ZQ, Jiao SS, et al. (febrero de 2017). "Niveles plasmáticos de amiloide beta en pacientes con diferentes tipos de cáncer". Neurotoxicity Research . 31 (2): 283–288. doi :10.1007/s12640-016-9682-9. PMID 27913965. S2CID 3795042.
- ^ Lim S, Yoo BK, Kim HS, Gilmore HL, Lee Y, Lee HP, et al. (diciembre de 2014). "La proteína precursora de amiloide-β promueve la proliferación y la motilidad celular del cáncer de mama avanzado". BMC Cancer . 14 : 928. doi : 10.1186/1471-2407-14-928 . PMC 4295427 . PMID 25491510.
- ^ Hartley SL, Handen BL, Devenny D, Mihaila I, Hardison R, Lao PJ, et al. (octubre de 2017). "Deterioro cognitivo y acumulación de amiloide-β en el cerebro a lo largo de 3 años en adultos con síndrome de Down". Neurobiología del envejecimiento . 58 : 68–76. doi :10.1016/j.neurobiolaging.2017.05.019. PMC 5581712 . PMID 28715661.
- ^ Olsson F, Schmidt S, Althoff V, Munter LM, Jin S, Rosqvist S, et al. (enero de 2014). "Caracterización de los pasos intermedios en la producción de beta amiloide (Aβ) en condiciones casi nativas". The Journal of Biological Chemistry . 289 (3): 1540–1550. doi : 10.1074/jbc.M113.498246 . PMC 3894335 . PMID 24225948.
- ^ Hartmann T, Bieger SC, Brühl B, Tienari PJ, Ida N, Allsop D, et al. (septiembre de 1997). "Sitios distintos de producción intracelular de péptidos amiloides beta40/42 de la enfermedad de Alzheimer". Nature Medicine . 3 (9): 1016–1020. doi :10.1038/nm0997-1016. PMID 9288729. S2CID 8390460.
- ^ Asociación de Alzheimer (marzo de 2008). "Datos y cifras sobre la enfermedad de Alzheimer en 2008". Alzheimer y demencia . 4 (2): 110–133. doi : 10.1016/j.jalz.2008.02.005 . PMID 18631956. S2CID 43750218.
- ^ De Jonghe C, Esselens C, Kumar-Singh S, Craessaerts K, Serneels S, Checler F, et al. (agosto de 2001). "Las mutaciones patógenas de APP cerca del sitio de escisión de la gamma-secretasa afectan de manera diferencial la secreción de Abeta y la estabilidad del fragmento C-terminal de APP". Human Molecular Genetics . 10 (16): 1665–1671. doi : 10.1093/hmg/10.16.1665 . PMID 11487570.
- ^ Chartier-Harlin MC, Crawford F, Houlden H, Warren A, Hughes D, Fidani L, et al. (octubre de 1991). "Enfermedad de Alzheimer de aparición temprana causada por mutaciones en el codón 717 del gen de la proteína precursora beta-amiloide". Nature . 353 (6347): 844–846. Bibcode :1991Natur.353..844C. doi :10.1038/353844a0. PMID 1944558. S2CID 4345311.
- ^ Lantos PL, Luthert PJ, Hanger D, Anderton BH, Mullan M , Rossor M (marzo de 1992). "La enfermedad de Alzheimer familiar con la mutación en la posición 717 de la proteína precursora amiloide y la enfermedad de Alzheimer esporádica tienen la misma patología citoesquelética". Neuroscience Letters . 137 (2): 221–224. doi :10.1016/0304-3940(92)90408-y. PMID 1584463. S2CID 25383047.
- ^ Lloyd GM, Trejo-Lopez JA, Xia Y, McFarland KN, Lincoln SJ, Ertekin-Taner N, et al. (marzo de 2020). "Patología prominente de la placa amiloide y angiopatía amiloide cerebral en portadores de APP V717I (Londres): variabilidad fenotípica en la enfermedad de Alzheimer autosómica dominante". Acta Neuropathologica Communications . 8 (1): 31. doi : 10.1186/s40478-020-0891-3 . PMC 7068954 . PMID 32164763.
- ^ Glenner GG, Wong CW (agosto de 1984). "Enfermedad de Alzheimer y síndrome de Down: compartición de una proteína fibrilar amiloide cerebrovascular única". Comunicaciones de investigación bioquímica y biofísica . 122 (3): 1131–1135. doi :10.1016/0006-291X(84)91209-9. PMID 6236805.
- ^ Zhang S, Iwata K, Lachenmann MJ, Peng JW, Li S, Stimson ER, et al. (junio de 2000). "El péptido a beta de la enfermedad de Alzheimer adopta una estructura de espiral colapsada en agua". Journal of Structural Biology . 130 (2–3): 130–141. doi :10.1006/jsbi.2000.4288. PMID 10940221.
- ^ Yang M, Teplow DB (diciembre de 2008). "Plegamiento del monómero de la proteína beta amiloide: las superficies de energía libre revelan diferencias específicas de la aloforma". Journal of Molecular Biology . 384 (2): 450–464. doi :10.1016/j.jmb.2008.09.039. PMC 2673916 . PMID 18835397.
- ^ Sgourakis NG, Merced-Serrano M, Boutsidis C, Drineas P, Du Z, Wang C, et al. (enero de 2011). "Caracterización a nivel atómico del conjunto del monómero Aβ(1-42) en agua utilizando simulaciones de dinámica molecular imparciales y algoritmos espectrales". Journal of Molecular Biology . 405 (2): 570–583. doi :10.1016/j.jmb.2010.10.015. PMC 3060569 . PMID 21056574.
- ^ Sgourakis NG, Yan Y, McCallum SA, Wang C, García AE (mayo de 2007). "Los péptidos Abeta40 y 42 de Alzheimer adoptan conformaciones distintas en el agua: un estudio combinado de MD/NMR". Revista de biología molecular . 368 (5): 1448-1457. doi :10.1016/j.jmb.2007.02.093. PMC 1978067 . PMID 17397862.
- ^ Ahmed M, Davis J, Aucoin D, Sato T, Ahuja S, Aimoto S, et al. (mayo de 2010). "Conversión estructural de oligómeros neurotóxicos de amiloide-beta(1-42) en fibrillas". Nature Structural & Molecular Biology . 17 (5): 561–567. doi :10.1038/nsmb.1799. PMC 2922021 . PMID 20383142.
- ^ Yu L, Edalji R, Harlan JE, Holzman TF, Lopez AP, Labkovsky B, et al. (marzo de 2009). "Caracterización estructural de un oligómero soluble de péptido beta amiloide". Bioquímica . 48 (9): 1870–1877. doi :10.1021/bi802046n. PMID 19216516.
- ^ Strodel B, Lee JW, Whittleston CS, Wales DJ (septiembre de 2010). "Estructuras transmembrana para oligómeros de Aβ(1-42) de Alzheimer". Revista de la Sociedad Química Americana . 132 (38): 13300–13312. doi :10.1021/ja103725c. PMID 20822103.
- ^ Cummings J, Lee G, Mortsdorf T, Ritter A, Zhong K (septiembre de 2017). "Proceso de desarrollo de fármacos para la enfermedad de Alzheimer: 2017". revisión. Alzheimer's & Dementia . 3 (3): 367–384. doi :10.1016/j.trci.2017.05.002. PMC 5651419 . PMID 29067343.
- ^ Schilling S, Rahfeld JU, Lues I, Lemere CA (mayo de 2018). "Inmunoterapia pasiva Aβ: logros actuales y perspectivas futuras". revisión. Molecules . 23 (5): 1068. doi : 10.3390/molecules23051068 . PMC 6099643 . PMID 29751505.
- ^ Heurling K, Leuzy A, Zimmer ER, Lubberink M, Nordberg A (febrero de 2016). "Obtención de imágenes de β-amiloide mediante tomografía por emisión de positrones con [(18)F]flutemetamol: de la dosimetría al diagnóstico clínico". Revista Europea de Medicina Nuclear e Imágenes Moleculares . 43 (2): 362–373. doi :10.1007/s00259-015-3208-1. PMID 26440450. S2CID 2695342.
- ^ Ito H, Shimada H, Shinotoh H, Takano H, Sasaki T, Nogami T, et al. (junio de 2014). "Análisis cuantitativo de la deposición de amiloide en la enfermedad de Alzheimer mediante PET y el radiotrazador ¹¹C-AZD2184". Journal of Nuclear Medicine . 55 (6): 932–938. doi : 10.2967/jnumed.113.133793 . PMID 24732152.
- ^ Schmidt SD, Nixon RA, Mathews PM (2012). "Procesamiento de tejidos previo al análisis de proteínas y metabolitos asociados a la enfermedad de Alzheimer, incluido Aβ". Proteínas amiloides . Métodos en biología molecular. Vol. 849. págs. 493–506. doi :10.1007/978-1-61779-551-0_33. ISBN . 978-1-61779-550-3. Número de identificación personal 22528111.
- ^ Schmidt SD, Mazzella MJ, Nixon RA, Mathews PM (2012). "Medición de Aβ mediante ensayo inmunoabsorbente ligado a enzimas". Proteínas amiloides . Métodos en biología molecular. Vol. 849. págs. 507–27. doi :10.1007/978-1-61779-551-0_34. ISBN . 978-1-61779-550-3. Número de identificación personal 22528112.
- ^ Stine WB, Dahlgren KN, Krafft GA, LaDu MJ (marzo de 2003). "Caracterización in vitro de las condiciones para la oligomerización y fibrilogénesis del péptido beta amiloide". The Journal of Biological Chemistry . 278 (13): 11612–11622. doi : 10.1074/jbc.M210207200 . PMID 12499373.
- ^ Lasch P, Kneipp J (2008). Espectroscopia vibratoria biomédica . Wiley. ISBN 978-0-470-22945-3.
- ^ Benseny-Cases N, Klementieva O, Cotte M, Ferrer I, Cladera J (diciembre de 2014). "La microespectroscopia (μFTIR) revela la co-localización de la oxidación lipídica y las placas amiloides en cerebros humanos con enfermedad de Alzheimer". Química analítica . 86 (24): 12047–12054. doi :10.1021/ac502667b. PMID 25415602.
- ^ Gengler S, Gault VA, Harriott P, Hölscher C (junio de 2007). "Los deterioros de la plasticidad sináptica del hipocampo inducidos por beta-amiloide (25-35) agregados dependen del protocolo de estimulación y del trasfondo genético". Experimental Brain Research . 179 (4): 621–630. doi :10.1007/s00221-006-0819-6. PMID 17171334. S2CID 41040399.
- ^ Rekas A, Jankova L, Thorn DC, Cappai R, Carver JA (diciembre de 2007). "Monitoreo de la prevención de la formación de fibrillas de amiloide por alfa-cristalina. Dependencia de la temperatura y naturaleza de las especies agregantes". The FEBS Journal . 274 (24): 6290–6304. doi :10.1111/j.1742-4658.2007.06144.x. PMID 18005258. S2CID 85794556.
- ^ Sanghera N, Swann MJ, Ronan G, Pinheiro TJ (octubre de 2009). "Información sobre los eventos tempranos en la agregación de la proteína priónica en las membranas lipídicas". Biochimica et Biophysica Acta (BBA) - Biomembranas . 1788 (10): 2245–2251. doi : 10.1016/j.bbamem.2009.08.005 . PMID 19703409.
Enlaces externos
- Herencia mendeliana en línea en el hombre (OMIM): 104300
