Valoración

La titulación (también conocida como titulación [1] y análisis volumétrico ) es un método común de laboratorio de análisis químico cuantitativo para determinar la concentración de un analito identificado (una sustancia a analizar). Se prepara un reactivo , denominado titulador o valorador [2] como una solución estándar de concentración y volumen conocidos . El titulador reacciona con una solución de analito (que también puede denominarse titulador [3] ) para determinar la concentración del analito. El volumen de titulador que reaccionó con el analito se denomina volumen de titulación .
Historia y etimología
La palabra «titulación» proviene del francés titrer (1543), que significa la proporción de oro o plata en monedas o en obras de oro o plata; es decir, una medida de finura o pureza. Tiltre se convirtió en titre , [4] que así pasó a significar la «finura del oro aleado», [5] y luego la «concentración de una sustancia en una muestra dada». [6] En 1828, el químico francés Joseph Louis Gay-Lussac utilizó por primera vez titre como verbo ( titrer ), que significa «determinar la concentración de una sustancia en una muestra dada». [7]
El análisis volumétrico se originó a finales del siglo XVIII en Francia. El químico francés François-Antoine-Henri Descroizilles (fr) desarrolló la primera bureta (que era similar a un cilindro graduado) en 1791. [8] [9] [10] Gay-Lussac desarrolló una versión mejorada de la bureta que incluía un brazo lateral e inventó los términos " pipeta " y " bureta " en un artículo de 1824 sobre la estandarización de soluciones de índigo. [11] La primera bureta verdadera fue inventada en 1845 por el químico francés Étienne Ossian Henry (1798-1873). [12] [13] [14] [15] Una mejora importante del método y la popularización del análisis volumétrico se debió a Karl Friedrich Mohr , quien rediseñó la bureta en una forma simple y conveniente, y quien escribió el primer libro de texto sobre el tema, Lehrbuch der chemisch-analytischen Titrirmethode ( Libro de texto de métodos de titulación de química analítica ), publicado en 1855. [16] [17]
Procedimiento

Una titulación típica comienza con un vaso de precipitados o un matraz Erlenmeyer que contiene una cantidad muy precisa del analito y una pequeña cantidad de indicador (como fenolftaleína ) colocado debajo de una bureta calibrada o una jeringa de pipeteo químico que contiene el titulante. [18] Luego se agregan pequeños volúmenes del titulante al analito y al indicador hasta que el indicador cambia de color en reacción al umbral de saturación del titulante, lo que representa la llegada al punto final de la titulación, lo que significa que la cantidad de titulante equilibra la cantidad de analito presente, de acuerdo con la reacción entre los dos. Dependiendo del punto final deseado, una sola gota o menos de una sola gota del titulante pueden marcar la diferencia entre un cambio permanente y temporal en el indicador. [ se necesita más explicación ]
Técnicas de preparación
Las titulaciones típicas requieren que el titulante y el analito estén en forma líquida (solución). Aunque los sólidos suelen disolverse en una solución acuosa, se utilizan otros disolventes como el ácido acético glacial o el etanol para fines especiales (como en la petroquímica , que se especializa en el petróleo). [19] Los analitos concentrados suelen diluirse para mejorar la precisión.
Muchas titulaciones no ácido-base requieren un pH constante durante la reacción. Por lo tanto, se puede agregar una solución tampón a la cámara de titulación para mantener el pH. [20]
En los casos en que dos reactivos en una muestra pueden reaccionar con el titulante y solo uno es el analito deseado, se puede agregar una solución de enmascaramiento separada a la cámara de reacción que elimina el efecto del ion no deseado. [21]
Algunas reacciones de reducción-oxidación ( redox ) pueden requerir calentar la solución de muestra y titularla mientras la solución aún está caliente para aumentar la velocidad de reacción . Por ejemplo, la oxidación de algunas soluciones de oxalato requiere calentar a 60 °C (140 °F) para mantener una velocidad de reacción razonable. [22]
Curvas de titulación
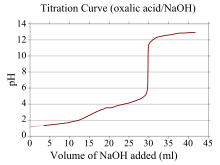
Una curva de titulación es una curva en un gráfico cuya coordenada x representa el volumen de titulante añadido desde el comienzo de la titulación, y cuya coordenada y representa la concentración del analito en la etapa correspondiente de la titulación (en una titulación ácido-base, la coordenada y generalmente representa el pH de la solución). [23]
En una titulación ácido - base , la curva de titulación representa la fuerza del ácido y la base correspondientes. Para un ácido fuerte y una base fuerte, la curva será relativamente suave y muy pronunciada cerca del punto de equivalencia. Debido a esto, un pequeño cambio en el volumen del titulante cerca del punto de equivalencia da como resultado un gran cambio de pH y muchos indicadores serían apropiados (por ejemplo, tornasol , fenolftaleína o azul de bromotimol ).
Si un reactivo es un ácido o base débil y el otro es un ácido o base fuerte, la curva de titulación es irregular y el pH cambia menos con pequeñas adiciones de titulante cerca del punto de equivalencia . Por ejemplo, se muestra la curva de titulación para la titulación entre ácido oxálico (un ácido débil) e hidróxido de sodio (una base fuerte). El punto de equivalencia ocurre entre pH 8-10, lo que indica que la solución es básica en el punto de equivalencia y un indicador como la fenolftaleína sería apropiado. Las curvas de titulación correspondientes a bases débiles y ácidos fuertes se comportan de manera similar, siendo la solución ácida en el punto de equivalencia y siendo los indicadores como el naranja de metilo y el azul de bromotimol los más apropiados.
Las titulaciones entre un ácido débil y una base débil tienen curvas de titulación muy irregulares. Por ello, puede que no sea adecuado ningún indicador definido y, a menudo, se utiliza un medidor de pH para controlar la reacción. [24]
El tipo de función que se puede utilizar para describir la curva se denomina función sigmoidea .
Tipos de titulaciones
Existen muchos tipos de titulaciones con diferentes procedimientos y objetivos. Los tipos más comunes de titulación cualitativa son las titulaciones ácido-base y las titulaciones redox .
Titulación ácido-base

| Indicador | Color en el lado ácido | Rango de cambio de color (pH) | Color en el lado básico |
|---|---|---|---|
| Violeta de metilo | Amarillo | 0,0—1,6 | Violeta |
| Azul de bromofenol | Amarillo | 3.0—4.6 | Azul |
| Naranja de metilo | Rojo | 3.1—4.4 | Amarillo |
| Rojo de metilo | Rojo | 4.4—6.3 | Amarillo |
| Tornasol | Rojo | 5.0—8.0 | Azul |
| Azul de bromotimol | Amarillo | 6.0—7.6 | Azul |
| Fenolftaleína | Incoloro | 8,3—10,0 | Rosa |
| Amarillo de alizarina | Amarillo | 10.1—12.0 | Rojo |
Las titulaciones ácido-base dependen de la neutralización entre un ácido y una base cuando se mezclan en solución. Además de la muestra, se añade un indicador de pH adecuado a la cámara de titulación, que representa el rango de pH del punto de equivalencia. El indicador ácido-base indica el punto final de la titulación cambiando de color. El punto final y el punto de equivalencia no son exactamente iguales porque el punto de equivalencia está determinado por la estequiometría de la reacción, mientras que el punto final es solo el cambio de color del indicador. Por lo tanto, una selección cuidadosa del indicador reducirá el error del indicador. Por ejemplo, si el punto de equivalencia está a un pH de 8,4, se utilizaría el indicador de fenolftaleína en lugar de amarillo de alizarina porque la fenolftaleína reduciría el error del indicador. Los indicadores comunes, sus colores y el rango de pH en el que cambian de color se dan en la tabla anterior. [25] Cuando se requieren resultados más precisos, o cuando los reactivos son un ácido débil y una base débil, se utiliza un medidor de pH o un medidor de conductancia.
Para bases muy fuertes, como reactivos de organolitio , amidas metálicas e hidruros , el agua generalmente no es un solvente adecuado y los indicadores cuyo pKa se encuentra en el rango de cambios de pH acuoso son de poca utilidad. En cambio, el valorante y el indicador utilizados son ácidos mucho más débiles y se utilizan solventes anhidros como THF . [26] [27]

El pH aproximado durante la titulación se puede aproximar mediante tres tipos de cálculos. Antes de comenzar la titulación, se calcula la concentración de en una solución acuosa de ácido débil antes de agregar cualquier base. Cuando el número de moles de bases agregadas es igual al número de moles de ácido inicial o el llamado punto de equivalencia , se calcula uno de hidrólisis y el pH se calcula de la misma manera que se calcularon las bases conjugadas del ácido titulado. Entre los puntos inicial y final, se obtiene a partir de la ecuación de Henderson-Hasselbalch y la mezcla de titulación se considera como tampón. En la ecuación de Henderson-Hasselbalch, se dice que [ácido] y [base] son las molaridades que habrían estado presentes incluso con disociación o hidrólisis. En un tampón, se puede calcular exactamente, pero se deben tener en cuenta la disociación de HA , la hidrólisis de y la autoionización del agua. [28] Se deben utilizar cuatro ecuaciones independientes: [29]
En las ecuaciones, y son los moles de ácido ( HA ) y sal ( XA donde X es el catión), respectivamente, utilizados en el tampón, y el volumen de solución es V. La ley de acción de masas se aplica a la ionización del agua y la disociación del ácido para derivar la primera y la segunda ecuaciones. El balance de masas se utiliza en la tercera ecuación, donde la suma de y debe ser igual al número de moles de ácido y base disueltos, respectivamente. El balance de carga se utiliza en la cuarta ecuación, donde el lado izquierdo representa la carga total de los cationes y el lado derecho representa la carga total de los aniones: es la molaridad del catión (por ejemplo, sodio, si se utiliza sal de sodio del ácido o hidróxido de sodio para preparar el tampón). [30]
Titulación redox
Las valoraciones redox se basan en una reacción de reducción-oxidación entre un agente oxidante y un agente reductor. Normalmente se utiliza un potenciómetro o un indicador redox para determinar el punto final de la valoración, como cuando uno de los componentes es el agente oxidante dicromato de potasio . El cambio de color de la solución de naranja a verde no es definitivo, por lo que se utiliza un indicador como la difenilamina sódica. [31] El análisis de vinos para dióxido de azufre requiere yodo como agente oxidante. En este caso, se utiliza almidón como indicador; se forma un complejo de almidón-yodo azul en presencia de exceso de yodo, lo que indica el punto final. [32]
Algunas titulaciones redox no requieren un indicador, debido al color intenso de los componentes. Por ejemplo, en la permanganometría, un ligero color rosa persistente señala el punto final de la titulación debido al color del exceso de agente oxidante permanganato de potasio . [33] En la yodometría , a concentraciones suficientemente grandes, la desaparición del ion triyoduro de color marrón rojizo oscuro puede usarse como punto final, aunque a concentraciones más bajas la sensibilidad se mejora añadiendo un indicador de almidón , que forma un complejo intensamente azul con el triyoduro.

Titulación en fase gaseosa
Las titulaciones en fase gaseosa son titulaciones realizadas en la fase gaseosa , específicamente como métodos para determinar especies reactivas por reacción con un exceso de algún otro gas , que actúa como titulante. En una titulación en fase gaseosa común, el ozono gaseoso se titula con óxido de nitrógeno de acuerdo con la reacción
- O 3 + NO → O 2 + NO 2 . [34] [35]
Una vez completada la reacción, se cuantifican el titulante y el producto restantes (por ejemplo, mediante espectroscopia de transformada de Fourier ) (FT-IR); esto se utiliza para determinar la cantidad de analito en la muestra original.
La titulación en fase gaseosa tiene varias ventajas sobre la espectrofotometría simple . En primer lugar, la medición no depende de la longitud del trayecto, porque se utiliza la misma longitud del trayecto para la medición tanto del exceso de titulante como del producto. En segundo lugar, la medición no depende de un cambio lineal en la absorbancia como función de la concentración del analito, tal como se define en la ley de Beer-Lambert . En tercer lugar, es útil para muestras que contienen especies que interfieren en longitudes de onda que se utilizan normalmente para el analito. [36]
Titulación complexométrica
Las titulaciones complexométricas se basan en la formación de un complejo entre el analito y el titulante. En general, requieren indicadores complexométricos especializados que formen complejos débiles con el analito. El ejemplo más común es el uso de un indicador de almidón para aumentar la sensibilidad de la titulación yodométrica, siendo el complejo azul oscuro de almidón con yodo y yoduro más visible que el yodo solo. Otros indicadores complexométricos son el negro de eriocromo T para la titulación de iones de calcio y magnesio , y el agente quelante EDTA utilizado para titular iones metálicos en solución. [37]
Titulación del potencial zeta
Las titulaciones de potencial zeta son titulaciones en las que la finalización se controla mediante el potencial zeta , en lugar de mediante un indicador , para caracterizar sistemas heterogéneos , como los coloides . [38] Uno de los usos es determinar el punto isoeléctrico cuando la carga superficial se vuelve cero, lo que se logra cambiando el pH o agregando surfactante . Otro uso es determinar la dosis óptima para la floculación o estabilización . [39]
Ensayo
Un ensayo es un tipo de titulación biológica que se utiliza para determinar la concentración de un virus o bacteria . Se realizan diluciones seriadas en una muestra en una proporción fija (como 1:1, 1:2, 1:4, 1:8, etc.) hasta que la última dilución no dé un resultado positivo en la prueba de presencia del virus. El valor positivo o negativo se puede determinar inspeccionando visualmente las células infectadas bajo un microscopio o mediante un método inmunoenzimático como el ensayo inmunoabsorbente ligado a enzimas (ELISA). Este valor se conoce como título . [40]
Medición del punto final de una titulación
Los diferentes métodos para determinar el punto final incluyen: [41]
- Indicador: Sustancia que cambia de color en respuesta a un cambio químico. Un indicador ácido-base (por ejemplo, fenolftaleína ) cambia de color según el pH. También se utilizan indicadores redox . Se añade una gota de solución indicadora a la titulación al principio; se alcanza el punto final cuando el color cambia.
- Potenciómetro : instrumento que mide el potencial del electrodo de la solución. Se utilizan para titulaciones redox; el potencial del electrodo de trabajo cambiará repentinamente cuando se alcance el punto final.

- Medidor de pH : Potenciómetro con un electrodo cuyo potencial depende de la cantidad de iones H + presentes en la solución. (Este es un ejemplo de electrodo selectivo de iones ). El pH de la solución se mide durante toda la titulación, con mayor precisión que con un indicador; en el punto final habrá un cambio repentino en el pH medido.
- Conductividad : Medición de iones en una solución. La concentración de iones puede cambiar significativamente en una titulación, lo que cambia la conductividad. (Por ejemplo, durante una titulación ácido-base, los iones H + y OH− reaccionan para formar H2O neutro ) . Como la conductancia total depende de todos los iones presentes en la solución y no todos los iones contribuyen por igual (debido a la movilidad y la fuerza iónica ), predecir el cambio en la conductividad es más difícil que medirlo.
- Cambio de color: en algunas reacciones, la solución cambia de color sin necesidad de añadir ningún indicador. Esto se observa a menudo en las valoraciones redox, cuando los diferentes estados de oxidación del producto y del reactivo producen colores diferentes.
- Precipitación : si una reacción produce un sólido, se formará un precipitado durante la titulación. Un ejemplo clásico es la reacción entre Ag + y Cl− para formar la sal insoluble AgCl. Los precipitados turbios suelen dificultar la determinación precisa del punto final. Para compensar, las titulaciones de precipitación a menudo deben realizarse como titulaciones "inversas" (ver a continuación).
- Calorímetro de titulación isotérmica : instrumento que mide el calor producido o consumido por la reacción para determinar el punto final. Se utiliza en titulaciones bioquímicas , como la determinación de cómo se unen los sustratos a las enzimas .
- Titulación termométrica : se diferencia de la titulación calorimétrica porque el calor de la reacción (indicado por el aumento o la caída de la temperatura) no se utiliza para determinar la cantidad de analito en la solución de muestra. En cambio, el punto final se determina por la velocidad del cambio de temperatura .
- Espectroscopia : Se utiliza para medir la absorción de luz por la solución durante la titulación si se conoce el espectro del reactivo, del titulante o del producto. La concentración del material se puede determinar mediante la Ley de Beer .
- Amperometría : mide la corriente producida por la reacción de titulación como resultado de la oxidación o reducción del analito. El punto final se detecta como un cambio en la corriente. Este método es más útil cuando se puede reducir el exceso de titulante, como en la titulación de haluros con Ag + .
Punto final y punto de equivalencia
Aunque los términos punto de equivalencia y punto final se utilizan a menudo indistintamente, son términos diferentes. El punto de equivalencia es la finalización teórica de la reacción: el volumen de titulante añadido en el que el número de moles de titulante es igual al número de moles de analito, o algún múltiplo de este (como en los ácidos polipróticos ). El punto final es lo que realmente se mide, un cambio físico en la solución determinado por un indicador o un instrumento mencionado anteriormente. [42]
Existe una ligera diferencia entre el punto final y el punto de equivalencia de la titulación. Este error se denomina error de indicador y es indeterminado. [43] [ ¿ Fuente autopublicada? ]
Titulación por retroceso
La titulación por retroceso es una titulación que se realiza en sentido inverso; en lugar de titular la muestra original, se añade a la solución un exceso conocido de reactivo estándar y se titula el exceso. La titulación por retroceso es útil si el punto final de la titulación inversa es más fácil de identificar que el punto final de la titulación normal, como en el caso de las reacciones de precipitación . Las titulaciones por retroceso también son útiles si la reacción entre el analito y el titulante es muy lenta o cuando el analito se encuentra en un sólido no soluble . [44]
Métodos gráficos
El proceso de titulación crea soluciones con composiciones que van desde el ácido puro hasta la base pura. Identificar el pH asociado con cualquier etapa del proceso de titulación es relativamente simple para los ácidos y bases monopróticos. La presencia de más de un grupo ácido o base complica estos cálculos. Los métodos gráficos [45] , como el equilígrafo [46] , se han utilizado durante mucho tiempo para explicar la interacción de los equilibrios acoplados.
Usos particulares

Titulaciones ácido-base
- Para el combustible biodiesel : el aceite vegetal usado (WVO) debe neutralizarse antes de que se pueda procesar un lote. Una parte del WVO se titula con una base para determinar la acidez, de modo que el resto del lote pueda neutralizarse adecuadamente. Esto elimina los ácidos grasos libres del WVO que normalmente reaccionarían para producir jabón en lugar de combustible biodiesel. [47]
- Método Kjeldahl : medida del contenido de nitrógeno en una muestra. El nitrógeno orgánico se digiere en amoníaco con ácido sulfúrico y sulfato de potasio . Finalmente, el amoníaco se titula de nuevo con ácido bórico y luego con carbonato de sodio . [48]
- Índice de acidez : masa en miligramos de hidróxido de potasio (KOH) necesaria para titular completamente un ácido en un gramo de muestra. Un ejemplo es la determinación del contenido de ácidos grasos libres .
- Índice de saponificación : masa en miligramos de KOH necesaria para saponificar un ácido graso en un gramo de muestra. La saponificación se utiliza para determinar la longitud media de la cadena de ácidos grasos en la grasa.
- Valor éster (o índice éster): índice calculado. Valor éster = índice de saponificación – índice de acidez.
- Valor de amina: la masa en miligramos de KOH igual al contenido de amina en un gramo de muestra.
- Índice de hidroxilo : masa en miligramos de KOH correspondiente a los grupos hidroxilo en un gramo de muestra. El analito se acetila utilizando anhídrido acético y luego se titula con KOH.
Titulaciones redox
- Prueba de Winkler para oxígeno disuelto : se utiliza para determinar la concentración de oxígeno en el agua. El oxígeno en las muestras de agua se reduce utilizando sulfato de manganeso (II) , que reacciona con yoduro de potasio para producir yodo . El yodo se libera en proporción al oxígeno en la muestra, por lo que la concentración de oxígeno se determina con una titulación redox de yodo con tiosulfato utilizando un indicador de almidón. [49]
- Vitamina C : También conocida como ácido ascórbico, la vitamina C es un potente agente reductor. Su concentración se puede identificar fácilmente cuando se titula con el colorante azul diclorofenolindofenol ( DCPIP ), que se vuelve incoloro cuando se reduce con la vitamina. [50]
- Reactivo de Benedict : el exceso de glucosa en la orina puede indicar diabetes en un paciente. El método de Benedict es el método convencional para cuantificar la glucosa en la orina utilizando un reactivo preparado. Durante este tipo de titulación, la glucosa reduce los iones cúpricos a iones cuprosos que reaccionan con el tiocianato de potasio para producir un precipitado blanco, que indica el punto final. [51]
- Número de bromo : Medida de insaturación de un analito, expresada en miligramos de bromo absorbidos por 100 gramos de muestra.
- Índice de yodo : Medida de insaturación de un analito, expresada en gramos de yodo absorbidos por 100 gramos de muestra.
Misceláneas
- Titulación de Karl Fischer : método potenciométrico para analizar trazas de agua en una sustancia. Se disuelve una muestra en metanol y se titula con un reactivo de Karl Fischer (que consta de yodo , dióxido de azufre , una base y un disolvente, como el alcohol ). El reactivo contiene yodo, que reacciona proporcionalmente con el agua. Por lo tanto, el contenido de agua se puede determinar controlando el potencial eléctrico del exceso de yodo. [52]
Véase también
- Los estándares primarios son compuestos con propiedades consistentes y confiables que se utilizan para preparar soluciones estándar para titulaciones.
Referencias
- ^ Whitney, WD; Smith, BE (1911). "Titrimetría". Diccionario y enciclopedia Century . The Century Co. pág. 6504.
- ^ Compendio de prácticas básicas en bioquímica . Universidad de Aarhus. 2008.
- ^ "Titrand". Diccionario de ciencia y tecnología . McGraw-Hill . Consultado el 30 de septiembre de 2011 .
- ^ Ortolang: "títre" (en francés): "4. a) 1543 inclinación «proporción d'or ou d'argent dans les monnaies, dans les ouvrages d'or et d'argent» " ( tiltre : proporción de oro o plata en dinero, en obras de oro o de plata)
- ^ "Etimología en línea: titular".
- ^ "WordReference: título y titulación".
- ^ Gay-Lussac (1828). "Essai des potasses du commerce" [Ensayos de potasa comercial]. Annales de Chimie et de Physique . 2da serie (en francés). 39 : 337–368. En la nota a pie de página (1) de la pág. 340, Gay-Lussac utiliza por primera vez título como verbo: "Il leur serait plus facile de titrer l'acide sulfurique normal au moyen du carbonate de soude ou de potasse pur;..." ([Al determinar la concentración de ácido sulfúrico] les resultaría más fácil valorar el ácido sulfúrico normal mediante carbonato de sodio o de potasio puro...)
- ^ Szabadváry, Ferenc (1993). Historia de la Química Analítica . Taylor y Francisco . págs. 208-209. ISBN 2-88124-569-2.
- ↑ Descroizilles (1795). «Description et usages du Berthollimêtre, ..." [Descripción y usos del Berthollimetro, ...]. Journal des Arts et Manufactures (en francés). 1 : 256–276.
- ^ Wisniak, Jaime (2014). "François Antoine Henri Descroizilles". Revista CENIC Ciencias Químicas . 45 (1): 184-193.
- ^ Gay-Lussac (1824). "Instruction sur l'essai du chlorure de chaux" [Instrucciones sobre la dosificación de la cal clorada]. Annales de chimie et de physique . 2da serie (en francés). 26 : 162-175. En las páginas 170-171, Gay-Lussac describe varias figuras que aparecen en una lámina (ilustración) que acompaña al artículo. De la página 170: " F , pequeña medida o pipeta de 2+1/2 cubos de centímetros, ... " ( F , pequeña medida o "pipeta" de 2+1/2 cc., ... ) De la pág. 171: " I , burette destinée à mesurer la teinture d'épreuve: ... " ( Yo , "burette" destinada a medir el tinte de prueba: ... )
- ^ Enrique, O. (1845). "Nouvelles expériences sur l'essai des potasses du commerce et appareil dit potassimètre pour l'effectuer" [Nuevos experimentos sobre el ensayo de potasa comercial y un aparato llamado "potasímetro" para realizarlo]. Journale de Pharmacie et de Chimie . 3ª serie (en francés). 7 : 214–222. Un boceto de la bureta de Henry aparece en la pág. 218.
- ^ Szabadváry, Ferenc (1986). "La historia del equipamiento de laboratorio químico". Periodica Polytechnica Chemical Engineering . 30 (1–2): 77–95.Véase pág. 87.
- ^ Szabadváry, Ferenc (1966). Historia de la Química Analítica. Traducido por Gyula Svehla. Oxford, Inglaterra: Permagon Press. pag. 237.ISBN 9781483157122.
- ^ Christophe, R. (1971). "L'analyse volumétrique de 1790 à 1860. Caractéristiques et importindustrielle. Evolution des instrument" [Análisis volumétrico de 1790-1860. Características e importancia industrial. Evolución de los instrumentos.]. Revue d'histoire des sciences (en francés). 24 (1): 25–44. doi :10.3406/rhs.1971.3172. De la pág. 38: "... il préfigure bien ses deendings actuelles..." (... [es decir, la bureta de Henry] presagia bien a sus descendientes modernos...)
- ^ Rosenfeld, L. (1999). Cuatro siglos de química clínica . CRC Press . Págs. 72-75. ISBN. 90-5699-645-2.
- ^ Mohr, Karl Friedrich (1855). Lehrbuch der chemisch-analytischen Titrirmethode..., parte 1 [ Libro de texto de métodos de valoración de química analítica... ] (en alemán). Braunschweig, (Alemania): Friederich Vieweg und Sohn. págs. 2–20. La página 3 muestra la bureta de Mohr; la página 12 muestra una bureta con una llave de paso de vidrio ( Glasshahn ).
- ^ Gaiao, Edvaldo da Nóbrega; Martíns, Valdomiro Lacerda; Lyra, Wellington da Silva; Almeida, Luciano Farías de; Silva, Edvan Cirino da; Araújo, Mário César Ugulino (2006). "Valoraciones basadas en imágenes digitales". Analytica Chimica Acta . 570 (2): 283–290. doi :10.1016/j.aca.2006.04.048. PMID 17723410.
- ^ Matar, S.; LF Hatch (2001). Química de los procesos petroquímicos (2.ª edición). Gulf Professional Publishing. ISBN 0-88415-315-0.
- ^ Verma, Dr. NK; SK Khanna; Dr. B. Kapila. Química integral XI . Nueva Delhi: Laxmi Publications. págs. 642–645. ISBN 81-7008-596-9.
- ^ Patnaik, P. (2004). Manual de química analítica del decano (2.ª edición). McGraw-Hill Prof. Med/Tech. págs. 2.11–2.16. ISBN 0-07-141060-0.
- ^ Walther, JV (2005). Fundamentos de geoquímica . Jones & Bartlett Learning. págs. 515–520. ISBN. 0-7637-2642-7.
- ^ Reger, DL; SR Goode; DW Ball (2009). Química: principios y práctica (3.ª edición). Cengage Learning. ISBN 978-0-534-42012-3.
- ^ Bewick, S.; J. Edge; T. Forsythe; R. Parsons (2009). Química de CK12 . Fundación CK-12. págs. 794–797.
- ^ "Medidas de pH con indicadores" . Consultado el 29 de septiembre de 2011 .
- ^ "Titulación de reactivos solubles RM, R2NM y ROM" (PDF) . shenvilab.org/education .
- ^ "Métodos para estandarizar reactivos de alquil-litio (bibliografía hasta 2006)" (PDF) . Consultado el 4 de junio de 2014 .
- ^ Harris, Daniel C. (2007). Análisis químico cuantitativo (séptima edición). Freeman and Company. ISBN 978-0-7167-7041-1.
- ^ Skoog, DA; West, DM; Holler, FJ (2000). Química analítica: una introducción, séptima edición. Emily Barrosse. págs. 265-305. ISBN 0-03-020293-0.
- ^ Henry, N.; MM Senozon (2001). La ecuación de Henderson-Hasselbalch: su historia y limitaciones . Revista de educación química. págs. 1499–1503.
- ^ Vogel, AI; J. Mendham (2000). Libro de texto de Vogel sobre análisis químico cuantitativo (6.ª ed.). Prentice Hall. pág. 423. ISBN 0-582-22628-7.
- ^ Amerine, MA; MA Joslyn (1970). Vinos de mesa: la tecnología de su producción . Vol. 2 (2.ª ed.). University of California Press. págs. 751–753. ISBN 0-520-01657-2.
- ^ Sociedad Química Alemana. División de Química Analítica (1959). Fresenius' Journal of Analytical Chemistry (en alemán). Vol. 166-167. Universidad de Michigan: JF Bergmann. pág. 1.
- ^ Hänsch, TW (2007). Metrología y constantes fundamentales . IOS Press. pág. 568. ISBN 978-1-58603-784-0.
- ^ "Valoración en fase gaseosa". Oficina Internacional de Pesos y Medidas . Consultado el 29 de septiembre de 2001 .
- ^ DeMore, WB; M. Patapoff (septiembre de 1976). "Comparación de determinaciones de ozono mediante fotometría ultravioleta y titulación en fase gaseosa". Environmental Science & Technology . 10 (9): 897–899. Bibcode :1976EnST...10..897D. doi :10.1021/es60120a012.
- ^ Khopkar, SM (1998). Conceptos básicos de química analítica (2.ª edición). New Age International. págs. 63–76. ISBN 81-224-1159-2.
- ^ Somasundaran, P. (2006). "Cálculo de potenciales zeta a partir de datos electrocinéticos". Enciclopedia de la ciencia de superficies y coloides . 2 (2.ª ed.). CRC Press: 1097. ISBN 0-8493-9607-7.
- ^ Dukhin, AS y Goetz, PJ Caracterización de líquidos, nanopartículas y micropartículas y cuerpos porosos mediante ultrasonido , Elsevier, 2017 ISBN 978-0-444-63908-0
- ^ Decker, JM (2000). Introducción a la inmunología . Eleventh Hour (3.ª ed.). Wiley-Blackwell. págs. 18-20. ISBN 0-632-04415-2.
- ^ "Titulación". Science & Technology Encyclopedia . McGraw-Hill . Consultado el 30 de septiembre de 2011 .
- ^ Harris, DC (2003). Análisis químico cuantitativo (6.ª ed.). Macmillan. pág. 129. ISBN 0-7167-4464-3.
- ^ Hannan, HJ (2007). Manual técnico de formulación de productos de limpieza industriales y domésticos . Lulu.com. pág. 103. ISBN 978-0-615-15601-9.[ fuente autopublicada ]
- ^ Kenkel, J. (2003). Química analítica para técnicos . Vol. 1 (3.ª ed.). CRC Press. págs. 108-109.
- ^ Hatfield, D. Brooke (2015). "El eculígrafo: revisitando una vieja herramienta". tahosa.us .
- ^ Freiser, H. (1963). Equilibrios iónicos en química analítica . Kreiger. ISBN 0-88275-955-8.
- ^ Purcella, G. (2007). Guía para hacerlo usted mismo sobre el biodiésel: su solución de combustible alternativo para ahorrar dinero, reducir la dependencia del petróleo y ayudar al planeta. Ulysses Press. págs. 81–96. ISBN 978-1-56975-624-9.
- ^ Remington: la ciencia y la práctica de la farmacia . Vol. 1 (21.ª ed.). Lippincott Williams & Wilkins. 2005. pág. 501. ISBN 0-7817-4673-6.
- ^ Spellman, FR (2009). Manual de operaciones de plantas de tratamiento de agua y aguas residuales (2.ª edición). CRC Press. pp. 545. ISBN 978-1-4200-7530-4.
- ^ Biología . Vol. 3. Londres: Taylor & Francis. 1967. pág. 52.
- ^ Nigam (2007). Manual de laboratorio de bioquímica . Tata McGraw-Hill Education. pág. 149. ISBN 978-0-07-061767-4.
- ^ Jackson, ML; P. Barak (2005). Análisis químico del suelo: curso avanzado . UW-Madison Libraries Parallel Press. págs. 305–309. ISBN 1-893311-47-3.
Enlaces externos
- Wikihow: Realizar una titulación
- Una guía interactiva sobre titulación
- Ayuda científica: una explicación sencilla de las titulaciones, incluidos ejemplos de cálculo
- Software gratuito de titulación: simulación de cualquier curva de pH frente a volumen, diagramas de distribución y análisis de datos reales
- Método gráfico para resolver problemas ácido-base, incluidas titulaciones
- Solucionador gráfico y numérico de problemas generales de ácido-base - Programa de software para teléfonos y tabletas
![{\displaystyle {\ce {[H+]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2f6781ee107d64f14c7da0bb7d25c3a8e3c4235f)

![{\displaystyle [{\ce {H+}}][{\ce {OH-}}]=10^{-14}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e64e80f918a64e1000aa161c7f047b046ed20149)
![{\displaystyle [{\ce {H+}}]=K_{a}{\ce {{\frac {[HA]}{[A^{-}]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9d401c8135577b043dbcb08c4ebc4b3340ce8430)
![{\displaystyle [{\ce {HA}}]+[{\ce {A-}}]={\frac {(n_{{\ce {A}}}+n_{{\ce {B}}} )}{V}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1515a6091588b1b119a198b28d6d1908decca748)
![{\displaystyle [{\ce {H+}}]+{\frac {n_{{\ce {B}}}}{V}}=[{\ce {A-}}]+[{\ce {OH -}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/60c7344bbd50c9a75dcb598142e874aa39349a93)


![{\displaystyle V[{\ce {HA}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b2580ec25274d91056971bfecc5c37718436f9c1)
![{\displaystyle V[{\ce {A-}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/45100d92fd8e282f61ee30e05034cbe2853523dd)


