Ribosoma
| Biología celular | |
|---|---|
| Diagrama de célula animal | |
 Componentes de una célula animal típica:
|
Los ribosomas ( / ˈraɪbəzoʊm , -sooʊm / ) son máquinas macromoleculares , que se encuentran dentro de todas las células , que realizan la síntesis de proteínas biológicas ( traducción del ARN mensajero ) . Los ribosomas unen los aminoácidos en el orden especificado por los codones de las moléculas de ARN mensajero para formar cadenas polipeptídicas . Los ribosomas constan de dos componentes principales: las subunidades ribosómicas pequeñas y grandes. Cada subunidad consta de una o más moléculas de ARN ribosómico y muchas proteínas ribosómicas ( proteínas r ). [1] [2] [3] Los ribosomas y las moléculas asociadas también se conocen como el aparato de traducción .
Descripción general
La secuencia de ADN que codifica la secuencia de aminoácidos de una proteína se transcribe en una cadena de ARN mensajero (ARNm). Los ribosomas se unen a los ARN mensajeros y utilizan sus secuencias [ aclaración necesaria ] para determinar la secuencia correcta de aminoácidos para generar una proteína dada. Los aminoácidos son seleccionados y transportados al ribosoma por moléculas de ARN de transferencia (ARNt), que entran en el ribosoma y se unen a la cadena de ARN mensajero a través de un bucle de tallo anticodón . Para cada triplete codificante ( codón ) en el ARN mensajero, hay un ARN de transferencia único que debe tener la coincidencia exacta con el anticodón y lleva el aminoácido correcto para incorporarse a una cadena polipeptídica en crecimiento . Una vez que se produce la proteína, puede plegarse para producir una estructura tridimensional funcional.
Un ribosoma está formado por complejos de ARN y proteínas y, por lo tanto, es un complejo ribonucleoproteico . En los procariotas, cada ribosoma está compuesto por componentes pequeños (30 S ) y grandes (50 S ), llamados subunidades, que están unidos entre sí:
- (30S) tiene principalmente una función de decodificación y también está unido al ARNm.
- (50S) tiene principalmente una función catalítica y también está unido a los ARNt aminoacilados.
La síntesis de proteínas a partir de sus componentes básicos se lleva a cabo en cuatro fases: iniciación, elongación, terminación y reciclaje. El codón de inicio en todas las moléculas de ARNm tiene la secuencia AUG. El codón de terminación es uno de los siguientes: UAA, UAG o UGA; dado que no hay moléculas de ARNt que reconozcan estos codones, el ribosoma reconoce que la traducción está completa. [4] Cuando un ribosoma termina de leer una molécula de ARNm, las dos subunidades se separan y, por lo general, se rompen, pero se pueden reutilizar. Los ribosomas son un tipo de enzima , llamadas ribozimas porque la actividad catalítica de la peptidil transferasa que une los aminoácidos la realiza el ARN ribosómico. [5]
En las células eucariotas , los ribosomas a menudo se asocian con las membranas intracelulares que forman el retículo endoplásmico rugoso .
Los ribosomas de bacterias , arqueas y eucariotas (en el sistema de tres dominios ) se parecen entre sí en un grado notable, evidencia de un origen común. Difieren en su tamaño, secuencia, estructura y la proporción de proteína a ARN. Las diferencias en la estructura permiten que algunos antibióticos maten bacterias inhibiendo sus ribosomas mientras que dejan intactos los ribosomas humanos. En todas las especies, más de un ribosoma puede moverse a lo largo de una sola cadena de ARNm a la vez (como un polisoma ), cada uno "leyendo" una secuencia específica y produciendo una molécula de proteína correspondiente.
Los ribosomas mitocondriales de las células eucariotas son distintos de los demás ribosomas. Funcionalmente se parecen a los de las bacterias, lo que refleja el origen evolutivo de las mitocondrias como bacterias endosimbióticas . [6] [7]
Descubrimiento
Los ribosomas fueron observados por primera vez a mediados de la década de 1950 por el biólogo celular rumano-estadounidense George Emil Palade , utilizando un microscopio electrónico , como partículas densas o gránulos. [8] Inicialmente se los llamó gránulos de Palade debido a su estructura granular. El término "ribosoma" fue propuesto en 1958 por Howard M. Dintzis: [9]
Durante el simposio se hizo evidente una dificultad semántica. Para algunos de los participantes, "microsomas" significa las partículas de ribonucleoproteína de la fracción de microsomas contaminadas por otro material proteico y lipídico; para otros, los microsomas consisten en proteínas y lípidos contaminados por partículas. La frase "partículas microsomales" no parece adecuada, y "partículas de ribonucleoproteína de la fracción de microsomas" es demasiado extraña. Durante la reunión, se sugirió la palabra "ribosoma", que tiene un nombre muy satisfactorio y un sonido agradable. La confusión actual se eliminaría si se adoptara "ribosoma" para designar partículas de ribonucleoproteína en tamaños que van desde 35 a 100S.
— Albert Claude, Partículas microsomales y síntesis de proteínas [10]
Albert Claude , Christian de Duve y George Emil Palade recibieron conjuntamente el Premio Nobel de Fisiología o Medicina , en 1974, por el descubrimiento del ribosoma. [11] El Premio Nobel de Química de 2009 fue otorgado a Venkatraman Ramakrishnan , Thomas A. Steitz y Ada E. Yonath por determinar la estructura y el mecanismo detallados del ribosoma. [12]
Estructura


El ribosoma es una máquina celular compleja. Está formado principalmente por ARN especializado, conocido como ARN ribosómico (ARNr), así como por docenas de proteínas distintas (la cantidad exacta varía ligeramente entre especies). Las proteínas ribosómicas y los ARNr están dispuestos en dos partes ribosómicas distintas de diferentes tamaños, conocidas generalmente como subunidades grande y pequeña del ribosoma. Los ribosomas constan de dos subunidades que encajan entre sí y funcionan como una sola para traducir el ARNm en una cadena polipeptídica durante la síntesis de proteínas. Debido a que están formados por dos subunidades de tamaño desigual, son ligeramente más largos en el eje que en el diámetro.
Ribosomas procariotas
Los ribosomas procariotas tienen alrededor de 20 nm (200 Å ) de diámetro y están compuestos de 65% de ARNr y 35% de proteínas ribosómicas . [13] Los ribosomas eucariotas tienen entre 25 y 30 nm (250–300 Å) de diámetro con una relación ARNr-proteína cercana a 1. [14] El trabajo cristalográfico [15] ha demostrado que no hay proteínas ribosómicas cerca del sitio de reacción para la síntesis de polipéptidos. Esto sugiere que los componentes proteicos de los ribosomas no participan directamente en la catálisis de formación de enlaces peptídicos, sino que estas proteínas actúan como un andamiaje que puede mejorar la capacidad del ARNr para sintetizar proteínas (ver: Ribozima ).
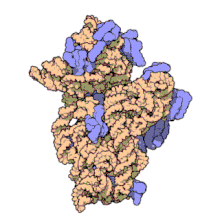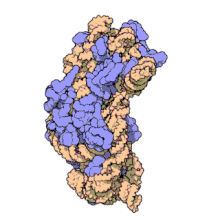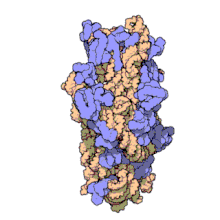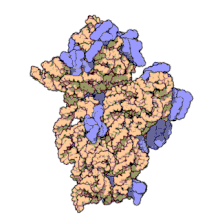
Las subunidades ribosómicas de procariotas y eucariotas son bastante similares. [17]
La unidad de medida utilizada para describir las subunidades ribosómicas y los fragmentos de ARNr es la unidad Svedberg , una medida de la velocidad de sedimentación en la centrifugación en lugar del tamaño. Esto explica por qué los nombres de los fragmentos no cuadran: por ejemplo, los ribosomas bacterianos 70S están formados por subunidades 50S y 30S.
Los procariotas tienen 70 ribosomas S , cada uno de los cuales consta de una subunidad pequeña ( 30S ) y una grande ( 50S ). E. coli , por ejemplo, tiene una subunidad de ARN 16S (que consta de 1540 nucleótidos) que está unida a 21 proteínas. La subunidad grande está compuesta por una subunidad de ARN 5S (120 nucleótidos), una subunidad de ARN 23S (2900 nucleótidos) y 31 proteínas . [17]
Ribosoma de E. coli (una bacteria) [18] : 962 ribosoma subunidad ARNr proteínas r Años 70 Años 50 23S (2904 nt ) 31 5S (120 nt) Años 30 16S (1542 nt) 21
La etiqueta de afinidad para los sitios de unión del ARNt en el ribosoma de E. coli permitió la identificación de las proteínas del sitio A y P probablemente asociadas con la actividad de la peptidiltransferasa; [5] las proteínas marcadas son L27, L14, L15, L16, L2; al menos L27 se encuentra en el sitio donante, como lo demostraron E. Collatz y AP Czernilofsky. [19] [20] Investigaciones adicionales han demostrado que las proteínas S1 y S21, en asociación con el extremo 3' del ARN ribosómico 16S, están involucradas en el inicio de la traducción. [21]
Ribosomas arqueales
Los ribosomas de las arqueas comparten las mismas dimensiones generales que los de las bacterias, siendo un ribosoma 70S formado por una subunidad grande 50S, una subunidad pequeña 30S y que contiene tres cadenas de ARNr. Sin embargo, a nivel de secuencia, son mucho más parecidos a los eucariotas que a los bacterianos. Cada proteína ribosomal adicional que tienen las arqueas en comparación con las bacterias tiene una contraparte eucariota, mientras que no se aplica tal relación entre las arqueas y las bacterias. [22] [23] [24]
Ribosomas eucariotas
Los eucariotas tienen ribosomas 80S ubicados en su citosol, cada uno de los cuales consta de una subunidad pequeña (40S) y una grande (60S) . Su subunidad 40S tiene un ARN 18S (1900 nucleótidos) y 33 proteínas. [25] [26] La subunidad grande está compuesta por una subunidad de ARN 5S (120 nucleótidos), ARN 28S (4700 nucleótidos), ARN 5.8S (160 nucleótidos) y 49 proteínas. [17] [25] [27]
Ribosomas citosólicos eucariotas ( R. norvegicus ) [18] : 65 ribosoma subunidad ARNr proteínas r Años 80 Años 60 28S (4718 nt) 49 5,8S (160 nt) 5S (120 nt) Años 40 18S (1874 nt) 33
En 1977, Czernilofsky publicó una investigación en la que utilizó el etiquetado por afinidad para identificar los sitios de unión del ARNt en los ribosomas del hígado de ratas. Varias proteínas, entre ellas L32/33, L36, L21, L23, L28/29 y L13, se consideraron implicadas en el centro de la peptidil transferasa o cerca de él . [28]
Plastoribosomas y mitoribosomas
En los eucariotas, los ribosomas están presentes en las mitocondrias (a veces llamadas mitoribosomas ) y en plástidos como los cloroplastos (también llamados plastorribosomas). También consisten en subunidades grandes y pequeñas unidas con proteínas en una partícula 70S. [17] Estos ribosomas son similares a los de las bacterias y se cree que estos orgánulos se originaron como bacterias simbióticas . [17] De los dos, los ribosomas cloroplásticos son más cercanos a los bacterianos que a los mitocondriales. Muchos fragmentos de ARN ribosómico en las mitocondrias se acortan y, en el caso del ARNr 5S , se reemplazan por otras estructuras en animales y hongos. [29] En particular, Leishmania tarentolae tiene un conjunto minimizado de ARNr mitocondrial. [30] Por el contrario, los mitoribosomas de las plantas tienen ARNr extendido y proteínas adicionales en comparación con las bacterias, en particular, muchas proteínas de repetición de pentatricopéptidos. [31]
Las algas criptomonas y cloraracniofitas pueden contener un nucleomorfo que se asemeja a un núcleo eucariota vestigial. [32] Los ribosomas 80S eucariotas pueden estar presentes en el compartimento que contiene el nucleomorfo. [33]
Aprovechar las diferencias
Las diferencias entre los ribosomas bacterianos y eucariotas son explotadas por los químicos farmacéuticos para crear antibióticos que pueden destruir una infección bacteriana sin dañar las células de la persona infectada. Debido a las diferencias en sus estructuras, los ribosomas bacterianos 70S son vulnerables a estos antibióticos mientras que los ribosomas eucariotas 80S no lo son. [34] Aunque las mitocondrias poseen ribosomas similares a los bacterianos, las mitocondrias no se ven afectadas por estos antibióticos porque están rodeadas por una doble membrana que no admite fácilmente estos antibióticos en el orgánulo . [35] Un contraejemplo notable es el antibiótico antineoplásico cloranfenicol , que inhibe los ribosomas bacterianos 50S y los mitocondriales eucariotas 50S. [36] Sin embargo, los ribosomas en los cloroplastos son diferentes: la resistencia a los antibióticos en las proteínas ribosómicas del cloroplasto es un rasgo que debe introducirse como marcador, con ingeniería genética. [37]
Propiedades comunes
Los diversos ribosomas comparten una estructura central, que es bastante similar a pesar de las grandes diferencias de tamaño. Gran parte del ARN está altamente organizado en varios motivos estructurales terciarios , por ejemplo, pseudonudos que exhiben apilamiento coaxial . El ARN adicional en los ribosomas más grandes se encuentra en varias inserciones largas y continuas, [38] de modo que forman bucles a partir de la estructura central sin alterarla ni cambiarla. [17] Toda la actividad catalítica del ribosoma la lleva a cabo el ARN ; las proteínas residen en la superficie y parecen estabilizar la estructura. [17]
Estructura de alta resolución

La estructura molecular general del ribosoma se conoce desde principios de la década de 1970. A principios de la década de 2000, la estructura se logró con altas resoluciones, del orden de unos pocos ångströms .
Los primeros artículos que dieron la estructura del ribosoma con resolución atómica se publicaron casi simultáneamente a finales de 2000. La subunidad 50S (procariota grande) se determinó a partir de la arqueona Haloarcula marismortui [39] y la bacteria Deinococcus radiodurans , y la estructura de la subunidad 30S se determinó a partir de la bacteria Thermus thermophilus . [16] [40] Estos estudios estructurales fueron galardonados con el Premio Nobel de Química en 2009. En mayo de 2001, estas coordenadas se utilizaron para reconstruir la partícula 70S completa de T. thermophilus con una resolución de 5,5 Å . [41]
En noviembre de 2005 se publicaron dos artículos con estructuras del ribosoma 70S de Escherichia coli . Las estructuras de un ribosoma vacante se determinaron con una resolución de 3,5 Å mediante cristalografía de rayos X. [42] Luego, dos semanas después, se publicó una estructura basada en criomicroscopía electrónica , [43] que representa al ribosoma con una resolución de 11–15 Å en el acto de pasar una cadena de proteína recién sintetizada al canal conductor de proteínas.
Las primeras estructuras atómicas del ribosoma complejado con moléculas de ARNt y ARNm fueron resueltas mediante cristalografía de rayos X por dos grupos de forma independiente, a 2,8 Å [44] y a 3,7 Å . [45] Estas estructuras permiten ver los detalles de las interacciones del ribosoma de Thermus thermophilus con el ARNm y con los ARNt unidos a los sitios ribosomales clásicos. Las interacciones del ribosoma con ARNm largos que contienen secuencias de Shine-Dalgarno se visualizaron poco después con una resolución de 4,5–5,5 Å . [46]
En 2011, se obtuvo la primera estructura atómica completa del ribosoma eucariota 80S de la levadura Saccharomyces cerevisiae mediante cristalografía. [25] El modelo revela la arquitectura de elementos específicos de eucariotas y su interacción con el núcleo universalmente conservado. Al mismo tiempo, se publicó el modelo completo de una estructura ribosomal eucariota 40S en Tetrahymena thermophila y se describió la estructura de la subunidad 40S , así como mucho sobre la interacción de la subunidad 40S con eIF1 durante la iniciación de la traducción . [26] De manera similar, también se determinó la estructura de la subunidad eucariota 60S de Tetrahymena thermophila en complejo con eIF6 . [27]
Función
Los ribosomas son partículas diminutas que consisten en ARN y proteínas asociadas que funcionan para sintetizar proteínas. Las proteínas son necesarias para muchas funciones celulares, como reparar daños o dirigir procesos químicos. Los ribosomas pueden encontrarse flotando dentro del citoplasma o adheridos al retículo endoplasmático . Su función principal es convertir el código genético en una secuencia de aminoácidos y construir polímeros proteicos a partir de monómeros de aminoácidos.
Los ribosomas actúan como catalizadores en dos procesos biológicos extremadamente importantes llamados transferencia de peptidilos e hidrólisis de peptidilos. [5] [47] El "centro PT es responsable de producir enlaces proteicos durante la elongación de las proteínas". [47]
En resumen, los ribosomas tienen dos funciones principales: decodificar el mensaje y formar enlaces peptídicos. Estas dos funciones residen en las subunidades ribosómicas. Cada subunidad está formada por uno o más ARNr y muchas proteínas r. La subunidad pequeña (30S en bacterias y arqueas, 40S en eucariotas) tiene la función de decodificación, mientras que la subunidad grande (50S en bacterias y arqueas, 60S en eucariotas) cataliza la formación de enlaces peptídicos, conocida como actividad peptidil-transferasa. La subunidad pequeña bacteriana (y arqueal) contiene el ARNr 16S y 21 proteínas r ( Escherichia coli ), mientras que la subunidad pequeña eucariota contiene el ARNr 18S y 32 proteínas r (Saccharomyces cerevisiae, aunque los números varían entre especies). La subunidad grande bacteriana contiene los ARNr 5S y 23S y 34 proteínas r ( E. coli ), mientras que la subunidad grande eucariota contiene los ARNr 5S, 5.8S y 25S/28S y 46 proteínas r ( S. cerevisiae ; nuevamente, los números exactos varían entre especies). [48]
Traducción
Los ribosomas son los lugares de trabajo de la biosíntesis de proteínas , el proceso de traducir el ARNm en proteína . El ARNm comprende una serie de codones que son decodificados por el ribosoma para fabricar la proteína. Usando el ARNm como plantilla, el ribosoma atraviesa cada codón (3 nucleótidos ) del ARNm, emparejándolo con el aminoácido apropiado proporcionado por un aminoacil-ARNt . El aminoacil-ARNt contiene un anticodón complementario en un extremo y el aminoácido apropiado en el otro. Para un reconocimiento rápido y preciso del ARNt apropiado, el ribosoma utiliza grandes cambios conformacionales ( corrección conformacional ). [49] La subunidad ribosómica pequeña, típicamente unida a un aminoacil-ARNt que contiene el primer aminoácido metionina , se une a un codón AUG en el ARNm y recluta a la subunidad ribosómica grande. El ribosoma contiene tres sitios de unión del ARN, denominados A, P y E. El sitio A se une a un aminoacil-ARNt o a factores de liberación de terminación; [50] [51] el sitio P se une a un peptidil-ARNt (un ARNt unido a la cadena polipeptídica); y el sitio E (salida) se une a un ARNt libre. La síntesis de proteínas comienza en un codón de inicio AUG cerca del extremo 5' del ARNm. El ARNm se une primero al sitio P del ribosoma. El ribosoma reconoce el codón de inicio utilizando la secuencia Shine-Dalgarno del ARNm en procariotas y la caja Kozak en eucariotas.
Aunque la catálisis del enlace peptídico implica el hidroxilo C2 de la adenosina del sitio P del ARN en un mecanismo de transporte de protones, otros pasos en la síntesis de proteínas (como la translocación) son causados por cambios en las conformaciones de las proteínas. Dado que su núcleo catalítico está hecho de ARN, los ribosomas se clasifican como " ribozimas ", [52] y se cree que podrían ser restos del mundo del ARN . [53]

En la Figura 5, ambas subunidades ribosomales ( pequeña y grande ) se ensamblan en el codón de inicio (hacia el extremo 5' del ARNm ). El ribosoma utiliza ARNt que coincide con el codón actual (triplete) en el ARNm para agregar un aminoácido a la cadena polipeptídica. Esto se hace para cada triplete en el ARNm, mientras que el ribosoma se mueve hacia el extremo 3' del ARNm. Por lo general, en las células bacterianas, varios ribosomas trabajan en paralelo en un solo ARNm, formando lo que se llama un polirribosoma o polisoma .
Plegado cotraduccional
Se sabe que el ribosoma participa activamente en el plegamiento de proteínas . [54] [55] Las estructuras obtenidas de esta manera suelen ser idénticas a las obtenidas durante el replegamiento químico de proteínas; sin embargo, las vías que conducen al producto final pueden ser diferentes. [56] [57] En algunos casos, el ribosoma es crucial para obtener la forma funcional de la proteína. Por ejemplo, uno de los posibles mecanismos de plegamiento de las proteínas profundamente anudadas se basa en que el ribosoma empuje la cadena a través del bucle adjunto. [58]
Adición de aminoácidos independientes de la traducción
La presencia de una proteína de control de calidad de ribosoma Rqc2 está asociada con la elongación de proteínas independiente del ARNm. [59] [60] Esta elongación es el resultado de la adición ribosomal (a través de ARNt traídos por Rqc2) de colas CAT : los ribosomas extienden el extremo C de una proteína bloqueada con secuencias aleatorias independientes de la traducción de a- laninas y treoninas . [61] [ 62]
Ubicación de los ribosomas
Los ribosomas se clasifican como "libres" o "unidos a la membrana".

Los ribosomas libres y unidos a la membrana difieren únicamente en su distribución espacial; son idénticos en estructura. El que el ribosoma exista en estado libre o unido a la membrana depende de la presencia de una secuencia señal que se dirija al RE en la proteína que se está sintetizando, por lo que un ribosoma individual podría estar unido a la membrana cuando está produciendo una proteína, pero libre en el citosol cuando produce otra proteína.
A veces se hace referencia a los ribosomas como orgánulos , pero el uso del término orgánulo suele restringirse a la descripción de componentes subcelulares que incluyen una membrana fosfolipídica, que los ribosomas, al ser totalmente particulados, no tienen. Por este motivo, a veces se los puede describir como "orgánulos no membranosos".
Ribosomas libres
Los ribosomas libres pueden moverse por cualquier parte del citosol , pero quedan excluidos del núcleo celular y otros orgánulos. Las proteínas que se forman a partir de ribosomas libres se liberan en el citosol y se utilizan dentro de la célula. Dado que el citosol contiene altas concentraciones de glutatión y es, por lo tanto, un entorno reductor , las proteínas que contienen enlaces disulfuro , que se forman a partir de residuos de cisteína oxidada, no se pueden producir en su interior.
Ribosomas unidos a la membrana
Cuando un ribosoma comienza a sintetizar proteínas que son necesarias en algunos orgánulos, el ribosoma que produce esta proteína puede quedar "ligado a la membrana". En las células eucariotas esto sucede en una región del retículo endoplasmático (RE) llamada "RE rugoso". Las cadenas polipeptídicas recién producidas son insertadas directamente en el RE por el ribosoma que realiza la síntesis vectorial y luego son transportadas a sus destinos, a través de la vía secretora . Los ribosomas ligados generalmente producen proteínas que se utilizan dentro de la membrana plasmática o se expulsan de la célula a través de la exocitosis . [63]
Biogénesis
En las células bacterianas, los ribosomas se sintetizan en el citoplasma a través de la transcripción de múltiples operones de genes ribosómicos . En los eucariotas, el proceso tiene lugar tanto en el citoplasma celular como en el nucléolo , que es una región dentro del núcleo celular . El proceso de ensamblaje implica la función coordinada de más de 200 proteínas en la síntesis y procesamiento de los cuatro ARNr, así como el ensamblaje de esos ARNr con las proteínas ribosómicas. [64]
Origen
El ribosoma puede haberse originado primero como un protorribosoma, [65] posiblemente conteniendo un centro de peptidil transferasa (PTC), en un mundo de ARN , apareciendo como un complejo autorreplicante que solo más tarde desarrolló la capacidad de sintetizar proteínas cuando comenzaron a aparecer los aminoácidos . [66] Los estudios sugieren que los ribosomas antiguos construidos únicamente de ARNr podrían haber desarrollado la capacidad de sintetizar enlaces peptídicos . [67] [68] [69] [70] [71] Además, la evidencia apunta firmemente a los ribosomas antiguos como complejos autorreplicantes, donde el ARNr en los ribosomas tenía propósitos informativos, estructurales y catalíticos porque podría haber codificado ARNt y proteínas necesarias para la autorreplicación ribosómica. [72] Los organismos celulares hipotéticos con ARN autorreplicante pero sin ADN se denominan ribocitos (o ribocélulas). [73] [74]
A medida que los aminoácidos aparecieron gradualmente en el mundo del ARN en condiciones prebióticas, [75] [76] sus interacciones con el ARN catalítico aumentarían tanto el rango como la eficiencia de la función de las moléculas de ARN catalítico. [66] Por lo tanto, la fuerza impulsora para la evolución del ribosoma desde una antigua máquina de autorreplicación a su forma actual como máquina de traducción puede haber sido la presión selectiva para incorporar proteínas a los mecanismos de autorreplicación del ribosoma, a fin de aumentar su capacidad de autorreplicación. [72] [77] [78]
Ribosomas heterogéneos
Los ribosomas son heterogéneos en su composición entre especies e incluso dentro de la misma célula, como lo demuestra la existencia de ribosomas citoplasmáticos y mitocondriales dentro de las mismas células eucariotas. Algunos investigadores han sugerido que la heterogeneidad en la composición de las proteínas ribosómicas en los mamíferos es importante para la regulación genética, es decir , la hipótesis del ribosoma especializado. [79] [80] Sin embargo, esta hipótesis es controvertida y es tema de investigación en curso. [81] [82]
Vince Mauro y Gerald Edelman fueron los primeros en proponer que la heterogeneidad en la composición de los ribosomas estaba involucrada en el control traduccional de la síntesis de proteínas . [83] Propusieron la hipótesis del filtro ribosomal para explicar las funciones reguladoras de los ribosomas. La evidencia ha sugerido que los ribosomas especializados específicos de diferentes poblaciones celulares pueden afectar la forma en que se traducen los genes. [84] Algunas proteínas ribosomales se intercambian del complejo ensamblado con copias citosólicas [85], lo que sugiere que la estructura del ribosoma in vivo se puede modificar sin sintetizar un ribosoma nuevo completo.
Ciertas proteínas ribosómicas son absolutamente críticas para la vida celular mientras que otras no lo son. En la levadura en ciernes , 14/78 proteínas ribosómicas no son esenciales para el crecimiento, mientras que en los humanos esto depende de la célula de estudio. [86] Otras formas de heterogeneidad incluyen modificaciones postraduccionales a las proteínas ribosómicas como la acetilación, metilación y fosforilación. [87] Arabidopsis , [88] [ 89] [90] [91] Los sitios de entrada interna al ribosoma viral (IRES) pueden mediar traducciones por ribosomas compositivamente distintos. Por ejemplo, las unidades ribosómicas 40S sin eS25 en levaduras y células de mamíferos son incapaces de reclutar el IRES del IGR de CrPV . [92]
La heterogeneidad de las modificaciones del ARN ribosómico desempeña un papel importante en el mantenimiento estructural y/o la función y la mayoría de las modificaciones del ARNm se encuentran en regiones altamente conservadas. [93] [94] Las modificaciones más comunes del ARNr son la pseudouridilación y la 2'-O-metilación de la ribosa. [95]
Véase también
- Aminoglucósidos
- Máquinas biológicas
- Modificación postraduccional
- Dinámica de proteínas
- Vesícula asociada al ribosoma
- Estructura terciaria del ARN
- Traducción (genética)
- Par de bases oscilantes
- Ada Yonath : cristalógrafa israelí conocida por su trabajo pionero sobre la estructura del ribosoma, por el que ganó el Premio Nobel .
Referencias
- ^ Konikkat S (febrero de 2016). Los eventos de remodelación dinámica impulsan la eliminación de la secuencia espaciadora ITS2 durante el ensamblaje de las subunidades ribosomales 60S en S. cerevisiae (tesis doctoral). Universidad Carnegie Mellon. Archivado desde el original el 3 de agosto de 2017.
- ^ Weiler EW, Nover L (2008). Allgemeine und Molekulare Botanik (en alemán). Stuttgart: Georg Thieme Verlag. pag. 532.ISBN 9783131527912.
- ^ de la Cruz J, Karbstein K, Woolford JL (2015). "Funciones de las proteínas ribosomales en el ensamblaje de ribosomas eucariotas in vivo". Revisión anual de bioquímica . 84 : 93–129. doi :10.1146/annurev-biochem-060614-033917. PMC 4772166 . PMID 25706898.
- ^ "Traducción citable por naturaleza / traducción de ARN".
- ^ abc Tirumalai MR, Rivas M, Tran Q, Fox GE (noviembre de 2021). "El centro de la peptidil transferasa: una ventana al pasado". Microbiol Mol Biol Rev . 85 (4): e0010421. doi :10.1128/MMBR.00104-21. PMC 8579967 . PMID 34756086.
- ^ Benne R, Sloof P (1987). "Evolución de la maquinaria de síntesis de proteínas mitocondriales". Bio Systems . 21 (1): 51–68. Bibcode :1987BiSys..21...51B. doi :10.1016/0303-2647(87)90006-2. PMID 2446672.
- ^ "Ribosomas". Archivado desde el original el 20 de marzo de 2009. Consultado el 28 de abril de 2011 .
- ^ Palade GE (enero de 1955). "Un pequeño componente particulado del citoplasma". Revista de citología biofísica y bioquímica . 1 (1): 59–68. doi :10.1083/jcb.1.1.59. PMC 2223592 . PMID 14381428.
- ^ Rheinberger, Hans-Jörg (septiembre de 2022). "Una breve historia de la biosíntesis de proteínas y la investigación de los ribosomas". Reuniones de premios Nobel de Lindau . Consultado el 16 de agosto de 2023 .
- ^ Roberts RB, ed. (1958). "Introducción". Partículas microsomales y síntesis de proteínas. Nueva York: Pergamon Press, Inc.
- ^ "El Premio Nobel de Fisiología o Medicina 1974". Nobelprize.org . La Fundación Nobel. Archivado desde el original el 26 de enero de 2013 . Consultado el 10 de diciembre de 2012 .
- ^ «Premio Nobel de Química 2009». Fundación Nobel. Archivado desde el original el 28 de abril de 2012. Consultado el 10 de diciembre de 2012 .
- ^ Kurland CG (1960). "Caracterización molecular del ácido ribonucleico de los ribosomas de Escherichia coli". Revista de biología molecular . 2 (2): 83–91. doi :10.1016/s0022-2836(60)80029-0.
- ^ Wilson DN, Doudna Cate JH (mayo de 2012). "La estructura y función del ribosoma eucariota". Cold Spring Harbor Perspectives in Biology . 4 (5): a011536. doi :10.1101/cshperspect.a011536. PMC 3331703 . PMID 22550233.
- ^ Nissen P, Hansen J, Ban N, Moore PB, Steitz TA (agosto de 2000). "La base estructural de la actividad del ribosoma en la síntesis de enlaces peptídicos" (PDF) . Science . 289 (5481): 920–30. Bibcode :2000Sci...289..920N. doi :10.1126/science.289.5481.920. PMID 10937990. S2CID 8370119. Archivado desde el original (PDF) el 2020-11-30.
- ^ ab Wimberly BT, Brodersen DE, Clemons WM, Morgan-Warren RJ, Carter AP, Vonrhein C, Hartsch T, Ramakrishnan V (septiembre de 2000). "Estructura de la subunidad ribosomal 30S". Nature . 407 (6802): 327–39. Bibcode :2000Natur.407..327W. doi :10.1038/35030006. PMID 11014182. S2CID 4419944.
- ^ abcdefg Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2002). "Los ribosomas unidos a la membrana definen el retículo endoplásmico rugoso". Biología molecular de la célula (4.ª ed.). Nueva York: Garland Science. pág. 342. ISBN 978-0-8153-4072-0.
- ^ ab Garrett R, Grisham CM (2009). Bioquímica (4.ª ed.). Servicios de aprendizaje de Cengage. ISBN 978-0-495-11464-2.
- ^ Collatz E, Küchler E, Stöffler G, Czernilofsky AP (abril de 1976). "El sitio de reacción en la proteína ribosomal L27 con un derivado de etiqueta de afinidad del ARNt Met f". FEBS Letters . 63 (2): 283–6. doi : 10.1016/0014-5793(76)80112-3 . PMID 770196.
- ^ Czernilofsky AP, Collatz EE, Stöffler G, Kuechler E (enero de 1974). "Proteínas en los sitios de unión del ARNt de los ribosomas de Escherichia coli". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 71 (1): 230–4. Bibcode :1974PNAS...71..230C. doi : 10.1073/pnas.71.1.230 . PMC 387971 . PMID 4589893.
- ^ Czernilofsky AP, Kurland CG, Stöffler G (octubre de 1975). "Proteínas ribosomales 30S asociadas con el extremo 3' del ARN 16S". FEBS Letters . 58 (1): 281–4. doi : 10.1016/0014-5793(75)80279-1 . PMID 1225593.
- ^ Cullen KE (2009). "Archaeal Ribosomes". Encyclopedia of Life Science . Nueva York: Facts On File. págs. 1–5. doi :10.1002/9780470015902.a0000293.pub3. ISBN 9780470015902.S2CID243730576 .
- ^ Tirumalai MR, Anane-Bediakoh D, Rajesh R, Fox GE (noviembre de 2021). "Las cargas netas de las proteínas ribosomales de los grupos S10 y spc de halófilos están inversamente relacionadas con el grado de halotolerancia". Microbiol. Spectr . 9 (3): e0178221. doi :10.1128/spectrum.01782-21. PMC 8672879. PMID 34908470 .
- ^ Wang J, Dasgupta I, Fox GE (28 de abril de 2009). "Muchas proteínas ribosomales arqueales no universales se encuentran en grupos de genes conservados". Archaea . 2 (4): 241–51. doi : 10.1155/2009/971494 . PMC 2686390 . PMID 19478915.
- ^ abc Ben-Shem A, Garreau de Loubresse N, Melnikov S, Jenner L, Yusupova G, Yusupov M (diciembre de 2011). "La estructura del ribosoma eucariota con una resolución de 3,0 Å". Science . 334 (6062): 1524–9. Bibcode :2011Sci...334.1524B. doi : 10.1126/science.1212642 . PMID 22096102. S2CID 9099683.
- ^ ab Rabl J, Leibundgut M, Ataide SF, Haag A, Ban N (febrero de 2011). "Estructura cristalina de la subunidad ribosomal eucariota 40S en complejo con el factor de iniciación 1" (PDF) . Science . 331 (6018): 730–6. Bibcode :2011Sci...331..730R. doi :10.1126/science.1198308. hdl : 20.500.11850/153130 . PMID 21205638. S2CID 24771575.
- ^ ab Klinge S, Voigts-Hoffmann F, Leibundgut M, Arpagaus S, Ban N (noviembre de 2011). "Estructura cristalina de la subunidad ribosomal eucariota 60S en complejo con el factor de iniciación 6". Science . 334 (6058): 941–8. Bibcode :2011Sci...334..941K. doi :10.1126/science.1211204. PMID 22052974. S2CID 206536444.
- ^ Fabijanski S, Pellegrini M (1977). "Identificación de proteínas en el sitio de unión del peptidil-ARNt de los ribosomas del hígado de rata". Genética molecular y general . 184 (3): 551–6. doi :10.1007/BF00431588. PMID 6950200. S2CID 9751945.
- ^ Agrawal RK, Sharma MR (diciembre de 2012). "Aspectos estructurales del aparato de traducción mitocondrial". Current Opinion in Structural Biology . 22 (6): 797–803. doi :10.1016/j.sbi.2012.08.003. PMC 3513651 . PMID 22959417.
- ^ Sharma MR, Booth TM, Simpson L, Maslov DA, Agrawal RK (junio de 2009). "Estructura de un ribosoma mitocondrial con ARN mínimo". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 106 (24): 9637–42. Bibcode :2009PNAS..106.9637S. doi : 10.1073/pnas.0901631106 . PMC 2700991 . PMID 19497863.
- ^ Waltz F, Nguyen TT, Arrivé M, Bochler A, Chicher J, Hammann P, Kuhn L, Quadrado M, Mireau H, Hashem Y, Giegé P (enero de 2019). "Lo pequeño es grande en el ribosoma mitocondrial de Arabidopsis". Nature Plants . 5 (1): 106–117. doi :10.1038/s41477-018-0339-y. PMID 30626926. S2CID 58004990.
- ^ Archibald JM, Lane CE (2009). "Se va, se va, pero no se ha ido del todo: los nucleomorfos como caso de estudio en la reducción del genoma nuclear". The Journal of Heredity . 100 (5): 582–90. doi : 10.1093/jhered/esp055 . PMID 19617523.
- ^ "Estructuras internas especializadas de los procariotas | Microbiología sin límites". courses.lumenlearning.com . Consultado el 24 de septiembre de 2021 .
- ^ Recht MI, Douthwaite S, Puglisi JD (junio de 1999). "Base para la especificidad procariota de la acción de los antibióticos aminoglucósidos". The EMBO Journal . 18 (11): 3133–8. doi :10.1093/emboj/18.11.3133. PMC 1171394 . PMID 10357824.
- ^ O'Brien TW (mayo de 1971). "La presencia general de ribosomas 55 S en mitocondrias de hígado de mamíferos". The Journal of Biological Chemistry . 246 (10): 3409–17. doi : 10.1016/S0021-9258(18)62239-2 . PMID 4930061.
- ^ "Supresión de la médula ósea inducida por cloranfenicol". JAMA . 213 (7): 1183–1184. 1970-08-17. doi :10.1001/jama.1970.03170330063011. ISSN 0098-7484. PMID 5468266.
- ^ Newman SM, Boynton JE, Gillham NW, Randolph-Anderson BL, Johnson AM, Harris EH (diciembre de 1990). "Transformación de genes de ARN ribosómico de cloroplastos en Chlamydomonas: caracterización molecular y genética de eventos de integración". Genética . 126 (4): 875–88. doi :10.1093/genetics/126.4.875. PMC 1204285 . PMID 1981764.
- ^ Penev PI, Fakhretaha-Aval S, Patel VJ, Cannone JJ, Gutell RR, Petrov AS, Williams LD, Glass JB (agosto de 2020). "Segmentos de expansión de ARN ribosómico de gran tamaño en arqueas de Asgard". Genome Biology and Evolution . 12 (10): 1694–1710. doi : 10.1093/gbe/evaa170 . PMC 7594248 . PMID 32785681.
- ^ ab Ban N, Nissen P, Hansen J, Moore PB, Steitz TA (agosto de 2000). "La estructura atómica completa de la subunidad ribosomal grande con una resolución de 2,4 A". Science . 289 (5481): 905–20. Bibcode :2000Sci...289..905B. CiteSeerX 10.1.1.58.2271 . doi :10.1126/science.289.5481.905. PMID 10937989.
- ^ Schluenzen F, Tocilj A, Zarivach R, Harms J, Gluehmann M, Janell D, Bashan A, Bartels H, Agmon I, Franceschi F, Yonath A (septiembre de 2000). "Estructura de la subunidad ribosomal pequeña funcionalmente activada a una resolución de 3,3 angstroms". Cell . 102 (5): 615–23. doi : 10.1016/S0092-8674(00)00084-2 . PMID 11007480. S2CID 1024446.
- ^ Yusupov MM, Yusupova GZ, Baucom A, Lieberman K, Earnest TN, Cate JH, Noller HF (mayo de 2001). "Estructura cristalina del ribosoma a una resolución de 5,5 A". Science . 292 (5518): 883–96. Bibcode :2001Sci...292..883Y. doi : 10.1126/science.1060089 . PMID 11283358. S2CID 39505192.
- ^ Schuwirth BS, Borovinskaya MA, Hau CW, Zhang W, Vila-Sanjurjo A, Holton JM, Cate JH (noviembre de 2005). "Estructuras del ribosoma bacteriano con una resolución de 3,5 A". Science . 310 (5749): 827–34. Bibcode :2005Sci...310..827S. doi :10.1126/science.1117230. PMID 16272117. S2CID 37382005.
- ^ Mitra K, Schaffitzel C, Shaikh T, Tama F, Jenni S, Brooks CL, Ban N, Frank J (noviembre de 2005). "Estructura del canal conductor de proteínas de E. coli unido a un ribosoma traductor". Nature . 438 (7066): 318–24. Bibcode :2005Natur.438..318M. doi :10.1038/nature04133. PMC 1351281 . PMID 16292303.
- ^ Selmer M, Dunham CM, Murphy FV, Weixlbaumer A, Petry S, Kelley AC, Weir JR, Ramakrishnan V (septiembre de 2006). "Estructura del ribosoma 70S en complejo con ARNm y ARNt". Science . 313 (5795): 1935–42. Bibcode :2006Sci...313.1935S. doi :10.1126/science.1131127. PMID 16959973. S2CID 9737925.
- ^ Korostelev A, Trakhanov S, Laurberg M, Noller HF (septiembre de 2006). "La estructura cristalina de un complejo ribosoma 70S-ARNt revela interacciones y reordenamientos funcionales". Cell . 126 (6): 1065–77. doi : 10.1016/j.cell.2006.08.032 . PMID 16962654. S2CID 13452915.
- ^ Yusupova G, Jenner L, Rees B, Moras D, Yusupov M (noviembre de 2006). "Base estructural del movimiento del ARN mensajero en el ribosoma". Nature . 444 (7117): 391–4. Bibcode :2006Natur.444..391Y. doi :10.1038/nature05281. PMID 17051149. S2CID 4419198.
- ^ ab "Estructuras internas especializadas de los procariotas". courses.lumenlearning.com . Boundless Microbiology . Consultado el 27 de septiembre de 2018 .
- ^ Lafontaine, D.; Tollervey, D. (2001). "La función y síntesis de los ribosomas". Nat Rev Mol Cell Biol . 2 (7): 514–520. doi :10.1038/35080045. hdl : 1842/729 . PMID 11433365. S2CID 2637106.
- ^ Savir Y, Tlusty T (abril de 2013). "El ribosoma como decodificador óptimo: una lección de reconocimiento molecular". Cell . 153 (2): 471–479. Bibcode :2013APS..MARY46006T. doi : 10.1016/j.cell.2013.03.032 . PMID 23582332.
- ^ Korkmaz G, Sanyal S (septiembre de 2017). "Escherichia coli". Revista de química biológica . 292 (36): 15134–15142. doi : 10.1074/jbc.M117.785238 . PMC 5592688 . PMID 28743745.
- ^ Konevega AL, Soboleva NG, Makhno VI, Semenkov YP, Wintermeyer W, Rodnina MV, Katunin VI (enero de 2004). "Las bases de purina en la posición 37 del ARNt estabilizan la interacción codón-anticodón en el sitio A del ribosoma mediante apilamiento e interacciones dependientes de Mg2+". ARN . 10 (1): 90–101. doi :10.1261/rna.5142404. PMC 1370521 . PMID 14681588.
- ^ Rodnina MV, Beringer M, Wintermeyer W (enero de 2007). "Cómo los ribosomas forman enlaces peptídicos". Tendencias en ciencias bioquímicas . 32 (1): 20–26. doi :10.1016/j.tibs.2006.11.007. PMID 17157507.
- ^ Cech, TR (agosto de 2000). "Biología estructural. El ribosoma es una ribozima". Science . 289 (5481): 878–879. doi :10.1126/science.289.5481.878. PMID 10960319. S2CID 24172338.
- ^ Banerjee D, Sanyal S (octubre de 2014). "Actividad de plegamiento de proteínas del ribosoma (PFAR): un objetivo para los compuestos antipriónicos". Viruses . 6 (10): 3907–3924. doi : 10.3390/v6103907 . PMC 4213570 . PMID 25341659.
- ^ Fedorov AN, Baldwin TO (diciembre de 1997). "Plegamiento de proteínas cotraduccional". The Journal of Biological Chemistry . 272 (52): 32715–32718. doi : 10.1074/jbc.272.52.32715 . PMID 9407040.
- ^ Baldwin RL (junio de 1975). "Intermediarios en las reacciones de plegamiento de proteínas y el mecanismo del plegamiento de proteínas". Revisión anual de bioquímica . 44 (1): 453–475. doi :10.1146/annurev.bi.44.070175.002321. PMID 1094916.
- ^ Das D, Das A, Samanta D, Ghosh J, Dasgupta S, Bhattacharya A, Basu A, Sanyal S, Das Gupta C (agosto de 2008). "El papel del ribosoma en el plegamiento de proteínas" (PDF) . Biotechnology Journal . 3 (8): 999–1009. doi :10.1002/biot.200800098. PMID 18702035.
- ^ Dabrowski-Tumanski P, Piejko M, Niewieczerzal S, Stasiak A, Sulkowska JI (diciembre de 2018). "Anudamiento de proteínas mediante enhebrado activo de la cadena polipeptídica naciente que sale del canal de salida del ribosoma". The Journal of Physical Chemistry B . 122 (49): 11616–11625. doi :10.1021/acs.jpcb.8b07634. PMID 30198720. S2CID 52176392.
- ^ Brandman O, Stewart-Ornstein J, Wong D, Larson A, Williams CC, Li GW, Zhou S, King D, Shen PS, Weibezahn J, Dunn JG, Rouskin S, Inada T, Frost A, Weissman JS (noviembre de 2012). "Un complejo de control de calidad unido a ribosomas desencadena la degradación de péptidos nacientes y señala el estrés de la traducción". Cell . 151 (5): 1042–1054. doi :10.1016/j.cell.2012.10.044. PMC 3534965 . PMID 23178123.
- ^ Defenouillère Q, Yao Y, Mouaikel J, Namane A, Galopier A, Decourty L, Doyen A, Malabat C, Saveanu C, Jacquier A, Fromont-Racine M (marzo de 2013). "El complejo asociado a Cdc48 unido a partículas 60S es necesario para la eliminación de productos de traducción aberrantes". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 110 (13): 5046–5051. Bibcode :2013PNAS..110.5046D. doi : 10.1073/pnas.1221724110 . PMC 3612664 . PMID 23479637.
- ^ Shen PS, Park J, Qin Y, Li X, Parsawar K, Larson MH, Cox J, Cheng Y, Lambowitz AM, Weissman JS, Brandman O, Frost A (enero de 2015). "Síntesis de proteínas. Las subunidades ribosomales Rqc2p y 60S median la elongación independiente del ARNm de las cadenas nacientes". Science . 347 (6217): 75–78. Bibcode :2015Sci...347...75S. doi :10.1126/science.1259724. PMC 4451101 . PMID 25554787.
- ^ Keeley, J.; Gutnikoff, R. (2 de enero de 2015). «Los estudios sobre los ribosomas revelan un nuevo mecanismo de síntesis proteica» (Nota de prensa). Instituto Médico Howard Hughes . Archivado desde el original el 12 de enero de 2015. Consultado el 16 de enero de 2015 .
- ^ Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2002). "Los ribosomas unidos a la membrana definen el retículo endoplásmico rugoso". Biología molecular de la célula (4.ª ed.). Nueva York: Garland Science. ISBN 978-0-8153-4072-0.
- ^ Kressler, Dieter; Hurt, Ed; Babler, Jochen (2009). "Impulsando el ensamblaje de ribosomas" (PDF) . Biochimica et Biophysica Acta (BBA) - Molecular Cell Research . 1803 (6): 673–683. doi :10.1016/j.bbamcr.2009.10.009. PMID 19879902.
- ^ Dance, Amber (28 de febrero de 2023). "¿Cómo empezó la vida? Se está descubriendo un ingrediente clave: un equipo de científicos ganadores del premio Nobel ha dado un gran paso adelante en su búsqueda para reconstruir un ARN de la Tierra primitiva capaz de construir proteínas". Nature . 615 (7950): 22–25. doi : 10.1038/d41586-023-00574-4 . PMID 36854922.
- ^ ab Noller HF (abril de 2012). "Evolución de la síntesis de proteínas a partir de un mundo de ARN". Cold Spring Harbor Perspectives in Biology . 4 (4): a003681. doi :10.1101/cshperspect.a003681. PMC 3312679 . PMID 20610545.
- ^ Dabbs ER (1986). Estudios de mutantes en el ribosoma procariota . Nueva York: Springer-Verlag.
- ^ Noller HF, Hoffarth V, Zimniak L (junio de 1992). "Resistencia inusual de la peptidil transferasa a los procedimientos de extracción de proteínas". Science . 256 (5062): 1416–9. Bibcode :1992Sci...256.1416N. doi :10.1126/science.1604315. PMID 1604315.
- ^ Nomura M, Mizushima S, Ozaki M, Traub P, Lowry CV (1969). "Estructura y función de los ribosomas y sus componentes moleculares". Simposios de Cold Spring Harbor sobre biología cuantitativa . 34 : 49–61. doi :10.1101/sqb.1969.034.01.009. PMID 4909519.
- ^ Krupkin M, Matzov D, Tang H, Metz M, Kalaora R, Belousoff MJ, Zimmerman E, Bashan A, Yonath A (octubre de 2011). "Un vestigio de una máquina de unión prebiótica está funcionando dentro del ribosoma contemporáneo". Phil. Trans. R. Soc. B. 366 ( 1580): 2972–8. doi :10.1098/rstb.2011.0146. PMC 3158926. PMID 21930590 .
- ^ Bose T, Fridkin G, Davidovich C, Krupkin M, Dinger N, Falkovich AH, Peleg Y, Agmon I, Bashan A, Yonat A (febrero de 2022). "Origen de la vida: el protorribosoma forma enlaces peptídicos y une mundos dominados por ARN y proteínas". Nucleic Acids Res . 50 (4): 1815–1828. doi :10.1093/nar/gkac052. PMC 8886871 . PMID 35137169.
- ^ ab Root-Bernstein M, Root-Bernstein R (febrero de 2015). "El ribosoma como eslabón perdido en la evolución de la vida". Journal of Theoretical Biology . 367 : 130–158. doi : 10.1016/j.jtbi.2014.11.025 . PMID 25500179.
- ^ Yarus M (2002). "Genética primordial: fenotipo del ribosoma". Revista Anual de Genética . 36 : 125–51. doi :10.1146/annurev.genet.36.031902.105056. PMID 12429689.
- ^ Forterre P, Krupovic M (2012). "El origen de los viriones y las virocélulas: la hipótesis del escape revisada". Virus: agentes esenciales de la vida . págs. 43–60. doi :10.1007/978-94-007-4899-6_3. ISBN 978-94-007-4898-9.
- ^ Caetano-Anollés G, Seufferheld MJ (2013). "Las raíces coevolutivas de la bioquímica y la organización celular desafían el paradigma del mundo del ARN". Journal of Molecular Microbiology and Biotechnology . 23 (1–2): 152–77. doi :10.1159/000346551. PMID 23615203. S2CID 41725226.
- ^ Saladino R, Botta G, Pino S, Costanzo G, Di Mauro E (agosto de 2012). "¿Primero la genética o primero el metabolismo? La pista de la formamida". Chemical Society Reviews . 41 (16): 5526–65. doi :10.1039/c2cs35066a. hdl :11573/494138. PMID 22684046.
- ^ Fox GE (septiembre de 2010). "Origen y evolución del ribosoma". Cold Spring Harb Perspect Biol . 2 (9): a003483. doi : 10.1101/cshperspect.a003483 . PMC 2926754 . PMID 20534711.
- ^ Fox GE (2016). "Orígenes y evolución temprana del ribosoma". En Hernández G, Jagus R (eds.). Evolución de la maquinaria de síntesis de proteínas y su regulación. Suiza: Springer, Cham. pp. 31–60. doi :10.1007/978-3-319-39468-8. ISBN 978-3-319-39468-8. Número de identificación del sujeto 27493054.
- ^ Shi Z, Fujii K, Kovary KM, Genuth NR, Röst HL, Teruel MN, Barna M (julio de 2017). "Los ribosomas heterogéneos traducen preferentemente distintos subgrupos de ARNm en todo el genoma". Molecular Cell . 67 (1). Elsevier BV: 71–83.e7. doi : 10.1016/j.molcel.2017.05.021 . PMC 5548184 . PMID 28625553.
- ^ Xue S, Barna M (mayo de 2012). "Ribosomas especializados: una nueva frontera en la regulación genética y la biología de los organismos". Nature Reviews. Biología celular molecular . 13 (6). Springer Science and Business Media LLC: 355–369. doi :10.1038/nrm3359. PMC 4039366. PMID 22617470 .
- ^ Ferretti MB, Karbstein K (mayo de 2019). "¿Realmente existe la especialización funcional de los ribosomas?". ARN . 25 (5). Laboratorio Cold Spring Harbor: 521–538. doi : 10.1261/rna.069823.118 . PMC 6467006 . PMID 30733326.
- ^ Farley-Barnes KI, Ogawa LM, Baserga SJ (octubre de 2019). "Ribosomopatías: viejos conceptos, nuevas controversias". Tendencias en genética . 35 (10). Elsevier BV: 754–767. doi :10.1016/j.tig.2019.07.004. PMC 6852887 . PMID 31376929.
- ^ Mauro VP, Edelman GM (septiembre de 2002). "La hipótesis del filtro de ribosomas". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 99 (19): 12031–6. Bibcode :2002PNAS...9912031M. doi : 10.1073/pnas.192442499 . PMC 129393 . PMID 12221294.
- ^ Xue S, Barna M (mayo de 2012). "Ribosomas especializados: una nueva frontera en la regulación genética y la biología organismal". Nature Reviews. Biología celular molecular . 13 (6): 355–69. doi :10.1038/nrm3359. PMC 4039366. PMID 22617470 .
- ^ Mathis AD, Naylor BC, Carson RH, Evans E, Harwell J, Knecht J, Hexem E, Peelor FF, Miller BF, Hamilton KL, Transtrum MK, Bikman BT, Price JC (febrero de 2017). "Mecanismos de cambio de mantenimiento de ribosomas in vivo en respuesta a señales de nutrientes". Proteómica molecular y celular . 16 (2): 243–254. doi : 10.1074/mcp.M116.063255 . PMC 5294211 . PMID 27932527.
- ^ Steffen KK, McCormick MA, Pham KM, MacKay VL, Delaney JR, Murakami CJ, et al. (mayo de 2012). "La deficiencia de ribosomas protege contra el estrés del RE en Saccharomyces cerevisiae". Genética . 191 (1). Sociedad de Genética de América: 107–118. doi :10.1534/genetics.111.136549. PMC 3338253 . PMID 22377630.
- ^ Lee SW, Berger SJ, Martinović S, Pasa-Tolić L, Anderson GA, Shen Y, et al. (abril de 2002). "Análisis espectrométrico de masas directo de proteínas intactas de la subunidad ribosomal grande de levadura utilizando LC/FTICR capilar". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 99 (9): 5942–5947. Bibcode :2002PNAS...99.5942L. doi : 10.1073/pnas.082119899 . PMC 122881 . PMID 11983894.
- ^ Carroll AJ, Heazlewood JL, Ito J, Millar AH (febrero de 2008). "El análisis del proteoma del ribosoma citosólico de Arabidopsis proporciona información detallada sobre sus componentes y su modificación postraduccional". Molecular & Cellular Proteomics . 7 (2): 347–369. doi : 10.1074/mcp.m700052-mcp200 . PMID 17934214.
- ^ Odintsova TI, Müller EC, Ivanov AV, Egorov TA, Bienert R, Vladimirov SN, et al. (abril de 2003). "Caracterización y análisis de modificaciones postraduccionales de las proteínas de la subunidad ribosomal citoplasmática grande humana mediante espectrometría de masas y secuenciación de Edman". Journal of Protein Chemistry . 22 (3): 249–258. doi :10.1023/a:1025068419698. PMID 12962325. S2CID 10710245.
- ^ Yu Y, Ji H, Doudna JA, Leary JA (junio de 2005). "Análisis espectrométrico de masas de la subunidad ribosomal humana 40S: complejos nativos y unidos a IRES del VHC". Protein Science . 14 (6): 1438–1446. doi :10.1110/ps.041293005. PMC 2253395 . PMID 15883184.
- ^ Zeidan Q, Wang Z, De Maio A, Hart GW (junio de 2010). "Las enzimas de ciclado de O-GlcNAc se asocian con la maquinaria de traducción y modifican las proteínas ribosomales centrales". Biología molecular de la célula . 21 (12): 1922–1936. doi :10.1091/mbc.e09-11-0941. PMC 2883937 . PMID 20410138.
- ^ Landry DM, Hertz MI, Thompson SR (diciembre de 2009). "RPS25 es esencial para la iniciación de la traducción por parte de Dicistroviridae y los IRES virales de la hepatitis C". Genes & Development . 23 (23): 2753–2764. doi :10.1101/gad.1832209. PMC 2788332 . PMID 19952110.
- ^ Decatur WA, Fournier MJ (julio de 2002). "Modificaciones del ARNr y función del ribosoma". Tendencias en ciencias bioquímicas . 27 (7): 344–51. doi :10.1016/s0968-0004(02)02109-6. PMID 12114023.
- ^ Natchiar SK, Myasnikov AG, Kratzat H, Hazemann I, Klaholz BP (noviembre de 2017). "Visualización de modificaciones químicas en la estructura del ribosoma 80S humano". Nature . 551 (7681): 472–477. Bibcode :2017Natur.551..472N. doi :10.1038/nature24482. PMID 29143818. S2CID 4465175.
- ^ Guo H (agosto de 2018). "Ribosomas especializados y el control de la traducción". Biochemical Society Transactions . 46 (4): 855–869. doi :10.1042/BST20160426. PMID 29986937. S2CID 51609077.
Enlaces externos
- La computadora del laboratorio simula el ribosoma en movimiento
- Función del ribosoma, Gwen V. Childs, copiado aquí
- Ribosoma en Proteopedia: la enciclopedia libre y colaborativa en 3D de proteínas y otras moléculas
- Familias de proteínas ribosomales en ExPASy Archivado el 30 de abril de 2011 en Wayback Machine.
- Molécula del mes Archivado el 27 de octubre de 2009 en Wayback Machine © RCSB Protein Data Bank:
- Ribosoma Archivado el 14 de noviembre de 2010 en Wayback Machine.
- Factores de elongación Archivado el 16 de marzo de 2011 en Wayback Machine.
- Palada
- Estructuras de ribosomas obtenidas mediante microscopía electrónica 3D en el Banco de Datos de Microscopía Electrónica (EMDB)
 Este artículo incorpora material de dominio público de Science Primer. NCBI . Archivado desde el original el 8 de diciembre de 2009.
Este artículo incorpora material de dominio público de Science Primer. NCBI . Archivado desde el original el 8 de diciembre de 2009.
