Pseudouridina
 | |
| Nombres | |
|---|---|
| Nombre IUPAC 5-(β- D -Ribofuranosil)pirimidina-2,4(1 H ,3 H )-diona | |
| Nombre sistemático de la IUPAC 5-[(2 S ,3 R ,4 S ,5 R )-3,4-Dihidroxi-5-(hidroximetil)oxolan-2-il]pirimidina-2,4(1 H ,3 H )-diona | |
| Otros nombres psi-Uridina, 5-Ribosiluracilo, beta-D-Pseudouridina, 5-(beta-D-Ribofuranosil)uracilo | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| 32779 | |
| EBICh | |
| Química biológica |
|
| Araña química | |
| BARRIL |
|
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C9H12N2O6 | |
| Masa molar | 244,20 g/mol |
| Apariencia | Polvo granulado blanco |
| Altamente soluble en agua. | |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
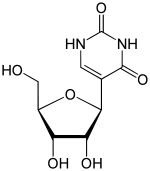
La pseudouridina ( 5-ribosiluracilo , abreviado con la letra griega psi- Ψ ) [1] es un isómero del nucleósido uridina en el que el uracilo está unido a través de un enlace glicosídico carbono-carbono en lugar de nitrógeno-carbono .
La pseudouridina es la modificación de ARN más abundante en el ARN celular . [2] Después de la transcripción y la síntesis, el ARN se puede modificar con más de 100 modificaciones químicamente distintas. Estas pueden regular potencialmente la expresión del ARN postranscripcionalmente, además de los cuatro nucleótidos estándar y desempeñan una variedad de funciones en la célula, incluida la traducción, la localización y la estabilización del ARN. La pseudouridina, siendo una de ellas, es el isómero glicósido C5 de la uridina que contiene un enlace CC entre C1 del azúcar ribosa y C5 del uracilo , en lugar del enlace C1-N1 habitual que se encuentra en la uridina. La uridina se convierte en pseudouridina rotando la molécula de uridina 180° a través de su eje N3-C6. [3] El enlace CC le da más libertad rotacional y flexibilidad conformacional. [4] Además, la pseudouridina tiene un donante de enlace de hidrógeno adicional en la posición N1.
La pseudouridina es un componente ubicuo del ARN estructural ( de transferencia , ribosómico , nuclear pequeño (snRNA) y nucleolar pequeño ), y está presente en el ARN codificante, en los tres dominios filogenéticos de la vida y fue la primera en descubrirse. Representa el 4% de los nucleótidos en el ARNt de levadura . [5] Esta modificación de bases es capaz de estabilizar el ARN y mejorar el apilamiento de bases formando enlaces de hidrógeno adicionales con agua a través de su grupo imino adicional. [6] Hay 11 pseudouridinas en el ARNr de Escherichia coli , 30 en el ARNr citoplasmático de levadura y una única modificación en el ARNr 21S mitocondrial y alrededor de 100 pseudouridinas en el ARNr humano, lo que indica que el grado de pseudouridilación aumenta con la complejidad de un organismo. [7] La pseudouridina también se detectó en el genoma de Leishmania donovani . Se detectaron 18 sitios de modificación de pseudouridina en el sitio de entrada de la peptidil transferasa y en el túnel de entrada del ARNm durante la traducción de proteínas. Estas modificaciones en el parásito conducen a un aumento de la síntesis de proteínas y de la tasa de crecimiento. [8]
Se ha demostrado que la pseudouridina en ARNr y ARNt ajusta y estabiliza la estructura regional y ayuda a mantener sus funciones en la decodificación de ARNm, el ensamblaje de ribosomas, el procesamiento y la traducción. [4] [9] [10] Se ha demostrado que la pseudouridina en ARNpn mejora la interacción ARN espliceosómico -pre-ARNm para facilitar la regulación del empalme. [11]

Efectos y modificaciones sobre diferentes ARN
ARNt

Pseudouridina = Ψ
Ψ es omnipresente en esta clase de ARN y facilita motivos estructurales comunes de ARNt . Uno de estos motivos estructurales es el tallo-bucle TΨC que incorpora Ψ55. Ψ se encuentra comúnmente en el tallo D y en el tallo-bucle anticodón de ARNt de cada dominio. En cada motivo estructural, las propiedades fisicoquímicas únicas de Ψ estabilizan estructuras que no serían posibles con el U estándar. [4]
Durante la traducción, Ψ modula las interacciones de las moléculas de ARNt con ARNr y ARNm . Ψ y otros nucleótidos modificados afectan la estructura local de los dominios de ARNt en los que se encuentran sin afectar el plegamiento general del ARN. En el bucle de tallo anticodón (ASL), Ψ parece ser crítico para la unión adecuada de los ARNt al ribosoma. Ψ estabiliza la estructura dinámica del ASL y promueve una unión más fuerte al ribosoma 30S. La conformación estabilizada del ASL ayuda a mantener los emparejamientos correctos anticodón - codón durante la traducción. Esta estabilidad puede aumentar la precisión de la traducción al disminuir la tasa de formación de enlaces peptídicos y permitir más tiempo para que se rechacen los pares codón-anticodón incorrectos. A pesar del papel de Ψ en la estabilización de la estructura local, la pseudouridilación del ARNt no es esencial para la viabilidad celular y generalmente no se requiere para la aminoacilación . [4]
ARNm
Ψ también se encuentra en los ARNm que son la plantilla para la síntesis de proteínas. Los residuos Ψ en el ARNm pueden afectar la especificidad de codificación de los codones de terminación UAA, UGA y UAG. En estos codones de terminación, tanto una modificación U→Ψ como una mutación U→C promueven la supresión de sinsentido. [12] En la vacuna contra el SARS-CoV2 de BioNTech/Pfizer, también conocida como BNT162b2 , tozinameran o Comirnaty, todas las U se han sustituido por N1-metilpseudouridina , [13] un nucleósido relacionado con Ψ que contiene un grupo metilo añadido al átomo N1.
ARNr
Ψ se encuentra en las subunidades ribosómicas grandes y pequeñas de todos los dominios de la vida y sus orgánulos . En el ribosoma, los residuos Ψ se agrupan en los dominios II, IV y V y estabilizan las interacciones ARN-ARN y/o ARN-proteína. La estabilidad proporcionada por Ψ puede ayudar al plegamiento del ARNr y al ensamblaje de los ribosomas. Ψ también puede influir en la estabilidad de las estructuras locales que afectan la velocidad y la precisión de la decodificación y la corrección durante la traducción. [4]
ARNnp
El Ψ se encuentra en los principales ARNsn espliceosomales de los eucariotas. Los residuos Ψ en los ARNsn suelen estar conservados filogenéticamente, pero presentan algunas variaciones entre taxones y organismos. Los residuos Ψ en los ARNsn normalmente se encuentran en regiones que participan en interacciones ARN-ARN y/o ARN-proteína implicadas en el ensamblaje y la función del espliceosoma. Los residuos Ψ en los ARNsn contribuyen al plegamiento y ensamblaje adecuados del espliceosoma, lo que es esencial para el procesamiento del pre-ARNm. [4]
Sintetasas
Las pseudouridinas son modificaciones del ARN que se realizan después de la transcripción , es decir, después de que se forma el ARN [ cita requerida ] . Las proteínas que realizan esta modificación se denominan pseudouridina sintasas (PUS) y se encuentran en todos los reinos de la vida. La mayor parte de la investigación se ha realizado sobre cómo las PUS modifican el ARNt, por lo que los mecanismos que involucran al ARNsn y al ARNm no están claramente definidos. Las PUS pueden variar en la especificidad del ARN, la estructura y los mecanismos de isomerización . Las diferentes estructuras de las PUS se dividen en cinco familias que comparten la secuencia activa y motivos estructurales importantes. [1]
Verdadero
El dominio TruA modifica una variedad de lugares diferentes en ARNt, ARNsn y ARNm. El mecanismo de isomerización de la uridina todavía se discute en esta familia. [10] [14]

La PUS 1 se encuentra en el núcleo y modifica el ARNt en diferentes lugares, U44 del ARNm pequeño U2 y U28 del ARNm pequeño U6. Los estudios han demostrado que la expresión de PUS 1 aumenta durante el estrés ambiental y es importante para regular el empalme del ARN. Además, la PUS 1 es necesaria para tomar el ARNt producido en el núcleo y enviarlo al citoplasma. [10]
La PUS 2 es muy similar a la PUS 1, pero se encuentra en la mitocondria y solo modifica U27 y U28 del ARNt mitocondrial. Esta proteína modifica el ARNt mitocondrial, que tiene una menor cantidad de modificaciones de pseudouridina en comparación con otros ARNt. A diferencia de la mayoría de las proteínas ubicadas en la mitocondria, no se ha encontrado que la PUS 2 tenga una señal de orientación mitocondrial o MTS. [10]
PUS 3 es un homólogo de PUS 1, pero modifica diferentes lugares del ARNt (U38/39) en el citoplasma y la mitocondria. Esta proteína es la más conservada de la familia TruA. Se encontró una disminución en las modificaciones realizadas por PUS 3 cuando la estructura del ARNt se plegó incorrectamente. Junto con el ARNt, la proteína se dirige al ARNnc y al ARNm; aún se necesita más investigación en cuanto a la importancia de esta modificación. PUS 3 junto con PUS 1 modifican el receptor activador de esteroides en humanos. [10]
Truco
La familia TruB solo contiene PUS 4, que se encuentra en la mitocondria y el núcleo. La modificación de PUS 4 está muy conservada y se encuentra en la región U55 del codo del ARNt. La forma humana de PUS 4 carece de un dominio de unión llamado PUA o pseudouridina sintasa y arqueosina transglicosilasa. PUS 4 tiene una especificidad de secuencia para la parte del bucle T del ARNt. Hay datos preliminares de que PUS4 modifica el ARNm, pero se necesita más investigación para confirmarlo. También se une a un virus del mosaico del bromo específico, que es un virus de ARN que infecta a las plantas. [10] [15]
TruD
TruD es capaz de modificar una variedad de ARN, y no está claro cómo se reconocen estos diferentes sustratos de ARN. PUS 7 modifica el ARNm U2 en la posición 35 y esta modificación aumentará cuando las células estén en choque térmico. Otra modificación es el ARNt citoplasmático en la posición 13, y la posición 35 en el pre-ARNt Tyr . PUS 7 modifica casi la especificidad no depende del tipo de ARN ya que el ARNm muestra pseudouridilación por PUS 7. Reconozca esto en la secuencia del ARN, UGUAR con la segunda U siendo el nucleótido que será modificado. La pseudouridilación del ARNm por PUS 7 aumenta durante el choque térmico, porque la proteína se mueve desde el núcleo al citoplasma. Se cree que la modificación aumenta la estabilidad del ARNm durante el choque térmico antes de que el ARN vaya al núcleo o mitocondria, pero se necesitan más estudios. [10] [14]
RluA
El dominio RluA de estas proteínas puede identificar el sustrato a través de una unión de proteína diferente al sustrato y luego enlaces particulares al dominio RluA. [1] [14]
La PUS 5 no está bien estudiada y se encuentra en la pseudouridina sintasa y, al igual que la Pus 2, no tiene una secuencia de señalización mitocondrial. La proteína modifica U2819 del ARNr 21S mitocondrial. También se sospecha que la Pus 5 modifica algunas uridinas en el ARNm, pero nuevamente se necesitan más datos para confirmarlo.
PUS 6 tiene uno que modifica únicamente el U31 del ARNt citoplasmático y mitocondrial. También se sabe que Pus 6 modifica el ARNm. [10]
PUS 8, también conocida como Rib2, modifica el ARNt citoplasmático en la posición U32. En el extremo C hay un dominio DRAP-desaminasa relacionado con la biosíntesis de riboflavina. El RluA y el dominio DRAP o desaminasa relacionado con la riboflavina sintasa tienen funciones completamente separadas en la proteína y no se sabe si interactúan entre sí. PUS 8 es necesaria en la levadura, pero se sospecha que está relacionada con la síntesis de riboflavina y no con la modificación de pseudouridina. [10]
PUS 9 y PUS 8 catalizan la misma posición en el ARNt mitocondrial en lugar de citoplasmático. Es la única proteína PUS que contiene un dominio de señal de orientación mitocondrial en el extremo N-terminal. Los estudios sugieren que PUS 9 puede modificar los ARNm, lo que significaría una menor especificidad del sustrato. [10]
RsuA
![[icono]](http://upload.wikimedia.org/wikipedia/commons/thumb/1/1c/Wiki_letter_w_cropped.svg/20px-Wiki_letter_w_cropped.svg.png) | Esta sección está vacía. Puedes ayudarnos agregándole algo. ( Julio 2022 ) |
Técnicas de secuenciación genómica de pseudouridina
La pseudouridina se puede identificar mediante una multitud de técnicas diferentes. Una técnica común para identificar modificaciones en el ARN y el ADN es la cromatografía líquida con espectrometría de masas o LC-MS . La espectrometría de masas separa las moléculas por la masa y la carga. Si bien la uridina y la pseudouridina tienen la misma masa, tienen diferentes cargas. La cromatografía líquida funciona por tiempo de retención, que tiene que ver con la salida de la columna. [16] Una forma química de identificar la pseudouridina utiliza un compuesto llamado CMC o N-ciclohexil-N′-β-(4-metilmorfolinio) etilcarbodiimida para marcar específicamente y distinguir la uridina de la pseudouridina. [17] La CMC se unirá tanto con la pseudouridina como con la uridina, pero se une más a la primera, debido a que el tercer nitrógeno puede formar un enlace de hidrógeno. La CMC unida a la pseudouridina se puede obtener luego mediante el etiquetado de una molécula de señalización. Este método todavía se está desarrollando para que sea de alto rendimiento. [18]
Relevancia médica de la pseudouridina
La pseudouridina ejerce una influencia sutil pero significativa en la cadena principal de azúcar-fosfato cercana y también mejora el apilamiento de bases. Estos efectos pueden ser la base del papel biológico de la mayoría, pero quizás no de todos los residuos de pseudouridina en el ARN. Ciertos mutantes genéticos que carecen de residuos específicos de pseudouridina en el ARNt o ARNr presentan dificultades en la traducción, muestran tasas de crecimiento lentas y no pueden competir eficazmente con cepas de tipo salvaje en cultivos mixtos. Las modificaciones de pseudouridina también están implicadas en enfermedades humanas como la miopatía mitocondrial y la anemia sideroblástica (MLASA) y la disqueratosis congénita. [10] La disqueratosis congénita y el síndrome de Hoyeraal-Hreidarsson son dos síndromes hereditarios raros causados por mutaciones en DKC1 , el gen que codifica la disquerina de la pseudouridina sintasa. Las pseudouridinas han sido reconocidas como reguladoras de los procesos de latencia viral en las infecciones por el virus de la inmunodeficiencia humana ( VIH ). [19] La pseudouridilación también se ha asociado con la patogénesis de la diabetes y sordera hereditarias de origen materno (MIDD). En particular, una mutación puntual en un ARNt mitocondrial parece impedir la pseudouridilación de un nucleótido, alterando así la estructura terciaria del ARNt. Esto puede conducir a una mayor inestabilidad del ARNt, lo que causa deficiencias en la traducción y respiración mitocondriales. [19]
Vacunas
Cuando se utiliza pseudouridina en lugar de uridina en el ARNm sintético, la molécula de ARNm modificada provoca una menor respuesta de los receptores tipo Toll , una parte del sistema inmunológico humano que de otro modo identificaría el ARNm como no deseado. Esto hace que la pseudouridina sea útil en las vacunas de ARNm , incluidas las vacunas de ARNm contra la COVID-19 . Esta propiedad de la pseudouridina fue descubierta por Katalin Karikó y Drew Weissman en 2005, por lo que compartieron el Premio Nobel de Fisiología o Medicina de 2023. [20] [ 21]
La N1-metilpseudouridina proporciona una respuesta inmune innata incluso menor que la Ψ, además de mejorar la capacidad de traducción . [22] Por lo tanto, tanto las vacunas de ARNm de Pfizer-BioNTech como las de Moderna utilizan N1-metilpseudouridina en lugar de Ψ. [ 22 ]
Véase también
Referencias
- ^ abc Hamma, Tomoko; Ferré-D'Amaré, Adrian R. (noviembre de 2006). "Sintasas de pseudouridina". Química y biología . 13 (11): 1125–1135. doi : 10.1016/j.chembiol.2006.09.009 . ISSN 1074-5521. PMID 17113994.
- ^ Penzo, Mariana; Guerrieri, Ania; Zacchini, Federico; Treré, Davide; Montañaro, Lorenzo (1 de noviembre de 2017). "Pseudouridilación de ARN en fisiología y medicina: para bien o para mal". Genes . 8 (11): 301. doi : 10.3390/genes8110301 . ISSN 2073-4425. PMC 5704214 . PMID 29104216.
- ^ Garus A, Autexier C (2021). "Disquerina: una pseudouridina sintasa esencial con funciones multifacéticas en la biogénesis de ribosomas, el empalme y el mantenimiento de los telómeros". ARN . 27 (12): 1441–1458. doi :10.1261/rna.078953.121. PMC 8594475 . PMID 34556550.
- ^ abcdef Gray, Michael Charette, Michael W. (1 de mayo de 2000). "Pseudouridina en el ARN: qué, dónde, cómo y por qué". IUBMB Life . 49 (5): 341–351. doi :10.1080/152165400410182. ISSN 1521-6543. PMID 10902565. S2CID 20561376.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Davis, FF; Allen, FW (octubre de 1957). «Ácidos ribonucleicos de levadura que contienen un quinto nucleótido». Revista de química biológica . 227 (2): 907–915. ISSN 0021-9258. PMID 13463012.
- ^ Davis, Darrell R. (1995). "Estabilización del apilamiento de ARN mediante pseudouridina". Nucleic Acids Research . 23 (24): 5020–5026. doi :10.1093/nar/23.24.5020. ISSN 0305-1048. PMC 307508 . PMID 8559660.
- ^ Ofengand, J; Bakin, A (21 de febrero de 1997). "Mapeo de la resolución de nucleótidos de residuos de pseudouridina en ARN ribosómicos de subunidades grandes de eucariotas, procariotas, arqueobacterias, mitocondrias y cloroplastos representativos". Journal of Molecular Biology . 266 (2): 246–268. doi : 10.1006/jmbi.1996.0737 . PMID 9047361.
- ^ Bussotti, Giovanni; Piel, Laura; Pescher, Pascale; Domagalska, Malgorzata A.; Rajan, K. Shanmugha; Cohen-Chalamish, Smadar; Doniger, Tirza; Hiregange, Disha-Gajanan; Myler, Peter J.; Unger, Ron; Michaeli, Shulamit; Späth, Gerald F. (21 de diciembre de 2021). "La inestabilidad del genoma impulsa la adaptación epistática en el patógeno humano Leishmania". Actas de la Academia Nacional de Ciencias . 118 (51): e2113744118. Bibcode :2021PNAS..11813744B. doi : 10.1073/pnas.2113744118 . ISSN 0027-8424. PMC 8713814 . Número de modelo: PMID34903666.
- ^ Ge, Junhui; Yu, Yi-Tao (abril de 2013). "Pseudouridilación del ARN: nuevos conocimientos sobre una antigua modificación". Tendencias en ciencias bioquímicas . 38 (4): 210–218. doi :10.1016/j.tibs.2013.01.002. ISSN 0968-0004. PMC 3608706 . PMID 23391857.
- ^ abcdefghijk Rintala-Dempsey, Anne C.; Kothe, Ute (3 de enero de 2017). "Pseudouridina sintasas autónomas eucariotas: enzimas modificadoras de ARN y reguladores emergentes de la expresión génica". RNA Biology . 14 (9): 1185–1196. doi :10.1080/15476286.2016.1276150. ISSN 1547-6286. PMC 5699540 . PMID 28045575.
- ^ Wu, Guowei; Radwan, Mohamed K.; Xiao, Mu; Adachi, Hironori; Fanático, Jason; Yu, Yi-Tao (7 de junio de 2016). "La vía de señalización TOR regula la pseudouridilación del ARNsn U2 de levadura inducida por inanición". ARN . 22 (8): 1146-1152. doi :10.1261/rna.056796.116. ISSN 1355-8382. PMC 4931107 . PMID 27268497.
- ^ Adachi, Hironori; De Zoysa, Meemanage D.; Yu, Yi-Tao (marzo de 2019). "Pseudouridilación postranscripcional en ARNm, así como en algunos tipos principales de ARN no codificantes". Biochimica et Biophysica Acta (BBA) - Mecanismos reguladores de genes . 1862 (3): 230–239. doi :10.1016/j.bbagrm.2018.11.002. ISSN 1874-9399. PMC 6401265 . PMID 30414851.
- ^ "Informe de evaluación de la Agencia Europea de Medicamentos sobre Comirnaty (nombre común: vacuna de ARNm contra la COVID-19) (modificada con nucleósidos), procedimiento n.º EMEA/H/C/005735/0000" (PDF) . 2021-02-19.
- ^ abc Penzo, M.; Guerrieri, AN; Zacchini, F.; Treré, D.; Montanaro, L. (1 de noviembre de 2017). "Pseudouridilación del ARN en fisiología y medicina: para bien y para mal". Genes . 8 (11): 301. doi : 10.3390/genes8110301 . ISSN 2073-4425. PMC 5704214 . PMID 29104216.
- ^ Keffer-Wilkes, Laura Carole; Veerareddygari, Govardhan Reddy; Kothe, Ute (14 de noviembre de 2016). "La enzima de modificación de ARN TruB es una chaperona de ARNt". Actas de la Academia Nacional de Ciencias . 113 (50): 14306–14311. Bibcode :2016PNAS..11314306K. doi : 10.1073/pnas.1607512113 . ISSN 0027-8424. PMC 5167154 . PMID 27849601.
- ^ Xu, J.; Gu, AY; Thumati, NR; Wong JMY (5 de septiembre de 2017). "Cuantificación de los niveles de pseudouridina en grupos de ARN celular con un ensayo HPLC-UV modificado". Genes . 8 (9): 219. doi : 10.3390/genes8090219 . ISSN 2073-4425. PMC 5615352 . PMID 28872587.
- ^ Bakin, A (21 de septiembre de 1993). "Cuatro residuos de pseudouridilato recientemente localizados en el ARN ribosómico 23S de Escherichia coli se encuentran todos en el centro de la peptidiltransferasa: análisis mediante la aplicación de una nueva técnica de secuenciación". Bioquímica . 32 (37): 9754–9762. doi :10.1021/bi00088a030. PMID 8373778.
- ^ Kalsotra, Auinash (2 de noviembre de 2016). "La evaluación de la facultad de 1000 para el mapeo de todo el transcriptoma revela una pseudouridilación generalizada regulada dinámicamente de ARNnc y ARNm". doi : 10.3410/f.718875945.793524920 .
{{cite journal}}: Requiere citar revista|journal=( ayuda ) - ^ ab Zhao, Yang; Karijolich, John; Glaunsinger, Britt; Zhou, Qiang (octubre de 2016). "La pseudouridilación del ARN 7 SK sn promueve la formación de RNP 7 SK sn para suprimir la transcripción del VIH-1 y escapar de la latencia". EMBO Reports . 17 (10): 1441–1451. doi :10.15252/embr.201642682. ISSN 1469-221X. PMC 5048380 . PMID 27558685.
- ^ Dolgin, Elie (14 de septiembre de 2021). "La enredada historia de las vacunas de ARNm". Nature .
- ^ "El Premio Nobel de Fisiología o Medicina 2023". NobelPrize.org . Consultado el 2 de octubre de 2023 .
- ^ ab Morais P, Adachi H, Yu Y (2021). "La contribución crítica de la pseudouridina a las vacunas de ARNm contra la COVID-19". Frontiers in Cell and Developmental Biology . 9 : 789427. doi : 10.3389/fcell.2021.789427 . PMC 8600071 . PMID 34805188.


