BRAF (gen)
| BRAF | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificadores | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Alias | BRAF , B-RAF1, BRAF1, NS7, RAFB1, B-Raf, protooncogén B-Raf, serina/treonina quinasa | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificaciones externas | OMIM : 164757; MGI : 88190; HomoloGene : 3197; Tarjetas genéticas : BRAF; OMA :BRAF - ortólogos | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wikidatos | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
BRAF es un gen humanoque codifica una proteína llamada B-Raf. El gen también se conoce como protooncogén B-Raf y homólogo del oncogén viral del sarcoma murino v-Raf B , mientras que la proteína se conoce más formalmente como serina/treonina-proteína quinasa B-Raf . [5] [6]
La proteína B-Raf participa en el envío de señales dentro de las células que están implicadas en la dirección del crecimiento celular . En 2002, se demostró que presentaba mutaciones en algunos cánceres humanos . [7]
Ciertas otras mutaciones hereditarias del gen BRAF causan defectos de nacimiento.
Se han desarrollado medicamentos para tratar los cánceres provocados por mutaciones BRAF . Dos de estos medicamentos, vemurafenib [8] y dabrafenib , están aprobados por la FDA para el tratamiento del melanoma en etapa avanzada. Vemurafenib fue el primer medicamento aprobado que surgió del descubrimiento de fármacos basado en fragmentos . [9]
Función

B-Raf es un miembro de la familia de las quinasas Raf de las proteínas quinasas de transducción de señales de crecimiento . Esta proteína desempeña un papel en la regulación de la vía de señalización de las quinasas MAP / ERK , que afecta la división , diferenciación y secreción celular. [10]
Estructura
B-Raf es una proteína quinasa específica de serina/treonina , de 766 aminoácidos , con transducción de señales regulada . En términos generales, se compone de tres dominios conservados característicos de la familia de quinasas Raf : región conservada 1 (CR1), un dominio autorregulador de unión a Ras - GTP [11] , región conservada 2 (CR2), una región bisagra rica en serina , y región conservada 3 (CR3), un dominio de proteína quinasa catalítica que fosforila una secuencia de consenso en sustratos proteicos. [12] En su conformación activa, B-Raf forma dímeros a través de enlaces de hidrógeno e interacciones electrostáticas de sus dominios quinasos. [13]
CR1
La región conservada 1 (CR1) autoinhibe el dominio quinasa de B-Raf (CR3) de modo que la señalización de B-Raf está regulada en lugar de ser constitutiva. [12] Los residuos 155-227 [14] forman el dominio de unión a Ras (RBD), que se une al dominio efector de Ras-GTP para liberar CR1 y detener la inhibición de la quinasa. Los residuos 234-280 comprenden un motivo de dedo de zinc de unión a DAG /éster de forbol que participa en el acoplamiento de la membrana de B-Raf después de la unión a Ras. [14] [15]
CR2
La región conservada 2 (CR2) proporciona un conector flexible que conecta CR1 y CR3 y actúa como una bisagra. [16]
CR3
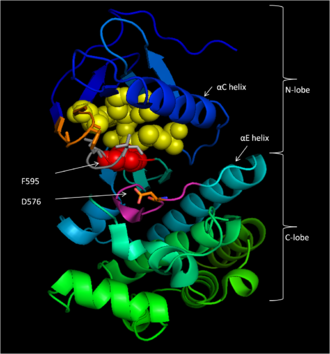
La región conservada 3 (CR3), residuos 457-717, [14] constituye el dominio de la quinasa enzimática de B-Raf. Esta estructura, en gran parte conservada [17] , es bilobal y está conectada por una región bisagra corta. [18] El lóbulo N más pequeño (residuos 457-530) es el principal responsable de la unión del ATP , mientras que el lóbulo C más grande (residuos 535-717) se une a las proteínas del sustrato . [17] El sitio activo es la hendidura entre los dos lóbulos, y el residuo catalítico Asp 576 se encuentra en el lóbulo C, mirando hacia el interior de esta hendidura. [14] [17]
Subregiones
Bucle P
El bucle P de B-Raf (residuos 464-471) estabiliza los grupos fosfato no transferibles del ATP durante la unión del ATP a la enzima. Específicamente, las amidas de la cadena principal S 467, F 468 y G 469 se unen por enlaces de hidrógeno al β-fosfato del ATP para anclar la molécula. Los motivos funcionales de B-Raf se han determinado analizando la homología de la PKA analizada por Hanks y Hunter con el dominio de la quinasa de B-Raf. [17]
Bolsillo de unión de nucleótidos
V 471, C 532, W 531, T 529, L 514 y A 481 forman un bolsillo hidrofóbico dentro del cual la adenina del ATP se ancla a través de atracciones de Van der Waals tras la unión del ATP. [17] [19]
Circuito catalítico
Los residuos 574-581 componen una sección del dominio quinasa responsable de apoyar la transferencia del fosfato γ de ATP al sustrato proteico de B-Raf. En particular, D 576 actúa como un aceptor de protones para activar el oxígeno hidroxilo nucleofílico en los residuos de serina o treonina del sustrato, lo que permite que se produzca la reacción de transferencia de fosfato mediada por catálisis básica . [17]
Motivo DFG
D 594, F 595 y G 596 componen un motivo central para la función de B-Raf tanto en su estado inactivo como en su estado activo. En el estado inactivo, F595 ocupa el bolsillo de unión de nucleótidos, lo que impide la entrada de ATP y disminuye la probabilidad de catálisis enzimática. [13] [19] [20] En el estado activo, D594 forma quelato del catión magnesio divalente que estabiliza los grupos β- y γ-fosfato del ATP, orientando el γ-fosfato para la transferencia. [17]
Bucle de activación
Los residuos 596-600 forman fuertes interacciones hidrofóbicas con el bucle P en la conformación inactiva de la quinasa, bloqueando la quinasa en su estado inactivo hasta que el bucle de activación se fosforila, desestabilizando estas interacciones con la presencia de carga negativa. Esto desencadena el cambio al estado activo de la quinasa. Específicamente, L597 y V600 del bucle de activación interactúan con G466, F468 y V471 del bucle P para mantener el dominio de la quinasa inactivo hasta que se fosforila. [18]
Enzimología
B-Raf es una proteína quinasa específica de serina/treonina . Como tal, cataliza la fosforilación de residuos de serina y treonina en una secuencia de consenso en proteínas objetivo por ATP , produciendo ADP y una proteína fosforilada como productos. [17] Dado que es una quinasa de transducción de señales altamente regulada , B-Raf primero debe unirse a Ras - GTP antes de volverse activa como enzima. [15] Una vez que B-Raf se activa, un núcleo catalítico de proteína quinasa conservado fosforila sustratos proteicos al promover el ataque nucleofílico del átomo de oxígeno hidroxilo de serina o treonina del sustrato activado en el grupo γ-fosfato de ATP a través de sustitución nucleofílica bimolecular . [17] [21] [22] [23]
Activación
Alivio de la autoinhibición de CR1
El dominio quinasa (CR3) de las quinasas Raf humanas es inhibido por dos mecanismos: autoinhibición por su propio dominio regulador CR1 de unión a Ras - GTP y una falta de fosforilación postraduccional de residuos clave de serina y tirosina (S338 e Y341 para c-Raf) en la región bisagra CR2. Durante la activación de B-Raf, el dominio autoinhibitorio CR1 de la proteína primero une el dominio efector de Ras-GTP al dominio de unión a Ras (RBD) de CR1 para liberar el dominio quinasa CR3 como otros miembros de la familia de quinasas Raf humanas . La interacción CR1-Ras se fortalece posteriormente a través de la unión del subdominio rico en cisteína (CRD) de CR1 a Ras y fosfolípidos de membrana . [12] A diferencia de A-Raf y C-Raf , que deben fosforilarse en residuos CR2 que contienen hidroxilo antes de liberar completamente CR1 para volverse activo, B-Raf se fosforila constitutivamente en CR2 S445. [24] Esto permite que la fosfoserina cargada negativamente repela inmediatamente a CR1 a través de interacciones estéricas y electrostáticas una vez que el dominio regulador se libera, liberando el dominio de la quinasa CR3 para interactuar con las proteínas del sustrato.
Activación del dominio CR3
Después de que se libera el dominio regulador autoinhibitorio CR1, el dominio quinasa CR3 de B-Raf debe cambiar a su confórmero activo de unión a ATP antes de que pueda catalizar la fosforilación de proteínas . En la conformación inactiva, F595 del motivo DFG bloquea el bolsillo de unión de adenina hidrofóbico mientras que los residuos del bucle de activación forman interacciones hidrofóbicas con el bucle P, impidiendo que el ATP acceda a su sitio de unión. Cuando el bucle de activación se fosforila, la carga negativa del fosfato es inestable en el entorno hidrofóbico del bucle P. Como resultado, el bucle de activación cambia de conformación , extendiéndose a través del lóbulo C del dominio quinasa . En este proceso, forma interacciones estabilizadoras de lámina β con la cadena β6. Mientras tanto, el residuo fosforilado se acerca a K507, formando un puente salino estabilizador para bloquear el bucle de activación en su lugar. El motivo DFG cambia de conformación con el bucle de activación, lo que hace que F595 se mueva fuera del sitio de unión del nucleótido de adenina y hacia un bolsillo hidrofóbico bordeado por las hélices αC y αE . Juntos, el DFG y el movimiento del bucle de activación tras la fosforilación abren el sitio de unión de ATP . Dado que todos los demás dominios catalíticos y de unión al sustrato ya están en su lugar, la fosforilación del bucle de activación por sí sola activa el dominio quinasa de B-Raf a través de una reacción en cadena que esencialmente elimina una tapa de un sitio activo preparado de otro modo. [18]
Mecanismo de catálisis

Para catalizar eficazmente la fosforilación de proteínas a través de la sustitución bimolecular de residuos de serina y treonina con ADP como grupo saliente , B-Raf primero debe unirse al ATP y luego estabilizar el estado de transición a medida que se transfiere el fosfato γ del ATP. [17]
Unión de ATP
B-Raf se une al ATP anclando el nucleótido de adenina en un bolsillo no polar (amarillo, Figura 1) y orientando la molécula a través de enlaces de hidrógeno e interacciones electrostáticas con grupos fosfato. Además de la unión de fosfato mediante bucle P y motivo DFG descrita anteriormente, K483 y E501 desempeñan papeles clave en la estabilización de los grupos fosfato no transferibles. La carga positiva en la amina primaria de K483 le permite estabilizar la carga negativa en los grupos fosfato α y β del ATP cuando se une el ATP. Cuando no hay ATP presente, la carga negativa del grupo carboxilo E501 equilibra esta carga. [17] [18]
Fosforilación
Una vez que el ATP se une al dominio de la quinasa B-Raf, el D576 del bucle catalítico activa un grupo hidroxilo del sustrato, lo que aumenta su nucleofilia para impulsar cinéticamente la reacción de fosforilación, mientras que otros residuos del bucle catalítico estabilizan el estado de transición (Figura 2). El N581 forma un quelato del catión magnesio divalente asociado con el ATP para ayudar a orientar la molécula para una sustitución óptima. El K578 neutraliza la carga negativa del grupo γ-fosfato del ATP, de modo que el residuo de sustrato ser/thr activado no experimente tanta repulsión electrón-electrón al atacar al fosfato. Después de que se transfiere el grupo fosfato, se liberan el ADP y la nueva fosfoproteína. [17]
Inhibidores
Dado que los mutantes B-Raf constitutivamente activos comúnmente causan cáncer (ver Importancia clínica) al enviar señales excesivas a las células para que crezcan, se han desarrollado inhibidores de B-Raf tanto para las conformaciones inactivas como activas del dominio quinasa como candidatos terapéuticos contra el cáncer. [18] [19] [20]
Sorafenib

BAY43-9006 ( Sorafenib , Nexavar) es un inhibidor de B-Raf y C-Raf mutante V600E aprobado por la FDA para el tratamiento del cáncer primario de hígado y riñón . Bay43-9006 desactiva el dominio de la cinasa B-Raf bloqueando la enzima en su forma inactiva. El inhibidor logra esto bloqueando el bolsillo de unión de ATP a través de una alta afinidad por el dominio de la cinasa. Luego se une al bucle de activación clave y a los residuos del motivo DFG para detener el movimiento del bucle de activación y del motivo DFG a la conformación activa. Finalmente, una fracción de fenilo trifluorometilo bloquea estéricamente el motivo DFG y el sitio de conformación activa del bucle de activación, lo que hace imposible que el dominio de la cinasa cambie de conformación para volverse activo. [18]
El anillo piridilo distal de BAY43-9006 se ancla en el bolsillo de unión de nucleótidos hidrofóbico del lóbulo N de la quinasa, interactuando con W531, F583 y F595. Las interacciones hidrofóbicas con el bucle catalítico F583 y el motivo DFG F595 estabilizan la conformación inactiva de estas estructuras, disminuyendo la probabilidad de activación de la enzima. La interacción hidrofóbica adicional de K483, L514 y T529 con el anillo fenilo central aumenta la afinidad del dominio de la quinasa por el inhibidor. La interacción hidrofóbica de F595 con el anillo central también disminuye aún más la favorabilidad energética de un cambio de conformación DFG. Finalmente, las interacciones polares de BAY43-9006 con el dominio de la quinasa continúan esta tendencia de aumentar la afinidad de la enzima por el inhibidor y estabilizar los residuos DFG en la conformación inactiva. E501 y C532 unen por enlace de hidrógeno los grupos urea y piridilo del inhibidor respectivamente, mientras que el carbonilo de la urea acepta un enlace de hidrógeno del nitrógeno amida de la cadena principal de D594 para fijar el motivo DFG en su lugar. [18]
La fracción trifluorometil fenilo consolida la favorabilidad termodinámica de la conformación inactiva cuando el dominio quinasa está unido a BAY43-9006 al bloquear estéricamente el bolsillo hidrofóbico entre las hélices αC y αE que el motivo DFG y el bucle de activación habitarían al cambiar a sus ubicaciones en la conformación activa de la proteína. [18]
Vemurafenib

PLX4032 ( Vemurafenib ) es un inhibidor de B-Raf mutante V600 aprobado por la FDA para el tratamiento del melanoma en etapa avanzada . [13] A diferencia de BAY43-9006 , que inhibe la forma inactiva del dominio quinasa, Vemurafenib inhibe la forma activa "DFG-in" de la quinasa, [19] [20] anclándose firmemente en el sitio de unión de ATP. Al inhibir solo la forma activa de la quinasa, Vemurafenib inhibe selectivamente la proliferación de células con B-Raf no regulado, normalmente aquellas que causan cáncer .
Dado que Vemurafenib solo se diferencia de su precursor, PLX4720, en un anillo de fenilo añadido por razones farmacocinéticas , [20] el modo de acción de PLX4720 es equivalente al de Vemurafenib. PLX4720 tiene buena afinidad por el sitio de unión de ATP en parte porque su región de anclaje, un 7-aza indol bicíclico , solo se diferencia de la adenina natural que ocupa el sitio en dos lugares donde los átomos de nitrógeno han sido reemplazados por carbono. Esto permite que se conserven fuertes interacciones intermoleculares como el enlace de hidrógeno N7 a C532 y el enlace de hidrógeno N1 a Q530. El excelente ajuste dentro del bolsillo hidrofóbico de unión de ATP (C532, W531, T529, L514, A481) también aumenta la afinidad de unión. La unión de hidrógeno del enlazador de cetona con el agua y el difluorofenilo encajan en un segundo bolsillo hidrófobo (A481, V482, K483, V471, I527, T529, L514 y F583) lo que contribuye a la afinidad de unión excepcionalmente alta en general. La unión selectiva al Raf activo se logra mediante el grupo propilo terminal que se une a un bolsillo selectivo de Raf creado por un desplazamiento de la hélice αC. La selectividad para la conformación activa de la quinasa aumenta aún más mediante un grupo sulfonamida desprotonado sensible al pH que se estabiliza mediante la unión de hidrógeno con el péptido de la cadena principal NH de D594 en el estado activo. En el estado inactivo, el grupo sulfonamida del inhibidor interactúa con el carbonilo de la cadena principal de ese residuo, lo que crea repulsión. Por lo tanto, Vemurafenib se une preferentemente al estado activo del dominio de la quinasa de B-Raf. [19] [20]
Importancia clínica
Las mutaciones del gen BRAF pueden causar enfermedades de dos maneras. En primer lugar, las mutaciones pueden heredarse y causar defectos de nacimiento. En segundo lugar, las mutaciones pueden aparecer más adelante en la vida y causar cáncer, como un oncogén .
Las mutaciones hereditarias en este gen causan el síndrome cardiofaciocutáneo , una enfermedad caracterizada por defectos cardíacos, retraso mental y una apariencia facial distintiva. [25]
Se han encontrado mutaciones en este gen en cánceres, incluido el linfoma no Hodgkin , el cáncer colorrectal , el melanoma maligno , el carcinoma papilar de tiroides , el carcinoma de pulmón de células no pequeñas , el adenocarcinoma de pulmón , tumores cerebrales que incluyen glioblastoma y xantoastrocitoma pleomórfico , así como enfermedades inflamatorias como la enfermedad de Erdheim-Chester . [10]
La mutación V600E del gen BRAF se ha asociado con la leucemia de células pilosas en numerosos estudios y se ha sugerido su uso en la detección del síndrome de Lynch para reducir la cantidad de pacientes que se someten a una secuenciación innecesaria de MLH1 . [26] [27]
Mutantes
Se han identificado más de 30 mutaciones del gen BRAF asociadas con cánceres humanos. La frecuencia de las mutaciones BRAF varía ampliamente en los cánceres humanos, desde más del 80% en melanomas y nevos , hasta tan solo el 0-18% en otros tumores , como el 1-3% en cánceres de pulmón y el 5% en cáncer colorrectal . [28] En el 90% de los casos, la timina se sustituye por adenina en el nucleótido 1799. Esto lleva a que la valina (V) sea sustituida por glutamato (E) en el codón 600 (ahora denominado V600E ) en el segmento de activación que se ha encontrado en cánceres humanos. [29] Esta mutación se ha observado ampliamente en carcinoma papilar de tiroides , cáncer colorrectal, melanoma y cáncer de pulmón de células no pequeñas . [30] [31] [32] [33] [34] [35] [36] La mutación BRAF-V600E está presente en el 57% de los pacientes con histiocitosis de células de Langerhans. [37] La mutación V600E es una probable mutación impulsora en el 100% de los casos de leucemia de células pilosas . [38] Se ha detectado una alta frecuencia de mutaciones BRAF V600E en el ameloblastoma , una neoplasia odontogénica benigna pero localmente infiltrante. [39] La mutación V600E también puede estar vinculada, como una mutación impulsora única (una "pistola humeante" genética), a ciertos casos de desarrollo de craneofaringioma papilar . [40]
Otras mutaciones que se han encontrado son R461I, I462S, G463E, G463V, G465A, G465E, G465V, G468A, G468E, G469R, N580S, E585K, D593V, F594L, G595R, L596V, T598I, V599D, V599E, V599K, V599R, V600K, A727V, etc. y la mayoría de estas mutaciones se agrupan en dos regiones: el bucle P rico en glicina del lóbulo N y el segmento de activación y las regiones flanqueantes. [18] Estas mutaciones cambian el segmento de activación del estado inactivo al estado activo, por ejemplo, en el artículo citado anteriormente se informó que la cadena lateral alifática de Val599 interactúa con el anillo de fenilo de Phe467 en el bucle P. Se esperaría que reemplazar la cadena lateral hidrofóbica de tamaño mediano de Val con un residuo más grande y cargado como el que se encuentra en el cáncer humano (Glu, Asp, Lys o Arg) desestabilice las interacciones que mantienen el motivo DFG en una conformación inactiva, cambiando así el segmento de activación a la posición activa. Dependiendo del tipo de mutación, la actividad de la quinasa hacia MEK también puede variar. La mayoría de los mutantes estimulan una actividad mejorada de la quinasa B-Raf hacia MEK. Sin embargo, algunos mutantes actúan a través de un mecanismo diferente porque, aunque su actividad hacia MEK se reduce, adoptan una conformación que activa C-RAF de tipo salvaje, que luego envía señales a ERK .
BRAF-V600E
- BRAF V600E es un determinante de la sensibilidad a los inhibidores del proteasoma . La vulnerabilidad a los inhibidores del proteasoma depende de la señalización persistente de BRAF, porque el bloqueo de BRAF-V600E por PLX4720 revirtió la sensibilidad a carfilzomib en células de cáncer colorrectal con mutación BRAF. La inhibición del proteasoma podría representar una valiosa estrategia de focalización en tumores colorrectales con mutación BRAF V600E. [41]
Inhibidores de BRAF
Como se mencionó anteriormente, algunas empresas farmacéuticas están desarrollando inhibidores específicos de la proteína B-raf mutada para uso anticancerígeno porque BRAF es un objetivo bien entendido y de alto rendimiento. [19] [42] Vemurafenib (RG7204 o PLX4032) fue autorizado por la Administración de Alimentos y Medicamentos de los EE. UU . como Zelboraf para el tratamiento del melanoma metastásico en agosto de 2011 con base en datos clínicos de Fase III. Se observó una mejor supervivencia, así como una tasa de respuesta al tratamiento del 53%, en comparación con el 7-12% con el mejor tratamiento quimioterapéutico anterior, dacarbazina . [43] En ensayos clínicos, B-Raf aumentó la probabilidad de supervivencia del paciente con melanoma metastásico. A pesar de la alta eficacia del fármaco, el 20% de los tumores aún desarrollan resistencia al tratamiento. En ratones, el 20% de los tumores se vuelven resistentes después de 56 días. [44] Aunque los mecanismos de esta resistencia aún son objeto de controversia, algunas hipótesis incluyen la sobreexpresión de B-Raf para compensar las altas concentraciones de Vemurafenib [44] y la regulación positiva de la señalización de crecimiento. [45]
Los inhibidores de B-Raf más generales incluyen GDC-0879, PLX-4720, sorafenib , dabrafenib y encorafenib .
Inhibidores de panRAF
El belvarafenib se clasifica como un inhibidor de panRAF. Un inhibidor de panRAF bloquea la función catalítica de ambas proteínas en el dímero. [46]
Interacciones
Se ha demostrado que el gen BRAF interactúa con:
Referencias
- ^ abc GRCh38: Lanzamiento de Ensembl 89: ENSG00000157764 – Ensembl , mayo de 2017
- ^ abc GRCm38: Lanzamiento de Ensembl 89: ENSMUSG00000002413 – Ensembl , mayo de 2017
- ^ "Referencia de PubMed humana:". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU .
- ^ "Referencia PubMed de ratón:". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU . .
- ^ Sithanandam G, Kolch W, Duh FM, Rapp UR (diciembre de 1990). "Secuencia codificante completa de un ADNc de B-raf humano y detección de la proteína quinasa B-raf con anticuerpos específicos de isoenzima". Oncogene . 5 (12): 1775–1780. PMID 2284096.
- ^ Sithanandam G, Druck T, Cannizzaro LA, Leuzzi G, Huebner K, Rapp UR (abril de 1992). "B-raf y un pseudogén B-raf se encuentran en 7q en el hombre". Oncogene . 7 (4): 795–799. PMID 1565476.
- ^ Davies H, Bignell GR, Cox C, Stephens P, Edkins S, Clegg S, et al. (junio de 2002). "Mutaciones del gen BRAF en el cáncer humano" (PDF) . Nature . 417 (6892): 949–954. Bibcode :2002Natur.417..949D. doi :10.1038/nature00766. PMID 12068308. S2CID 3071547.
- ^ "La FDA aprueba Zelboraf (Vemurafenib) y un fármaco complementario para el melanoma metastásico con mutación BRAF positiva, una forma mortal de cáncer de piel" (Comunicado de prensa). Genentech . Consultado el 17 de agosto de 2011 .
- ^ Erlanson DA, Fesik SW, Hubbard RE, Jahnke W, Jhoti H (septiembre de 2016). "Veinte años después: el impacto de los fragmentos en el descubrimiento de fármacos". Nature Reviews. Descubrimiento de fármacos . 15 (9): 605–619. doi :10.1038/nrd.2016.109. PMID 27417849. S2CID 19634793.
- ^ ab "Entre Gene: BRAF".
- ^ Daum G, Eisenmann-Tappe I, Fries HW, Troppmair J, Rapp UR (noviembre de 1994). "Los entresijos de las quinasas Raf". Tendencias en ciencias bioquímicas . 19 (11): 474–480. doi :10.1016/0968-0004(94)90133-3. PMID 7855890.
- ^ abc Cutler RE, Stephens RM, Saracino MR, Morrison DK (agosto de 1998). "Autorregulación de la serina/treonina quinasa Raf-1". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 95 (16): 9214–9219. Bibcode :1998PNAS...95.9214C. doi : 10.1073/pnas.95.16.9214 . PMC 21318 . PMID 9689060.
- ^ abc Bollag G, Tsai J, Zhang J, Zhang C, Ibrahim P, Nolop K, et al. (noviembre de 2012). "Vemurafenib: el primer fármaco aprobado para el cáncer con mutación BRAF". Nature Reviews. Drug Discovery . 11 (11): 873–886. doi :10.1038/nrd3847. PMID 23060265. S2CID 9337155.
- ^ abcd "Serine/threonine protein kinase B-rAF" . Consultado el 4 de marzo de 2013 .
- ^ ab Morrison DK, Cutler RE (abril de 1997). "La complejidad de la regulación de Raf-1". Current Opinion in Cell Biology . 9 (2): 174–179. doi :10.1016/S0955-0674(97)80060-9. PMID 9069260.
- ^ Khan PS, Rajesh P, Rajendra P, Chaskar MG, Rohidas A, Jaiprakash S (marzo de 2022). "Avances recientes en inhibidores de B-RAF como agentes anticancerígenos". Química bioorgánica . 120 . Elsevier BV: 105597. doi :10.1016/j.bioorg.2022.105597. PMID 35033817.
- ^ abcdefghijkl Hanks SK, Hunter T (mayo de 1995). "Proteínas quinasas 6. La superfamilia de proteínas quinasas eucariotas: estructura y clasificación del dominio de las quinasas (catalíticas)". Revista FASEB . 9 (8): 576–596. doi : 10.1096/fasebj.9.8.7768349 . PMID 7768349. S2CID 21377422.
- ^ abcdefghi Wan PT, Garnett MJ, Roe SM, Lee S, Niculescu-Duvaz D, Good VM, et al. (marzo de 2004). "Mecanismo de activación de la vía de señalización RAF-ERK por mutaciones oncogénicas de B-RAF". Cell . 116 (6). Cancer Genome Project: 855–867. doi : 10.1016/S0092-8674(04)00215-6 . PMID 15035987. S2CID 126161.
- ^ abcdef Tsai J, Lee JT, Wang W, Zhang J, Cho H, Mamo S, et al. (febrero de 2008). "Descubrimiento de un inhibidor selectivo de la quinasa B-Raf oncogénica con potente actividad antimelanoma". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 105 (8): 3041–3046. Bibcode :2008PNAS..105.3041T. doi : 10.1073/pnas.0711741105 . PMC 2268581 . PMID 18287029.
- ^ abcde Bollag G, Hirth P, Tsai J, Zhang J, Ibrahim PN, Cho H, et al. (Septiembre de 2010). "La eficacia clínica de un inhibidor de RAF necesita un bloqueo amplio del objetivo en el melanoma con mutación BRAF". Naturaleza . 467 (7315): 596–599. Código Bib :2010Natur.467..596B. doi : 10.1038/naturaleza09454. PMC 2948082 . PMID 20823850.
- ^ Hanks SK, Quinn AM, Hunter T (julio de 1988). "La familia de las proteínas quinasas: características conservadas y filogenia deducida de los dominios catalíticos". Science . 241 (4861): 42–52. Bibcode :1988Sci...241...42H. doi :10.1126/science.3291115. PMID 3291115.
- ^ Hanks SK (junio de 1991). "Proteínas quinasas eucariotas". Curr. Opin. Struct. Biol . 1 (3): 369–383. doi :10.1016/0959-440X(91)90035-R.
- ^ Hanks SK, Quinn AM (1991). "[2] Base de datos de secuencias del dominio catalítico de la proteína quinasa: identificación de características conservadas de la estructura primaria y clasificación de los miembros de la familia". Base de datos de secuencias del dominio catalítico de la proteína quinasa: identificación de características conservadas de la estructura primaria y clasificación de los miembros de la familia . Métodos en enzimología. Vol. 200. págs. 38–62. doi :10.1016/0076-6879(91)00126-H. ISBN 978-0-12-182101-2. Número de identificación personal 1956325.
- ^ Mason CS, Springer CJ, Cooper RG, Superti-Furga G, Marshall CJ, Marais R (abril de 1999). "Las fosforilaciones de serina y tirosina cooperan en la activación de Raf-1, pero no de B-Raf". The EMBO Journal . 18 (8): 2137–2148. doi :10.1093/emboj/18.8.2137. PMC 1171298 . PMID 10205168.
- ^ Roberts A, Allanson J, Jadico SK, Kavamura MI, Noonan J, Opitz JM, et al. (noviembre de 2006). "El síndrome cardiofaciocutáneo". Revista de genética médica . 43 (11): 833–842. doi :10.1136/jmg.2006.042796. PMC 2563180 . PMID 16825433.
- ^ Ewalt M, Nandula S, Phillips A, Alobeid B, Murty VV, Mansukhani MM, et al. (diciembre de 2012). "El análisis basado en PCR en tiempo real de la mutación BRAF V600E en linfomas de grado bajo e intermedio confirma la aparición frecuente en la leucemia de células pilosas". Oncología hematológica . 30 (4): 190–193. doi :10.1002/hon.1023. PMID 22246856. S2CID 204843221.
- ^ Palomaki GE, McClain MR, Melillo S, Hampel HL, Thibodeau SN (enero de 2009). "Revisión de evidencia complementaria de EGAPP: estrategias de pruebas de ADN destinadas a reducir la morbilidad y la mortalidad por síndrome de Lynch". Genética en Medicina . 11 (1): 42–65. doi :10.1097/GIM.0b013e31818fa2db. PMC 2743613 . PMID 19125127.
- ^ Namba H, Nakashima M, Hayashi T, Hayashida N, Maeda S, Rogounovitch TI, et al. (septiembre de 2003). "Implicación clínica de la mutación BRAF V599E en el punto caliente en los cánceres papilares de tiroides". The Journal of Clinical Endocrinology and Metabolism . 88 (9): 4393–4397. doi : 10.1210/jc.2003-030305 . PMID 12970315.
- ^ Tan YH, Liu Y, Eu KW, Ang PW, Li WQ, Salto-Tellez M, et al. (abril de 2008). "Detección de la mutación BRAF V600E mediante pirosecuenciación". Patología . 40 (3): 295–298. doi :10.1080/00313020801911512. PMID 18428050. S2CID 32051681.
- ^ Li WQ, Kawakami K, Ruszkiewicz A, Bennett G, Moore J, Iacopetta B (enero de 2006). "Las mutaciones de BRAF se asocian con características clínicas, patológicas y moleculares distintivas del cáncer colorrectal independientemente del estado de inestabilidad de microsatélites". Molecular Cancer . 5 (1): 2. doi : 10.1186/1476-4598-5-2 . PMC 1360090 . PMID 16403224.
- ^ Benlloch S, Payá A, Alenda C, Bessa X, Andreu M, Jover R, et al. (noviembre de 2006). "Detección de la mutación BRAF V600E en el cáncer colorrectal: comparación de la secuenciación automática y la metodología de química en tiempo real". The Journal of Molecular Diagnostics . 8 (5): 540–543. doi :10.2353/jmoldx.2006.060070. PMC 1876165 . PMID 17065421.
- ^ Deng G, Bell I, Crawley S, Gum J, Terdiman JP, Allen BA, et al. (enero de 2004). "La mutación BRAF está presente con frecuencia en el cáncer colorrectal esporádico con hMLH1 metilado, pero no en el cáncer colorrectal hereditario sin poliposis". Clinical Cancer Research . 10 (1 Pt 1): 191–195. doi : 10.1158/1078-0432.CCR-1118-3 . PMID 14734469.
- ^ Gear H, Williams H, Kemp EG, Roberts F (agosto de 2004). "Mutaciones de BRAF en el melanoma conjuntival". Oftalmología investigativa y ciencia visual . 45 (8): 2484–2488. doi : 10.1167/iovs.04-0093 . PMID: 15277467.
- ^ Maldonado JL, Fridlyand J, Patel H, Jain AN, Busam K, Kageshita T, et al. (Diciembre de 2003). "Determinantes de mutaciones BRAF en melanomas primarios". Revista del Instituto Nacional del Cáncer . 95 (24): 1878–1890. doi : 10.1093/jnci/djg123 . PMID 14679157.
- ^ Puxeddu E, Moretti S, Elisei R, Romei C, Pascucci R, Martinelli M, et al. (mayo de 2004). "La mutación BRAF(V599E) es el principal evento genético en carcinomas papilares tiroideos esporádicos en adultos". The Journal of Clinical Endocrinology and Metabolism . 89 (5): 2414–2420. doi : 10.1210/jc.2003-031425 . PMID 15126572.
- ^ Elisei R, Ugolini C, Viola D, Lupi C, Biagini A, Giannini R, et al. (octubre de 2008). "Mutación BRAF(V600E) y evolución de pacientes con carcinoma papilar de tiroides: un estudio de seguimiento medio de 15 años". The Journal of Clinical Endocrinology and Metabolism . 93 (10): 3943–3949. doi : 10.1210/jc.2008-0607 . PMID 18682506.
- ^ Badalian-Very G, Vergilio JA, Degar BA, Rodríguez-Galindo C, Rollins BJ (enero de 2012). "Avances recientes en la comprensión de la histiocitosis de células de Langerhans". Revista británica de hematología . 156 (2): 163-172. doi : 10.1111/j.1365-2141.2011.08915.x . PMID 22017623. S2CID 34922416.
- ^ Tiacci E, Trifonov V, Schiavoni G, Holmes A, Kern W, Martelli MP, et al. (junio de 2011). "Mutaciones de BRAF en la leucemia de células pilosas". The New England Journal of Medicine . 364 (24): 2305–2315. doi :10.1056/NEJMoa1014209. PMC 3689585 . PMID 21663470. *Resumen para legos en: "La investigación sobre la leucemia de células pilosas muestra la promesa de nuevas tecnologías de escaneo de ADN". Cancer Research UK . 11 de junio de 2011.
- ^ Kurppa KJ, Catón J, Morgan PR, Ristimäki A, Ruhin B, Kellokoski J, et al. (Abril de 2014). "Alta frecuencia de mutaciones BRAF V600E en ameloblastoma". La Revista de Patología . 232 (5): 492–498. doi : 10.1002/ruta.4317. PMC 4255689 . PMID 24374844.
- ^ Brastianos PK, Taylor-Weiner A, Manley PE, Jones RT, Dias-Santagata D, Thorner AR, et al. (febrero de 2014). "La secuenciación del exoma identifica mutaciones BRAF en craneofaringiomas papilares". Genética de la Naturaleza . 46 (2): 161–165. doi :10.1038/ng.2868. PMC 3982316 . PMID 24413733. *Resumen para legos en: Leah Eisenstadt (30 de enero de 2014). "Mutación de un solo factor desencadenante hallada en un tumor cerebral poco frecuente". Instituto BROAD .
- ^ Zecchin D, Boscaro V, Medico E, Barault L, Martini M, Arena S, et al. (diciembre de 2013). "BRAF V600E es un determinante de la sensibilidad a los inhibidores del proteasoma". Molecular Cancer Therapeutics . 12 (12): 2950–2961. doi : 10.1158/1535-7163.MCT-13-0243 . hdl : 2318/140935 . PMID 24107445. S2CID 17012966.
- ^ King AJ, Patrick DR, Batorsky RS, Ho ML, Do HT, Zhang SY, et al. (diciembre de 2006). "Demostración de un índice terapéutico genético para tumores que expresan BRAF oncogénico mediante el inhibidor de quinasa SB-590885". Cancer Research . 66 (23): 11100–11105. doi : 10.1158/0008-5472.CAN-06-2554 . PMID 17145850.
- ^ Chapman PB, Hauschild A, Robert C, Haanen JB, Ascierto P, Larkin J, et al. (junio de 2011). "Mejora de la supervivencia con vemurafenib en el melanoma con mutación BRAF V600E". The New England Journal of Medicine . 364 (26). Grupo de estudio BRIM-3: 2507–2516. doi :10.1056/NEJMoa1103782. PMC 3549296 . PMID 21639808.
- ^ ab Das Thakur M, Salangsang F, Landman AS, Sellers WR, Pryer NK, Levesque MP, et al. (febrero de 2013). "Modelar la resistencia a vemurafenib en el melanoma revela una estrategia para prevenir la resistencia a los fármacos". Nature . 494 (7436): 251–255. Bibcode :2013Natur.494..251D. doi :10.1038/nature11814. PMC 3930354 . PMID 23302800.
- ^ Nazarian R, Shi H, Wang Q, Kong X, Koya RC, Lee H, et al. (diciembre de 2010). "Los melanomas adquieren resistencia a la inhibición de B-RAF(V600E) por la sobreexpresión de RTK o N-RAS". Nature . 468 (7326): 973–977. Bibcode :2010Natur.468..973N. doi :10.1038/nature09626. PMC 3143360 . PMID 21107323.
- ^ Degirmenci U, Yap J, Sim YR, Qin S, Hu J (2021). "Resistencia a fármacos en terapias dirigidas contra el cáncer con inhibidores de RAF". Resistencia a fármacos contra el cáncer . 4 (3): 665–683. doi : 10.20517/cdr.2021.36 . PMC 9094075 . PMID 35582307.
- ^ Guan KL, Figueroa C, Brtva TR, Zhu T, Taylor J, Barber TD, et al. (septiembre de 2000). "Regulación negativa de la serina/treonina quinasa B-Raf por Akt". The Journal of Biological Chemistry . 275 (35): 27354–27359. doi : 10.1074/jbc.M004371200 . PMID 10869359.
- ^ Weber CK, Slupsky JR, Kalmes HA, Rapp UR (mayo de 2001). "Active Ras induce heterodimerización de cRaf y BRaf". Cancer Research . 61 (9): 3595–3598. PMID 11325826.
- ^ Stang S, Bottorff D, Stone JC (junio de 1997). "La interacción de Ras activado con Raf-1 por sí sola puede ser suficiente para la transformación de células rat2". Biología molecular y celular . 17 (6): 3047–3055. doi :10.1128/MCB.17.6.3047. PMC 232157 . PMID 9154803.
- ^ Reuter CW, Catling AD, Jelinek T, Weber MJ (marzo de 1995). "Análisis bioquímico de la activación de MEK en fibroblastos NIH3T3. Identificación de B-Raf y otros activadores". The Journal of Biological Chemistry . 270 (13): 7644–7655. doi : 10.1074/jbc.270.13.7644 . PMID 7706312.
- ^ Ewing RM, Chu P, Elisma F, Li H, Taylor P, Climie S, et al. (2007). "Mapeo a gran escala de interacciones proteína-proteína humanas mediante espectrometría de masas". Biología de sistemas moleculares . 3 (1): 89. doi :10.1038/msb4100134. PMC 1847948 . PMID 17353931.
- ^ Qiu W, Zhuang S, von Lintig FC, Boss GR, Pilz RB (octubre de 2000). "Regulación específica del tipo celular de la quinasa B-Raf por AMPc y proteínas 14-3-3". The Journal of Biological Chemistry . 275 (41): 31921–31929. doi : 10.1074/jbc.M003327200 . PMID 10931830.
Lectura adicional
- Garnett MJ, Marais R (octubre de 2004). "Culpable según los cargos: B-RAF es un oncogén humano". Cancer Cell . 6 (4): 313–319. doi : 10.1016/j.ccr.2004.09.022 . PMID 15488754.
- Quiros RM, Ding HG, Gattuso P, Prinz RA, Xu X (junio de 2005). "Evidencia de que un subconjunto de carcinomas anaplásicos de tiroides se deriva de carcinomas papilares debido a mutaciones de BRAF y p53". Cancer . 103 (11): 2261–2268. doi : 10.1002/cncr.21073 . PMID 15880523. S2CID 29665029.
- Karbowniczek M, Henske EP (noviembre de 2005). "El papel de la tuberina en la diferenciación celular: ¿están implicadas B-Raf y MAPK?". Anales de la Academia de Ciencias de Nueva York . 1059 (1): 168–173. Bibcode :2005NYASA1059..168K. doi :10.1196/annals.1339.045. PMID 16382052. S2CID 39146204.
- Ciampi R, Nikiforov YE (marzo de 2007). "Reordenamientos de RET / PTC y mutaciones BRAF en la tumorigénesis de tiroides". Endocrinología . 148 (3): 936–941. doi : 10.1210/en.2006-0921 . PMID 16946010.
- Espinosa AV, Porchia L, Ringel MD (enero de 2007). "Dirigirse a BRAF en el cáncer de tiroides". Revista británica de cáncer . 96 (1): 16-20. doi : 10.1038/sj.bjc.6603520. PMC 2360215 . PMID 17179987.
- Allanson JE, Roberts AE (8 de agosto de 2019). "Síndrome de Noonan". En Pagon RA, Bird TD, Dolan CR, et al. (eds.). GeneReviews [Internet] . Seattle WA: Universidad de Washington, Seattle. PMID 20301303.
- Rauen KA (3 de marzo de 2016) [18 de enero de 2007]. "Síndrome cardiofaciocutáneo". En Pagon RA, Bird TD, Dolan CR (eds.). GeneReviews [Internet] . Seattle WA: Universidad de Washington, Seattle. PMID 20301365.
- Gelb BD, Tartaglia M (14 de mayo de 2015) [30 de noviembre de 2007]. "Síndrome LEOPARD". En Pagon RA, Bird TD, Dolan CR (eds.). GeneReviews [Internet] . Seattle WA: Universidad de Washington, Seattle. PMID 20301557.
Enlaces externos
- "Gen BRAF". Diccionario de términos sobre cáncer del NCI . Consultado el 25 de noviembre de 2007 .
- Encontrar fallos en BRAF Archivado el 19 de agosto de 2018 en Wayback Machine — Publicación del blog de Cancer Research UK sobre el descubrimiento de mutaciones BRAF que causan cáncer (incluye video)
- Página de detalles del gen BRAF y ubicación del genoma BRAF humano en el navegador de genoma de la UCSC .
![]() Este artículo incorpora material de dominio público del Diccionario de términos sobre el cáncer. Instituto Nacional del Cáncer de EE. UU .Este artículo incorpora texto de la Biblioteca Nacional de Medicina de los Estados Unidos , que se encuentra en el dominio público .
Este artículo incorpora material de dominio público del Diccionario de términos sobre el cáncer. Instituto Nacional del Cáncer de EE. UU .Este artículo incorpora texto de la Biblioteca Nacional de Medicina de los Estados Unidos , que se encuentra en el dominio público .