Dióxido de azufre
 | |
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC Dióxido de azufre | |
Otros nombres
| |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| 3535237 | |
| EBICh | |
| Química biológica | |
| Araña química | |
| Tarjeta informativa de la ECHA | 100.028.359 |
| Número CE |
|
| Número E | E220 (conservantes) |
| 1443 | |
| BARRIL | |
| Malla | Dióxido de azufre |
Identificador de centro de PubChem |
|
| Número RTECS |
|
| UNIVERSIDAD | |
| Número de la ONU | 1079, 2037 |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| ENTONCES 2 | |
| Masa molar | 64,066 g/mol |
| Apariencia | Gas incoloro y picante. |
| Olor | Picante; similar a una cerilla recién encendida [1] |
| Densidad | 2,619 kg m −3 [2] |
| Punto de fusión | −72 °C; −98 °F; 201 K |
| Punto de ebullición | -10 °C (14 °F; 263 K) |
| 94 g/L [3] forma ácido sulfuroso | |
| Presión de vapor | 230 kPa a 10 °C; 330 kPa a 20 °C; 462 kPa a 30 °C; 630 kPa a 40 °C [4] |
| Acidez (p K a ) | ~1,81 |
| Basicidad (p K b ) | ~12,19 |
| −18,2·10 −6 cm3 / mol | |
| Viscosidad | 12,82 μPa·s [5] |
| Estructura | |
| C 2v | |
| Digonal | |
| Diédrico | |
| 1,62 D | |
| Termoquímica | |
Entropía molar estándar ( S ⦵ 298 ) | 248,223 JK −1 mol −1 |
Entalpía estándar de formación (Δ f H ⦵ 298 ) | −296,81 kJ mol −1 |
| Peligros | |
| Etiquetado SGA : | |
  | |
| Peligro | |
| H314 , H331 [6] | |
| NFPA 704 (rombo cortafuegos) | |
| Dosis o concentración letal (LD, LC): | |
LC 50 ( concentración media ) | 3000 ppm (ratón, 30 min) 2520 ppm (rata, 1 h) [8] |
LC Lo ( valor más bajo publicado ) | 993 ppm (rata, 20 min) 611 ppm (rata, 5 h) 764 ppm (ratón, 20 min) 1000 ppm (humano, 10 min) 3000 ppm (humano, 5 min) [8] |
| NIOSH (límites de exposición a la salud en EE. UU.): | |
PEL (Permisible) | TWA 5 ppm (13 mg/m3 ) [ 7] |
REL (recomendado) | TWA 2 ppm (5 mg/m3 ) ST 5 ppm (13 mg/m3 ) [ 7] |
IDLH (Peligro inmediato) | 100 ppm [7] |
| Compuestos relacionados | |
| Monóxido de azufre Trióxido de azufre Monóxido de disazufre | |
Compuestos relacionados | Ozono Dióxido de selenio |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El dióxido de azufre ( ortografía recomendada por la IUPAC ) o dióxido de azufre ( inglés tradicional de la Commonwealth ) es el compuesto químico con la fórmula S O
2Es un gas incoloro de olor penetrante que causa el olor a fósforos quemados. Se libera de forma natural por la actividad volcánica y se produce como subproducto de la extracción de cobre y de la quema de combustibles fósiles que contienen azufre . [9]
El dióxido de azufre es algo tóxico para los seres humanos, aunque sólo cuando se inhala en cantidades relativamente grandes durante un período de varios minutos o más. Los alquimistas medievales lo conocían como "espíritu volátil de azufre". [10]
Estructura y unión
El SO 2 es una molécula curvada con un grupo puntual de simetría C 2v . Un enfoque de la teoría del enlace de valencia que considere solo los orbitales s y p describiría el enlace en términos de resonancia entre dos estructuras resonantes.

El enlace azufre-oxígeno tiene un orden de enlace de 1,5. Este enfoque simple, que no requiere la participación del orbital d , cuenta con respaldo . [11] En términos del formalismo de conteo de electrones , el átomo de azufre tiene un estado de oxidación de +4 y una carga formal de +1.
Aparición

El dióxido de azufre se encuentra en la Tierra y existe en concentraciones muy pequeñas en la atmósfera, alrededor de 15 ppb . [12]
En otros planetas, el dióxido de azufre se puede encontrar en diversas concentraciones, siendo la más significativa la atmósfera de Venus , donde es el tercer gas atmosférico más abundante con 150 ppm. Allí, reacciona con el agua para formar nubes de ácido sulfuroso (SO2 + H2O ⇌ HSO−3+ H+), y es un componente clave del ciclo atmosférico global del azufre del planeta y contribuye al calentamiento global . [13] Se lo ha implicado como un agente clave en el calentamiento del Marte primitivo , con estimaciones de concentraciones en la atmósfera inferior de hasta 100 ppm, [14] aunque solo existe en cantidades traza. Tanto en Venus como en Marte, al igual que en la Tierra, se cree que su fuente principal es volcánica. La atmósfera de Ío , un satélite natural de Júpiter , es 90% dióxido de azufre [15] y se cree que también existen cantidades traza en la atmósfera de Júpiter . El telescopio espacial James Webb ha observado la presencia de dióxido de azufre en el exoplaneta WASP-39b , donde se forma a través de la fotoquímica en la atmósfera del planeta. [16]
Se cree que existe en abundancia como hielo en las lunas galileanas , como hielo sublimado o escarcha en el hemisferio posterior de Ío , [17] y en la corteza y el manto de Europa , Ganímedes y Calisto , posiblemente también en forma líquida y reaccionando fácilmente con el agua. [18]
Producción
El dióxido de azufre se produce principalmente para la fabricación de ácido sulfúrico (véase el proceso de contacto , pero otros procesos lo precedieron al menos desde el siglo XVI [10] ). En los Estados Unidos en 1979, se utilizaron 23,6 millones de toneladas métricas (26 millones de toneladas cortas estadounidenses) de dióxido de azufre de esta manera, en comparación con 150.000 toneladas métricas (165.347 toneladas cortas estadounidenses) utilizadas para otros fines. La mayor parte del dióxido de azufre se produce por la combustión de azufre elemental . También se produce algo de dióxido de azufre tostando pirita y otros minerales de sulfuro en el aire. [19]
Rutas de combustión
El dióxido de azufre es el producto de la quema de azufre o de la quema de materiales que contienen azufre:
- S8 +8O2 → 8SO2 , ΔH = −297 kJ / mol
Para ayudar a la combustión, se rocía azufre licuado (140–150 °C (284–302 °F) a través de una boquilla atomizadora para generar gotas finas de azufre con una gran superficie. La reacción es exotérmica y la combustión produce temperaturas de 1000–1600 °C (1830–2910 °F). La cantidad significativa de calor producido se recupera mediante la generación de vapor que posteriormente se puede convertir en electricidad. [19]
La combustión del sulfuro de hidrógeno y de los compuestos organosulfurados se produce de forma similar. Por ejemplo:
- 2H2S + 3O2 → 2SO2 + 2H2O
La tostación de minerales de sulfuro como la pirita , la esfalrita y el cinabrio (sulfuro de mercurio) también libera SO 2 : [20]
- 4 FeS2 + 11 O2 → 2 Fe2O3 + 8 SO2
- 2ZnS + 3O2 → 2ZnO + 2SO2
- HgS + O2 → Hg + SO2
- 4 FeS + 7 O 2 → 2 Fe 2 O 3 + 4 SO 2
Una combinación de estas reacciones es responsable de la mayor fuente de dióxido de azufre: las erupciones volcánicas. Estos eventos pueden liberar millones de toneladas de SO 2 .
Reducción de óxidos superiores
El dióxido de azufre también puede ser un subproducto en la fabricación de cemento de silicato de calcio ; en este proceso, el CaSO4 se calienta con coque y arena:
- 2 CaSO 4 + 2 SiO 2 + C → 2 CaSiO 3 + 2 SO 2 + CO 2
Hasta la década de 1970, se producían cantidades comerciales de ácido sulfúrico y cemento mediante este proceso en Whitehaven , Inglaterra. Al mezclarse con pizarra o marga y tostarse, el sulfato liberaba dióxido de azufre gaseoso, que se utilizaba en la producción de ácido sulfúrico; la reacción también producía silicato de calcio, un precursor en la producción de cemento. [21]
A escala de laboratorio, la acción del ácido sulfúrico concentrado caliente sobre virutas de cobre produce dióxido de azufre.
- Cu + 2 H 2 SO 4 → CuSO 4 + SO 2 + 2 H 2 O
El estaño también reacciona con ácido sulfúrico concentrado, pero produce sulfato de estaño (II) que luego puede pirolizarse a 360 °C en dióxido de estaño y dióxido de azufre seco.
- Sn + H2SO4 → SnSO4 + H2
- SnSO4 → SnO2 + SO2
De sulfitos
La reacción inversa ocurre durante la acidificación:
- H ++ HSO4−3 → SO2 + H2O
Reacciones
Los sulfitos resultan de la acción de una base acuosa sobre el dióxido de azufre:
- SO 2 + 2 NaOH → Na 2 SO 3 + H 2 O
El dióxido de azufre es un agente reductor suave pero útil . Se oxida con halógenos para dar haluros de sulfurilo, como el cloruro de sulfurilo :
- SO2 + Cl2 → SO2Cl2
El dióxido de azufre es el agente oxidante en el proceso Claus , que se lleva a cabo a gran escala en las refinerías de petróleo . En este proceso, el dióxido de azufre se reduce con sulfuro de hidrógeno para dar azufre elemental:
- SO2 + 2H2S → 3S + 2H2O
La oxidación secuencial del dióxido de azufre seguida de su hidratación se utiliza en la producción de ácido sulfúrico.
- SO2 + H2O + 1 ⁄ 2 O2 → H2SO4
El dióxido de azufre se disuelve en agua para formar " ácido sulfuroso ", que no se puede aislar y es en cambio una solución ácida de iones bisulfito y posiblemente sulfito .
- SO2 + H2O ⇌ HSO−3+ H + K a = 1,54 × 10 −2 ; p K a = 1,81
Reacciones de laboratorio
El dióxido de azufre es uno de los pocos gases ácidos pero reductores comunes. Hace que el tornasol húmedo se torne rosado (por ser ácido) y luego blanco (debido a su efecto blanqueador). Se puede identificar burbujeándolo a través de una solución de dicromato , lo que hace que la solución pase de naranja a verde (Cr 3+ (aq)). También puede reducir los iones férricos a ferrosos. [22]
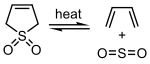
El dióxido de azufre puede reaccionar con ciertos 1,3- dienos en una reacción quelotrópica para formar sulfonas cíclicas . Esta reacción se aprovecha a escala industrial para la síntesis de sulfolano , que es un disolvente importante en la industria petroquímica .
El dióxido de azufre puede unirse a iones metálicos como ligando para formar complejos de dióxido de azufre metálico , típicamente donde el metal de transición está en estado de oxidación 0 o +1. Se reconocen muchos modos de enlace diferentes (geometrías), pero en la mayoría de los casos, el ligando es monodentado, unido al metal a través del azufre, que puede ser planar y piramidal η 1 . [9] Como ligando η 1 -SO 2 (planar con enlace S), el dióxido de azufre funciona como una base de Lewis utilizando el par solitario en S. SO 2 funciona como un ácido de Lewis en su modo de enlace η 1 -SO 2 (piramidal con enlace S) con metales y en sus aductos 1:1 con bases de Lewis como dimetilacetamida y trimetilamina . Cuando se une a bases de Lewis, los parámetros ácidos de SO 2 son E A = 0,51 y E A = 1,56.
Usos
El uso dominante y generalizado del dióxido de azufre es en la producción de ácido sulfúrico . [19]
Precursor del ácido sulfúrico
El dióxido de azufre es un intermediario en la producción de ácido sulfúrico, que se convierte en trióxido de azufre y luego en óleum , que se transforma en ácido sulfúrico. El dióxido de azufre para este propósito se produce cuando el azufre se combina con el oxígeno. El método de conversión de dióxido de azufre en ácido sulfúrico se denomina proceso de contacto . Se producen varios millones de toneladas al año para este propósito.
Conservante de alimentos
El dióxido de azufre se utiliza a veces como conservante para albaricoques secos, higos secos y otras frutas secas, debido a sus propiedades antimicrobianas y su capacidad para prevenir la oxidación , [23] y se llama E 220 [24] cuando se usa de esta manera en Europa. Como conservante, mantiene la apariencia colorida de la fruta y evita la pudrición . Históricamente, la melaza se "sulfurizaba" como conservante y también para aclarar su color. El tratamiento de la fruta seca generalmente se hacía al aire libre, encendiendo azufre sublimado y quemándolo en un espacio cerrado con las frutas. [25] Las frutas se pueden sulfurar sumergiéndolas en bisulfito de sodio , sulfito de sodio o metabisulfito de sodio . [25]
Elaboración de vino
El dióxido de azufre fue utilizado por primera vez en la elaboración de vino por los romanos, cuando descubrieron que quemar velas de azufre dentro de recipientes de vino vacíos los mantenía frescos y libres de olor a vinagre. [26]
Sigue siendo un compuesto importante en la elaboración del vino y se mide en partes por millón ( ppm ) en el vino. Está presente incluso en el llamado vino no sulfurado en concentraciones de hasta 10 mg/L. [27] Actúa como antibiótico y antioxidante , protegiendo al vino del deterioro por bacterias y la oxidación, un fenómeno que conduce al pardeamiento del vino y a la pérdida de sabores específicos de la variedad. [28] [29] Su acción antimicrobiana también ayuda a minimizar la acidez volátil. Los vinos que contienen dióxido de azufre suelen estar etiquetados con "que contienen sulfitos ".
El dióxido de azufre existe en el vino en forma libre y ligada, y las combinaciones se denominan SO2 total . La unión, por ejemplo, al grupo carbonilo del acetaldehído , varía según el vino en cuestión. La forma libre existe en equilibrio entre el SO2 molecular ( como gas disuelto) y el ion bisulfito, que a su vez está en equilibrio con el ion sulfito. Estos equilibrios dependen del pH del vino. Un pH más bajo desplaza el equilibrio hacia el SO2 molecular (gaseoso) , que es la forma activa, mientras que a un pH más alto se encuentra más SO2 en las formas inactivas de sulfito y bisulfito. El SO2 molecular es activo como antimicrobiano y antioxidante, y esta es también la forma que puede percibirse como un olor acre en niveles altos. Los vinos con concentraciones totales de SO2 inferiores a 10 ppm no requieren "contiene sulfitos" en la etiqueta según las leyes de EE. UU. y la UE. El límite superior de SO2 total permitido en el vino en EE. UU. es de 350 ppm; En la UE, es de 160 ppm para los vinos tintos y de 210 ppm para los vinos blancos y rosados. En concentraciones bajas, el SO2 es prácticamente indetectable en el vino, pero en concentraciones de SO2 libre superiores a 50 ppm, el SO2 se hace evidente en el olor y el sabor del vino. [ cita requerida ]
El SO 2 también es un compuesto muy importante en la desinfección de bodegas. Las bodegas y los equipos deben mantenerse limpios y, como no se puede utilizar lejía en una bodega debido al riesgo de que el corcho se eche a perder , [30] se utiliza habitualmente una mezcla de SO 2 , agua y ácido cítrico para limpiar y desinfectar los equipos. El ozono (O 3 ) se utiliza ahora ampliamente para la desinfección de bodegas debido a su eficacia y porque no afecta al vino ni a la mayoría de los equipos. [31]
Como agente reductor
El dióxido de azufre también es un buen reductor . En presencia de agua, el dióxido de azufre es capaz de decolorar sustancias. En concreto, es un blanqueador reductor útil para papeles y materiales delicados como la ropa. Este efecto blanqueador normalmente no dura mucho. El oxígeno de la atmósfera reoxida los tintes reducidos, restaurando el color. En el tratamiento de aguas residuales municipales, el dióxido de azufre se utiliza para tratar las aguas residuales cloradas antes de su vertido. El dióxido de azufre reduce el cloro libre y combinado a cloruro . [32]
El dióxido de azufre es bastante soluble en agua y, tanto por espectroscopia IR como por espectroscopia Raman, el ácido sulfuroso hipotético , H 2 SO 3 , no está presente en ninguna medida. Sin embargo, dichas soluciones sí muestran espectros del ion sulfito de hidrógeno, HSO 3 − , por reacción con agua, y de hecho es el agente reductor real presente:
- SO 2 + H 2 O ⇌ HSO 3 − + H +
Como fumigante
A principios del siglo XX, el dióxido de azufre se utilizó en Buenos Aires como fumigante para matar ratas portadoras de la bacteria Yersinia pestis , causante de la peste bubónica. La aplicación tuvo éxito y la aplicación de este método se extendió a otras zonas de América del Sur. En Buenos Aires, donde estos aparatos se conocían como Sulfurozador , pero más tarde también en Río de Janeiro, Nueva Orleans y San Francisco, las máquinas de tratamiento con dióxido de azufre se llevaron a las calles para permitir amplias campañas de desinfección, con resultados efectivos. [33]
Funciones bioquímicas y biomédicas
El dióxido de azufre o su base conjugada bisulfito se produce biológicamente como intermediario tanto en organismos reductores de sulfato como en bacterias oxidantes de azufre. El papel del dióxido de azufre en la biología de los mamíferos aún no se comprende bien. [34] El dióxido de azufre bloquea las señales nerviosas de los receptores de estiramiento pulmonar y elimina el reflejo de inflación de Hering-Breuer .
Se considera que el dióxido de azufre endógeno desempeña un papel fisiológico importante en la regulación de la función cardíaca y de los vasos sanguíneos , y el metabolismo aberrante o deficiente del dióxido de azufre puede contribuir a varias enfermedades cardiovasculares diferentes, como la hipertensión arterial , la aterosclerosis , la hipertensión arterial pulmonar y la estenocardia . [35]
Se ha demostrado que en niños con hipertensión arterial pulmonar debida a cardiopatías congénitas el nivel de homocisteína es más alto y el nivel de dióxido de azufre endógeno es más bajo que en niños de control normales. Además, estos parámetros bioquímicos se correlacionan fuertemente con la gravedad de la hipertensión arterial pulmonar. Los autores consideraron que la homocisteína es uno de los marcadores bioquímicos útiles de la gravedad de la enfermedad y el metabolismo del dióxido de azufre es uno de los objetivos terapéuticos potenciales en esos pacientes. [36]
También se ha demostrado que el dióxido de azufre endógeno reduce la tasa de proliferación de las células musculares lisas endoteliales en los vasos sanguíneos, al reducir la actividad de MAPK y activar la adenilil ciclasa y la proteína quinasa A. [ 37] La proliferación de células musculares lisas es uno de los mecanismos importantes de remodelación hipertensiva de los vasos sanguíneos y su estenosis , por lo que es un mecanismo patogénico importante en la hipertensión arterial y la aterosclerosis.
El dióxido de azufre endógeno en bajas concentraciones causa vasodilatación dependiente del endotelio . En concentraciones más altas causa vasodilatación independiente del endotelio y tiene un efecto inotrópico negativo sobre la función del gasto cardíaco, reduciendo así eficazmente la presión arterial y el consumo de oxígeno del miocardio. Los efectos vasodilatadores y broncodilatadores del dióxido de azufre están mediados por los canales de calcio dependientes de ATP y los canales de calcio de tipo L ("dihidropiridina"). El dióxido de azufre endógeno también es un potente agente antiinflamatorio, antioxidante y citoprotector. Reduce la presión arterial y retarda la remodelación hipertensiva de los vasos sanguíneos, especialmente el engrosamiento de su íntima. También regula el metabolismo de los lípidos. [38]
El dióxido de azufre endógeno también disminuye el daño miocárdico, causado por la hiperestimulación adrenérgica del isoproterenol , y fortalece la reserva de defensa antioxidante del miocardio. [39]
Como reactivo y disolvente en el laboratorio.
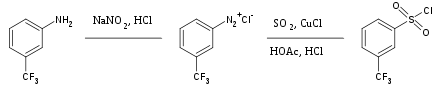
El dióxido de azufre es un disolvente inerte versátil que se utiliza ampliamente para disolver sales altamente oxidantes. También se utiliza ocasionalmente como fuente del grupo sulfonilo en la síntesis orgánica . El tratamiento de sales de aril diazonio con dióxido de azufre y cloruro cuproso produce el cloruro de aril sulfonilo correspondiente, por ejemplo: [40]
Como resultado de su basicidad de Lewis muy baja , a menudo se utiliza como un disolvente/diluyente de baja temperatura para superácidos como el ácido mágico (FSO 3 H/SbF 5 ), lo que permite observar espectroscópicamente especies altamente reactivas como el catión terc -butilo a baja temperatura (aunque los carbocationes terciarios reaccionan con SO 2 por encima de aproximadamente -30 °C, e incluso disolventes menos reactivos como SO 2 ClF deben usarse a estas temperaturas más altas). [41]
Como refrigerante
El dióxido de azufre , que se condensa fácilmente y posee un alto calor de evaporación , es un material candidato para refrigerantes. Antes del desarrollo de los clorofluorocarbonos , el dióxido de azufre se utilizaba como refrigerante en los refrigeradores domésticos .
Como indicador de actividad volcánica
La Oficina Meteorológica de Islandia mide el contenido de dióxido de azufre en los gases geotérmicos liberados naturalmente como indicador de posible actividad volcánica. [42]
Seguridad

Ingestión
En los Estados Unidos, el Centro para la Ciencia en el Interés Público enumera los dos conservantes alimentarios, el dióxido de azufre y el bisulfito de sodio , como seguros para el consumo humano, excepto para ciertas personas asmáticas que pueden ser sensibles a ellos, especialmente en grandes cantidades. [43] Los síntomas de sensibilidad a los agentes sulfitantes , incluido el dióxido de azufre, se manifiestan como dificultad para respirar potencialmente mortal a los pocos minutos de la ingestión. [44] Los sulfitos también pueden causar síntomas en personas no asmáticas, a saber, dermatitis , urticaria , sofocos , hipotensión , dolor abdominal y diarrea, e incluso anafilaxia potencialmente mortal . [45]
Inhalación
La exposición incidental al dióxido de azufre es habitual, por ejemplo, el humo de las cerillas, el carbón y los combustibles que contienen azufre, como el combustible para búnkeres . En comparación con otras sustancias químicas, es sólo ligeramente tóxico y requiere altas concentraciones para ser activamente peligroso. [46] Sin embargo, su ubicuidad lo convierte en un importante contaminante del aire con impactos significativos en la salud humana. [47]
En 2008, la Conferencia Americana de Higienistas Industriales Gubernamentales redujo el límite de exposición a corto plazo a 0,25 partes por millón (ppm). En los EE. UU., la OSHA fijó el PEL en 5 ppm (13 mg/m 3 ) de promedio ponderado en el tiempo. También en los EE. UU., NIOSH fijó el IDLH en 100 ppm. [48] En 2010, la EPA "revisó las NAAQS primarias de SO 2 estableciendo un nuevo estándar de una hora a un nivel de 75 partes por mil millones (ppb) . La EPA revocó las dos normas primarias existentes porque no proporcionarían protección adicional a la salud pública dado un estándar de una hora a 75 ppb". [47]
Papel del medio ambiente
Contaminación del aire

Las grandes erupciones volcánicas tienen un efecto abrumador en las concentraciones de aerosoles de sulfato en los años en que ocurren: las erupciones con un rango de 4 o más en el Índice de Explosividad Volcánica inyectan SO2 y vapor de agua directamente en la estratosfera , donde reaccionan para crear columnas de aerosoles de sulfato. [49] Las emisiones volcánicas varían significativamente en composición y tienen una química compleja debido a la presencia de partículas de ceniza y una amplia variedad de otros elementos en la columna. Solo los estratovolcanes que contienen principalmente magmas félsicos son responsables de estos flujos, ya que el magma máfico que erupciona en volcanes escudo no da como resultado columnas que alcancen la estratosfera. [50] Sin embargo, antes de la Revolución Industrial , la vía del sulfuro de dimetilo era la que más contribuía a las concentraciones de aerosoles de sulfato en un año más promedio sin actividad volcánica importante. Según el Primer Informe de Evaluación del IPCC , publicado en 1990, las emisiones volcánicas ascendieron por lo general a alrededor de 10 millones de toneladas en la década de 1980, mientras que el sulfuro de dimetilo ascendió a 40 millones de toneladas. Sin embargo, en ese momento, las emisiones globales de azufre causadas por el hombre a la atmósfera se volvieron "al menos tan grandes" como todas las emisiones naturales de compuestos que contienen azufre juntas : eran menos de 3 millones de toneladas por año en 1860, y luego aumentaron a 15 millones de toneladas en 1900, 40 millones de toneladas en 1940 y alrededor de 80 millones en 1980. El mismo informe señaló que "en las regiones industrializadas de Europa y América del Norte, las emisiones antropogénicas dominan sobre las emisiones naturales en un factor de aproximadamente diez o incluso más". [51] En el este de los Estados Unidos, se estimó que las partículas de sulfato representaban el 25% o más de toda la contaminación del aire. [52] La exposición a las emisiones de dióxido de azufre de las centrales eléctricas de carbón (PM 2,5 de carbón ) en los EE. UU. se asoció con un riesgo de mortalidad 2,1 veces mayor que la exposición a PM 2,5 de todas las fuentes. [53] Mientras tanto, el hemisferio sur tuvo concentraciones mucho más bajas debido a que está mucho menos densamente poblado, con un estimado del 90% de la población humana en el norte. A principios de la década de 1990, el azufre antropogénico dominaba en el hemisferio norte , donde solo el 16% de las emisiones anuales de azufre eran naturales, pero representaban menos de la mitad de las emisiones en el hemisferio sur. [54]

Este aumento de las emisiones de aerosoles de sulfato tuvo diversos efectos. En su momento, el más visible fue la lluvia ácida , causada por la precipitación de nubes que transportaban altas concentraciones de aerosoles de sulfato en la troposfera . [55] En su apogeo, la lluvia ácida ha eliminado la trucha de arroyo y algunas otras especies de peces e insectos de lagos y arroyos en áreas geográficamente sensibles, como las montañas Adirondack en los Estados Unidos. [56] La lluvia ácida empeora la función del suelo , ya que se pierde parte de su microbiota y se movilizan metales pesados como el aluminio (se propagan más fácilmente), mientras que los nutrientes y minerales esenciales como el magnesio pueden filtrarse debido a lo mismo. En última instancia, las plantas que no pueden tolerar un pH bajo mueren, y los bosques montañosos son algunos de los ecosistemas más afectados debido a su exposición regular a la niebla portadora de sulfato a grandes altitudes. [57] [58] [59] [60] [61] Aunque la lluvia ácida estaba demasiado diluida para afectar directamente la salud humana, se sabe que respirar smog o incluso cualquier aire con concentraciones elevadas de sulfato contribuye a afecciones cardíacas y pulmonares , incluidas el asma y la bronquitis . [52] Además, esta forma de contaminación está relacionada con el parto prematuro y el bajo peso al nacer , y un estudio de 74.671 mujeres embarazadas en Beijing encontró que cada 100 μg/m 3 adicionales de SO 2 en el aire reducían el peso de los bebés en 7,3 g, lo que lo convierte, junto con otras formas de contaminación del aire, en el mayor factor de riesgo atribuible al bajo peso al nacer jamás observado. [62]
Medidas de control

Debido en gran medida al Programa de Lluvia Ácida de la Agencia de Protección Ambiental de Estados Unidos (EPA) , las emisiones en ese país disminuyeron un 33% entre 1983 y 2002 (véase la tabla). Esta mejora se debió en parte a la desulfuración de gases de combustión , una tecnología que permite que el SO2 se adhiera químicamente en las centrales eléctricas que queman carbón o petróleo que contienen azufre.
| Año | SO 2 |
|---|---|
| 1970 | 31.161.000 toneladas cortas (28,3 Mt) |
| 1980 | 25.905.000 toneladas cortas (23,5 Mt) |
| 1990 | 23.678.000 toneladas cortas (21,5 Mt) |
| 1996 | 18.859.000 toneladas cortas (17,1 Mt) |
| 1997 | 19.363.000 toneladas cortas (17,6 Mt) |
| 1998 | 19.491.000 toneladas cortas (17,7 Mt) |
| 1999 | 18.867.000 toneladas cortas (17,1 Mt) |
En particular, el óxido de calcio (cal) reacciona con el dióxido de azufre para formar sulfito de calcio :
- CaO + SO2 → CaSO3
La oxidación aeróbica del CaSO 3 produce CaSO 4 , anhidrita . La mayor parte del yeso que se vende en Europa procede de la desulfuración de gases de combustión.
Para controlar las emisiones de azufre, se han desarrollado docenas de métodos con eficiencias relativamente altas para la instalación de plantas de energía a carbón. [64] El azufre se puede eliminar del carbón durante la combustión utilizando piedra caliza como material de lecho en la combustión en lecho fluidizado . [65]
El azufre también se puede eliminar de los combustibles antes de quemarlos, lo que evita la formación de SO2 cuando se quema el combustible. El proceso Claus se utiliza en refinerías para producir azufre como subproducto. El proceso Stretford también se ha utilizado para eliminar el azufre del combustible. También se pueden utilizar procesos redox que utilizan óxidos de hierro, por ejemplo, Lo-Cat [66] o Sulferox. [67]
Se pueden utilizar aditivos de combustible como aditivos de calcio y carboxilato de magnesio en motores marinos para reducir la emisión de gases de dióxido de azufre a la atmósfera. [68]
Impacto en el cambio climático

Impactos proyectados

Dado que los cambios en las concentraciones de aerosoles ya tienen un impacto en el clima global, necesariamente influirán también en las proyecciones futuras. De hecho, es imposible estimar completamente el impacto del calentamiento de todos los gases de efecto invernadero sin tener en cuenta el enfriamiento que contrarresta el efecto de los aerosoles. [78] [79]
Independientemente de la fuerza actual del enfriamiento por aerosoles, todos los escenarios futuros de cambio climático proyectan disminuciones en las partículas y esto incluye los escenarios donde se cumplen los objetivos de 1,5 °C (2,7 °F) y 2 °C (3,6 °F): sus objetivos específicos de reducción de emisiones suponen la necesidad de compensar el menor oscurecimiento. [80] Dado que los modelos estiman que el enfriamiento causado por los sulfatos es en gran medida equivalente al calentamiento causado por el metano atmosférico (y dado que el metano es un gas de efecto invernadero de vida relativamente corta), se cree que las reducciones simultáneas en ambos se cancelarían efectivamente entre sí. [81]
[82] Sin embargo, en los últimos años, las concentraciones de metano han aumentado a tasas que superan su período anterior de crecimiento máximo en la década de 1980, [83] [84] con las emisiones de metano de los humedales impulsando gran parte del crecimiento reciente, [85] [86] mientras que la contaminación del aire se está limpiando agresivamente. [87] Estas tendencias son algunas de las principales razones por las que ahora se espera un calentamiento de 1,5 °C (2,7 °F) alrededor de 2030, a diferencia de las estimaciones de mediados de la década de 2010, donde no ocurriría hasta 2040. [78]Geoingeniería solar

Propiedades
Tabla de propiedades térmicas y físicas del dióxido de azufre líquido saturado: [99] [100]
| Temperatura (°C) | Densidad (kg/m3) | Calor específico (kJ/kg·K) | Viscosidad cinemática (m^2/s) | Conductividad (W/m·K) | Difusividad térmica (m^2/s) | Número de Prandtl | Módulo volumétrico (K^-1) |
| -50 | 1560.84 | 1.3595 | 4.84E-07 | 0,242 | 1.14E-07 | 4.24 | – |
| -40 | 1536.81 | 1.3607 | 4.24E-07 | 0,235 | 1.13E-07 | 3.74 | – |
| -30 | 1520.64 | 1.3616 | 3.71E-07 | 0,23 | 1.12E-07 | 3.31 | – |
| -20 | 1488.6 | 1.3624 | 3.24E-07 | 0,225 | 1.11E-07 | 2.93 | – |
| -10 | 1463.61 | 1.3628 | 2.88E-07 | 0,218 | 1.10E-07 | 2.62 | – |
| 0 | 1438,46 | 1.3636 | 2.57E-07 | 0,211 | 1.08E-07 | 2.38 | – |
| 10 | 1412.51 | 1.3645 | 2.32E-07 | 0,204 | 1.07E-07 | 2.18 | – |
| 20 | 1386.4 | 1.3653 | 2.10E-07 | 0,199 | 1.05E-07 | 2 | 1.94E-03 |
| 30 | 1359.33 | 1.3662 | 1.90E-07 | 0,192 | 1.04E-07 | 1.83 | – |
| 40 | 1329.22 | 1.3674 | 1.73E-07 | 0,185 | 1.02E-07 | 1.7 | – |
| 50 | 1299.1 | 1.3683 | 1.62E-07 | 0,177 | 9.99E-08 | 1.61 | – |
Véase también
- Combustible bunker
- Normas nacionales de calidad del aire ambiental
- Trióxido de azufre
- Ciclo del azufre y el yodo
Referencias
- ^ Dióxido de azufre Archivado el 30 de diciembre de 2019 en Wayback Machine , Biblioteca Nacional de Medicina de EE. UU.
- ^ "Dióxido de azufre". Archivado desde el original el 24 de septiembre de 2023. Consultado el 22 de marzo de 2024 .Biblioteca Nacional de Medicina de EE. UU.
- ^ Lide DR, ed. (2006). Manual de química y física del CRC (87.ª edición). Boca Raton, FL: CRC Press . ISBN 0-8493-0487-3.
- ^ "Banco de datos de sustancias peligrosas".
- ^ Miller J Jr, Shah P, Yaws C (1976). "Constantes de correlación para compuestos químicos". Ingeniería química . 83 (25): 153–180. ISSN 0009-2460.
- ^ "Inventario C&L".
- ^ abc Guía de bolsillo del NIOSH sobre peligros químicos. "#0575". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ ab "Dióxido de azufre". Concentraciones inmediatamente peligrosas para la vida o la salud (IDLH) . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ ab Greenwood NN , Earnshaw A (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- ^ ab Wothers P (2019). Antimonio, oro y el lobo de Júpiter: cómo se nombraron los elementos. Oxford University Press. ISBN 978-0-19-965272-3.
- ^ Cunningham, Terence P., Cooper, David L., Gerratt, Joseph, Karadakov, Peter B., Raimondi, Mario (1997). "Enlace químico en oxofluoruros de azufre hipercoordinado". Revista de la Sociedad Química, Faraday Transactions . 93 (13): 2247–2254. doi :10.1039/A700708F.
- ^ US EPA O (4 de mayo de 2016). "Tendencias del dióxido de azufre". www.epa.gov . Consultado el 16 de febrero de 2023 .
- ^ Marcq E, Bertaux JL, Montmessin F, Belyaev D (2012). "Variaciones del dióxido de azufre en la parte superior de las nubes de la atmósfera dinámica de Venus". Nature Geoscience . 6 (1): 25–28. Bibcode :2013NatGe...6...25M. doi :10.1038/ngeo1650. ISSN 1752-0894. S2CID 59323909.
- ^ Halevy I, Zuber MT, Schrag DP (2007). "Una retroalimentación climática del dióxido de azufre en el Marte primitivo". Science . 318 (5858): 1903–1907. Bibcode :2007Sci...318.1903H. doi :10.1126/science.1147039. ISSN 0036-8075. PMID 18096802. S2CID 7246517.
- ^ Lellouch E (2007). "La atmósfera de Io". En Lopes, RMC , Spencer, JR (eds.). Io después de Galileo . Springer-Praxis. págs. 231–264. ISBN 978-3-540-34681-4.
- ^ "El telescopio espacial James Webb revela una atmósfera de exoplaneta como nunca antes se había visto".
- ^ Cruikshank DP, Howell RR, Geballe TR, Fanale FP (1985). "Hielo de dióxido de azufre en IO". ICES en el sistema solar . págs. 805–815. doi :10.1007/978-94-009-5418-2_55. ISBN 978-94-010-8891-6.
- ^ La química oculta del hielo en Europa – Laboratorio de Propulsión a Chorro de la NASA. Jpl.nasa.gov (4 de octubre de 2010). Recuperado el 24 de septiembre de 2013.
- ^ abcMüller , Hermann. "Dióxido de azufre". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a25_569. ISBN 978-3527306732.
- ^ Shriver, Atkins. Química inorgánica, quinta edición. WH Freeman and Company; Nueva York, 2010; pág. 414.
- ^ ESTUDIO ARQUEOLÓGICO DE LA COSTA DE WHITEHAVEN. lakestay.co.uk (2007)
- ^ "Información archivada en la Web" (PDF) .
- ^ Zamboni CB, Medeiros IM, de Medeiros JA (octubre de 2011). Análisis de azufre en frutos secos mediante NAA (PDF) . 2011 Conferencia Internacional del Atlántico Nuclear – INAC 2011. ISBN 978-85-99141-03-8Archivado desde el original (PDF) el 4 de junio de 2020 . Consultado el 4 de junio de 2020 .
- ^ Aditivos actuales aprobados por la UE y sus números E, sitio web de la Agencia de Normas Alimentarias.
- ^ ab Conservación de alimentos: secado de frutas y verduras (PDF) , Servicio de extensión cooperativa de la Universidad de Georgia, archivado desde el original (PDF) el 27 de septiembre de 2022 , consultado el 6 de junio de 2022
- ^ "Practical Winery & Vineyard Journal, enero/febrero de 2009". www.practicalwinery.com. 1 de febrero de 2009. Archivado desde el original el 28 de septiembre de 2013.
- ^ Sulfitos en el vino, MoreThanOrganic.com.
- ^ Jackson, RS (2008) Ciencia del vino: principios y aplicaciones, Ámsterdam; Boston: Elsevier/Academic Press
- ^ Guerrero RF, Cantos-Villar E (2015). "Demostración de la eficiencia de las sustituciones de dióxido de azufre en el vino: una revisión de parámetros". Tendencias en Ciencia y Tecnología de Alimentos . 42 (1): 27–43. doi :10.1016/j.tifs.2014.11.004.
- ^ Uso de cloro en las bodegas. Universidad de Purdue
- ^ Uso de ozono para el saneamiento ambiental y de bodegas Archivado el 12 de septiembre de 2017 en Wayback Machine , Practical Winery & Vineyard Journal.
- ^ Tchobanoglous G (1979). Ingeniería de aguas residuales (3.ª ed.). Nueva York: McGraw Hill. ISBN 0-07-041677-X.
- ^ Engelmann L (julio de 2018). "Fumigando la ciudad modelo higiénica: peste bubónica y sulfurozador en Buenos Aires a principios del siglo XX". Historia médica . 62 (3): 360–382. doi :10.1017/mdh.2018.37. PMC 6113751 . PMID 29886876.
- ^ Liu D, Jin H, Tang C, Du J (2010). "Dióxido de azufre: una nueva señal gaseosa en la regulación de las funciones cardiovasculares". Mini-Revisiones en Química Medicinal . 10 (11): 1039–1045. doi :10.2174/1389557511009011039. PMID 20540708.
- ^ Tian H (5 de noviembre de 2014). "Avances en el estudio del dióxido de azufre endógeno en el sistema cardiovascular". Revista Médica China . 127 (21): 3803–3807. doi : 10.3760/cma.j.issn.0366-6999.20133031 . PMID 25382339. S2CID 11924999.
- ^ Yang R, Yang Y, Dong X, Wu X, Wei Y (agosto de 2014). "Correlación entre el dióxido de azufre endógeno y la homocisteína en niños con hipertensión arterial pulmonar asociada a cardiopatía congénita". Zhonghua Er Ke Za Zhi (en chino). 52 (8): 625–629. PMID 25224243.
- ^ Liu D, Huang Y, Bu D, Liu AD, Holmberg L, Jia Y, Tang C, Du J, Jin H (mayo de 2014). "El dióxido de azufre inhibe la proliferación de células musculares lisas vasculares mediante la supresión de la vía de la quinasa Erk/MAP mediada por la señalización de cAMP/PKA". Cell Death Dis . 5 (5): e1251. doi :10.1038/cddis.2014.229. PMC 4047873 . PMID 24853429.
- ^ Wang XB, Jin HF, Tang CS, Du JB (16 de noviembre de 2011). "El efecto biológico del dióxido de azufre endógeno en el sistema cardiovascular". Eur J Pharmacol . 670 (1): 1–6. doi :10.1016/j.ejphar.2011.08.031. PMID 21925165.
- ^ Liang Y, Liu D, Ochs T, Tang C, Chen S, Zhang S, Geng B, Jin H, Du J (enero de 2011). "El dióxido de azufre endógeno protege contra la lesión miocárdica inducida por isoproterenol y aumenta la capacidad antioxidante miocárdica en ratas". Lab. Invest . 91 (1): 12–23. doi : 10.1038/labinvest.2010.156 . PMID 20733562.
- ^ Hoffman, RV (1990). "Cloruro de m-trifluorometilbencenosulfonilo". Síntesis orgánica; Volúmenes recopilados , vol. 7, pág. 508.
- ^ Olah GA, Lukas J (1 de agosto de 1967). "Iones de carbonio estables. XLVII. Formación de iones de alquilcarbonio a partir de alcanos mediante la abstracción de iones de hidruro (alquido) en una solución de ácido fluorosulfónico-pentafluoruro de antimonio-clorofluoruro de sulfurilo". Revista de la Sociedad Química Americana . 89 (18): 4739–4744. doi :10.1021/ja00994a030. ISSN 0002-7863.
- ^ "Gases volcánicos". Oficina Meteorológica de Islandia . nd
- ^ "Centro para la Ciencia en el Interés Público – Cocina Química" . Consultado el 17 de marzo de 2010 .
- ^ "Departamento de Salud Pública de California: División de Alimentos y Medicamentos: Sulfitos" (PDF) . Archivado desde el original (PDF) el 23 de julio de 2012. Consultado el 27 de septiembre de 2013 .
- ^ Vally H, Misso NL (2012). "Reacciones adversas a los aditivos de sulfito". Gastroenterol Hepatol Bed Bench . 5 (1): 16–23. PMC 4017440 . PMID 24834193.
- ^ Conceptos básicos sobre el dióxido de azufre Agencia de Protección Ambiental de EE. UU.
- ^ ab Contaminación por dióxido de azufre (SO2). Agencia de Protección Ambiental de los Estados Unidos
- ^ "Guía de bolsillo del NIOSH sobre peligros químicos".
- ^ "Los aerosoles de azufre volcánico afectan el clima y la capa de ozono de la Tierra". Servicio Geológico de los Estados Unidos. Archivado desde el original el 14 de noviembre de 2015. Consultado el 17 de febrero de 2009 .
- ^ Mathera TA, Oppenheimer AG, McGonigle A (2004). "Química de aerosoles de emisiones de tres volcanes contrastantes en Italia". Atmospheric Environment . 38 (33): 5637–5649. Bibcode :2004AtmEn..38.5637M. doi :10.1016/j.atmosenv.2004.06.017.
- ^ IPCC, 1990: Capítulo 1: Gases de efecto invernadero y aerosoles [RT Watson, H. Rodhe, H. Oeschger y U. Siegenthaler]. En: Cambio climático: la evaluación científica del IPCC [JTHoughton, GJJenkins y JJEphraums (eds.)]. Cambridge University Press, Cambridge, Reino Unido y Nueva York, NY, EE. UU., págs. 31–34,
- ^ ab Efectos de la lluvia ácida – Salud humana Archivado el 18 de enero de 2008 en Wayback Machine . Epa.gov (2 de junio de 2006). Recuperado el 9 de febrero de 2013.
- ^ Henneman L, Choirat C, Dedoussi I, Dominici F, Roberts J, Zigler C (24 de noviembre de 2023). "Riesgo de mortalidad de la generación de electricidad a partir de carbón en Estados Unidos". Science . 382 (6673): 941–946. Bibcode :2023Sci...382..941H. doi :10.1126/science.adf4915. PMC 10870829 . PMID 37995235.
- ^ Bates TS, Lamb BK, Guenther A, Dignon J, Stoiber RE (abril de 1992). "Emisiones de azufre a la atmósfera de fuentes naturales". Journal of Atmospheric Chemistry . 14 (1–4): 315–337. Bibcode :1992JAtC...14..315B. doi :10.1007/BF00115242. ISSN 0167-7764. S2CID 55497518.
- ^ Burns DA, Aherne J, Gay DA, Lehmann CM (2016). "Lluvia ácida y sus efectos ambientales: avances científicos recientes". Atmospheric Environment . 146 : 1–4. Bibcode :2016AtmEn.146....1B. doi : 10.1016/j.atmosenv.2016.10.019 .
- ^ "Efectos de la lluvia ácida: aguas superficiales y animales acuáticos". Agencia de Protección Ambiental de los Estados Unidos . Archivado desde el original el 14 de mayo de 2009.
- ^ Rodhe H, Dentener F, Schulz M (1 de octubre de 2002). "La distribución global de la deposición húmeda acidificante". Environmental Science & Technology . 36 (20): 4382–4388. Bibcode :2002EnST...36.4382R. doi :10.1021/es020057g. ISSN 0013-936X. PMID 12387412.
- ^ EPA de EE. UU.: Efectos de la lluvia ácida en los bosques Archivado el 26 de julio de 2008 en Wayback Machine.
- ^ Likens GE, Driscoll CT, Buso DC (1996). "Efectos a largo plazo de la lluvia ácida: respuesta y recuperación de un ecosistema forestal" (PDF) . Science . 272 (5259): 244. Bibcode :1996Sci...272..244L. doi :10.1126/science.272.5259.244. S2CID 178546205. Archivado (PDF) desde el original el 24 de diciembre de 2012 . Consultado el 9 de febrero de 2013 .
- ^ Larssen T, Carmichael GR (1 de octubre de 2000). «Lluvia ácida y acidificación en China: la importancia de la deposición de cationes básicos». Contaminación ambiental . 110 (1): 89–102. doi :10.1016/S0269-7491(99)00279-1. ISSN 0269-7491. PMID 15092859. Archivado desde el original el 30 de marzo de 2015. Consultado el 22 de abril de 2020 .
- ^ Johnson DW, Turner J, Kelly JM (1982). "Los efectos de la lluvia ácida en el estado de los nutrientes de los bosques". Water Resources Research . 18 (3): 449–461. Bibcode :1982WRR....18..449J. doi :10.1029/WR018i003p00449. ISSN 1944-7973.
- ^ Wang X, Ding H, Ryan L, Xu X (1 de mayo de 1997). "Asociación entre la contaminación del aire y el bajo peso al nacer: un estudio basado en la comunidad". Environmental Health Perspectives . 105 (5): 514–20. doi :10.1289/ehp.97105514. ISSN 0091-6765. PMC 1469882 . PMID 9222137. S2CID 2707126.
- ^ Xu Y, Ramanathan V, Victor DG (5 de diciembre de 2018). «El calentamiento global ocurrirá más rápido de lo que pensamos». Nature . 564 (7734): 30–32. Bibcode :2018Natur.564...30X. doi : 10.1038/d41586-018-07586-5 . PMID 30518902.
- ^ Lin CK, Lin RT, Chen PC, Wang P, De Marcellis-Warin N, Zigler C, Christiani DC (8 de febrero de 2018). "Una perspectiva global sobre los controles de óxido de azufre en plantas de energía a carbón y enfermedades cardiovasculares". Scientific Reports . 8 (1): 2611. Bibcode :2018NatSR...8.2611L. doi :10.1038/s41598-018-20404-2. ISSN 2045-2322. PMC 5805744 . PMID 29422539.
- ^ Lindeburg MR (2006). Manual de referencia de ingeniería mecánica para el examen de PE . Belmont, CA: Professional Publications, Inc., págs. 27-3. ISBN 978-1-59126-049-3.
- ^ Preguntas frecuentes sobre la eliminación y recuperación de azufre con el sistema de eliminación de sulfuro de hidrógeno LO-CAT®. gtp-merichem.com
- ^ Análisis de procesos de tratamiento de gas alternativo y eliminación de azufre para gasificación. (Diciembre de 2002) Informe de SFA Pacific, Inc. preparado para el Departamento de Energía de EE. UU. (PDF) Recuperado el 31 de octubre de 2011.
- ^ May, Walter R. Reducción de emisiones marinas Archivado el 2 de abril de 2015 en Wayback Machine . SFA International, Inc., pág. 6.
- ^ ab Julsrud IR, Storelvmo T, Schulz M, Moseid KO, Wild M (20 de octubre de 2022). "Descifrando los efectos de los aerosoles y las nubes sobre el oscurecimiento y el brillo en las observaciones y CMIP6". Revista de investigación geofísica: atmósferas . 127 (21): e2021JD035476. Código Bibliográfico :2022JGRD..12735476J. doi : 10.1029/2021JD035476 . hdl : 10852/97300 .
- ^ Stanhill G, Moreshet S (6 de noviembre de 2004). "Cambios climáticos de radiación global en Israel". Cambio climático . 22 (2): 121–138. Bibcode :1992ClCh...22..121S. doi :10.1007/BF00142962. S2CID 154006620.
- ^ Gilgen H, Wild M, Ohmura A (1998). "Medias y tendencias de la irradiancia de onda corta en la superficie estimadas a partir de datos de archivo del balance energético global" (PDF) . Journal of Climate . 11 (8): 2042–2061. Bibcode :1998JCli...11.2042G. doi : 10.1175/1520-0442-11.8.2042 .
- ^ Stanhill G, Cohen S (2001). "Oscurecimiento global: una revisión de la evidencia de una reducción generalizada y significativa de la radiación global con discusión de sus causas probables y posibles consecuencias agrícolas". Meteorología agrícola y forestal . 107 (4): 255–278. Bibcode :2001AgFM..107..255S. doi :10.1016/S0168-1923(00)00241-0.
- ^ Liepert BG (2 de mayo de 2002). "Reducciones observadas en la radiación solar superficial en los Estados Unidos y en todo el mundo desde 1961 hasta 1990" (PDF) . Geophysical Research Letters . 29 (12): 61–1–61–4. Bibcode :2002GeoRL..29.1421L. doi : 10.1029/2002GL014910 .
- ^ Eddy JA, Gilliland RL, Hoyt DV (23 de diciembre de 1982). "Cambios en la constante solar y efectos climáticos". Nature . 300 (5894): 689–693. Bibcode :1982Natur.300..689E. doi :10.1038/300689a0. S2CID 4320853.
Las mediciones de naves espaciales han establecido que la emisión radiativa total del Sol varía en un nivel de 0,1−0,3%.
- ^ ab "La contaminación por aerosoles ha provocado décadas de oscurecimiento global". American Geophysical Union . 18 de febrero de 2021. Archivado desde el original el 27 de marzo de 2023. Consultado el 18 de diciembre de 2023 .
- ^ Adam D (18 de diciembre de 2003). "Adiós, sol". The Guardian . Consultado el 26 de agosto de 2009 .
- ^ Wild M, Wacker S, Yang S, Sanchez-Lorenzo A (1 de febrero de 2021). "Evidencia de oscurecimiento y brillo del cielo despejado en Europa central". Geophysical Research Letters . 48 (6). Código Bibliográfico :2021GeoRL..4892216W. doi :10.1029/2020GL092216. hdl : 20.500.11850/477374 . S2CID 233645438.
- ^ ab Xu Y, Ramanathan V, Victor DG (5 de diciembre de 2018). "El calentamiento global ocurrirá más rápido de lo que pensamos". Nature . 564 (7734): 30–32. Bibcode :2018Natur.564...30X. doi : 10.1038/d41586-018-07586-5 . PMID 30518902.
- ^ Bellouin N, Quaas J, Gryspeerdt E, Kinne S, Stier P, Watson-Parris D, Boucher O, Carslaw KS, Christensen M, Daniau AL, Dufresne JL, Feingold G, Fiedler S, Forster P, Gettelman A, Haywood JM , Lohmann U, Malavelle F, Mauritsen T, McCoy DT, Myhre G, Mülmenstädt J, Neubauer D, Possner A, Rugenstein M, Sato Y, Schulz M, Schwartz SE, Sourdeval O, Storelvmo T, Toll V, Winker D, Stevens B (1 de noviembre de 2019). "Limitar el forzamiento radiativo global de aerosoles del cambio climático". Reseñas de Geofísica . 58 (1): e2019RG000660. doi :10.1029/2019RG000660. PMC 7384191. PMID 32734279 .
- ^ IPCC, 2021: Resumen para responsables de políticas. En: Cambio climático 2021: la base científica física. Contribución del Grupo de trabajo I al sexto informe de evaluación del Grupo Intergubernamental de Expertos sobre el Cambio Climático [Masson-Delmotte, V., P. Zhai, A. Pirani, SL Connors, C. Péan, S. Berger, N. Caud, Y. Chen, L. Goldfarb, MI Gomis, M. Huang, K. Leitzell, E. Lonnoy, JBR Matthews, TK Maycock, T. Waterfield, O. Yelekçi, R. Yu y B. Zhou (eds.)]. Cambridge University Press, Cambridge, Reino Unido y Nueva York, NY, EE. UU., págs. 3–32, doi :10.1017/9781009157896.001.
- ^ Hausfather Z (29 de abril de 2021). "Explicación: ¿Se detendrá el calentamiento global tan pronto como se alcancen las emisiones netas cero?". Carbon Brief . Consultado el 3 de marzo de 2023 .
- ^ Hassan T, Allen RJ, et al. (27 de junio de 2022). "Se prevé que las mejoras en la calidad del aire debiliten la circulación de retorno meridional del Atlántico a través de efectos de forzamiento radiativo". Communications Earth & Environment . 3 (3): 149. Bibcode :2022ComEE...3..149H. doi : 10.1038/s43247-022-00476-9 . S2CID 250077615.
- ^ "Tendencias del metano atmosférico". NOAA . Consultado el 14 de octubre de 2022 .
- ^ Tollefson J (8 de febrero de 2022). «Los científicos alertan sobre el crecimiento 'peligrosamente rápido' del metano atmosférico». Nature . Consultado el 14 de octubre de 2022 .
- ^ Lan X, Basu S, Schwietzke S, Bruhwiler LM, Dlugokencky EJ, Michel SE, Sherwood OA, Tans PP, Thoning K, Etiope G, Zhuang Q, Liu L, Oh Y, Miller JB, Pétron G, Vaughn BH, Crippa M (8 de mayo de 2021). "Restricciones mejoradas en las emisiones y sumideros globales de metano utilizando δ13C-CH4". Ciclos biogeoquímicos globales . 35 (6): e2021GB007000. Código Bibliográfico :2021GBioC..3507000L. doi : 10.1029/2021GB007000 . PMC 8244052 . PMID 34219915.
- ^ Feng L, Palmer PI, Zhu S, Parker RJ, Liu Y (16 de marzo de 2022). "Las emisiones tropicales de metano explican una gran fracción de los cambios recientes en la tasa de crecimiento global del metano atmosférico". Nature Communications . 13 (1): 1378. Bibcode :2022NatCo..13.1378F. doi :10.1038/s41467-022-28989-z. PMC 8927109 . PMID 35297408.
- ^ Quaas J, Jia H, Smith C, Albright AL, Aas W, Bellouin N, Boucher O, Doutriaux-Boucher M, Forster PM, Grosvenor D, Jenkins S, Klimont Z, Loeb NG, Ma X, Naik V, Paulot F, Stier P, Wild M, Myhre G, Schulz M (21 de septiembre de 2022). "Evidencia sólida de la reversión de la tendencia en el forzamiento climático efectivo de los aerosoles". Química atmosférica y física . 22 (18): 12221–12239. Bibcode :2022ACP....2212221Q. doi : 10.5194/acp-22-12221-2022 . hdl : 20.500.11850/572791 . Número de identificación del sujeto 252446168.
- ^ Kobayashi Y, Ide Y, Takegawa N (3 de abril de 2021). "Desarrollo de un nuevo espectrómetro de masas de partículas para mediciones en línea de aerosoles de sulfato refractario". Ciencia y tecnología de aerosoles . 55 (4): 371–386. Código Bibliográfico :2021AerST..55..371K. doi :10.1080/02786826.2020.1852168. ISSN 0278-6826. S2CID 229506768.
- ^ Palumbo, P., A. Rotundi, V. Della Corte, A. Ciucci, L. Colangeli, F. Esposito, E. Mazzotta Epifani, V. Mennella, JR Brucato, FJM Rietmeijer, GJ Flynn, J.-B. Renard, JR Stephens, E. Zona. "El experimento DUSTER: recogida y análisis de aerosoles en la alta estratosfera". Sociedad Astronómica Italiana . Consultado el 19 de febrero de 2009 .
- ^ Myhre G, Stordal F, Berglen TF, Sundet JK, Isaksen IS (1 de marzo de 2004). "Incertidumbres en el forzamiento radiativo debido a los aerosoles de sulfato". Revista de ciencias atmosféricas . 61 (5): 485–498. Bibcode :2004JAtS...61..485M. doi : 10.1175/1520-0469(2004)061<0485:UITRFD>2.0.CO;2 . ISSN 0022-4928. S2CID 55623817.
- ^ Zhang J, Furtado K, Turnock ST, Mulcahy JP, Wilcox LJ, Booth BB, Sexton D, Wu T, Zhang F, Liu Q (22 de diciembre de 2021). "El papel de los aerosoles antropogénicos en el enfriamiento anómalo de 1960 a 1990 en los modelos del sistema terrestre CMIP6". Química y física atmosférica . 21 (4): 18609–18627. Código Bibliográfico :2021ACP....2118609Z. doi : 10.5194/acp-21-18609-2021 .
- ^ "Aerosoles y luz solar entrante (efectos directos)". NASA . 2 de noviembre de 2010.
- ^ "Las inyecciones estratosféricas podrían ayudar a enfriar la Tierra, según un modelo informático". ScienceDaily. 15 de septiembre de 2006. Consultado el 19 de febrero de 2009 .
- ^ Launder B., JMT Thompson (1996). "Ingeniería climática global y ártica: estudios de modelos numéricos". Phil. Trans. R. Soc. A. 366 ( 1882): 4039–56. Bibcode :2008RSPTA.366.4039C. doi : 10.1098/rsta.2008.0132 . PMID 18757275.
- ^ Crutzen PJ (2006). "Mejora del albedo mediante inyecciones de azufre estratosférico: ¿una contribución para resolver un dilema de políticas?". Cambio climático . 77 (3–4): 211–220. Bibcode :2006ClCh...77..211C. doi : 10.1007/s10584-006-9101-y .
- ^ Visioni D, Slessarev E, MacMartin DG, Mahowald NM, Goodale CL, Xia L (1 de septiembre de 2020). "Lo que sube debe bajar: impactos de la deposición en un escenario de geoingeniería de sulfatos". Environmental Research Letters . 15 (9): 094063. Bibcode :2020ERL....15i4063V. doi : 10.1088/1748-9326/ab94eb . ISSN 1748-9326.
- ^ Andrew Charlton-Perez, Eleanor Highwood. «Costos y beneficios de la geoingeniería en la estratosfera» (PDF) . Archivado desde el original (PDF) el 14 de enero de 2017. Consultado el 17 de febrero de 2009 .
- ^ Trisos CH, Geden O, Seneviratne SI, Sugiyama M, van Aalst M, Bala G, Mach KJ, Ginzburg V, de Coninck H, Patt A (2021). "Grupo de trabajo transversal Box SRM: Modificación de la radiación solar" (PDF) . Cambio climático 2021: la base científica física. Contribución del Grupo de trabajo I al sexto informe de evaluación del Grupo Intergubernamental de Expertos sobre el Cambio Climático . 2021 : 1238. Bibcode :2021AGUFM.U13B..05K. doi :10.1017/9781009157896.007.
- ^ Holman JP (2002). Transferencia de calor (novena edición). Nueva York, NY: McGraw-Hill Companies, Inc., págs. 600-606. ISBN 9780072406559.
- ^ Incropera rP, Dewitt DP, Bergman TL, Lavigne AS (2007). Fundamentos de transferencia de calor y masa (6.ª ed.). Hoboken, Nueva Jersey: John Wiley and Sons, Inc., págs. 941–950. ISBN 9780471457282.
Enlaces externos
- Mapa mundial de la distribución del dióxido de azufre
- Página sobre dióxido de azufre de la Agencia de Protección Ambiental de los Estados Unidos
- Ficha internacional de seguridad química 0074
- Monografías del IARC. "Dióxido de azufre y algunos sulfitos, bisulfitos y metabisulfitos". vol. 54. 1992. pág. 131.
- Guía de bolsillo del NIOSH sobre peligros químicos
- CDC – Dióxido de azufre – Tema de seguridad y salud en el trabajo de NIOSH
- Dióxido de azufre, molécula del mes