Sulfito de calcio
 | |
| Nombres | |
|---|---|
| Nombre IUPAC Sulfito de calcio | |
Otros nombres
| |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| Araña química | |
| Tarjeta informativa de la ECHA | 100.030.529 |
| Número CE |
|
| Número E | E226 (conservantes) |
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| CaSO3 | |
| Masa molar | 120,17 g/mol |
| Apariencia | Sólido blanco |
| Punto de fusión | 600 °C (1112 °F; 873 K) |
| 4,3 mg/100 ml (18 °C) | |
Producto de solubilidad ( K sp ) | 3,1 × 10 −7 [1] |
| Peligros | |
| punto de inflamabilidad | Ininflamable |
| Compuestos relacionados | |
Otros aniones | Sulfato de calcio |
Otros cationes | Sulfito de sodio |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El sulfito de calcio , o sulfito de calcio , es un compuesto químico, la sal de calcio del sulfito con la fórmula CaSO 3 ·x(H 2 O). Se conocen dos formas cristalinas, el hemihidrato y el tetrahidrato, respectivamente CaSO 3 ·½(H 2 O) y CaSO 3 ·4(H 2 O). [2] Todas las formas son sólidos blancos. Es más notable como producto de la desulfuración de gases de combustión .
Producción
Se produce a gran escala mediante la desulfuración de gases de combustión (FGD). Cuando se quema carbón u otro combustible fósil, el subproducto se conoce como gas de combustión . El gas de combustión a menudo contiene SO2 , cuya emisión suele regularse para evitar la lluvia ácida . El dióxido de azufre se depura antes de que los gases restantes se emitan a través de la chimenea . Una forma económica de depurar el SO2 de los gases de combustión es tratar el efluente con cal hidratada Ca(OH) 2 o piedra caliza CaCO3 . [3]
El fregado con piedra caliza sigue la siguiente reacción idealizada:
- SO 2 + CaCO 3 → CaSO 3 + CO 2
El lavado con cal hidratada sigue la siguiente reacción idealizada: [4] [5]
- SO 2 + Ca(OH) 2 → CaSO 3 + H 2 O
El sulfito de calcio resultante se oxida en el aire para dar yeso:
- 2 CaSO3 + O2 → 2 CaSO4
El yeso, si es suficientemente puro, se puede comercializar como material de construcción.
Usos
Paneles de yeso
El sulfito de calcio se genera como intermediario en la producción de yeso, que es el componente principal de los paneles de yeso . Una casa típica en los EE. UU. contiene 7 toneladas métricas de este tipo de paneles de yeso. [6]
Aditivo alimentario
Como aditivo alimentario, se utiliza como conservante con el número E E226. Junto con otros sulfitos antioxidantes , se utiliza habitualmente para conservar vino, sidra, zumos de frutas, frutas y verduras enlatadas. Los sulfitos son fuertes reductores en solución, actúan como antioxidantes captadores de oxígeno para conservar los alimentos, pero es necesario indicarlo en el etiquetado, ya que algunas personas pueden ser hipersensibles .
Producción de pulpa de madera
La pulpa química de la madera consiste en eliminar la celulosa de la madera disolviendo la lignina que une la celulosa. El sulfito de calcio se puede utilizar en la producción de pulpa de madera mediante el proceso de sulfito , como alternativa al proceso Kraft que utiliza hidróxidos y sulfuros en lugar de sulfitos. Se utilizaba sulfito de calcio, pero ha sido reemplazado en gran medida por sulfitos y bisulfitos de magnesio y sodio para atacar la lignina. [ cita requerida ]
Yeso
Existe la posibilidad de utilizar sulfito de calcio para producir yeso oxidándolo (añadiéndole O2 ) en una mezcla de agua con el catión manganeso ( Mn2 + ) o catalizadores de ácido sulfúrico . [7] [8]
Estructura
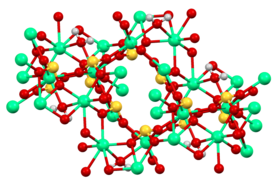
- Estructura de la jaula [Ca 3 (SO 3 ) 2 (H 2 O) 12 ] 2+ en sulfito de calcio tetrahidratado.
- Estructura del CaSO 3 anhidro .
La cristalografía de rayos X muestra que el sulfito de calcio anhidro tiene una estructura polimérica complicada. [9] El tetrahidrato cristaliza como una solución sólida de Ca 3 (SO 3 ) 2 (SO 4 ) . 12H 2 O y Ca 3 (SO 3 ) 2 (SO 3 ) . 12H 2 O. El sulfito-sulfato mixto representa un intermediario en la oxidación del sulfito al sulfato, como se practica en la producción de yeso . Esta solución sólida consta de cationes [Ca 3 (SO 3 ) 2 (H 2 O) 12 ] 2+ y sulfito o sulfato como anión. [2] [10] Estos estudios cristalográficos confirman que el anión sulfito adopta una geometría piramidal.
Ocurrencia natural
El hemihidrato de sulfito de calcio (III) se presenta en la naturaleza como el mineral raro hannebachita. [11] [12]
Véase también
- Sulfito
- Sulfito de magnesio
- Sulfito de sodio
- Bisulfito de sodio
- Metabisulfito de sodio
- Tableta de Campden
Referencias
- ^ John Rumble (18 de junio de 2018). Manual de química y física del CRC (99.ª edición). CRC Press. pp. 5–188. ISBN 978-1138561632.
- ^ ab Abraham Cohen; Mendel Zangen (1984). "Estudios sobre sulfitos alcalinotérreos. Estructura y estabilidad del nuevo compuesto Ca3(SO3)2SO4.12H2O y su solución sólida en sulfito de calcio tetrahidratado". Chemistry Letters . 13 (7): 1051–1054. doi : 10.1246/cl.1984.1051 .
- ^ Wirsching, Franz (2000). "Sulfato de calcio". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a04_555. ISBN 3527306730.
- ^ Hudson, JL (1980). Oxidación de azufre en sistemas de depuración . Universidad de Virginia.
- ^ Miller, Bruce (2004). Sistemas de energía a base de carbón . Elsevier Science Technology. págs. 294–299.
- ^ "Estadísticas e información sobre yeso del USGS". USGS . Consultado el 26 de junio de 2016 .
- ^ Li, Yuran; Zhou, Jinting; Zhu, Tingyu; Jing, Pengfei (1 de febrero de 2014). "Oxidación de sulfito de calcio y crecimiento de cristales en el proceso de residuos de carburo de calcio para producir yeso". Valorización de residuos y biomasa . 5 (1): 125–131. Bibcode :2014WBioV...5..125L. doi :10.1007/s12649-013-9206-2. ISSN 1877-2641. S2CID 98774317.
- ^ "¿Cómo podemos convertir el sulfito de calcio en sulfato de calcio después de..." ResearchGate . Consultado el 18 de mayo de 2018 .
- ^ Yasue, Tamotsu; Arai, Yasuo (1986). "Estructura cristalina del sulfito de calcio". Yeso y cal (idioma japonés) . 203 : 235–44.
- ^ Matsuno, Takashi; Takayanagi, Hiroaki; Furuhata, Kimio; Koishi, Masumi; Ogura, Haruo (1984). "La estructura cristalina del hemihidrato de sulfito de calcio". Boletín de la Sociedad Química de Japón . 57 (4): 1155–6. doi : 10.1246/bcsj.57.1155 .
- ^ "Hannebachita".
- ^ "Lista de minerales". 21 de marzo de 2011.



![Estructura de la jaula [Ca3(SO3)2(H2O)12]2+ en sulfito de calcio tetrahidratado.](http://upload.wikimedia.org/wikipedia/commons/thumb/3/35/Ca3%28SO3%292aq12.png/180px-Ca3%28SO3%292aq12.png)