Triptófano
 Fórmula esquelética del L -triptófano | |||
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC Triptófano | |||
| Nombre sistemático de la IUPAC Ácido (2 S )-2-amino-3-(1 H -indol-3-il)propanoico | |||
| Otros nombres Ácido 2-amino-3-(1 H -indol-3-il)propanoico | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| EBICh |
| ||
| Química biológica | |||
| Araña química | |||
| Banco de medicamentos | |||
| Tarjeta informativa de la ECHA | 100.000.723 | ||
| |||
| BARRIL | |||
Identificador de centro de PubChem |
| ||
| UNIVERSIDAD | |||
Panel de control CompTox ( EPA ) |
| ||
| |||
| Propiedades | |||
| C11H12N2O2 | |||
| Masa molar | 204,229 g·mol −1 | ||
| Soluble: 0,23 g/L a 0 °C, 11,4 g/L a 25 °C, | |||
| Solubilidad | Soluble en alcohol caliente, hidróxidos alcalinos; insoluble en cloroformo . | ||
| Acidez (p K a ) | 2,38 (carboxilo), 9,39 (amino) [2] | ||
| -132,0·10 −6 cm3 / mol | |||
| Farmacología | |||
| N06AX02 ( OMS ) | |||
| Página de datos complementarios | |||
| Triptófano (página de datos) | |||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El triptófano (símbolo Trp o W ) [3] es un α - aminoácido que se utiliza en la biosíntesis de proteínas . El triptófano contiene un grupo α -amino, un grupo de ácido α-carboxílico y una cadena lateral indol , lo que lo convierte en una molécula polar con un sustituyente de carbono beta aromático no polar . El triptófano también es un precursor del neurotransmisor serotonina , la hormona melatonina y la vitamina B 3 (niacina). [4] Está codificado por el codón UGG.
Al igual que otros aminoácidos, el triptófano es un zwitterión a pH fisiológico donde el grupo amino está protonado ( –NH+
3; pK a = 9,39) y el ácido carboxílico se desprotona ( –COO − ; pK a = 2,38). [5]
Los humanos y muchos animales no pueden sintetizar triptófano: necesitan obtenerlo a través de la dieta, lo que lo convierte en un aminoácido esencial .
El triptófano recibe su nombre de las enzimas digestivas tripsina , que se utilizaron en su primer aislamiento a partir de proteínas de caseína . [6] Se le asignó el símbolo de una letra W basándose en que el anillo doble sugiere visualmente la letra voluminosa. [7]
Función

Los aminoácidos, incluido el triptófano, se utilizan como bloques de construcción en la biosíntesis de proteínas , y las proteínas son necesarias para mantener la vida. El triptófano es uno de los aminoácidos menos comunes que se encuentran en las proteínas, pero desempeña importantes papeles estructurales o funcionales siempre que se encuentra. Por ejemplo, los residuos de triptófano y tirosina desempeñan papeles especiales en el "anclaje" de las proteínas de membrana dentro de la membrana celular . El triptófano, junto con otros aminoácidos aromáticos , también es importante en las interacciones entre glicanos y proteínas . Además, el triptófano funciona como precursor bioquímico de los siguientes compuestos :
- Serotonina (un neurotransmisor ), sintetizada por la triptófano hidroxilasa . [8] [9]
- La melatonina (una neurohormona ) se sintetiza a su vez a partir de la serotonina, a través de las enzimas N-acetiltransferasa y 5-hidroxiindol-O-metiltransferasa . [10]
- Quinurenina , a la que se metaboliza principalmente el triptófano (más del 95%). Dos enzimas, a saber, la indolamina 2,3-dioxigenasa (IDO) en el sistema inmunológico y el cerebro, y la triptófano 2,3-dioxigenasa (TDO) en el hígado, son responsables de la síntesis de quinurenina a partir del triptófano. La vía de la quinurenina del catabolismo del triptófano se altera en varias enfermedades, incluidos los trastornos psiquiátricos como la esquizofrenia [11] , el trastorno depresivo mayor [11] y el trastorno bipolar [ 11] [12]
- La niacina , también conocida como vitamina B3 , se sintetiza a partir del triptófano a través de la quinurenina y los ácidos quinolínicos . [13]
- Las auxinas (una clase de fitohormonas ) se sintetizan a partir del triptófano. [14]
El trastorno de malabsorción de fructosa provoca una absorción inadecuada de triptófano en el intestino, niveles reducidos de triptófano en la sangre [15] y depresión. [16]
En las bacterias que sintetizan triptófano, los altos niveles celulares de este aminoácido activan una proteína represora , que se une al operón trp . [17] La unión de este represor al operón triptófano impide la transcripción del ADN que codifica las enzimas implicadas en la biosíntesis del triptófano. Por lo tanto, los altos niveles de triptófano impiden la síntesis de triptófano a través de un ciclo de retroalimentación negativa , y cuando los niveles de triptófano de la célula vuelven a bajar, se reanuda la transcripción del operón trp . Esto permite respuestas rápidas y estrictamente reguladas a los cambios en los niveles internos y externos de triptófano de la célula.
Metabolismo del triptófano por la microbiota gastrointestinal humana () Triptófano Triptofanasa : bacterias que expresan Neuroprotector : ↓ Activación de células gliales y astrocitos ↓ Niveles de 4-hidroxi-2-nonenal ↓ Daño al ADN – Antioxidante – Inhibe la formación de fibrillas de β-amiloide Mantiene la reactividad de la mucosa: ↑ Producción de IL-22 Asociado con enfermedad vascular : ↑ Estrés oxidativo ↑ Proliferación de células musculares lisas ↑ Espesor de la pared aórtica y calcificación Asociado a enfermedad renal crónica : ↑ Disfunción renal – Toxina urémica Este diagrama muestra la biosíntesis de compuestos bioactivos ( indol y ciertos otros derivados) a partir del triptófano por bacterias en el intestino. [18] El indol es producido a partir del triptófano por bacterias que expresan triptofanasa . [18] Clostridium sporogenes metaboliza el triptófano en indol y posteriormente en ácido 3-indolpropiónico (IPA), [19] un antioxidante neuroprotector muy potente que elimina los radicales hidroxilo . [18] [20] [21] El IPA se une al receptor X de pregnano (PXR) en las células intestinales, facilitando así la homeostasis de la mucosa y la función de barrera . [18] Tras la absorción en el intestino y la distribución al cerebro, el IPA confiere un efecto neuroprotector contra la isquemia cerebral y la enfermedad de Alzheimer . [18] Las especies de Lactobacillaceae ( Lactobacillus s.l. ) metabolizan el triptófano en indol-3-aldehído (I3A) que actúa sobre el receptor de hidrocarburos arílicos (AhR) en las células inmunes intestinales, aumentando a su vez la producción de interleucina-22 (IL-22). [18] El indol en sí mismo desencadena la secreción del péptido similar al glucagón-1 (GLP-1) en las células L intestinales y actúa como un ligando para AhR. [18] El indol también puede ser metabolizado por el hígado en sulfato de indoxilo , un compuesto que es tóxico en altas concentraciones y está asociado con enfermedad vascular y disfunción renal . [18] El AST-120 ( carbón activado ), un sorbente intestinal que se toma por vía oral , adsorbe el indol, lo que a su vez disminuye la concentración de sulfato de indoxilo en el plasma sanguíneo. [18] |
Ingesta dietética recomendada
En 2002, el Instituto de Medicina de Estados Unidos estableció una ingesta diaria recomendada (IDR) de 5 mg/kg de peso corporal/día de triptófano para adultos de 19 años o más. [22]
Fuentes dietéticas
El triptófano está presente en la mayoría de los alimentos a base de proteínas o proteínas dietéticas. Es particularmente abundante en el chocolate , la avena , los dátiles secos , la leche , el yogur , el requesón , la carne roja , los huevos , el pescado , las aves , el sésamo , los garbanzos , las almendras , las semillas de girasol , las semillas de calabaza , las semillas de cáñamo , el trigo sarraceno , la espirulina y los cacahuetes . Contrariamente a la creencia popular [23] [24] de que el pavo cocido contiene una gran cantidad de triptófano, el contenido de triptófano en el pavo es típico de las aves de corral. [25]
| Alimento | Triptófano [g/100 g de alimento] | Proteína [g/100 g de alimento] | Triptófano/proteína [%] |
|---|---|---|---|
| Clara de huevo , seca | 1.00 | 81.10 | 1.23 |
| Espirulina , seca | 0,92 | 57,47 | 1.62 |
| Bacalao del Atlántico seco | 0,70 | 62,82 | 1.11 |
| Soja cruda | 0,59 | 36,49 | 1.62 |
| Queso, parmesano | 0,56 | 37,90 | 1.47 |
| Semillas de chía , secas | 0,44 | 16,50 | 2.64 |
| Semilla de sésamo | 0,37 | 17.00 | 2.17 |
| Semilla de cáñamo , descascarada | 0,37 | 31,56 | 1.17 |
| Queso, cheddar | 0,32 | 24,90 | 1.29 |
| Semilla de girasol | 0,30 | 17.20 | 1,74 |
| Chuleta de cerdo | 0,25 | 19.27 | 1.27 |
| Pavo | 0,24 | 21,89 | 1.11 |
| Pollo | 0,24 | 20,85 | 1.14 |
| Carne de res | 0,23 | 20.13 | 1.12 |
| Avena | 0,23 | 16,89 | 1.39 |
| Salmón | 0,22 | 19,84 | 1.12 |
| Cordero, chuleta | 0,21 | 18.33 | 1.17 |
| Perca del Atlántico | 0,21 | 18.62 | 1.12 |
| Garbanzos crudos | 0,19 | 19.30 | 0,96 |
| Huevo | 0,17 | 12.58 | 1.33 |
| Harina de trigo, blanca | 0,13 | 10.33 | 1.23 |
| Chocolate para hornear , sin azúcar | 0,13 | 12,90 | 1.23 |
| Leche | 0,08 | 3.22 | 2.34 |
| Arroz blanco de grano medio cocido | 0,03 | 2.38 | 1.18 |
| Quinua cruda | 0,17 | 14.12 | 1.20 |
| Quinua cocida | 0,05 | 4.40 | 1.10 |
| Patatas, rojizas | 0,02 | 2.14 | 0,84 |
| Tamarindo | 0,02 | 2.80 | 0,64 |
| Banana | 0,01 | 1.03 | 0,87 |
Uso médico
Depresión
Debido a que el triptófano se convierte en 5-hidroxitriptófano (5-HTP), que luego se convierte en el neurotransmisor serotonina, se ha propuesto que el consumo de triptófano o 5-HTP puede mejorar los síntomas de la depresión al aumentar el nivel de serotonina en el cerebro. El triptófano se vende sin receta en los Estados Unidos (después de haber sido prohibido en diversos grados entre 1989 y 2005) y el Reino Unido como un suplemento dietético para su uso como antidepresivo , ansiolítico y ayuda para dormir . También se comercializa como medicamento de venta con receta en algunos países europeos para el tratamiento de la depresión mayor . Existe evidencia de que es poco probable que los niveles de triptófano en sangre se alteren al cambiar la dieta, [27] [28] pero el consumo de triptófano purificado aumenta el nivel de serotonina en el cerebro, mientras que comer alimentos que contienen triptófano no lo hace. [29]
En 2001 se publicó una revisión Cochrane sobre el efecto del 5-HTP y el triptófano en la depresión. Los autores incluyeron sólo estudios de alto rigor e incluyeron tanto el 5-HTP como el triptófano en su revisión debido a la escasez de datos sobre ambos. De 108 estudios sobre el 5-HTP y el triptófano en la depresión publicados entre 1966 y 2000, sólo dos cumplieron los estándares de calidad de los autores para su inclusión, con un total de 64 participantes en el estudio. Las sustancias fueron más eficaces que el placebo en los dos estudios incluidos, pero los autores afirman que "la evidencia no fue de calidad suficiente para ser concluyente" y señalan que "debido a que existen antidepresivos alternativos que han demostrado ser eficaces y seguros, la utilidad clínica del 5-HTP y el triptófano es limitada en la actualidad". [30] El uso del triptófano como terapia complementaria además del tratamiento estándar para los trastornos del estado de ánimo y la ansiedad no está respaldado por la evidencia científica. [30] [31]
Insomnio
Las pautas de práctica clínica de 2017 de la Academia Estadounidense de Medicina del Sueño recomendaron no utilizar triptófano en el tratamiento del insomnio debido a su baja eficacia. [32]
Efectos secundarios
Los posibles efectos secundarios de la suplementación con triptófano incluyen náuseas , diarrea , somnolencia , mareos , dolor de cabeza , boca seca , visión borrosa , sedación , euforia y nistagmo (movimientos oculares involuntarios). [33] [34]
Interacciones
El triptófano tomado como suplemento dietético (por ejemplo, en forma de comprimidos) tiene el potencial de causar síndrome serotoninérgico cuando se combina con antidepresivos de la clase IMAO o ISRS u otros fármacos fuertemente serotoninérgicos. [34] Debido a que la suplementación con triptófano no se ha estudiado exhaustivamente en un entorno clínico, sus interacciones con otros fármacos no son bien conocidas. [30]
Aislamiento
El aislamiento del triptófano fue informado por primera vez por Frederick Hopkins en 1901. [35] Hopkins recuperó triptófano de la caseína hidrolizada , recuperando entre 4 y 8 g de triptófano de 600 g de caseína cruda. [36]
Biosíntesis y producción industrial
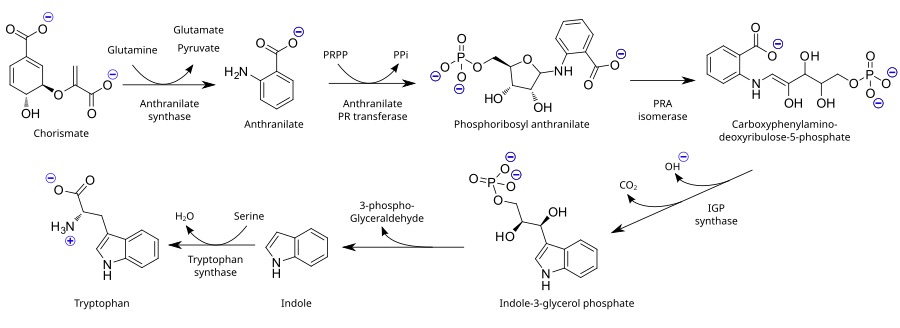
Como aminoácido esencial, el triptófano no se sintetiza a partir de sustancias más simples en humanos y otros animales, por lo que debe estar presente en la dieta en forma de proteínas que contengan triptófano. Las plantas y los microorganismos comúnmente sintetizan triptófano a partir de ácido shikímico o antranilato : [37] el antranilato se condensa con fosforribosilpirofosfato (PRPP), generando pirofosfato como subproducto. El anillo de la fracción ribosa se abre y se somete a descarboxilación reductora , produciendo fosfato de indol-3-glicerol; este, a su vez, se transforma en indol . En el último paso, la triptófano sintasa cataliza la formación de triptófano a partir de indol y el aminoácido serina .
La producción industrial de triptófano también es biosintética y se basa en la fermentación de serina e indol utilizando bacterias de tipo salvaje o genéticamente modificadas como B. amyloliquefaciens , B. subtilis , C. glutamicum o E. coli . Estas cepas son portadoras de mutaciones que impiden la recaptación de aminoácidos aromáticos o de operones trp múltiples/sobreexpresados . La conversión es catalizada por la enzima triptófano sintasa . [38] [39] [40]
Sociedad y cultura
Escándalo de contaminación de Showa Denko
En 1989, en Estados Unidos se produjo un gran brote de síndrome de eosinofilia-mialgia (EMS), con más de 1.500 casos notificados a los CDC y al menos 37 muertes. [41] Después de que una investigación preliminar revelara que el brote estaba relacionado con la ingesta de triptófano, la Administración de Alimentos y Medicamentos de Estados Unidos (FDA) retiró del mercado los suplementos de triptófano en 1989 y prohibió la mayoría de las ventas al público en 1990, [42] [43] [44] y otros países siguieron su ejemplo. [45] [46]
Estudios posteriores sugirieron que el EMS estaba vinculado a lotes específicos de L -triptófano suministrados por un único gran fabricante japonés, Showa Denko . [42] [47] [48] [49] Finalmente se hizo evidente que lotes recientes de L -triptófano de Showa Denko estaban contaminados por impurezas traza, que posteriormente se creyó que eran responsables del brote de EMS de 1989. [42] [50] [51] Sin embargo, otra evidencia sugiere que el triptófano en sí mismo puede ser un factor contribuyente potencialmente importante en el EMS. [52] También hay afirmaciones de que un precursor alcanzó concentraciones suficientes para formar un dímero tóxico . [53]
La FDA flexibilizó sus restricciones a las ventas y comercialización de triptófano en febrero de 2001, [42] pero continuó limitando la importación de triptófano no destinado a un uso exento hasta 2005. [54]
El hecho de que la planta de Showa Denko haya utilizado bacterias genéticamente modificadas para producir los lotes contaminados de L -triptófano que más tarde se descubrió que habían causado el brote del síndrome de eosinofilia-mialgia ha sido citado como prueba de la necesidad de "vigilar de cerca la pureza química de los productos derivados de la biotecnología". [55] Quienes piden que se vigile la pureza han sido, a su vez, criticados como activistas anti- OGM que pasan por alto posibles causas no relacionadas con los OGM de contaminación y amenazan el desarrollo de la biotecnología. [56]
Hipótesis sobre la carne de pavo y la somnolencia
Una afirmación común en los EE. UU. y el Reino Unido [57] es que el consumo excesivo de carne de pavo , como se ve durante el Día de Acción de Gracias y Navidad , produce somnolencia , debido a los altos niveles de triptófano que contiene el pavo. [24] Sin embargo, la cantidad de triptófano en el pavo es comparable con la de otras carnes. [23] [25] La somnolencia después de comer puede ser causada por otros alimentos consumidos con el pavo, particularmente carbohidratos . [58] La ingestión de una comida rica en carbohidratos desencadena la liberación de insulina . [59] [60] [61] [62] La insulina, a su vez, estimula la absorción de grandes aminoácidos de cadena ramificada neutrales (AACR), pero no de triptófano, en el músculo, lo que aumenta la proporción de triptófano a AACR en el torrente sanguíneo. La mayor proporción de triptófano resultante reduce la competencia en el gran transportador de aminoácidos neutros (que transporta tanto aminoácidos de cadena ramificada como aminoácidos aromáticos), lo que resulta en una mayor absorción de triptófano a través de la barrera hematoencefálica hacia el líquido cefalorraquídeo (LCR). [62] [63] [64] Una vez en el LCR, el triptófano se convierte en serotonina en los núcleos del rafe por la vía enzimática normal. [60] [65] La serotonina resultante se metaboliza aún más en la hormona melatonina , que es un mediador importante del ritmo circadiano [66] , por la glándula pineal . [10] Por lo tanto, estos datos sugieren que la "somnolencia inducida por el festín" -o somnolencia posprandial- puede ser el resultado de una comida pesada rica en carbohidratos, que indirectamente aumenta la producción de melatonina en el cerebro y, por lo tanto, promueve el sueño. [59] [60] [61] [65]
Investigación
Metabolismo de aminoácidos en levaduras
En 1912, Felix Ehrlich demostró que la levadura metaboliza los aminoácidos naturales esencialmente mediante la separación del dióxido de carbono y la sustitución del grupo amino por un grupo hidroxilo . Mediante esta reacción , el triptófano da lugar al triptófano . [67]
Precursor de la serotonina
El triptófano afecta la síntesis de serotonina en el cerebro cuando se administra por vía oral en forma purificada y se utiliza para modificar los niveles de serotonina para la investigación. [29] El bajo nivel de serotonina en el cerebro se induce mediante la administración de proteína pobre en triptófano en una técnica llamada depleción aguda de triptófano . [68] Los estudios que utilizan este método han evaluado el efecto de la serotonina en el estado de ánimo y el comportamiento social, encontrando que la serotonina reduce la agresión y aumenta la amabilidad. [69]
Efectos psicodélicos
El triptófano produce la respuesta de espasmo de cabeza (HTR) en roedores cuando se administra en dosis suficientemente altas. [70] La HTR es inducida por psicodélicos serotoninérgicos como la dietilamida del ácido lisérgico (LSD) y la psilocibina y es un indicador conductual de los efectos psicodélicos. [71] [72] El triptófano se convierte en la amina traza triptamina y la triptamina es N - metilada por la indoletilamina N -metiltransferasa (INMT) en N -metiltriptamina (NMT) y N , N -dimetiltriptamina ( N , N -DMT), que son psicodélicos serotoninérgicos conocidos. [70] [73] [74] [75] [76] [77]
Fluorescencia
El triptófano es una sonda fluorescente intrínseca importante (aminoácido) que se puede utilizar para estimar la naturaleza del microambiente que rodea al residuo de triptófano. La mayoría de las emisiones de fluorescencia intrínseca de una proteína plegada se deben a la excitación de los residuos de triptófano.
Véase también
- 5-Hidroxitriptófano (5-HTP)
- α-Metiltriptófano
- Reacción de Acree-Rosenheim
- Reacción de Adamkiewicz
- Atenuador (genética)
- N , N -Dimetiltriptamina
- Reacción de Hopkins-Cole
- Serotonina
- Triptamina
Referencias
- ^ ab Görbitz CH, Törnroos KW, Day GM (2012). "Investigación monocristalina de L-triptófano con Z ′ = 16". Acta Crystallographica Sección B . 68 (Pt 5): 549–557. doi :10.1107/S0108768112033484. PMID 22992800.
- ^ Dawson RM, et al. (1969). Datos para la investigación bioquímica . Oxford: Clarendon Press. ISBN 0-19-855338-2.
- ^ "Nomenclatura y simbolismo de aminoácidos y péptidos". Comisión Conjunta IUPAC-IUB sobre Nomenclatura Bioquímica. 1983. Archivado desde el original el 2 de diciembre de 2021. Consultado el 22 de octubre de 2022 .
- ^ Slominski A, Semak I, Pisarchik A, Sweatman T, Szczesniewski A, Wortsman J (2002). "Conversión de L-triptófano en serotonina y melatonina en células de melanoma humano". FEBS Letters . 511 (1–3): 102–6. Bibcode :2002FEBSL.511..102S. doi : 10.1016/s0014-5793(01)03319-1 . PMID 11821057. S2CID 7820568.
- ^ "L-triptófano | C11H12N2O2 - PubChem". pubchem.ncbi.nlm.nih.gov . Consultado el 22 de diciembre de 2016 .
- ^ Curzon G (31 de diciembre de 1987), Bender DA, Joseph MH, Kochen W, Steinhart H (eds.), "Hopkins y el descubrimiento del triptófano", Progreso en la investigación del triptófano y la serotonina 1986 , Berlín, Boston: De Gruyter, págs. XXIX–XL, doi :10.1515/9783110854657-004, ISBN 978-3-11-085465-7, consultado el 19 de febrero de 2024
- ^ "Comisión IUPAC-IUB sobre nomenclatura bioquímica: una notación de una letra para secuencias de aminoácidos". Journal of Biological Chemistry . 243 (13): 3557–3559. 10 de julio de 1968. doi : 10.1016/S0021-9258(19)34176-6 .
- ^ Fernstrom JD (1983). "El papel de la disponibilidad de precursores en el control de la biosíntesis de monoaminas en el cerebro". Physiological Reviews . 63 (2): 484–546. doi :10.1152/physrev.1983.63.2.484. PMID 6132421.
- ^ Schaechter JD, Wurtman RJ (1990). "La liberación de serotonina varía con los niveles de triptófano en el cerebro" (PDF) . Brain Research . 532 (1–2): 203–10. doi :10.1016/0006-8993(90)91761-5. PMID 1704290. S2CID 8451316. Archivado desde el original (PDF) el 9 de agosto de 2020 . Consultado el 30 de mayo de 2014 .
- ^ ab Wurtman RJ, Anton-Tay F (1969). "La glándula pineal de los mamíferos como transductor neuroendocrino" (PDF) . Progresos recientes en la investigación hormonal . 25 : 493–522. doi :10.1016/b978-0-12-571125-8.50014-4. ISBN 978-0-12-571125-8. PMID 4391290. Archivado desde el original (PDF) el 31 de mayo de 2014.
- ^ abc Marx W, McGuinness AJ, Rocks T, Ruusunen A, Cleminson J, Walker AJ, Gomes-da-Costa S, Lane M, Sanches M, Diaz AP, Tseng PT (23 de noviembre de 2020). "La vía de la quinurenina en el trastorno depresivo mayor, el trastorno bipolar y la esquizofrenia: un metaanálisis de 101 estudios". Psiquiatría molecular . 26 (8): 4158–4178. doi :10.1038/s41380-020-00951-9. ISSN 1476-5578. PMID 33230205. S2CID 227132820.
- ^ Bartoli F, Misiak B, Callovini T, Cavaleri D, Cioni RM, Crocamo C, Savitz JB, Carrà G (19 de octubre de 2020). "La vía de la quinurenina en el trastorno bipolar: un metaanálisis sobre los niveles de triptófano y metabolitos relacionados en sangre periférica". Psiquiatría molecular . 26 (7): 3419–3429. doi :10.1038/s41380-020-00913-1. PMID 33077852. S2CID 224314102.
- ^ Ikeda M, Tsuji H, Nakamura S, Ichiyama A, Nishizuka Y, Hayaishi O (1965). "Estudios sobre la biosíntesis de nicotinamida adenina dinucleótido. II. Un papel de la carboxilasa picolínica en la biosíntesis de nicotinamida adenina dinucleótido a partir de triptófano en mamíferos". The Journal of Biological Chemistry . 240 (3): 1395–401. doi : 10.1016/S0021-9258(18)97589-7 . PMID 14284754.
- ^ Palme K, Nagy F (2008). "Un nuevo gen para la síntesis de auxina". Cell . 133 (1): 31–2. doi : 10.1016/j.cell.2008.03.014 . PMID 18394986. S2CID 9949830.
- ^ Ledochowski M, Widner B, Murr C, Sperner-Unterweger B, Fuchs D (2001). "La malabsorción de fructosa se asocia con una disminución del triptófano plasmático" (PDF) . Scandinavian Journal of Gastroenterology . 36 (4): 367–71. doi :10.1080/003655201300051135. PMID 11336160. Archivado desde el original (PDF) el 19 de abril de 2016.
- ^ Ledochowski M, Sperner-Unterweger B, Widner B, Fuchs D (junio de 1998). "La malabsorción de fructosa se asocia con signos tempranos de depresión mental". Revista Europea de Investigación Médica . 3 (6): 295–8. PMID 9620891.
- ^ Gollnick P, Babitzke P, Antson A, Yanofsky C (2005). "Complejidad en la regulación de la biosíntesis de triptófano en Bacillus subtilis". Revisión anual de genética . 39 : 47–68. doi :10.1146/annurev.genet.39.073003.093745. PMID 16285852.
- ^ abcdefghi Zhang LS, Davies SS (abril de 2016). "Metabolismo microbiano de componentes dietéticos a metabolitos bioactivos: oportunidades para nuevas intervenciones terapéuticas". Genome Med . 8 (1): 46. doi : 10.1186/s13073-016-0296-x . PMC 4840492 . PMID 27102537. Las especies de
Lactobacillus
convierten el triptófano en indol-3-aldehído (I3A) a través de enzimas no identificadas [125].
Clostridium sporogenes
convierte el triptófano en IPA [6], probablemente a través de una triptófano desaminasa. ... El IPA también elimina de forma potente los radicales hidroxilo
Tabla 2: Metabolitos microbianos: su síntesis, mecanismos de acción y efectos sobre la salud y la enfermedad
Figura 1: Mecanismos moleculares de acción del indol y sus metabolitos sobre la fisiología del huésped y la enfermedad - ^ Wikoff WR, Anfora AT, Liu J, Schultz PG, Lesley SA, Peters EC, Siuzdak G (marzo de 2009). "El análisis metabolómico revela grandes efectos de la microflora intestinal en los metabolitos sanguíneos de los mamíferos". Proc. Natl. Sci. EE. UU . . 106 (10): 3698–3703. Bibcode :2009PNAS..106.3698W. doi : 10.1073/pnas.0812874106 . PMC 2656143 . PMID 19234110.
Se demostró que la producción de IPA depende completamente de la presencia de microflora intestinal y podría establecerse mediante la colonización con la bacteria
Clostridium sporogenes
.
Diagrama del metabolismo del IPA - ^ "Ácido 3-indolpropiónico". Base de datos del metaboloma humano . Universidad de Alberta . Consultado el 12 de junio de 2018 .
- ^ Chyan YJ, Poeggeler B, Omar RA, Chain DG, Frangione B, Ghiso J, Pappolla MA (julio de 1999). "Potentes propiedades neuroprotectoras contra el beta-amiloide de Alzheimer por una estructura indólica endógena relacionada con la melatonina, el ácido indol-3-propiónico". J. Biol. Chem . 274 (31): 21937–21942. doi : 10.1074/jbc.274.31.21937 . PMID 10419516. S2CID 6630247.
[El ácido indol-3-propiónico (IPA)] se ha identificado previamente en el plasma y el líquido cefalorraquídeo de humanos, pero sus funciones no se conocen. ... En experimentos de competencia cinética con agentes que atrapan radicales libres, la capacidad del IPA para eliminar radicales hidroxilo superó a la de la melatonina, una indolamina considerada el eliminador natural de radicales libres más potente. A diferencia de otros antioxidantes, el IPA no se convirtió en intermediarios reactivos con actividad prooxidante.
- ^ Instituto de Medicina (2002). "Proteínas y aminoácidos". Ingestas dietéticas de referencia para energía, carbohidratos, fibra, grasas, ácidos grasos, colesterol, proteínas y aminoácidos . Washington, DC: The National Academies Press. págs. 589–768. doi :10.17226/10490. ISBN. 978-0-309-08525-0.
- ^ ab Ballantyne C (21 de noviembre de 2007). "¿El pavo te da sueño?". Scientific American . Consultado el 6 de junio de 2013 .
- ^ ab McCue K. "Chemistry.org: Thanksgiving, Turkey, and Tryptophan". Archivado desde el original el 4 de abril de 2007. Consultado el 17 de agosto de 2007 .
- ^ abc Holden J. "Base de datos nacional de nutrientes del USDA para referencia estándar, versión 22". Laboratorio de datos de nutrientes, Servicio de investigación agrícola, Departamento de agricultura de los Estados Unidos . Consultado el 29 de noviembre de 2009 .
- ^ Rambali B, Van Andel I, Schenk E, Wolterink G, van de Werken G, Stevenson H, Vleeming W (2002). "[La contribución del aditivo de cacao a la adicción al tabaquismo]" (PDF) . RIVM (informe 650270002/2002). Instituto Nacional de Salud Pública y Medio Ambiente (Países Bajos). Archivado desde el original (PDF) el 8 de noviembre de 2005.
- ^ Soh NL, Walter GT (2011). "Triptófano y depresión: ¿puede la dieta por sí sola ser la respuesta?". Acta Neuropsychiatrica . 23 (1): 1601–5215. doi :10.1111/j.1601-5215.2010.00508.x. S2CID 145779393.
- ^ Fernstrom JD (2012). "Efectos y efectos secundarios asociados con el uso no nutricional del triptófano por parte de los seres humanos". The Journal of Nutrition . 142 (12): 2236S–2244S. doi : 10.3945/jn.111.157065 . PMID 23077193.
- ^ ab Wurtman RJ, Hefti F, Melamed E (1980). "Control de precursores de la síntesis de neurotransmisores". Revisiones farmacológicas . 32 (4): 315–35. PMID 6115400.
- ^ abc Shaw K, Turner J, Del Mar C (2002). Shaw KA (ed.). "Triptófano y 5-hidroxitriptófano para la depresión" (PDF) . Base de Datos Cochrane de Revisiones Sistemáticas . 2010 (1): CD003198. doi :10.1002/14651858.CD003198. PMID 11869656.
- ^ Ravindran AV, da Silva TL (septiembre de 2013). "Terapias complementarias y alternativas como complemento a la farmacoterapia para trastornos del estado de ánimo y la ansiedad: una revisión sistemática". Journal of Affective Disorders . 150 (3): 707–19. doi :10.1016/j.jad.2013.05.042. PMID 23769610.
- ^ Sateia MJ, Buysse DJ, Krystal AD, Neubauer DN, Heald JL (febrero de 2017). "Guía de práctica clínica para el tratamiento farmacológico del insomnio crónico en adultos: una guía de práctica clínica de la Academia Estadounidense de Medicina del Sueño". J Clin Sleep Med . 13 (2): 307–349. doi :10.5664/jcsm.6470. PMC 5263087 . PMID 27998379.
- ^ Kimura T, Bier DM, Taylor CL (diciembre de 2012). "Resumen de las discusiones del taller sobre el establecimiento de límites superiores para los aminoácidos con especial atención a los datos disponibles para los aminoácidos esenciales leucina y triptófano". The Journal of Nutrition . 142 (12): 2245S–2248S. doi : 10.3945/jn.112.160846 . PMID 23077196.
- ^ ab Howland RH (junio de 2012). "Terapias farmacológicas con suplementos dietéticos para la depresión". Revista de enfermería psicosocial y servicios de salud mental . 50 (6): 13–6. doi :10.3928/02793695-20120508-06. PMID 22589230.
- ^ Hopkins FG, Cole SW (diciembre de 1901). "Una contribución a la química de los proteidos: Parte I. Un estudio preliminar de un producto de digestión tríptica no descrito hasta ahora". The Journal of Physiology . 27 (4–5): 418–428. doi :10.1113/jphysiol.1901.sp000880. PMC 1540554 . PMID 16992614.
- ^ Cox G, Rey H (1930). "L-triptófano". Org. Sintetizador . 10 : 100. doi : 10.15227/orgsyn.010.0100.
- ^ Radwanski ER, Last RL (1995). "Biosíntesis y metabolismo del triptófano: genética bioquímica y molecular". The Plant Cell . 7 (7): 921–34. doi :10.1105/tpc.7.7.921. PMC 160888 . PMID 7640526.
- ^ Ikeda M (2002). "Procesos de producción de aminoácidos". Producción microbiana de l-aminoácidos . Avances en ingeniería bioquímica/biotecnología. Vol. 79. págs. 1–35. doi :10.1007/3-540-45989-8_1. ISBN 978-3-540-43383-5. Número de identificación personal 12523387.
- ^ Becker J, Wittmann C (2012). "Producción de productos químicos, materiales y combustibles de base biológica: Corynebacterium glutamicum como fábrica celular versátil". Current Opinion in Biotechnology . 23 (4): 631–40. doi :10.1016/j.copbio.2011.11.012. PMID 22138494.
- ^ Conrado RJ, Varner JD, DeLisa MP (2008). "Ingeniería de la organización espacial de las enzimas metabólicas: imitando la sinergia de la naturaleza". Current Opinion in Biotechnology . 19 (5): 492–9. doi :10.1016/j.copbio.2008.07.006. PMID 18725290.
- ^ Allen J, Varga J (2014). "Síndrome de eosinofilia y mialgia". En Wexler P (ed.). Enciclopedia de toxicología (3.ª ed.). Burlington: Elsevier Science. ISBN 978-0-12-386455-0.
- ^ abcd "Documento informativo sobre el L-triptófano y el 5-hidroxi-L-triptófano". FU. S. Administración de Alimentos y Medicamentos, Centro de Seguridad Alimentaria y Nutrición Aplicada, Oficina de Productos Nutricionales, Etiquetado y Suplementos Dietéticos. 1 de febrero de 2001. Archivado desde el original el 25 de febrero de 2005 . Consultado el 8 de febrero de 2012 .
- ^ "L-triptófano: usos y riesgos". WebMD . 12 de mayo de 2017 . Consultado el 5 de junio de 2017 .
- ^ Altman LK (27 de abril de 1990). "Estudios vinculan el trastorno con el fabricante de un suplemento alimenticio". The New York Times .
- ^ Castot A, Bidault I, Bournerias I, Carlier P, Efthymiou ML (1991). "[Síndrome de "eosinofilia-mialgia" debido a productos que contienen L-triptófano. Evaluación cooperativa de los Centros Regionales Franceses de Farmacovigilancia. Análisis de 24 casos]". Thérapie . 46 (5): 355–65. PMID 1754978.
- ^ "Declaración del COT sobre el triptófano y el síndrome de eosinofilia-mialgia" (PDF) . Comité del Reino Unido sobre toxicidad de sustancias químicas en alimentos, productos de consumo y medio ambiente. Junio de 2004.
- ^ Slutsker L, Hoesly FC, Miller L, Williams LP, Watson JC, Fleming DW (julio de 1990). "Síndrome de eosinofilia-mialgia asociado con la exposición al triptófano de un único fabricante". JAMA . 264 (2): 213–7. doi :10.1001/jama.264.2.213. PMID 2355442.
- ^ Back EE, Henning KJ, Kallenbach LR, Brix KA, Gunn RA, Melius JM (abril de 1993). "Factores de riesgo para el desarrollo del síndrome de mialgia eosinofílica entre los usuarios de L-triptófano en Nueva York". The Journal of Rheumatology . 20 (4): 666–72. PMID 8496862.
- ^ Kilbourne EM, Philen RM, Kamb ML, Falk H (octubre de 1996). "Triptófano producido por Showa Denko y síndrome epidémico de eosinofilia-mialgia". The Journal of Rheumatology. Suplemento . 46 : 81–8, discusión 89–91. PMID 8895184.
- ^ Mayeno AN, Lin F, Foote CS, Loegering DA, Ames MM, Hedberg CW, Gleich GJ (diciembre de 1990). "Caracterización del "pico E", un nuevo aminoácido asociado con el síndrome de eosinofilia-mialgia". Science . 250 (4988): 1707–8. Bibcode :1990Sci...250.1707M. doi :10.1126/science.2270484. PMID 2270484.
- ^ Ito J, Hosaki Y, Torigoe Y, Sakimoto K (enero de 1992). "Identificación de sustancias formadas por descomposición de la sustancia de pico E en triptófano". Toxicología alimentaria y química . 30 (1): 71–81. doi :10.1016/0278-6915(92)90139-C. PMID 1544609.
- ^ Smith MJ, Garrett RH (noviembre de 2005). "Un punto crucial hasta ahora no revelado del síndrome de eosinofilia-mialgia: degradación comprometida de la histamina". Investigación sobre la inflamación . 54 (11): 435–50. doi :10.1007/s00011-005-1380-7. PMID 16307217. S2CID 7785345.
- ^ Michael Predator Carlton. "Biología molecular e ingeniería genética explicadas por alguien que las ha practicado". Archivado desde el original el 24 de junio de 2007.
- ^ Allen JA, Peterson A, Sufit R, Hinchcliff ME, Mahoney JM, Wood TA, Miller FW, Whitfield ML, Varga J (noviembre de 2011). "Síndrome de eosinofilia-mialgia posepidémico asociado con L-triptófano". Arthritis and Rheumatism . 63 (11): 3633–9. doi :10.1002/art.30514. PMC 3848710 . PMID 21702023.
- ^ Mayeno AN, Gleich GJ (septiembre de 1994). "Síndrome de eosinofilia-mialgia y producción de triptófano: una advertencia". Tendencias en biotecnología . 12 (9): 346–52. doi :10.1016/0167-7799(94)90035-3. PMID 7765187.
- ^ Raphals P (noviembre de 1990). "¿El misterio médico amenaza a la biotecnología?". Science . 250 (4981): 619. Bibcode :1990Sci...250..619R. doi :10.1126/science.2237411. PMID 2237411.
- ^ Harding N (21 de diciembre de 2023). «Cómo evitar que la comida navideña arruine tu sueño». The Telegraph . ISSN 0307-1235 . Consultado el 25 de diciembre de 2023 .
- ^ "Alimentación y estado de ánimo. (Profesor de neurociencia Richard Wurtman) (Entrevista)". Nutrition Action Healthletter . Septiembre de 1992.[ enlace muerto ]
- ^ ab Lyons PM, Truswell AS (marzo de 1988). "Precursor de serotonina influenciado por el tipo de comida con carbohidratos en adultos sanos". The American Journal of Clinical Nutrition . 47 (3): 433–9. doi : 10.1093/ajcn/47.3.433 . PMID 3279747.
- ^ abc Wurtman RJ, Wurtman JJ, Regan MM, McDermott JM, Tsay RH, Breu JJ (enero de 2003). "Efectos de comidas normales ricas en carbohidratos o proteínas en las proporciones plasmáticas de triptófano y tirosina". The American Journal of Clinical Nutrition . 77 (1): 128–32. doi : 10.1093/ajcn/77.1.128 . PMID 12499331.
- ^ ab Afaghi A, O'Connor H, Chow CM (febrero de 2007). "Las comidas con carbohidratos de alto índice glucémico acortan el inicio del sueño". The American Journal of Clinical Nutrition . 85 (2): 426–30. doi : 10.1093/ajcn/85.2.426 . PMID 17284739.
- ^ ab Banks WA, Owen JB, Erickson MA (2012). "Insulina en el cerebro: ida y vuelta". Farmacología y terapéutica . 136 (1): 82–93. doi :10.1016/j.pharmthera.2012.07.006. ISSN 0163-7258. PMC 4134675 . PMID 22820012.
- ^ Pardridge WM, Oldendorf WH (agosto de 1975). "Análisis cinético del transporte de aminoácidos a través de la barrera hematoencefálica". Biochimica et Biophysica Acta (BBA) - Biomembranas . 401 (1): 128–36. doi :10.1016/0005-2736(75)90347-8. PMID 1148286.
- ^ Maher TJ, Glaeser BS, Wurtman RJ (mayo de 1984). "Variaciones diurnas en las concentraciones plasmáticas de aminoácidos básicos y neutros y en las concentraciones de aspartato y glutamato en los glóbulos rojos: efectos de la ingesta de proteínas en la dieta". The American Journal of Clinical Nutrition . 39 (5): 722–9. doi :10.1093/ajcn/39.5.722. PMID 6538743.
- ^ ab Fernstrom JD, Wurtman RJ (1971). "Contenido de serotonina en el cerebro: aumento tras la ingestión de una dieta rica en carbohidratos". Science . 174 (4013): 1023–5. Bibcode :1971Sci...174.1023F. doi :10.1126/science.174.4013.1023. PMID 5120086. S2CID 14345137.
- ^ Atul Khullar MD (10 de julio de 2012). "El papel de la melatonina en el ciclo circadiano sueño-vigilia". Psychiatric Times . 29 (7).
- ^ Jackson RW (1930). "Una síntesis de triptofol" (PDF) . Revista de química biológica . 88 (3): 659–662. doi : 10.1016/S0021-9258(18)76755-0 .
- ^ Young SN (septiembre de 2013). "Depleción aguda de triptófano en humanos: una revisión de los aspectos teóricos, prácticos y éticos". Journal of Psychiatry & Neuroscience . 38 (5): 294–305. doi :10.1503/jpn.120209. PMC 3756112 . PMID 23428157.
- ^ Young SN (2013). "El efecto de aumentar y disminuir los niveles de triptófano en el estado de ánimo y el comportamiento social humanos". Philosophical Transactions of the Royal Society of London. Serie B, Ciencias Biológicas . 368 (1615): 20110375. doi :10.1098/rstb.2011.0375. PMC 3638380 . PMID 23440461.
- ^ ab Halberstadt AL, Geyer MA (2018). "Efecto de los alucinógenos en la conducta incondicionada". Curr Top Behav Neurosci . Temas actuales en neurociencias del comportamiento. 36 : 159–199. doi :10.1007/7854_2016_466. ISBN 978-3-662-55878-2. PMC 5787039 . PMID 28224459.
- ^ Canal CE, Morgan D (2012). "Respuesta de espasmo de cabeza en roedores inducida por el alucinógeno 2,5-dimetoxi-4-yodoanfetamina: una historia completa, una reevaluación de los mecanismos y su utilidad como modelo". Drug Test Anal . 4 (7–8): 556–576. doi :10.1002/dta.1333. PMC 3722587 . PMID 22517680.
- ^ Kozlenkov A, González-Maeso J (2013). "Modelos animales y drogas alucinógenas". La neurociencia de las alucinaciones . Nueva York, Nueva York: Springer Nueva York. págs. 253–277. doi :10.1007/978-1-4614-4121-2_14. ISBN 978-1-4614-4120-5.
- ^ Carbonaro TM, Gatch MB (septiembre de 2016). "Neurofarmacología de la N,N-dimetiltriptamina". Brain Res Bull . 126 (Pt 1): 74–88. doi :10.1016/j.brainresbull.2016.04.016. PMC 5048497 . PMID 27126737.
La DMT endógena se sintetiza a partir del aminoácido esencial triptófano, que se descarboxila a triptamina. Luego, la triptamina es transmetilada por la enzima indoletilamina-N-metiltransferasa (INMT) (usando S-adenosil metionina como sustrato), que cataliza la adición de grupos metilo que resultan en la producción de N-metiltriptamina (NMT) y DMT. El NMT también puede actuar como sustrato para la biosíntesis de DMT dependiente de INMT (Barker et al., 1981).
- ^ Barker SA (2018). "N, N-dimetiltriptamina (DMT), un alucinógeno endógeno: investigaciones pasadas, presentes y futuras para determinar su papel y función". Front Neurosci . 12 : 536. doi : 10.3389/fnins.2018.00536 . PMC 6088236 . PMID 30127713.
Después del descubrimiento de una indol-N-metil transferasa (INMT; Axelrod, 1961) en el cerebro de ratas, los investigadores pronto examinaron si la conversión de triptófano (2, Figura 2) en triptamina (TA; 3, Figura 2) podría convertirse en DMT en el cerebro y otros tejidos de varias especies de mamíferos. Numerosos estudios demostraron posteriormente la biosíntesis de DMT en preparaciones de tejido de mamíferos in vitro e in vivo (Saavedra y Axelrod, 1972; Saavedra et al., 1973). En 1972, Juan Saavedra y Julius Axelrod informaron que el TA administrado intracisternalmente se convertía en N-metiltriptamina (NMT; 4, Figura 2) y DMT en la rata, la primera demostración de la formación de DMT por tejido cerebral in vivo.
- ^ Cameron LP, Olson DE (octubre de 2018). "Clásicos oscuros en neurociencia química: N, N-dimetiltriptamina (DMT)" (PDF) . ACS Chem Neurosci . 9 (10): 2344–2357. doi :10.1021/acschemneuro.8b00101. PMID 30036036.
Al igual que la serotonina y la melatonina, la DMT es un producto del metabolismo del triptófano.25 Después de la descarboxilación del triptófano, la triptamina es metilada por una N-metiltransferasa (es decir, INMT) con S-adenosilmetionina sirviendo como donante de metilo. Una segunda metilación enzimática produce DMT (Figura 3A).26 [...] La enzima indoletilamina N-metiltransferasa (INMT) cataliza la metilación de una variedad de aminas biógenas y es responsable de convertir la triptamina en DMT en los mamíferos.140
- ^ Colosimo FA, Borsellino P, Krider RI, Marquez RE, Vida TA (26 de febrero de 2024). "El potencial clínico de la dimetiltriptamina: avances en el otro lado de la enfermedad mental, la neurodegeneración y la conciencia". Psicoactivos . 3 (1). MDPI AG: 93–122. doi : 10.3390/psychoactives3010007 . ISSN 2813-1851.
El metabolismo de la DMT dentro del cuerpo comienza con su síntesis. La DMT endógena se elabora a partir del triptófano después de que la descarboxilación lo transforme en triptamina [22,25]. La triptamina luego sufre una transmetilación mediada por la indoletilamina-N-metiltransferasa (INMT) con S-adenosil metionina (SAM) como sustrato, transformándose en N-metiltriptamina (NMT) y finalmente produciendo N,N-DMT [26]. Curiosamente, la INMT se distribuye ampliamente por todo el cuerpo, predominantemente en los pulmones, la tiroides y las glándulas suprarrenales, con una densa presencia en el asta anterior de la médula espinal. Dentro del dominio cerebral, regiones como el uncus, el bulbo raquídeo, la amígdala, la corteza frontal, el lóbulo frontoparietal y el lóbulo temporal exhiben actividad INMT, localizada principalmente en el soma [26]. Las transcripciones de INMT se encuentran en regiones cerebrales específicas, incluida la corteza cerebral, la glándula pineal y el plexo coroideo, tanto en ratas como en humanos. Aunque el cerebro de la rata es capaz de sintetizar y liberar DMT en concentraciones similares a las de los neurotransmisores monoamínicos establecidos, como la serotonina [27], la posibilidad de que el DMT sea un neurotransmisor auténtico sigue siendo especulativa. Esta cuestión ha sido controvertida durante décadas [28] y requiere la demostración de una liberación dependiente de la actividad (es decir, estimulada por Ca2+) de DMT en una hendidura sináptica para que esté completamente establecida en el cerebro humano.
- ^ Araújo AM, Carvalho F, Bastos Mde L, Guedes de Pinho P, Carvalho M (agosto de 2015). "El mundo alucinógeno de las triptaminas: una revisión actualizada". Arco Toxicol . 89 (8): 1151-1173. doi :10.1007/s00204-015-1513-x. PMID 25877327.
Lectura adicional
Enlaces externos
- "VÍA KEGG: Metabolismo del triptófano - Homo sapiens". KEGG: Enciclopedia de Kioto de genes y genomas. 23 de agosto de 2006. Consultado el 20 de abril de 2008 .
- GP Moss. «Catabolismo del triptófano (etapas iniciales)». Comité de Nomenclatura de la Unión Internacional de Bioquímica y Biología Molecular (NC-IUBMB). Archivado desde el original el 13 de septiembre de 2003. Consultado el 20 de abril de 2008 .
- GP Moss. «Catábolismo del triptófano (etapas posteriores)». Comité de Nomenclatura de la Unión Internacional de Bioquímica y Biología Molecular (NC-IUBMB). Archivado desde el original el 13 de septiembre de 2003. Consultado el 20 de abril de 2008 .
- B. Mikkelson, DP Mikkelson (22 de noviembre de 2007). "Turkey Causes Sleepiness" (El pavo provoca somnolencia). Páginas de referencia de leyendas urbanas . Snopes.com . Consultado el 20 de abril de 2008 .