Clormetina
 | |
 | |
| Nombres | |
|---|---|
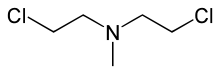
| Nombre IUPAC 2-Cloro- N -(2-cloroetil)- N -metiletanamina | |
Otros nombres
| |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| EBICh | |
| Química biológica | |
| Araña química | |
| Banco de medicamentos | |
| Tarjeta informativa de la ECHA | 100.000.110 |
| Número CE |
|
| BARRIL | |
| Malla | Mecloretamina |
Identificador de centro de PubChem |
|
| Número RTECS |
|
| UNIVERSIDAD | |
| Número de la ONU | 2810 |
Panel de control CompTox ( EPA ) |
|
| |
| Propiedades | |
| C5H11Cl2N | |
| Masa molar | 156,05 g·mol −1 |
| Apariencia | Líquido incoloro |
| Olor | A pescado, amoniacal |
| registro P | 0,91 |
| Farmacología | |
| D08AX04 ( OMS ) L01AA05 ( OMS ) | |
| |
| |
| Farmacocinética : | |
| <1 minuto | |
| 50% (riñón) | |
| Estatus legal | |
| Compuestos relacionados | |
Aminas relacionadas | |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
La clormetina ( INN , BAN ), también conocida como mecloretamina ( USAN , USP ), mustina , HN2 y (en los estados postsoviéticos ) embikhin (эмбихин), es una mostaza nitrogenada que se vende bajo la marca Mustargen, entre otras. Es el prototipo de los agentes alquilantes , un grupo de fármacos quimioterapéuticos contra el cáncer . Funciona uniéndose al ADN, reticulando dos hebras y evitando la duplicación celular. Se une al nitrógeno N7 de la base del ADN guanina . Como el químico es un agente vesicante , su uso está fuertemente restringido dentro de la Convención sobre Armas Químicas, donde está clasificado como una sustancia de la Lista 1 .
La mecloretamina pertenece al grupo de agentes alquilantes de mostaza nitrogenada . [4] [5] [6]
Usos
Se ha derivado en el análogo de estrógeno fosfato de estramustina , utilizado para tratar el cáncer de próstata . También se puede utilizar en la guerra química donde tiene el nombre clave HN2 . Este químico es una forma de gas mostaza nitrogenado y un potente vesicante . Históricamente, algunos usos de la mecloretamina han incluido neoplasias malignas linfoides como la enfermedad de Hodgkin, el linfosarcoma, la leucemia mielocítica crónica, la policitemia vera y el carcinoma broncogénico [7]. La mecloretamina a menudo se administra por vía intravenosa, [8] pero cuando se combina en una formulación tópica también se puede utilizar para tratar enfermedades de la piel. Se han realizado estudios que demuestran que la administración tópica de mecloretamina tiene eficacia en el linfoma cutáneo de células T de tipo micosis fungoide. [9] [10] [11]
Otro uso de la clormetina es en la síntesis de petidina (meperidina). [12]
Efectos secundarios y toxicidad
La mecloretamina es un medicamento altamente tóxico, especialmente para mujeres embarazadas, en período de lactancia o en edad fértil. [13] [14] En niveles suficientemente altos, la exposición puede ser fatal. [6]
Los efectos adversos de la mecloretamina dependen de la formulación. [15] Cuando se utiliza en la guerra química, puede causar inmunosupresión y daño a las membranas mucosas de los ojos, la piel y el tracto respiratorio. Las membranas mucosas y la piel húmeda o dañada son más afectadas por la exposición al HN-2. Aunque los síntomas de exposición generalmente se retrasan, el daño al ADN que causa ocurre muy rápidamente. Las exposiciones más graves hacen que los síntomas se desarrollen antes. Los síntomas oculares se desarrollan primero, en las primeras 1-2 horas (exposición grave) o 3-12 horas (exposición leve a moderada), seguidos de los síntomas de las vías respiratorias (2-6/12-24 horas) y de la piel (6-48 horas). El clima cálido y húmedo acorta el período de latencia (sin síntomas). [6]
Los síntomas de la exposición tóxica al HN-2 varían según la vía de exposición. La exposición ocular provoca lagrimeo (producción de lágrimas), ardor, irritación, picazón, sensación de arenilla o sequedad, blefaroespasmo (espasmos del párpado) y miosis (pupilas contraídas). Los casos más graves provocan edema (hinchazón por acumulación de líquido) en los párpados, fotofobia (sensibilidad extrema a la luz), dolor intenso, ulceración corneal y ceguera. [6]
La inhalación de clormetina daña las vías respiratorias superiores e inferiores de forma secuencial, y las exposiciones más graves provocan daños más rápidos que afectan las partes inferiores del tracto respiratorio. Los primeros síntomas incluyen rinorrea (secreción nasal), epistaxis (hemorragia nasal), voz sin tono, estornudos, tos perruna y disnea (en fumadores y asmáticos). Los síntomas posteriores incluyen dolor en la nariz y los senos nasales e inflamación de las vías respiratorias. En casos graves, puede haber necrosis epitelial en todo el tracto respiratorio, lo que provoca la formación de pseudomembranas, que pueden obstruir las vías respiratorias. Puede desarrollarse neumonía y resultar mortal. [6]
La exposición cutánea causa principalmente eritema (enrojecimiento) y vesicación (formación de ampollas) al principio, pero la absorción a través de la piel causa toxicidad sistémica. En los casos en que más del 25% de la piel está afectada, es probable que se haya producido una exposición mortal. [6]
Aunque la ingestión es poco común, si se ingiere mecloretamina provoca quemaduras químicas graves en el tracto gastrointestinal y náuseas, vómitos, diarrea, dolor abdominal y hemorragia concomitantes. [6]
Los efectos a largo plazo de la exposición aguda o crónica a la clormetina son causados por daños al sistema inmunológico . Los recuentos de glóbulos blancos disminuyen, lo que aumenta el riesgo de infección, y los recuentos de glóbulos rojos y plaquetas también pueden disminuir debido al daño a la médula ósea . Las infecciones oculares crónicas pueden resultar de la exposición, pero la ceguera es temporal. Los efectos a largo plazo en el sistema respiratorio incluyen anosmia (incapacidad para oler), ageusia (incapacidad para saborear), inflamación, infecciones crónicas, fibrosis y cáncer. La piel que ha sido dañada por HN2 puede cambiar de pigmentación o quedar cicatrizada y, con el tiempo, puede desarrollar cáncer. [6]
Historia
El efecto de los agentes vesicantes (que forman ampollas) en forma de gas mostaza (mostaza de azufre, sulfuro de bis(2-cloroetilo)) sobre la médula ósea y los glóbulos blancos se conocía desde la Primera Guerra Mundial. [16] En 1935, varias líneas de investigación química y biológica dieron resultados que se explorarían después del comienzo de la Segunda Guerra Mundial. Se descubrió la acción vesicante de una familia de sustancias químicas relacionadas con las mostazas de azufre, pero con nitrógeno sustituyendo al azufre: así nacieron las "mostazas nitrogenadas". [17] Se sintetizó por primera vez la mostaza nitrogenada particular, la clormetina (mecloretamina). [18] Y se investigó por primera vez la acción de la mostaza de azufre sobre los tumores en animales de laboratorio. [19]
Tras la entrada de los EE.UU. en la Segunda Guerra Mundial, las mostazas nitrogenadas se convirtieron en posibles agentes de guerra química y la Oficina de Investigación y Desarrollo Científico ( OSRD ) inició la investigación sobre ellas. La OSRD otorgó contratos a dos universidades, la Universidad de Yale y la Universidad de Chicago, para estudiarlas. Inspirados quizás por la investigación preliminar de 1935, ambos grupos pensaron de forma independiente en comprobar si existía una toxicidad diferencial útil desde el punto de vista médico entre los animales y los tumores animales. [20] Los farmacólogos de Yale Louis Goodman y Alfred Gilman fueron los primeros en realizar un ensayo clínico, el 27 de agosto de 1942, utilizando el agente HN3 (tris(2-cloroetil)amina) en un paciente conocido como JD [21] [22] [23]
Al año siguiente, el grupo de Chicago, dirigido por Leon O. Jacobson, realizó ensayos con HN2 (clormetina), que fue el único agente de este grupo que llegó a utilizarse en la práctica clínica. El secreto de la guerra impidió que se publicara ninguno de estos trabajos pioneros sobre quimioterapia, pero se publicaron algunos artículos una vez que terminó el secreto de la guerra, en 1946. [24]
Química
La clormetina es combustible y se vuelve explosiva en condiciones extremas. Puede reaccionar con metales para formar hidrógeno gaseoso. [6]
Referencias
- ^ abc "Ledaga". Therapeutic Goods Administration (TGA) . 30 de junio de 2021. Archivado desde el original el 5 de septiembre de 2021. Consultado el 5 de septiembre de 2021 .
- ^ ab "Ledaga EPAR". Agencia Europea de Medicamentos . 17 de septiembre de 2018. Archivado desde el original el 5 de septiembre de 2021. Consultado el 5 de septiembre de 2021 .
- ^ "Aspectos destacados de los productos sanitarios en 2021: Anexos de productos aprobados en 2021". Health Canada . 3 de agosto de 2022 . Consultado el 25 de marzo de 2024 .
- ^ Rappeneau S, Baeza-Squiban A, Jeulin C, Marano F (marzo de 2000). "Protección contra los efectos citotóxicos inducidos por la mostaza nitrogenada mecloretamina en células epiteliales bronquiales humanas in vitro". Toxicol. Sci . 54 (1): 212–21. doi : 10.1093/toxsci/54.1.212 . PMID 10746948.
- ^ "Capítulo 3: Principios de la farmacoterapia oncológica". Tratamiento del cáncer: un enfoque multidisciplinario. 2010. Archivado desde el original el 15 de mayo de 2009. Consultado el 8 de octubre de 2023 .
- ^ abcdefghi "CDC - Base de datos de salud y seguridad de respuesta a emergencias: Agente vesicante: MOSTAZA NITROGENADA HN-2 - NIOSH". Centros para el Control y la Prevención de Enfermedades (CDC) de EE. UU . Archivado desde el original el 28 de junio de 2019. Consultado el 20 de abril de 2016 .
- ^ Bunn Jr, PA; Hoffman, SJ; Norris, D; Golitz, LE; Aeling, JL (1994). "Terapia sistémica de los linfomas cutáneos de células T (micosis fungoide y síndrome de Sézary)". Anales de Medicina Interna . 121 (8): 592–602. doi :10.7326/0003-4819-121-8-199410150-00007. PMID 8085692. S2CID 22909007.
- ^ Medline (2012). Mecloretamina. Recuperado de https://www.nlm.nih.gov/medlineplus/druginfo/meds/a682223.html. Archivado el 5 de julio de 2016 en Wayback Machine.
- ^ Lindahl LM, Fenger-Gron M, Iversen L. Terapia tópica con mostaza nitrogenada en pacientes con micosis fungoide o parapsoriasis. J Eur Acad Dermatol Venereol. Febrero de 2013;27(2):163-8.
- ^ Galper SL, Smith BD, Wilson LD. Diagnóstico y tratamiento de la micosis fungoide. Oncología (Williston Park). Mayo de 2010;24(6):491-501.
- ^ Lessin SR, Duvic M, Guitart J, Pandya AG, Strober BE, Olsen EA, Hull CM, Knobler EH, Rook AH, Kim EJ, Naylor MF, Adelson DM, Kimball AB, Wood GS, Sundram U, Wu H, Kim YH. Quimioterapia tópica en el linfoma cutáneo de células T: resultados positivos de un ensayo aleatorizado, controlado y multicéntrico que prueba la eficacia y seguridad de un nuevo gel de mecloretamina al 0,02 % en la micosis fungoide. JAMA Dermatol. Enero de 2013;149(1):25-32.
- ^ McErlane, KM; Wood, RJ; Matsui, F; Lovering, EG (julio de 1978). "Impurezas en fármacos II: meperidina y sus formulaciones". Revista de ciencias farmacéuticas . 67 (7): 958–961. doi :10.1002/jps.2600670723. PMID 660515.
- ^ Recordati Rare Diseases Inc. (2013). Prospecto de Mustargen. Recuperado de https://www.drugs.com/pro/mustargen.html Archivado el 20 de septiembre de 2018 en Wayback Machine.
- ^ Actelion Pharmaceuticals Ltd. (2013) Prospecto de Valchlor. Recuperado de http://www.accessdata.fda.gov/drugsatfda_docs/label/2013/202317lbl.pdf Archivado el 28 de marzo de 2021 en Wayback Machine.
- ^ Mustargen Archivado el 20 de septiembre de 2018 en Wayback Machine y Valchlor Archivado el 28 de marzo de 2021 en Wayback Machine
- ^ Krumbhaar EB, Krumbhaar HD (1919). "La sangre y la médula ósea en el envenenamiento por gas mostaza: cambios producidos en la médula ósea de casos fatales". J Med Res . 40 (5): 497–508. doi :10.1016/0002-9610(63)90232-0. PMID 13947966. Archivado desde el original el 2020-02-10 . Consultado el 2018-10-14 .
- ^ Ward, Kyle (1935). "Las etilaminas cloradas: un nuevo tipo de vesicante". J. Am. Chem. Soc . 57 (5): 914–916. doi :10.1021/ja01308a041.
- ^ V. Prelog, V. Štěpán (1935). "Nouvele synthèse des pipérazines N-monoalcoylées (VIIièmecommunication sur les bis-[β-halogénoéthyl]-amines)". Colección de comunicaciones químicas checoslovacas . 7 : 93-102. doi :10.1135/cccc19350093.
- ^ Berenblum I. (1935). "Inhibición experimental de la inducción de tumores por gas mostaza y otros compuestos". Revista de patología y bacteriología . 40 (3): 549–558. doi :10.1002/path.1700400312.
- ^ Einhorn, J. (1985). "Mostaza nitrogenada: el origen de la quimioterapia contra el cáncer". Int J Radiat Oncol Biol Phys . 11 (7): 1375–1378. doi :10.1016/0360-3016(85)90254-8. PMID 3891698.
- ^ Alfred Gilman, Frederick S. Philips (1946). "Las acciones biológicas y aplicaciones terapéuticas de las aminas y sulfuros de b-cloroetilo". Science . 103 (2675): 409–436. Bibcode :1946Sci...103..409G. doi :10.1126/science.103.2675.409. PMID 17751251.
- ^ Gilman, Alfred (1963). "El ensayo clínico inicial de la mostaza nitrogenada". Am J Surg . 105 (5): 574–578. doi :10.1016/0002-9610(63)90232-0. PMID 13947966.
- ^ Fenn, John E.; et al. (2011). "Primer uso de quimioterapia intravenosa para el tratamiento del cáncer: rectificando el historial". Revista del Colegio Americano de Cirujanos . 212 (3): 413–417. doi :10.1016/j.jamcollsurg.2010.10.018. PMID 21247779.
- ^ Jacobson LO, Spurr CL, Barron E., Smith T., Lushbaugh C., Dick GF (1946). "Terapia con mostaza nitrogenada: estudios sobre el efecto del clorhidrato de metil-bis (beta-cloroetil) amina en enfermedades neoplásicas y trastornos relacionados del sistema hematopoyético". JAMA . 132 (2675): 263–271. doi :10.1001/jama.1946.02870400011003. PMID 20997209.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace )



