Adenoma hipofisario
| Adenoma hipofisario | |
|---|---|
 | |
| Pérdida del campo visual en la hemianopsia bitemporal : pérdida de la visión periférica que afecta a ambos ojos, como resultado de un tumor (normalmente un adenoma hipofisario) que ejerce presión sobre el quiasma óptico. | |
| Especialidad | Oncología , endocrinología |
Los adenomas hipofisarios son tumores que se producen en la glándula pituitaria . La mayoría de los tumores hipofisarios son benignos, aproximadamente el 35% son invasivos y solo el 0,1% al 0,2% son carcinomas . [1] Los adenomas hipofisarios representan del 10% al 25% de todas las neoplasias intracraneales, con una tasa de prevalencia estimada en la población general de aproximadamente el 17%. [1] [2]
Los adenomas hipofisarios no invasivos y no secretores se consideran benignos tanto en el sentido literal como en el clínico, aunque un metanálisis de 2011 de las investigaciones disponibles mostró que la investigación para apoyar o refutar esta suposición era escasa y de calidad cuestionable. [3]
Los adenomas que superan los 10 mm (0,39 pulgadas) de tamaño se definen como macroadenomas , mientras que los menores de 10 mm (0,39 pulgadas) se denominan microadenomas . La mayoría de los adenomas hipofisarios son microadenomas y tienen una prevalencia estimada del 16,7% (14,4% en estudios de autopsia y 22,5% en estudios radiológicos ). [2] [4] La mayoría de los microadenomas hipofisarios permanecen sin diagnosticar, y los que se diagnostican a menudo se encuentran como un hallazgo incidental y se denominan incidentalomas .
Los macroadenomas hipofisarios son la causa más común de hipopituitarismo . [5] [6]
Si bien los adenomas pituitarios son comunes y afectan aproximadamente a 1 de cada 6 miembros de la población general, los adenomas pituitarios clínicamente activos que requieren tratamiento quirúrgico son más raros y afectan aproximadamente a 1 de cada 1000. [7]
Signos y síntomas
Físico
Los adenomas hipofisarios secretores de hormonas causan una de varias formas de hiperpituitarismo . Los detalles dependen del tipo de hormona. Algunos tumores secretan más de una hormona, siendo la combinación más común [8] la GH y la prolactina , que se presentan como gigantismo o acromegalia y lactancia inesperada (tanto en hombres como en mujeres). [ cita requerida ]
Un paciente con adenoma hipofisario puede presentar defectos del campo visual , clásicamente a la izquierda y a la derecha en la hemianopsia bitemporal . Surge de la compresión del nervio óptico por el tumor. El área específica de la vía visual en la que ocurre la compresión por estos tumores es en el quiasma óptico . Si se origina superior al quiasma óptico, más comúnmente en un craneofaringioma del tallo hipofisario , el defecto del campo visual aparecerá primero como cuadrantanopsia inferior bitemporal . Si se origina inferior al quiasma óptico, el defecto del campo visual aparecerá primero como cuadrantanopsia superior bitemporal . La expansión lateral de un adenoma hipofisario también puede comprimir el nervio abducens , causando una parálisis del recto lateral . [9]
Además, un adenoma hipofisario puede causar síntomas de aumento de la presión intracraneal . Los prolactinomas suelen comenzar a dar síntomas, especialmente durante el embarazo, cuando el aumento del nivel de la hormona estrógeno puede aumentar la tasa de crecimiento del tumor. [10]
En los pacientes con adenomas hipofisarios, son comunes varios tipos de dolores de cabeza. El adenoma puede ser el factor causal principal del dolor de cabeza o puede servir para exacerbar un dolor de cabeza causado por otros factores. Entre los tipos de dolores de cabeza experimentados se encuentran la migraña crónica y episódica y, con menor frecuencia, varios dolores de cabeza unilaterales; dolor de cabeza punzante primario, [11] ataques de dolor de cabeza neuralgiforme unilateral de corta duración con inyección conjuntival y lagrimeo (SUNCT) [12] – otro tipo de dolor de cabeza punzante caracterizado por breves punzadas de dolor – dolor de cabeza en racimos , [13] y hemicránea continua (HS). [14]
Los síntomas compresivos de los adenomas hipofisarios (déficits del campo visual, disminución de la agudeza visual, dolores de cabeza) se observan con más frecuencia en los macroadenomas (que tienen más de 10 mm de diámetro) que en los microadenomas (que tienen menos de 10 mm de diámetro). [15]
Los adenomas no secretores pueden pasar desapercibidos durante un tiempo prolongado porque no se observan anomalías obvias; la reducción gradual de las actividades normales debido a la disminución de la producción de hormonas es bastante menos evidente. Por ejemplo, la falta de hormona adrenocorticotrópica significa que las glándulas suprarrenales no producirán suficiente cortisol , lo que da lugar a una recuperación lenta de la enfermedad, inflamación y fatiga crónica; la falta de hormona del crecimiento en niños y adolescentes conduce a una disminución de la estatura, pero esto puede tener muchas otras explicaciones. [ cita requerida ]
Psiquiátrico
Se han asociado diversas manifestaciones psiquiátricas con trastornos hipofisarios, incluidos los adenomas hipofisarios. Se han observado síntomas psiquiátricos como depresión, ansiedad [16] , apatía, inestabilidad emocional, irritabilidad fácil y hostilidad. [17]
Complicaciones

- La acromegalia es un síndrome que se produce cuando la glándula pituitaria anterior produce un exceso de hormona del crecimiento (GH). Aproximadamente el 90-95% de los casos de acromegalia son causados por un adenoma pituitario y afecta más comúnmente a adultos de mediana edad. [18] La acromegalia puede provocar desfiguración grave, complicaciones graves y muerte prematura si no se controla. La enfermedad, que a menudo también se asocia con gigantismo , es difícil de diagnosticar en las primeras etapas y con frecuencia se pasa por alto durante muchos años, hasta que se notan cambios en las características externas, especialmente en la cara, y el tiempo medio desde el desarrollo de los síntomas iniciales hasta el diagnóstico es de doce años. [19]
- El síndrome de Cushing es un trastorno hormonal que causa hipercortisolismo, que consiste en niveles elevados de cortisol en la sangre. La enfermedad de Cushing (EC) es la causa más frecuente del síndrome de Cushing, responsable de aproximadamente el 70% de los casos. [20] La EC se produce cuando un adenoma hipofisario provoca una secreción excesiva de hormona adrenocorticotrópica (ACTH) que estimula las glándulas suprarrenales para que produzcan cantidades excesivas de cortisol . [21]
- La enfermedad de Cushing puede causar fatiga, aumento de peso, depósitos de grasa alrededor del abdomen y la espalda baja (obesidad troncal) y la cara ("cara de luna"), estrías ( estrías ) en la piel del abdomen, los muslos, los senos y los brazos, hipertensión , intolerancia a la glucosa y diversas infecciones. En las mujeres, puede causar un crecimiento excesivo del vello facial ( hirsutismo ) y en los hombres, disfunción eréctil . Las manifestaciones psiquiátricas pueden incluir depresión, ansiedad , irritabilidad fácil e inestabilidad emocional. También puede dar lugar a diversas dificultades cognitivas . [ cita requerida ]
- El hiperpituitarismo es una enfermedad del lóbulo anterior de la glándula pituitaria que generalmente es causada por un adenoma hipofisario funcional y da lugar a una hipersecreción de hormonas adenohipofisarias como la hormona del crecimiento, la prolactina, la tirotropina, la hormona luteinizante, la hormona folículo estimulante y la hormona adrenocorticotrópica. [ cita requerida ]
- La apoplejía hipofisaria es una afección que se produce cuando los adenomas hipofisarios sufren una hemorragia interna repentina, lo que provoca un aumento rápido de tamaño o cuando el tumor supera el aporte sanguíneo necesario, lo que provoca necrosis tisular y posterior hinchazón del tejido muerto. La apoplejía hipofisaria suele presentarse con pérdida de visión y cefalea de aparición repentina y requiere un tratamiento oportuno, a menudo con corticosteroides y, si es necesario, intervención quirúrgica. [22]
- La diabetes insípida central es causada por una disminución en la producción de la hormona antidiurética vasopresina , que causa sed intensa y una producción excesiva de orina muy diluida ( poliuria ), lo que puede provocar deshidratación . La vasopresina se produce en el hipotálamo y luego se transporta por el tallo hipofisario y se almacena en el lóbulo posterior de la glándula pituitaria, que luego la secreta al torrente sanguíneo. [23]
Como la glándula pituitaria está muy cerca del cerebro, los adenomas invasivos pueden invadir la duramadre , el hueso craneal o el hueso esfenoides . [24]
Factores de riesgo
Neoplasia endocrina múltiple
Los adenomas de la glándula pituitaria anterior son una característica clínica importante de la neoplasia endocrina múltiple tipo 1 (MEN1), un síndrome endocrino hereditario poco común que afecta a 1 persona de cada 30.000. La MEN causa varias combinaciones de tumores benignos o malignos en varias glándulas del sistema endocrino o puede hacer que las glándulas se agranden sin formar tumores. A menudo afecta las glándulas paratiroides , las células de los islotes pancreáticos y el lóbulo anterior de la glándula pituitaria. La MEN1 también puede causar tumores no endocrinos como angiofibromas faciales , colagenomas , lipomas , meningiomas , ependimomas y leiomiomas . Aproximadamente el 25 por ciento de los pacientes con MEN1 desarrollan adenomas hipofisarios. [25] [26]
Complejo Carney
El complejo de Carney (CNC), también conocido como síndrome LAMB [27] y síndrome NAME [27] es una afección autosómica dominante que comprende mixomas del corazón y la piel, hiperpigmentación de la piel ( lentiginosis ) e hiperactividad endocrina y es distinta de la tríada de Carney . [28] [29] Aproximadamente el 7% de todos los mixomas cardíacos están asociados con el complejo de Carney. [30] Los pacientes con CNC desarrollan tumores hipofisarios productores de hormona de crecimiento (GH) y en algunos casos estos mismos tumores también secretan prolactina . Sin embargo, no hay prolactinomas aislados ni ningún otro tipo de tumor hipofisario. En algunos pacientes con CNC, la glándula pituitaria se caracteriza por áreas hiperplásicas con la hiperplasia probablemente precediendo la formación de adenomas productores de GH. [31]
Adenoma hipofisario familiar aislado
El adenoma hipofisario aislado familiar (FIPA) es un término que se utiliza para identificar una afección que muestra una herencia autosómica dominante y se caracteriza por la presencia de dos o más pacientes relacionados afectados por adenomas de la glándula pituitaria únicamente, sin otros síntomas asociados que ocurren en la neoplasia endocrina múltiple tipo 1 (MEN-1), complejo de Carney y con mutaciones en el gen de la proteína que interactúa con el receptor de hidrocarburos arílicos (AIP). [32] [33] [34] El FIPA fue descrito por primera vez en una cohorte limitada de familias por el grupo de Albert Beckers en Lieja, Bélgica; [35] más tarde, el FIPA se caracterizó por completo en un estudio internacional multicéntrico de 64 familias. [33] Las familias FIPA se dividen en aquellas que son homogéneas y tienen el mismo tipo de adenoma hipofisario en todos los miembros de la familia afectados (por ejemplo, solo acromegalia , solo prolactinoma , etc.), mientras que las familias FIPA heterogéneas pueden tener diferentes adenomas hipofisarios en los miembros de la familia afectados. [36]
Genética de FIPA
La FIPA tiene dos causas genéticas conocidas, mutaciones en el gen de la proteína que interactúa con el receptor AH (AIP) [37] y duplicaciones en el cromosoma Xq26.3 que incluyen el gen GPR101 que también causa el síndrome de acrogigantismo ligado al cromosoma X (X-LAG). [38] Alrededor del 15-20% de las familias con FIPA son portadoras de una mutación o deleción del gen AIP de la línea germinal, y la enfermedad se presenta como autosómica dominante con penetrancia incompleta, lo que significa que alrededor del 20% de los portadores de la mutación AIP desarrollarán un adenoma hipofisario. [36] Los adenomas hipofisarios asociados a la mutación AIP (que se presentan como FIPA o como casos individuales, no familiares) suelen ser adenomas secretores de hormona del crecimiento ( acromegalia ) o secretores de prolactina ( prolactinoma ) que son grandes (macroadenomas) y a menudo se presentan en niños, adolescentes y adultos jóvenes. Daly y sus colegas demostraron que los casos de acromegalia con mutaciones AIP ocurrieron unos 20 años antes que los casos de acromegalia sin mutaciones AIP y estos tumores son grandes y relativamente resistentes al tratamiento. [39] Debido a su temprana edad de aparición, las mutaciones AIP son la causa genética más frecuente de gigantismo hipofisario (29% de los casos). [40]
X-LAG es un síndrome raro de tumores/hiperplasia hipofisaria de aparición muy temprana en la infancia que conduce a un exceso de hormona de crecimiento y un sobrecrecimiento severo y gigantismo hipofisario. [38] [41] Hasta la fecha, se han informado tres familias FIPA con X-LAG, todas las cuales tuvieron transmisión de una duplicación del cromosoma Xq26.3 de la madre afectada al hijo afectado. [41] [38] Las características de la enfermedad del gigantismo hipofisario de aparición muy temprana conducen a un sobrecrecimiento severo si no se trata adecuadamente; muchos de los humanos más altos de la historia (por ejemplo, Robert Pershing Wadlow ; Sandy Allen , André Rousimoff (Andre el Gigante), Zeng Jinlian ) tenían una historia clínica similar a los pacientes con síndrome X-LAG. [42] El individuo histórico más alto con una causa genética conocida fue Julius Koch (Geant Constantin), a quien se le encontró X-LAG en un estudio genético de su esqueleto. [43] La X-LAG tiene una penetrancia del 100% hasta el momento (todos los afectados con la duplicación Xq26.3 tienen la enfermedad y afecta predominantemente a mujeres. [38] Los casos aislados no familiares de X-LAG pueden tener una duplicación constitucional de un cromosoma Xq26.3 que incluye GPR101 , o mosaicismo para la duplicación (presente en una minoría de células) en el caso de pacientes masculinos aislados. [44] La X-LAG causa alrededor del 10% de los casos de gigantismo hipofisario . [40]
Mecanismo
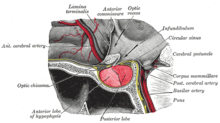
La glándula pituitaria o hipófisis se suele denominar la "glándula maestra" del cuerpo humano. Forma parte del eje hipotálamo-hipofisario y controla la mayoría de las funciones endocrinas del cuerpo a través de la secreción de varias hormonas en el sistema circulatorio . La glándula pituitaria está situada debajo del cerebro en una depresión ( fosa ) del hueso esfenoides conocida como silla turca . Aunque está conectada anatómica y funcionalmente al cerebro, la glándula pituitaria [45] se encuentra fuera de la barrera hematoencefálica . Está separada del espacio subaracnoideo por el diafragma de la silla turca , por lo que la aracnoides y, por tanto, el líquido cefalorraquídeo no pueden entrar en la silla turca. [ cita requerida ]
La glándula pituitaria se divide en dos lóbulos, el lóbulo anterior (que representa dos tercios del volumen de la glándula) y el lóbulo posterior (un tercio del volumen) separados por la pars intermedia . [8]
El lóbulo posterior (lóbulo neural o neurohipófisis) de la glándula pituitaria no es, a pesar de su nombre, una verdadera glándula . El lóbulo posterior contiene axones de neuronas que se extienden desde el hipotálamo al que está conectado a través del tallo pituitario. Las hormonas vasopresina y oxitocina , producidas por las neuronas de los núcleos supraóptico y paraventricular del hipotálamo, se almacenan en el lóbulo posterior y se liberan desde las terminaciones axónicas ( dendritas ) dentro del lóbulo. [46]
El lóbulo anterior de la glándula pituitaria (adenohipófisis) es una glándula verdadera que produce y secreta seis hormonas diferentes: hormona estimulante de la tiroides (TSH), hormona adrenocorticotrópica (ACTH), hormona folículo estimulante (FSH), hormona luteinizante (LH), hormona del crecimiento (GH) y prolactina (PRL). [47]
Diagnóstico
El diagnóstico de adenoma hipofisario se puede realizar, o al menos sospechar, mediante una constelación de síntomas relacionados presentados anteriormente. [9]
El diagnóstico diferencial incluye el tuberculoma hipofisario, especialmente en países en desarrollo y en pacientes inmunodeprimidos. [48] El diagnóstico se confirma mediante pruebas de los niveles hormonales y mediante imágenes radiográficas de la hipófisis (por ejemplo, mediante tomografía computarizada o resonancia magnética ). [ cita requerida ]
Clasificación
Los adenomas hipofisarios se clasifican como tumores endocrinos y también como tumores cerebrales, aunque algunos grupos de pacientes prefieren no referirse a ellos como tumores cerebrales. [49] [50] [51] [52] Los adenomas hipofisarios se clasifican según criterios anatómicos , histológicos y funcionales. [53]
- Los tumores hipofisarios se clasifican anatómicamente por su tamaño según los hallazgos radiológicos; ya sean microadenomas (menores de <10 mm) o macroadenomas (iguales o mayores de ≥10 mm).
- La clasificación basada en los hallazgos radioanatómicos ubica a los adenomas en 1 de 4 grados (I–IV): [54]
- Estadio I: microadenomas (<1 cm) sin expansión de la silla turca.
- Estadio II: macroadenomas (≥1 cm) y pueden extenderse por encima de la silla turca.
- Estadio III: macroadenomas con agrandamiento e invasión del piso o extensión supraselar.
- Estadio IV: destrucción de la silla turca.
- La clasificación histológica utiliza una caracterización inmunohistológica de los tumores en términos de su producción hormonal. [53] Históricamente se clasificaban como basófilos , acidófilos o cromófobos en función de si captaban o no las tinciones hematoxilina y eosina . Esta clasificación ha caído en desuso, a favor de una clasificación basada en el tipo de hormona secretada por el tumor. Aproximadamente el 20-25% de los adenomas no secretan ninguna hormona activa fácilmente identificable ("tumores no funcionales"), pero a veces todavía se los denomina "cromófobos". [ cita requerida ]
- La clasificación funcional se basa en la actividad endocrina de los tumores, determinada por los niveles de hormonas séricas y la secreción hormonal celular del tejido hipofisario detectada mediante tinción inmunohistoquímica . [55] Los valores del "Porcentaje de casos de producción hormonal" son las fracciones de adenomas que producen cada hormona relacionada de cada tipo de tumor en comparación con todos los casos de tumores hipofisarios, y no se correlacionan directamente con los porcentajes de cada tipo de tumor debido a una incidencia mayor o menor de ausencia de secreción de la hormona esperada. Por lo tanto, los adenomas no secretores pueden ser adenomas de células nulas o un adenoma más específico que, sin embargo, sigue siendo no secretor. [ cita requerida ]
- Cualquier tipo de adenocarcinoma hipofisario enumerado en la tabla a continuación puede causar síntomas compresivos debido a la expansión local, además de los efectos sistémicos de las hormonas secretadas enumeradas en la columna de patología. [ cita requerida ]
- Los adenomas de células nulas por definición no secretan hormonas, pero suelen causar efectos compresivos sobre el tallo hipofisario (efecto tallo). Esto conduce a una disminución de los niveles de dopamina desde el hipotálamo hasta la glándula pituitaria anterior. La dopamina ejerce un efecto inhibidor sobre la secreción de prolactina. Con la ausencia de este efecto inhibidor, los niveles de prolactina aumentan y a menudo aumentan en los adenomas de células nulas. Esto conduce a síntomas de hipogonadismo. [15]
| Tipo de adenoma | Secreción | Tinción | Patología | Porcentaje de casos de producción de hormonas | Porcentaje de casos silenciosos [56] |
|---|---|---|---|---|---|
| Adenomas lactotróficos ( prolactinomas ) | secretan prolactina | acidófilo | galactorrea , hipogonadismo , amenorrea , infertilidad e impotencia | 30% [57] | <9% [56] |
| adenomas somatotróficos | secretan hormona del crecimiento (GH) | acidófilo | acromegalia en adultos; gigantismo en niños | 15% [57] | <9% [56] |
| adenomas corticotróficos | secretan hormona adenocorticotrópica (ACTH) | basófilo | Enfermedad de Cushing | 2–6% [15] | 10% |
| adenomas gonadotróficos | secretan hormona luteinizante (LH), hormona folículo estimulante (FSH) y sus subunidades | basófilo | Generalmente no causa síntomas, ocasionalmente hipergonadismo [15] | 10% [57] | 73% [56] |
| adenomas tirotróficos (poco frecuentes) | secretan hormona estimulante de la tiroides (TSH) | basófilo a cromófobo | Ocasionalmente , el hipertiroidismo [58] por lo general no causa síntomas. | Menos del 1% [57] | <9% |
| adenomas de células nulas | no secretan hormonas | Puede dar positivo para sinaptofisina. | Asintomático o hipogonadismo [15] | El 25% de los adenomas hipofisarios no son secretores [57] | 1% [56] |
- Adenoma hipofisario somatotrofo que muestra citoplasma acidófilo
- Un adenoma hipofisario gonadotropo silencioso que, en este caso, es eosinofílico (al contrario de las células gonadotropas basófilas normales)
- Los adenomas de células nulas verdaderas suelen estar compuestos por células uniformes, levemente atípicas, con citoplasma cromófobo. Este caso tiene una arquitectura papilar similar a la de los adenomas gonadotropos. [59]
Incidentalomas hipofisarios
Los incidentalomas hipofisarios son tumores hipofisarios que se caracterizan por ser un hallazgo incidental . A menudo se descubren mediante tomografía computarizada (TC) o resonancia magnética (RM), realizadas en la evaluación de afecciones médicas no relacionadas, como un traumatismo craneoencefálico sospechoso , en la estadificación del cáncer o en la evaluación de síntomas inespecíficos como mareos y dolor de cabeza . No es raro que se descubran en la autopsia . En un metanálisis , se encontraron adenomas en un promedio de 16,7% en estudios post mortem, y la mayoría eran microadenomas (<10 mm); los macrodenomas representaron solo entre el 0,16% y el 0,2% de los fallecidos. [2] Si bien los microadenomas hipofisarios no secretores y no invasivos generalmente se consideran literal y clínicamente benignos , un metanálisis de 2011 de la investigación disponible mostró que, hasta ese momento, había escasos estudios de baja calidad que respaldaran esta afirmación. [3]
Las Guías de Práctica Clínica, publicadas en abril de 2011 en The Journal of Clinical Endocrinology and Metabolism por la Endocrine Society (una organización médica internacional profesional), recomiendan que todos los pacientes con incidentalomas hipofisarios se sometan a una historia clínica completa y un examen físico , evaluaciones de laboratorio para detectar hipersecreción hormonal e hipopituitarismo . Si la lesión está muy cerca de los nervios ópticos o el quiasma óptico , se debe realizar un examen del campo visual . Para aquellos con incidentalomas que no requieren extirpación quirúrgica, se deben realizar evaluaciones clínicas de seguimiento y neuroimagen, así como exámenes de seguimiento del campo visual para incidentalomas que lindan o comprimen el nervio óptico y el quiasma y pruebas endocrinas de seguimiento para macroincidentalomas. [60]
Adenoma hipofisario ectópico
Un adenoma pituitario ectópico (que se presenta en un lugar anormal) es un tipo raro de tumor que se presenta fuera de la silla turca , con mayor frecuencia en el seno esfenoidal , [61] la región supraselar, la nasofaringe y los senos cavernosos . [62]
Metástasis en la glándula pituitaria
Los carcinomas que hacen metástasis en la glándula pituitaria son poco comunes y se observan típicamente en ancianos, [63] [64] siendo los cánceres de pulmón y de mama los más frecuentes, [65] En pacientes con cáncer de mama, las metástasis en la glándula pituitaria ocurren en aproximadamente el 6-8% de los casos. [66]
Las metástasis hipofisarias sintomáticas representan solo el 7% de los casos notificados. En aquellos que presentan síntomas , a menudo se presenta diabetes insípida , con tasas de aproximadamente el 29-71%. Otros síntomas notificados con frecuencia incluyen disfunción de la hipófisis anterior, defectos del campo visual, dolor de cabeza y oftalmoplejía . [67]
Tratamiento
Las opciones de tratamiento dependen del tipo de tumor y de su tamaño:
- Los prolactinomas (microadenomas y macroadenomas) se tratan con mayor frecuencia con cabergolina o bromocriptina (ambos agonistas de la dopamina ) como primera línea de tratamiento. [68] El tratamiento médico generalmente disminuye eficazmente el tamaño del tumor y alivia los síntomas. [68] Los adenomas hipofisarios también se controlan con imágenes seriadas (generalmente resonancia magnética ) para detectar cualquier aumento de tamaño o efecto de masa en las estructuras cercanas. Si la terapia médica falla, la segunda opción suele ser la cirugía hipofisaria transesfenoidal . [68] Una terapia de tercera línea es la radioterapia, terapia de protones para reducir el tamaño del tumor. [68]
- Los tirotropinomas se tratan con cirugía pituitaria transesfenoidal como la opción de tratamiento de primera línea. [68] La terapia médica es un tratamiento de segunda línea, y los tirotropinomas responden al tratamiento con ligandos del receptor de somatostatina como octreótido o lanreótido . [68] En personas con tirotropinomas, el tratamiento con ligandos del receptor de somatostatina normalizó los niveles de hormona tiroidea en el 80-90% de las personas, y el 42% de las personas tuvieron una disminución del tamaño del tumor. [68]
- Los adenomas somatotróficos se tratan principalmente con cirugía pituitaria transesfenoidal, especialmente si hay síntomas de acromegalia. [68] Una estrategia de tratamiento de segunda línea (que se puede utilizar si hay una masa persistente o recurrente o síntomas después de la cirugía) utiliza terapia médica, incluyendo octreótido o lanreótido , que son análogos de la somatostatina de acción prolongada . Estos análogos del receptor de somatostatina inhiben la secreción de la hormona del crecimiento. [68] Se encontró que tenían una eficacia de alrededor del 50-55% en la reducción de la masa tumoral y la reducción de los niveles de la hormona del crecimiento y del factor de crecimiento similar a la insulina 1 ( IGF-1 ) en estudios. [15] El antagonista del receptor de la hormona del crecimiento pegvisomant también se utiliza en el tratamiento de los adenomas somatotróficos. Pegvisomant bloquea la acción de la hormona del crecimiento. Puede utilizarse como monoterapia o combinado con un análogo de la somatostatina. [69]
- Los corticotropinomas se tratan principalmente con cirugía pituitaria transesfenoidal, especialmente si hay signos y síntomas del síndrome de Cushing . [68] La terapia con medicamentos es de segunda línea e incluye inhibidores de la esteroidogénesis ( ketoconazol , metirapona , osilodrostat , etomidato o mitotano ) que disminuyen la producción de cortisol, bloqueadores hipofisarios como el ligando del receptor de somatostatina pasireotida o el agonista de la dopamina cabergolina , o el antagonista del receptor de glucocorticoides mifepristona . [68] Estos medicamentos se pueden combinar para lograr un efecto sinérgico. La terapia con medicamentos a menudo se usa junto con la radioterapia para los corticotropinomas. [68]
- La cirugía es un tratamiento común para los tumores hipofisarios. El abordaje normal es la adenectomía transesfenoidal , que generalmente puede extirpar el tumor sin afectar el cerebro ni los nervios ópticos. [70]
- La radioterapia también se utiliza para tratar los adenomas hipofisarios. Algunos ejemplos incluyen radioterapia con haz externo o con haz de protones o radiocirugía estereotáctica. La radioterapia externa de los adenomas hipofisarios puede detener el crecimiento del tumor durante varios años, pero la insuficiencia hipofisaria se desarrolla dentro de los 10 años en la mayoría de los pacientes, lo que requiere reemplazo hormonal de por vida. [15] La radioterapia para los adenomas hipofisarios se asocia con un aumento de cuatro veces en la mortalidad debido a enfermedad cerebrovascular. [15] Se recomienda un control de por vida de las hormonas hipofisarias después de la radioterapia, ya que el hipopituitarismo se desarrolló en el 17% de los pacientes sometidos a radioterapia. [68]
Véase también
Referencias
- ^ ab Tratamiento de los tumores hipofisarios (PDQ®)–Versión para profesionales de salud NIH Instituto Nacional del Cáncer
- ^ abc Ezzat S, Asa SL, Couldwell WT , Barr CE, Dodge WE, Vance ML, et al. (agosto de 2004). "La prevalencia de adenomas hipofisarios: una revisión sistemática". Cáncer . 101 (3): 613–619. doi : 10.1002/cncr.20412 . PMID: 15274075. S2CID : 16595581.
- ^ ab Fernández-Balsells MM, Murad MH, Barwise A, Gallegos-Orozco JF, Paul A, Lane MA, et al. (Abril de 2011). "Historia natural de los adenomas e incidentalomas hipofisarios no funcionantes: una revisión sistemática y un metaanálisis". La Revista de Endocrinología Clínica y Metabolismo . 96 (4): 905–912. doi : 10.1210/jc.2010-1054 . PMID 21474687.
- ^ Asa SL (agosto de 2008). "Patología hipofisaria práctica: ¿qué necesita saber el patólogo?". Archivos de patología y medicina de laboratorio . 132 (8): 1231–1240. doi :10.5858/2008-132-1231-PPPWDT. PMID 18684022.
- ^ Higham CE, Johannsson G, Shalet SM (noviembre de 2016). "Hipopituitarismo". Lanceta . 388 (10058): 2403–2415. doi :10.1016/S0140-6736(16)30053-8. PMID 27041067. S2CID 208791062.
- ^ Hipertiroidismo desenmascarado varios años después del tratamiento médico y radioquirúrgico de un macroprolactinoma invasivo que indujo hipopituitarismo: reporte de un caso. L Foppiani, A Ruelle, P Cavazzani, P del Monte – Cases Journal, 2009
- ^ Daly AF, Rixhon M, Adam C, Dempegioti A, Tichomirowa MA, Beckers A (diciembre de 2006). "Alta prevalencia de adenomas hipofisarios: un estudio transversal en la provincia de Lieja, Bélgica". The Journal of Clinical Endocrinology and Metabolism . 91 (12): 4769–4775. doi : 10.1210/jc.2006-1668 . PMID 16968795.
- ^ ab Serri O, Somma M, Rasio E, Brazeau P (enero de 1989). "El factor liberador de la hormona del crecimiento aumenta las concentraciones séricas de prolactina en sujetos normales y en pacientes con adenomas hipofisarios". Endocrinología clínica . 30 (1): 65–75. doi :10.1111/j.1365-2265.1989.tb03728.x. PMID 2505955. S2CID 27780583.
- ^ ab "Acromegalia y gigantismo". Biblioteca de conceptos médicos de Lecturio . Consultado el 26 de junio de 2021 .
- ^ Almalki MH, Alzahrani S, Alshahrani F, Alsherbeni S, Almoharib O, Aljohani N, et al. (2015). "Manejo de los prolactinomas durante el embarazo". Fronteras en Endocrinología . 6 : 85. doi : 10.3389/fendo.2015.00085 . PMC 4443771 . PMID 26074878.
- ^ Levy MJ, Matharu MS, Meeran K, Powell M, Goadsby PJ (agosto de 2005). "Características clínicas del dolor de cabeza en pacientes con tumores hipofisarios". Brain . 128 (Pt 8): 1921–1930. doi : 10.1093/brain/awh525 . PMID 15888539.
- ^ Matharu MS, Levy MJ, Merry RT, Goadsby PJ (noviembre de 2003). "Síndrome SUNCT secundario a prolactinoma". Revista de neurología, neurocirugía y psiquiatría . 74 (11): 1590–1592. doi :10.1136/jnnp.74.11.1590. PMC 1738244 . PMID 14617728.
- ^ Milos P, Havelius U, Hindfelt B (marzo de 1996). "Cefalea en racimos en un paciente con adenoma hipofisario. Con una revisión de la literatura". Cefalea . 36 (3): 184–188. doi : 10.1046/j.1526-4610.1996.3603184.x . PMID 8984093. S2CID 1681207.
- ^ Levy MJ, Matharu MS, Goadsby PJ (marzo de 2003). "Prolactinomas, agonistas de la dopamina y cefalea: informes de dos casos". Revista Europea de Neurología . 10 (2): 169–173. doi :10.1046/j.1468-1331.2003.00549.x. PMID 12603293. S2CID 9475046.
- ^ abcdefgh Melmed S (marzo de 2020). "Endocrinopatías hipofisarias-tumorales". The New England Journal of Medicine . 382 (10): 937–950. doi :10.1056/NEJMra1810772. PMID 32130815. S2CID 212417223.
- ^ Sievers C, Ising M, Pfister H, Dimopoulou C, Schneider HJ, Roemmler J, et al. (marzo de 2009). "La personalidad en pacientes con adenomas hipofisarios se caracteriza por un aumento de los rasgos relacionados con la ansiedad: comparación de 70 pacientes acromegálicos con pacientes con adenomas hipofisarios no funcionales y controles emparejados por edad y género". Revista Europea de Endocrinología . 160 (3): 367–373. doi : 10.1530/EJE-08-0896 . PMID 19073833.
- ^ Weitzner MA, Kanfer S, Booth-Jones M (2005). "Apatía y enfermedad pituitaria: no tiene nada que ver con la depresión". Revista de neuropsiquiatría y neurociencias clínicas . 17 (2): 159–166. doi :10.1176/appi.neuropsych.17.2.159. PMID 15939968.
- ^ "Acromegalia y gigantismo". Merck.com . Consultado el 26 de octubre de 2010 .
- ^ Nabarro JD (abril de 1987). "Acromegalia". Endocrinología clínica . 26 (4): 481–512. doi : 10.1111/j.1365-2265.1987.tb00805.x . PMID 3308190. S2CID 221550204.
- ^ Síndrome de Cushing Archivado el 10 de abril de 2011 en Wayback Machine en The National Endocrine and Metabolic Diseases Information Service. Julio de 2008. Citando a su vez a: Nieman LK, Ilias I (diciembre de 2005). "Evaluación y tratamiento del síndrome de Cushing". The American Journal of Medicine . 118 (12): 1340–1346. doi :10.1016/j.amjmed.2005.01.059. PMID 16378774.
- ^ Kirk LF, Hash RB, Katner HP, Jones T (septiembre de 2000). "Enfermedad de Cushing: manifestaciones clínicas y evaluación diagnóstica". American Family Physician . 62 (5): 1119–27, 1133–4. PMID 10997535.
- ^ Biousse V, Newman NJ, Oyesiku NM (octubre de 2001). "Factores desencadenantes de la apoplejía hipofisaria". Revista de neurología, neurocirugía y psiquiatría . 71 (4): 542–545. doi :10.1136/jnnp.71.4.542. PMC 1763528 . PMID 11561045.
- ^ Maghnie M (2003). "Diabetes insípida". Investigación hormonal . 59 (Supl. 1): 42–54. doi :10.1159/000067844. PMID 12566720. S2CID 24638358.
- ^ Ganapathy MK, Tadi P (2022). "Anatomía, cabeza y cuello, glándula pituitaria". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE . UU . . PMID 31855373 . Consultado el 26 de junio de 2021 .
- ^ Newey PJ, Thakker RV (2011). "Papel del análisis mutacional de neoplasia endocrina múltiple tipo 1 en la práctica clínica". Endocrine Practice . 17 (Supl 3): 8–17. doi :10.4158/EP10379.RA. PMID 21454234.
- ^ Marini F, Falchetti A, Luzi E, Tonelli F, Maria Luisa B (2009). "Síndrome de neoplasia endocrina múltiple tipo 1 (MEN1)". En Riegert-Johnson DL (ed.). Síndromes de cáncer . Centro Nacional de Información Biotecnológica (EE. UU.). PMID 21249756.
- ^ Síndrome de Carney en eMedicine
- ^ Carney JA, Gordon H, Carpenter PC, Shenoy BV, Go VL (julio de 1985). "El complejo de mixomas, pigmentación irregular e hiperactividad endocrina". Medicina . 64 (4): 270–283. doi : 10.1097/00005792-198507000-00007 . PMID 4010501. S2CID 20522398.
- ^ McCarthy PM, Piehler JM, Schaff HV, Pluth JR, Orszulak TA, Vidaillet HJ, et al. (marzo de 1986). "La importancia de los mixomas cardíacos múltiples, recurrentes y "complejos". The Journal of Thoracic and Cardiovascular Surgery . 91 (3): 389–396. doi : 10.1016/S0022-5223(19)36054-4 . PMID 3951243.
- ^ Reynen K (diciembre de 1995). "Mixomas cardíacos". The New England Journal of Medicine . 333 (24): 1610–1617. doi :10.1056/NEJM199512143332407. PMID 7477198.
- ^ Stergiopoulos SG, Abu-Asab MS, Tsokos M, Stratakis CA (2004). "Patología hipofisaria en pacientes con complejo de Carney". Pituitaria . 7 (2): 73–82. doi :10.1007/s11102-005-5348-y. PMC 2366887 . PMID 15761655.
- ^ Daly AF, Vanbellinghen JF, Beckers A (noviembre de 2007). "Características de los adenomas hipofisarios familiares aislados". Expert Review of Endocrinology & Metabolism . 2 (6): 725–733. doi :10.1586/17446651.2.6.725. PMID 30290472. S2CID 52924983.
- ^ ab Daly AF, Jaffrain-Rea ML, Ciccarelli A, Valdés-Socin H, Rohmer V, Tamburrano G, et al. (Septiembre de 2006). "Caracterización clínica de adenomas hipofisarios aislados familiares". La Revista de Endocrinología Clínica y Metabolismo . 91 (9): 3316–3323. doi : 10.1210/jc.2005-2671 . PMID 16787992.
- ^ Caimari F, Hernández-Ramírez LC, Dang MN, Gabrovska P, Iacovazzo D, Stals K, et al. (abril de 2018). "Sistema de categorías de riesgo para identificar pacientes con adenoma hipofisario con mutaciones de AIP". Journal of Medical Genetics . 55 (4): 254–260. doi :10.1136/jmedgenet-2017-104957. PMC 5869708 . PMID 29440248.
- ^ Valdes-Socin, Hernan y Poncin, J y Stevens, V y Stevenaert, Achille y Beckers, A. (2000). Adenomas hipofisarios familiares aislados no relacionados con mutaciones de MEN1: seguimiento de 27 pacientes. Ann Endocrinol (París). 61.
- ^ ab Beckers A, Aaltonen LA, Daly AF, Karhu A (abril de 2013). "Adenomas hipofisarios aislados familiares (FIPA) y predisposición al adenoma hipofisario debido a mutaciones en el gen de la proteína que interactúa con el receptor de hidrocarburos arílicos (AIP)". Endocrine Reviews . 34 (2): 239–277. doi :10.1210/er.2012-1013. PMC 3610678 . PMID 23371967.
- ^ Daly AF, Vanbellinghen JF, Khoo SK, Jaffrain-Rea ML, Naves LA, Guitelman MA, et al. (mayo de 2007). "Mutaciones de genes de proteínas que interactúan con el receptor de hidrocarburos arílicos en adenomas hipofisarios aislados familiares: análisis en 73 familias". The Journal of Clinical Endocrinology and Metabolism . 92 (5): 1891–1896. doi : 10.1210/jc.2006-2513 . PMID 17244780.
- ^ abcd Trivellin G, Daly AF, Faucz FR, Yuan B, Rostomyan L, Larco DO, et al. (diciembre de 2014). "Gigantismo y acromegalia debido a microduplicaciones de Xq26 y mutación GPR101". The New England Journal of Medicine . 371 (25): 2363–2374. doi :10.1056/nejmoa1408028. PMC 4291174 . PMID 25470569.
- ^ Daly AF, Tichomirowa MA, Petrossians P, Heliövaara E, Jaffrain-Rea ML, Barlier A, et al. (noviembre de 2010). "Características clínicas y respuestas terapéuticas en pacientes con mutaciones de la línea germinal AIP y adenomas hipofisarios: un estudio colaborativo internacional". The Journal of Clinical Endocrinology and Metabolism . 95 (11): E373–E383. doi : 10.1210/jc.2009-2556 . PMID 20685857.
- ^ ab Rostomyan L, Daly AF, Petrossians P, Nachev E, Lila AR, Lecoq AL, et al. (octubre de 2015). "Caracterización clínica y genética del gigantismo hipofisario: un estudio colaborativo internacional en 208 pacientes". Cáncer relacionado con el sistema endocrino . 22 (5): 745–757. doi :10.1530/ERC-15-0320. PMC 6533620. PMID 26187128 .
- ^ ab Beckers A, Lodish MB, Trivellin G, Rostomyan L, Lee M, Faucz FR, et al. (junio de 2015). "Síndrome de acrogigantismo ligado al cromosoma X: perfil clínico y respuestas terapéuticas". Cáncer relacionado con el sistema endocrino . 22 (3): 353–367. doi :10.1530/ERC-15-0038. PMC 4433400. PMID 25712922 .
- ^ Beckers A, Rostomyan L, Potorac I, Beckers P, Daly AF (junio de 2017). "X-LAG: ¿Cómo crecieron tanto?". Annales d'Endocrinologie . 78 (2): 131–136. doi :10.1016/j.ando.2017.04.013. hdl : 2268/210037 . PMID 28457479.
- ^ Beckers A, Fernandes D, Fina F, Novak M, Abati A, Rostomyan L, et al. (febrero de 2017). "Estudio paleogenético del ADN antiguo que sugiere acrogigantismo ligado al cromosoma X". Cáncer relacionado con el sistema endocrino . 24 (2): L17–L20. doi : 10.1530/ERC-16-0558 . PMID: 28049632.
- ^ Daly AF, Yuan B, Fina F, Caberg JH, Trivellin G, Rostomyan L, et al. (abril de 2016). "El mosaicismo somático subyace al síndrome de acrogigantismo ligado al cromosoma X en sujetos masculinos esporádicos". Cáncer relacionado con el sistema endocrino . 23 (4): 221–233. doi :10.1530/ERC-16-0082. PMC 4877443. PMID 26935837 .
- ^ Druve
- ^ Whitehead SA, Nussey SS (2001). Endocrinología: un enfoque integrado . Oxford: BIOS Scientific Publishers. ISBN 978-0-203-45043-7.[ página necesaria ]
- ^ Zhao Y, Mailloux CM, Hermesz E, Palkóvits M, Westphal H (enero de 2010). "Un papel del gen LIM-homeobox Lhx2 en la regulación del desarrollo hipofisario". Biología del desarrollo . 337 (2): 313–323. doi :10.1016/j.ydbio.2009.11.002. PMC 2832476 . PMID 19900438.
- ^ Saini KS, Patel AL, Shaikh WA, Magar LN, Pungaonkar SA (agosto de 2007). "Espectroscopia de resonancia magnética en tuberculoma hipofisario" (PDF) . Revista médica de Singapur . 48 (8): 783–786. PMID 17657390.
- ^ Dai C, Kang J, Liu X, Yao Y, Wang H, Wang R (17 de marzo de 2021). "Cómo clasificar y definir los tumores hipofisarios: avances recientes y controversias actuales". Frontiers in Endocrinology . 12 : 604644. doi : 10.3389/fendo.2021.604644 . PMC 8010908 . PMID 33815274.
- ^ Ostrom QT, Cioffi G, Waite K, Kruchko C, Barnholtz-Sloan JS (octubre de 2021). "Informe estadístico de CBTRUS: tumores cerebrales primarios y otros tumores del sistema nervioso central diagnosticados en los Estados Unidos en 2014-2018". Neuro-Oncology . 23 (12 Suppl 2): iii1–iii105. doi :10.1093/neuonc/noab200. PMC 8491279 . PMID 34608945.
- ^ "Tumor cerebral benigno (no canceroso)". nhs.uk . 20 de octubre de 2017 . Consultado el 12 de agosto de 2024 .
- ^ appeal.admin (18 de noviembre de 2020). «Tumor hipofisario vs. tumor cerebral». Fundación Pituitaria . Consultado el 12 de agosto de 2024 .
- ^ ab Ironside JW (agosto de 2003). "Mejores prácticas n.° 172: patología de la glándula pituitaria". Revista de patología clínica . 56 (8): 561–568. doi :10.1136/jcp.56.8.561. PMC 1770019 . PMID 12890801.
- ^ Asa SL, Ezzat S (diciembre de 1998). "La citogénesis y patogénesis de los adenomas hipofisarios". Endocrine Reviews . 19 (6): 798–827. doi : 10.1210/edrv.19.6.0350 . PMID 9861546. S2CID 32722411.
- ^ Scanarini M, Mingrino S (1980). "Clasificación funcional de los adenomas hipofisarios". Acta Neurochirurgica . 52 (3–4): 195–202. doi :10.1007/BF01402074. PMID 7424602. S2CID 8095432.
- ^ abcde Drummond J, Roncaroli F, Grossman AB, Korbonits M (julio de 2019). "Aspectos clínicos y patológicos de los adenomas hipofisarios silenciosos". Revista de endocrinología clínica y metabolismo . 104 (7): 2473–2489. doi :10.1210/jc.2018-00688. PMC 6517166. PMID 30020466 .
- ^ abcde Reddy SS, Hamrahian AH (2009). "Trastornos hipofisarios y síndromes de neoplasia endocrina múltiple". En Stoller JK, Michota FA, Mandell BF (eds.). Revisión intensiva de medicina interna de la Fundación Clínica Cleveland . Hagerstwon, MD: Lippincott Williams & Wilkins. págs. 525–35. ISBN 978-0-7817-9079-6.
- ^ Chanson P, Weintraub BD, Harris AG (agosto de 1993). "Terapia con octreotida para adenomas hipofisarios secretores de hormona estimulante de la tiroides. Seguimiento de 52 pacientes". Anales de Medicina Interna . 119 (3): 236–240. doi :10.7326/0003-4819-119-3-199308010-00010. PMID 8323093. S2CID 27660512.
- ^ Drummond J, Roncaroli F, Grossman AB, Korbonits M (julio de 2019). "Aspectos clínicos y patológicos de los adenomas hipofisarios silenciosos". Revista de endocrinología clínica y metabolismo . 104 (7): 2473–2489. doi :10.1210/jc.2018-00688. PMC 6517166. PMID 30020466 .
- "Este artículo ha sido publicado bajo los términos de la Licencia Creative Commons Atribución (CC BY; https://creativecommons.org/licenses/by/4.0/)" - ^ Freda PU, Beckers AM, Katznelson L, Molitch ME, Montori VM, Post KD, et al. (abril de 2011). "Incidealoma hipofisario: una guía de práctica clínica de la sociedad endocrina". Revista de endocrinología clínica y metabolismo . 96 (4): 894–904. doi :10.1210/jc.2010-1048. PMC 5393422. PMID 21474686 .
- ^ Thompson LD, Seethala RR, Müller S (marzo de 2012). "Adenoma hipofisario ectópico del seno esfenoidal (ESSPA) con glándula pituitaria anterior normal: un estudio clinicopatológico e inmunofenotípico de 32 casos con una revisión exhaustiva de la literatura inglesa". Patología de cabeza y cuello . 6 (1): 75–100. doi :10.1007/s12105-012-0336-9. PMC 3311955 . PMID 22430769.
- ^ Leon Barnes: Patología y genética de los tumores de cabeza y cuello; pág. 100: Organización Mundial de la Salud; (2005) ISBN 92-832-2417-5
- ^ Weil RJ (diciembre de 2002). "Metástasis hipofisaria". Archivos de neurología . 59 (12): 1962–1963. doi :10.1001/archneur.59.12.1962. PMID 12470187.
- ^ Bret P, Jouvet A, Madarassy G, Guyotat J, Trouillas J (mayo de 2001). "Metástasis de cáncer visceral en adenoma hipofisario: informe de dos casos". Neurología quirúrgica . 55 (5): 284–290. doi :10.1016/S0090-3019(01)00447-5. PMID 11516470.
- ^ Morita A, Meyer FB, Laws ER (julio de 1998). "Metástasis hipofisarias sintomáticas". Revista de neurocirugía . 89 (1): 69–73. doi :10.3171/jns.1998.89.1.0069. PMID 9647174.
- ^ Daniel R. Fassett, MD; William T. Couldwell, MD , PhD; Medscape : Metástasis en la glándula pituitaria [1]
- ^ Komninos J, Vlassopoulou V, Protopapa D, Korfias S, Kontogeorgos G, Sakas DE, et al. (febrero de 2004). "Tumores metastásicos en la glándula pituitaria: informe de caso y revisión de la literatura". The Journal of Clinical Endocrinology and Metabolism . 89 (2): 574–580. doi : 10.1210/jc.2003-030395 . PMID 14764764.
- ^ abcdefghijklm Tritos NA, Miller KK (abril de 2023). "Diagnóstico y tratamiento de los adenomas hipofisarios: una revisión". JAMA . 329 (16): 1386–1398. doi :10.1001/jama.2023.5444. PMID 37097352. S2CID 258310567.
- ^ Neggers SJ, Muhammad A, van der Lely AJ (2016). "Tratamiento con pegvisomant en la acromegalia". Neuroendocrinología . 103 (1): 59–65. doi : 10.1159/000381644 . PMID 25792221. S2CID 19588354.
- ^ Preguntas frecuentes sobre cirugía transesfenoidal Neuroendocrine Clinical Center, Massachusetts General Hospital/Harvard Medical School. Consultado el 25 de noviembre de 2016
Enlaces externos
- Cancer.gov: tumores hipofisarios
_GH_production.jpg/440px-Pituitary_adenoma_(2)_GH_production.jpg)

![Los adenomas de células nulas verdaderos suelen estar compuestos por células uniformes, levemente atípicas, con citoplasma cromófobo. Este caso tiene una arquitectura papilar similar a la de los adenomas gonadotropos.[59]](http://upload.wikimedia.org/wikipedia/commons/thumb/4/40/Histopathology_of_a_true_null_cell_adenoma.jpg/440px-Histopathology_of_a_true_null_cell_adenoma.jpg)
