Carbonato de calcio
 | |
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC Carbonato de calcio | |
| Otros nombres | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| EBICh | |
| Química biológica | |
| Araña química | |
| Banco de medicamentos |
|
| Tarjeta informativa de la ECHA | 100.006.765 |
| Número CE |
|
| Número E | E170 (colores) |
| BARRIL | |
Identificador de centro de PubChem |
|
| Número RTECS |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| CaCO3 | |
| Masa molar | 100,0869 g/mol |
| Apariencia | Polvo blanco fino o cristales incoloros; sabor a tiza. |
| Olor | inodoro |
| Densidad | 2,711 g/cm 3 ( calcita ) 2,83 g/cm 3 ( aragonito ) |
| Punto de fusión | 1.339 °C (2.442 °F; 1.612 K) (calcita) 825 °C (1.517 °F; 1.098 K) (aragonito) [4] [5] |
| Punto de ebullición | se descompone |
| 0,013 g/L (25 °C) [1] [2] | |
Producto de solubilidad ( K sp ) | 3,3 × 10 −9 [3] |
| Solubilidad en ácidos diluidos | soluble |
| Acidez (p K a ) | 9.0 |
| −3,82 × 10 −5 cm3 / mol | |
Índice de refracción ( n D ) | 1,59 |
| Estructura | |
| Trigonal | |
| 3 2/m | |
| Termoquímica | |
Entropía molar estándar ( S ⦵ 298 ) | 93 J/(mol·K) [6] |
Entalpía estándar de formación (Δ f H ⦵ 298 ) | −1207 kJ/mol [6] |
| Farmacología | |
| A02AC01 ( OMS ) A12AA04 ( OMS ) | |
| Peligros | |
| NFPA 704 (rombo cortafuegos) | |
| Dosis o concentración letal (LD, LC): | |
LD 50 ( dosis media ) | 6450 mg/kg (oral, rata) |
| NIOSH (límites de exposición a la salud en EE. UU.): | |
PEL (Permisible) | TWA 15 mg/m3 ( total) TWA 5 mg/m3 ( resp.) [7] |
| Ficha de datos de seguridad (FDS) | ICSC 1193 |
| Compuestos relacionados | |
Otros aniones | Bicarbonato de calcio |
Otros cationes | |
Compuestos relacionados | Sulfato de calcio |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |

El carbonato de calcio es un compuesto químico con la fórmula química CaCO3 . Es una sustancia común que se encuentra en rocas como los minerales calcita y aragonito , más notablemente en tiza y piedra caliza , cáscaras de huevo , conchas de gasterópodos , esqueletos de mariscos y perlas . Los materiales que contienen mucho carbonato de calcio o que se le parecen se describen como calcáreos . El carbonato de calcio es el ingrediente activo de la cal agrícola y se produce cuando los iones de calcio en agua dura reaccionan con los iones de carbonato para formar cal . Tiene uso médico como suplemento de calcio o como antiácido , pero el consumo excesivo puede ser peligroso y causar hipercalcemia y problemas digestivos. [8]
Química
El carbonato de calcio comparte las propiedades típicas de otros carbonatos . En particular,
- reacciona con los ácidos , liberando ácido carbónico que rápidamente se desintegra en dióxido de carbono y agua :
- CaCO3 (s) + 2 H + (ac) → Ca2 + ( ac) + CO2 ( g) + H2O ( l)
- libera dióxido de carbono al calentarse, lo que se denomina reacción de descomposición térmica , o calcinación (a más de 840 °C en el caso del CaCO 3 ), para formar óxido de calcio , CaO, comúnmente llamado cal viva , con una entalpía de reacción de 178 kJ/mol:
- CaCO 3 (s) → CaO (s) + CO 2 (g)
- Reacciona con hidrógeno gaseoso para formar metano y vapor de agua, además de óxido de calcio sólido o hidróxido de calcio, según la temperatura y la composición del gas producido. Varios metales, incluidos el paladio y el níquel, son catalizadores de la reacción.
El carbonato de calcio reacciona con agua saturada con dióxido de carbono para formar bicarbonato de calcio soluble .
- CaCO3 (s) + CO2 ( g ) + H2O (l) → Ca(HCO3 ) 2 ( ac)
Esta reacción es importante en la erosión de la roca carbonatada , formando cavernas y dando lugar a agua dura en muchas regiones.
Una forma inusual de carbonato de calcio es el hexahidrato de ikaita , CaCO3 ·6H2O . La ikaita es estable sólo por debajo de los 8 °C.
Preparación
La gran mayoría del carbonato de calcio que se utiliza en la industria se extrae mediante minería o canteras. El carbonato de calcio puro (por ejemplo, para uso alimentario o farmacéutico) se puede producir a partir de una fuente pura extraída de una cantera (normalmente mármol ).
Alternativamente, el carbonato de calcio se prepara a partir de óxido de calcio . Se agrega agua para obtener hidróxido de calcio y luego se hace pasar dióxido de carbono a través de esta solución para precipitar el carbonato de calcio deseado, al que en la industria se denomina carbonato de calcio precipitado (PCC). Este proceso se denomina carbonatación : [9]
- CaO + H2O → Ca(OH) 2
- Ca(OH) 2 + CO 2 → CaCO 3 + H 2 O
En un laboratorio, el carbonato de calcio se puede cristalizar fácilmente a partir de cloruro de calcio ( CaCl 2 ), colocando una solución acuosa de CaCl 2 en un desecador junto con carbonato de amonio [NH 4 ] 2 CO 3 . [10] En el desecador, el carbonato de amonio se expone al aire y se descompone en amoníaco , dióxido de carbono y agua . Luego, el dióxido de carbono se difunde en la solución acuosa de cloruro de calcio, reacciona con los iones de calcio y el agua y forma carbonato de calcio.
Estructura
La forma termodinámicamente estable de CaCO 3 en condiciones normales es hexagonal β- CaCO 3 (el mineral calcita ). Se pueden preparar otras formas, la ortorrómbica λ- CaCO 3 más densa (2,83 g/cm 3 ) (el mineral aragonito ) y la hexagonal μ- CaCO 3 , que se presenta como el mineral vaterita . La forma aragonito se puede preparar por precipitación a temperaturas superiores a 85 °C; la forma vaterita se puede preparar por precipitación a 60 °C. La calcita contiene átomos de calcio coordinados por seis átomos de oxígeno; en el aragonito están coordinados por nueve átomos de oxígeno. [ cita requerida ] La estructura de la vaterita no se entiende completamente. [11] El carbonato de magnesio ( MgCO 3 ) tiene la estructura de calcita, mientras que el carbonato de estroncio ( SrCO 3 ) y el carbonato de bario ( BaCO 3 ) adoptan la estructura de aragonito, lo que refleja sus radios iónicos más grandes . [ cita requerida ]
Polimorfos
El carbonato de calcio cristaliza en tres polimorfos anhidros , [12] [13] de los cuales la calcita es el termodinámicamente más estable a temperatura ambiente, la aragonita es solo ligeramente menos estable y la vaterita es la menos estable. [14]
Estructura cristalina
La estructura cristalina de la calcita es trigonal , con grupo espacial R 3 c (No. 167 en las Tablas Internacionales de Cristalografía [15] ), y símbolo de Pearson hR10. [16] La aragonita es ortorrómbica , con grupo espacial Pmcn (No. 62), y símbolo de Pearson oP20. [17] La vaterita se compone de al menos dos estructuras cristalográficas coexistentes diferentes. La estructura principal exhibe simetría hexagonal en el grupo espacial P6 3 /mmc, la estructura menor aún es desconocida. [18]
Cristalización

Los tres polimorfos cristalizan simultáneamente a partir de soluciones acuosas en condiciones ambientales. [14] En soluciones acuosas sin aditivos, la calcita se forma fácilmente como producto principal, mientras que la aragonita aparece solo como producto menor.
En condiciones de alta saturación, la vaterita es típicamente la primera fase precipitada, seguida de una transformación de la vaterita en calcita. [19] Este comportamiento parece seguir la regla de Ostwald , en la que el polimorfo menos estable cristaliza primero, seguido de la cristalización de diferentes polimorfos a través de una secuencia de fases cada vez más estables. [20] Sin embargo, la aragonita, cuya estabilidad se encuentra entre las de la vaterita y la calcita, parece ser la excepción a esta regla, ya que la aragonita no se forma como precursora de la calcita en condiciones ambientales. [14]

La aragonita se produce en su mayor parte cuando las condiciones de reacción inhiben la formación de calcita y/o promueven la nucleación de la aragonita. Por ejemplo, la formación de aragonita se promueve mediante la presencia de iones de magnesio, [21] o mediante el uso de proteínas y péptidos derivados del carbonato de calcio biológico. [22] Se ha demostrado que algunas poliaminas como la cadaverina y la poli(etilenimina) facilitan la formación de aragonita sobre calcita. [14]
Selección por organismos
Los organismos, como los moluscos y los artrópodos , han demostrado la capacidad de desarrollar los tres polimorfos cristalinos del carbonato de calcio, principalmente como protección (caparazones) y como fijación muscular. [23] Además, exhiben una notable capacidad de selección de fase sobre la calcita y la aragonita, y algunos organismos pueden cambiar entre los dos polimorfos. La capacidad de selección de fase suele atribuirse al uso de macromoléculas específicas o combinaciones de macromoléculas por parte de dichos organismos. [24] [25] [26]
Aparición

Fuentes geológicas
La calcita , la aragonita y la vaterita son minerales de carbonato de calcio puro. Entre las rocas madre de importancia industrial que contienen predominantemente carbonato de calcio se encuentran la piedra caliza , la tiza , el mármol y el travertino .
Fuentes biológicas

Las cáscaras de huevo , las conchas de caracol y la mayoría de las conchas marinas son predominantemente carbonato de calcio y pueden usarse como fuentes industriales de ese químico. [28] Las conchas de ostras han gozado de un reconocimiento reciente como fuente de calcio dietético, pero también son una fuente industrial práctica. [29] [30] Las verduras de color verde oscuro como el brócoli y la col rizada contienen cantidades dietéticamente significativas de carbonato de calcio, pero no son prácticas como fuente industrial. [31]
Los anélidos de la familia Lumbricidae , las lombrices de tierra, poseen una regionalización del tracto digestivo llamada glándulas calcíferas, Kalkdrüsen, o glandes de Morren, que procesan el calcio y el CO2 en carbonato de calcio, que luego se excreta en la tierra. [32] La función de estas glándulas es desconocida, pero se cree que sirven como un mecanismo de regulación del CO2 dentro de los tejidos de los animales. [33] Este proceso es ecológicamente significativo, ya que estabiliza el pH de los suelos ácidos . [34]
Extraterrestre
Más allá de la Tierra, hay pruebas sólidas que sugieren la presencia de carbonato de calcio en Marte . Se han detectado señales de carbonato de calcio en más de un lugar (en particular, en los cráteres Gusev y Huygens ). Esto proporciona cierta evidencia de la presencia de agua líquida en el pasado. [35] [36]
Geología

El carbonato se encuentra con frecuencia en entornos geológicos y constituye un enorme depósito de carbono . El carbonato de calcio se presenta en forma de aragonito , calcita y dolomita, que son componentes importantes del ciclo del calcio . Los minerales carbonatados forman los siguientes tipos de rocas: caliza , tiza , mármol , travertino , toba y otros.

En aguas tropicales cálidas y claras, los corales son más abundantes que en los polos, donde las aguas son frías. Los contribuyentes de carbonato de calcio, incluido el plancton (como los cocolitos y los foraminíferos planctónicos ), las algas coralinas , las esponjas , los braquiópodos , los equinodermos , los briozoos y los moluscos , se encuentran típicamente en entornos de aguas poco profundas donde la luz solar y el alimento filtrable son más abundantes. Los carbonatos de agua fría existen en latitudes más altas, pero tienen una tasa de crecimiento muy lenta. Los procesos de calcificación se modifican por la acidificación de los océanos .
Cuando la corteza oceánica se hunde bajo una placa continental, los sedimentos se desplazan hacia zonas más cálidas de la astenosfera y la litosfera . En estas condiciones, el carbonato de calcio se descompone para producir dióxido de carbono que, junto con otros gases, da lugar a erupciones volcánicas explosivas .
Profundidad de compensación de carbonato
La profundidad de compensación de carbonato (CCD) es el punto en el océano donde la tasa de precipitación de carbonato de calcio se equilibra con la tasa de disolución debido a las condiciones presentes. En las profundidades del océano, la temperatura desciende y la presión aumenta. El aumento de la presión también aumenta la solubilidad del carbonato de calcio. El carbonato de calcio es inusual en el sentido de que su solubilidad aumenta con la disminución de la temperatura. [37] La profundidad de compensación de carbonato varía de 4.000 a 6.000 metros por debajo del nivel del mar en los océanos modernos, y los diversos polimorfos (calcita, aragonito) tienen diferentes profundidades de compensación en función de su estabilidad. [38]
Papel en la tafonomía
El carbonato de calcio puede preservar fósiles mediante permineralización . La mayoría de los fósiles de vertebrados de la Formación Two Medicine —una formación geológica conocida por sus huevos de dinosaurio con pico de pato— se conservan mediante permineralización con CaCO3 . [39] Este tipo de conservación conserva altos niveles de detalle, incluso hasta el nivel microscópico. Sin embargo, también deja a los especímenes vulnerables a la erosión cuando se exponen a la superficie. [39]
Se creía que las poblaciones de trilobites constituían la mayor parte de la vida acuática durante el Cámbrico , debido a que sus caparazones ricos en carbonato de calcio se conservaban más fácilmente que los de otras especies, [40] que tenían caparazones puramente quitinosos .
Usos
Construcción
El carbonato de calcio se utiliza principalmente en la industria de la construcción, ya sea como material de construcción, como agregado de piedra caliza para la construcción de carreteras, como ingrediente del cemento o como materia prima para la preparación de cal de construcción mediante su quema en un horno . Sin embargo, debido a la erosión causada principalmente por la lluvia ácida , [41] el carbonato de calcio (en forma de piedra caliza) ya no se utiliza para fines de construcción por sí solo, sino solo como materia prima primaria para materiales de construcción.
El carbonato de calcio también se utiliza en la purificación del hierro a partir del mineral de hierro en un alto horno . El carbonato se calcina in situ para dar óxido de calcio , que forma una escoria con diversas impurezas presentes y se separa del hierro purificado. [42]
En la industria petrolera , el carbonato de calcio se añade a los fluidos de perforación como agente de sellado de tortas de filtración y puenteo de formaciones; también es un material densificante que aumenta la densidad de los fluidos de perforación para controlar la presión en el fondo del pozo. El carbonato de calcio se añade a las piscinas como corrector de pH para mantener la alcalinidad y compensar las propiedades ácidas del agente desinfectante . [43]
También se utiliza como materia prima en la refinación del azúcar de remolacha azucarera ; se calcina en un horno con antracita para producir óxido de calcio y dióxido de carbono. Esta cal quemada se apaga luego en agua dulce para producir una suspensión de hidróxido de calcio para la precipitación de impurezas en el jugo crudo durante la carbonatación . [44]
El carbonato de calcio en forma de tiza ha sido tradicionalmente un componente importante de la tiza para pizarra . Sin embargo, la tiza fabricada moderna es principalmente yeso , sulfato de calcio hidratado CaSO4 ·2H2O . El carbonato de calcio es una fuente principal para el crecimiento de biorock . El carbonato de calcio precipitado (PCC), predispersado en forma de suspensión , es un material de relleno común para guantes de látex con el objetivo de lograr el máximo ahorro en materiales y costos de producción. [45]
El carbonato de calcio molido fino (GCC) es un ingrediente esencial en la película microporosa utilizada en pañales y algunas películas de construcción, ya que los poros se nuclean alrededor de las partículas de carbonato de calcio durante la fabricación de la película mediante estiramiento biaxial. El GCC y el PCC se utilizan como relleno en papel porque son más baratos que la fibra de madera . El papel de impresión y escritura puede contener entre un 10 y un 20 % de carbonato de calcio. En América del Norte, el carbonato de calcio ha comenzado a reemplazar al caolín en la producción de papel brillante . Europa ha estado practicando esto como fabricación de papel alcalino o fabricación de papel sin ácido durante algunas décadas. El PCC utilizado para el relleno de papel y los recubrimientos de papel se precipita y se prepara en una variedad de formas y tamaños que tienen distribuciones de tamaño de partícula estrechas características y diámetros esféricos equivalentes de 0,4 a 3 micrómetros. [ cita requerida ]
El carbonato de calcio se utiliza ampliamente como extensor en pinturas , [46] en particular pintura de emulsión mate donde típicamente el 30% en peso de la pintura es tiza o mármol. También es un relleno popular en plásticos. [46] Algunos ejemplos típicos incluyen alrededor del 15-20% de carga de tiza en tuberías de drenaje de cloruro de polivinilo no plastificado (uPVC) , 5-15% de carga de tiza o mármol recubierto de estearato en perfil de ventana de uPVC. Los cables de PVC pueden usar carbonato de calcio en cargas de hasta 70 phr (partes por cien partes de resina) para mejorar las propiedades mecánicas (resistencia a la tracción y alargamiento) y las propiedades eléctricas (resistividad volumétrica). [ cita requerida ] Los compuestos de polipropileno a menudo se rellenan con carbonato de calcio para aumentar la rigidez, un requisito que se vuelve importante a altas temperaturas de uso. [47] Aquí el porcentaje es a menudo del 20 al 40%. También se utiliza rutinariamente como relleno en resinas termoendurecibles (compuestos de moldeo en láminas y a granel) [47] y también se ha mezclado con ABS y otros ingredientes para formar algunos tipos de fichas de póquer de "arcilla" moldeadas por compresión . [48] El carbonato de calcio precipitado, elaborado al dejar caer óxido de calcio en agua, se utiliza solo o con aditivos como pintura blanca, conocida como blanqueado . [49] [50]
El carbonato de calcio se añade a una amplia gama de adhesivos, selladores y rellenos decorativos para uso comercial y doméstico . [46] Los adhesivos para baldosas cerámicas suelen contener entre un 70% y un 80% de piedra caliza. Los rellenos decorativos para grietas contienen niveles similares de mármol o dolomita. También se mezcla con masilla para colocar vidrieras y como capa protectora para evitar que el vidrio se adhiera a los estantes del horno cuando se cuecen esmaltes y pinturas a alta temperatura. [51] [52] [53] [54]
En las aplicaciones de esmalte cerámico , el carbonato de calcio se conoce como blanqueador , [46] y es un ingrediente común para muchos esmaltes en su forma de polvo blanco. Cuando un esmalte que contiene este material se cuece en un horno, el blanqueador actúa como un material fundente en el esmalte. El carbonato de calcio molido es un abrasivo (tanto como polvo limpiador como ingrediente de cremas limpiadoras domésticas), en particular en su forma de calcita, que tiene un nivel de dureza relativamente bajo de 3 en la escala de Mohs , y por lo tanto no rayará el vidrio y la mayoría de las demás cerámicas , esmalte , bronce , hierro y acero , y tiene un efecto moderado en metales más blandos como el aluminio y el cobre . Se puede utilizar una pasta hecha de carbonato de calcio y agua desionizada para limpiar el deslustre de la plata . [55]
Salud y dieta

El carbonato de calcio se utiliza ampliamente con fines medicinales como un suplemento dietético de calcio económico para los antiácidos gástricos [56] (como Tums y Eno ). Se puede utilizar como un aglutinante de fosfato para el tratamiento de la hiperfosfatemia (principalmente en pacientes con insuficiencia renal crónica ). Se utiliza en la industria farmacéutica como un relleno inerte para comprimidos y otros productos farmacéuticos . [57]
El carbonato de calcio se utiliza en la producción de óxido de calcio, así como de pasta de dientes, y ha experimentado un resurgimiento como conservante de alimentos y retenedor de color, cuando se utiliza en o con productos como manzanas orgánicas. [58]
El carbonato de calcio se utiliza terapéuticamente como quelante de fosfato en pacientes en hemodiálisis de mantenimiento . Es la forma más común de quelante de fosfato que se prescribe, en particular en la enfermedad renal crónica no relacionada con diálisis. El carbonato de calcio es el quelante de fosfato más comúnmente utilizado, pero los médicos prescriben cada vez más quelantes de fosfato no basados en calcio, más costosos, en particular el sevelámero .
El exceso de calcio proveniente de suplementos, alimentos fortificados y dietas ricas en calcio puede causar el síndrome de leche y alcalinos , que tiene una toxicidad grave y puede ser fatal. En 1915, Bertram Sippy introdujo el "régimen Sippy" de ingestión de leche y crema cada hora, y la adición gradual de huevos y cereales cocidos, durante 10 días, combinados con polvos alcalinos, que proporcionó alivio sintomático para la enfermedad de úlcera péptica. Durante las siguientes décadas, el régimen Sippy resultó en insuficiencia renal , alcalosis e hipercalcemia , principalmente en hombres con enfermedad de úlcera péptica. Estos efectos adversos se revirtieron cuando se interrumpió el régimen, pero fue fatal en algunos pacientes con vómitos prolongados. El síndrome de leche y alcalinos disminuyó en los hombres después de que surgieron tratamientos efectivos para la enfermedad de úlcera péptica . Desde la década de 1990, se ha informado con mayor frecuencia en mujeres que toman suplementos de calcio por encima del rango recomendado de 1,2 a 1,5 gramos diarios, para la prevención y el tratamiento de la osteoporosis, [59] [60] y se ve exacerbada por la deshidratación . Se ha añadido calcio a productos de venta libre, lo que contribuye a una ingesta excesiva inadvertida. La ingesta excesiva de calcio puede provocar hipercalcemia, cuyas complicaciones incluyen vómitos, dolor abdominal y alteración del estado mental. [61]
Como aditivo alimentario se le designa E170 , [62] y tiene un número INS de 170. Utilizado como regulador de acidez , agente antiaglomerante , estabilizador o colorante, está aprobado para su uso en la UE, [63] EE. UU. [64] y Australia y Nueva Zelanda . [65] Se "añade por ley a toda la harina de pan molida del Reino Unido, excepto la integral". [66] [67] Se utiliza en algunos productos de leche de soja y leche de almendras como fuente de calcio dietético; al menos un estudio sugiere que el carbonato de calcio podría ser tan biodisponible como el calcio de la leche de vaca . [68] El carbonato de calcio también se utiliza como agente reafirmante en muchos productos vegetales enlatados y embotellados.
Se ha documentado que varias formulaciones de suplementos de calcio contienen el elemento químico plomo , [69] lo que plantea un problema de salud pública . [70] El plomo se encuentra comúnmente en fuentes naturales de calcio. [69]
Agricultura y acuicultura
La cal agrícola , tiza en polvo o piedra caliza, se utiliza como un método barato para neutralizar el suelo ácido , lo que la hace adecuada para la siembra, también se utiliza en la industria de la acuicultura para regular el pH del suelo del estanque antes de iniciar el cultivo. [71] Existe interés en comprender si puede o no afectar la adsorción y desorción de pesticidas en suelo calcáreo. [72]
Limpieza del hogar
El carbonato de calcio es un ingrediente clave en muchos polvos de limpieza domésticos como Comet y se utiliza como agente limpiador.
Mitigación de la contaminación
En 1989, un investigador, Ken Simmons, introdujo CaCO3 en el arroyo Whetstone en Massachusetts . [73] Su esperanza era que el carbonato de calcio contrarrestara el ácido del arroyo causado por la lluvia ácida y salvara a las truchas que habían dejado de desovar. Aunque su experimento fue un éxito, sí aumentó la cantidad de iones de aluminio en el área del arroyo que no fue tratada con la piedra caliza. Esto demuestra que se puede agregar CaCO3 para neutralizar los efectos de la lluvia ácida en los ecosistemas fluviales . Actualmente, el carbonato de calcio se utiliza para neutralizar las condiciones ácidas tanto en el suelo como en el agua. [74] [75] [76] Desde la década de 1970, este tipo de encalado se ha practicado a gran escala en Suecia para mitigar la acidificación y varios miles de lagos y arroyos se encalan repetidamente. [77]
El carbonato de calcio también se utiliza en aplicaciones de desulfuración de gases de combustión , eliminando las emisiones nocivas de SO2 y NO2 del carbón y otros combustibles fósiles quemados en grandes centrales eléctricas de combustibles fósiles. [74]
Plástica
El carbonato de calcio se utiliza habitualmente en la industria del plástico como relleno. Cuando se incorpora a un material plástico, puede mejorar la dureza, la rigidez, la estabilidad dimensional y la procesabilidad del material. [78]
Equilibrio de calcinación
La calcinación de piedra caliza mediante el uso de carbón vegetal para producir cal viva se ha practicado desde la antigüedad en culturas de todo el mundo. La temperatura a la que la piedra caliza produce óxido de calcio se suele indicar como 825 °C, pero indicar un umbral absoluto es engañoso. El carbonato de calcio existe en equilibrio con el óxido de calcio y el dióxido de carbono a cualquier temperatura. A cada temperatura hay una presión parcial de dióxido de carbono que está en equilibrio con el carbonato de calcio. A temperatura ambiente, el equilibrio favorece abrumadoramente al carbonato de calcio, porque la presión de equilibrio de CO2 es solo una pequeña fracción de la presión parcial de CO2 en el aire, que es de aproximadamente 0,035 kPa.
A temperaturas superiores a 550 °C, la presión de equilibrio del CO2 comienza a superar la presión del CO2 en el aire. Por lo tanto, por encima de 550 °C, el carbonato de calcio comienza a liberar CO2 en el aire. Sin embargo, en un horno alimentado con carbón, la concentración de CO2 será mucho mayor que en el aire. De hecho, si todo el oxígeno del horno se consume en el fuego, la presión parcial del CO2 en el horno puede llegar a ser de hasta 20 kPa. [ 79]
La tabla muestra que esta presión parcial no se alcanza hasta que la temperatura es cercana a los 800 °C. Para que la desgasificación de CO2 del carbonato de calcio se produzca a un ritmo económicamente útil, la presión de equilibrio debe superar significativamente la presión ambiental de CO2 . Y para que esto ocurra rápidamente, la presión de equilibrio debe superar la presión atmosférica total de 101 kPa, lo que ocurre a 898 °C.
Presión de equilibrio de CO 2 sobre CaCO 3 ( P ) versus temperatura ( T ). [80] P (kPa) 0,055 0,13 0,31 1,80 5.9 9.3 14 24 34 51 72 80 91 101 179 901 3961 Temperatura (°C) 550 587 605 680 727 748 777 800 830 852 871 881 891 898 937 1082 1241
Solubilidad
Con variacionesCO2presión

El carbonato de calcio es poco soluble en agua pura (47 mg/L a presión parcial de CO2 atmosférico normal, como se muestra a continuación).
El equilibrio de su solución viene dado por la ecuación (con carbonato de calcio disuelto a la derecha):
CaCO3 ⇌ Ca2 + + CO2−3 K sp =3,7 × 10 −9 a8,7 × 10 −9 a 25 °C
donde el producto de solubilidad para [Ca 2+ ][CO2−3] se da en cualquier valor entre K sp =3,7 × 10 −9 a K sp =8,7 × 10 −9 a 25 °C, dependiendo de la fuente de datos. [80] [81] Lo que significa la ecuación es que el producto de la concentración molar de iones de calcio ( moles de Ca 2+ disuelto por litro de solución) con la concentración molar de CO disuelto2−3no puede superar el valor de K sp . Sin embargo, esta ecuación de solubilidad aparentemente simple debe tomarse junto con el equilibrio más complicado del dióxido de carbono con agua (ver ácido carbónico ). Algunos de los CO2−3se combina con H + en la solución según
OHC−3⇌ H ++ CO2−3 K a2 =5,61 × 10 −11 a 25 °C
OHC−3Se le conoce como ion bicarbonato . El bicarbonato de calcio es mucho más soluble en agua que el carbonato de calcio; de hecho, solo existe en solución.
Algunas de las HCO−3se combina con H + en solución según
H2CO3 ⇌ H ++ HCO−3 K a1 =2,5 × 10 −4 a 25 °C
Parte del H 2 CO 3 se descompone en agua y dióxido de carbono disuelto según
H 2 O + CO 2 ( acuoso ) ⇌ H 2 CO 3 K h =1,70 × 10 −3 a 25 °C
Y el dióxido de carbono disuelto está en equilibrio con el dióxido de carbono atmosférico según
PCO2/[ CO2 ] = donde = 29,76 atm/(mol/L) a 25 °C ( volatilidad de Henry ), y P CO 2 es la presión parcial de CO 2 .
Para el aire ambiente, el P CO 2 es de alrededor de3,5 × 10 −4 atm (o equivalentemente 35 Pa ). La última ecuación anterior fija la concentración de CO 2 disuelto en función de P CO 2 , independientemente de la concentración de CaCO 3 disuelto . A presión parcial atmosférica de CO 2 , la concentración de CO 2 disuelto es1,2 × 10 −5 moles por litro. La ecuación anterior fija la concentración de H 2 CO 3 en función de la concentración de CO 2. Para [ CO 2 ] =1,2 × 10 −5 , resulta en [H 2 CO 3 ] =2,0 × 10 −8 moles por litro. Cuando se conoce [H 2 CO 3 ] , las tres ecuaciones restantes junto con
| PCO2 ( atmósferas ) | pH | [Ca 2+ ] (mol/L) |
|---|---|---|
| 10 −12 | 12.0 | 5,19 × 10 −3 |
| 10 −10 | 11.3 | 1,12 × 10 −3 |
| 10 −8 | 10.7 | 2,55 × 10 −4 |
| 10 −6 | 9.83 | 1,20 × 10 −4 |
| 10 −4 | 8.62 | 3,16 × 10 −4 |
| 3,5 × 10 −4 | 8.27 | 4,70 × 10 −4 |
| 10 −3 | 7,96 | 6,62 × 10 −4 |
| 10 −2 | 7.30 | 1,42 × 10 −3 |
| 10 −1 | 6.63 | 3,05 × 10 −3 |
| 1 | 5,96 | 6,58 × 10 −3 |
| 10 | 5.30 | 1,42 × 10 −2 |
H2O ⇌ H + + OH − K = 10 −14 a 25 °C
(lo cual es cierto para todas las soluciones acuosas), y la restricción de que la solución debe ser eléctricamente neutra, es decir, la carga total de iones positivos disueltos [Ca 2+ ] + 2 [H + ] debe ser cancelada por la carga total de iones negativos disueltos [HCO−3] + [CO2−3] + [OH − ] , permiten resolver simultáneamente las cinco concentraciones desconocidas restantes (la forma de neutralidad mencionada anteriormente es válida solo si el carbonato de calcio se ha puesto en contacto con agua pura o con una solución de pH neutro; en el caso en que el pH inicial del disolvente de agua no sea neutro, el equilibrio no es neutro).
La tabla adyacente muestra el resultado para [Ca 2+ ] y [H + ] (en forma de pH) en función de la presión parcial ambiental de CO 2 ( K sp =Para el cálculo se ha tomado 4,47 × 10 −9 ).
- A niveles atmosféricos de CO2 ambiental , la tabla indica que la solución será ligeramente alcalina con una solubilidad máxima en CaCO3 de 47 mg/L.
- A medida que la presión parcial de CO 2 ambiental se reduce por debajo de los niveles atmosféricos, la solución se vuelve cada vez más alcalina. A una P CO 2 extremadamente baja , el CO 2 disuelto , el ion bicarbonato y el ion carbonato se evaporan en gran medida de la solución, dejando una solución altamente alcalina de hidróxido de calcio , que es más soluble que el CaCO 3 . Para una P CO 2 = 10 −12 atm, el producto [Ca 2+ ][OH − ] 2 todavía está por debajo del producto de solubilidad de Ca(OH) 2 (8 × 10 −6 ). Para una presión de CO 2 aún más baja , la precipitación de Ca(OH) 2 ocurrirá antes que la precipitación de CaCO 3 .
- A medida que la presión parcial de CO2 ambiental aumenta a niveles superiores al atmosférico, el pH disminuye y gran parte del ion carbonato se convierte en ion bicarbonato, lo que da como resultado una mayor solubilidad del Ca2 + .
El efecto de este último es especialmente evidente en la vida cotidiana de las personas que tienen agua dura. El agua de los acuíferos subterráneos puede estar expuesta a niveles de CO2 mucho más altos que los atmosféricos. A medida que el agua se filtra a través de la roca de carbonato de calcio, el CaCO3 se disuelve de acuerdo con una de las tendencias anteriores. Cuando esa misma agua emerge del grifo, con el tiempo se equilibra con los niveles de CO2 en el aire al desgasificar su exceso de CO2 . Como resultado, el carbonato de calcio se vuelve menos soluble y el exceso precipita en forma de cal. Este mismo proceso es responsable de la formación de estalactitas y estalagmitas en cuevas de piedra caliza.
Dos fases hidratadas de carbonato de calcio, monohidrocalcita CaCO 3 ·H 2 O e ikaita CaCO 3 ·6H 2 O , pueden precipitar del agua en condiciones ambientales y persistir como fases metaestables.
Con variaciones de pH, temperatura y salinidad:CaCO3incrustaciones en piscinas
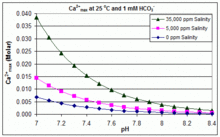
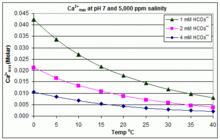
En contraste con el escenario de equilibrio abierto anterior, muchas piscinas se gestionan mediante la adición de bicarbonato de sodio ( NaHCO 3 ) a una concentración de aproximadamente 2 mmol/L como tampón, y luego se controla el pH mediante el uso de HCl, NaHSO 4 , Na 2 CO 3 , NaOH o formulaciones de cloro que son ácidas o básicas. En esta situación, el carbono inorgánico disuelto ( carbono inorgánico total ) está lejos del equilibrio con el CO 2 atmosférico . El progreso hacia el equilibrio a través de la desgasificación del CO 2 se ve ralentizado por
En esta situación, las constantes de disociación para las reacciones mucho más rápidas
- H2CO3 ⇌ H ++ HCO−3⇌ 2 H + + CO2−3
Permite predecir las concentraciones de cada especie de carbono inorgánico disuelto en solución, a partir de la concentración añadida de HCO−3(que constituye más del 90% de las especies de la parcela Bjerrum de pH 7 a pH 8 a 25 °C en agua dulce). [83] Adición de HCO−3aumentará el CO2−3concentración a cualquier pH. Reordenando las ecuaciones dadas anteriormente, podemos ver que [Ca 2+ ] = K- spp./[ CO2−3] , y [ CO2−3] = K a2 [ HCO3−3]/[ H + ] . Por lo tanto, cuando HCO−3Se conoce la concentración, la concentración máxima de iones Ca 2+ antes de escalar a través de la precipitación de CaCO 3 se puede predecir a partir de la fórmula:
- [ Ca 2+ ] máx = K- spp./K a2×[ H + ]/[ HCO2]−3]
El producto de solubilidad para CaCO3 ( K sp ) y las constantes de disociación para las especies de carbono inorgánico disuelto (incluyendo K a2 ) se ven sustancialmente afectados por la temperatura y la salinidad , [83] con el efecto general de que [ Ca 2+ ] max aumenta de agua dulce a agua salada, y disminuye con el aumento de la temperatura, el pH o el nivel de bicarbonato agregado, como se ilustra en los gráficos adjuntos.
Las tendencias son ilustrativas para la gestión de piscinas, pero la formación de incrustaciones también depende de otros factores, incluidas las interacciones con Mg 2+ , [B(OH) 4 ] − y otros iones en la piscina, así como los efectos de sobresaturación. [84] [85] La formación de incrustaciones se observa comúnmente en los generadores de cloro electrolítico, donde hay un pH alto cerca de la superficie del cátodo y la deposición de incrustaciones aumenta aún más la temperatura. Esta es una de las razones por las que algunos operadores de piscinas prefieren el borato en lugar del bicarbonato como principal tampón de pH y evitan el uso de productos químicos para piscinas que contengan calcio. [86]
Solubilidad en una solución de ácido fuerte o débil
Existen en el mercado soluciones de ácidos fuertes ( HCl ), moderadamente fuertes ( sulfámico ) o débiles ( acético , cítrico , sórbico , láctico , fosfórico ). Se utilizan habitualmente como agentes desincrustantes para eliminar los depósitos de cal . La cantidad máxima de CaCO3 que se puede "disolver" en un litro de solución ácida se puede calcular utilizando las ecuaciones de equilibrio anteriores.
- En el caso de un monoácido fuerte con concentración de ácido decreciente [A] = [ A − ], obtenemos (con masa molar de CaCO 3 = 100 g/mol):
[A] (mol/L) 1 10 −1 10 −2 10 −3 10 −4 10 −5 10 −6 10 −7 10 −10 pH inicial 0.00 1.00 2.00 3.00 4.00 5.00 6.00 6,79 7.00 pH final 6,75 7.25 7,75 8.14 8.25 8.26 8.26 8.26 8.27 CaCO3 disuelto ( g/L de ácido) 50.0 5.00 0,514 0,0849 0,0504 0,0474 0,0471 0,0470 0,0470
- donde el estado inicial es la solución ácida sin Ca 2+ (sin tener en cuenta la posible disolución de CO 2 ) y el estado final es la solución con Ca 2+ saturado . Para concentraciones de ácidos fuertes, todas las especies tienen una concentración despreciable en el estado final con respecto a Ca 2+ y A − de modo que la ecuación de neutralidad se reduce aproximadamente a 2[ Ca 2+ ] = [ A − ] produciendo [ Ca 2+ ] ≈ 0,5 [ A − ]. Cuando la concentración disminuye, [ HCO−3] se vuelve no despreciable, por lo que la expresión anterior ya no es válida. Para concentraciones de ácido que se desvanecen, se puede recuperar el pH final y la solubilidad del CaCO 3 en agua pura.
- En el caso de un monoácido débil (aquí tomamos ácido acético con p K a = 4,76) con concentración total de ácido decreciente [A] = [ A − ] + [AH], obtenemos:
[A] (mol/L) [ Ca 2+ ] ≈ 0,5 [ A − ] [ aclaración necesaria ] 10 −1 10 −2 10 −3 10 −4 10 −5 10 −6 10 −7 10 −10 pH inicial 2.38 2.88 3.39 3.91 4.47 5.15 6.02 6,79 7.00 pH final 6,75 7.25 7,75 8.14 8.25 8.26 8.26 8.26 8.27 CaCO3 disuelto ( g/L de ácido) 49,5 4,99 0,513 0,0848 0,0504 0,0474 0,0471 0,0470 0,0470
- Para una misma concentración total de ácido, el pH inicial del ácido débil es menos ácido que el del ácido fuerte; sin embargo, la cantidad máxima de CaCO 3 que se puede disolver es aproximadamente la misma. Esto se debe a que en el estado final, el pH es mayor que el p K a , de modo que el ácido débil se disocia casi por completo, dando lugar al final a tantos iones H + como el ácido fuerte para "disolver" el carbonato de calcio.
- El cálculo en el caso del ácido fosfórico (que es el más utilizado para aplicaciones domésticas) es más complicado ya que las concentraciones de los cuatro estados de disociación correspondientes a este ácido deben calcularse junto con [ HCO−3], [ CO2−3], [ Ca 2+ ], [ H + ] y [ OH − ]. El sistema puede reducirse a una ecuación de séptimo grado para [ H + ] cuya solución numérica da
[A] (mol/L) 1 10 −1 10 −2 10 −3 10 −4 10 −5 10 −6 10 −7 10 −10 pH inicial 1.08 1.62 2.25 3.05 4.01 5.00 5,97 6,74 7.00 pH final 6.71 7.17 7.63 8.06 8.24 8.26 8.26 8.26 8.27 CaCO3 disuelto ( g/L de ácido) 62.0 7.39 0,874 0,123 0,0536 0,0477 0,0471 0,0471 0,0470
- donde [A] = [H 3 PO 4 ] + [H 2 PO−4] + [HPO2−4] + [P.O.3−4] es la concentración total de ácido. Por lo tanto, el ácido fosfórico es más eficiente que un monoácido ya que en el pH final casi neutro, la segunda concentración del estado disociado [ HPO2−4] no es despreciable (véase ácido fosfórico ).
Véase también


Referencias
- ^ Aylward, Gordon; Findlay, Tristán (2008). Libro de datos químicos del SI (4ª ed.). John Wiley e hijos Australia. ISBN 978-0-470-81638-7.
- ^ Rohleder, J.; Kroker, E. (2001). Carbonato de calcio: desde el período Cretácico hasta el siglo XXI. Springer Science & Business Media. ISBN 978-3-7643-6425-0.
- ^ Benjamin, Mark M. (2002). Química del agua. McGraw-Hill. ISBN 978-0-07-238390-4.
- ^ "Directriz de seguridad y salud ocupacional para el carbonato de calcio" (PDF) . Departamento de Salud y Servicios Humanos de EE. UU. Archivado (PDF) desde el original el 30 de abril de 2011 . Consultado el 31 de marzo de 2011 .
- ^ "Copia archivada" (PDF) . Archivado desde el original (PDF) el 29 de octubre de 2018. Consultado el 29 de octubre de 2018 .
{{cite web}}: CS1 maint: copia archivada como título ( enlace ) - ^ de Zumdahl, Steven S. (2009). Principios químicos, sexta edición . Houghton Mifflin Company. pág. A21. ISBN 978-0-618-94690-7.
- ^ Guía de bolsillo del NIOSH sobre peligros químicos. "#0090". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ Strumińska-Parulska, DI (2015). "Determinación de 210 Po en suplementos de calcio y posible evaluación de la dosis relacionada para los consumidores". Revista de radioactividad ambiental . 150 : 121–125. doi :10.1016/j.jenvrad.2015.08.006. PMID 26318774.
- ^ "Carbonato de calcio precipitado". Archivado desde el original el 11 de enero de 2014 . Consultado el 11 de enero de 2014 .
- ^ Kim, Yi-Yeoun; Schenk, Anna S.; Ihli, Johannes; Kulak, Alex N.; Hetherington, Nicola BJ; Tang, Chiu C.; Schmahl, Wolfgang W.; Griesshaber, Erika; Hyett, Geoffrey; Meldrum, Fiona C. (septiembre de 2014). "Un análisis crítico de los mesocristales de carbonato de calcio". Nature Communications . 5 (1): 4341. Bibcode :2014NatCo...5.4341K. doi :10.1038/ncomms5341. ISSN 2041-1723. PMC 4104461 . PMID 25014563.
- ^ Demichelis, Raffaella; Raiteri, Paolo; Gale, Julian D.; Dovesi, Roberto (2013). "Las múltiples estructuras de la vaterita". Crecimiento y diseño de cristales . 13 (6): 2247–2251. doi :10.1021/cg4002972. ISSN 1528-7483.
- ^ Morse, John W.; Arvidson, Rolf S.; Lüttge, Andreas (1 de febrero de 2007). "Formación y disolución de carbonato de calcio". Chemical Reviews . 107 (2): 342–381. doi :10.1021/cr050358j. ISSN 0009-2665. PMID 17261071. Archivado desde el original el 1 de diciembre de 2022 . Consultado el 15 de diciembre de 2022 .
- ^ Géologue., Lippmann, Friedrich (1973). Minerales carbonatados sedimentarios . Saltador. ISBN 3-540-06011-1.OCLC 715109304 .
{{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ abcd Nahi, Ouassef; Kulak, Alexander N.; Zhang, Shuheng; He, Xuefeng; Aslam, Zabeada; Ilett, Martha A.; Ford, Ian J.; Darkins, Robert; Meldrum, Fiona C. (20 de noviembre de 2022). "Las poliaminas promueven la nucleación de aragonito y generan estructuras biomiméticas". Ciencia avanzada . 10 (1): 2203759. doi :10.1002/advs.202203759. ISSN 2198-3844. PMC 9811428 . PMID 36403251. S2CID 253707446.
- ^ Welberry, T. R, ed. (2006). Tablas internacionales para cristalografía . Chester, Inglaterra: Unión Internacional de Cristalografía. doi :10.1107/97809553602060000001. ISBN 978-0-7923-6590-7.OCLC 166325528.S2CID 146060934 .
- ^ Chessin, H.; Hamilton, WC; Post, B. (1 de abril de 1965). "Posición y parámetros térmicos de átomos de oxígeno en calcita". Acta Crystallographica . 18 (4): 689–693. Código Bibliográfico :1965AcCry..18..689C. doi :10.1107/S0365110X65001585. ISSN 0365-110X. Archivado desde el original el 15 de diciembre de 2022 . Consultado el 15 de diciembre de 2022 .
- ^ Negro, AD (1971). «Refinamiento de la estructura cristalina de la aragonita» (PDF) . American Mineralogist: Journal of Earth and Planetary Materials . 56 : 768–772. Archivado (PDF) del original el 15 de diciembre de 2022. Consultado el 15 de diciembre de 2022 a través de GeoScienceWorld.
- ^ Kabalah-Amitai, Lee; Mayzel, Boaz; Kauffmann, Yaron; Fitch, Andrew N.; Bloch, Leonid; Gilbert, Pupa UPA; Pokroy, Boaz (26 de abril de 2013). "Los cristales de vaterita contienen dos estructuras cristalinas intercaladas". Science . 340 (6131): 454–457. Bibcode :2013Sci...340..454K. doi :10.1126/science.1232139. ISSN 0036-8075. PMID 23620047. S2CID 206546317.
- ^ Bots, Pieter; Benning, Liane G.; Rodriguez-Blanco, Juan-Diego; Roncal-Herrero, Teresa; Shaw, Samuel (3 de julio de 2012). "Información mecanicista sobre la cristalización del carbonato de calcio amorfo (ACC)". Crystal Growth & Design . 12 (7): 3806–3814. doi :10.1021/cg300676b. ISSN 1528-7483. Archivado desde el original el 15 de diciembre de 2022 . Consultado el 15 de diciembre de 2022 .
- ^ Cardew, Peter T.; Davey, Roger J. (2 de octubre de 2019). "La relación de Ostwald, diagramas de fases cinéticas y mapas de polimorfos". Crecimiento y diseño de cristales . 19 (10): 5798–5810. doi :10.1021/acs.cgd.9b00815. ISSN 1528-7483. S2CID 202885778. Archivado desde el original el 15 de diciembre de 2022 . Consultado el 15 de diciembre de 2022 .
- ^ Zhang, Shuheng; Nahi, Ouassef; Chen, Li; Aslam, Zabeada; Kapur, Nikil; Kim, Yi-Yeoun; Meldrum, Fiona C. (junio de 2022). "Los iones de magnesio dirigen la transformación en estado sólido de películas delgadas de carbonato de calcio amorfo en aragonito, calcita de magnesio o dolomita". Materiales funcionales avanzados . 32 (25): 2201394. doi :10.1002/adfm.202201394. ISSN 1616-301X. S2CID 247587883. Archivado desde el original el 15 de diciembre de 2022 . Consultado el 15 de diciembre de 2022 .
- ^ Metzler, Rebecca A.; Evans, John Spencer; Killian, Christopher E.; Zhou, Dong; Churchill, Tyler H.; Appathurai, Narayana P.; Coppersmith, Susan N.; Gilbert, PUPA (12 de mayo de 2010). "Plantillas de fragmentos de proteína de nácar para el crecimiento laminar de aragonito". Journal of the American Chemical Society . 132 (18): 6329–6334. doi :10.1021/ja909735y. ISSN 0002-7863. PMID 20397648. Archivado desde el original el 15 de diciembre de 2022. Consultado el 15 de diciembre de 2022 .
- ^ Lowenstam, HA; Weiner, S. (1989). Sobre la biomineralización . Oxford University Press. ISBN 978-0-19-504977-0.
- ^ Belcher, AM; Wu, XH; Christensen, RJ; Hansma, PK; Stucky, GD; Morse, DE (mayo de 1996). "Control del cambio de fase cristalina y la orientación por proteínas solubles de la concha de moluscos". Nature . 381 (6577): 56–58. Bibcode :1996Natur.381...56B. doi :10.1038/381056a0. ISSN 1476-4687. S2CID 4285912. Archivado desde el original el 15 de diciembre de 2022 . Consultado el 15 de diciembre de 2022 .
- ^ Falini, Giuseppe; Albeck, Shira; Weiner, Steve; Addadi, Lia (5 de enero de 1996). "Control del polimorfismo de aragonito o calcita mediante macromoléculas de concha de molusco". Ciencia . 271 (5245): 67–69. Código Bib : 1996 Ciencia... 271... 67F. doi :10.1126/ciencia.271.5245.67. ISSN 0036-8075. S2CID 95357556. Archivado desde el original el 15 de diciembre de 2022 . Consultado el 15 de diciembre de 2022 .
- ^ Marin, Frédéric (octubre de 2020). «Conchas de moluscos: pasado, presente y futuro». Journal of Structural Biology . 212 (1): 107583. doi : 10.1016/j.jsb.2020.107583 . PMID 32721585. S2CID 220850117.
- ^ Russell, Daniel E. 17 de febrero de 2008. Consultado el 31 de diciembre de 2010. "Mina de espato de Islandia de Helgustadir Archivado el 8 de mayo de 2019 en Wayback Machine. " mindat.org
- ^ Horne, Francis (23 de octubre de 2006). «¿Cómo se crean las conchas marinas?». Scientific American . Archivado desde el original el 19 de marzo de 2011. Consultado el 25 de abril de 2012 .
- ^ "Calcio de la concha de ostra". WebMD . Consultado el 25 de abril de 2012 .
- ^ "Carbonato de calcio de concha de ostra". Caltron Clays & Chemicals. Archivado desde el original el 10 de septiembre de 2013. Consultado el 25 de abril de 2012 .
- ^ Mangels, Ann Reed (4 de junio de 2014). "Nutrientes óseos para vegetarianos". The American Journal of Clinical Nutrition . 100 (1): 469S–475S. doi : 10.3945/ajcn.113.071423 . PMID 24898231.
- ^ "La función de las glándulas calcáreas de las lombrices de tierra". La compañía de los biólogos . Archivado desde el original el 5 de febrero de 2024. Consultado el 5 de febrero de 2024 .
- ^ Briones, María Jesús Iglesias; Ostle, Nicholas J.; Piearce, Trevor G. (2008). «Los isótopos estables revelan que la glándula calcífera de las lombrices de tierra es un órgano fijador de CO2». Soil Biology and Biochemistry . 40 (2): 554–557. doi :10.1016/j.soilbio.2007.09.012. Archivado desde el original el 29 de enero de 2012 . Consultado el 5 de febrero de 2024 .
- ^ "Funciones ecológicas de las lombrices de tierra en el suelo". eDepot . Archivado desde el original el 5 de febrero de 2024 . Consultado el 5 de febrero de 2024 .
- ^ Boynton, WV; Ming, DW; Kounaves, SP; et al. (2009). "Evidencia de carbonato de calcio en el sitio de aterrizaje de la sonda Mars Phoenix" (PDF) . Science . 325 (5936): 61–64. Bibcode :2009Sci...325...61B. doi :10.1126/science.1172768. PMID 19574384. S2CID 26740165. Archivado (PDF) desde el original el 5 de marzo de 2016 . Consultado el 7 de enero de 2015 .
- ^ Clark, BC III; Arvidson, RE; Gellert, R.; Morris, RV; Ming, DW; Richter, L.; Ruff, SW; Michalski, JR; Farrand, WH; Yen, A.; Herkenhoff, KE; Li, R.; Squyres, SW; Schröder, C.; Klingelhöfer, G.; Bell, JF (2007). "Evidencia de montmorillonita o su equivalente composicional en Columbia Hills, Marte" (PDF) . Journal of Geophysical Research . 112 (E6): E06S01. Bibcode :2007JGRE..112.6S01C. doi :10.1029/2006JE002756. hdl : 1893/17119 . Archivado (PDF) desde el original el 29 de julio de 2018 . Recuperado el 20 de abril de 2018 .
- ^ Weyl, PK (1959). "El cambio en la solubilidad del carbonato de calcio con la temperatura y el contenido de dióxido de carbono". Geochimica et Cosmochimica Acta . 17 (3–4): 214–225. Código Bibliográfico :1959GeCoA..17..214W. doi :10.1016/0016-7037(59)90096-1.
- ^ Burton, Elizabeth (1990). "Profundidad de compensación de carbonatos". Profundidad de compensación de carbonatos . p. 73. doi :10.1007/1-4020-4496-8_46. ISBN 978-1-4020-4496-0Archivado desde el original el 22 de diciembre de 2023. Consultado el 22 de diciembre de 2023 – vía Elsevier.
{{cite book}}:|journal=ignorado ( ayuda ) - ^ ab Trexler, D. (2001). "Formación Two Medicine, Montana: geología y fauna". En Tanke, DH; Carpenter, K. (eds.). Vida de vertebrados mesozoicos. Indiana University Press. págs. 298–309. ISBN 978-0-253-33907-2.
- ^ Ward, Peter (2006). De la nada: dinosaurios, aves y la antigua atmósfera de la Tierra. doi :10.17226/11630. ISBN 978-0-309-66612-1Archivado desde el original el 1 de enero de 2018 . Consultado el 31 de diciembre de 2017 .
- ^ "Efectos de la lluvia ácida". Agencia de Protección Ambiental de Estados Unidos. Archivado desde el original el 2 de marzo de 2015. Consultado el 14 de marzo de 2015 .
- ^ "Alto horno". Science Aid. Archivado desde el original el 17 de diciembre de 2007. Consultado el 30 de diciembre de 2007 .
- ^ Sfetcu, Nicolae (2 de mayo de 2014). Salud y medicamentos: enfermedades, prescripciones y medicamentos. Nicolae Sfetcu.
- ^ McGinnis, RA Beet-Sugar Technology (2.ª ed.). Fundación para el Desarrollo del Azúcar de Remolacha. pág. 178.
- ^ "Usos del carbonato de calcio precipitado". Archivado desde el original el 25 de julio de 2014.
- ^ abcd «Calcium Carbonate Powder». Reade Advanced Materials. 4 de febrero de 2006. Archivado desde el original el 22 de febrero de 2008. Consultado el 30 de diciembre de 2007 .
- ^ ab "Carbonato de calcio en aplicaciones plásticas". Imerys Performance Minerals. Archivado desde el original el 4 de agosto de 2008. Consultado el 1 de agosto de 2008 .
- ^ "¿Por qué el carbonato de calcio juega un papel importante en la industria?" www.xintuchemical.com . Archivado desde el original el 7 de octubre de 2018 . Consultado el 7 de octubre de 2018 .
- ^ "Precio de la materia prima de carbonato de calcio precipitado". www.dgci.be . Archivado desde el original el 7 de octubre de 2018 . Consultado el 7 de octubre de 2018 .
- ^ Jimoh, OA; et al. (2017). "Comprensión del mecanismo de producción de carbonato de calcio precipitado (PCC) y sus características en el sistema líquido-gas utilizando suspensión de lechada de cal (MOL)" (PDF) . Revista Sudafricana de Química . 70 : 1–7. doi : 10.17159/0379-4350/2017/v70a1 . Archivado (PDF) del original el 21 de septiembre de 2018 . Consultado el 7 de octubre de 2018 .
- ^ "Tema: Re: ¿Se pueden utilizar nuestros "residuos" de carbonato de calcio en otras industrias para evitar que terminen en los vertederos?". www.chemicalprocessing.com . 4 de marzo de 2010. Archivado desde el original el 23 de marzo de 2017 . Consultado el 3 de febrero de 2021 .
- ^ "¿Por qué el carbonato de calcio juega un papel importante en la industria?". www.xintuchemical.com . Archivado desde el original el 7 de octubre de 2018 . Consultado el 3 de febrero de 2021 .
- ^ "Carbonatos de calcio/calcita/caliza. CaCO3 | Rajasthan Minerals & Chemicals". www.rmcl.co.in. Archivado desde el original el 15 de abril de 2021. Consultado el 3 de febrero de 2021 .
- ^ "Carbonato de calcio". kamceramics.com . Archivado desde el original el 15 de abril de 2021 . Consultado el 3 de febrero de 2021 .
- ^ "Blog de la Sociedad Histórica de Ohio: Make It Shine". Sociedad Histórica de Ohio. Archivado desde el original el 23 de marzo de 2012. Consultado el 2 de junio de 2011 .
- ^ "Carbonato de calcio". Medline Plus . Institutos Nacionales de Salud . 1 de octubre de 2005. Archivado desde el original el 17 de octubre de 2007 . Consultado el 30 de diciembre de 2007 .
- ^ Lieberman, Herbert A.; Lachman, Leon; Schwartz, Joseph B. (1990). Formas farmacéuticas de dosificación: comprimidos . Nueva York: Dekker. pág. 153. ISBN 978-0-8247-8044-9.
- ^ "Aditivos alimentarios: nombres que empiezan con C". Chemistry.about.com . 10 de abril de 2012. Archivado desde el original el 16 de octubre de 2006 . Consultado el 24 de mayo de 2012 .
- ^ Caruso JB, Patel RM, Julka K, Parish DC (julio de 2007). "Enfermedad inducida por la conducta saludable: regreso del síndrome de leche y álcalis". J Gen Intern Med . 22 (7): 1053–5. doi :10.1007/s11606-007-0226-0. PMC 2219730 . PMID 17483976.
- ^ Beall DP, Henslee HB, Webb HR, Scofield RH (mayo de 2006). "Síndrome de leche y alcalinos: una revisión histórica y descripción de la versión moderna del síndrome". Am. J. Med. Sci . 331 (5): 233–42. doi :10.1097/00000441-200605000-00001. PMID 16702792. S2CID 45802184.
- ^ Gabriely, Ilan; Leu, James P.; Barzel, Uriel S. (2008). "Resolución de problemas clínicos, vuelta a lo básico". New England Journal of Medicine . 358 (18): 1952–6. doi :10.1056/NEJMcps0706188. PMID 18450607.
- ^ "Números E: E170 Carbonato de calcio". Food-Info.net . Archivado desde el original el 14 de octubre de 2022 . Consultado el 19 de abril de 2008 .080419 info-alimentos.net
- ^ "Aditivos aprobados actualmente por la UE y sus números E". Agencia de Normas Alimentarias del Reino Unido. Archivado desde el original el 7 de octubre de 2010. Consultado el 27 de octubre de 2011 .
- ^ "Listado de la condición de aditivos alimentarios, parte I". Administración de Alimentos y Medicamentos de Estados Unidos . Archivado desde el original el 14 de marzo de 2013. Consultado el 27 de octubre de 2011 .
- ^ "Norma 1.2.4 – Etiquetado de ingredientes". Código de Normas Alimentarias de Australia y Nueva Zelanda. 8 de septiembre de 2011. Archivado desde el original el 2 de septiembre de 2013. Consultado el 27 de octubre de 2011 .
- ^ Holdstock, Lee. "¿Por qué optar por lo orgánico?". Campaña del pan de verdad. Soil Association Certification Limited. Archivado desde el original el 14 de octubre de 2022. Consultado el 3 de abril de 2021 .
- ^ "Reglamento sobre el pan y la harina de 1998. Resumen de las respuestas a la consulta y respuesta del Gobierno" (PDF) . Departamento de Medio Ambiente, Alimentación y Asuntos Rurales. Agosto de 2013. Archivado (PDF) del original el 19 de septiembre de 2021. Consultado el 9 de abril de 2021 .
- ^ Zhao, Y.; Martin, BR; Weaver, CM (2005). "La biodisponibilidad de calcio de la leche de soja fortificada con carbonato de calcio es equivalente a la de la leche de vaca en mujeres jóvenes". The Journal of Nutrition . 135 (10): 2379–2382. doi : 10.1093/jn/135.10.2379 . PMID 16177199.
- ^ ab Kauffman, John F.; Westenberger, Benjamin J.; Robertson, J. David; Guthrie, James; Jacobs, Abigail; Cummins, Susan K. (1 de julio de 2007). "Plomo en productos farmacéuticos y suplementos dietéticos". Toxicología y farmacología regulatoria . 48 (2): 128–134. doi :10.1016/j.yrtph.2007.03.001. ISSN 0273-2300. PMID 17467129. Archivado desde el original el 11 de julio de 2021. Consultado el 11 de julio de 2021 .
- ^ Ross, Edward A.; Szabo, NJ; Tebbett, IR (2000). "Contenido de plomo en suplementos de calcio". JAMA . 284 (11): 1425–1429. doi :10.1001/jama.284.11.1425. PMID 10989406.
- ^ Oates, JAH (11 de julio de 2008). Cal y piedra caliza: química y tecnología, producción y usos. John Wiley & Sons. págs. 111–113. ISBN 978-3-527-61201-7.
- ^ El-Aswad, Ahmed F.; Fouad, Mohamed R.; Badawy, Mohamed EI; Aly, Maher I. (31 de mayo de 2023). "Efecto del contenido de carbonato de calcio en la adsorción y desorción potencial de pesticidas en suelo calcáreo". Comunicaciones en ciencia del suelo y análisis de plantas . 54 (10): 1379–1387. Código Bibliográfico :2023CSSPA..54.1379E. doi :10.1080/00103624.2022.2146131. ISSN 0010-3624. S2CID 253559627. Archivado desde el original el 18 de agosto de 2023 . Consultado el 18 de agosto de 2023 .
- ^ "Dispensador de piedra caliza combate la lluvia ácida en un arroyo". The New York Times . Associated Press . 13 de junio de 1989. Archivado desde el original el 28 de julio de 2018 . Consultado el 27 de julio de 2018 .
- ^ ab "Usos ambientales del carbonato de calcio". Congcal. 6 de septiembre de 2012. Archivado desde el original el 4 de enero de 2014 . Consultado el 5 de agosto de 2013 .
- ^ Schreiber, RK (1988). "Investigación cooperativa federal-estatal sobre encalado en aguas superficiales afectadas por deposición ácida". Contaminación del agua, el aire y el suelo . 41 (1): 53–73. Bibcode :1988WASP...41...53S. doi :10.1007/BF00160344. S2CID 98404326. Archivado desde el original el 10 de enero de 2018 . Consultado el 28 de agosto de 2017 .
- ^ Kircheis, Dan; Dill, Richard (2006). "Efectos del bajo pH y el alto contenido de aluminio en los salmones jóvenes del Atlántico en el este de Maine y análisis de viabilidad del proyecto de encalado" (reimpreso en Downeast Salmon Federation) . Servicio Nacional de Pesca Marina y Comisión del Salmón del Atlántico de Maine.[ enlace muerto permanente ]
- ^ Guhrén, M.; Bigler, C.; Renberg, I. (2006). "El encalado desde una perspectiva a largo plazo: un estudio paleolimnológico de 12 lagos en el programa sueco de encalado". Revista de Paleolimnología . 37 (2): 247–258. Código Bibliográfico :2007JPall..37..247G. doi :10.1007/s10933-006-9014-9. S2CID 129439066.
- ^ "Por qué se utiliza carbonato de calcio en la industria del plástico". EuroPlas . Consultado el 12 de julio de 2024 .
- ^ "Carbonato de calcio precipitado Solvay: producción". Solvay. 9 de marzo de 2007. Archivado desde el original el 19 de octubre de 2007. Consultado el 30 de diciembre de 2007 .
- ^ ab Lide, DR, ed. (2005). Manual de química y física del CRC (86.ª edición). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ "Productos de solubilidad seleccionados y constantes de formación a 25 °C". Universidad Estatal de California, Dominguez Hills . Archivado desde el original el 25 de mayo de 2006. Consultado el 7 de junio de 2007 .
- ^ Wang, X.; Conway, W.; Burns, R.; McCann, N.; Maeder, M. (2010). "Estudio exhaustivo de las reacciones de hidratación y deshidratación del dióxido de carbono en solución acuosa". The Journal of Physical Chemistry A . 114 (4): 1734–40. Bibcode :2010JPCA..114.1734W. doi :10.1021/jp909019u. PMID 20039712.
- ^ ab Mook, W. (2000). "Química del ácido carbónico en el agua". Isótopos ambientales en el ciclo hidrológico: principios y aplicaciones (PDF) . París: INEA/UNESCO. págs. 143–165. Archivado desde el original (PDF) el 18 de marzo de 2014 . Consultado el 18 de marzo de 2014 .
- ^ Wojtowicz, JA (1998). "Factores que afectan la precipitación del carbonato de calcio" (PDF) . Journal of the Swimming Pool and Spa Industry . 3 (1): 18–23. Archivado desde el original (PDF) el 18 de marzo de 2014. Consultado el 18 de marzo de 2014 .
- ^ Wojtowicz, JA (1998). "Correcciones, posibles errores y significación del índice de saturación" (PDF) . Revista de la industria de piscinas y spas . 3 (1): 37–40. Archivado desde el original (PDF) el 24 de agosto de 2012. Consultado el 18 de marzo de 2014 .
- ^ Birch, RG (2013). "BABES: un método mejor que "BBB" para piscinas con generador de cloro de agua salada" (PDF) . scithings.id.au . Archivado (PDF) del original el 15 de abril de 2021 . Consultado el 11 de octubre de 2020 .
Enlaces externos
- Ficha internacional de seguridad química 1193
- CID 516889 de PubChem
- Códigos ATC : A02AC01 ( OMS ) y A12AA04 ( OMS )
- Asociación Británica de Carbonato de Calcio: ¿Qué es el carbonato de calcio? Archivado el 24 de mayo de 2008 en Wayback Machine
- CDC – Guía de bolsillo de NIOSH sobre peligros químicos: carbonato de calcio




