Carbonato de magnesio
 | |
 | |
 | |
| Nombres | |
|---|---|
| Otros nombres | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| EBICh | |
| Química biológica | |
| Araña química | |
| Tarjeta informativa de la ECHA | 100.008.106 |
| Número E | E504(i) (reguladores de acidez, ...) |
Identificador de centro de PubChem |
|
| Número RTECS |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| MgCO3 | |
| Masa molar | 84,3139 g/mol (anhidro) |
| Apariencia | Cristales incoloros o sólido blanco Higroscópico |
| Olor | Inodoro |
| Densidad | 2,958 g/cm 3 (anhidro) 2,825 g/cm 3 (dihidrato) 1,837 g/cm 3 (trihidrato) 1,73 g/cm 3 (pentahidrato) |
| Punto de fusión | 350 °C (662 °F; 623 K) se descompone (anhidro) 165 °C (329 °F; 438 K) (trihidrato) |
| Anhidro: 0,0139 g/100 ml (25 °C) 0,0063 g/100 ml (100 °C) [1] | |
Producto de solubilidad ( K sp ) | 10 −7,8 [2] |
| Solubilidad | Soluble en ácido, CO2 acuoso Insoluble en acetona , amoniaco |
| −32,4·10 −6 cm3 / mol | |
Índice de refracción ( n D ) | 1,717 (anhidro) 1,458 (dihidrato) 1,412 (trihidrato) |
| Estructura | |
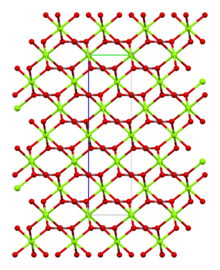
| Trigonal | |
| R 3 c, Núm. 167 [3] | |
| Termoquímica | |
Capacidad calorífica ( C ) | 75,6 J/mol·K [1] |
Entropía molar estándar ( S ⦵ 298 ) | 65,7 J/mol·K [1] [4] |
Entalpía estándar de formación (Δ f H ⦵ 298 ) | −1113 kJ/mol [4] |
Energía libre de Gibbs (Δ f G ⦵ ) | −1029,3 kJ/mol [1] |
| Farmacología | |
| A02AA01 ( OMS ) A06AD01 ( OMS ) | |
| Peligros | |
| NFPA 704 (rombo cortafuegos) | |
| punto de inflamabilidad | Ininflamable |
| NIOSH (límites de exposición a la salud en EE. UU.): | |
PEL (Permisible) |
|
| Ficha de datos de seguridad (FDS) | ICSC 0969 |
| Compuestos relacionados | |
Otros aniones | Bicarbonato de magnesio |
Otros cationes | Carbonato de berilio Carbonato de calcio Carbonato de estroncio Carbonato de bario Carbonato de radio |
Compuestos relacionados | Artinita Hidromagnesita Dypingita |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
Puedes ayudar a ampliar este artículo con texto traducido del artículo correspondiente en alemán . (Diciembre de 2018) Haz clic en [mostrar] para obtener instrucciones de traducción importantes.
|
El carbonato de magnesio , MgCO3 ( nombre arcaico magnesia alba ), es una sal inorgánica que es un sólido incoloro o blanco. También existen varias formas hidratadas y básicas de carbonato de magnesio como minerales .
Formularios
Las formas más comunes de carbonato de magnesio son la sal anhidra llamada magnesita ( MgCO3 ), y los di, tri y pentahidratos conocidos como barringtonita ( MgCO3 · 2H2O ) , nesquehonita ( MgCO3 · 3H2O ) y lansfordita ( MgCO3 · 5H2O ) , respectivamente . [ 6] Algunas formas básicas como la artinita ( Mg2CO3 ( OH ) 2 · 3H2O ) , la hidromagnesita ( Mg5 (CO3 ) 4 ( OH) 2 ·4H2O ) y la dipingita ( Mg5 (CO3 ) 4 ( OH) 2 ·5H2O ) también se presentan como minerales . Todos esos minerales son incoloros o blancos .
La magnesita está formada por cristales trigonales incoloros o blancos . La sal anhidra es prácticamente insoluble en agua , acetona y amoníaco . Todas las formas de carbonato de magnesio reaccionan con ácidos . La magnesita cristaliza en la estructura de calcita , en la que Mg 2+ está rodeado por seis átomos de oxígeno . [3]
| Coordinación de carbonatos | Coordinación de magnesio | Celda unitaria |
|---|---|---|
 | 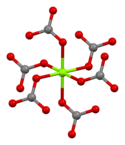 |  |
El dihidrato tiene una estructura triclínica , mientras que el trihidrato tiene una estructura monoclínica .
Las referencias a carbonatos de magnesio "ligeros" y "pesados" en realidad se refieren a los hidroxicarbonatos de magnesio hidromagnesita y dipingita , respectivamente. [7] La forma "ligera" se precipita a partir de soluciones de magnesio utilizando carbonato alcalino a "temperaturas normales", mientras que la "pesada" se puede producir a partir de soluciones concentradas en ebullición seguida de precipitación a sequedad, lavado del precipitado y secado a 100 °C. [8]
Preparación
El carbonato de magnesio se obtiene generalmente a partir de la extracción del mineral magnesita . El setenta por ciento del suministro mundial se extrae y se prepara en China. [9]
El carbonato de magnesio se puede preparar en el laboratorio mediante la reacción entre cualquier sal de magnesio soluble y bicarbonato de sodio :
- MgCl 2 (acuoso) + 2 NaHCO 3 (acuoso) → MgCO 3 (s) + 2 NaCl (ac) + H 2 O (l) + CO 2 (g)
Si se trata el cloruro (o sulfato) de magnesio con carbonato de sodio acuoso, se forma un precipitado de carbonato de magnesio básico (un complejo hidratado de carbonato de magnesio e hidróxido de magnesio ) en lugar del propio carbonato de magnesio:
- 5 MgCl 2 (acuoso) + 5 Na 2 CO 3 (acuoso) + 5 H 2 O(l) → Mg 4 (CO 3 ) 3 (OH) 2 ·3H 2 O(s) + Mg(HCO 3 ) 2 (acuoso) + 10 NaCl(acuoso)
Las rutas industriales de alta pureza incluyen una vía a través del bicarbonato de magnesio , que se puede formar combinando una suspensión de hidróxido de magnesio y dióxido de carbono a alta presión y temperatura moderada. [6] Luego, el bicarbonato se seca al vacío, lo que hace que pierda dióxido de carbono y una molécula de agua:
- Mg( OH ) 2 + 2CO2 → Mg( HCO3 ) 2
- Mg(HCO 3 ) 2 → MgCO 3 + CO 2 + H 2 O
Propiedades químicas
Con ácidos
Al igual que muchos carbonatos metálicos comunes del grupo 2, el carbonato de magnesio reacciona con ácidos acuosos para liberar dióxido de carbono y agua :
- MgCO 3 + 2 HCl → MgCl 2 + CO 2 + H 2 O
- MgCO3 + H2SO4 → MgSO4 + CO2 + H2O
Descomposición
A altas temperaturas, el MgCO3 se descompone en óxido de magnesio y dióxido de carbono . Este proceso es importante en la producción de óxido de magnesio. [6] Este proceso se llama calcinación :
- MgCO3 → MgO + CO2 ( ΔH = +118 kJ/mol)
La temperatura de descomposición se da como 350 °C (662 °F). [10] [11] Sin embargo, la calcinación al óxido generalmente no se considera completa por debajo de los 900 °C debido a la interferencia de la readsorción del dióxido de carbono liberado.
Los hidratos de las sales pierden agua a diferentes temperaturas durante la descomposición. [12] Por ejemplo, en el trihidrato MgCO 3 ·3H 2 O , cuya fórmula molecular puede escribirse como Mg(HCO 3 )(OH)·2H 2 O , los pasos de deshidratación ocurren a 157 °C y 179 °C de la siguiente manera: [12]
- Mg(HCO3 ) (OH)·2(H2O ) → Mg(HCO3 ) (OH)·(H2O ) + H2O a 157 ° C
- Mg(HCO3 ) (OH)·(H2O ) → Mg(HCO3 ) (OH) + H2O a 179 ° C
Usos
El uso principal del carbonato de magnesio es la producción de óxido de magnesio por calcinación . Los minerales de magnesita y dolomita se utilizan para producir ladrillos refractarios . [6] El MgCO3 también se utiliza en suelos , ignifugación , composiciones extintoras , cosméticos , polvos para espolvorear y pasta de dientes . Otras aplicaciones son como material de relleno , supresor de humo en plásticos, agente de refuerzo en caucho de neopreno , agente de secado y retención de color en alimentos.
Debido a su baja solubilidad en agua y sus propiedades higroscópicas , el MgCO3 se añadió por primera vez a la sal de mesa ( NaCl ) en 1911 para que fluyera más libremente. La empresa Morton Salt adoptó el eslogan "Cuando llueve, llueve a cántaros", destacando que su sal, que contenía MgCO3 , no se aglutinaría en climas húmedos. [ 13]

El carbonato de magnesio en polvo, conocido como tiza de escalada o tiza de gimnasio , también se utiliza como agente secante en las manos de los atletas en escalada en roca , gimnasia , levantamiento de potencia, levantamiento de pesas y otros deportes en los que es necesario un agarre firme. [9] Una variante es la tiza líquida .
Como aditivo alimentario , el carbonato de magnesio se conoce como E504. Su único efecto secundario conocido es que puede funcionar como laxante en altas concentraciones. [14]
El carbonato de magnesio se utiliza en taxidermia para blanquear cráneos. Se puede mezclar con peróxido de hidrógeno para crear una pasta que se extiende sobre el cráneo para darle un acabado blanco.
El carbonato de magnesio se utiliza como revestimiento blanco mate para pantallas de proyección . [15]
Uso médico
Es un laxante para aflojar los intestinos .
Además, el carbonato de magnesio de alta pureza se utiliza como antiácido y como aditivo en la sal de mesa para que fluya libremente. El carbonato de magnesio puede hacer esto porque no se disuelve en agua, solo en ácido, donde burbujea . [ 16]
Seguridad
El carbonato de magnesio no es tóxico ni inflamable.
Estado compendial
- Farmacopea Británica [17]
- Farmacopea Japonesa [18]
Véase también
- Acetato de calcio/carbonato de magnesio
- Upsalite , una forma amorfa de carbonato de magnesio
Notas y referencias
- ^ abcd "Carbonato de magnesio".
- ^ Bénézeth, Pascale; Saldi, Giuseppe D.; Dandurand, Jean-Louis; Schott, Jacques (2011). "Determinación experimental del producto de solubilidad de la magnesita a 50 a 200 °C". Chemical Geology . 286 (1–2): 21–31. Bibcode :2011ChGeo.286...21B. doi :10.1016/j.chemgeo.2011.04.016.
- ^ ab Ross, Nancy L. (1997). "La ecuación de estado y el comportamiento a alta presión de la magnesita". Am. Mineral. 82 (7–8): 682–688. Bibcode :1997AmMin..82..682R. doi :10.2138/am-1997-7-805. S2CID 43668770.
- ^ de Zumdahl, Steven S. (2009). Principios químicos, sexta edición . Houghton Mifflin Company. pág. A22. ISBN 978-0-618-94690-7.
- ^ Guía de bolsillo del NIOSH sobre peligros químicos. "#0373". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ abcd Margarete Seeger; Walter Otto; Wilhelm Flick; Friedrich Bickelhaupt; Otto S. Akkerman. "Compuestos de magnesio". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a15_595.pub2. ISBN 978-3527306732.
- ^ Botha, A.; Strydom, CA (2001). "Preparación de un hidroxicarbonato de magnesio a partir de hidróxido de magnesio". Hidrometalurgia . 62 (3): 175. Bibcode :2001HydMe..62..175B. doi :10.1016/S0304-386X(01)00197-9.
- ^ JR Partington (1951). Química general e inorgánica, 2.ª ed .
- ^ ab Allf, Bradley (21 de mayo de 2018). "El costo ambiental oculto de la tiza para escalada". Revista de escalada . Cruz Bay Publishing . Consultado el 22 de mayo de 2018 .
De hecho, China produce el 70 por ciento de la magnesita del mundo. La mayor parte de esa producción (tanto la minería como el procesamiento) se concentra en un pequeño rincón de Liaoning, una provincia industrial montañosa en el noreste de China, entre Pekín y Corea del Norte.
- ^ "MSDS de IAState".
- ^ Weast, Robert C.; et al. (1978). Manual de química y física del CRC (59.ª edición). West Palm Beach, Florida: CRC Press. pág. B-133. ISBN 0-8493-0549-8 .
- ^ ab "Análisis térmico convencional y de velocidad controlada de nesquehonita Mg(HCO3)(OH)·2(H2O)" (PDF) .
- ^ "Su debut - Morton Salt" . Consultado el 27 de diciembre de 2017 .
- ^ "Food-Info.net: Números E: E504: Carbonatos de magnesio".080419 info-alimentos.net
- ^ Noronha, Shonan (2015). Especialista certificado en tecnología de instalación . McGraw Hill Education. pág. 256. ISBN 978-0071835657.
- ^ "¿Qué es el carbonato de magnesio?". Sciencing . Consultado el 15 de abril de 2018 .
- ^ Secretaría de la Comisión de la Farmacopea Británica (2009). «Índice, BP 2009» (PDF) . Archivado desde el original (PDF) el 11 de abril de 2009. Consultado el 31 de enero de 2010 .
- ^ "Farmacopea Japonesa, Decimoquinta Edición" (PDF) . 2006. Archivado desde el original (PDF) el 22 de julio de 2011. Consultado el 31 de enero de 2010 .
Enlaces externos
- Ficha internacional de seguridad química 0969
- Base de datos de referencia estándar del NIST





