Tiroiditis de Hashimoto
| Tiroiditis de Hashimoto | |
|---|---|
| Otros nombres | Tiroiditis linfocítica crónica, tiroiditis autoinmune, estruma linfomatoso, enfermedad de Hashimoto |
 | |
| La tiroides de una persona con tiroiditis de Hashimoto vista con un microscopio a bajo aumento. | |
| Especialidad | Endocrinología |
| Síntomas | Bocio indoloro , aumento de peso , sensación de cansancio , estreñimiento , depresión , piel seca , caída del cabello [1] |
| Complicaciones | Linfoma de tiroides . [2] |
| Inicio habitual | 30–50 años [1] [3] |
| Causas | Factores genéticos y ambientales . [4] |
| Factores de riesgo | Antecedentes familiares, otra enfermedad autoinmune [1] |
| Método de diagnóstico | TSH , T4, autoanticuerpos antitiroideos [1] |
| Diagnóstico diferencial | Enfermedad de Graves , bocio nodular no tóxico [5] |
| Tratamiento | Levotiroxina , cirugía [1] [5] |
| Frecuencia | 2% en algún momento [4] |
La tiroiditis de Hashimoto , también conocida como tiroiditis linfocítica crónica y enfermedad de Hashimoto , es una enfermedad autoinmune en la que la glándula tiroides se destruye gradualmente. [1] [6] Un término un poco más amplio es tiroiditis autoinmune , idéntico salvo que también se utiliza para describir una afección similar sin bocio. [7] [8]
Al principio, los síntomas pueden no notarse. [1] Con el tiempo, la tiroides puede agrandarse, formando un bocio indoloro . [1] Algunas personas eventualmente desarrollan hipotiroidismo con aumento de peso , fatiga , estreñimiento , depresión , pérdida de cabello y dolores generales. [1] Después de muchos años, la tiroides generalmente se encoge de tamaño. [1] Las posibles complicaciones incluyen linfoma de tiroides . [2] Además, debido a que es común que los pacientes de Hashimoto no tratados desarrollen hipotiroidismo, otras complicaciones pueden incluir, entre otras, colesterol alto , enfermedad cardíaca , insuficiencia cardíaca , presión arterial alta , mixedema y posibles problemas de embarazo. [9]
Se cree que la tiroiditis de Hashimoto se debe a una combinación de factores genéticos y ambientales . [4] Los factores de riesgo incluyen antecedentes familiares de la enfermedad y tener otra enfermedad autoinmune. [1] El diagnóstico se confirma con análisis de sangre para TSH , T4 y autoanticuerpos antitiroideos . [1] Otras afecciones que pueden producir síntomas similares incluyen la enfermedad de Graves y el bocio nodular no tóxico . [5]
La tiroiditis de Hashimoto se trata típicamente con levotiroxina . [1] [10] Si no hay hipotiroidismo, algunos pueden recomendar no realizar ningún tratamiento, mientras que otros pueden tratar para intentar reducir el tamaño del bocio. [1] [11] Los afectados deben evitar comer grandes cantidades de yodo ; sin embargo, se requiere suficiente yodo especialmente durante el embarazo. [1] Rara vez se requiere cirugía para tratar el bocio. [5]
La tiroiditis de Hashimoto afecta a alrededor del 5% de las personas blancas de ascendencia europea occidental en algún momento de sus vidas. [4] Es la causa más común de hipotiroidismo en áreas del mundo con suficiente yodo. [12] Por lo general, comienza entre los 30 y los 50 años y es mucho más común en mujeres que en hombres. [1] [3] Las tasas de la enfermedad parecen estar aumentando. [5] Fue descrita por primera vez por el médico japonés Hakaru Hashimoto en 1912. [13] En 1957, fue reconocida como un trastorno autoinmune. [14]
Signos y síntomas
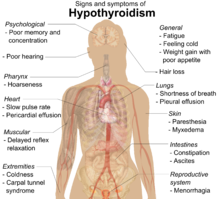

Muchos síntomas se atribuyen al desarrollo de la tiroiditis de Hashimoto. Los síntomas más comunes incluyen: fatiga , aumento de peso, cara pálida o hinchada, sensación de frío, dolor en las articulaciones y los músculos , estreñimiento , cabello seco y ralo, flujo menstrual abundante o períodos irregulares , depresión , trastorno de pánico , frecuencia cardíaca lenta y problemas para quedar embarazada y abortos espontáneos . [15]
Algunos pacientes en la etapa temprana de la enfermedad pueden experimentar síntomas de hipertiroidismo debido a la liberación de hormonas tiroideas por la destrucción intermitente de la tiroides. [16]
La enfermedad de Hashimoto es aproximadamente siete veces más común en mujeres que en hombres. Puede presentarse en adolescentes y mujeres jóvenes, pero es más común en la mediana edad , particularmente en los hombres. Las personas que desarrollan la enfermedad de Hashimoto a menudo tienen familiares que padecen enfermedades tiroideas u otras enfermedades autoinmunes y, a veces, ellos mismos padecen otras enfermedades autoinmunes. [17]
Las primeras etapas de la tiroiditis autoinmune pueden tener un examen físico normal con o sin bocio. [18] Un bocio es una hinchazón difusa, a menudo simétrica, de la glándula tiroides visible en la parte anterior del cuello que puede desarrollarse. [18] La glándula tiroides puede volverse firme, grande y lobulada en la tiroiditis de Hashimoto, pero los cambios en la tiroides también pueden ser no palpables. [19] El agrandamiento de la tiroides se debe a la infiltración linfocítica y la fibrosis , en lugar de la hipertrofia tisular . Si bien su papel en la destrucción inicial de los folículos no está claro, los anticuerpos contra la peroxidasa tiroidea o la tiroglobulina son relevantes, ya que sirven como marcadores para detectar la enfermedad y su gravedad. [20] Se cree que son los productos secundarios de la destrucción de la glándula mediada por células T. [21]
A medida que progresa la infiltración linfocítica, los pacientes pueden presentar signos de hipotiroidismo en múltiples sistemas corporales, incluidos, entre otros, un bocio más grande, aumento de peso, intolerancia al frío, fatiga, mixedema, estreñimiento, trastornos menstruales, piel pálida o seca y cabello seco y quebradizo, depresión, ataxia y debilidad muscular. [18] [12]
Los pacientes con bocio que han tenido tiroiditis autoinmune durante muchos años pueden ver cómo su bocio se encoge en las últimas etapas de la enfermedad debido a la destrucción de la tiroides. [16]
Aunque son poco frecuentes, las complicaciones más graves del hipotiroidismo resultante de la tiroiditis autoinmune son el derrame pericárdico , el derrame pleural , ambos que requieren mayor atención médica, y el coma mixedematoso , que es una emergencia endocrina. [12]
Relación con otras enfermedades autoinmunes
La enfermedad de Graves puede presentarse antes o después del desarrollo de la tiroiditis autoinmune. [22] Los pacientes también pueden tener afecciones autoinmunes coexistentes de otros órganos. Estas pueden incluir la enfermedad de Addison , la diabetes tipo 1 , el síndrome de Sjögren , la enfermedad celíaca y la artritis reumatoide . [18] [16] También se ha observado tiroiditis autoinmune en pacientes con síndromes poliendocrinos autoinmunes tipo 1 y 2. [22]
Genética
La autoinmunidad tiroidea puede ser familiar. [7] Muchos pacientes informan antecedentes familiares de tiroiditis autoinmune o enfermedad de Graves . [18] Estudios en gemelos han revelado una concordancia de la enfermedad de Hashimoto en gemelos monocigóticos. [12]
Factores de riesgo
El fuerte componente genético se confirma en estudios sobre gemelos monocigóticos , con una concordancia del 38-55%, con una concordancia aún mayor de anticuerpos tiroideos circulantes no relacionados con la presentación clínica (hasta el 80% en gemelos monocigóticos). Ninguno de los resultados se observó en un grado similar en gemelos dicigóticos , lo que ofrece un fuerte apoyo a la etiología genética alta . [23]
Medicamentos que influyen en la función tiroidea
Se ha asociado a ciertos medicamentos o fármacos con la alteración e interferencia de la función tiroidea. De estos fármacos, existen dos mecanismos principales de interferencia que pueden tener. [24]
Uno de los mecanismos de interferencia es cuando un fármaco altera las proteínas de transferencia sérica de la hormona tiroidea. [24] El estrógeno , el tamoxifeno , la heroína , la metadona , el clofibrato , el 5-fluorouracilo , el mitotano y la perfenazina aumentan la concentración de globulina transportadora de tiroides (TBG). [24] Los andrógenos , los esteroides anabólicos como el danazol , los glucocorticoides y el ácido nicotínico de liberación lenta disminuyen las concentraciones de TBG. La furosemida , el fenoflenac, el ácido mefenámico , los salicilatos , la fenitoína , el diazepam , las sulfonilureas , los ácidos grasos libres y la heparina interfieren en la unión de la hormona tiroidea a la TBG y/o la transtiretina . [24]
El otro mecanismo que pueden utilizar los medicamentos para interferir con la función tiroidea sería alterar el metabolismo extratiroideo de la hormona tiroidea. El propiltiouracilo, los glucocorticoides, el propranolol, los agentes de contraste ionizados, la amiodarona y la clomipramina inhiben la conversión de T4 y T3. [24] El fenobarbital, la rifampicina, la fenitoína y la carbamazepina aumentan el metabolismo hepático. [24] Finalmente, la colestriamina, el colestipol, el hidróxido de aluminio, el sulfato ferroso y el sucralfato son medicamentos que disminuyen la absorción de T4 o mejoran su excreción. [24]
Genes HLA
El primer locus genético asociado con la enfermedad tiroidea autoinmune fue la región del complejo mayor de histocompatibilidad (CMH) en el cromosoma 6p21. Codifica los HLA. Los alelos HLA específicos tienen una mayor afinidad por los péptidos tiroideos autoantigénicos y pueden contribuir al desarrollo de la enfermedad tiroidea autoinmune. Específicamente, en la enfermedad de Hashimoto, se ha demostrado la expresión aberrante de HLA II en los tirocitos. Pueden presentar autoantígenos tiroideos e iniciar la enfermedad tiroidea autoinmune. [25] Los alelos de susceptibilidad no son consistentes en la enfermedad de Hashimoto. En los caucásicos, se informa que varios alelos están asociados con la enfermedad, incluidos DR3, DR5 y DQ7. [26] [27]
Genes CTLA-4
Este gen es el segundo gen inmunorregulador más importante relacionado con la enfermedad tiroidea autoinmune. Los polimorfismos del gen CTLA-4 pueden contribuir a la reducción de la inhibición de la proliferación de células T y aumentar la susceptibilidad a la respuesta autoinmune. [28] CTLA-4 es un gen de susceptibilidad a los autoanticuerpos tiroideos importante. Se demostró un vínculo de la región CTLA-4 con la presencia de autoanticuerpos tiroideos mediante un análisis de ligamiento del genoma completo. [29] CTLA-4 se confirmó como el locus principal de los autoanticuerpos tiroideos. [30]
Gen de la proteína tirosina fosfatasa no receptora de tipo 22
El gen inmunorregulador PTPN22 identificado más recientemente y asociado con la enfermedad tiroidea autoinmune. Se encuentra en el cromosoma 1p13 y se expresa en los linfocitos. Actúa como regulador negativo de la activación de las células T. La mutación en este gen es un factor de riesgo para muchas enfermedades autoinmunes. Una señalización de células T más débil puede conducir a una eliminación deficiente de células T autorreactivas en el timo, y una mayor función de PTPN22 puede dar lugar a la inhibición de las células T reguladoras, que protegen contra la autoinmunidad. [31]
Genes relacionados con el sistema inmunológico
El IFN-γ promueve la citotoxicidad mediada por células contra la tiroides. Las mutaciones que causan una mayor producción de IFN-γ se asociaron con la gravedad del hipotiroidismo. [32] El hipotiroidismo grave se asocia con mutaciones que conducen a una menor producción de IL-4 (citocina Th2 que suprime la autoinmunidad mediada por células), [33] una menor secreción de TGF-β (inhibidor de la producción de citocinas), [34] y mutaciones de FoxP3, un factor regulador esencial para el desarrollo de las células Tregs. [35] El desarrollo de la enfermedad de Hashimoto se asoció con la mutación del gen de TNF-α (estimulador de la producción de IFN-γ), lo que provocó una mayor concentración de este gen. [36]
Se ha implicado a factores ambientales prevenibles, entre ellos la ingesta elevada de yodo, la deficiencia de selenio y las enfermedades infecciosas y ciertos medicamentos, en el desarrollo de la enfermedad tiroidea autoinmune en individuos genéticamente predispuestos. [37]
Yodo
La ingesta excesiva de yodo es un factor ambiental bien establecido que desencadena la autoinmunidad tiroidea. Se ha descubierto que los autoanticuerpos tiroideos son más frecuentes en áreas geográficas con niveles más altos de yodo en la dieta. Se han propuesto varios mecanismos por los cuales el yodo puede promover la autoinmunidad tiroidea. La exposición al yodo conduce a una mayor yodación de la tiroglobulina, lo que aumenta su inmunogenicidad al crear nuevos epítopos que contienen yodo o exponer epítopos crípticos. Puede facilitar la presentación por parte de las células APC, mejorar la afinidad de unión del receptor de células T y activar células T específicas. [38]
Se ha demostrado que la exposición al yodo aumenta el nivel de especies reactivas de oxígeno, que potencian la expresión de la molécula de adhesión intracelular-1 en las células foliculares tiroideas, lo que podría atraer a las células inmunocompetentes hacia la glándula tiroides. [39]
El yodo es tóxico para los tirocitos, ya que las especies de oxígeno altamente reactivas pueden unirse a los lípidos y proteínas de la membrana. Provoca daño a los tirocitos y la liberación de autoantígenos. El yodo también promueve la apoptosis de las células foliculares y tiene influencia sobre las células inmunes (aumento de la maduración de las células dendríticas, aumento del número de células T, estimulación de la producción de inmunoglobulina de las células B). [40] [41]
Los datos de la Investigación danesa sobre la ingesta de yodo y la enfermedad tiroidea muestran que en dos cohortes (hombres y mujeres) con deficiencia moderada y leve de yodo , los niveles de peroxidasa tiroidea y anticuerpos de tiroglobulina son más altos en las mujeres y las tasas de prevalencia de ambos anticuerpos aumentan con la edad. [42]
Sexo
Un estudio de gemelos daneses sanos divididos en tres grupos (pares de gemelos monocigóticos y dicigóticos del mismo sexo y pares de gemelos de sexo opuesto) estimó que la contribución genética a la susceptibilidad a los anticuerpos de peroxidasa tiroidea fue del 61% en los varones y del 72% en las mujeres, y la contribución a la susceptibilidad a los anticuerpos de tiroglobulina fue del 39% en los varones y del 75% en las mujeres. [43]
El alto predominio femenino en la autoinmunidad tiroidea puede estar asociado con el cromosoma X. Contiene genes relacionados con el sexo y el sistema inmunitario responsables de la tolerancia inmunitaria. [44] Se informó una mayor incidencia de autoinmunidad tiroidea en pacientes con una mayor tasa de monosomía del cromosoma X en los glóbulos blancos periféricos. [45]
Otro mecanismo potencial podría ser la inactivación sesgada del cromosoma X, lo que llevaría al escape de los autoantígenos ligados al cromosoma X de su presentación en el timo y a la pérdida de la tolerancia de las células T. [ cita requerida ]
Tener otras enfermedades autoinmunes es un factor de riesgo para desarrollar tiroiditis de Hashimoto, y lo opuesto también es cierto. [1] Las enfermedades autoinmunes más comúnmente asociadas con la tiroiditis de Hashimoto incluyen la enfermedad celíaca , la diabetes tipo 1 , el vitíligo y la alopecia . [46]
Los genes implicados varían en diferentes grupos étnicos y la incidencia es mayor en personas con trastornos cromosómicos, incluidos los síndromes de Turner , Down y Klinefelter , generalmente asociados con autoanticuerpos contra la tiroglobulina y la tiroperoxidasa . El agotamiento progresivo de estas células como respuesta inmunitaria citotóxica conduce a grados más altos de hipotiroidismo primario, que se presenta con niveles bajos de T3/T4 y elevaciones compensatorias de TSH. [ cita requerida ]
Fisiopatología
El mecanismo de la tiroiditis autoinmune no se entiende bien, pero se cree que se desarrolla como resultado de una interacción compleja de factores genéticos y ambientales. [47] Los autoanticuerpos tiroideos aparecen principalmente con la presencia de linfocitos en el órgano diana. [7] [48] Los linfocitos producen anticuerpos dirigidos a tres proteínas tiroideas diferentes: anticuerpos de peroxidasa tiroidea (TPOAb), anticuerpos de tiroglobulina (TgAb) y anticuerpos del receptor de la hormona estimulante de la tiroides (TRAb). [7] [49] Los ataques de anticuerpos en última instancia conducen al hipotiroidismo, que es causado por el reemplazo de células foliculares con tejido parenquimatoso. [50]
Los dos anticuerpos más comúnmente implicados en la tiroiditis autoinmune son los anticuerpos contra la peroxidasa tiroidea (TPOAb) y la tiroglobulina (TgAb). [47] Se plantea la hipótesis de que se desarrollan como resultado del daño tiroideo, donde los linfocitos T se sensibilizan a la peroxidasa tiroidea residual y la tiroglobulina, en lugar de ser la causa del daño tiroideo. [47] Sin embargo, pueden exacerbar una mayor destrucción de la tiroides al unirse al sistema del complemento y desencadenar la apoptosis de las células tiroideas. [47] Los factores ambientales que pueden predisponer a los pacientes a este tipo de desregulación inmunológica incluyen toxinas, medicamentos, factores dietéticos y agentes infecciosos. [22]
Algunos pacientes sanos o asintomáticos pueden dar positivo en más de uno de estos anticuerpos. Los médicos que atienden a estos pacientes probablemente los controlarán, ya que existe la posibilidad de que desarrollen algún tipo de disfunción con el tiempo. [49]
Se observan cambios morfológicos macroscópicos en la tiroides en el agrandamiento general, que es mucho más nodular e irregular a nivel local que los patrones más difusos (como el del hipertiroidismo ). Si bien la cápsula está intacta y la glándula en sí todavía se distingue del tejido circundante, el examen microscópico puede proporcionar una indicación más reveladora del nivel de daño. [51]
Patología


La patología macroscópica de una tiroides con tiroiditis autoinmune puede mostrar una tiroides agrandada simétricamente. [47] A menudo es de color más pálido, en comparación con el tejido tiroideo normal, que es de color marrón rojizo. [47] El examen microscópico mostrará infiltración de linfocitos y células plasmáticas. Los linfocitos son predominantemente linfocitos T con una representación de células CD4 positivas y CD8 positivas. [47] Las células plasmáticas son policlonales, con centros germinales presentes que se asemejan a la estructura de un ganglio linfático. [47] También se puede encontrar tejido fibroso en toda la tiroides afectada. [47] Generalmente, los hallazgos patológicos de la tiroides están relacionados con la cantidad de función tiroidea existente: cuanto mayor sea la infiltración y la fibrosis, menos probable será que un paciente tenga una función tiroidea normal. [47] En las últimas etapas de la enfermedad, la tiroides puede estar atrófica. [12]
Histológicamente, la hipersensibilidad se ve como una infiltración parenquimatosa difusa por linfocitos, particularmente células B plasmáticas , que a menudo se pueden ver como folículos linfoides secundarios (centros germinales, que no deben confundirse con los folículos llenos de coloides normalmente presentes que constituyen la tiroides). La atrofia de los cuerpos coloides está revestida por células de Hürthle , células con citoplasma granular intensamente eosinofílico , una metaplasia de las células cuboidales normales que constituyen el revestimiento de los folículos tiroideos. La atrofia tiroidea grave se presenta a menudo con bandas fibróticas más densas de colágeno que permanecen dentro de los confines de la cápsula tiroidea. [51]
También se caracteriza por la invasión del tejido tiroideo por leucocitos , principalmente linfocitos T. Una complicación rara pero grave es el linfoma de tiroides , generalmente del tipo de células B, el linfoma no Hodgkin . [52]
Diagnóstico

El diagnóstico se realiza generalmente detectando niveles elevados de anticuerpos antiperoxidasa tiroidea en el suero, pero también es posible la tiroiditis seronegativa (sin autoanticuerpos circulantes). [53] Una ecografía puede ser útil para detectar la tiroiditis de Hashimoto, especialmente en aquellos con tiroiditis seronegativa, debido a características clave detectadas en la ecografía de una persona con tiroiditis de Hashimoto, como "ecogenicidad, heterogeneidad, hipervascularidad y presencia de pequeños quistes". [54]
Se pueden elegir varias pruebas según los síntomas que se presenten. En el caso de los pacientes con tiroiditis autoinmune, si bien se sabe que muchos pacientes pueden tener anticuerpos circulantes antes de presentar síntomas, es posible que los pacientes acudan a sus médicos para una evaluación con síntomas de hipotiroidismo. [12] Los médicos suelen comenzar evaluando los síntomas informados y realizando un examen físico completo, que incluye un examen del cuello. [12]
Dados los síntomas relativamente inespecíficos del hipotiroidismo inicial, la tiroiditis de Hashimoto a menudo se diagnostica erróneamente como depresión , ciclotimia , síndrome premenstrual , síndrome de fatiga crónica , fibromialgia y, con menor frecuencia, como disfunción eréctil o un trastorno de ansiedad . En el examen macroscópico, a menudo se presenta un bocio duro que no es doloroso al tacto; [51] otros síntomas observados con hipotiroidismo, como mixedema periorbitario , dependen del estado actual de progresión de la respuesta, especialmente dado el desarrollo generalmente gradual de hipotiroidismo clínicamente relevante. Las pruebas de hormona estimulante de la tiroides (TSH), T3 libre, T4 libre y los anticuerpos antitiroglobulina (anti-Tg), anticuerpos antiperoxidasa tiroidea (anti-TPO o TPOAb) y anticuerpos antimicrosomales pueden ayudar a obtener un diagnóstico preciso. [55] Una evaluación temprana de la persona puede presentar niveles elevados de tiroglobulina debido a tirotoxicosis transitoria , ya que la inflamación dentro de la tiroides causa daño a la integridad del almacenamiento de tiroglobulina del folículo tiroideo; la secreción de TSH de la pituitaria anterior aumenta en respuesta a una disminución en la inhibición de retroalimentación negativa secundaria a la disminución de las hormonas tiroideas séricas. Por lo general, T4 es la prueba de hormona tiroidea preferida para el hipotiroidismo. [56] Se cree que esta exposición del cuerpo a cantidades sustanciales de enzimas tiroideas previamente aisladas contribuye a la exacerbación de la ruptura de la tolerancia, lo que da lugar a los síntomas más pronunciados que se observan más adelante en la enfermedad. La infiltración linfocítica de los tejidos asociados a los tirocitos a menudo conduce al hallazgo histológicamente significativo del desarrollo del centro germinal dentro de la glándula tiroides. [ cita requerida ]
Cuando la enfermedad de Hashimoto se presenta como manía, se la conoce como síndrome de Prasad, en honor a Ashok Prasad, el psiquiatra que la describió por primera vez. [57]
Valores de laboratorio
La evaluación diagnóstica inicial comenzará con la concentración plasmática de hormona estimulante de la tiroides (TSH). [16] Si está elevada, significa hipotiroidismo. [16] La elevación suele ser un aumento marcado por encima del rango normal y generalmente es mayor a 20 mg/dl. [18] Los niveles de T4 libre suelen estar reducidos, pero a veces pueden ser normales. [58]
Los médicos pueden comprobar los anticuerpos antitiroglobulina (TgAb) cada vez que se realiza una prueba de tiroglobulina para ver si el anticuerpo está interfiriendo. Los TgAb también pueden solicitarse a intervalos regulares después de que a una persona se le haya diagnosticado cáncer de tiroides y, al igual que los TPOAb, pueden estar asociados con la tiroiditis de Hashimoto. [49] Los valores de laboratorio complementarios más comunes en pacientes con tiroiditis autoinmune son TSH alta, T4 baja y anticuerpos TPO positivos. [58]
Ultrasonido

Cuando los pacientes tienen valores de laboratorio normales pero síntomas de tiroiditis autoinmune, la ecografía juega un papel en el diagnóstico. [16] Las imágenes obtenidas con ecografía pueden evaluar el tamaño de la tiroides y respaldar aún más el diagnóstico de tiroiditis autoinmune, revelar la presencia de nódulos o proporcionar pistas para el diagnóstico de otras afecciones tiroideas. [16] Una captación y exploración de tiroides con medicina nuclear también puede ser útil para diagnosticar la función tiroidea.
Tratamiento
Control de los niveles hormonales

El hipotiroidismo causado por la tiroiditis de Hashimoto se trata con agentes de reemplazo de la hormona tiroidea, como levotiroxina , triyodotironina o extracto de tiroides desecado . Una tableta tomada una vez al día generalmente mantiene los niveles de hormona tiroidea normales. En la mayoría de los casos, el tratamiento debe tomarse por el resto de la vida de la persona. Si el hipotiroidismo es causado por la tiroiditis de Hashimoto, se puede recomendar que los niveles de TSH se mantengan por debajo de 3,0 mIU / l. [59]
El estándar de atención es la terapia con levotiroxina , que es un medicamento oral estructurado como T4 endógeno. [47] La levotiroxina se puede dosificar en función del peso, más comúnmente, o la elevación de TSH. [47] Por lo general, la dosis prescrita varía de 1,6 mcg/kg a 1,8 mcg/kg, pero se puede ajustar en función de cada paciente. [12] Por ejemplo, la dosis se puede reducir para pacientes de edad avanzada o pacientes con ciertas afecciones cardíacas, pero se debe aumentar en pacientes embarazadas. [12] Se debe administrar en un horario constante. [47] Algunos pacientes eligen la terapia combinada con levotiroxina y liotironina , que es una T3 sintética, sin embargo, los estudios de terapia combinada son limitados. [47]
Los efectos secundarios de la terapia de reemplazo de tiroides están asociados con hipertiroidismo iatrogénico . [47] Los síntomas a tener en cuenta incluyen, entre otros, ansiedad, temblor, pérdida de peso, sensibilidad al calor, diarrea y dificultad para respirar. Los síntomas más preocupantes incluyen fibrilación auricular y pérdida de densidad ósea. [47]
Escucha
La hormona estimulante de la tiroides (TSH) es el valor de laboratorio de elección para controlar la respuesta al tratamiento con levotiroixina. [58] Cuando se inicia el tratamiento por primera vez, los niveles de TSH pueden controlarse con una frecuencia de cada 6 a 8 semanas. [58] Cada vez que se ajusta la dosis, los niveles de TSH pueden medirse con esa frecuencia hasta que se determine la dosis correcta. [58] Una vez que se haya ajustado a una dosis adecuada, los niveles de TSH se controlarán anualmente. [58]
Consideraciones sobre la cirugía
La cirugía no es el tratamiento de elección inicial para la enfermedad autoinmune, y la tiroiditis de Hashimoto no complicada no es una indicación para la tiroidectomía. [47] Los pacientes generalmente pueden hablar sobre la cirugía con su médico si experimentan síntomas de presión significativos o preocupaciones cosméticas, o tienen nódulos presentes en la ecografía. [47] Un estudio bien realizado de pacientes con síntomas generales problemáticos y con niveles de antitiroperoxidasa (anti-TPO) mayores de 1000 UI/ml (normal <100 UI/ml) mostró que la tiroidectomía total causó la resolución de los síntomas, pero hubo complicaciones posoperatorias en el 14%. [60]
Pronóstico
La disfunción tiroidea sintomática y manifiesta es la complicación más frecuente, y aproximadamente el 5% de las personas con hipotiroidismo subclínico y tiroiditis autoinmune crónica progresan a insuficiencia tiroidea cada año. A veces se producen períodos transitorios de tirotoxicosis (hiperactividad de la tiroides) y, en raras ocasiones, la enfermedad puede progresar a una enfermedad de Graves hipertiroidea completa con orbitopatía activa (ojos saltones e inflamados). Los casos raros de tiroiditis autoinmune fibrosa se presentan con disnea grave y dificultad para tragar , que se asemejan a los tumores tiroideos agresivos, pero estos síntomas siempre mejoran con cirugía o terapia con corticosteroides. Aunque el linfoma primario de células B de tiroides afecta a menos de una de cada 1000 personas, es más probable que afecte a quienes tienen tiroiditis autoinmune de larga duración, [61] ya que existe un riesgo de 67 a 80 veces mayor de desarrollar linfoma primario de tiroides en pacientes con tiroiditis de Hashimoto. [62]
Epidemiología
Se cree que el trastorno de tiroiditis de Hashimoto es la causa más común de hipotiroidismo primario en América del Norte. [51] Dentro de las tendencias descriptivas de la epidemiología en cuanto a persona, lugar y tiempo, se vuelve más claro cómo se desarrolla la tiroiditis de Hashimoto y cómo impacta en diferentes poblaciones.
La tiroiditis autoinmune es la causa más común de hipotiroidismo en entornos con suficiente yodo . [12] Se estima que afecta al 2% de la población mundial. [47] Puede afectar hasta al 5% de la población de los Estados Unidos. [63] Cualquier persona puede desarrollar esta enfermedad, pero la tiroiditis autoinmune afecta a las mujeres con más frecuencia que a los hombres en aproximadamente 10 veces. [47] La diferencia en la prevalencia entre los géneros se debe a los efectos de las hormonas sexuales . [22] La incidencia alcanza su pico en la quinta década de la vida, pero los pacientes generalmente son diagnosticados entre los 30 y los 50 años. [16] [63]
Alto consumo de yodo
La tiroiditis autoinmune tiene una mayor prevalencia en sociedades que tienen una mayor ingesta de yodo en su dieta, como Estados Unidos y Japón. Es la causa más común de hipotiroidismo en áreas con suficiente yodo. [12] Además, la tasa de infiltración linfocítica aumentó en áreas donde la ingesta de yodo alguna vez fue baja, pero aumentó debido a la suplementación con yodo. [7]
Edad
Se ha demostrado que "la prevalencia de pruebas positivas de anticuerpos tiroideos aumenta con la edad, con una frecuencia tan alta como 33 por ciento en mujeres de 70 años o más". [7] La incidencia alcanza su pico máximo en la quinta década de la vida y la prevalencia aumenta con la edad. [12] [63]
Tendencias de características personales
En general, la tiroiditis de Hashimoto afecta hasta al 2% de la población general. [23] Alrededor del 5% de los caucásicos desarrollarán tiroiditis de Hashimoto en algún momento de sus vidas. [4] En los EE. UU., la población afroamericana la padece con menos frecuencia, pero tiene una mayor mortalidad asociada. [64] También es menos frecuente en las poblaciones asiáticas. [65] Aproximadamente entre 1,0 y 1,5 de cada 1000 personas padecen esta enfermedad en algún momento. [51] Se presenta entre 8 y 15 veces más a menudo en mujeres que en hombres. Algunas investigaciones sugieren una conexión con el papel de la placenta como explicación de la diferencia de sexo. [66] Aunque puede presentarse a cualquier edad, incluso en niños, se observa con mayor frecuencia en mujeres de entre 30 y 60 años de edad. [61] La prevalencia más alta de un estudio se encontró en los miembros mayores de la comunidad. [67]
Las personas que ya padecen una enfermedad autoinmune tienen un mayor riesgo de desarrollar Hashimoto, ya que las enfermedades generalmente coexisten entre sí. [23] Las enfermedades comunes que coexisten con Hashimoto incluyen la enfermedad celíaca , la esclerosis múltiple , la diabetes tipo 1 , el vitíligo y la artritis reumatoide . [ cita requerida ]
El hipotiroidismo congénito afecta a 1 de cada 3500-4000 recién nacidos al nacer y es una versión de discapacidad intelectual que se puede tratar si se detecta a tiempo, pero puede ser difícil de diagnosticar dado que los síntomas son mínimos a una edad temprana. [67] El hipotiroidismo congénito generalmente es causado por defectos de la glándula tiroides, pero en la mayoría de los casos en Europa, Asia y África, la ingesta de yodo puede causar hipotiroidismo en los recién nacidos.
Influencia geográfica de las tendencias alimentarias
Las dietas que consisten en una ingesta baja o alta de yodo determinan el riesgo de una población de desarrollar trastornos relacionados con la tiroides. [68] Es más común en regiones con una ingesta dietética alta de yodo y entre personas que son genéticamente susceptibles. [61] La geografía juega un papel importante en qué regiones tienen acceso a dietas con bajo o alto contenido de yodo. Los niveles de yodo tanto en el agua como en la sal deben controlarse estrechamente para proteger a las poblaciones en riesgo de desarrollar hipotiroidismo. [69]
Las tendencias geográficas del hipotiroidismo varían en todo el mundo, ya que en cada lugar hay distintas formas de definir la enfermedad y de informar los casos. Las poblaciones dispersas o mal definidas pueden distorsionar los datos de forma inesperada. [23]
El trastorno por deficiencia de yodo (TDI) se combate aumentando el yodo en la dieta de una persona. Cuando se produce un cambio drástico en la dieta de una persona, aumenta el riesgo de desarrollar hipotiroidismo y otros trastornos de la tiroides. La lucha contra el TDI con una ingesta elevada de sal debe hacerse con cuidado y precaución, ya que el riesgo de Hashimoto puede aumentar. [68] Si se realizan modificaciones en la dieta, es importante utilizar el criterio de un médico para asegurarse de que los cambios en la dieta sean la mejor opción, ya que las recomendaciones pueden variar de persona a persona. [ cita requerida ]
Tendencias seculares
Las tendencias seculares del hipotiroidismo revelan cómo la enfermedad ha cambiado a lo largo del tiempo, dados los cambios en la tecnología y las opciones de tratamiento. Aunque la tecnología de ultrasonido y las opciones de tratamiento han mejorado, la incidencia del hipotiroidismo ha aumentado según los datos centrados en los EE. UU. y Europa. Entre 1993 y 2001, por cada 1000 mujeres, la enfermedad se encontró que variaba entre 3,9 y 4,89. Entre 1994 y 2001, por cada 1000 hombres, la enfermedad aumentó de 0,65 a 1,01. [67]
Los cambios en la definición del hipotiroidismo y las opciones de tratamiento modifican la incidencia y la prevalencia de la enfermedad en general. El tratamiento con levotiroxina es individualizado y, por lo tanto, permite que la enfermedad sea más manejable con el tiempo, pero no funciona como cura para la enfermedad. [23]
Historia
También conocida como enfermedad de Hashimoto, la tiroiditis de Hashimoto recibe su nombre del médico japonés Hakaru Hashimoto (1881−1934) de la facultad de medicina de la Universidad de Kyushu , [70] quien describió por primera vez los síntomas de las personas con estruma linfomatoso , una intensa infiltración de linfocitos dentro de la tiroides, en 1912 en la revista alemana llamada Archiv für Klinische Chirurgie . [3] [71] Este artículo estaba compuesto por 30 páginas y 5 ilustraciones que describían los cambios histológicos en el tejido tiroideo. Además, todos los resultados de su primer estudio se recopilaron de cuatro mujeres. Estos resultados explicaron las características patológicas observadas en estas mujeres, especialmente la infiltración de células linfoides y plasmáticas, así como la formación de folículos linfoides con centros germinales, fibrosis, células epiteliales tiroideas degeneradas y leucocitos en el lumen. [3] Describió estos rasgos como histológicamente similares a los de la enfermedad de Mikulic. Como se mencionó anteriormente, una vez que descubrió estos rasgos en esta nueva enfermedad, la denominó estruma linfomatoso. Esta enfermedad enfatizaba la infiltración de células linfoides y la formación de folículos linfoides con centros germinales, ninguno de los cuales se había informado previamente. [3]
A pesar del descubrimiento y publicación del Dr. Hashimoto, la enfermedad no fue reconocida como distinta de la tiroiditis de Reidel , que era una enfermedad común en ese momento en Europa. Aunque otros investigadores informaron y publicaron muchos otros artículos, el estruma linfomatoso de Hashimoto solo se reconoció como una fase temprana de la tiroiditis de Reidel a principios del siglo XX. No fue hasta 1931 que la enfermedad fue reconocida como una enfermedad por derecho propio, cuando los investigadores Allen Graham et al. de Cleveland informaron sobre sus síntomas y presentación de la misma manera detallada que Hakaru. [3]
En 1956, los doctores Rose y Witebsky pudieron demostrar que la inmunización de ciertos roedores con extractos de tiroides de otros roedores se parecía a la enfermedad que Hakaru y otros investigadores estaban tratando de describir. [3] Estos médicos también pudieron describir anticuerpos anti-tiroglobulina en muestras de suero sanguíneo de estos mismos animales. [ cita requerida ]
Más tarde, ese mismo año, investigadores del Hospital Middlesex de Londres pudieron realizar experimentos humanos en pacientes que presentaban síntomas similares. Purificaron el anticuerpo anti-tiroglobulina de su suero y pudieron concluir que estos pacientes enfermos tenían una reacción inmunológica a la tiroglobulina humana. [3] A partir de estos datos, se propuso que el estruma de Hashimoto podría ser una enfermedad autoinmune de la glándula tiroides.
En 1957, se reconoció como un trastorno autoinmune y fue el primer trastorno autoinmune específico de un órgano identificado. [14]
Tras este reconocimiento, los mismos investigadores del Hospital Middlesex publicaron en 1962 un artículo en The Lancet que incluía un retrato de Hakaru Hashimoto. [3] A partir de ese momento, la enfermedad se hizo más conocida y la enfermedad de Hashimoto empezó a aparecer con más frecuencia en los libros de texto. [ cita requerida ]
Desde esos descubrimientos, se han descubierto varias enfermedades autoinmunes, muchas de ellas relacionadas con anticuerpos específicos de la tiroides. [ cita requerida ]
Embarazo
Las mujeres embarazadas que son positivas para tiroiditis de Hashimoto pueden tener una función tiroidea disminuida o la glándula puede fallar por completo. [72] Si una mujer es TPOAb-positiva, los médicos pueden informarle de los riesgos para ella y su bebé si la enfermedad no se trata. "Los anticuerpos de peroxidasa tiroidea (TPOAb) se detectan en el 10% de las mujeres embarazadas", lo que presenta riesgos para esos embarazos. [72] Las mujeres que tienen una función tiroidea baja que no se ha estabilizado tienen un mayor riesgo de tener un bebé con: bajo peso al nacer, dificultad respiratoria neonatal, hidrocefalia , hipospadias , aborto espontáneo y parto prematuro. [72] [73] La tasa de trasplante de embriones y los resultados exitosos del embarazo mejoran cuando se trata la tiroiditis de Hashimoto. [73] Las recomendaciones son tratar a las mujeres embarazadas solo si son TPOAb-positivas durante la totalidad de sus embarazos y examinar a todas las mujeres embarazadas para detectar los niveles de tiroides. [72] La estrecha colaboración entre el endocrinólogo y el obstetra beneficia a la mujer y al bebé. [72] [74] [75] La Endocrine Society recomienda la detección en mujeres embarazadas que se consideran de alto riesgo de enfermedad autoinmune tiroidea. [76]
Se recomienda la prueba de anticuerpos contra peróxidos tiroideos para las mujeres que alguna vez estuvieron embarazadas, independientemente del resultado del embarazo. "[E]l embarazo previo desempeña un papel importante en el desarrollo de hipotiroidismo autoinmune manifiesto en mujeres premenopáusicas, y se debe tener en cuenta la cantidad de embarazos previos al evaluar el riesgo de hipotiroidismo en una mujer joven [ sic ]". [77]
Los cambios hormonales y la expresión de moléculas inmunomoduladoras clave en el trofoblasto conducen a la inmunosupresión y la tolerancia fetal. Los principales actores en la regulación de la respuesta inmune son las células Treg. Tanto las respuestas inmunes mediadas por células como las humorales se atenúan, lo que resulta en tolerancia inmune y supresión de la autoinmunidad. Se ha informado que durante el embarazo, los niveles de peroxidasa tiroidea y anticuerpos de tiroglobulina disminuyen. Después de dar a luz, las células Treg disminuyen rápidamente y las respuestas inmunes se restablecen. Puede conducir a la aparición o agravamiento de la enfermedad tiroidea autoinmune. [78] En hasta el 50% de las mujeres con anticuerpos de peroxidasa tiroidea en el embarazo temprano, la autoinmunidad tiroidea en el período posparto se exacerba en forma de tiroiditis posparto. [79] Se ha informado de una mayor secreción de IFN-γ e IL-4, y una menor concentración de cortisol plasmático durante el embarazo en mujeres con tiroiditis posparto que en mujeres sanas. Esto indica que una inmunosupresión más débil durante el embarazo podría contribuir a la disfunción tiroidea posparto. [80]
Microquimerismo fetal
Varios años después del parto, las células quiméricas masculinas pueden detectarse en la sangre periférica materna, la tiroides, los pulmones, la piel o los ganglios linfáticos. Las células inmunitarias fetales en la glándula tiroides materna pueden activarse y actuar como un desencadenante que puede iniciar o exacerbar la enfermedad tiroidea autoinmune. En pacientes con enfermedad de Hashimoto, se detectaron células microquiméricas fetales en la tiroides en cantidades significativamente mayores que en mujeres sanas. [81]
Otros organismos
La enfermedad de Hashimoto también se conoce en pollos ( Gallus domesticus ), [82] [83] ratas ( Rattus rattus ), [83] ratones ( Mus musculus ), [83] perros ( Canis familiaris ), [83] y titíes (Callitrichidae). [83]
Véase también
Referencias
- ^ abcdefghijklmnopq «Enfermedad de Hashimoto». NIDDK . Mayo de 2014. Archivado desde el original el 22 de agosto de 2016. Consultado el 9 de agosto de 2016 .
- ^ ab Noureldine SI, Tufano RP (enero de 2015). "Asociación de tiroiditis de Hashimoto y cáncer de tiroides". Current Opinion in Oncology . 27 (1): 21–25. doi :10.1097/cco.0000000000000150. PMID 25390557. S2CID 32109200.
- ^ abcdefghi Hiromatsu Y, Satoh H, Amino N (enero de 2013). "Tiroiditis de Hashimoto: historia y perspectivas futuras". Hormones . 12 (1): 12–18. doi :10.1007/BF03401282. PMID 23624127. S2CID 38996783.
- ^ abcde Pyzik A, Grywalska E, Matyjaszek-Matuszek B, Roliński J (2015). "Trastornos inmunológicos en la tiroiditis de Hashimoto: ¿qué sabemos hasta ahora?". Journal of Immunology Research . 2015 : 979167. doi : 10.1155/2015/979167 . PMC 4426893. PMID 26000316 .
- ^ abcde Akamizu T, Amino N, Feingold KR, Anawalt B, Boyce A, Chrousos G, de Herder WW, Dungan K, Grossman A, Hershman JM, Hofland J, Kaltsas G, Koch C, Kopp P, Korbonits M, McLachlan R , Morley JE, New M, Purnell J, Singer F, Stratakis CA, Trence DL, Wilson DP (2000). "Tiroiditis de Hashimoto". En Akamizu T, Amino N (eds.). Endotexto. MDTexto. PMID 25905412. Archivado desde el original el 24 de septiembre de 2020 . Consultado el 31 de enero de 2021 .
- ^ "Enfermedad de Hashimoto". Oficina de Salud de la Mujer, Departamento de Salud y Servicios Humanos de EE. UU. 12 de junio de 2017. Archivado desde el original el 28 de julio de 2017 . Consultado el 17 de julio de 2017 .
 Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público .
Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público . - ^ abcdef Dayan Dayan, Colin M, Dayan, Colin M., Gilbert H. Daniels (1996). "Tiroiditis autoinmune crónica". The New England Journal of Medicine . 335 (2): 99–107. doi :10.1056/nejm199607113350206. PMID 8649497.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ "Tiroiditis autoinmune". Autoimmune Registry Inc. Archivado desde el original el 25 de febrero de 2020. Consultado el 15 de junio de 2022 .
- ^ "Enfermedad de Hashimoto | NIDDK". Instituto Nacional de Diabetes y Enfermedades Digestivas y Renales . Archivado desde el original el 8 de diciembre de 2021. Consultado el 28 de noviembre de 2021 .
- ^ "Tiroiditis de Hashimoto: trastornos endocrinos y metabólicos". Manual Merck, edición profesional . Julio de 2016. Archivado desde el original el 31 de diciembre de 2017. Consultado el 30 de diciembre de 2017 .
- ^ "Tiroiditis de Hashimoto: trastornos hormonales y metabólicos". Manual Merck, versión para el consumidor . Archivado desde el original el 30 de diciembre de 2017. Consultado el 30 de diciembre de 2017 .
- ^ abcdefghijkl Mincer DL, Jialal I (2022), "Tiroiditis de Hashimoto", StatPearls , Treasure Island (FL): StatPearls Publishing, PMID 29083758, archivado desde el original el 4 de octubre de 2023 , consultado el 23 de enero de 2023
- ^ Shoenfeld Y, Cervera R, Gershwin ME, eds. (2010). Criterios de diagnóstico en enfermedades autoinmunes. Springer Science & Business Media. pág. 216. ISBN 978-1-60327-285-8.
- ^ ab Moore EA, Wilkinson S (2009). La promesa de la terapia con naltrexona en dosis bajas: posibles beneficios en el cáncer y en trastornos autoinmunes, neurológicos e infecciosos. McFarland. pág. 30. ISBN 978-0-7864-5258-3.
- ^ "Enfermedad de Hashimoto: síntomas y causas". Mayo Clinic . Archivado desde el original el 29 de octubre de 2018. Consultado el 5 de octubre de 2018 .
- ^ abcdefgh «Enfermedad de Hashimoto | NIDDK». Instituto Nacional de Diabetes y Enfermedades Digestivas y Renales . Archivado desde el original el 8 de diciembre de 2021. Consultado el 23 de enero de 2023 .
- ^ "Hoja informativa sobre la enfermedad de Hashimoto". Oficina de Salud de la Mujer, Departamento de Salud y Servicios Humanos de EE. UU., womenshealth.gov (o girlshealth.gov). 16 de julio de 2012. Archivado desde el original el 2 de diciembre de 2014 . Consultado el 23 de noviembre de 2014 .
- ^ abcdef Singh S, Clutter WE (2020). The Washington Manual®, The Endocrinology - Subspecialty Consult (4.ª ed.). Filadelfia, Pensilvania: Lippincott Williams & Wilkins. págs. 70–76. ISBN 978-1-9751-1333-9.
- ^ Página 56 en: Staecker H, Van De Water TR (2006). Otorrinolaringología: ciencia básica y revisión clínica . Stuttgart: Thieme. ISBN 978-0-86577-901-3.
- ^ "Patogénesis de la tiroiditis de Hashimoto (tiroiditis autoinmune crónica)". UpToDate . Archivado desde el original el 5 de diciembre de 2020 . Consultado el 19 de julio de 2019 .
- ^ Mincer DL, Jialal I (2019). "Tiroiditis de Hashimoto". NCBI StatPearls . PMID 29083758. Archivado desde el original el 23 de noviembre de 2019. Consultado el 19 de julio de 2019 .
- ^ abcd Weetman AP (2021). La tiroides de Werner e Ingbar: un texto fundamental y clínico (11.ª ed.). Filadelfia, Pensilvania: Lippincott Williams & Wilkins. págs. 531–541. ISBN 978-1-975112-96-7.
- ^ abcde Chistiakov DA (marzo de 2005). "Inmunogenética de la tiroiditis de Hashimoto". Journal of Autoimmune Diseases . 2 (1): 1. doi : 10.1186/1740-2557-2-1 . PMC 555850 . PMID 15762980.
- ^ abcdefg Surks MI, Sievert R (diciembre de 1995). Wood AJ (ed.). "Fármacos y función tiroidea". The New England Journal of Medicine . 333 (25): 1688–1694. doi :10.1056/NEJM199512213332507. PMID 7477223.
- ^ Jacobson EM, Huber A, Tomer Y (2008). "El complejo de genes HLA en la autoinmunidad tiroidea: de la epidemiología a la etiología". Journal of Autoimmunity . 30 (1–2): 58–62. doi :10.1016/j.jaut.2007.11.010. PMC 2244911 . PMID 18178059.
- ^ Tandon N, Zhang L, Weetman AP (mayo de 1991). "Asociaciones de HLA con tiroiditis de Hashimoto". Endocrinología clínica . 34 (5): 383–386. doi :10.1111/j.1365-2265.1991.tb00309.x. PMID 1676351. S2CID 28987581.
- ^ Bogner U, Badenhoop K, Peters H, Schmieg D, Mayr WR, Usadel KH, Schleusener H (enero de 1992). "Variación del gen HLA-DR/DQ en tiroiditis autoinmune no bocio a nivel serológico y molecular". Autoinmunidad . 14 (2): 155-158. doi :10.3109/08916939209083135. PMID 1363895.
- ^ Zaletel K, Gaberšček S (diciembre de 2011). "Tiroiditis de Hashimoto: de los genes a la enfermedad". Current Genomics . 12 (8): 576–588. doi :10.2174/138920211798120763. PMC 3271310 . PMID 22654557.
- ^ Tomer Y, Greenberg DA, Barbesino G, Concepcion E, Davies TF (abril de 2001). "CTLA-4 y no CD28 es un gen de susceptibilidad para la producción de autoanticuerpos tiroideos". The Journal of Clinical Endocrinology and Metabolism . 86 (4): 1687–1693. doi : 10.1210/jcem.86.4.7372 . PMID 11297604.
- ^ Ban Y, Davies TF, Greenberg DA, Kissin A, Marder B, Murphy B, et al. (diciembre de 2003). "Análisis de los genes CTLA-4, CD28 y coestimulador inducible (ICOS) en la enfermedad tiroidea autoinmune". Genes and Immunity . 4 (8): 586–593. doi :10.1038/sj.gene.6364018. PMID 14647199. S2CID 6920190.
- ^ Burn GL, Svensson L, Sanchez-Blanco C, Saini M, Cope AP (diciembre de 2011). "¿Por qué PTPN22 es un buen candidato como gen de susceptibilidad para enfermedades autoinmunes?". FEBS Letters . 585 (23): 3689–3698. doi : 10.1016/j.febslet.2011.04.032 . PMID 21515266. S2CID 21572847.
- ^ Ito C, Watanabe M, Okuda N, Watanabe C, Iwatani Y (agosto de 2006). "Asociación entre la gravedad de la enfermedad de Hashimoto y el polimorfismo funcional +874A/T en el gen del interferón gamma". Endocrine Journal . 53 (4): 473–478. doi : 10.1507/endocrj.k06-015 . PMID 16820703.
- ^ Nanba T, Watanabe M, Akamizu T, Iwatani Y (marzo de 2008). "El genotipo -590CC en el gen IL4 como un fuerte factor predictivo del desarrollo de hipotiroidismo en la enfermedad de Hashimoto". Química clínica . 54 (3): 621–623. doi :10.1373/clinchem.2007.099739. PMID 18310157.
- ^ Yamada H, Watanabe M, Nanba T, Akamizu T, Iwatani Y (marzo de 2008). "El polimorfismo +869T/C en el gen del factor de crecimiento transformante beta1 está asociado con la gravedad y la intratabilidad de la enfermedad tiroidea autoinmune". Inmunología clínica y experimental . 151 (3): 379–382. doi :10.1111/j.1365-2249.2007.03575.x. PMC 2276968 . PMID 18190611.
- ^ Inoue N, Watanabe M, Morita M, Tomizawa R, Akamizu T, Tatsumi K, et al. (diciembre de 2010). "Asociación de polimorfismos funcionales relacionados con el nivel transcripcional de FOXP3 con el pronóstico de enfermedades tiroideas autoinmunes". Inmunología clínica y experimental . 162 (3): 402–406. doi :10.1111/j.1365-2249.2010.04229.x. PMC 3026543 . PMID 20942809.
- ^ Inoue N, Watanabe M, Nanba T, Wada M, Akamizu T, Iwatani Y (mayo de 2009). "Participación de polimorfismos funcionales en el gen TNFA en la patogénesis de enfermedades tiroideas autoinmunes y producción de anticuerpos antirreceptor de tirotropina". Inmunología clínica y experimental . 156 (2): 199–204. doi :10.1111/j.1365-2249.2009.03884.x. PMC 2759465 . PMID 19250279.
- ^ Saranac L, Zivanovic S, Bjelakovic B, Stamenkovic H, Novak M, Kamenov B (2011). "¿Por qué la tiroides es tan propensa a las enfermedades autoinmunes?". Investigación hormonal en pediatría . 75 (3): 157–165. doi : 10.1159/000324442 . PMID 21346360.
- ^ Rose NR, Bonita R, Burek CL (febrero de 2002). "Yodo: un desencadenante ambiental de la tiroiditis". Autoimmunity Reviews . 1 (1–2): 97–103. CiteSeerX 10.1.1.326.5700 . doi :10.1016/s1568-9972(01)00016-7. PMID 12849065.
- ^ Burek CL, Talor MV (noviembre de 2009). "Desencadenantes ambientales de la tiroiditis autoinmune". Journal of Autoimmunity . 33 (3–4): 183–189. doi :10.1016/j.jaut.2009.09.001. PMC 2790188 . PMID 19818584.
- ^ Fountoulakis S, Philippou G, Tsatsoulis A (enero de 2007). "El papel del yodo en la evolución de la enfermedad tiroidea en Grecia: del bocio endémico a la autoinmunidad tiroidea". Hormones . 6 (1): 25–35. PMID 17324915.
- ^ Yu X, Li L, Li Q, Zang X, Liu Z (noviembre de 2011). "TRAIL y DR5 promueven la apoptosis de células foliculares tiroideas en la tiroiditis autoinmune experimental inducida por exceso de yodo en ratones NOD". Biological Trace Element Research . 143 (2): 1064–1076. doi :10.1007/s12011-010-8941-5. PMID 21225479. S2CID 10926594.
- ^ Pedersen IB, Knudsen N, Jørgensen T, Perrild H, Ovesen L, Laurberg P (enero de 2003). "Autoanticuerpos de peroxidasa tiroidea y tiroglobulina en un estudio amplio de poblaciones con deficiencia de yodo leve y moderada". Endocrinología clínica . 58 (1): 36–42. doi :10.1046/j.1365-2265.2003.01633.x. PMID 12519410. S2CID 23758580.
- ^ Hansen PS, Brix TH, Iachine I, Kyvik KO, Hegedüs L (enero de 2006). "La importancia relativa de los efectos genéticos y ambientales para las primeras etapas de la autoinmunidad tiroidea: un estudio de gemelos daneses sanos". Revista Europea de Endocrinología . 154 (1): 29–38. doi :10.1530/eje.1.02060. PMID 16381988. S2CID 25372591.
- ^ McCombe PA, Greer JM, Mackay IR (diciembre de 2009). "Dimorfismo sexual en enfermedades autoinmunes". Medicina molecular actual . 9 (9): 1058–1079. doi :10.2174/156652409789839116. PMID 19747114.
- ^ Invernizzi P, Miozzo M, Selmi C, Persani L, Battezzati PM, Zuin M, et al. (Julio de 2005). "Monosomía del cromosoma X: un mecanismo común para las enfermedades autoinmunes". Revista de Inmunología . 175 (1): 575–578. doi : 10.4049/jimmunol.175.1.575 . PMID 15972694. S2CID 40557667.
- ^ Radetti G (2014). "Aspectos clínicos de la tiroiditis de Hashimoto". Tiroidología Pediátrica . Desarrollo endocrino. vol. 26. págs. 158-170. doi :10.1159/000363162. ISBN 978-3-318-02720-4. Número de identificación personal 25231451.
- ^ abcdefghijklmnopqrst Ramos-Levi AM, Marazuela M (2023). Endocrinología, ciencia básica y práctica clínica de DeGroot (8ª ed.). Filadelfia, PA: Elsevier. págs. 1214-1233. ISBN 978-0-323694124.
- ^ Weetman AP, AM McGregor, H. Lazarus, R. Hall (abril de 1982). "Los anticuerpos tiroideos son producidos por linfocitos derivados de la tiroides". Clin Exp Immunol . 48 (1): 196–200. PMC 1536583. PMID 7044629 .
- ^ abc «Anticuerpos tiroideos». Archivado desde el original el 19 de julio de 2011. Consultado el 4 de abril de 2012 .
- ^ Berghi N (2017). "Mecanismos inmunológicos implicados en la patogénesis de la urticaria crónica y la tiroiditis de Hashimoto". Revista iraní de alergia, asma e inmunología . 16 (4): 358–366. PMID 28865416. Archivado desde el original el 19 de abril de 2021. Consultado el 3 de diciembre de 2020 .
- ^ abcde Maitra A (2014). "El sistema endocrino". En Kumar V, Abbas AK, Aster JC (eds.). Robbins y Cotran Pathologic Basis of Disease . Elsevier Health Sciences. págs. 1073–1140. ISBN 978-0-323-29635-9.
- ^ Dayan CM, Daniels GH (julio de 1996). "Tiroiditis autoinmune crónica". The New England Journal of Medicine . 335 (2): 99–107. doi :10.1056/NEJM199607113350206. PMID 8649497.
- ^ Grani G, Carbotta G, Nesca A, D'Alessandri M, Vitale M, Del Sordo M, Fumarola A (junio de 2015). "Una puntuación integral para diagnosticar la tiroiditis de Hashimoto: una propuesta". Endocrino . 49 (2): 361–365. doi :10.1007/s12020-014-0441-5. PMID 25280964. S2CID 23026213.
- ^ Klubo-Gwiezdzinska J, Wartofsky L (30 de marzo de 2022). "Tiroiditis de Hashimoto: una guía basada en evidencia sobre etiología, diagnóstico y tratamiento". Archivos Polacos de Medicina Interna . 132 (3): 16222. doi :10.20452/pamw.16222. ISSN 0032-3772. PMC 9478900. PMID 35243857 .
- ^ Giannini AJ (1986). Los fundamentos biológicos de la psiquiatría clínica . New Hyde Park, Nueva York: Medical Examination Publishing Company. págs. 193-198. ISBN. 978-0-87488-449-4.
- ^ Tiroiditis de Hashimoto: evaluación en eMedicine
- ^ Weiner MJ, Kennedy C (marzo de 1988). "Síndrome de Prasad". The British Journal of Psychiatry . 152 (3): 438–439. doi : 10.1192/bjp.152.3.438b . PMID 3167392.
- ^ abcdef «Tiroiditis de Hashimoto». Asociación Estadounidense de la Tiroides . Archivado desde el original el 23 de septiembre de 2023. Consultado el 23 de enero de 2023 .
- ^ "¿Conoce su médico los nuevos estándares de laboratorio de TSH?" Archivado desde el original el 4 de diciembre de 2010.
- ^ Guldvog I y otros. Anales de Medicina Interna 2019; 21: 161-167.
- ^ abc Monaco F (2012). Enfermedades de la tiroides . Taylor y Francis. pág. 78. ISBN 978-1-4398-6839-3.
- ^ Noureldine SI, Tufano RP (enero de 2015). "Asociación de tiroiditis de Hashimoto y cáncer de tiroides". Current Opinion in Oncology . 27 (1): 21–25. doi :10.1097/CCO.0000000000000150. PMID 25390557. S2CID 32109200.
- ^ abc Biddinger PW (2020). Patología diagnóstica y genética molecular de la tiroides: una guía completa para la práctica de la patología tiroidea (3.ª ed.). Filadelfia, PA: Lippincott Williams & Wilkins. págs. 59–72. ISBN 978-1-4963-9653-2.
- ^ Boyles S (23 de mayo de 2013). "El hipotiroidismo aumenta el riesgo de muerte en los negros". MedPage Today .
- ^ McLeod DS, Caturegli P, Cooper DS, Matos PG, Hutfless S (abril de 2014). "Variación en las tasas de enfermedad tiroidea autoinmune por raza/etnia en personal militar estadounidense". JAMA . 311 (15): 1563–1565. doi :10.1001/jama.2013.285606. PMID 24737370.
- Resumen para legos en: McLeod DS (15 de abril de 2014). "El riesgo de enfermedad tiroidea varía entre negros, asiáticos y blancos". JAMA Network .
- ^ Natri H, Garcia AR, Buetow KH, Trumble BC, Wilson MA (julio de 2019). "El dilema del embarazo: la compensación inmunitaria evolucionada debida al embarazo subyace a las diferencias sexuales en las enfermedades humanas". Tendencias en genética . 35 (7): 478–488. doi :10.1016/j.tig.2019.04.008. PMC 6611699 . PMID 31200807.
- ^ abc Vanderpump MP (1 de septiembre de 2011). "La epidemiología de la enfermedad tiroidea". British Medical Bulletin . 99 (1): 39–51. doi :10.1093/bmb/ldr030. PMID 21893493.
- ^ ab Khattak RM, Ittermann T, Nauck M, Below H, Völzke H (2016). "Monitoreo de la prevalencia de trastornos tiroideos en la población adulta del noreste de Alemania". Métricas de salud poblacional . 14 : 39. doi : 10.1186/s12963-016-0111-3 . PMC 5101821. PMID 27833458 .
- ^ Katagiri R, Yuan X, Kobayashi S, Sasaki S (10 de marzo de 2017). "Efecto de la ingesta excesiva de yodo en las enfermedades tiroideas en diferentes poblaciones: una revisión sistemática y metanálisis que incluyen estudios observacionales". PLOS ONE . 12 (3): e0173722. Bibcode :2017PLoSO..1273722K. doi : 10.1371/journal.pone.0173722 . PMC 5345857 . PMID 28282437.
- ^ Hakaru Hashimoto en ¿Quién le puso nombre?
- ^ Hashimoto H (1912). "Zur Kenntnis der linfomatösen Veränderung der Schilddrüse (Struma linfomatosa)" [Conocimiento de los cambios linfomatosos en la glándula tiroides (bocio linfomatoso)]. Archiv für Klinische Chirurgie (en alemán). 97 : 219–248. NAID 10005555208.
- ^ abcde Lepoutre T, Debiève F, Gruson D, Daumerie C (1 de enero de 2012). "Reducción de abortos espontáneos mediante la detección y el tratamiento universales de enfermedades autoinmunes tiroideas". Investigación ginecológica y obstétrica . 74 (4): 265–273. doi :10.1159/000343759. PMID 23147711. S2CID 1646888.
- ^ ab Gaberšček S, Zaletel K (septiembre de 2011). "Fisiología tiroidea y autoinmunidad en el embarazo y después del parto". Expert Review of Clinical Immunology . 7 (5): 697–706, cuestionario 707. doi : 10.1586/eci.11.42 . PMID 21895480.
- ^ Budenhofer BK, Ditsch N, Jeschke U, Gärtner R, Toth B (enero de 2013). "(Dis)función tiroidea en el embarazo normal y alterado". Archivos de ginecología y obstetricia . 287 (1): 1–7. doi :10.1007/s00404-012-2592-z. PMID 23104052. S2CID 24969196. Archivado desde el original el 23 de enero de 2022. Consultado el 16 de enero de 2022 .
- ^ Balucan FS, Morshed SA, Davies TF (2013). "Autoanticuerpos tiroideos en el embarazo: su función, regulación y relevancia clínica". Journal of Thyroid Research . 2013 : 182472. doi : 10.1155/2013/182472 . PMC 3652173 . PMID 23691429.
- ^ "Expertos en endocrinología apoyan la detección de disfunción tiroidea en mujeres embarazadas". Endocrine Society . 26 de marzo de 2015. Archivado desde el original el 8 de octubre de 2015 . Consultado el 4 de octubre de 2015 .
- ^ Carlé A, Pedersen IB, Knudsen N, Perrild H, Ovesen L, Rasmussen LB, Laurberg P (junio de 2014). "El desarrollo de hipotiroidismo autoinmune manifiesto está altamente asociado con nacimientos vivos y abortos inducidos, pero solo en mujeres premenopáusicas". The Journal of Clinical Endocrinology and Metabolism . 99 (6): 2241–2249. doi : 10.1210/jc.2013-4474 . PMID 24694338.
- ^ Weetman AP (junio de 2010). "Inmunidad, función tiroidea y embarazo: mecanismos moleculares". Nature Reviews. Endocrinology . 6 (6): 311–318. doi :10.1038/nrendo.2010.46. PMID 20421883. S2CID 9900120.
- ^ Lazarus JH (marzo de 2011). "La saga continua de la tiroiditis posparto". The Journal of Clinical Endocrinology and Metabolism . 96 (3): 614–616. doi : 10.1210/jc.2011-0091 . PMID 21378224.
- ^ Kokandi AA, Parkes AB, Premawardhana LD, John R, Lazarus JH (marzo de 2003). "Asociación de la disfunción tiroidea posparto con cambios hormonales e inmunológicos anteparto". The Journal of Clinical Endocrinology and Metabolism . 88 (3): 1126–1132. doi : 10.1210/jc.2002-021219 . PMID 12629095.
- ^ Koopmans M, Kremer Hovinga IC, Baelde HJ, Harvey MS, de Heer E, Bruijn JA, Bajema IM (junio de 2008). "El quimerismo se produce en tiroides, pulmones, piel y ganglios linfáticos de mujeres con hijos varones". Revista de Inmunología Reproductiva . 78 (1): 68–75. doi :10.1016/j.jri.2008.01.002. PMID 18329105.
- ^ Wick G, Möst J, Schauenstein K, Krömer G, Dietrich H, Ziemiecki A, Fässler R, Schwarz S, Eu N, Hálaa K (1985). "Tiroiditis autoinmune espontánea: una vista panorámica". Inmunología hoy . 12 (6). Elsevier Science Publishers BV : 359–64. doi :10.1016/0167-5699(85)90095-7. PMID 25291225. S2CID 8191727. Archivado desde el original el 29 de diciembre de 2022 . Consultado el 29 de diciembre de 2022 .
- ^ abcde McLachlan S, Alpi K, Rapoport B (2011). "Revisión e hipótesis: ¿Se desarrolla la enfermedad de Graves en grandes simios no humanos?". Inmunología, autoinmunidad y oftalmopatía de Graves. Tiroides . 21 (12). Mary Ann Liebert, Inc. ( Asociación Estadounidense de Tiroides (ATA)): 1359–1366. doi :10.1089/thy.2011.0209. PMC 3229821. PMID 22066476 .