Estreptococo
| Estreptococo | |
|---|---|
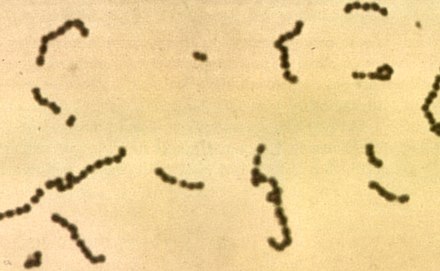 | |
| Clasificación científica | |
| Dominio: | Bacteria |
| Filo: | Bacillota |
| Clase: | Bacilos |
| Orden: | Lactobacilos |
| Familia: | Estreptococos |
| Género: | Estreptococo Rosenbach , 1884 |
| Especies [1] | |
| |
Streptococcus es un género de bacterias grampositivas ( pl.: cocos ) o esféricas que pertenece a la familia Streptococcaceae , dentro del orden Lactobacillales (bacterias del ácido láctico), en el filo Bacillota . [2] La división celular en los estreptococos ocurre a lo largo de un solo eje , por lo que cuando crecen tienden a formar pares o cadenas, que pueden aparecer dobladas o retorcidas. Esto difiere de los estafilococos , que se dividen a lo largo de múltiples ejes, generando así racimos de células irregulares, similares a uvas. La mayoría de los estreptococos son oxidasa-negativos y catalasa-negativos , y muchos son anaerobios facultativos (capaces de crecer tanto aeróbicamente como anaeróbicamente).
El término fue acuñado en 1877 por el cirujano vienés Albert Theodor Billroth (1829-1894), [3] combinando el prefijo "strepto-" (del griego antiguo : στρεπτός , romanizado : streptós , lit. 'fácilmente retorcido, flexible' [4] ), junto con el sufijo "-coccus" (del latín moderno : coccus , del griego antiguo: κόκκος , romanizado: kókkos , lit. 'grano, semilla, baya'. [5] ) En 1984, muchas bacterias anteriormente agrupadas en el género Streptococcus se separaron en los géneros Enterococcus y Lactococcus . [6] Actualmente, se reconocen más de 50 especies en este género. Se ha descubierto que este género forma parte del microbioma salival . [7]
Patogenia y clasificación
Además de la faringitis estreptocócica (faringitis estreptocócica), ciertas especies de Streptococcus son responsables de muchos casos de conjuntivitis , [8] meningitis , neumonía bacteriana , endocarditis , erisipela y fascitis necrosante (las infecciones bacterianas "carnívoras"). Sin embargo, muchas especies de estreptococos no son patógenas y forman parte de la microbiota humana comensal de la boca, la piel, el intestino y el tracto respiratorio superior. Los estreptococos también son un ingrediente necesario en la producción de queso emmental ("suizo") . [9]
Las especies de estreptococos se clasifican en función de sus propiedades hemolíticas . [10] Las especies alfa-hemolíticas provocan la oxidación del hierro en las moléculas de hemoglobina dentro de los glóbulos rojos, lo que le da un color verdoso en agar sangre. Las especies beta-hemolíticas provocan la ruptura completa de los glóbulos rojos. En agar sangre, esto aparece como amplias áreas libres de células sanguíneas que rodean las colonias bacterianas. Las especies gamma-hemolíticas no provocan hemólisis. [11]
Los estreptococos beta-hemolíticos se clasifican además mediante el agrupamiento de Lancefield , una clasificación de serotipos (es decir, que describe los carbohidratos específicos presentes en la pared celular bacteriana). [6] Los 21 serotipos descritos se denominan grupos de Lancefield A a W (excluidos E, I y J). Este sistema de clasificación fue desarrollado por Rebecca Lancefield , científica de la Universidad Rockefeller . [12]
En el ámbito médico, los grupos más importantes son los estreptococos alfa-hemolíticos de los grupos S. pneumoniae y Streptococcus viridans , y los estreptococos beta-hemolíticos de los grupos Lancefield A y B (también conocidos como "estreptococos del grupo A" y "estreptococos del grupo B").
Tabla: Estreptococos de relevancia médica [10]
| Especies | Anfitrión | Enfermedad |
|---|---|---|
| S. pyogenes | humano | faringitis , celulitis , erisipela |
| S. agalactiae | humano, ganado | Meningitis y sepsis neonatal |
| S. dysgalactiae | humano, animales | endocarditis , bacteriemia , neumonía , meningitis , infecciones respiratorias |
| S. gallolyticus | humano, animales | Infecciones del tracto biliar o urinario , endocarditis. |
| Sanguinaria anginosus | humano, animales | Abscesos subcutáneos/orgánicos , meningitis , infecciones respiratorias |
| S. sanguinis | humano | endocarditis, caries dental |
| S. suis | cerdo | meningitis |
| S. mitis | humano | endocarditis |
| S. mutans | humano | caries dental |
| S. pneumoniae | humano | neumonía |
Alfa-hemolítico
Cuando hay alfa-hemólisis (α-hemólisis), el agar debajo de la colonia se verá oscuro y verdoso debido a la conversión de hemoglobina en biliverdina verde . Streptococcus pneumoniae y un grupo de estreptococos orales ( Streptococcus viridans o estreptococos viridans) presentan alfa-hemólisis. La alfa-hemólisis también se denomina hemólisis incompleta o hemólisis parcial porque las membranas celulares de los glóbulos rojos quedan intactas. A esto también se le llama a veces hemólisis verde debido al cambio de color en el agar. [ cita requerida ]
Neumococos
- S. pneumoniae (a veces llamado neumococo) es una de las principales causas de neumonía bacteriana y, ocasionalmente, de otitis media , sinusitis , meningitis y peritonitis . Se cree que la inflamación es la principal causa de la enfermedad causada por los neumococos, de ahí la tendencia de los diagnósticos asociados a ellos a implicar inflamación. No poseen antígenos de Lancefield. [2]
El grupo viridans: alfa-hemolítico
- Los estreptococos viridans son un gran grupo de bacterias comensales que son alfa-hemolíticas , produciendo una coloración verde en las placas de agar sangre (de ahí el nombre "viridans", del latín vĭrĭdis , verde), o no hemolíticas. No poseen antígenos de Lancefield. [2]
Beta-hemolítico
La beta-hemólisis (β-hemólisis), a veces llamada hemólisis completa , es una lisis completa de los glóbulos rojos en el medio alrededor y debajo de las colonias: el área aparece aclarada (amarilla) y transparente. La estreptolisina, una exotoxina, es la enzima producida por la bacteria que causa la lisis completa de los glóbulos rojos. Hay dos tipos de estreptolisina: estreptolisina O (SLO) y estreptolisina S (SLS). La estreptolisina O es una citotoxina sensible al oxígeno, secretada por la mayoría de los estreptococos del grupo A (GAS), e interactúa con el colesterol en la membrana de las células eucariotas (principalmente glóbulos rojos y blancos, macrófagos y plaquetas), y generalmente da como resultado beta-hemólisis debajo de la superficie del agar sangre. La estreptolisina S es una citotoxina estable al oxígeno también producida por la mayoría de las cepas de GAS que da como resultado un aclaramiento en la superficie del agar sangre. El SLS afecta a las células inmunitarias, incluidos los leucocitos polimorfonucleares y los linfocitos, y se cree que impide que el sistema inmunitario del huésped elimine la infección. Streptococcus pyogenes , o GAS, presenta betahemólisis.
Algunas especies débilmente beta-hemolíticas causan una hemólisis intensa cuando se cultivan junto con una cepa de Staphylococcus . Esta es la llamada prueba CAMP . Streptococcus agalactiae muestra esta propiedad. Clostridium perfringens se puede identificar de manera presuntiva con esta prueba. Listeria monocytogenes también es positiva en agar sangre de carnero.

Grupo A
El S. pyogenes del grupo A es el agente causal de una amplia gama de infecciones por estreptococos del grupo A (EGA). Estas infecciones pueden ser invasivas o no invasivas. Las infecciones no invasivas tienden a ser más comunes y menos graves. Las más comunes de estas infecciones incluyen la faringitis estreptocócica (faringitis estreptocócica) y el impétigo . [13] La escarlatina es otro ejemplo de infección no invasiva del grupo A.
Las infecciones invasivas causadas por estreptococos beta-hemolíticos del grupo A tienden a ser más graves y menos comunes. Esto ocurre cuando la bacteria es capaz de infectar áreas en las que no se encuentra habitualmente, como la sangre y los órganos . [14] Las enfermedades que pueden ser causadas incluyen el síndrome de choque tóxico estreptocócico , la fascitis necrosante , la neumonía y la bacteriemia . [13] A nivel mundial, se ha estimado que el GAS causa más de 500.000 muertes cada año, lo que lo convierte en uno de los principales patógenos del mundo . [13]
El GAS puede causar complicaciones adicionales, a saber, fiebre reumática aguda y glomerulonefritis aguda . La fiebre reumática , una enfermedad que afecta las articulaciones , los riñones y las válvulas cardíacas , es una consecuencia de una infección por estreptococo A no tratada causada no por la bacteria en sí, sino por los anticuerpos creados por el sistema inmunológico para combatir la infección que reaccionan de forma cruzada con otras proteínas del cuerpo. Esta "reacción cruzada" hace que el cuerpo se ataque esencialmente a sí mismo y conduce al daño mencionado anteriormente. Se plantea la hipótesis de que un mecanismo autoinmune similar iniciado por la infección por estreptococo beta-hemolítico del grupo A (GABHS) causa trastornos neuropsiquiátricos autoinmunes pediátricos asociados con infecciones estreptocócicas (PANDAS) , en los que los anticuerpos autoinmunes afectan los ganglios basales, lo que provoca la aparición rápida de síntomas psiquiátricos, motores, del sueño y otros en pacientes pediátricos.
La infección por GAS generalmente se diagnostica con una prueba rápida de estreptococos o mediante cultivo.
Grupo B
S. agalactiae , o estreptococo del grupo B, GBS , causa neumonía y meningitis en recién nacidos y ancianos , con bacteriemia sistémica ocasional . Es importante destacar que Streptococcus agalactiae es la causa más común de meningitis en bebés de uno a tres meses de edad. También pueden colonizar los intestinos y el tracto reproductivo femenino, lo que aumenta el riesgo de ruptura prematura de membranas durante el embarazo y la transmisión del organismo al bebé. El Colegio Estadounidense de Obstetras y Ginecólogos , la Academia Estadounidense de Pediatría y los Centros para el Control de Enfermedades recomiendan que todas las mujeres embarazadas entre 35 y 37 semanas de gestación se realicen la prueba del GBS. Las mujeres que resulten positivas deben recibir antibióticos profilácticos durante el parto, lo que generalmente evitará la transmisión al bebé. [15] Las vacunas de polisacáridos del grupo III han demostrado ser eficaces para prevenir la transmisión del GBS de la madre al bebé. [16]
El Reino Unido ha optado por adoptar un protocolo basado en factores de riesgo, en lugar del protocolo basado en el cultivo que se sigue en los EE. UU. [17] Las directrices actuales establecen que si está presente uno o más de los siguientes factores de riesgo, la mujer debe recibir tratamiento con antibióticos durante el parto :
- Bacteriuria por SGB durante este embarazo
- Antecedentes de enfermedad por SGB en un lactante anterior
- Fiebre intraparto (≥38 °C)
- Parto prematuro (<37 semanas)
- Rotura prolongada de membranas (>18 horas)
Este protocolo permite la administración de antibióticos durante el parto a entre el 15 y el 20 % de las mujeres embarazadas y previene entre el 65 y el 70 % de los casos de sepsis por SGB de aparición temprana. [18]
Grupo C
Este grupo incluye S. equi , que causa estrangulamientos en caballos, [19] y S. zooepidemicus — S. equi es un descendiente clonal o biovar del ancestral S. zooepidemicus — que causa infecciones en varias especies de mamíferos, incluidos el ganado y los caballos. S. dysgalactiae subsp. dysgalactiae [20] también es miembro del grupo C, estreptococos beta-hemolíticos que pueden causar faringitis y otras infecciones piógenas similares a los estreptococos del grupo A. Las bacterias estreptocócicas del grupo C se consideran patógenos zoonóticos, lo que significa que la infección puede transmitirse de animales a humanos. [21]
Grupo D (enterococos)
Muchos antiguos estreptococos del grupo D han sido reclasificados y colocados en el género Enterococcus (incluidos E. faecalis , E. faecium , E. durans y E. avium ). [22] Por ejemplo, Streptococcus faecalis es ahora Enterococcus faecalis . E. faecalis es a veces alfa-hemolítico y E. faecium es a veces beta-hemolítico. [23]
Las cepas restantes del grupo D no enterocócicas incluyen Streptococcus gallolyticus , Streptococcus bovis , Streptococcus equinus y Streptococcus suis .
Los estreptococos no hemolíticos rara vez causan enfermedades. Sin embargo, los estreptococos betahemolíticos del grupo D débilmente hemolíticos y Listeria monocytogenes (que en realidad es un bacilo grampositivo ) no deben confundirse con los estreptococos no hemolíticos.
Estreptococos del grupo F
Los estreptococos del grupo F fueron descritos por primera vez en 1934 por Long y Bliss entre los "estreptococos hemolíticos diminutos". [24] También se les conoce como Streptococcus anginosus (según el sistema de clasificación de Lancefield) o como miembros del grupo S. milleri (según el sistema europeo).
Estreptococos del grupo G
Estos estreptococos son generalmente, pero no exclusivamente, beta-hemolíticos. Streptococcus dysgalactiae subsp. canis [20] es la subespecie predominante encontrada. Es un GGS particularmente común en humanos, aunque típicamente se encuentra en animales. S. phocae es una subespecie de GGS que se ha encontrado en mamíferos marinos y especies de peces marinos. En mamíferos marinos se ha asociado principalmente con meningoencefalitis , sepsis y endocarditis , pero también se asocia con muchas otras patologías. Su reservorio ambiental y medios de transmisión en mamíferos marinos no están bien caracterizados. Los estreptococos del grupo G también se consideran patógenos zoonóticos.
Estreptococos del grupo H
Los estreptococos del grupo H causan infecciones en caninos de tamaño mediano. Los estreptococos del grupo H rara vez causan enfermedades humanas, a menos que una persona tenga contacto directo con la boca de un canino. Una de las formas más comunes de propagación es el contacto boca a boca entre humanos y caninos. Sin embargo, el canino puede lamer la mano del humano y también puede transmitir la infección. [25]
Identificación clínica
En la práctica clínica, los grupos más comunes de Streptococcus se pueden distinguir mediante pruebas de laboratorio sencillas, como la prueba PYR para estreptococos del grupo A. También existen kits de aglutinación de látex que pueden distinguir cada uno de los principales grupos que se observan en la práctica clínica.
Tratamiento
Las infecciones estreptocócicas pueden tratarse con antibióticos de la familia de las penicilinas . La penicilina o la amoxicilina son los antibióticos más utilizados para tratar las infecciones estreptocócicas. Estos antibióticos actúan interrumpiendo la producción de peptidoglicano en la pared celular. [26] El tratamiento suele consistir en un ciclo de antibióticos orales de 10 días. En el caso de los pacientes alérgicos a la penicilina y los que sufren infecciones cutáneas, se puede utilizar clindamicina. La clindamicina actúa interrumpiendo la síntesis de proteínas dentro de la célula.
Taxonomía molecular y filogenética

Los estreptococos se han dividido en seis grupos sobre la base de sus secuencias de ADNr 16S : S. anginosus, S. gallolyticus, S. mitis, S. mutans, S. pyogenes y S. salivarius . [28] Los grupos 16S se han confirmado mediante secuenciación del genoma completo (ver figura). Los patógenos importantes S. pneumoniae y S. pyogenes pertenecen a los grupos S. mitis y S. pyogenes , respectivamente, [29] mientras que el agente causante de la caries dental , Streptococcus mutans , es basal al grupo Streptococcus .

Los avances tecnológicos recientes han dado como resultado un aumento de las secuencias genómicas disponibles para las especies de Streptococcus , lo que permite realizar análisis filogenéticos y genómicos comparativos más sólidos y confiables. [30] En 2018, Patel y Gupta reexaminaron las relaciones evolutivas dentro de Streptococcus a través del análisis de árboles filogenéticos integrales construidos con base en cuatro conjuntos de datos diferentes de proteínas y la identificación de 134 firmas moleculares altamente específicas (en forma de indeles de firmas conservadas ) que son compartidas exclusivamente por todo el género o sus subclados distintos. [30]
Los resultados revelaron la presencia de dos clados principales en el nivel más alto dentro de Streptococcus , denominados clados "Mitis-Suis" y "Pyogenes-Equinus-Mutans". [30] El clado principal "Mitis-Suis" comprende el subclado Suis y el clado Mitis, que abarca los subclados Angiosus, Pneumoniae, Gordonii y Parasanguinis. El segundo clado principal, "Pyogenes-Equinus-Mutans", incluye los subclados Pyogenes, Mutans, Salivarius, Equinus, Sobrinus, Halotolerans, Porci, Entericus y Orisratti. En total, se han identificado 14 subclados distintos dentro del género Streptococcus , cada uno respaldado por patrones de ramificación confiables en árboles filogenéticos y por la presencia de múltiples indeles de firma conservados en diferentes proteínas que son características distintivas de los miembros de estos 14 clados. [30] En una figura de esta página se muestra un diagrama resumido que muestra las relaciones generales entre los Streptococcus según estos estudios.
Genómica

Se han secuenciado los genomas de cientos de especies. [32] La mayoría de los genomas de Streptococcus tienen un tamaño de entre 1,8 y 2,3 Mb y codifican entre 1700 y 2300 proteínas. Algunos genomas importantes se enumeran en la tabla. [33] Las cuatro especies que se muestran en la tabla ( S. pyogenes, S. agalactiae, S. pneumoniae y S. mutans ) tienen una identidad de secuencia de proteínas por pares promedio de aproximadamente el 70%. [33]
| característica | S. pyogenes | S. agalactiae | S. pneumoniae | S. mutans |
|---|---|---|---|---|
| pares de bases | 1.852.442 | 2.211.488 | 2.160.837 | 2.030.921 |
| ORF | 1792 | 2118 | 2236 | 1963 |
| profagos | Sí | No | No | No |
Bacteriófago
Se han descrito bacteriófagos para muchas especies de Streptococcus . Se han descrito 18 profagos en S. pneumoniae que varían en tamaño de 38 a 41 kb, codificando de 42 a 66 genes cada uno. [34] Algunos de los primeros fagos de Streptococcus descubiertos fueron Dp-1 [35] [36] y ω1 (alias ω-1). [37] [38] [39] En 1981 se descubrió la familia Cp (fago complutense 1, oficialmente virus Streptococcus Cp1 , Picovirinae ) con Cp-1 como su primer miembro. [40] Dp-1 y Cp-1 infectan tanto a S. pneumoniae como a S. mitis . [41] Sin embargo, los rangos de hospedadores de la mayoría de los fagos de Streptococcus no se han investigado sistemáticamente.
Transformación genética natural
La transformación genética natural implica la transferencia de ADN de una bacteria a otra a través del medio circundante. La transformación es un proceso complejo que depende de la expresión de numerosos genes. Para ser capaz de transformarse, una bacteria debe entrar en un estado fisiológico especial denominado competencia . S. pneumoniae , S. mitis y S. oralis pueden volverse competentes y, como resultado, adquirir activamente ADN homólogo para la transformación mediante un mecanismo fratricida depredador [42]. Este mecanismo fratricida explota principalmente a hermanos no competentes presentes en el mismo nicho [43]. Entre los aislados altamente competentes de S. pneumoniae , Li et al. [44] demostraron que la aptitud para la colonización nasal y la virulencia (infectividad pulmonar) dependen de un sistema de competencia intacto. La competencia puede permitir que el patógeno estreptocócico utilice ADN homólogo externo para la reparación recombinatoria de los daños del ADN causados por el ataque oxidativo del huésped. [45]
Véase también
- ARN pequeños dependientes de Cia
- Reacción de sofocación
- Infección estreptocócica en aves de corral
- Faringitis estreptocócica
- Estreptoquinasa
Referencias
- ^ abcdefghijklmnopqrstu vwxyz aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar as at au av aw ax ay az ba bb bc bd be bf bg bh bi bj bk bl bm bn bo bp bq br bs bt Parte C.A. "Estreptococo". LPSN .
- ^ abc Ryan KJ, Sherris JC, eds. (1994). Sherris Medical Microbiology (3.ª ed.). Appleton & Lange. págs. 266–7. ISBN 0-8385-8541-8.
- ^ "estreptococo". Diccionario Etimológico Online . Consultado el 25 de julio de 2018 .
- ^ στρεπτός en Liddell, Henry George ; Scott, Robert (1940) A Greek–English Lexicon , revisado y ampliado en su totalidad por Jones, Sir Henry Stuart , con la ayuda de McKenzie, Roderick. Oxford: Clarendon Press. En la Perseus Digital Library , Tufts University.
- ^ κόκκος en Liddell y Scott
- ^ ab Facklam R (octubre de 2002). "Qué pasó con los estreptococos: descripción general de los cambios taxonómicos y de nomenclatura". Clinical Microbiology Reviews . 15 (4): 613–630. doi :10.1128/CMR.15.4.613-630.2002. PMC 126867 . PMID 12364372.
- ^ Wang K, Lu W, Tu Q, Ge Y, He J, Zhou Y, et al. (marzo de 2016). "Análisis preliminar del microbioma salival y sus posibles funciones en el liquen plano oral". Scientific Reports . 6 (1): 22943. Bibcode :2016NatSR...622943W. doi :10.1038/srep22943. PMC 4785528 . PMID 26961389.
- ^ "Cómo deshacerse de la conjuntivitis: síntomas, tratamiento, causas e imágenes".
- ^ "Streptococcus | Centro de Investigación Académica y Formación en Antropogenia (CARTA)". carta.anthropogeny.org . Consultado el 23 de julio de 2022 .
- ^ ab Patterson MJ (1996). Baron S; et al. (eds.). Streptococcus. En: Baron's Medical Microbiology (4.ª ed.). Rama Médica de la Universidad de Texas. ISBN 978-0-9631172-1-2(vía NCBI Bookshelf).
- ^ Sharma S, Khanna G, Gangane SD (13 de julio de 2019). Libro electrónico de patología y genética para enfermeras. Elsevier Health Sciences. ISBN 978-81-312-5538-4.
- ^ Carroll KC (agosto de 2019). Munson E (ed.). "Artículo biográfico: Rebecca Lancefield, Ph.D". Revista de microbiología clínica . 57 (8). doi :10.1128/JCM.00728-19. PMC 6663886 . PMID 31142605.
- ^ abc Cohen-Poradosu R, Kasper DL (octubre de 2007). "Epidemiología del estreptococo del grupo A e implicaciones de la vacuna". Enfermedades infecciosas clínicas . 45 (7): 863–865. doi : 10.1086/521263 . PMID: 17806050.
- ^ "Infecciones estreptocócicas (estreptococo invasivo del grupo A)". Departamento de Salud e Higiene Mental de la Ciudad de Nueva York. Archivado desde el original el 6 de noviembre de 2012. Consultado el 21 de noviembre de 2012 .
- ^ Schrag S, Gorwitz R, Fultz-Butts K, Schuchat A (agosto de 2002). "Prevención de la enfermedad estreptocócica perinatal del grupo B. Directrices revisadas de los CDC". MMWR. Recomendaciones e informes . 51 (RR-11): 1–22. PMID 12211284.
- ^ Noya, Francisco JD; Baker, Carol J. (1992-03-01). "PREVENCIÓN DE LA INFECCIÓN POR ESTREPTOCÓCICO DEL GRUPO B". Clínicas de Enfermedades Infecciosas de Norteamérica . 6 (1): 41–55. doi :10.1016/S0891-5520(20)30424-4. ISSN 0891-5520. PMID 1578122.
- ^ "Prevención de la enfermedad estreptocócica neonatal de aparición temprana del grupo B: directriz Green-top n.º 36". BJOG . 124 (12): e280–e305. Noviembre de 2017. doi : 10.1111/1471-0528.14821 . PMID 28901693.
- ^ Norwitz ER, Schorge JO (2013). Obstetricia y ginecología de un vistazo (4.ª ed.). Chichester: John Wiley & Sons, Ltd. ISBN 978-1118341735.
- ^ Harrington DJ, Sutcliffe IC, Chanter N (abril de 2002). "La base molecular de la infección y la enfermedad causadas por Streptococcus equi". Microbes and Infection . 4 (4): 501–510. doi : 10.1016/S1286-4579(02)01565-4 . PMID 11932201.
- ^ ab Haslam DB, St Geme III JW (2023). "122 - Estreptococos de los grupos C y G". En Long SS, Prober CG, Fischer M, Kimberlin D (eds.). Principios y práctica de las enfermedades infecciosas pediátricas (sexta edición). Elsevier. págs. 752–753. doi :10.1016/B978-0-323-75608-2.00122-1. ISBN 978-0-323-75608-2.Nótese que según la misma fuente, la subespecie equisimilis es una agrupación de grandes colonias de S. dysgalactiae , ya sean miembros del Grupo C o del Grupo G.
- ^ Klos, Marta (12 de junio de 2017). "Patogenicidad de especies virulentas de estreptococos del grupo C en humanos". Can J Infect Dis Med Microbiol . 2017 : 1–5. doi : 10.1155/2017/9509604 . PMC 5485279 . PMID 28694832.
- ^ Köhler W (junio de 2007). "El estado actual de las especies dentro de los géneros Streptococcus y Enterococcus". Revista internacional de microbiología médica . 297 (3): 133–150. doi :10.1016/j.ijmm.2006.11.008. PMID 17400023.
- ^ Holt et al. (1994). Manual de bacteriología determinante de Bergey (novena edición). Lippincott Williams & Wilkins. ISBN 0-683-00603-7
- ^ Whitworth JM (noviembre de 1990). "Grupo F de Lancefield y estreptococos relacionados". Revista de microbiología médica . 33 (3): 135–151. doi : 10.1099/00222615-33-3-135 . PMID 2250284.[ enlace muerto permanente ]
- ^ "Infección bacteriana (estreptococo) en perros". petmd.com . Consultado el 12 de diciembre de 2014 .
- ^ Lowe, Derek (19 de enero de 2022). "¿Cómo funcionan realmente las penicilinas?". Science – vía Asociación Estadounidense para el Avance de la Ciencia.
- ^ "Bacteria-Firmicutes-Bacilli-Lactobacillales-Streptococcaceae-Streptococcus". PATRIC, Universidad de Chicago . Consultado el 12 de diciembre de 2014 .
- ^ Kawamura Y, Hou XG, Sultana F, Miura H, Ezaki T (abril de 1995). "Determinación de secuencias de ARNr 16S de Streptococcus mitis y Streptococcus gordonii y relaciones filogenéticas entre miembros del género Streptococcus". Revista internacional de bacteriología sistemática . 45 (2): 406–408. doi : 10.1099/00207713-45-2-406 . PMID 7537076.
- ^ Liu, D., Detección molecular de patógenos bacterianos humanos ( Boca Raton : CRC Press , 2011), pág. 324.
- ^ abcde Patel S, Gupta RS (diciembre de 2018). "Demarcación robusta de catorce grupos de especies diferentes dentro del género Streptococcus basada en filogenias basadas en el genoma y firmas moleculares". Infección, genética y evolución . 66 : 130–151. Bibcode :2018InfGE..66..130P. doi :10.1016/j.meegid.2018.09.020. PMID 30248475. S2CID 52813184.
- ^ Xu P, Alves JM, Kitten T, Brown A, Chen Z, Ozaki LS, et al. (Abril de 2007). "Genoma del patógeno oportunista Streptococcus sanguinis". Revista de Bacteriología . 189 (8): 3166–3175. doi :10.1128/JB.01808-06. PMC 1855836 . PMID 17277061.
- ^ "Streptococcus". PATRIC . Blacksburg, VA: Instituto de Bioinformática de Virginia. Archivado desde el original el 10 de marzo de 2013.
- ^ ab Ferretti JJ, Ajdic D, McShan WM (mayo de 2004). "Genómica comparativa de especies de estreptococos". The Indian Journal of Medical Research . 119 (Supl): 1–6. PMID 15232152.
- ^ McShan, W. Michael; Nguyen, Scott V. (2016), Ferretti, Joseph J.; Stevens, Dennis L.; Fischetti, Vincent A. (eds.), "Los bacteriófagos de Streptococcus pyogenes", Streptococcus pyogenes: Biología básica para manifestaciones clínicas , Oklahoma City (OK): Centro de Ciencias de la Salud de la Universidad de Oklahoma, PMID 26866212 , consultado el 7 de febrero de 2024
- ^ McDonnell M, Ronda C, Tomasz A (1975) "Diplophage": un bacteriófago de Diplococcus pneumoniae. Virology 63:577–582
- ^ NCBI: Fago de Streptococcus Dp-1 (especie)
- ^ Tiraby JG, Tiraby E, Fox MS (diciembre de 1975) Bacteriófagos neumocócicos. Virology 68:566–569. doi:10.1016/0042-6822(75)90300-1. PMID 844
- ^ López R (septiembre de 2004). «Streptococcus pneumoniae y sus bacteriófagos: una larga discusión». Microbiología Internacional . 7 (3): 163–171. PMID 15492930.PDF vía archivo web (9 de agosto de 2017)
- ^ Rubens López, Ernesto García: Tendencias recientes en la biología molecular de las cápsulas neumocócicas, enzimas líticas y bacteriófagos, Oxford Academic FEMS Microbiology Reviews. Volumen 28, Número 5. 1 de noviembre de 2004, págs. 554-580, doi:10.1016/j.femsre.2004.05.002 (Texto completo gratuito)
- ^ Ronda C, López R, García E (noviembre de 1981). "Aislamiento y caracterización de un nuevo bacteriófago, Cp-1, que infecta a Streptococcus pneumoniae". Journal of Virology . 40 (2): 551–559. doi :10.1128/JVI.40.2.551-559.1981. PMC 256658 . PMID 6275103.
- ^ Ouennane S, Leprohon P, Moineau S (2015). "Diversos neumófagos virulentos infectan Streptococcus mitis". MÁS UNO . 10 (2): e0118807. Código Bib : 2015PLoSO..1018807O. doi : 10.1371/journal.pone.0118807 . PMC 4334900 . PMID 25692983.
- ^ Johnsborg O, Eldholm V, Bjørnstad ML, Håvarstein LS (julio de 2008). "Un mecanismo depredador aumenta drásticamente la eficiencia de la transferencia lateral de genes en Streptococcus pneumoniae y especies comensales relacionadas". Microbiología molecular . 69 (1): 245–253. doi : 10.1111/j.1365-2958.2008.06288.x . PMID 18485065. S2CID 30923996.
- ^ Claverys JP, Håvarstein LS (marzo de 2007). "Canibalismo y fratricidio: mecanismos y razones de ser". Reseñas de la naturaleza. Microbiología . 5 (3): 219–229. doi :10.1038/nrmicro1613. PMID 17277796. S2CID 35433490.
- ^ Li G, Liang Z, Wang X, Yang Y, Shao Z, Li M, et al. (junio de 2016). "Adicción de los aislamientos neumocócicos hipertransformables a la transformación natural para la aptitud y la virulencia in vivo". Infección e inmunidad . 84 (6): 1887–1901. doi :10.1128/IAI.00097-16. PMC 4907133 . PMID 27068094.
- ^ Michod RE, Bernstein H, Nedelcu AM (mayo de 2008). "Valor adaptativo del sexo en patógenos microbianos". Infección, genética y evolución . 8 (3): 267–285. Bibcode :2008InfGE...8..267M. doi :10.1016/j.meegid.2008.01.002. PMID 18295550.
Enlaces externos
- Centros para el Control y la Prevención de Enfermedades (CDC) (marzo de 2000). "Adopción de recomendaciones para la prevención de la enfermedad por estreptococo del grupo B perinatal por parte de los proveedores de atención prenatal: Connecticut y Minnesota, 1998". MMWR. Informe semanal de morbilidad y mortalidad . 49 (11): 228–232. PMID 10763673.
- Los descubrimientos enzimáticos CRISPR inspirados en la naturaleza amplían enormemente la edición del genoma. En: SciTechDaily. 16 de junio de 2020. Fuente: Media Lab, Instituto Tecnológico de Massachusetts.
- Genomas de Streptococcus e información relacionada en PATRIC, un centro de recursos bioinformáticos financiado por el NIAID
- Fundación Canadiense contra el Estreptococo B Archivado el 2 de mayo de 2013 en Wayback Machine
- La organización benéfica británica de apoyo a los estreptococos del grupo B
- Infección por estreptococo tartamudo
